Abilify 10mg, 15mg, 20mg Aripiprazole Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.

¿Qué es Abilify 20mg y cómo se usa?
Abilify es un medicamento recetado que se usa para tratar los síntomas de la esquizofrenia, el trastorno bipolar I (maníaco depresivo) y el trastorno depresivo mayor. Abilify 10 mg se puede usar solo o con otros medicamentos. Abilify es un agente antipsicótico y antimaníaco.
- No se sabe si Abilify es seguro y eficaz en niños menores de 6 años.
¿Cuáles son los posibles efectos secundarios de Abilify 15 mg?
Abilify 15 mg puede causar efectos secundarios graves, que incluyen:
- agitación severa o angustia,
- sentirse inquieto,
- espasmos o movimientos incontrolables de ojos, labios, lengua, cara, brazos o piernas,
- apariencia de la cara como una máscara,
- dificultad al tragar,
- problemas del habla,
- convulsiones (convulsiones),
- pensamientos de suicidio o autolesión,
- músculos rígidos o rígidos,
- fiebre alta,
- transpiración,
- confusión,
- latidos cardíacos rápidos o irregulares,
- temblores (sacudidas),
- sentirse mareado,
- escalofríos,
- dolor de garganta,
- úlceras de boca,
- llagas en la piel,
- tos,
- respiración dificultosa,
- aumento de la sed,
- aumento de la micción,
- boca seca, y
- aliento con olor afrutado
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Abilify 20 mg incluyen:
- movimientos musculares descontrolados,
- ansiedad,
- sentirse inquieto,
- aumento de peso,
- náuseas,
- vómitos,
- estreñimiento,
- Apetito incrementado,
- dolor de cabeza,
- mareo,
- somnolencia,
- sensación de cansancio,
- problemas para dormir (insomnio),
- nariz tapada, y
- dolor de garganta
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Abilify. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
ADVERTENCIA
AUMENTO DE LA MORTALIDAD EN PACIENTES ANCIANOS CON PSICOSIS RELACIONADA CON DEMENCIA Y PENSAMIENTOS Y CONDUCTAS SUICIDAS CON FÁRMACOS ANTIDEPRESIVOS
Los pacientes de edad avanzada con psicosis relacionada con la demencia tratados con medicamentos antipsicóticos tienen un mayor riesgo de muerte. ABILIFY 20 mg no está aprobado para el tratamiento de pacientes con psicosis relacionada con demencia [ver ADVERTENCIAS Y PRECAUCIONES].
Los antidepresivos aumentaron el riesgo de pensamientos y conductas suicidas en niños, adolescentes y adultos jóvenes en estudios a corto plazo. Estos estudios no mostraron un aumento en el riesgo de pensamientos y conductas suicidas con el uso de antidepresivos en pacientes mayores de 24 años; hubo una reducción en el riesgo con el uso de antidepresivos en pacientes de 65 años o más [ver ADVERTENCIAS Y PRECAUCIONES].
En pacientes de todas las edades que comienzan con la terapia antidepresiva, controle de cerca el empeoramiento y la aparición de pensamientos y comportamientos suicidas. Aconseje a las familias y cuidadores sobre la necesidad de una estrecha observación y comunicación con el prescriptor [ver ADVERTENCIAS Y PRECAUCIONES].
DESCRIPCIÓN
El aripiprazol es un fármaco psicotrópico que está disponible como tabletas ABILIFY® (aripiprazol), tabletas de desintegración oral ABILIFY DISCMELT® (aripiprazol), solución oral ABILIFY® (aripiprazol) y inyección ABILIFY® (aripiprazol), una solución para inyección intramuscular. El aripiprazol es 7-[4-[4-(2,3diclorofenil)-1-piperazinil]butoxi]-3,4-dihidrocarboestirilo. La fórmula empírica es C23H27Cl2N3O2 y su peso molecular es 448,38. La estructura química es:
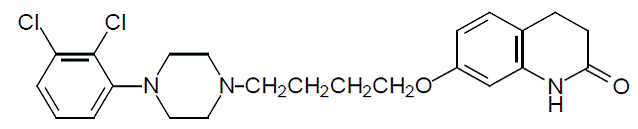
Las tabletas ABILIFY están disponibles en concentraciones de 2 mg, 5 mg, 10 mg, 15 mg, 20 mg y 30 mg. Los ingredientes inactivos incluyen almidón de maíz, hidroxipropilcelulosa, lactosa monohidrato, estearato de magnesio y celulosa microcristalina. Los colorantes incluyen óxido férrico (amarillo o rojo) y FD&C Blue No. 2 Aluminium Lake.
Las tabletas de desintegración oral ABILIFY 20mg DISCMELT están disponibles en concentraciones de 10 mg y 15 mg. Los ingredientes inactivos incluyen acesulfamo de potasio, aspartamo, silicato de calcio, croscarmelosa de sodio, crospovidona, crema de vainilla (sabores naturales y artificiales), estearato de magnesio, celulosa microcristalina, dióxido de silicio, ácido tartárico y xilitol. Los colorantes incluyen óxido férrico (amarillo o rojo) y FD&C Blue No. 2 Aluminium Lake.
La solución oral ABILIFY es una solución transparente, de incolora a amarillo claro, disponible en una concentración de 1 mg/mL. Los ingredientes inactivos de esta solución incluyen edetato disódico, fructosa, glicerina, ácido dl-láctico, metilparabeno, propilenglicol, propilparabeno, hidróxido de sodio, sacarosa y agua purificada. La solución oral está aromatizada con crema de naranja natural y otros aromas naturales.
ABILIFY Inyectable está disponible en viales de dosis única como una solución acuosa estéril, transparente, incolora y lista para usar de 9,75 mg/1,3 ml (7,5 mg/ml) para uso intramuscular únicamente. Los ingredientes inactivos de esta solución incluyen 199,5 mg de sulfobutiléter β-ciclodextrina (SBECD), 10,4 mg de ácido tartárico, qs a pH 4,3 de hidróxido de sodio y qs a 1,33 ml de agua para inyección.
INDICACIONES
Las tabletas orales, las tabletas de desintegración oral y la solución oral de ABILIFY están indicadas para el tratamiento de:
- Esquizofrenia [ver Estudios clínicos ]
- Tratamiento agudo de episodios maníacos y mixtos asociados con el trastorno bipolar I [ver Estudios clínicos ]
- Tratamiento adyuvante del trastorno depresivo mayor [ver Estudios clínicos ]
- Irritabilidad asociada con el trastorno autista [ver Estudios clínicos ]
- Tratamiento del trastorno de Tourette [ver Estudios clínicos ]
ABILIFY Inyectable está indicado para el tratamiento de:
- Agitación asociada con esquizofrenia o manía bipolar [ver Estudios clínicos ]
DOSIFICACIÓN Y ADMINISTRACIÓN
Esquizofrenia
Adultos
La dosis inicial y objetivo recomendada para ABILIFY es de 10 o 15 mg/día administrados en un horario de una vez al día sin tener en cuenta las comidas. ABILIFY ha sido evaluado sistemáticamente y ha demostrado ser eficaz en un rango de dosis de 10 a 30 mg/día, cuando se administra como formulación en comprimidos; sin embargo, las dosis superiores a 10 o 15 mg/día no fueron más eficaces que las de 10 o 15 mg/día. Por lo general, los aumentos de dosis no deben realizarse antes de las 2 semanas, el tiempo necesario para alcanzar el estado estacionario [ver Estudios clínicos ].
Tratamiento de mantenimiento: El mantenimiento de la eficacia en la esquizofrenia se demostró en un ensayo en el que participaron pacientes con esquizofrenia que habían estado sintomáticamente estables con otros medicamentos antipsicóticos durante períodos de 3 meses o más. A estos pacientes se les interrumpió el tratamiento con esos medicamentos y se les aleatorizó a recibir ABILIFY 15 mg/día o placebo, y se les observó en busca de recaídas [ver Estudios clínicos ]. Los pacientes deben ser reevaluados periódicamente para determinar la necesidad continua de tratamiento de mantenimiento.
Adolescentes
La dosis objetivo recomendada de ABILIFY es de 10 mg/día. El aripiprazol se estudió en pacientes adolescentes de 13 a 17 años con esquizofrenia a dosis diarias de 10 mg y 30 mg. La dosis diaria inicial de la formulación en comprimidos en estos pacientes fue de 2 mg, que se ajustó a 5 mg después de 2 días y a la dosis objetivo de 10 mg después de 2 días adicionales. Los aumentos posteriores de la dosis deben administrarse en incrementos de 5 mg. La dosis de 30 mg/día no demostró ser más eficaz que la dosis de 10 mg/día. ABILIFY puede administrarse independientemente de las comidas [ver Estudios clínicos ]. Los pacientes deben ser reevaluados periódicamente para determinar la necesidad de un tratamiento de mantenimiento.
Cambio desde otros antipsicóticos
No hay datos recopilados sistemáticamente para abordar específicamente el cambio de pacientes con esquizofrenia de otros antipsicóticos a ABILIFY 20 mg o sobre la administración concomitante con otros antipsicóticos. Si bien la interrupción inmediata del tratamiento antipsicótico previo puede ser aceptable para algunos pacientes con esquizofrenia, la interrupción más gradual puede ser más adecuada para otros. En todos los casos, se debe minimizar el período de superposición de la administración de antipsicóticos.
Trastorno bipolar I
Tratamiento agudo de episodios maníacos y mixtos
Adultos
La dosis inicial recomendada en adultos es de 15 mg administrados una vez al día como monoterapia y de 10 mg a 15 mg administrados una vez al día como terapia adyuvante con litio o valproato. ABILIFY 10 mg se puede administrar sin tener en cuenta las comidas. La dosis objetivo recomendada de ABILIFY es de 15 mg/día, como monoterapia o como terapia adyuvante con litio o valproato. La dosis puede aumentarse a 30 mg/día según la respuesta clínica. La seguridad de dosis superiores a 30 mg/día no ha sido evaluada en ensayos clínicos.
Pediatría
La dosis inicial recomendada en pacientes pediátricos (10 a 17 años) como monoterapia es de 2 mg/día, con ajuste a 5 mg/día después de 2 días y una dosis objetivo de 10 mg/día después de 2 días adicionales. La dosificación recomendada como terapia adjunta al litio o al valproato es la misma. Los aumentos posteriores de la dosis, si es necesario, deben administrarse en incrementos de 5 mg/día. ABILIFY se puede administrar sin tener en cuenta las comidas [ver Estudios clínicos ].
Tratamiento adyuvante del trastorno depresivo mayor
Adultos
La dosis inicial recomendada de ABILIFY como tratamiento adyuvante para pacientes que ya toman un antidepresivo es de 2 a 5 mg/día. El rango de dosis recomendado es de 2 a 15 mg/día. Los ajustes de dosis de hasta 5 mg/día deben ocurrir gradualmente, a intervalos de no menos de 1 semana [ver Estudios clínicos ]. Los pacientes deben ser reevaluados periódicamente para determinar la necesidad continua de tratamiento de mantenimiento.
Irritabilidad asociada con el trastorno autista
Pacientes Pediátricos (6 A 17 Años)
El rango de dosificación recomendado para el tratamiento de pacientes pediátricos con irritabilidad asociada con el trastorno autista es de 5 a 15 mg/día.
La dosificación debe iniciarse a 2 mg/día. La dosis debe aumentarse a 5 mg/día, con aumentos posteriores a 10 o 15 mg/día si es necesario. Los ajustes de dosis de hasta 5 mg/día deben ocurrir gradualmente, a intervalos de no menos de 1 semana [ver Estudios clínicos ]. Los pacientes deben ser reevaluados periódicamente para determinar la necesidad continua de tratamiento de mantenimiento.
Trastorno de Tourette
Pacientes Pediátricos (6 A 18 Años)
El rango de dosis recomendado para el trastorno de Tourette es de 5 a 20 mg/día.
Para pacientes que pesan menos de 50 kg, la dosificación debe iniciarse a 2 mg/día con una dosis objetivo de 5 mg/día después de 2 días. La dosis se puede aumentar a 10 mg/día en pacientes que no logran un control óptimo de los tics. Los ajustes de dosis deben ocurrir gradualmente a intervalos de no menos de 1 semana.
Para los pacientes que pesan 50 kg o más, la dosificación debe iniciarse con 2 mg/día durante 2 días y luego aumentarse a 5 mg/día durante 5 días, con una dosis objetivo de 10 mg/día el día 8. La dosis puede ser aumentado hasta 20 mg/día para pacientes que no logran un control óptimo de los tics. Los ajustes de dosis deben ocurrir gradualmente en incrementos de 5 mg/día a intervalos de no menos de 1 semana. [Ver Estudios clínicos ].
Los pacientes deben ser reevaluados periódicamente para determinar la necesidad continua de tratamiento de mantenimiento.
Agitación asociada con esquizofrenia o manía bipolar (inyección intramuscular)
Adultos
La dosis recomendada en estos pacientes es de 9,75 mg. El rango de dosis recomendado es de 5,25 a 15 mg. No se demostró ningún beneficio adicional con 15 mg en comparación con 9,75 mg. Se puede considerar una dosis más baja de 5,25 mg cuando los factores clínicos lo justifiquen. Si persiste la agitación que justifica una segunda dosis después de la dosis inicial, se pueden administrar dosis acumulativas hasta un total de 30 mg/día. Sin embargo, la eficacia de dosis repetidas de ABILIFY 10 mg inyectables en pacientes agitados no ha sido evaluada sistemáticamente en ensayos clínicos controlados. La seguridad de las dosis diarias totales superiores a 30 mg o de las inyecciones administradas con una frecuencia superior a cada 2 horas no se ha evaluado adecuadamente en ensayos clínicos [ver Estudios clínicos ].
Si la terapia continua con ABILIFY está clínicamente indicada, ABILIFY oral en un rango de 10 a 30 mg/día debe reemplazar la inyección de ABILIFY tan pronto como sea posible [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Administración de la inyección de ABILIFY
Para administrar la inyección de ABILIFY 10 mg, extraiga el volumen requerido de solución en la jeringa como se muestra en la Tabla 1. Deseche cualquier porción no utilizada.
La inyección de ABILIFY está destinada únicamente para uso intramuscular. No administrar por vía intravenosa o subcutánea. Inyecte lentamente, profundamente en la masa muscular.
Los productos farmacéuticos parenterales deben inspeccionarse visualmente en busca de partículas y decoloración antes de la administración, siempre que la solución y el envase lo permitan.
Ajustes de dosis para consideraciones de citocromo P450
Se recomiendan ajustes de dosis en pacientes que se sabe que son metabolizadores lentos de CYP2D6 y en pacientes que toman concomitantemente inhibidores de CYP3A4 o inhibidores de CYP2D6 o inductores potentes de CYP3A4 (ver Tabla 2). Cuando el fármaco coadministrado se retira de la terapia de combinación, la dosis de ABILIFY 10 mg debe ajustarse a su nivel original. Cuando se retira el inductor CYP3A4 coadministrado, la dosis de ABILIFY debe reducirse al nivel original durante 1 a 2 semanas. Los pacientes que puedan estar recibiendo una combinación de inhibidores fuertes, moderados y débiles de CYP3A4 y CYP2D6 (p. ej., un inhibidor fuerte de CYP3A4 y un inhibidor moderado de CYP2D6 o un inhibidor moderado de CYP3A4 con un inhibidor moderado de CYP2D6), la dosis puede reducirse a una -cuarto (25%) de la dosis habitual inicialmente y luego ajustada para lograr una respuesta clínica favorable.
Cuando se administra ABILIFY adyuvante a pacientes con trastorno depresivo mayor, se debe administrar ABILIFY 10 mg sin ajustar la dosis, como se especifica en Dosis y administración (2.3).
Dosificación de solución oral
La solución oral se puede sustituir por tabletas en mg por mg hasta el nivel de dosis de 25 mg. Los pacientes que reciben comprimidos de 30 mg deben recibir 25 mg de la solución [ver FARMACOLOGÍA CLÍNICA ].
Dosificación de tabletas de desintegración oral
La dosificación de ABILIFY 10 mg comprimidos de desintegración oral es la misma que para los comprimidos orales [ver Secciones anteriores ].
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Las tabletas ABILIFY® (aripiprazol) están disponibles como se describe en la Tabla 3.
Las tabletas de desintegración oral ABILIFY DISCMELT® (aripiprazol) están disponibles como se describe en la Tabla 4.
La solución oral ABILIFY® (aripiprazol) (1 mg/ml) es una solución transparente, de incolora a amarillo claro, que se suministra en frascos a prueba de niños junto con un vaso dosificador oral calibrado.
ABILIFY® (aripiprazol) inyectable para uso intramuscular es una solución transparente e incolora disponible como una solución lista para usar de 9,75 mg/1,3 ml (7,5 mg/ml) en viales de vidrio transparente tipo 1.
Almacenamiento y manipulación
ABILIFY® (aripiprazol) Tabletas tienen marcas en un lado y están disponibles en las concentraciones y paquetes enumerados en la Tabla 32.
ABILIFY 15 mg DISCMELT® (aripiprazol) tabletas de desintegración oral son tabletas redondas con marcas en ambos lados. ABILIFY 15 mg DISCMELT está disponible en las concentraciones y presentaciones enumeradas en la Tabla 33.
La solución oral ABILIFY® (aripiprazol) (1 mg/ml) se suministra en frascos a prueba de niños junto con un vaso dosificador oral calibrado. ABILIFY 20 mg Solución oral está disponible de la siguiente manera:
Botella de 150 ml NDC 59148-013-15
La inyección de ABILIFY® (aripiprazol) para uso intramuscular está disponible como una solución lista para usar de 9,75 mg/1,3 ml (7,5 mg/ml) en viales de vidrio transparente tipo 1 de la siguiente manera:
Vial de dosis única de 9,75 mg/1,3 ml NDC 59148-016-65
Almacenamiento
tabletas
Almacenar a 25°C (77°F); excursiones permitidas entre 15°C a 30°C (59°F a 86°F) [ver Temperatura ambiente controlada por USP ].
Solucion Oral
Almacenar a 25°C (77°F); excursiones permitidas entre 15°C a 30°C (59°F a 86°F) [ver Temperatura ambiente controlada por USP ]. Los frascos abiertos de ABILIFY Solución oral se pueden usar hasta 6 meses después de abrirlos, pero no más allá de la fecha de vencimiento que figura en el frasco. El frasco y su contenido deben desecharse después de la fecha de vencimiento.
Inyección
Almacenar a 25°C (77°F); excursiones permitidas entre 15°C a 30°C (59°F a 86°F) [ver Temperatura ambiente controlada por USP ]. Proteger de la luz conservando en el envase original. Conservar en la caja hasta el momento de su uso.
Distribuido y comercializado por Otsuka America Pharmaceutical, Inc., Rockville, MD 20850 EE. UU. Otsuka América Farmacéutica, Inc.,. Rev Ago 2019
EFECTOS SECUNDARIOS
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Las siguientes reacciones adversas se analizan con más detalle en otras secciones de la etiqueta:
- Aumento de la mortalidad en pacientes de edad avanzada con psicosis relacionada con demencia [ver ADVERTENCIA EN CAJA y ADVERTENCIAS Y PRECAUCIONES ]
- Eventos adversos cerebrovasculares, incluido accidente cerebrovascular [ver ADVERTENCIAS Y PRECAUCIONES ]
- Pensamientos y conductas suicidas en niños, adolescentes y adultos jóvenes [ver ADVERTENCIA EN CAJA y ADVERTENCIAS Y PRECAUCIONES ]
- Síndrome neuroléptico maligno (SNM) [ver ADVERTENCIAS Y PRECAUCIONES ]
- Discinesia tardía [ver ADVERTENCIAS Y PRECAUCIONES ]
- Cambios metabólicos [ver ADVERTENCIAS Y PRECAUCIONES ]
- Juego patológico y otras conductas compulsivas [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hipotensión ortostática [ver ADVERTENCIAS Y PRECAUCIONES ]
- Caídas [ver ADVERTENCIAS Y PRECAUCIONES ]
- Leucopenia, neutropenia y agranulocitosis [ver ADVERTENCIAS Y PRECAUCIONES ]
- Convulsiones/Convulsiones [ver ADVERTENCIAS Y PRECAUCIONES ]
- Potencial de deterioro cognitivo y motor [ver ADVERTENCIAS Y PRECAUCIONES ]
- Regulación de la temperatura corporal [ver ADVERTENCIAS Y PRECAUCIONES ]
- Suicidio [ver ADVERTENCIAS Y PRECAUCIONES ]
- Disfagia [ver ADVERTENCIAS Y PRECAUCIONES ]
Las reacciones adversas más comunes en pacientes adultos en ensayos clínicos (≥10 %) fueron náuseas, vómitos, estreñimiento, dolor de cabeza, mareos, acatisia, ansiedad, insomnio e inquietud.
Las reacciones adversas más comunes en los ensayos clínicos pediátricos (≥10 %) fueron somnolencia, dolor de cabeza, vómitos, trastorno extrapiramidal, fatiga, aumento del apetito, insomnio, náuseas, nasofaringitis y aumento de peso.
Se evaluó la seguridad de ABILIFY en 13 543 pacientes adultos que participaron en ensayos clínicos de dosis múltiples en esquizofrenia, trastorno bipolar, trastorno depresivo mayor, demencia tipo Alzheimer, enfermedad de Parkinson y alcoholismo, y que tenían aproximadamente 7619 años-paciente de exposición a ABILIFY oral 10 mg y 749 pacientes con exposición a ABILIFY inyectable. Un total de 3390 pacientes fueron tratados con ABILIFY oral durante al menos 180 días y 1933 pacientes tratados con ABILIFY oral tuvieron al menos 1 año de exposición.
Se evaluó la seguridad de ABILIFY 15 mg en 1686 pacientes (de 6 a 18 años) que participaron en ensayos clínicos de dosis múltiples en esquizofrenia, manía bipolar, trastorno autista o trastorno de Tourette y que tuvieron aproximadamente 1342 años-paciente de exposición a ABILIFY oral. . Un total de 959 pacientes pediátricos fueron tratados con ABILIFY oral durante al menos 180 días y 556 pacientes pediátricos tratados con ABILIFY oral de 10 mg tuvieron al menos 1 año de exposición.
Las condiciones y la duración del tratamiento con ABILIFY (monoterapia y terapia adyuvante con antidepresivos o estabilizadores del estado de ánimo) incluyeron (en categorías superpuestas) estudios abiertos doble ciego, comparativos y no comparativos, estudios con pacientes hospitalizados y ambulatorios, estudios de dosis fija y flexible, y exposición a corto y largo plazo.
Experiencia en ensayos clínicos
Pacientes adultos con esquizofrenia
Los siguientes hallazgos se basan en un conjunto de cinco ensayos controlados con placebo (cuatro de 4 semanas y uno de 6 semanas) en los que se administró ABILIFY 15 mg por vía oral en dosis que oscilaron entre 2 y 30 mg/día.
Reacciones adversas comúnmente observadas
La única reacción adversa comúnmente observada asociada con el uso de ABILIFY 20 mg en pacientes con esquizofrenia (incidencia del 5 % o mayor e incidencia de ABILIFY al menos el doble que la del placebo) fue acatisia (ABILIFY 8 %; placebo 4 %).
Pacientes adultos con manía bipolar
Monoterapia
Los siguientes hallazgos se basan en un conjunto de ensayos de manía bipolar controlados con placebo de 3 semanas en los que se administró ABILIFY 15 mg por vía oral en dosis de 15 o 30 mg/día.
Reacciones adversas comúnmente observadas
Las reacciones adversas comúnmente observadas asociadas con el uso de ABILIFY en pacientes con manía bipolar (incidencia del 5 % o mayor e incidencia de ABILIFY 15 mg al menos el doble que para el placebo) se muestran en la Tabla 16.
Reacciones adversas menos comunes en adultos
La Tabla 17 enumera la incidencia agrupada, redondeada al porcentaje más cercano, de reacciones adversas que ocurrieron durante la terapia aguda (hasta 6 semanas en esquizofrenia y hasta 3 semanas en manía bipolar), incluidas solo aquellas reacciones que ocurrieron en 2% o más de pacientes tratados con ABILIFY (dosis ≥2 mg/día) y para los cuales la incidencia en pacientes tratados con ABILIFY 20 mg fue mayor que la incidencia en pacientes tratados con placebo en el conjunto de datos combinado.
Un examen de los subgrupos de población no reveló ninguna evidencia clara de incidencia diferencial de reacciones adversas en función de la edad, el sexo o la raza.
Pacientes adultos con terapia adyuvante con manía bipolar
Los siguientes hallazgos se basan en un ensayo controlado con placebo de pacientes adultos con trastorno bipolar en los que se administró ABILIFY 15 mg en dosis de 15 o 30 mg/día como terapia adyuvante con litio o valproato.
Reacciones adversas asociadas con la interrupción del tratamiento
En un estudio de pacientes que ya toleraban litio o valproato como monoterapia, las tasas de interrupción debido a reacciones adversas fueron del 12 % para los pacientes tratados con ABILIFY adyuvante en comparación con el 6 % para los pacientes tratados con placebo adyuvante. Las reacciones adversas al medicamento más comunes asociadas con la interrupción en los pacientes tratados con ABILIFY adyuvante en comparación con los pacientes tratados con placebo fueron acatisia (5 % y 1 %, respectivamente) y temblor (2 % y 1 %, respectivamente).
Reacciones adversas comúnmente observadas
Las reacciones adversas comúnmente observadas asociadas con ABILIFY adyuvante y litio o valproato en pacientes con manía bipolar (incidencia del 5 % o mayor e incidencia de al menos el doble que para el placebo adyuvante) fueron: acatisia, insomnio y trastorno extrapiramidal.
Reacciones adversas menos comunes en pacientes adultos con terapia adyuvante en la manía bipolar
La Tabla 18 enumera la incidencia, redondeada al porcentaje más cercano, de reacciones adversas que ocurrieron durante el tratamiento agudo (hasta 6 semanas), incluidas solo aquellas reacciones que ocurrieron en el 2 % o más de los pacientes tratados con ABILIFY adyuvante (dosis de 15 o 30 mg/día) y litio o valproato y cuya incidencia en pacientes tratados con esta combinación fue mayor que la incidencia en pacientes tratados con placebo más litio o valproato.
Pacientes pediátricos (13 a 17 años) con esquizofrenia
Los siguientes hallazgos se basan en un ensayo controlado con placebo de 6 semanas en el que se administró ABILIFY oral en dosis que oscilaron entre 2 y 30 mg/día.
Reacciones adversas asociadas con la interrupción del tratamiento
La incidencia de interrupción debido a reacciones adversas entre los pacientes pediátricos tratados con ABILIFY y los tratados con placebo (de 13 a 17 años) fue del 5 % y el 2 %, respectivamente.
Reacciones adversas comúnmente observadas
Las reacciones adversas comúnmente observadas asociadas con el uso de ABILIFY 10 mg en pacientes adolescentes con esquizofrenia (incidencia del 5% o mayor e incidencia de ABILIFY al menos el doble que para el placebo) fueron trastorno extrapiramidal, somnolencia y temblor.
Pacientes Pediátricos (10 A 17 Años) Con Manía Bipolar
Los siguientes hallazgos se basan en un ensayo controlado con placebo de 4 semanas en el que se administró ABILIFY oral en dosis de 10 o 30 mg/día.
Reacciones adversas asociadas con la interrupción del tratamiento
La incidencia de interrupción debido a reacciones adversas entre los pacientes pediátricos tratados con ABILIFY y los tratados con placebo (de 10 a 17 años) fue del 7 % y el 2 %, respectivamente.
Reacciones adversas comúnmente observadas
Las reacciones adversas comúnmente observadas asociadas con el uso de ABILIFY 20 mg en pacientes pediátricos con manía bipolar (incidencia del 5% o mayor e incidencia de ABILIFY al menos el doble que para el placebo) se muestran en la Tabla 19.
Pacientes Pediátricos (6 A 17 Años) Con Trastorno Autista
Los siguientes hallazgos se basan en dos ensayos controlados con placebo de 8 semanas en los que se administraron 20 mg de ABILIFY por vía oral en dosis de 2 a 15 mg/día.
Reacciones adversas asociadas con la interrupción del tratamiento
La incidencia de interrupción debido a reacciones adversas entre los pacientes pediátricos tratados con ABILIFY y los tratados con placebo (6 a 17 años) fue del 10 % y el 8 %, respectivamente.
Reacciones adversas comúnmente observadas
Las reacciones adversas comúnmente observadas asociadas con el uso de ABILIFY en pacientes pediátricos con trastorno autista (incidencia del 5 % o mayor e incidencia de ABILIFY 10 mg al menos el doble que para el placebo) se muestran en la Tabla 20.
Pacientes pediátricos (6 a 18 años) con trastorno de Tourette
Los siguientes hallazgos se basan en un ensayo controlado con placebo de 8 semanas y otro de 10 semanas en los que se administró ABILIFY 15 mg por vía oral en dosis de 2 a 20 mg/día.
Reacciones adversas asociadas con la interrupción del tratamiento
La incidencia de interrupción debido a reacciones adversas entre los pacientes pediátricos tratados con ABILIFY y los tratados con placebo (de 6 a 18 años) fue del 7 % y el 1 %, respectivamente.
Reacciones adversas comúnmente observadas
Las reacciones adversas comúnmente observadas asociadas con el uso de ABILIFY en pacientes pediátricos con el trastorno de Tourette (incidencia del 5 % o mayor e incidencia de ABILIFY 10 mg al menos el doble que para el placebo) se muestran en la Tabla 21.
Reacciones adversas menos comunes en pacientes pediátricos (6 a 18 años) con esquizofrenia, manía bipolar, trastorno autista o trastorno de Tourette
La Tabla 22 enumera la incidencia agrupada, redondeada al porcentaje más cercano, de reacciones adversas que ocurrieron durante la terapia aguda (hasta 6 semanas en esquizofrenia, hasta 4 semanas en manía bipolar, hasta 8 semanas en trastorno autista y hasta 10 semanas en el trastorno de Tourette), incluyendo solo aquellas reacciones que ocurrieron en el 2% o más de los pacientes pediátricos tratados con ABILIFY (dosis ≥2 mg/día) y para las cuales la incidencia en pacientes tratados con ABILIFY 10 mg fue mayor que la incidencia en pacientes tratados con placebo.
Pacientes adultos que reciben ABILIFY como tratamiento adyuvante del trastorno depresivo mayor
Los siguientes hallazgos se basan en un conjunto de dos ensayos controlados con placebo de pacientes con trastorno depresivo mayor en los que se administró ABILIFY 20 mg en dosis de 2 mg a 20 mg como tratamiento complementario a la terapia antidepresiva continua.
Reacciones adversas asociadas con la interrupción del tratamiento
La incidencia de interrupción debido a reacciones adversas fue del 6 % para los pacientes tratados con ABILIFY adyuvante y del 2 % para los pacientes tratados con placebo adyuvante.
Reacciones adversas comúnmente observadas
Las reacciones adversas comúnmente observadas asociadas con el uso adyuvante de ABILIFY 15 mg en pacientes con trastorno depresivo mayor (incidencia del 5 % o mayor y ABILIFY 15 mg incidencia de al menos el doble que para el placebo) fueron: acatisia, inquietud, insomnio, estreñimiento, fatiga y visión borrosa.
Reacciones adversas menos frecuentes en pacientes adultos con trastorno depresivo mayor
La Tabla 23 enumera la incidencia agrupada, redondeada al porcentaje más cercano, de las reacciones adversas que ocurrieron durante el tratamiento agudo (hasta 6 semanas), incluidas solo las reacciones adversas que ocurrieron en el 2 % o más de los pacientes tratados con ABILIFY adyuvante (dosis ≥2 mg/día) y cuya incidencia en pacientes tratados con ABILIFY 10 mg adyuvante fue mayor que la incidencia en pacientes tratados con placebo adyuvante en el conjunto de datos combinado.
Pacientes con agitación asociada con esquizofrenia o manía bipolar (inyección intramuscular)
Los siguientes hallazgos se basan en un conjunto de tres ensayos controlados con placebo de pacientes con agitación asociada con esquizofrenia o manía bipolar en los que se administró una inyección de ABILIFY de 20 mg en dosis de 5,25 mg a 15 mg.
Reacciones adversas comúnmente observadas
Hubo una reacción adversa comúnmente observada (náuseas) asociada con el uso de la inyección de ABILIFY 10 mg en pacientes con agitación asociada con esquizofrenia y manía bipolar (incidencia del 5 % o mayor y una incidencia de ABILIFY 20 mg de al menos el doble que para el placebo).
Reacciones adversas menos comunes en pacientes con agitación asociada con esquizofrenia o manía bipolar
La Tabla 24 enumera la incidencia agrupada, redondeada al porcentaje más cercano, de reacciones adversas que ocurrieron durante la terapia aguda (24 horas), incluidas solo aquellas reacciones adversas que ocurrieron en el 2 % o más de los pacientes tratados con ABILIFY inyectable (dosis ≥5,25 mg /día) y cuya incidencia en pacientes tratados con ABILIFY 15 mg inyectable fue mayor que la incidencia en pacientes tratados con placebo en el conjunto de datos combinado.
Reacciones adversas relacionadas con la dosis
Esquizofrenia
Las relaciones de respuesta a la dosis para la incidencia de eventos adversos emergentes del tratamiento se evaluaron a partir de cuatro ensayos en pacientes adultos con esquizofrenia que compararon varias dosis fijas (2, 5, 10, 15, 20 y 30 mg/día) de ABILIFY oral con placebo. Este análisis, estratificado por estudio, indicó que la única reacción adversa que tuvo una posible relación dosis-respuesta, y luego la más prominente solo con 30 mg, fue la somnolencia [incluida la sedación]; (las incidencias fueron placebo, 7,1 %; 10 mg, 8,5 %; 15 mg, 8,7 %; 20 mg, 7,5 %; 30 mg, 12,6 %).
En el estudio de pacientes pediátricos (de 13 a 17 años de edad) con esquizofrenia, tres reacciones adversas frecuentes parecieron tener una posible relación dosis-respuesta: trastorno extrapiramidal (las incidencias fueron placebo, 5,0 %; 10 mg, 13,0 %; 30 mg, 21,6 %); somnolencia (las incidencias fueron placebo, 6,0 %; 10 mg, 11,0 %; 30 mg, 21,6 %); y temblor (las incidencias fueron placebo, 2,0 %; 10 mg, 2,0 %; 30 mg, 11,8 %).
Manía bipolar
En el estudio de pacientes pediátricos (de 10 a 17 años de edad) con manía bipolar, cuatro reacciones adversas frecuentes tuvieron una posible relación dosis-respuesta a las 4 semanas; trastorno extrapiramidal (las incidencias fueron placebo, 3,1 %; 10 mg, 12,2 %; 30 mg, 27,3 %); somnolencia (las incidencias fueron placebo, 3,1 %; 10 mg, 19,4 %; 30 mg, 26,3 %); acatisia (las incidencias fueron placebo, 2,1 %; 10 mg, 8,2 %; 30 mg, 11,1 %); e hipersecreción salival (las incidencias fueron placebo, 0 %; 10 mg, 3,1 %; 30 mg, 8,1 %).
Trastorno autista
En un estudio de pacientes pediátricos (6 a 17 años de edad) con trastorno autista, una reacción adversa común tuvo una posible relación dosis-respuesta: fatiga (las incidencias fueron placebo, 0 %; 5 mg, 3,8 %; 10 mg, 22,0 %; 15 mg, 18,5%).
Trastorno de Tourette
En un estudio de pacientes pediátricos (de 7 a 17 años de edad) con trastorno de Tourette, ninguna reacción adversa común tuvo una relación dosis-respuesta.
Síntomas extrapiramidales
Esquizofrenia
En ensayos controlados con placebo a corto plazo en esquizofrenia en adultos, la incidencia de eventos relacionados con SEP informados, excluyendo eventos relacionados con acatisia, para pacientes tratados con ABILIFY fue del 13 % frente al 12 % para el placebo; y la incidencia de eventos relacionados con la acatisia para los pacientes tratados con ABILIFY fue del 8 % frente al 4 % para el placebo. En el ensayo a corto plazo controlado con placebo de esquizofrenia en pacientes pediátricos (13 a 17 años), la incidencia de eventos relacionados con SEP informados, excluyendo eventos relacionados con acatisia, para pacientes tratados con ABILIFY fue del 25 % frente al 7 % para placebo; y la incidencia de eventos relacionados con la acatisia para los pacientes tratados con ABILIFY fue del 9 % frente al 6 % para el placebo.
Los datos recopilados objetivamente de esos ensayos se recopilaron en la Escala de calificación Simpson Angus (para EPS), la Escala de acatisia de Barnes (para acatisia) y las Escalas de evaluación de movimientos involuntarios (para discinesias). En los ensayos de esquizofrenia en adultos, los datos recopilados objetivamente no mostraron una diferencia entre ABILIFY 10 mg y el placebo, con la excepción de la escala de acatisia de Barnes (ABILIFY 20 mg, 0,08; placebo, -0,05). En el ensayo de esquizofrenia pediátrica (13 a 17 años), los datos recopilados objetivamente no mostraron una diferencia entre ABILIFY 20 mg y el placebo, con la excepción de la escala de calificación Simpson Angus (ABILIFY 20 mg, 0,24; placebo, -0,29).
De manera similar, en un ensayo controlado con placebo a largo plazo (26 semanas) de esquizofrenia en adultos, se recopilaron datos de forma objetiva sobre la Escala de calificación Simpson Angus (para EPS), la Escala de acatisia de Barnes (para acatisia) y las Evaluaciones de trastornos involuntarios. Las escalas de movimiento (para discinesias) no mostraron una diferencia entre ABILIFY y el placebo.
Manía bipolar
En los ensayos controlados con placebo a corto plazo en la manía bipolar en adultos, la incidencia de eventos relacionados con SEP informados, excluyendo los eventos relacionados con la acatisia, para los pacientes tratados con ABILIFY en monoterapia fue del 16 % frente al 8 % para el placebo y la incidencia de los eventos relacionados con la acatisia para los pacientes tratados con monoterapia con ABILIFY fue del 13 % frente al 4 % para el placebo. En el ensayo controlado con placebo de 6 semanas en la manía bipolar para la terapia adyuvante con litio o valproato, la incidencia de eventos relacionados con SEP informados, excluyendo los eventos relacionados con la acatisia para los pacientes tratados con ABILIFY adyuvante, fue del 15 % frente al 8 % para los pacientes tratados con ABILIFY adyuvante. placebo y la incidencia de eventos relacionados con la acatisia para los pacientes tratados con ABILIFY adyuvante fue del 19 % frente al 5 % para el placebo adyuvante. En el ensayo a corto plazo controlado con placebo en manía bipolar en pacientes pediátricos (10 a 17 años), la incidencia de eventos relacionados con SEP informados, excluyendo eventos relacionados con acatisia, para pacientes tratados con ABILIFY fue del 26 % frente al 5 % para el placebo y la incidencia de eventos relacionados con la acatisia para los pacientes tratados con ABILIFY fue del 10 % frente al 2 % para el placebo.
En los ensayos de manía bipolar en adultos con ABILIFY en monoterapia, la escala de calificación Simpson Angus y la escala de acatisia de Barnes mostraron una diferencia significativa entre ABILIFY 15 mg y el placebo (ABILIFY, 0,50; placebo, -0,01 y ABILIFY 10 mg, 0,21; placebo, -0,05). Los cambios en las escalas de evaluación de movimientos involuntarios fueron similares para los grupos de ABILIFY 15 mg y placebo. En los ensayos de manía bipolar con ABILIFY 20 mg como terapia adyuvante con litio o valproato, la escala de calificación Simpson Angus y la escala de acatisia de Barnes mostraron una diferencia significativa entre ABILIFY adyuvante y placebo adyuvante (ABILIFY 20 mg, 0,73; placebo, 0,07 y ABILIFY 10 mg, 0,30; placebo, 0,11). Los cambios en las escalas de evaluación de movimientos involuntarios fueron similares para ABILIFY 20 mg adyuvante y placebo adyuvante. En el ensayo de manía bipolar pediátrica (10 a 17 años), a corto plazo, la escala de calificación Simpson Angus mostró una diferencia significativa entre ABILIFY 10 mg y el placebo (ABILIFY 15 mg, 0,90; placebo, -0,05). Los cambios en la Escala de acatisia de Barnes y las Escalas de evaluación de movimientos involuntarios fueron similares para los grupos de ABILIFY 20 mg y placebo.
Trastorno depresivo mayor
En los ensayos controlados con placebo a corto plazo en el trastorno depresivo mayor, la incidencia de eventos relacionados con los SEP informados, excluyendo los eventos relacionados con la acatisia, para los pacientes tratados con ABILIFY adyuvante fue del 8 % frente al 5 % para los pacientes tratados con placebo adyuvante; y la incidencia de eventos relacionados con la acatisia para los pacientes tratados con ABILIFY adyuvante fue del 25 % frente al 4 % para los pacientes tratados con placebo adyuvante.
En los ensayos de trastorno depresivo mayor, la escala de calificación Simpson Angus y la escala de acatisia de Barnes mostraron una diferencia significativa entre ABILIFY adyuvante y placebo adyuvante (ABILIFY 10 mg, 0,31; placebo, 0,03 y ABILIFY, 0,22; placebo, 0,02). Los cambios en las escalas de evaluación de movimientos involuntarios fueron similares para los grupos de ABILIFY adyuvante y de placebo adyuvante.
Trastorno autista
En los ensayos controlados con placebo a corto plazo en el trastorno autista en pacientes pediátricos (de 6 a 17 años), la incidencia de eventos relacionados con SEP notificados, excluyendo los eventos relacionados con la acatisia, para los pacientes tratados con ABILIFY fue del 18 % frente al 2 % para el placebo y la incidencia de eventos relacionados con la acatisia para los pacientes tratados con ABILIFY fue del 3 % frente al 9 % para el placebo.
En los ensayos pediátricos (de 6 a 17 años) de trastorno autista a corto plazo, la escala de calificación Simpson Angus mostró una diferencia significativa entre ABILIFY y el placebo (ABILIFY 20 mg, 0,1; placebo, -0,4). Los cambios en la Escala de acatisia de Barnes y las Escalas de evaluación de movimientos involuntarios fueron similares para los grupos de ABILIFY 10 mg y placebo.
Trastorno de Tourette
En los ensayos controlados con placebo a corto plazo en el trastorno de Tourette en pacientes pediátricos (de 6 a 18 años), la incidencia de eventos relacionados con SEP notificados, excluyendo los eventos relacionados con la acatisia, para los pacientes tratados con ABILIFY fue del 7 % frente al 6 % para el placebo y la incidencia de eventos relacionados con la acatisia para los pacientes tratados con ABILIFY fue del 4 % frente al 6 % para el placebo.
En los ensayos pediátricos (de 6 a 18 años) de trastorno de Tourette a corto plazo, los cambios en la escala de calificación Simpson Angus, la escala de acatisia de Barnes y la escala de evaluación de movimientos involuntarios no fueron clínicamente significativamente diferentes para ABILIFY 15 mg y el placebo.
Agitación asociada con la esquizofrenia o la manía bipolar
En los ensayos controlados con placebo en pacientes con agitación asociada con esquizofrenia o manía bipolar, la incidencia de eventos relacionados con SEP informados excluyendo eventos relacionados con acatisia para pacientes tratados con ABILIFY fue del 2 % frente al 2 % para el placebo y la incidencia de acatisia- eventos relacionados para los pacientes tratados con ABILIFY fue del 2 % frente al 0 % para el placebo. Los datos recopilados objetivamente en la escala de calificación Simpson Angus (para EPS) y la escala de acatisia de Barnes (para acatisia) para todos los grupos de tratamiento no mostraron una diferencia entre ABILIFY 10 mg y el placebo.
distonía
Los síntomas de distonía, contracciones anormales prolongadas de grupos musculares, pueden ocurrir en individuos susceptibles durante los primeros días de tratamiento. Los síntomas distónicos incluyen: espasmo de los músculos del cuello, que a veces progresa a opresión en la garganta, dificultad para tragar, dificultad para respirar y/o protrusión de la lengua. Si bien estos síntomas pueden ocurrir en dosis bajas, ocurren con mayor frecuencia y con mayor gravedad con alta potencia y en dosis más altas de fármacos antipsicóticos de primera generación. Se observa un riesgo elevado de distonía aguda en hombres y grupos de edad más jóvenes.
Hallazgos adicionales observados en ensayos clínicos
Reacciones adversas en ensayos a largo plazo, doble ciego, controlados con placebo
Las reacciones adversas informadas en un ensayo doble ciego de 26 semanas que comparó ABILIFY 10 mg oral y placebo en pacientes con esquizofrenia fueron generalmente consistentes con las informadas en los ensayos a corto plazo controlados con placebo, excepto por una mayor incidencia de temblor [8 % (12/153) para ABILIFY 20 mg vs. 2 % (3/153) para placebo]. En este estudio, la mayoría de los casos de temblor fueron de intensidad leve (8/12 leves y 4/12 moderados), ocurrieron temprano en el tratamiento (9/12 ≤49 días) y fueron de duración limitada (7/12 ≤ 10 días). El temblor condujo con poca frecuencia a la suspensión (
Otras reacciones adversas observadas durante la evaluación previa a la comercialización de ABILIFY
La siguiente lista no incluye reacciones: 1) ya enumeradas en tablas anteriores o en otra parte del etiquetado, 2) para las cuales la causa de un fármaco era remota, 3) que fueron tan generales como para no ser informativas, 4) que no se consideró que tuvieran efectos significativos. implicaciones clínicas, o 5) que ocurrió a una tasa igual o menor que el placebo.
Las reacciones se clasifican por sistema corporal de acuerdo con las siguientes definiciones: reacciones adversas frecuentes son aquellas que ocurren en al menos 1/100 pacientes; las reacciones adversas poco frecuentes son las que ocurren en 1/100 a 1/1000 pacientes; reacciones raras son aquellas que ocurren en menos de 1/1000 pacientes:
Adultos - Administración oral
Trastornos de la sangre y del sistema linfático: raro - trombocitopenia
Trastornos cardíacos: poco frecuentes - bradicardia, palpitaciones, raras - aleteo auricular, paro cardiorrespiratorio, bloqueo auriculoventricular, fibrilación auricular, angina de pecho, isquemia miocárdica, infarto de miocardio, insuficiencia cardiopulmonar
Trastornos oculares: poco frecuente - fotofobia; raro - diplopía
Desórdenes gastrointestinales: infrecuente - enfermedad por reflujo gastroesofágico
Desordenes generales y condiciones administrativas del sitio: frecuente - astenia; infrecuente - edema periférico, dolor de pecho; raro - edema facial
Trastornos hepatobiliares: raro - hepatitis, ictericia
Trastornos del sistema inmunológico : raro - hipersensibilidad
Lesiones, envenenamiento y complicaciones de procedimientos: infrecuente - caída; raro - golpe de calor
Investigaciones: frecuentes - disminución de peso, infrecuentes - aumento de las enzimas hepáticas, aumento de la glucosa en sangre, aumento de la lactato deshidrogenasa en sangre, aumento de la gamma glutamil transferasa; Raros: aumento de la prolactina en sangre, aumento de la urea en sangre, aumento de la creatinina en sangre, aumento de la bilirrubina en sangre, prolongación del intervalo QT del electrocardiograma, aumento de la hemoglobina glicosilada.
Trastornos del metabolismo y la nutrición: frecuente - anorexia; raros - hipopotasemia, hiponatremia, hipoglucemia
Trastornos musculoesqueléticos y del tejido conjuntivo: poco frecuentes - debilidad muscular, tensión muscular; raras - rabdomiólisis, disminución de la movilidad
Trastornos del sistema nervioso: poco frecuentes - parkinsonismo, deterioro de la memoria, rigidez de rueda dentada, hipocinesia, bradicinesia; raros - acinesia, mioclono, coordinación anormal, trastorno del habla, convulsión de Grand Mal;
Desórdenes psiquiátricos: infrecuente - agresión, pérdida de la libido, delirio; Raros: aumento de la libido, anorgasmia, tic, ideación homicida, catatonia, sonambulismo.
Trastornos renales y urinarios: raros - retención urinaria, nicturia
Trastornos del sistema reproductivo y de la mama: infrecuente - disfunción eréctil; raros - ginecomastia, menstruación irregular, amenorrea, dolor de pecho, priapismo
Trastornos respiratorios, torácicos y mediastínicos: infrecuente - congestión nasal, disnea
Trastornos de la piel y del tejido subcutáneo: poco frecuentes - erupción, hiperhidrosis, prurito, reacción de fotosensibilidad, alopecia; raro - urticaria
Trastornos vasculares: poco frecuentes - hipotensión, hipertensión
Pacientes pediátricos: administración oral
La mayoría de los eventos adversos observados en la base de datos agrupada de 1686 pacientes pediátricos, de 6 a 18 años de edad, también se observaron en la población adulta. Las reacciones adversas adicionales observadas en la población pediátrica se enumeran a continuación.
Trastornos oculares infrecuente - crisis oculógira
Desórdenes gastrointestinales: infrecuente -lengua seca, espasmo lingual
Investigaciones: frecuente - aumento de la insulina en sangre
Trastornos del sistema nervioso: poco frecuente - hablar dormido
Trastornos renales y urinarios frecuentes - enuresis
Trastornos de la piel y del tejido subcutáneo: infrecuente - hirsutismo
Adultos - Inyección intramuscular
La mayoría de las reacciones adversas observadas en la base de datos agrupada de 749 pacientes adultos tratados con ABILIFY inyectable también se observaron en la población adulta tratada con ABILIFY oral. Las reacciones adversas adicionales observadas en la población inyectada de ABILIFY se enumeran a continuación.
Desordenes generales y condiciones administrativas del sitio: ≥1/100 pacientes - reacción en el lugar de la inyección; ≥1/1000 pacientes y
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de ABILIFY. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible establecer una relación causal con la exposición al fármaco: reacciones alérgicas (reacción anafiláctica, angioedema, laringoespasmo, prurito/urticaria o espasmo orofaríngeo), juego patológico , hipo y fluctuación de la glucosa en sangre.
INTERACCIONES CON LA DROGAS
Fármacos que tienen interacciones clínicamente importantes con ABILIFY
Medicamentos que no tienen interacciones clínicamente importantes con ABILIFY
Según estudios farmacocinéticos, no es necesario ajustar la dosis de ABILIFY cuando se administra de forma concomitante con famotidina, valproato, litio, lorazepam.
Además, no es necesario ajustar la dosis para los sustratos de CYP2D6 (p. ej., dextrometorfano, fluoxetina, paroxetina o venlafaxina), CYP2C9 (p. ej., warfarina), CYP2C19 (p. ej., omeprazol, warfarina, escitalopram) o CYP3A4 (p. ej., dextrometorfano) cuando se coadministra con ABILIFY. Además, no es necesario ajustar la dosis de valproato, litio, lamotrigina, lorazepam o sertralina cuando se administran junto con ABILIFY [ver FARMACOLOGÍA CLÍNICA ].
Abuso y dependencia de drogas
Sustancia controlada
ABILIFY no es una sustancia controlada.
Abuso
ABILIFY no se ha estudiado sistemáticamente en humanos por su potencial de abuso, tolerancia o dependencia física. En consecuencia, los pacientes deben ser evaluados cuidadosamente en busca de antecedentes de abuso de drogas, y dichos pacientes deben ser observados de cerca en busca de signos de uso indebido o abuso de ABILIFY 20 mg (p. ej., desarrollo de tolerancia, aumentos en la dosis, comportamiento de búsqueda de drogas).
Dependencia
En estudios de dependencia física en monos, se observaron síntomas de abstinencia tras la interrupción brusca de la dosificación. Si bien los ensayos clínicos no revelaron ninguna tendencia a ningún comportamiento de búsqueda de fármacos, estas observaciones no fueron sistemáticas y, sobre la base de esta experiencia limitada, no es posible predecir hasta qué punto un fármaco activo sobre el SNC será mal utilizado, desviado, y/o abusado una vez comercializado.
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Aumento de la mortalidad en pacientes ancianos con psicosis relacionada con demencia
Mortalidad aumentada
Los pacientes de edad avanzada con psicosis relacionada con la demencia tratados con medicamentos antipsicóticos tienen un mayor riesgo de muerte. ABILIFY (aripiprazol) no está aprobado para el tratamiento de pacientes con psicosis relacionada con la demencia [ver ADVERTENCIA EN EL RECUADRO].
Experiencia de Seguridad en Pacientes Ancianos con Psicosis Asociada a la Enfermedad de Alzheimer
En tres estudios controlados con placebo de 10 semanas de ABILIFY 10 mg en pacientes de edad avanzada con psicosis asociada con la enfermedad de Alzheimer (n=938; edad media: 82,4 años; rango: 56-99 años), las reacciones adversas que se informados con una incidencia de ≥3 % y ABILIFY 15 mg una incidencia de al menos el doble que para el placebo fueron letargo [placebo 2 %, ABILIFY 5 %], somnolencia (incluida la sedación) [placebo 3 %, ABILIFY 8 %] e incontinencia (principalmente , incontinencia urinaria) [placebo 1 %, ABILIFY 5 %], salivación excesiva [placebo 0 %, ABILIFY 4 %] y mareos [placebo 1 %, ABILIFY 4 %].
No se ha establecido la seguridad y eficacia de ABILIFY 15 mg en el tratamiento de pacientes con psicosis asociada con demencia. Si el prescriptor elige tratar a dichos pacientes con ABILIFY 15 mg, evalúe la aparición de dificultad para tragar o somnolencia excesiva, lo que podría predisponer a una lesión o aspiración accidental [ver ADVERTENCIA EN CAJA ].
Eventos adversos cerebrovasculares, incluido el accidente cerebrovascular
En estudios clínicos controlados con placebo (dos estudios de dosis flexible y uno de dosis fija) de psicosis relacionada con la demencia, hubo una mayor incidencia de eventos adversos cerebrovasculares (p. ej., accidente cerebrovascular, ataque isquémico transitorio), incluidas muertes, en pacientes tratados con ABILIFY ( edad media: 84 años; rango: 78-88 años). En el estudio de dosis fija, hubo una relación dosis-respuesta estadísticamente significativa para eventos adversos cerebrovasculares en pacientes tratados con ABILIFY. ABILIFY no está aprobado para el tratamiento de pacientes con psicosis relacionada con demencia [ver ADVERTENCIA EN CAJA ].
Pensamientos y conductas suicidas en niños, adolescentes y adultos jóvenes
Los pacientes con trastorno depresivo mayor (MDD), tanto adultos como pediátricos, pueden experimentar un empeoramiento de su depresión y/o la aparición de ideación y comportamiento suicida (suicidalidad) o cambios inusuales en el comportamiento, estén o no tomando medicamentos antidepresivos, y esto el riesgo puede persistir hasta que ocurra una remisión significativa. El suicidio es un riesgo conocido de depresión y ciertos otros trastornos psiquiátricos, y estos trastornos en sí mismos son los predictores más fuertes de suicidio. Sin embargo, desde hace mucho tiempo existe la preocupación de que los antidepresivos puedan tener un papel en la inducción del empeoramiento de la depresión y la aparición de tendencias suicidas en ciertos pacientes durante las primeras fases del tratamiento. Los análisis combinados de ensayos a corto plazo controlados con placebo de medicamentos antidepresivos (ISRS y otros) mostraron que estos medicamentos aumentan el riesgo de pensamientos y conductas suicidas (tendencia suicida) en niños, adolescentes y adultos jóvenes (de 18 a 24 años) con MDD y otros trastornos psiquiátricos. Los estudios a corto plazo no mostraron un aumento en el riesgo de tendencias suicidas con antidepresivos en comparación con placebo en adultos mayores de 24 años; hubo una reducción con los antidepresivos en comparación con el placebo en adultos de 65 años o más.
Los análisis agrupados de ensayos controlados con placebo en niños y adolescentes con TDM, trastorno obsesivo compulsivo (TOC) u otros trastornos psiquiátricos incluyeron un total de 24 ensayos a corto plazo de 9 fármacos antidepresivos en más de 4400 pacientes. Los análisis agrupados de ensayos controlados con placebo en adultos con MDD u otros trastornos psiquiátricos incluyeron un total de 295 ensayos a corto plazo (duración media de 2 meses) de 11 fármacos antidepresivos en más de 77 000 pacientes. Hubo una variación considerable en el riesgo de suicidio entre los fármacos, pero una tendencia hacia un aumento en los pacientes más jóvenes para casi todos los fármacos estudiados. Hubo diferencias en el riesgo absoluto de suicidio entre las diferentes indicaciones, con la mayor incidencia en MDD. Sin embargo, las diferencias de riesgo (fármaco frente a placebo) fueron relativamente estables dentro de los estratos de edad y entre las indicaciones. Estas diferencias de riesgo (diferencia fármaco-placebo en el número de casos de tendencias suicidas por cada 1000 pacientes tratados) se proporcionan en la Tabla 5.
No se produjeron suicidios en ninguno de los ensayos pediátricos. Hubo suicidios en los ensayos con adultos, pero el número no fue suficiente para llegar a ninguna conclusión sobre el efecto del fármaco sobre el suicidio.
Se desconoce si el riesgo de suicidio se extiende al uso a largo plazo, es decir, más allá de varios meses. Sin embargo, existe evidencia sustancial de ensayos de mantenimiento controlados con placebo en adultos con depresión de que el uso de antidepresivos puede retrasar la recurrencia de la depresión.
Todos los pacientes que reciben tratamiento con antidepresivos por cualquier indicación deben ser monitoreados adecuadamente y observados de cerca por si empeoran clínicamente, tienen tendencias suicidas y cambios inusuales en el comportamiento, especialmente durante los meses iniciales de un ciclo de terapia con medicamentos, o en momentos de cambios de dosis, ya sea aumentos o disminuye.
Los siguientes síntomas, ansiedad, agitación, ataques de pánico, insomnio, irritabilidad, hostilidad, agresividad, impulsividad, acatisia (inquietud psicomotora), hipomanía y manía, se han informado en pacientes adultos y pediátricos tratados con antidepresivos para MDD así como para otras indicaciones, tanto psiquiátricas como no psiquiátricas. Aunque no se ha establecido un vínculo causal entre la aparición de tales síntomas y el empeoramiento de la depresión y/o la aparición de impulsos suicidas, existe la preocupación de que tales síntomas puedan representar precursores de tendencias suicidas emergentes.
Se debe considerar cambiar el régimen terapéutico, incluida la posibilidad de suspender el medicamento, en pacientes cuya depresión empeora persistentemente, o que están experimentando tendencias suicidas emergentes o síntomas que podrían ser precursores de un empeoramiento de la depresión o tendencias suicidas, especialmente si estos síntomas son severos, abruptos. en el inicio, o no formaban parte de los síntomas de presentación del paciente.
Se debe alertar a las familias y cuidadores de pacientes que reciben tratamiento con antidepresivos por trastorno depresivo mayor u otras indicaciones, tanto psiquiátricas como no psiquiátricas, sobre la necesidad de monitorear a los pacientes para detectar la aparición de agitación, irritabilidad, cambios inusuales en el comportamiento y los demás síntomas descritos anteriormente. , así como el surgimiento de tendencias suicidas, e informar dichos síntomas de inmediato a los proveedores de atención médica. Dicho seguimiento debe incluir la observación diaria por parte de las familias y los cuidadores. Las recetas de ABILIFY deben hacerse para la cantidad más pequeña de comprimidos compatible con un buen manejo del paciente, a fin de reducir el riesgo de sobredosis.
Detección de pacientes para el trastorno bipolar
Un episodio depresivo mayor puede ser la presentación inicial del trastorno bipolar. En general, se cree (aunque no se ha establecido en ensayos controlados) que tratar un episodio de este tipo con un antidepresivo solo puede aumentar la probabilidad de precipitación de un episodio mixto/maníaco en pacientes con riesgo de trastorno bipolar. Se desconoce si alguno de los síntomas descritos anteriormente representa tal conversión. Sin embargo, antes de iniciar el tratamiento con un antidepresivo, los pacientes con síntomas depresivos deben someterse a un cribado adecuado para determinar si tienen riesgo de trastorno bipolar; dicha evaluación debe incluir un historial psiquiátrico detallado, incluidos antecedentes familiares de suicidio, trastorno bipolar y depresión.
Cabe señalar que ABILIFY 20 mg no está aprobado para su uso en el tratamiento de la depresión en la población pediátrica.
Síndrome Neuroléptico Maligno (SNM)
Un complejo de síntomas potencialmente mortales, a veces denominado Síndrome Neuroléptico Maligno (SNM), puede ocurrir con la administración de medicamentos antipsicóticos, incluido ABILIFY. casos raros de SNM ocurrieron durante el tratamiento con ABILIFY 15 mg en la base de datos clínica mundial. Las manifestaciones clínicas del SNM son hiperpirexia, rigidez muscular, estado mental alterado y evidencia de inestabilidad autonómica (pulso o presión arterial irregulares, taquicardia, diaforesis y arritmia cardíaca). Los signos adicionales pueden incluir creatina fosfocinasa elevada, mioglobinuria (rabdomiolisis) e insuficiencia renal aguda.
La evaluación diagnóstica de los pacientes con este síndrome es complicada. Al llegar a un diagnóstico, es importante excluir los casos en los que la presentación clínica incluye tanto una enfermedad médica grave (p. ej., neumonía, infección sistémica) como signos y síntomas extrapiramidales (EPS) no tratados o tratados inadecuadamente. Otras consideraciones importantes en el diagnóstico diferencial incluyen toxicidad anticolinérgica central, golpe de calor, fiebre por fármacos y patología primaria del sistema nervioso central.
El manejo del SNM debe incluir: 1) suspensión inmediata de los medicamentos antipsicóticos y otros medicamentos que no sean esenciales para la terapia concurrente; 2) tratamiento sintomático intensivo y seguimiento médico; y 3) tratamiento de cualquier problema médico grave concomitante para el cual haya tratamientos específicos disponibles. No existe un acuerdo general sobre los regímenes de tratamiento farmacológico específicos para el SNM no complicado.
Si un paciente requiere tratamiento con medicamentos antipsicóticos después de la recuperación del SNM, se debe considerar cuidadosamente la posible reintroducción de la terapia con medicamentos. El paciente debe ser monitoreado cuidadosamente, ya que se han informado recurrencias de SNM.
Discinesia tardía
Se puede desarrollar un síndrome de movimientos discinéticos involuntarios, potencialmente irreversibles, en pacientes tratados con fármacos antipsicóticos. Aunque la prevalencia del síndrome parece ser mayor entre los ancianos, especialmente en las mujeres de edad avanzada, es imposible confiar en las estimaciones de prevalencia para predecir, al inicio del tratamiento antipsicótico, qué pacientes tienen probabilidades de desarrollar el síndrome. Se desconoce si los medicamentos antipsicóticos difieren en su potencial para causar discinesia tardía.
Se cree que el riesgo de desarrollar discinesia tardía y la probabilidad de que se vuelva irreversible aumentan a medida que aumenta la duración del tratamiento y la dosis total acumulada de fármacos antipsicóticos administrados al paciente. Sin embargo, el síndrome puede desarrollarse, aunque con mucha menos frecuencia, después de períodos de tratamiento relativamente breves con dosis bajas.
La discinesia tardía puede remitir, parcial o completamente, si se suspende el tratamiento antipsicótico. Sin embargo, el tratamiento antipsicótico en sí mismo puede suprimir (o suprimir parcialmente) los signos y síntomas del síndrome y, por lo tanto, es posible que enmascare el proceso subyacente. Se desconoce el efecto que tiene la supresión sintomática sobre el curso a largo plazo del síndrome.
Dadas estas consideraciones, ABILIFY debe prescribirse de la manera que sea más probable que minimice la aparición de discinesia tardía. El tratamiento antipsicótico crónico generalmente debe reservarse para pacientes que padecen una enfermedad crónica que (1) se sabe que responde a los medicamentos antipsicóticos y (2) para quienes tratamientos alternativos, igualmente efectivos, pero potencialmente menos dañinos, no están disponibles o no son apropiados. En pacientes que sí requieren tratamiento crónico, se debe buscar la menor dosis y la menor duración del tratamiento que produzca una respuesta clínica satisfactoria. La necesidad de continuar el tratamiento debe reevaluarse periódicamente.
Si aparecen signos y síntomas de discinesia tardía en un paciente que recibe ABILIFY, se debe considerar la suspensión del fármaco. Sin embargo, algunos pacientes pueden requerir tratamiento con ABILIFY 15 mg a pesar de la presencia del síndrome.
Cambios metabólicos
Los fármacos antipsicóticos atípicos se han asociado con cambios metabólicos que incluyen hiperglucemia/diabetes mellitus, dislipidemia y aumento de peso corporal. Si bien se ha demostrado que todos los medicamentos de la clase producen algunos cambios metabólicos, cada medicamento tiene su propio perfil de riesgo específico.
Hiperglucemia/Diabetes Mellitus
Se ha notificado hiperglucemia, en algunos casos extrema y asociada con cetoacidosis o coma hiperosmolar o muerte, en pacientes tratados con antipsicóticos atípicos. Ha habido informes de hiperglucemia en pacientes tratados con ABILIFY [ver REACCIONES ADVERSAS ]. La evaluación de la relación entre el uso de antipsicóticos atípicos y las anomalías de la glucosa se complica por la posibilidad de un mayor riesgo de diabetes mellitus en pacientes con esquizofrenia y la creciente incidencia de diabetes mellitus en la población general. Dados estos factores de confusión, la relación entre el uso de antipsicóticos atípicos y los eventos adversos relacionados con la hiperglucemia no se comprende por completo. Sin embargo, los estudios epidemiológicos sugieren un mayor riesgo de reacciones adversas relacionadas con la hiperglucemia en pacientes tratados con antipsicóticos atípicos. Debido a que ABILIFY no se comercializaba en el momento en que se realizaron estos estudios, no se sabe si ABILIFY está asociado con este mayor riesgo. No se dispone de estimaciones precisas del riesgo de reacciones adversas relacionadas con la hiperglucemia en pacientes tratados con antipsicóticos atípicos.
Los pacientes con un diagnóstico establecido de diabetes mellitus que comienzan con antipsicóticos atípicos deben ser monitoreados regularmente para detectar un empeoramiento del control de la glucosa. Los pacientes con factores de riesgo de diabetes mellitus (p. ej., obesidad, antecedentes familiares de diabetes) que inician un tratamiento con antipsicóticos atípicos deben someterse a pruebas de glucosa en sangre en ayunas al comienzo del tratamiento y periódicamente durante el tratamiento. Cualquier paciente tratado con antipsicóticos atípicos debe ser monitoreado por síntomas de hiperglucemia que incluyen polidipsia, poliuria, polifagia y debilidad. Los pacientes que desarrollan síntomas de hiperglucemia durante el tratamiento con antipsicóticos atípicos deben someterse a pruebas de glucosa en sangre en ayunas. En algunos casos, la hiperglucemia se resolvió cuando se suspendió el antipsicótico atípico; sin embargo, algunos pacientes requirieron la continuación del tratamiento antidiabético a pesar de la interrupción del fármaco sospechoso.
Adultos
En un análisis de 13 ensayos de monoterapia controlados con placebo en adultos, principalmente con esquizofrenia o trastorno bipolar, el cambio medio en la glucosa en ayunas en pacientes tratados con ABILIFY (+4,4 mg/dl; mediana de exposición 25 días; N=1057) no fue significativamente diferente que en los pacientes tratados con placebo (+2,5 mg/dL; mediana de exposición 22 días; N=799). La Tabla 6 muestra la proporción de pacientes tratados con ABILIFY con glucosa en ayunas normal y en el límite al inicio (exposición media de 25 días) que tuvieron mediciones altas de glucosa en ayunas emergentes del tratamiento en comparación con los pacientes tratados con placebo (exposición media de 22 días).
A las 24 semanas, el cambio medio en la glucosa en ayunas en los pacientes tratados con ABILIFY no fue significativamente diferente al de los pacientes tratados con placebo [+2.2 mg/dL (n=42) y +9.6 mg/dL (n=28), respectivamente] .
El cambio medio en la glucosa en ayunas en pacientes con trastorno depresivo mayor tratados con ABILIFY adyuvante (+0,7 mg/dL; mediana de exposición 42 días; N=241) no fue significativamente diferente al de los pacientes tratados con placebo (+0,8 mg/dL; mediana exposición 42 días; N=246). La Tabla 7 muestra la proporción de pacientes adultos con cambios en los niveles de glucosa en ayunas de dos ensayos complementarios controlados con placebo (exposición media de 42 días) en pacientes con trastorno depresivo mayor.
Pacientes Pediátricos Y Adolescentes
En un análisis de dos ensayos controlados con placebo en adolescentes con esquizofrenia (13 a 17 años) y pacientes pediátricos con trastorno bipolar (10 a 17 años), el cambio medio en la glucosa en ayunas en pacientes tratados con ABILIFY (+4,8 mg/dL; con una mediana de exposición de 43 días; N=259) no fue significativamente diferente que en los pacientes tratados con placebo (+1,7 mg/dl; con una mediana de exposición de 42 días; N=123).
En un análisis de dos ensayos controlados con placebo en pacientes pediátricos y adolescentes con irritabilidad asociada con el trastorno autista (de 6 a 17 años) con una mediana de exposición de 56 días, el cambio medio en la glucosa en ayunas en pacientes tratados con ABILIFY (-0,2 mg /dL; N=83) no fue significativamente diferente que en los pacientes tratados con placebo (-0,6 mg/dL; N=33).
En un análisis de dos ensayos controlados con placebo en pacientes pediátricos y adolescentes con trastorno de Tourette (de 6 a 18 años) con una mediana de exposición de 57 días, el cambio medio en la glucosa en ayunas en pacientes tratados con ABILIFY (0,79 mg/dl; N=90) no fue significativamente diferente que en los pacientes tratados con placebo (-1,66 mg/dL; N=58).
La Tabla 8 muestra la proporción de pacientes con cambios en los niveles de glucosa en ayunas del grupo de pacientes adolescentes esquizofrénicos y bipolares pediátricos (exposición media de 42 a 43 días), de dos ensayos controlados con placebo en pacientes pediátricos (de 6 a 17 años) con irritabilidad asociada con trastorno autista (exposición media de 56 días), y de los dos ensayos controlados con placebo en pacientes pediátricos (de 6 a 18 años) con trastorno de Tourette (exposición media de 57 días).
A las 12 semanas en los ensayos combinados de esquizofrenia en adolescentes y trastorno bipolar pediátrico, el cambio medio en la glucosa en ayunas en los pacientes tratados con ABILIFY no fue significativamente diferente al de los pacientes tratados con placebo [+2.4 mg/dL (n=81) y +0.1 mg /dL (n=15), respectivamente].
dislipidemia
Se han observado alteraciones indeseables de los lípidos en pacientes tratados con antipsicóticos atípicos.
No hubo diferencias significativas entre los pacientes tratados con ABILIFY y con placebo en la proporción con cambios de niveles normales a niveles clínicamente significativos para el colesterol total en ayunas/sin ayunar, los triglicéridos en ayunas, las LDL en ayunas y las HDL en ayunas/sin ayunas. Los análisis de pacientes con al menos 12 o 24 semanas de exposición estuvieron limitados por el pequeño número de pacientes.
Adultos
La Tabla 9 muestra la proporción de pacientes adultos, principalmente de ensayos combinados controlados con placebo de monoterapia de esquizofrenia y trastorno bipolar, con cambios en el colesterol total (agrupado de 17 ensayos; mediana de exposición de 21 a 25 días), triglicéridos en ayunas (agrupado de ocho ensayos; mediana de exposición de 42 días), colesterol LDL en ayunas (agrupado de ocho ensayos; mediana de exposición de 39 a 45 días, excepto para los pacientes tratados con placebo con mediciones basales de LDL en ayunas normales, que tuvieron una mediana de exposición al tratamiento de 24 días) y colesterol HDL (agrupado de nueve ensayos; mediana de exposición de 40 a 42 días).
En ensayos de monoterapia en adultos, la proporción de pacientes a las 12 y 24 semanas con cambios de Normal a Alto en el colesterol total (en ayunas/sin ayuno), los triglicéridos en ayunas y el colesterol LDL en ayunas fue similar entre los pacientes tratados con ABILIFY y con placebo: 12 semanas, colesterol total (en ayunas/sin ayuno), 1/71 (1,4 %) frente a 3/74 (4,1 %); triglicéridos en ayunas, 8/62 (12,9 %) frente a 5/37 (13,5 %); Colesterol LDL en ayunas, 0/34 (0 %) frente a 1/25 (4,0 %), respectivamente; ya las 24 semanas, colesterol total (en ayunas/sin ayunar), 1/42 (2,4 %) frente a 3/37 (8,1 %); triglicéridos en ayunas, 5/34 (14,7 %) frente a 5/20 (25 %); Colesterol LDL en ayunas, 0/22 (0 %) frente a 1/18 (5,6 %), respectivamente.
La Tabla 10 muestra la proporción de pacientes con cambios en el colesterol total (en ayunas/sin ayuno), los triglicéridos en ayunas, el colesterol LDL en ayunas y el colesterol HDL de dos ensayos complementarios controlados con placebo en pacientes adultos con trastorno depresivo mayor (exposición media de 42 días).
Pacientes Pediátricos Y Adolescentes
La Tabla 11 muestra la proporción de adolescentes con esquizofrenia (13 a 17 años) y pacientes pediátricos con trastorno bipolar (10 a 17 años) con cambios en el colesterol total y el colesterol HDL (agrupados de dos ensayos controlados con placebo; mediana de exposición de 42 a 43 días). ) y triglicéridos en ayunas (agrupados de dos ensayos controlados con placebo; mediana de exposición de 42 a 44 días).
En ensayos de monoterapia de adolescentes con esquizofrenia y pacientes pediátricos con trastorno bipolar, la proporción de pacientes a las 12 y 24 semanas con cambios de Normal a Alto en el colesterol total (en ayunas/sin ayunar), los triglicéridos en ayunas y el colesterol LDL en ayunas fueron similares entre ABILIFY - y pacientes tratados con placebo: a las 12 semanas, colesterol total (en ayunas/sin ayunar), 0/57 (0 %) frente a 0/15 (0 %); Triglicéridos en ayunas, 2/72 (2,8 %) frente a 1/14 (7,1 %), respectivamente; ya las 24 semanas, colesterol total (en ayunas/sin ayunar), 0/36 (0 %) frente a 0/12 (0 %); Triglicéridos en ayunas, 1/47 (2,1 %) frente a 1/10 (10,0 %), respectivamente.
La Tabla 12 muestra la proporción de pacientes con cambios en el colesterol total (en ayunas/sin ayunar) y triglicéridos en ayunas (exposición media de 56 días) y colesterol HDL (exposición media de 55 a 56 días) de dos ensayos controlados con placebo en pacientes pediátricos (6 a 17 años) con irritabilidad asociada con el trastorno autista.
La Tabla 13 muestra la proporción de pacientes con cambios en el colesterol total (en ayunas/sin ayunar) y triglicéridos en ayunas (exposición media de 57 días) y colesterol HDL (exposición media de 57 días) de dos ensayos controlados con placebo en pacientes pediátricos (de 6 a 18 años) con el Trastorno de Tourette.
Aumento de peso
Se ha observado aumento de peso con el uso de antipsicóticos atípicos. Se recomienda el control clínico del peso.
Adultos
En un análisis de 13 ensayos de monoterapia controlados con placebo, principalmente de esquizofrenia y trastorno bipolar combinados, con una mediana de exposición de 21 a 25 días, el cambio medio en el peso corporal en pacientes tratados con ABILIFY fue de +0,3 kg (N=1673) en comparación con a –0,1 kg (N=1100) en pacientes controlados con placebo. A las 24 semanas, el cambio medio desde el inicio en el peso corporal en los pacientes tratados con ABILIFY fue de -1,5 kg (n=73) en comparación con -0,2 kg (n=46) en los pacientes tratados con placebo.
En los ensayos que agregaron ABILIFY a los antidepresivos, los pacientes primero recibieron 8 semanas de tratamiento antidepresivo seguido de 6 semanas de ABILIFY 10 mg o placebo adyuvante además de su tratamiento antidepresivo en curso. El cambio medio en el peso corporal en pacientes que recibieron ABILIFY adyuvante fue de +1,7 kg (N=347) en comparación con +0,4 kg (N=330) en pacientes que recibieron placebo adyuvante.
La Tabla 14 muestra el porcentaje de pacientes adultos con aumento de peso ≥7% del peso corporal por indicación.
Pacientes Pediátricos Y Adolescentes
En un análisis de dos ensayos controlados con placebo en adolescentes con esquizofrenia (13 a 17 años) y pacientes pediátricos con trastorno bipolar (10 a 17 años) con una mediana de exposición de 42 a 43 días, el cambio medio en el peso corporal en pacientes tratados con ABILIFY pacientes fue de +1,6 kg (N=381) en comparación con +0,3 kg (N=187) en pacientes tratados con placebo. A las 24 semanas, el cambio medio desde el inicio en el peso corporal en
pacientes tratados con ABILIFY fue de +5,8 kg (n=62) en comparación con +1,4 kg (n=13) en pacientes tratados con placebo.
En dos ensayos controlados con placebo a corto plazo en pacientes (de 6 a 17 años) con irritabilidad asociada con el trastorno autista con una mediana de exposición de 56 días, el cambio medio en el peso corporal en pacientes tratados con ABILIFY fue de +1,6 kg (n=209 ) en comparación con +0,4 kg (n=98) en pacientes tratados con placebo.
En dos ensayos controlados con placebo a corto plazo en pacientes (de 6 a 18 años) con trastorno de Tourette con una mediana de exposición de 57 días, el cambio medio en el peso corporal en pacientes tratados con ABILIFY fue de +1,5 kg (n=105 ) en comparación con +0,4 kg (n=66) en pacientes tratados con placebo.
La tabla 15 muestra el porcentaje de pacientes pediátricos y adolescentes con aumento de peso ≥7% del peso corporal por indicación.
En un ensayo abierto que inscribió a pacientes de los dos ensayos controlados con placebo de adolescentes con esquizofrenia (13 a 17 años) y pacientes pediátricos con trastorno bipolar (10 a 17 años), el 73,2 % de los pacientes (238/325) completaron 26 semanas de terapia con ABILIFY. Después de 26 semanas, el 32,8% de los pacientes ganó ≥7% de su peso corporal, sin ajustar por crecimiento normal. Para ajustar el crecimiento normal, se derivaron puntuaciones z (medidas en desviaciones estándar [SD]), que se normalizan para el crecimiento natural de pacientes pediátricos y adolescentes en comparación con estándares de población equiparados por edad y sexo. Un cambio de puntuación z
En un ensayo abierto que inscribió a pacientes de dos ensayos a corto plazo controlados con placebo, pacientes (de 6 a 17 años) con irritabilidad asociada con el trastorno autista, así como pacientes de novo, el 60,3 % (199/330) completó un año de terapia con ABILIFY. El cambio medio en la puntuación z del peso fue de 0,26 SD para los pacientes que recibieron más de 9 meses de tratamiento.
Cuando se trate a pacientes pediátricos por cualquier indicación, se debe controlar y evaluar el aumento de peso frente al esperado para un crecimiento normal.
Juego patológico y otras conductas compulsivas
Los informes de casos posteriores a la comercialización sugieren que los pacientes pueden experimentar ansias intensas, particularmente por jugar, y la incapacidad de controlar estas ansias mientras toman aripiprazol. Otros impulsos compulsivos, informados con menos frecuencia, incluyen: impulsos sexuales, ir de compras, comer o comer en exceso y otros comportamientos impulsivos o compulsivos. Debido a que los pacientes pueden no reconocer estos comportamientos como anormales, es importante que los prescriptores pregunten a los pacientes o a sus cuidadores específicamente sobre el desarrollo de impulsos de juego nuevos o intensos, impulsos sexuales compulsivos, compras compulsivas, atracones o comidas compulsivas u otros impulsos durante el tratamiento. con aripiprazol. Cabe señalar que los síntomas de control de los impulsos pueden estar asociados con el trastorno subyacente. En algunos casos, aunque no en todos, se informó que las urgencias cesaron cuando se redujo la dosis o se suspendió el medicamento. Los comportamientos compulsivos pueden causar daño al paciente y a otros si no se reconocen. Considere reducir la dosis o suspender el medicamento si un paciente desarrolla tales impulsos.
Hipotensión ortostática
ABILIFY 20 mg puede causar hipotensión ortostática, quizás debido a su antagonismo del receptor adrenérgico α1. La incidencia de eventos asociados con hipotensión ortostática de ensayos a corto plazo controlados con placebo de pacientes adultos que tomaban ABILIFY oral (n=2467) incluyeron (incidencia de ABILIFY 20 mg, incidencia de placebo) hipotensión ortostática (1 %, 0,3 %), mareos posturales ( 0,5%, 0,3%) y síncope (0,5%, 0,4%); de los pacientes pediátricos de 6 a 18 años de edad (n=732) que recibieron ABILIFY oral incluyeron hipotensión ortostática (0,5 %, 0 %), mareos posturales (0,4 %, 0 %) y síncope (0,2 %, 0 %); y de los pacientes que recibieron ABILIFY Inyectable (n=501) incluyeron hipotensión ortostática (0,6 %, 0 %), mareos posturales (0,2 %, 0,5 %) y síncope (0,4 %, 0 %) [ver REACCIONES ADVERSAS ].
La incidencia de un cambio ortostático significativo en la presión arterial (definida como una disminución en la presión arterial sistólica ≥20 mmHg acompañada de un aumento en la frecuencia cardíaca ≥25 lpm al comparar los valores de pie con los valores supinos) para ABILIFY no fue significativamente diferente del placebo (la incidencia de ABILIFY , incidencia de placebo): en pacientes adultos tratados con ABILIFY oral (4 %, 2 %), en pacientes pediátricos
Pacientes tratados con ABILIFY de 6 a 18 años de edad (0,4 %, 1 %), o en pacientes tratados con ABILIFY 15 mg por inyección (3 %, 2 %).
ABILIFY 20 mg debe usarse con precaución en pacientes con enfermedad cardiovascular conocida (antecedentes de infarto de miocardio o cardiopatía isquémica, insuficiencia cardíaca o anomalías de la conducción), enfermedad cerebrovascular o condiciones que predispondrían a los pacientes a la hipotensión (deshidratación, hipovolemia y tratamiento con antihipertensivos). medicamentos) [ver INTERACCIONES CON LA DROGAS ].
Si se considera necesaria la terapia con benzodiacepinas parenterales además del tratamiento con inyección de ABILIFY, se debe monitorear a los pacientes para detectar sedación excesiva e hipotensión ortostática [ver INTERACCIONES CON LA DROGAS ].
Caídas
Los antipsicóticos, incluido ABILIFY 10 mg, pueden causar somnolencia, hipotensión postural, inestabilidad motora y sensorial, lo que puede provocar caídas y, en consecuencia, fracturas u otras lesiones. Para los pacientes con enfermedades, afecciones o medicamentos que podrían exacerbar estos efectos, complete las evaluaciones de riesgo de caídas al iniciar el tratamiento antipsicótico y de manera recurrente para los pacientes que reciben terapia antipsicótica a largo plazo.
Leucopenia, neutropenia y agranulocitosis
En ensayos clínicos y/o experiencia posterior a la comercialización, se informaron eventos de leucopenia y neutropenia relacionados temporalmente con agentes antipsicóticos, incluido ABILIFY. También se ha informado agranulocitosis.
Los posibles factores de riesgo para la leucopenia/neutropenia incluyen un recuento bajo preexistente de glóbulos blancos (WBC)/recuento absoluto de neutrófilos (ANC) y antecedentes de leucopenia/neutropenia inducida por fármacos. En pacientes con antecedentes de leucopenia/neutropenia inducida por fármacos o leucopenia/neutropenia inducida por fármacos clínicamente significativa, realice un hemograma completo (CSC) con frecuencia durante los primeros meses de tratamiento. En tales pacientes, considere la interrupción de ABILIFY ante el primer signo de una disminución clínicamente significativa en WBC en ausencia de otros factores causales.
Vigile a los pacientes con neutropenia clínicamente significativa en busca de fiebre u otros síntomas o signos de infección y trátelos de inmediato si se presentan tales síntomas o signos. Suspenda ABILIFY 20 mg en pacientes con neutropenia grave (recuento absoluto de neutrófilos
Ataques/Convulsiones
En ensayos controlados con placebo a corto plazo, los pacientes con antecedentes de convulsiones excluyeron las convulsiones ocurrieron en el 0,1 % (3/2467) de los pacientes adultos no diagnosticados tratados con ABILIFY 20 mg por vía oral, en el 0,1 % (1/732) de los pacientes pediátricos (6 a 18 años), y en el 0,2 % (1/501) de los pacientes adultos tratados con ABILIFY 15 mg por inyección.
Al igual que con otros medicamentos antipsicóticos, ABILIFY 15 mg debe usarse con precaución en pacientes con antecedentes de convulsiones o con condiciones que reducen el umbral convulsivo. Las condiciones que reducen el umbral de convulsiones pueden ser más frecuentes en una población de 65 años o más.
Potencial de deterioro cognitivo y motor
ABILIFY, al igual que otros antipsicóticos, puede tener el potencial de afectar el juicio, el pensamiento o las habilidades motoras. Por ejemplo, en ensayos a corto plazo controlados con placebo, la somnolencia (incluida la sedación) se informó de la siguiente manera (incidencia de ABILIFY, incidencia de placebo): en pacientes adultos (n=2467) tratados con ABILIFY oral (11 %, 6 %), en pacientes pediátricos de 6 a 17 años (n=611) (24 %, 6 %) y en pacientes adultos (n=501) en ABILIFY Inyectable (9 %, 6 %). La somnolencia (incluida la sedación) condujo a la suspensión en el 0,3 % (8/2467) de los pacientes adultos y en el 3 % (20/732) de los pacientes pediátricos (de 6 a 18 años) que tomaban ABILIFY 10 mg por vía oral en ensayos a corto plazo controlados con placebo. pero no condujo a la suspensión de ningún paciente adulto con ABILIFY Inyectable.
A pesar del aumento relativamente modesto de la incidencia de estos eventos en comparación con el placebo, se debe advertir a los pacientes sobre el manejo de maquinaria peligrosa, incluidos los automóviles, hasta que estén razonablemente seguros de que la terapia con ABILIFY 15 mg no los afecta de manera adversa.
Regulación de la temperatura corporal
La interrupción de la capacidad del cuerpo para reducir la temperatura corporal central se ha atribuido a los agentes antipsicóticos. Se recomienda el cuidado adecuado al recetar ABILIFY 10 mg a pacientes que experimentarán condiciones que pueden contribuir a una elevación de la temperatura corporal central (p. ej., ejercicio intenso, exposición a calor extremo, tratamiento concomitante con actividad anticolinérgica o deshidratación). [ver REACCIONES ADVERSAS ].
Suicidio
La posibilidad de un intento de suicidio es inherente a las enfermedades psicóticas, el trastorno bipolar y el trastorno depresivo mayor, y la supervisión estrecha de los pacientes de alto riesgo debe acompañar al tratamiento farmacológico. Las recetas de ABILIFY deben escribirse para la cantidad más pequeña compatible con un buen manejo del paciente para reducir el riesgo de sobredosis [ver REACCIONES ADVERSAS ].
disfagia
La alteración de la motilidad esofágica y la aspiración se han asociado con el uso de fármacos antipsicóticos, incluido ABILIFY. La neumonía por aspiración es una causa común de morbilidad y mortalidad en pacientes de edad avanzada, en particular en aquellos con demencia de Alzheimer avanzada. ABILIFY y otros medicamentos antipsicóticos deben usarse con precaución en pacientes con riesgo de neumonía por aspiración [ver Aumento de la mortalidad en pacientes ancianos con psicosis relacionada con demencia y REACCIONES ADVERSAS ].
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( Guía de medicamentos ).
Discuta los siguientes temas con los pacientes a los que se les recetó ABILIFY:
Empeoramiento clínico de la depresión y riesgo de suicidio
Se debe alentar a los pacientes, sus familias y sus cuidadores a estar alerta ante la aparición de ansiedad, agitación, ataques de pánico, insomnio, irritabilidad, hostilidad, agresividad, impulsividad, acatisia (inquietud psicomotora), hipomanía, manía, otros cambios inusuales en el comportamiento. , empeoramiento de la depresión e ideación suicida, especialmente al principio del tratamiento con antidepresivos y cuando la dosis se ajusta hacia arriba o hacia abajo. Se debe recomendar a las familias y cuidadores de los pacientes que estén atentos a la aparición de dichos síntomas en el día a día, ya que los cambios pueden ser abruptos. Dichos síntomas deben informarse al prescriptor del paciente o al profesional de la salud, especialmente si son graves, de inicio repentino o no formaban parte de los síntomas de presentación del paciente. Síntomas como estos pueden estar asociados con un mayor riesgo de pensamientos y conductas suicidas e indican la necesidad de un control muy estricto y posiblemente cambios en la medicación [ver ADVERTENCIAS Y PRECAUCIONES ].
Los prescriptores u otros profesionales de la salud deben informar a los pacientes, sus familias y sus cuidadores sobre los beneficios y riesgos asociados con el tratamiento con ABILIFY y deben asesorarlos sobre su uso apropiado. Se encuentra disponible para ABILIFY una Guía del medicamento para el paciente que incluye información sobre “Medicamentos antidepresivos, depresión y otras enfermedades mentales graves y pensamientos o acciones suicidas”. El prescriptor o el profesional de la salud debe instruir a los pacientes, sus familias y sus cuidadores para que lean la Guía del medicamento y debe ayudarlos a comprender su contenido. Los pacientes deben tener la oportunidad de discutir el contenido de la Guía del medicamento y obtener respuestas a cualquier pregunta que puedan tener. Cabe señalar que ABILIFY no está aprobado como agente único para el tratamiento de la depresión y no se ha evaluado en el trastorno depresivo mayor pediátrico.
Juego patológico y otras conductas compulsivas
Advierta a los pacientes y a sus cuidadores sobre la posibilidad de que experimenten impulsos compulsivos de comprar, impulsos intensos de apostar, impulsos sexuales compulsivos, atracones de comida y/u otros impulsos compulsivos y la incapacidad de controlar estos impulsos mientras toman aripiprazol. En algunos casos, pero no en todos, se informó que las ansias cesaron cuando se redujo o suspendió la dosis [ver ADVERTENCIAS Y PRECAUCIONES ].
Uso de tabletas de desintegración oral
No abra el blister hasta que esté listo para administrar. Para retirar una sola tableta, abra el paquete y retire la lámina del blíster para exponer la tableta. No empuje la tableta a través de la lámina porque esto podría dañar la tableta. Inmediatamente después de abrir el blíster, con las manos secas, retire la tableta y coloque toda la tableta de desintegración oral ABILIFY DISCMELT en la lengua. La desintegración de la tableta ocurre rápidamente en la saliva. Se recomienda tomar ABILIFY DISCMELT sin líquido. Sin embargo, si es necesario, se puede tomar con líquido. No intente dividir la tableta.
Interferencia con el rendimiento cognitivo y motor
Debido a que ABILIFY puede tener el potencial de afectar el juicio, el pensamiento o las habilidades motoras, se debe advertir a los pacientes sobre el manejo de maquinaria peligrosa, incluidos los automóviles, hasta que estén razonablemente seguros de que la terapia con ABILIFY no los afecta de manera adversa [ver ADVERTENCIAS Y PRECAUCIONES ].
Medicación concomitante
Se debe recomendar a los pacientes que informen a sus médicos si están tomando, o planean tomar, cualquier medicamento recetado o de venta libre, ya que existe la posibilidad de interacciones [ver INTERACCIONES CON LA DROGAS ].
Exposición al calor y deshidratación
Se debe advertir a los pacientes sobre el cuidado apropiado para evitar el sobrecalentamiento y la deshidratación [ver ADVERTENCIAS Y PRECAUCIONES ].
Contenido de azúcar
Se debe informar a los pacientes que cada ml de solución oral de 10 mg de ABILIFY contiene 400 mg de sacarosa y 200 mg de fructosa.
El embarazo
Aconseje a las pacientes que notifiquen a su proveedor de atención médica si quedan embarazadas o tienen la intención de quedar embarazadas durante el tratamiento con ABILIFY. Advierta a los pacientes que ABILIFY 20 mg puede causar síntomas extrapiramidales y/o de abstinencia (agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria y trastorno de la alimentación) en un recién nacido. Informe a los pacientes que existe un registro de embarazos que monitorea los resultados del embarazo en mujeres expuestas a ABILIFY 15 mg durante el embarazo [ver Uso en poblaciones específicas ].
fenilcetonúricos
La fenilalanina es un componente del aspartamo. Cada tableta de desintegración oral ABILIFY DISCMELT contiene las siguientes cantidades: 10 mg, 1,12 mg de fenilalanina y 15 mg, 1,68 mg de fenilalanina.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Carcinogénesis
Se realizaron estudios de carcinogenicidad de por vida en ratones ICR, ratas F344 y ratas Sprague-Dawley (SD). Se administró aripiprazol durante 2 años en la dieta a dosis de 1, 3, 10 y 30 mg/kg/día a ratones ICR y 1, 3 y 10 mg/kg/día a ratas F344 (0,2, 0,5, 2 y 5 veces y 0,3, 1 y 3 veces la MRHD de 30 mg/día según mg/m² de superficie corporal, respectivamente). Además, las ratas SD recibieron dosis orales durante 2 años de 10, 20, 40 y 60 mg/kg/día, que son 3, 6, 13 y 19 veces la MRHD en base a mg/m² de superficie corporal. Aripiprazol no indujo tumores en ratones machos ni en ratas machos. En ratones hembra, las incidencias de adenomas de la glándula pituitaria y adenocarcinomas y adenoacantomas de la glándula mamaria aumentaron con dosis dietéticas de 3 a 30 mg/kg/día (0,5 a 5 veces la MRHD). En ratas hembra, la incidencia de fibroadenomas de las glándulas mamarias aumentó con una dosis dietética de 10 mg/kg/día (3 veces la MRHD); y las incidencias de carcinomas adrenocorticales y adenomas/carcinomas adrenocorticales combinados aumentaron con una dosis oral de 60 mg/kg/día (19 veces la MRHD).
Se ha encontrado un aumento de neoplasias mamarias, hipofisarias y pancreáticas endocrinas en roedores después de la administración crónica de otros fármacos antipsicóticos y se considera que está mediado por el antagonismo prolongado del receptor D2 de la dopamina y la hiperprolactinemia. La prolactina sérica no se midió en los estudios de carcinogenicidad de aripiprazol. Sin embargo, se observaron aumentos en los niveles de prolactina sérica en ratones hembra en un estudio dietético de 13 semanas a las dosis asociadas con tumores de glándula mamaria y pituitaria. La prolactina sérica no aumentó en ratas hembra en estudios dietéticos de 4 y 13 semanas a la dosis asociada con tumores de las glándulas mamarias. La relevancia para el riesgo humano de los hallazgos de tumores endocrinos mediados por prolactina en roedores no está clara.
mutagénesis
El potencial mutagénico de aripiprazol se probó en el ensayo de mutación inversa bacteriana in vitro, el ensayo de reparación de ADN bacteriano in vitro, el ensayo de mutación genética directa in vitro en células de linfoma de ratón, el ensayo de aberración cromosómica in vitro en pulmón de hámster chino (CHL) células, el ensayo de micronúcleo in vivo en ratones y el ensayo de síntesis de ADN no programada en ratas. El aripiprazol y un metabolito (2,3-DCPP) fueron clastogénicos en el ensayo de aberración cromosómica in vitro en células CHL con y sin activación metabólica. El metabolito, 2,3DCPP, aumentó las aberraciones numéricas en el ensayo in vitro en células CHL en ausencia de activación metabólica. Se obtuvo una respuesta positiva en el ensayo de micronúcleos in vivo en ratones; sin embargo, la respuesta se debió a un mecanismo que no se consideró relevante para los humanos.
Deterioro de la fertilidad
Se trató a ratas hembra por vía oral con aripiprazol desde 2 semanas antes del apareamiento hasta el día 7 de gestación en dosis de 2, 6 y 20 mg/kg/día, que son 0,6, 2 y 6 veces la MRHD de 30 mg/día en base a mg/m² de superficie corporal. Se observaron irregularidades en el ciclo estral y aumento de los cuerpos lúteos en todas las dosis, pero no se observó deterioro de la fertilidad. Se observó un aumento de la pérdida previa a la implantación a 2 y 6 veces la MRHD, y se observó una disminución del peso fetal a 6 veces la MRHD.
Se trató a ratas macho por vía oral con aripiprazol desde 9 semanas antes del apareamiento hasta el apareamiento en dosis de 20, 40 y 60 mg/kg/día, que son 6, 13 y 19 veces la MRHD de 30 mg/día en base a mg/día. m² de superficie corporal. Se observaron alteraciones en la espermatogénesis a 19 veces la MRHD y se observó atrofia de próstata a 13 y 19 veces la MRHD sin deterioro de la fertilidad.
Uso en poblaciones específicas
El embarazo
Registro de exposición durante el embarazo
Existe un registro de exposición durante el embarazo que monitorea los resultados del embarazo en mujeres expuestas a antipsicóticos atípicos, incluido ABILIFY, durante el embarazo. Se alienta a los proveedores de atención médica a registrar a los pacientes comunicándose con el Registro Nacional de Embarazo para Antipsicóticos Atípicos al 1-866-961-2388 o visitando http://womensmentalhealth.org/clinical-and-researchprograms/pregnancyregistry/.
Resumen de riesgos
Los recién nacidos expuestos a fármacos antipsicóticos, incluido ABILIFY 20 mg, durante el tercer trimestre del embarazo corren el riesgo de presentar síntomas extrapiramidales y/o de abstinencia después del parto (ver Consideraciones clínicas ). Los datos generales disponibles de estudios epidemiológicos publicados de mujeres embarazadas expuestas a aripiprazol no han establecido un riesgo asociado con el fármaco de defectos congénitos importantes, aborto espontáneo o resultados maternos o fetales adversos (ver Datos ). Existen riesgos para la madre asociados con la esquizofrenia, el trastorno bipolar I o el trastorno depresivo mayor no tratados, y con la exposición a antipsicóticos, incluido ABILIFY, durante el embarazo (ver Consideraciones clínicas ).
En estudios de reproducción en animales, la administración oral e intravenosa de aripiprazol durante la organogénesis en ratas y/o conejos en dosis 10 y 19 veces, respectivamente, la dosis máxima recomendada en humanos (DMRH) de 30 mg/día en base a mg/m² de superficie corporal, produjo muerte fetal, disminución del peso fetal, testículos no descendidos, osificación esquelética retardada, anomalías esqueléticas y hernia diafragmática. La administración oral e intravenosa de aripiprazol durante el período prenatal y posnatal en ratas en dosis 10 veces superiores a la MRHD según mg/m² de superficie corporal, produjo gestación prolongada, mortinatos, disminución del peso de las crías y disminución de la supervivencia de las crías (ver Datos ).
Se desconoce el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo para la población indicada. Todos los embarazos tienen un riesgo de fondo de defecto congénito, pérdida u otros resultados adversos. En la población general de EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 al 4 % y del 15 al 20 %, respectivamente.
Consideraciones clínicas
Riesgo materno y/o embrionario/fetal asociado a la enfermedad
Existe un riesgo para la madre debido a la esquizofrenia o al trastorno bipolar I no tratados, incluido un mayor riesgo de recaída, hospitalización y suicidio. La esquizofrenia y el trastorno bipolar I se asocian con mayores resultados perinatales adversos, incluido el parto prematuro. No se sabe si esto es un resultado directo de la enfermedad o de otros factores comórbidos.
Un estudio longitudinal prospectivo siguió a 201 mujeres embarazadas con antecedentes de trastorno depresivo mayor que eran eutímicas y tomaban antidepresivos al comienzo del embarazo. Las mujeres que suspendieron los antidepresivos durante el embarazo tenían más probabilidades de experimentar una recaída de depresión mayor que las mujeres que continuaron con los antidepresivos. Considere el riesgo de depresión no tratada al suspender o cambiar el tratamiento con medicamentos antidepresivos durante el embarazo y el posparto.
Reacciones adversas fetales/neonatales
Se han informado síntomas extrapiramidales y/o de abstinencia, que incluyen agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria y trastornos de la alimentación en recién nacidos que estuvieron expuestos a medicamentos antipsicóticos (incluido ABILIFY) durante el tercer trimestre del embarazo. Estos síntomas han variado en severidad. Supervise a los recién nacidos para detectar síntomas extrapiramidales y/o de abstinencia, y maneje los síntomas adecuadamente. Algunos neonatos se recuperaron en horas o días sin tratamiento específico; otros requirieron hospitalización prolongada.
Datos
Datos humanos
Los datos publicados de estudios observacionales, registros de nacimiento e informes de casos sobre el uso de antipsicóticos atípicos durante el embarazo no informan una asociación clara con los antipsicóticos y defectos congénitos importantes. Un estudio retrospectivo de una base de datos de Medicaid de 9258 mujeres expuestas a antipsicóticos durante el embarazo no indicó un mayor riesgo general de defectos congénitos importantes.
Datos de animales
En estudios con animales, el aripiprazol demostró toxicidad en el desarrollo, incluidos posibles efectos teratogénicos en ratas y conejos.
En ratas preñadas tratadas por vía oral con aripiprazol durante la organogénesis en dosis de 3, 10 y 30 mg/kg/día, que son aproximadamente 1, 3 y 10 veces la MRHD de 30 mg/día en base a mg/m² de superficie corporal, una Se observó una ligera prolongación de la gestación y un retraso en el desarrollo fetal, como lo demuestra la disminución del peso fetal y testículos no descendidos, a 10 veces la MRHD. Se observó osificación esquelética retardada a 3 y 10 veces la MRHD. Las crías nacidas tuvieron una mayor incidencia de nódulos hepatodiafragmáticos y se observaron hernias diafragmáticas a 10 veces la MRHD (los otros grupos de dosis no se examinaron para detectar estos hallazgos). Después del nacimiento, se observó un retraso en la apertura vaginal a 3 y 10 veces la MRHD. Se observaron deficiencias en el rendimiento reproductivo (tasa de fertilidad reducida, cuerpos lúteos, implantes, fetos vivos y mayor pérdida posterior a la implantación, probablemente mediada por efectos en las crías femeninas) con 10 veces la MRHD; sin embargo, no hubo evidencia que sugiriera que estos efectos en el desarrollo fueran secundarios a la toxicidad materna.
En ratas preñadas inyectadas por vía intravenosa con aripiprazol durante la organogénesis en dosis de 3, 9 y 27 mg/kg/día, que son 1, 3 y 9 veces la MRHD de 30 mg/día en base a mg/m² de superficie corporal, disminución se observaron peso fetal y osificación esquelética retrasada a 9 veces la MRHD; esta dosis también causó toxicidad materna.
En conejas preñadas tratadas por vía oral con aripiprazol durante la organogénesis en dosis de 10, 30 y 100 mg/kg/día que son 6, 19 y 65 veces la MRHD de 30 mg/día según mg/m² de superficie corporal, la disminución de la el consumo de alimentos y el aumento de los abortos, así como el aumento de la mortalidad fetal se observaron en 65 veces la MHRD. Se observó una disminución del peso fetal y una mayor incidencia de esternebras fusionadas a 19 y 65 veces la MRHD.
En conejas preñadas inyectadas por vía intravenosa con aripiprazol durante la organogénesis en dosis de 3, 10 y 30 mg/kg/día, que son 2, 6 y 19 veces la MRHD de 30 mg/día en base a mg/m² de área de superficie corporal, disminuyó se observaron peso fetal, aumento de anomalías fetales (principalmente esqueléticas) y disminución de la osificación esquelética fetal a 19 veces la MRHD; esta dosis también causó toxicidad materna. La dosis fetal sin efecto fue de 10 mg/kg/día, que es 6 veces la MRHD.
En ratas tratadas por vía oral con aripiprazol perinatal y posnatal desde el día 17 de gestación hasta el día 21 posparto en dosis de 3, 10 y 30 mg/kg/día que son 1, 3 y 10 veces la MRHD de 30 mg/día basado en mg/m² de área de superficie corporal, se observó una ligera toxicidad materna y una gestación ligeramente prolongada a 10 veces la MHRD. Con esta dosis también se observó un aumento de mortinatos y disminuciones en el peso de las crías (persistentes hasta la edad adulta) y la supervivencia.
En ratas inyectadas por vía intravenosa con aripiprazol desde el día 6 de gestación hasta el día 20 de lactancia en dosis de 3, 8 y 20 mg/kg/día, que son 1, 3 y 6 veces la MRHD de 30 mg/día en base a mg/m² área de superficie corporal, se observaron más mortinatos a 3 y 6 veces la MRHD; y se observaron disminuciones en el peso posnatal temprano de las crías y en la supervivencia a 6 veces la MRHD; estas dosis también causaron cierta toxicidad materna. No hubo efectos sobre el desarrollo conductual y reproductivo posnatal.
Lactancia
Resumen de riesgos
Los datos limitados de la literatura publicada informan la presencia de aripiprazol en la leche materna humana, en dosis infantiles relativas que oscilan entre el 0,7 % y el 8,3 % de la dosis materna ajustada al peso. Hay informes de poco aumento de peso en bebés amamantados expuestos a aripiprazol e informes de suministro inadecuado de leche en mujeres lactantes que toman aripiprazol.
Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de ABILIFY de la madre y cualquier efecto adverso potencial en el lactante a causa de ABILIFY o de la afección materna subyacente.
Uso pediátrico
No se ha establecido la seguridad y eficacia en pacientes pediátricos con trastorno depresivo mayor o agitación asociada con esquizofrenia o manía bipolar.
La farmacocinética de aripiprazol y dehidro-aripiprazol en pacientes pediátricos, de 10 a 17 años de edad, fue similar a la de los adultos después de corregir las diferencias en el peso corporal [ver FARMACOLOGÍA CLÍNICA ].
Esquizofrenia
La seguridad y la eficacia en pacientes pediátricos con esquizofrenia se establecieron en un ensayo clínico controlado con placebo de 6 semanas en 202 pacientes pediátricos de 13 a 17 años [ver DOSIFICACIÓN Y ADMINISTRACIÓN , REACCIONES ADVERSAS , y Estudios clínicos ]. Aunque la eficacia de mantenimiento en pacientes pediátricos no se ha evaluado sistemáticamente, la eficacia de mantenimiento se puede extrapolar a partir de datos de adultos junto con comparaciones de parámetros farmacocinéticos de aripiprazol en pacientes adultos y pediátricos.
Trastorno bipolar I
La seguridad y la eficacia en pacientes pediátricos con manía bipolar se establecieron en un ensayo clínico controlado con placebo de 4 semanas en 197 pacientes pediátricos de 10 a 17 años [ver DOSIFICACIÓN Y ADMINISTRACIÓN , REACCIONES ADVERSAS , y Estudios clínicos ]. Aunque la eficacia de mantenimiento en pacientes pediátricos no se ha evaluado sistemáticamente, la eficacia de mantenimiento se puede extrapolar a partir de datos de adultos junto con comparaciones de parámetros farmacocinéticos de aripiprazol en pacientes adultos y pediátricos.
No se ha evaluado sistemáticamente la eficacia de ABILIFY 10 mg adyuvante con litio o valproato concomitantes en el tratamiento de episodios maníacos o mixtos en pacientes pediátricos. Sin embargo, dicha eficacia y la falta de interacción farmacocinética entre aripiprazol y litio o valproato pueden extrapolarse a partir de datos de adultos, junto con comparaciones de parámetros farmacocinéticos de aripiprazol en pacientes adultos y pediátricos.
Irritabilidad asociada con el trastorno autista
La seguridad y la eficacia en pacientes pediátricos que demostraron irritabilidad asociada con el trastorno autista se establecieron en dos ensayos clínicos controlados con placebo de 8 semanas en 212 pacientes pediátricos de 6 a 17 años [ver INDICACIONES Y USO , DOSIFICACIÓN Y ADMINISTRACIÓN , REACCIONES ADVERSAS , y Estudios clínicos ]. Se realizó un ensayo de mantenimiento en pacientes pediátricos (6 a 17 años de edad) con irritabilidad asociada con el trastorno autista. La primera fase de este ensayo fue una fase abierta, con dosificación flexible (aripiprazol de 2 a 15 mg/día) en la que los pacientes se estabilizaron (definida como una mejoría > 25 % en la subescala ABC-I y una calificación CGI-I de “mejoró mucho” o “mejoró mucho”) en ABILIFY durante 12 semanas consecutivas. En general, 85 pacientes se estabilizaron y entraron en la segunda fase doble ciego de 16 semanas en la que se aleatorizaron para continuar el tratamiento con ABILIFY o cambiar a placebo. En este ensayo, no se estableció la eficacia de ABILIFY para el tratamiento de mantenimiento de la irritabilidad asociada con el trastorno autista.
Trastorno de Tourette
La seguridad y la eficacia de aripiprazol en pacientes pediátricos con trastorno de Tourette se establecieron en un ensayo de 8 semanas (de 7 a 17 años) y uno de 10 semanas (de 6 a 18 años) en 194 pacientes pediátricos [ver DOSIFICACIÓN Y ADMINISTRACIÓN , REACCIONES ADVERSAS , y Estudios clínicos ]. No se ha evaluado sistemáticamente la eficacia de mantenimiento en pacientes pediátricos.
Estudios de animales juveniles
El aripiprazol en ratas jóvenes causó mortalidad, signos clínicos en el SNC, deterioro de la memoria y el aprendizaje y retraso en la maduración sexual cuando se administró en dosis orales de 10, 20, 40 mg/kg/día desde el destete (21 días de edad) hasta la madurez (80 días de edad) . A 40 mg/kg/día, se observaron mortalidad, disminución de la actividad, extremidades traseras extendidas, postura encorvada, ataxia, temblores y otros signos del SNC en ambos sexos. Además, se observó un retraso en la maduración sexual en los machos. En todas las dosis y de manera dependiente de la dosis, alteración de la memoria y el aprendizaje, aumento de la actividad motora y cambios histopatológicos en la hipófisis (atrofia), las glándulas suprarrenales (hipertrofia corticosuprarrenal), las glándulas mamarias (hiperplasia y aumento de la secreción) y los órganos reproductores femeninos ( mucificación vaginal, atrofia endometrial, disminución de los cuerpos lúteos ováricos). Los cambios en los órganos reproductores femeninos se consideraron secundarios al aumento de los niveles séricos de prolactina. No se pudo determinar un nivel sin efecto adverso observado (NOAEL) y, a la dosis más baja probada de 10 mg/kg/día, no hay margen de seguridad en relación con las exposiciones sistémicas (AUC0-24) para aripiprazol o su principal metabolito activo en adolescentes a la dosis pediátrica máxima recomendada de 15 mg/día. Todos los efectos relacionados con el fármaco fueron reversibles después de un período de recuperación de 2 meses, y la mayoría de los efectos del fármaco en ratas jóvenes también se observaron en ratas adultas de estudios realizados anteriormente.
Aripiprazol en perros jóvenes (2 meses de edad) causó signos clínicos en el SNC de temblores, hipoactividad, ataxia, decúbito y uso limitado de las patas traseras cuando se administró por vía oral durante 6 meses a 3, 10, 30 mg/kg/día. El peso corporal medio y la ganancia de peso se redujeron hasta en un 18 % en las mujeres en todos los grupos de fármacos en relación con los valores de control. No se pudo determinar un NOAEL y, a la dosis más baja probada de 3 mg/kg/día, no hay margen de seguridad en relación con las exposiciones sistémicas (AUC0-24) para aripiprazol o su principal metabolito activo en adolescentes con la dosis pediátrica máxima recomendada. dosis de 15 mg/día. Todos los efectos relacionados con el fármaco fueron reversibles después de un período de recuperación de 2 meses.
Uso geriátrico
No se recomienda ajustar la dosis en pacientes de edad avanzada [ver ADVERTENCIA EN CAJA , ADVERTENCIAS Y PRECAUCIONES , y FARMACOLOGÍA CLÍNICA ].
De los 13 543 pacientes tratados con ABILIFY 15 mg por vía oral en los ensayos clínicos, 1073 (8 %) tenían ≥65 años y 799 (6 %) tenían ≥75 años. Los estudios controlados con placebo de ABILIFY 10 mg por vía oral en la esquizofrenia, la manía bipolar o el trastorno depresivo mayor no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes.
De los 749 pacientes tratados con ABILIFY inyectable en ensayos clínicos, 99 (13 %) tenían ≥65 años y 78 (10 %) tenían ≥75 años. Los estudios controlados con placebo de la inyección de ABILIFY en pacientes con agitación asociada con la esquizofrenia o la manía bipolar no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes.
ABILIFY 15 mg no está aprobado para el tratamiento de pacientes con psicosis asociada con la enfermedad de Alzheimer [ver ADVERTENCIA EN CAJA y ADVERTENCIAS Y PRECAUCIONES ].
Metabolizadores deficientes CYP2D6
Se recomienda ajustar la dosis en metabolizadores lentos conocidos de CYP2D6 debido a las altas concentraciones de aripiprazol. Aproximadamente el 8 % de los caucásicos y el 3-8 % de los negros/afroamericanos no pueden metabolizar los sustratos de CYP2D6 y se clasifican como metabolizadores lentos (PM) [ver DOSIFICACIÓN Y ADMINISTRACIÓN y FARMACOLOGÍA CLÍNICA ].
Insuficiencia hepática y renal
No es necesario ajustar la dosis de ABILIFY en función de la función hepática del paciente (insuficiencia hepática leve a grave, puntuación de Child-Pugh entre 5 y 15), o la función renal (insuficiencia renal leve a grave, tasa de filtración glomerular entre 15 y 90 mL/minuto) [ver FARMACOLOGÍA CLÍNICA ].
Otras poblaciones específicas
No es necesario ajustar la dosis de ABILIFY en función del sexo, la raza o el tabaquismo del paciente [ver FARMACOLOGÍA CLÍNICA ].
SOBREDOSIS
Se ha utilizado la terminología de MedDRA para clasificar las reacciones adversas.
Experiencia humana
En ensayos clínicos y en la experiencia posterior a la comercialización, se informaron reacciones adversas de sobredosis deliberada o accidental con ABILIFY oral en todo el mundo. Estos incluyen sobredosis con ABILIFY 20 mg por vía oral solo y en combinación con otras sustancias. No se informó ninguna fatalidad con ABILIFY solo. La dosis más grande conocida con un resultado conocido involucró la ingestión aguda de 1260 mg de ABILIFY oral (42 veces la dosis diaria máxima recomendada) por parte de un paciente que se recuperó por completo. También se informó sobredosis deliberada o accidental en niños (menores de 12 años) que involucraron ingestiones orales de ABILIFY 10 mg de hasta 195 mg sin muertes.
Las reacciones adversas comunes (notificadas en al menos el 5 % de todos los casos de sobredosis) notificadas con la sobredosis oral de ABILIFY (solo o en combinación con otras sustancias) incluyen vómitos, somnolencia y temblor. Otros signos y síntomas clínicamente importantes observados en uno o más pacientes con sobredosis de ABILIFY (solo o con otras sustancias) incluyen acidosis, agresividad, aumento de la aspartato aminotransferasa, fibrilación auricular, bradicardia, coma, estado de confusión, convulsiones, aumento de la creatina fosfocinasa en sangre, nivel reducido de conciencia, hipertensión, hipopotasemia, hipotensión, letargo, pérdida de conciencia, prolongación del complejo QRS, prolongación del intervalo QT, neumonía por aspiración, paro respiratorio, estado epiléptico y taquicardia.
Manejo de sobredosis
No hay información específica disponible sobre el tratamiento de la sobredosis con ABILIFY. Se debe obtener un electrocardiograma en caso de sobredosis y si se presenta prolongación del intervalo QT, se debe instituir un monitoreo cardíaco. De lo contrario, el manejo de la sobredosis debe concentrarse en la terapia de apoyo, manteniendo una vía aérea adecuada, oxigenación y ventilación, y el manejo de los síntomas. La supervisión y el control médico estrictos deben continuar hasta que el paciente se recupere.
Carbón
En caso de sobredosis de ABILIFY 10 mg, la administración temprana de carbón puede ser útil para prevenir parcialmente la absorción de aripiprazol. La administración de 50 g de carbón activado, una hora después de una dosis oral única de 15 mg de ABILIFY, disminuyó el AUC medio y la Cmax de aripiprazol en un 50 %.
Hemodiálisis
Aunque no hay información sobre el efecto de la hemodiálisis en el tratamiento de una sobredosis de ABILIFY, es poco probable que la hemodiálisis sea útil en el tratamiento de la sobredosis, ya que el aripiprazol se une en gran medida a las proteínas plasmáticas.
CONTRAINDICACIONES
ABILIFY 15 mg está contraindicado en pacientes con antecedentes de reacción de hipersensibilidad al aripiprazol. Las reacciones han variado desde prurito/urticaria hasta anafilaxia [ver REACCIONES ADVERSAS ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
El mecanismo de acción del aripiprazol en la esquizofrenia o la manía bipolar no está claro. Sin embargo, la eficacia de aripiprazol en las indicaciones enumeradas podría estar mediada por una combinación de actividad agonista parcial en los receptores D2 y 5-HT1A y actividad antagonista en los receptores 5-HT2A.
Farmacodinámica
El aripiprazol muestra una alta afinidad por los receptores de dopamina D2 y D3, serotonina 5-HT1A y 5-HT2A (valores de Ki de 0,34 nM, 0,8 nM, 1,7 nM y 3,4 nM, respectivamente), afinidad moderada por los receptores de dopamina D4, serotonina 5-HT2C y Receptores 5-HT7, alfa1-adrenérgicos e histamina H1 (valores de Ki de 44 nM, 15 nM, 39 nM, 57 nM y 61 nM, respectivamente) y moderada afinidad por el sitio de recaptación de serotonina (Ki = 98 nM). El aripiprazol no tiene una afinidad apreciable por los receptores muscarínicos colinérgicos (IC50>1000 nM).
Farmacocinética
Se supone que la actividad de ABILIFY se debe principalmente al fármaco original, el aripiprazol, y en menor medida, a su principal metabolito, el deshidroaripiprazol, que ha demostrado tener afinidades por los receptores D2 similares a las del fármaco original y representa el 40 % de la actividad original. exposición al fármaco en plasma. Las semividas de eliminación medias son de unas 75 horas y 94 horas para el aripiprazol y el deshidroaripiprazol, respectivamente. Las concentraciones en estado estacionario se alcanzan dentro de los 14 días posteriores a la dosificación de ambas fracciones activas. La acumulación de aripiprazol es predecible a partir de la farmacocinética de dosis única. En estado estacionario, la farmacocinética de aripiprazol es proporcional a la dosis. La eliminación de aripiprazol se realiza principalmente a través del metabolismo hepático que involucra dos isoenzimas P450, CYP2D6 y CYP3A4. Para los metabolizadores lentos de CYP2D6, la vida media de eliminación promedio para aripiprazol es de aproximadamente 146 horas.
Los estudios farmacocinéticos demostraron que ABILIFY 10 mg DISCMELT Tabletas de desintegración oral son bioequivalentes a ABILIFY 15 mg Tabletas.
Administracion oral
Absorción
Tableta: el aripiprazol se absorbe bien después de la administración de la tableta, con concentraciones plasmáticas máximas que ocurren dentro de las 3 a 5 horas; la biodisponibilidad oral absoluta de la formulación en comprimidos es del 87 %. ABILIFY 10 mg puede administrarse con o sin alimentos. La administración de una tableta de ABILIFY de 15 mg con una comida estándar rica en grasas no afectó significativamente la Cmax o el AUC de aripiprazol o su metabolito activo, dehidro-aripiprazol, pero retrasó el Tmax en 3 horas para aripiprazol y 12 horas para dehidro-aripiprazol.
Solución oral: el aripiprazol se absorbe bien cuando se administra por vía oral como solución. A dosis equivalentes, las concentraciones plasmáticas de aripiprazol de la solución fueron más altas que las de la formulación en comprimidos. En un estudio de biodisponibilidad relativa que comparó la farmacocinética de 30 mg de aripiprazol como solución oral con tabletas de 30 mg de aripiprazol en sujetos sanos, las proporciones de solución a tableta de la media geométrica de los valores de Cmax y AUC fueron 122 % y 114 %, respectivamente [ver DOSIFICACIÓN Y ADMINISTRACIÓN ]. La farmacocinética de dosis única de aripiprazol fue lineal y proporcional a la dosis entre las dosis de 5 mg a 30 mg.
Distribución
El volumen de distribución en estado estacionario de aripiprazol después de la administración intravenosa es alto (404 l o 4,9 l/kg), lo que indica una amplia distribución extravascular. A concentraciones terapéuticas, el aripiprazol y su principal metabolito se unen en más del 99 % a las proteínas séricas, principalmente a la albúmina. En voluntarios humanos sanos a los que se les administró de 0,5 a 30 mg/día de aripiprazol durante 14 días, hubo una ocupación del receptor D2 dependiente de la dosis, lo que indica penetración cerebral de aripiprazol en humanos.
Metabolismo y eliminación
El aripiprazol se metaboliza principalmente por tres vías de biotransformación: deshidrogenación, hidroxilación y N-desalquilación. Según estudios in vitro, las enzimas CYP3A4 y CYP2D6 son responsables de la deshidrogenación e hidroxilación del aripiprazol, y la N-desalquilación es catalizada por CYP3A4. El aripiprazol es la fracción farmacológica predominante en la circulación sistémica. En el estado estacionario, el dehidro-aripiprazol, el metabolito activo, representa alrededor del 40 % del AUC de aripiprazol en plasma.
Después de una dosis oral única de aripiprazol marcado con [14C], aproximadamente el 25 % y el 55 % de la radiactividad administrada se recuperó en la orina y las heces, respectivamente. Menos del 1 % del aripiprazol inalterado se excretó en la orina y aproximadamente el 18 % de la dosis oral se recuperó sin cambios en las heces.
Estudios de interacción farmacológica
Los efectos de otras drogas sobre las exposiciones de aripiprazol y dehidro-aripiprazol se resumen en la Figura 1 y la Figura 2, respectivamente. Según la simulación, se espera un aumento de 4,5 veces en los valores medios de Cmax y AUC en el estado estacionario cuando se administran metabolizadores rápidos de CYP2D6 con inhibidores potentes de CYP2D6 y CYP3A4. Se espera un aumento de 3 veces en los valores medios de Cmax y AUC en estado estacionario en metabolizadores lentos de CYP2D6 administrados con inhibidores potentes de CYP3A4.
Figura 1: Los efectos de otras drogas en la farmacocinética de aripiprazol 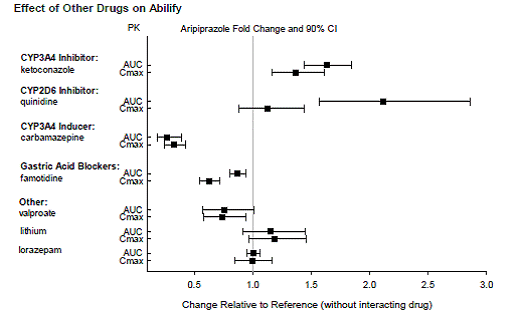
Figura 2: Los efectos de otras drogas en la farmacocinética de dehidro-aripiprazol 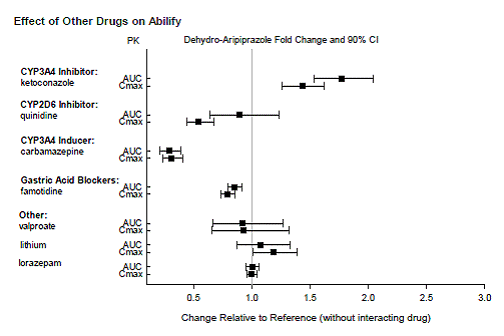
Los efectos de ABILIFY 15 mg sobre la exposición de otros fármacos se resumen en la Figura 3. Un análisis farmacocinético poblacional en pacientes con trastorno depresivo mayor no mostró cambios sustanciales en las concentraciones plasmáticas de fluoxetina (20 o 40 mg/día), paroxetina CR (37,5 o 50 mg/día), o sertralina (100 o 150 mg/día) dosificados hasta el estado estacionario. Las concentraciones plasmáticas en estado estacionario de fluoxetina y norfluoxetina aumentaron aproximadamente un 18 % y un 36 %, respectivamente, y las concentraciones de paroxetina disminuyeron aproximadamente un 27 %. Las concentraciones plasmáticas en estado estacionario de sertralina y desmetilsertralina no cambiaron sustancialmente cuando estas terapias antidepresivas se administraron junto con aripiprazol.
Figura 3: Los efectos de ABILIFY 15 mg en la farmacocinética de otras drogas 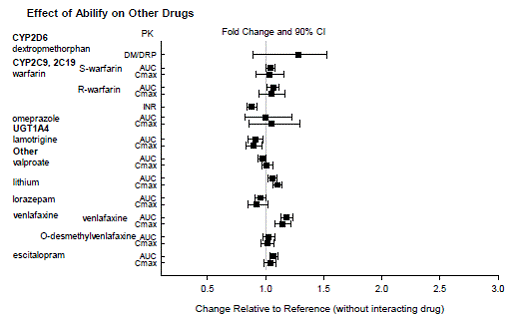
Estudios en Poblaciones Específicas
Las exposiciones de aripiprazol y dehidro-aripiprazol en poblaciones específicas se resumen en la Figura 4 y la Figura 5, respectivamente. Además, en pacientes pediátricos (de 10 a 17 años de edad) que recibieron ABILIFY (20 mg a 30 mg), el aclaramiento de aripiprazol corregido por peso corporal fue similar al de los adultos.
Figura 4: Efectos de los factores intrínsecos en la farmacocinética de aripiprazol 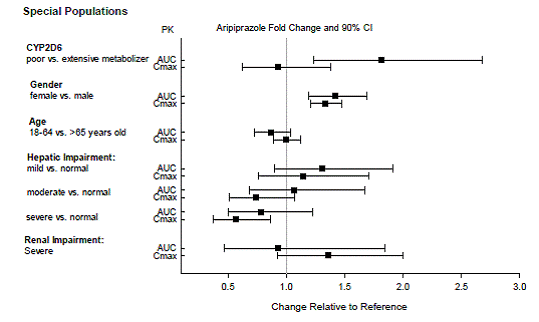
Figura 5: Efectos de los factores intrínsecos en la farmacocinética del dehidro-aripiprazol 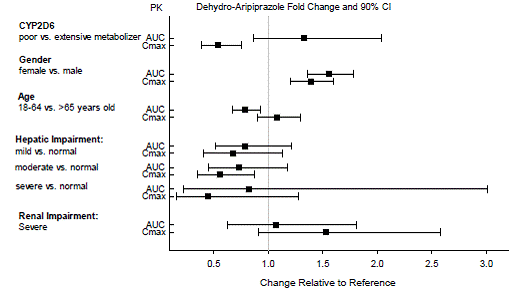
Administración Intramuscular
En dos estudios farmacocinéticos de inyección de aripiprazol administrado por vía intramuscular a sujetos sanos, la mediana de los tiempos hasta las concentraciones plasmáticas máximas fue de 1 hora y 3 horas. Una inyección intramuscular de 5 mg de aripiprazol tuvo una biodisponibilidad absoluta del 100 %. La concentración máxima media geométrica alcanzada después de una dosis intramuscular fue en promedio un 19 % más alta que la Cmax de la tableta oral. Si bien la exposición sistémica durante 24 horas fue generalmente similar entre la inyección de aripiprazol administrada por vía intramuscular y después de la administración de tabletas orales, el AUC de aripiprazol en las primeras 2 horas después de una inyección intramuscular fue un 90 % mayor que el AUC después de la misma dosis como tableta. En pacientes estables con esquizofrenia o trastorno esquizoafectivo, la farmacocinética de aripiprazol después de la administración intramuscular fue lineal en un rango de dosis de 1 mg a 45 mg. Aunque no se evaluó sistemáticamente el metabolismo de la inyección de aripiprazol, no se espera que la vía de administración intramuscular altere las vías metabólicas.
Toxicología Animal Y/o Farmacología
Aripiprazol produjo degeneración retiniana en ratas albinas en un estudio de toxicidad crónica de 26 semanas a una dosis de 60 mg/kg/día y en un estudio de carcinogenicidad de 2 años a dosis de 40 y 60 mg/kg/día que son 13 y 19 veces la MRHD de 30 mg/día basada en mg/m² de superficie corporal. La evaluación de las retinas de ratones albinos y de monos no reveló evidencia de degeneración retinal. No se han realizado estudios adicionales para evaluar más a fondo el mecanismo. Se desconoce la relevancia de este hallazgo para el riesgo humano.
Estudios clínicos
La eficacia de las formulaciones orales de ABILIFY (aripiprazol) se estableció en los siguientes ensayos adecuados y bien controlados:
- Cuatro ensayos a corto plazo y un ensayo de mantenimiento en pacientes adultos y un ensayo a corto plazo en adolescentes (de 13 a 17 años) con esquizofrenia [ver Estudios clínicos ]
- Cuatro ensayos de monoterapia a corto plazo y un ensayo adyuvante de 6 semanas en pacientes adultos y un ensayo de monoterapia a corto plazo en pacientes pediátricos (de 10 a 17 años) con episodios maníacos o mixtos [ver Estudios clínicos ]
- Un ensayo de monoterapia de mantenimiento y un ensayo adyuvante de mantenimiento en pacientes adultos con trastorno bipolar I [ver Estudios clínicos ]
- Dos ensayos a corto plazo en pacientes adultos con MDD que tuvieron una respuesta inadecuada a la terapia antidepresiva durante el episodio actual [ver Estudios clínicos ]
- Dos ensayos a corto plazo en pacientes pediátricos (de 6 a 17 años) para el tratamiento de la irritabilidad asociada con el trastorno autista [ver Estudios clínicos ]
- Dos ensayos a corto plazo en pacientes pediátricos (de 6 a 18 años de edad) con trastorno de Tourette [ver Estudios clínicos ]
La eficacia de la formulación inyectable de ABILIFY (aripiprazol) se estableció en los siguientes ensayos adecuados y bien controlados:
- Tres ensayos de 24 horas en pacientes adultos agitados con esquizofrenia o episodios maníacos/mixtos de trastorno bipolar I [ver Estudios clínicos ]
Esquizofrenia
Adultos
La eficacia de ABILIFY 15 mg en el tratamiento de la esquizofrenia se evaluó en cinco ensayos controlados con placebo a corto plazo (4 semanas y 6 semanas) de pacientes hospitalizados con recaída aguda que cumplían predominantemente con los criterios del DSM-III/IV para la esquizofrenia. Cuatro de los cinco ensayos pudieron distinguir ABILIFY del placebo, pero un estudio, el más pequeño, no lo hizo. Tres de estos estudios también incluyeron un grupo de control activo que constaba de risperidona (un ensayo) o haloperidol (dos ensayos), pero no estaban diseñados para permitir una comparación de ABILIFY 20 mg y los comparadores activos.
En los cuatro ensayos positivos para ABILIFY 10 mg, se utilizaron cuatro medidas principales para evaluar los signos y síntomas psiquiátricos. La eficacia se evaluó utilizando la puntuación total en la Escala de Síndrome Positivo y Negativo (PANSS). La PANSS es una escala de 30 ítems que mide los síntomas positivos de la esquizofrenia (7 ítems), los síntomas negativos de la esquizofrenia (7 ítems) y la psicopatología general (16 ítems), cada uno calificado en una escala de 1 (ausente) a 7 (extremo) ; las puntuaciones totales de la PANSS oscilan entre 30 y 210. La evaluación de la Impresión clínica global (CGI) refleja la impresión de un observador experto, completamente familiarizado con las manifestaciones de la esquizofrenia, sobre el estado clínico general del paciente.
En un ensayo de 4 semanas (n=414) que comparó dos dosis fijas de ABILIFY (15 o 30 mg/día) con placebo, ambas dosis de ABILIFY de 10 mg fueron superiores al placebo en la puntuación total de la PANSS (Estudio 1 en la Tabla 26), Subescala positiva de PANSS y puntuación de gravedad CGI. Además, la dosis de 15 mg fue superior al placebo en la subescala negativa de PANSS.
En un ensayo de 4 semanas (n=404) que comparó dos dosis fijas de ABILIFY (20 o 30 mg/día) con placebo, ambas dosis de ABILIFY fueron superiores al placebo en la puntuación total de la PANSS (Estudio 2 en la Tabla 26), la PANSS subescala positiva, subescala negativa de PANSS y puntuación de gravedad CGI.
En un ensayo de 6 semanas (n=420) que comparó tres dosis fijas de ABILIFY (10, 15 o 20 mg/día) con placebo, las tres dosis de ABILIFY fueron superiores al placebo en la puntuación total de la PANSS (Estudio 3 en la Tabla 26), la subescala positiva de PANSS y la subescala negativa de PANSS.
En un ensayo de 6 semanas (n=367) que comparó tres dosis fijas de ABILIFY (2, 5 o 10 mg/día) con placebo, la dosis de 10 mg de ABILIFY fue superior al placebo en la puntuación total de la PANSS (Estudio 4 en Tabla 26), la medida de resultado primaria del estudio. Las dosis de 2 y 5 mg no demostraron superioridad al placebo en la medida de resultado primaria.
Por lo tanto, la eficacia de las dosis diarias de 10, 15, 20 y 30 mg se estableció en dos estudios para cada dosis. Entre estas dosis, no hubo evidencia de que los grupos de dosis más altas ofrecieran alguna ventaja sobre el grupo de dosis más baja de estos estudios.
Un examen de los subgrupos de población no reveló ninguna evidencia clara de sensibilidad diferencial en función de la edad, el género o la raza.
Un ensayo a más largo plazo inscribió a 310 pacientes hospitalizados o ambulatorios que cumplían con los criterios del DSM-IV para la esquizofrenia y que, según sus antecedentes, estaban sintomáticamente estables con otros medicamentos antipsicóticos durante períodos de 3 meses o más. A estos pacientes se les interrumpió la medicación antipsicótica y se les asignó al azar 15 mg/día de ABILIFY o placebo durante un máximo de 26 semanas de observación en busca de recaídas. La recaída durante la fase doble ciego se definió como una puntuación de mejora CGI de ≥5 (mínimamente peor), puntuaciones ≥5 (moderadamente grave) en los elementos de hostilidad o falta de cooperación de la PANSS, o un aumento de ≥20 % en la puntuación total de la PANSS. Los pacientes que recibieron ABILIFY 15 mg/día experimentaron un tiempo significativamente mayor hasta la recaída durante las siguientes 26 semanas en comparación con los que recibieron placebo (Estudio 5 en la Figura 6).
Pacientes pediátricos
La eficacia de ABILIFY (aripiprazol) en el tratamiento de la esquizofrenia en pacientes pediátricos (de 13 a 17 años de edad) se evaluó en un ensayo de 6 semanas controlado con placebo de pacientes ambulatorios que cumplían con los criterios del DSM-IV para la esquizofrenia y tenían una puntuación PANSS ≥70 al inicio del estudio. En este ensayo (n=302) que comparó dos dosis fijas de ABILIFY (10 o 30 mg/día) con placebo, se tituló ABILIFY 15 mg desde 2 mg/día hasta la dosis objetivo en 5 días en el brazo de tratamiento de 10 mg/día. y en 11 días en el brazo de tratamiento de 30 mg/día. Ambas dosis de ABILIFY fueron superiores al placebo en la puntuación total de la PANSS (Estudio 6 en la Tabla 26), la medida de resultado principal del estudio. La dosis de 30 mg/día no demostró ser más eficaz que la dosis de 10 mg/día. Aunque la eficacia de mantenimiento en pacientes pediátricos no se ha evaluado sistemáticamente, la eficacia de mantenimiento se puede extrapolar a partir de datos de adultos junto con comparaciones de parámetros farmacocinéticos de aripiprazol en pacientes adultos y pediátricos.
Figura 6: Estimación de Kaplan-Meier de la proporción acumulada de pacientes con recaída (Estudio de esquizofrenia 5) 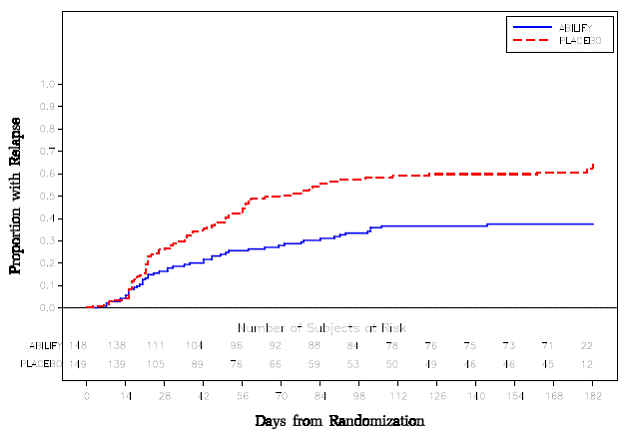
Trastorno bipolar
Tratamiento agudo de episodios maníacos y mixtos
Adultos
Monoterapia
La eficacia de ABILIFY 10 mg como monoterapia en el tratamiento agudo de los episodios maníacos se estableció en cuatro ensayos controlados con placebo de 3 semanas de duración en pacientes hospitalizados que cumplían con los criterios del DSM-IV para el trastorno bipolar I con episodios maníacos o mixtos. Estos estudios incluyeron pacientes con o sin características psicóticas y dos de los estudios también incluyeron pacientes con o sin ciclo rápido.
El instrumento principal utilizado para evaluar los síntomas maníacos fue la Young Mania Rating Scale (Y-MRS), una escala de 11 ítems calificada por médicos que se usa tradicionalmente para evaluar el grado de sintomatología maníaca en un rango de 0 (sin características maníacas) a 60 ( puntaje máximo). Un instrumento secundario clave incluía la escala Clinical Global Impression-Bipolar (CGI-BP).
En los cuatro ensayos positivos, de 3 semanas, controlados con placebo (n=268; n=248; n=480; n=485) que evaluaron ABILIFY en un rango de 15 mg a 30 mg, una vez al día (con una dosis inicial de 30 mg/día en dos estudios y 15 mg/día en dos estudios), ABILIFY 20 mg fue superior al placebo en la reducción de la puntuación total de Y-MRS (Estudios 1-4 en la Tabla 27) y la puntuación de gravedad de la enfermedad CGI-BP (manía). En los dos estudios con una dosis inicial de 15 mg/día, el 48 % y el 44 % de los pacientes recibían 15 mg/día al final. En los dos estudios con una dosis inicial de 30 mg/día, el 86 % y el 85 % de los pacientes recibían 30 mg/día al final.
Terapia adyuvante
La eficacia de ABILIFY adyuvante con litio o valproato concomitante en el tratamiento de episodios maníacos o mixtos se estableció en un estudio controlado con placebo de 6 semanas (n=384) con una fase inicial de monoterapia con estabilizadores del estado de ánimo de 2 semanas en pacientes adultos. que cumplían los criterios del DSM-IV para el trastorno bipolar I. Este estudio incluyó pacientes con episodios maníacos o mixtos y con o sin características psicóticas.
Los pacientes comenzaron con litio de etiqueta abierta (0,6 a 1,0 mEq/L) o valproato (50 a 125 μg/mL) a niveles séricos terapéuticos y permanecieron en dosis estables durante 2 semanas. Al final de las 2 semanas, los pacientes que demostraron una respuesta inadecuada (puntuación total de YMRS ≥16 y ≤25 % de mejora en la puntuación total de Y-MRS) al litio o al valproato se aleatorizaron para recibir ABILIFY (15 mg/día o un aumento a 30 mg/día). mg/día tan pronto como el día 7) o placebo como terapia adyuvante con litio o valproato de etiqueta abierta. En la fase controlada con placebo de 6 semanas, ABILIFY adyuvante a partir de 15 mg/día con litio o valproato concomitante (en un rango terapéutico de 0.6 a 1.0 mEq/L o 50 a 125 μg/mL, respectivamente) fue superior al litio. o valproato con placebo adyuvante en la reducción de la puntuación total de YMRS (estudio 5 en la tabla 27) y la puntuación de gravedad de la enfermedad CGI-BP (manía). El 71 % de los pacientes a los que se administró conjuntamente valproato y el 62 % de los pacientes a los que se administró litio conjuntamente recibían 15 mg/día al final de las 6 semanas.
Pacientes pediátricos
La eficacia de ABILIFY 15 mg en el tratamiento del trastorno bipolar I en pacientes pediátricos (10 a 17 años de edad) se evaluó en un ensayo controlado con placebo de 4 semanas (n=296) de pacientes ambulatorios que cumplieron con los criterios del DSM-IV para trastorno bipolar. Trastorno maníaco o episodios mixtos con o sin características psicóticas y tenía una puntuación de Y-MRS ≥20 al inicio del estudio. Este ensayo doble ciego controlado con placebo comparó dos dosis fijas de ABILIFY (10 o 30 mg/día) con un placebo. La dosis de 20 mg de ABILIFY se inició con 2 mg/día, que se ajustó a 5 mg/día después de 2 días, y a la dosis objetivo en 5 días en el brazo de tratamiento de 10 mg/día, y en 13 días en el brazo de tratamiento de 30 mg/día. brazo de tratamiento diurno. Ambas dosis de ABILIFY 10 mg fueron superiores al placebo en el cambio desde el inicio hasta la semana 4 en la puntuación total de Y-MRS (Estudio 6 en la Tabla 27).
Tratamiento de mantenimiento del trastorno bipolar I
Monoterapia Terapia de mantenimiento
Se realizó un ensayo de mantenimiento en pacientes adultos que cumplían con los criterios del DSM-IV para el trastorno bipolar I con un episodio maníaco o mixto reciente que se habían estabilizado con ABILIFY 20 mg de etiqueta abierta y que habían mantenido una respuesta clínica durante al menos 6 semanas. La primera fase de este ensayo fue un período de estabilización de etiqueta abierta en el que los pacientes hospitalizados y ambulatorios se estabilizaron clínicamente y luego se mantuvieron con ABILIFY de etiqueta abierta (15 o 30 mg/día, con una dosis inicial de 30 mg/día) durante al menos 6 semanas consecutivas. Luego, ciento sesenta y un pacientes ambulatorios fueron aleatorizados en forma doble ciego, ya sea a la misma dosis de ABILIFY que estaban recibiendo al final del período de estabilización y mantenimiento o al placebo y luego fueron monitoreados para detectar recaídas maníacas o depresivas. Durante la fase de aleatorización, ABILIFY fue superior al placebo en cuanto al número de recaídas afectivas combinadas (maníaca más depresiva), la medida de resultado principal de este estudio (Estudio 7 en la Figura 7). Se observaron un total de 55 eventos del estado de ánimo durante la fase de tratamiento doble ciego. Diecinueve eran del grupo ABILIFY y 36 eran del grupo placebo. El número de episodios maníacos observados en el grupo de ABILIFY 15 mg (6) fue menor que en el grupo de placebo (19), mientras que el número de episodios depresivos en el grupo de ABILIFY (9) fue similar al del grupo de placebo (11) .
Un examen de los subgrupos de población no reveló ninguna evidencia clara de sensibilidad diferencial sobre la base de la edad y el género; sin embargo, hubo un número insuficiente de pacientes en cada uno de los grupos étnicos para evaluar adecuadamente las diferencias entre grupos.
Figura 7: Estimación de Kaplan-Meier de la proporción acumulada de pacientes con recaída (estudio bipolar 7) 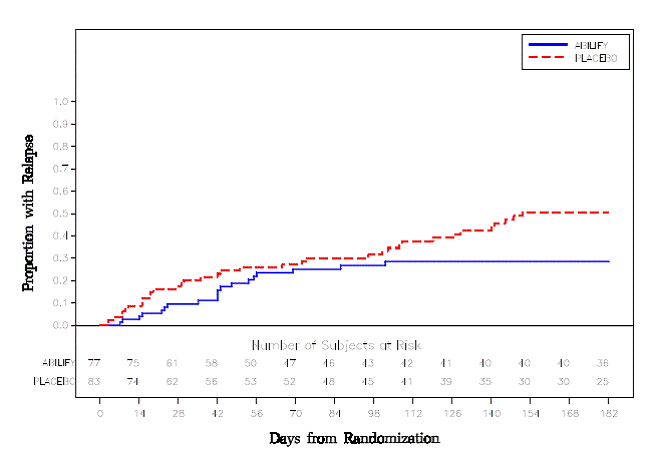
Terapia de mantenimiento adyuvante
Se realizó un ensayo de mantenimiento adyuvante en pacientes adultos que cumplían los criterios DSMIV para el trastorno bipolar I con un episodio maníaco o mixto reciente. Los pacientes comenzaron con litio de etiqueta abierta (0,6 a 1,0 mEq/L) o valproato (50 a 125 μg/mL) a niveles séricos terapéuticos y permanecieron en dosis estables durante 2 semanas. Al final de las 2 semanas, los pacientes que demostraron una respuesta inadecuada (puntuación total de Y-MRS ≥16 y ≤35 % de mejora en la puntuación total de Y-MRS) al litio o al valproato recibieron ABILIFY con una dosis inicial de 15 mg/día con la opción para aumentar a 30 mg o reducir a 10 mg tan pronto como el día 4, como terapia adyuvante con litio o valproato de etiqueta abierta. Antes de la aleatorización, los pacientes que recibieron la combinación de ABILIFY simple ciego y litio o valproato debían mantener la estabilidad (puntuaciones totales de Y-MRS y MADRS ≤12) durante 12 semanas consecutivas. Luego, 337 pacientes fueron aleatorizados en forma doble ciego, ya sea a la misma dosis de ABILIFY 20 mg que estaban tomando al final del período de estabilización o a placebo más litio o valproato y luego fueron monitoreados para detectar síntomas maníacos, mixtos o recaída depresiva durante un máximo de 52 semanas. ABILIFY 15 mg fue superior al placebo en el criterio principal de valoración, el tiempo desde la aleatorización hasta la recaída y cualquier evento del estado de ánimo (Estudio 8 en la Figura 8). Un evento del estado de ánimo se definió como la hospitalización por un episodio maníaco, mixto o depresivo, la interrupción del estudio debido a la falta de eficacia acompañada de una puntuación de Y-MRS> 16 y/o una MADRS> 16, o un SAE de empeoramiento de la enfermedad acompañado de Y- Puntuación MRS >16 y/o MADRS >16. Se observaron un total de 68 eventos del estado de ánimo durante la fase de tratamiento doble ciego. Veinticinco eran del grupo de ABILIFY de 20 mg y 43 del grupo de placebo. El número de episodios maníacos observados en el grupo de ABILIFY 15 mg (7) fue menor que en el grupo de placebo (19), mientras que el número de episodios depresivos en el grupo de ABILIFY (14) fue similar al del grupo de placebo (18) . Las curvas de Kaplan-Meier del tiempo desde la aleatorización hasta la recaída a cualquier evento del estado de ánimo durante la fase de tratamiento doble ciego de 52 semanas para los grupos ABILIFY 10 mg y placebo se muestran en la Figura 8.
Figura 8: Estimación de Kaplan-Meier de la proporción acumulada de pacientes con recaída a cualquier evento del estado de ánimo (estudio bipolar 8) 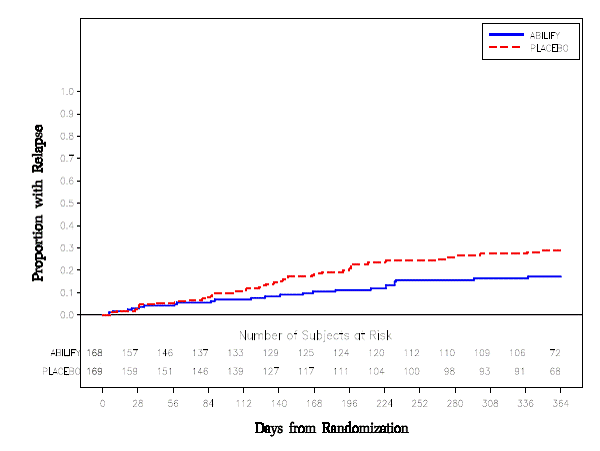
Un examen de los subgrupos de población no reveló ninguna evidencia clara de sensibilidad diferencial sobre la base de la edad y el género; sin embargo, hubo un número insuficiente de pacientes en cada uno de los grupos étnicos para evaluar adecuadamente las diferencias entre grupos.
Tratamiento adyuvante del trastorno depresivo mayor
Adultos
La eficacia de ABILIFY 15 mg en el tratamiento adyuvante del trastorno depresivo mayor (MDD) se demostró en dos ensayos controlados con placebo a corto plazo (6 semanas) de pacientes adultos que cumplían con los criterios del DSM-IV para MDD que habían tenido una respuesta inadecuada a tratamiento antidepresivo previo (1 a 3 ciclos) en el episodio actual y que también hayan demostrado una respuesta inadecuada a 8 semanas de tratamiento antidepresivo prospectivo (paroxetina de liberación controlada, venlafaxina de liberación prolongada, fluoxetina, escitalopram o sertralina). La respuesta inadecuada para el tratamiento prospectivo se definió como una mejora de menos del 50 % en la versión de 17 ítems de la escala de calificación de depresión de Hamilton (HAMD17), una puntuación mínima de HAMD17 de 14 y una calificación de mejora de las impresiones clínicas globales de no mejor que una mejora mínima. La respuesta inadecuada al tratamiento anterior se definió como una mejora inferior al 50 % percibida por el paciente después de un mínimo de 6 semanas de tratamiento antidepresivo a la dosis mínima eficaz o superior.
El instrumento principal utilizado para evaluar los síntomas depresivos fue la Escala de calificación de depresión de Montgomery-Asberg (MADRS), una escala calificada por médicos de 10 ítems que se usa para evaluar el grado de sintomatología depresiva. El instrumento secundario clave fue la Escala de discapacidad de Sheehan (SDS), un instrumento autoevaluado de 3 ítems utilizado para evaluar el impacto de la depresión en tres dominios de funcionamiento con cada ítem puntuado de 0 (nada) a 10 (extremo).
En los dos ensayos (n=381, n=362), ABILIFY 15 mg fue superior al placebo en la reducción de las puntuaciones totales medias de MADRS (Estudios 1, 2 en la Tabla 28). En un estudio, ABILIFY también fue superior al placebo en la reducción de la puntuación SDS media.
En ambos ensayos, los pacientes recibieron ABILIFY 15 mg como complemento de los antidepresivos en una dosis de 5 mg/día. Según la tolerabilidad y la eficacia, las dosis podrían ajustarse en incrementos de 5 mg, con una semana de diferencia. Las dosis permitidas fueron: 2, 5, 10, 15 mg/día, y para los pacientes que no estaban tomando inhibidores potentes de CYP2D6, fluoxetina y paroxetina, 20 mg/día. La dosis final media al final de los dos ensayos fue de 10,7 y 11,4 mg/día.
Un examen de los subgrupos de población no reveló evidencia de respuesta diferencial basada en la edad, la elección del posible antidepresivo o la raza. Con respecto al género, se observó una reducción media menor en la puntuación total de MADRS en los hombres que en las mujeres.
Irritabilidad asociada con el trastorno autista
Pacientes pediátricos
La eficacia de ABILIFY (aripiprazol) en el tratamiento de la irritabilidad asociada con el trastorno autista se estableció en dos ensayos controlados con placebo de 8 semanas de duración en pacientes pediátricos (de 6 a 17 años de edad) que cumplían con los criterios del DSM-IV para el trastorno autista y Comportamientos demostrados como rabietas, agresión, comportamiento auto agresivo o una combinación de estos problemas. Más del 75% de estos sujetos eran menores de 13 años.
La eficacia se evaluó utilizando dos escalas de evaluación: la Lista de Verificación de Comportamiento Aberrante (ABC) y la escala de Mejora de la Impresión Clínica Global (CGI-I). La medida de resultado primaria en ambos ensayos fue el cambio desde el inicio hasta el final en la subescala de irritabilidad del ABC (ABC-I). La subescala ABC-I midió los síntomas de irritabilidad en el trastorno autista.
Los resultados de estos ensayos son los siguientes:
En uno de los ensayos controlados con placebo de 8 semanas, niños y adolescentes con trastorno autista (n=98), de 6 a 17 años de edad, recibieron dosis diarias de placebo o ABILIFY de 2 a 15 mg/día. ABILIFY, comenzando con 2 mg/día con aumentos permitidos hasta 15 mg/día según la respuesta clínica, mejoró significativamente las puntuaciones en la subescala ABC-I y en la escala CGI-I en comparación con el placebo. La dosis diaria media de ABILIFY 10 mg al final del tratamiento de 8 semanas fue de 8,6 mg/día (Estudio 1 en la Tabla 29).
En el otro ensayo controlado con placebo de 8 semanas en niños y adolescentes con trastorno autista (n=218), de 6 a 17 años, se administraron tres dosis fijas de ABILIFY (5 mg/día, 10 mg/día o 15 mg/día). día) se compararon con placebo. La dosificación de ABILIFY comenzó con 2 mg/día y se aumentó a 5 mg/día después de una semana. Después de una segunda semana, se aumentó a 10 mg/día para los pacientes en los brazos de dosis de 10 y 15 mg, y después de una tercera semana, se aumentó a 15 mg/día en el brazo de tratamiento de 15 mg/día (Estudio 2 en Tabla 29). Las tres dosis de ABILIFY mejoraron significativamente las puntuaciones en la subescala ABC-I en comparación con el placebo.
Trastorno de Tourette
Pacientes pediátricos
La eficacia de ABILIFY (aripiprazol) en el tratamiento del trastorno de Tourette se estableció en un ensayo controlado con placebo de 8 semanas (de 7 a 17 años de edad) y de 10 semanas (de 6 a 18 años de edad) en Pacientes pediátricos (de 6 a 18 años de edad) que cumplieron con los criterios del DSM-IV para el trastorno de Tourette y tenían una puntuación total de tics (TTS) ≥ 20 - 22 en la Escala global de gravedad de tics de Yale (YGTSS). El YGTSS es una escala totalmente validada diseñada para medir la gravedad actual de los tics. La eficacia se evaluó utilizando dos escalas de evaluación: 1) la puntuación total de tics (TTS) del YGTSS y 2) la escala de impresiones clínicas globales para el síndrome de Tourette (CGI-TS), una medida resumida determinada por un médico que tiene en cuenta toda la información disponible del paciente. Más del 65% de estos pacientes eran menores de 13 años.
La medida de resultado primaria en ambos ensayos fue el cambio desde el inicio hasta el final en el TTS del YGTSS. Las calificaciones para el TTS se realizan a lo largo de 5 dimensiones diferentes en una escala de 0 a 5 para tics motores y vocales cada uno. La suma de estas 10 puntuaciones proporciona un TTS (es decir, 0-50).
Los resultados de estos ensayos son los siguientes:
En el ensayo de dosis fija, controlado con placebo, de 8 semanas, niños y adolescentes con trastorno de Tourette (n=133), de 7 a 17 años de edad, fueron aleatorizados 1:1:1 para recibir una dosis baja de ABILIFY, una dosis alta de ABILIFY 15 mg o placebo. Las dosis objetivo para los grupos de dosis baja y alta de ABILIFY 10 mg se basaron en el peso. Los pacientes
Figura 9: Medias de cambio de mínimos cuadrados desde el inicio en YGTSS TTS por semana (Estudio 1 sobre el trastorno de Tourette) 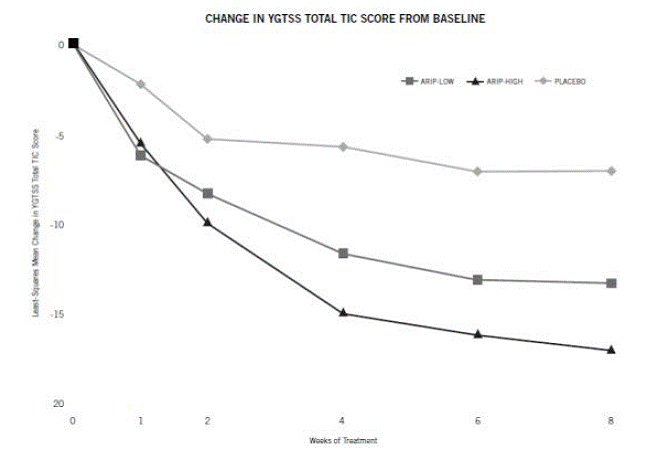
En el ensayo de dosis flexible, controlado con placebo, de 10 semanas de duración en niños y adolescentes con trastorno de Tourette (n=61), de 6 a 18 años de edad, los pacientes recibieron dosis diarias de placebo o ABILIFY, a partir de 2 mg/día. día con aumentos permitidos hasta 20 mg/día según la respuesta clínica. ABILIFY demostró puntuaciones mejoradas estadísticamente significativas en la escala YGTSS TTS en comparación con el placebo (Estudio 2 en la Tabla 30). La dosis diaria media de ABILIFY al final del tratamiento de 10 semanas fue de 6,54 mg/día.
Agitación asociada con la esquizofrenia o la manía bipolar
La eficacia de ABILIFY intramuscular inyectable para el tratamiento de la agitación se estableció en tres ensayos controlados con placebo a corto plazo (24 horas) en pacientes hospitalizados agitados de dos grupos de diagnóstico: esquizofrenia y trastorno bipolar I (episodios maníacos o mixtos, con o sin sin rasgos psicóticos). Cada uno de los ensayos incluyó un solo brazo de tratamiento con comparador activo de inyección de haloperidol (estudios de esquizofrenia) o inyección de lorazepam (estudio de manía bipolar). Los pacientes podían recibir hasta tres inyecciones durante los períodos de tratamiento de 24 horas; sin embargo, los pacientes no pudieron recibir la segunda inyección hasta después del período inicial de 2 horas cuando se evaluó la medida de eficacia primaria. Los pacientes inscritos en los ensayos debían ser: (1) juzgados por los investigadores clínicos como clínicamente agitados y candidatos clínicamente apropiados para el tratamiento con medicación intramuscular, y (2) exhibiendo un nivel de agitación que alcanzara o excediera una puntuación de umbral de ≥15 en los cinco ítems que comprenden el Componente Excitado de la Escala del Síndrome Positivo y Negativo (PANSS) (es decir, ítems de control de impulsos deficiente, tensión, hostilidad, falta de cooperación y entusiasmo) con al menos dos puntajes de ítems individuales ≥4 usando un sistema de puntuación de 1-7 (1 = ausente, 4 = moderado, 7 = extremo). En los estudios, la puntuación inicial media del componente excitado de la PANSS fue de 19, con puntuaciones que oscilaban entre 15 y 34 (de una puntuación máxima de 35), lo que sugiere niveles de agitación predominantemente moderados y algunos pacientes experimentaron niveles de agitación leves o graves. La principal medida de eficacia utilizada para evaluar los signos y síntomas de agitación en estos ensayos fue el cambio desde el valor inicial en el componente excitado de la PANSS 2 horas después de la inyección. Una medida secundaria clave fue la Escala de impresión clínica global de mejora (CGI-I). Los resultados de los ensayos son los siguientes:
En un ensayo controlado con placebo en pacientes hospitalizados agitados que cumplían predominantemente con los criterios del DSM-IV para la esquizofrenia (n=350), se evaluaron cuatro dosis inyectables fijas de ABILIFY de 20 mg de 1 mg, 5,25 mg, 9,75 mg y 15 mg. Dos horas después de la inyección, las dosis de 5,25 mg, 9,75 mg y 15 mg fueron estadísticamente superiores al placebo en el componente excitado de la PANSS (estudio 1 en la tabla 31) y en la escala CGII.
En un segundo ensayo controlado con placebo en pacientes hospitalizados agitados que cumplían predominantemente con los criterios del DSM-IV para la esquizofrenia (n=445), se evaluó una dosis inyectable fija de 15 mg de ABILIFY de 9,75 mg. Dos horas después de la inyección, ABILIFY para inyección fue estadísticamente superior al placebo en el componente excitado de la PANSS (estudio 2 en la tabla 31) y en la escala CGI-I.
En un ensayo controlado con placebo en pacientes hospitalizados agitados que cumplían con los criterios DSMIV para el trastorno bipolar I (maníaco o mixto) (n=291), se evaluaron dos dosis inyectables fijas de 10 mg de ABILIFY de 9,75 mg y 15 mg. Dos horas después de la inyección, ambas dosis fueron estadísticamente superiores al placebo en el componente excitado de la PANSS (Estudio 3 en la Tabla 31).
El examen de los subconjuntos de población (edad, raza y género) no reveló ninguna respuesta diferencial sobre la base de estos subgrupos.
INFORMACIÓN DEL PACIENTE
ABILIFY® (aripiprazol) Comprimidos
ABILIFY DISCMELT® (aripiprazol) tabletas de desintegración oral
ABILIFY® (aripiprazol) solución oral
ABILIFY® (aripiprazol) inyectable solo para uso intramuscular
¿Cuál es la información más importante que debo saber sobre ABILIFY 20mg?
(Para otros efectos secundarios, consulte también “¿Cuáles son los posibles efectos secundarios de ABILIFY?”)
Pueden ocurrir efectos secundarios graves cuando toma ABILIFY, que incluyen:
- Mayor riesgo de muerte en pacientes de edad avanzada con psicosis relacionada con la demencia: Medicamentos como ABILIFY 10 mg pueden aumentar el riesgo de muerte en personas mayores que han perdido el contacto con la realidad (psicosis) debido a confusión y pérdida de memoria (demencia). ABILIFY no está aprobado para el tratamiento de pacientes con psicosis relacionada con la demencia.
- Riesgo de pensamientos o acciones suicidas: Medicamentos antidepresivos, depresión y otras enfermedades mentales graves, y pensamientos o acciones suicidas:
1. Los medicamentos antidepresivos pueden aumentar los pensamientos o acciones suicidas en algunos niños, adolescentes y adultos jóvenes durante los primeros meses de tratamiento.
2. La depresión y otras enfermedades mentales graves son las causas más importantes de pensamientos y acciones suicidas. Algunas personas pueden tener un riesgo particularmente alto de tener pensamientos o acciones suicidas. Estos incluyen personas que tienen (o tienen antecedentes familiares de) enfermedad bipolar (también llamada enfermedad maníaco-depresiva) o pensamientos o acciones suicidas.
3. ¿Cómo puedo vigilar y tratar de prevenir pensamientos y acciones suicidas en mí mismo o en un miembro de la familia?
- Preste mucha atención a cualquier cambio, especialmente a los repentinos, en el estado de ánimo, el comportamiento, los pensamientos o los sentimientos. Esto es muy importante cuando se inicia un medicamento antidepresivo o cuando se cambia la dosis.
- Llame al proveedor de atención médica de inmediato para informar cambios nuevos o repentinos en el estado de ánimo, el comportamiento, los pensamientos o los sentimientos.
- Mantenga todas las visitas de seguimiento con el proveedor de atención médica según lo programado. Llame al proveedor de atención médica entre visitas según sea necesario, especialmente si le preocupan los síntomas.
Llame a un proveedor de atención médica de inmediato si usted o un miembro de su familia tienen alguno de los siguientes síntomas, especialmente si son nuevos, empeoran o le preocupan:
- pensamientos sobre el suicidio o la muerte
- intentos de suicidio
- depresión nueva o peor
- ansiedad nueva o peor
- sentirse muy agitado o inquieto
- ataques de pánico
- dificultad para dormir (insomnio)
- irritabilidad nueva o peor
- Actuar agresivo, estar enojado o violento.
- actuando sobre impulsos peligrosos
- un aumento extremo en la actividad y el habla (manía)
- otros cambios inusuales en el comportamiento o el estado de ánimo
¿Qué más necesito saber sobre los medicamentos antidepresivos?
- Nunca deje de tomar un medicamento antidepresivo sin hablar primero con un proveedor de atención médica. Detener un medicamento antidepresivo repentinamente puede causar otros síntomas.
- Los antidepresivos son medicamentos que se usan para tratar la depresión y otras enfermedades. Es importante discutir todos los riesgos de tratar la depresión y también los riesgos de no tratarla. Los pacientes y sus familias u otros cuidadores deben analizar todas las opciones de tratamiento con el proveedor de atención médica, no solo el uso de antidepresivos.
- Las medicinas antidepresivas tienen otros efectos secundarios. Hable con el proveedor de atención médica sobre los efectos secundarios del medicamento recetado para usted o su familiar.
- Los medicamentos antidepresivos pueden interactuar con otros medicamentos. Conozca todos los medicamentos que toma usted o su familiar. Mantenga una lista de todos los medicamentos para mostrársela al proveedor de atención médica. No empiece a tomar nuevos medicamentos sin antes consultar con su proveedor de atención médica.
- No todos los medicamentos antidepresivos recetados para niños están aprobados por la FDA para su uso en niños. Hable con el proveedor de atención médica de su hijo para obtener más información.
¿Qué es ABILIFY?
- Las tabletas orales, las tabletas de desintegración oral y la solución oral ABILIFY de 20 mg son medicamentos recetados que se usan para tratar:
- Esquizofrenia
- episodios maníacos o mixtos que ocurren con el trastorno bipolar I
- trastorno depresivo mayor (TDM) cuando ABILIFY 20 mg se usa con medicamentos antidepresivos
- irritabilidad asociada con el trastorno autista
- Trastorno de Tourette
- La inyección de ABILIFY es un medicamento recetado que se usa para tratar:
- agitación asociada con esquizofrenia o manía bipolar
No se sabe si ABILIFY 10 mg es seguro o efectivo en niños:
- menores de 13 años con esquizofrenia
- menores de 10 años con trastorno bipolar I
- menores de 6 años con irritabilidad asociada a trastorno autista
- menores de 6 años con síndrome de Tourette
No tome ABILIFY 20 mg si es alérgico al aripiprazol o a cualquiera de los ingredientes de ABILIFY. Consulte el final de esta Guía del medicamento para obtener una lista completa de los ingredientes de ABILIFY.
Antes de tomar ABILIFY 15 mg, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si tiene o tuvo:
- diabetes o nivel alto de azúcar en la sangre en usted o su familia; su proveedor de atención médica debe controlar su nivel de azúcar en la sangre antes de comenzar con ABILIFY 10 mg y también durante la terapia.
- convulsiones (convulsiones).
- presión arterial baja o alta.
- problemas cardíacos o derrames cerebrales.
- embarazo o planes de quedar embarazada. No se sabe si ABILIFY dañará a su bebé nonato.
- Si queda embarazada mientras recibe ABILIFY 10 mg, hable con su proveedor de atención médica acerca de registrarse en el Registro Nacional de Embarazo para Antipsicóticos Atípicos. Puede registrarse llamando al 1-866-961-2388 o vaya a http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
- lactancia o planes para amamantar. ABILIFY pasa a la leche materna. Hable con su proveedor de atención médica sobre la mejor manera de alimentar a su bebé si recibe ABILIFY.
- recuento bajo de glóbulos blancos.
- fenilcetonuria. Las tabletas de desintegración oral ABILIFY DISCMELT contienen fenilalanina.
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos a base de hierbas.
ABILIFY y otros medicamentos pueden afectarse entre sí y causar posibles efectos secundarios graves. ABILIFY puede afectar la forma en que funcionan otros medicamentos, y otros medicamentos pueden afectar la forma en que funciona ABILIFY.
Su proveedor de atención médica puede decirle si es seguro tomar ABILIFY con sus otros medicamentos. No comience ni suspenda ningún medicamento mientras toma ABILIFY sin hablar primero con su proveedor de atención médica. Conozca los medicamentos que toma. Mantenga una lista de sus medicamentos para mostrársela a su proveedor de atención médica y farmacéutico cuando obtenga un nuevo medicamento.
¿Cómo debo tomar ABILIFY 20mg?
- Tome ABILIFY 10 mg exactamente como se lo indique su proveedor de atención médica. No cambie la dosis ni deje de tomar ABILIFY usted mismo.
- ABILIFY 20 mg se puede tomar con o sin alimentos.
- Los comprimidos de ABILIFY deben tragarse enteros.
- Si olvida una dosis de ABILIFY 20 mg, tome la dosis olvidada tan pronto como lo recuerde. Si es casi la hora de la próxima dosis, simplemente omita la dosis olvidada y tome la próxima dosis a la hora habitual. No tome dos dosis de ABILIFY 10 mg al mismo tiempo.
- Si le han recetado ABILIFY DISCMELT, tómelo de la siguiente manera:
- No abra el blíster hasta que esté listo para tomar la tableta DISCMELT.
- Para retirar una tableta de DISCMELT, abra el paquete y retire la lámina del blíster para exponer la tableta.
- No empuje la tableta a través de la lámina porque esto podría dañar la tableta.
- Inmediatamente después de abrir el blíster, con las manos secas, retire la tableta y coloque toda la tableta de desintegración oral ABILIFY DISCMELT en la lengua.
- La desintegración de la tableta ocurre rápidamente en la saliva. Se recomienda tomar ABILIFY 10 mg DISCMELT sin líquido. Sin embargo, si es necesario, se puede tomar con líquido.
- No intente dividir la tableta DISCMELT.
- Si toma demasiado ABILIFY, llame de inmediato a su proveedor de atención médica o al centro de toxicología al 1-800-222-1222, o vaya a la sala de emergencias del hospital más cercano.
¿Qué debo evitar mientras tomo ABILIFY 10mg?
- No conduzca, opere maquinaria pesada ni realice otras actividades peligrosas hasta que sepa cómo le afecta ABILIFY 10 mg. ABILIFY 20 mg puede provocarle somnolencia.
- Evite sobrecalentarse o deshidratarse.
- No haga demasiado ejercicio.
- Si hace calor, quédese adentro en un lugar fresco si es posible.
- Mantente alejado de el sol. No use demasiada ropa ni pesada.
- Beber abundante agua.
¿Cuáles son los posibles efectos secundarios de ABILIFY?
ABILIFY 10 mg puede causar efectos secundarios graves, que incluyen:
- Consulte "¿Cuál es la información más importante que debo saber sobre ABILIFY 10 mg?"
- Accidente cerebrovascular en personas mayores (problemas cerebrovasculares) que puede conducir a la muerte
- Síndrome neuroléptico maligno (SNM). Informe a su proveedor de atención médica de inmediato si tiene algunos o todos los síntomas siguientes: fiebre alta, rigidez muscular, confusión, sudoración, cambios en el pulso, la frecuencia cardíaca y la presión arterial. Estos pueden ser síntomas de una afección rara y grave que puede causar la muerte. Llame a su proveedor de atención médica de inmediato si tiene alguno de estos síntomas.
- Movimientos corporales descontrolados (discinesia tardía). ABILIFY puede causar movimientos que no puede controlar en su cara, lengua u otras partes del cuerpo. Es posible que la discinesia tardía no desaparezca, incluso si deja de recibir ABILIFY. La discinesia tardía también puede comenzar después de que deje de recibir ABILIFY.
- Problemas con su metabolismo tales como:
- Alto nivel de azúcar en la sangre (hiperglucemia) y diabetes. Algunas personas que toman ABILIFY pueden sufrir aumentos de azúcar en la sangre. Los niveles extremadamente altos de azúcar en la sangre pueden provocar coma o la muerte. Si tiene diabetes o factores de riesgo para la diabetes (como sobrepeso o antecedentes familiares de diabetes), su proveedor de atención médica debe controlar su nivel de azúcar en la sangre antes de comenzar con ABILIFY y durante su tratamiento.
Llame a su proveedor de atención médica si tiene alguno de estos síntomas de nivel alto de azúcar en la sangre mientras recibe ABILIFY:
- sentir mucha sed
- necesidad de orinar más de lo normal
- sentir mucha hambre
- sentirse débil o cansado
- sentirse mal del estómago
- se siente confundido, o su aliento huele afrutado
- Aumento de los niveles de grasas (colesterol y triglicéridos) en sangre.
- Aumento de peso. Usted y su proveedor de atención médica deben controlar su peso con regularidad.
- Impulsos inusuales. Algunas personas que toman ABILIFY 15 mg han tenido impulsos inusuales, como apuestas, atracones o comidas que no puede controlar (compulsión), compras compulsivas e impulsos sexuales. Si usted o los miembros de su familia notan que tiene impulsos o comportamientos inusuales, hable con su proveedor de atención médica.
- Hipotensión ortostática (disminución de la presión arterial). Se pueden producir mareos o desmayos al levantarse demasiado rápido de una posición sentada o acostada.
- Caídas. ABILIFY puede causarle sueño o mareos, puede causar una disminución de la presión arterial al cambiar de posición y puede ralentizar su pensamiento y sus habilidades motoras, lo que puede provocar caídas que pueden causar fracturas u otras lesiones.
- Recuento bajo de glóbulos blancos
- Convulsiones (convulsiones)
- Problemas con el control de la temperatura de su cuerpo, especialmente cuando hace mucho ejercicio o está en un área muy caliente. Es importante que beba agua para evitar la deshidratación. Consulte "¿Qué debo evitar mientras recibo ABILIFY 15 mg?"
- Dificultad para tragar que puede hacer que los alimentos o líquidos entren en los pulmones.
Los efectos secundarios más comunes de ABILIFY 10 mg en adultos incluyen:
- Náuseas
- mareo
- vómitos
- ansiedad
- estreñimiento
- insomnio
- dolor de cabeza
- inquietud
- visión borrosa
- enfermedad respiratoria superior
- sensación interna de inquietud/necesidad de moverse (acatisia)
Los efectos secundarios más comunes de ABILIFY en niños incluyen:
- me siento con sueño
- insomnio
- dolor de cabeza
- náuseas
- vómitos
- congestión nasal
- fatiga
- aumento de peso
- aumento o disminución del apetito
- movimiento incontrolado como inquietud, temblor
- aumento de saliva o babeo
- rigidez muscular
Estos no son todos los posibles efectos secundarios de ABILIFY.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar ABILIFY?
- Guarde ABILIFY 15 mg a temperatura ambiente, entre 20 °C y 25 °C (68 °F y 77 °F).
- Los frascos abiertos de ABILIFY 10 mg Solución oral se pueden usar hasta 6 meses después de abrirlos, pero no más allá de la fecha de vencimiento que figura en el frasco.
Mantenga ABILIFY y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de ABILIFY
A veces, los medicamentos se recetan para fines distintos a los enumerados en la Guía del medicamento. No use ABILIFY 20 mg para una condición para la cual no fue recetado. No le dé ABILIFY 20 mg a otras personas, incluso si tienen los mismos síntomas que usted. Puede que les haga daño. Puede pedirle a su proveedor de atención médica o farmacéutico información sobre ABILIFY 10 mg que se escribió para profesionales de la salud.
¿Cuáles son los ingredientes de ABILIFY?
Ingrediente activo: aripiprazol
Ingredientes inactivos:
almidón de maíz, hidroxipropilcelulosa, lactosa monohidrato, estearato de magnesio y celulosa microcristalina. Los colorantes incluyen óxido férrico (amarillo o rojo) y FD&C Blue No. 2 Aluminium Lake
ABILIFY 10 mg DISCMELT Tabletas de desintegración oral: acesulfamo de potasio, aspartamo (que contiene fenilalanina), silicato de calcio, croscarmelosa de sodio, crospovidona, crema de vainilla (sabores naturales y artificiales), estearato de magnesio, celulosa microcristalina, dióxido de silicio, ácido tartárico y xilitol. Los colorantes incluyen óxido férrico (amarillo o rojo) y FD&C Blue No. 2 Aluminium Lake
Solución oral ABILIFY: edetato disódico, fructosa (200 mg por ml), glicerina, ácido dl-láctico, metilparabeno, propilenglicol, propilparabeno, hidróxido de sodio, sacarosa (400 mg por ml) y agua purificada. La solución oral está aromatizada con crema de naranja natural y otros aromas naturales.
Para obtener más información sobre ABILIFY, visite www.abilify.com o llame al 1-800-438-6055.
Esta Guía del medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de EE. UU.
