Casodex 50mg Bicalutamide Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Casodex y cómo se usa?
Casodex es un medicamento recetado que se usa para tratar los síntomas del cáncer de próstata. Casodex 50 mg puede usarse solo o con otros medicamentos.
Casodex 50 mg pertenece a una clase de medicamentos llamados Antineoplásicos, Antiandrógenos; Inhibidor de CYP3A4, moderado.
No se sabe si Casodex es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Casodex?
Casodex puede causar efectos secundarios graves que incluyen:
- dolor o hinchazón de los senos,
- sangre en tu orina,
- fiebre,
- escalofríos,
- dolor o malestar repentino en el pecho,
- sibilancias,
- tos seca,
- dificultad para respirar,
- piel pálida,
- aturdimiento,
- ritmo cárdiaco elevado,
- problemas para concentrarse,
- náuseas,
- dolor de estómago superior,
- sensación de cansancio,
- pérdida de apetito,
- orina oscura,
- heces de color arcilla,
- coloración amarillenta de la piel o los ojos (ictericia),
- aumento de la sed,
- aumento de la micción,
- hambre,
- boca seca,
- aliento con olor afrutado,
- somnolencia,
- piel seca,
- visión borrosa y
- pérdida de peso
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Casodex 50 mg incluyen:
- Sofocos,
- dolor en la espalda,
- dolor pélvico,
- dolor abdominal,
- hinchazón en las manos, los tobillos o los pies,
- aumento de la micción nocturna,
- debilidad,
- mareo,
- náuseas,
- diarrea, y
- estreñimiento
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Casodex. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
Los comprimidos de CASODEX® (bicalutamida) contienen 50 mg de bicalutamida, un inhibidor del receptor de andrógenos no esteroideo sin otra actividad endocrina conocida. El nombre químico es propanamida, N [4 ciano-3- (trifluorometil)fenil]-3-[(4-fluorofenil)sulfonil]-2-hidroxi-2-metil-,(+-). Las fórmulas estructural y empírica son:
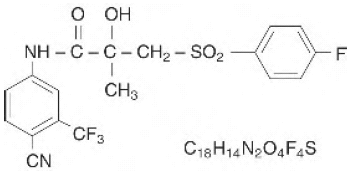
La bicalutamida tiene un peso molecular de 430,37. El pKa' es de aproximadamente 12. La bicalutamida es un polvo fino de color blanco a blanquecino que es prácticamente insoluble en agua a 37 °C (5 mg por 1000 ml), ligeramente soluble en cloroformo y etanol absoluto, escasamente soluble en metanol y soluble en acetona y tetrahidrofurano.
CASODEX es un racemato cuya actividad antiandrogénica la exhibe casi exclusivamente el enantiómero R de la bicalutamida; el enantiómero S es esencialmente inactivo.
Los ingredientes inactivos de las tabletas CASODEX de 50 mg son lactosa, estearato de magnesio, hipromelosa, polietilenglicol, polividona, glicolato de almidón de sodio y dióxido de titanio.
INDICACIONES
CASODEX 50 mg diarios está indicado para usar en terapia combinada con un análogo de la hormona liberadora de hormona luteinizante (LHRH) para el tratamiento del carcinoma metastásico de próstata en estadio D2.
CASODEX 150 mg diarios no está aprobado para usar solo o con otros tratamientos [ver Estudios clínicos ].
DOSIFICACIÓN Y ADMINISTRACIÓN
Dosis recomendada y horario
La dosis recomendada para la terapia con CASODEX 50 mg en combinación con un análogo de LHRH es una tableta de 50 mg una vez al día (mañana o noche), con o sin alimentos. Se recomienda tomar CASODEX 50 mg a la misma hora todos los días. El tratamiento con CASODEX debe iniciarse al mismo tiempo que el tratamiento con un análogo de LHRH. Si se olvida una dosis de CASODEX 50 mg, tome la siguiente dosis a la hora programada. No tome la dosis olvidada y no duplique la dosis siguiente.
Ajuste de dosis en insuficiencia renal
No es necesario ajustar la dosis en pacientes con insuficiencia renal [ver Uso en poblaciones específicas ].
Ajuste de dosis en insuficiencia hepática
No es necesario ajustar la dosis en pacientes con insuficiencia hepática de leve a moderada. En pacientes con insuficiencia hepática grave (n=4), aunque hubo un aumento del 76 % en la vida media (5,9 y 10,4 días para pacientes normales y con insuficiencia, respectivamente) del enantiómero activo de bicalutamida, no es necesario ajustar la dosis [ ver Uso en poblaciones específicas ].
CÓMO SUMINISTRADO
Formas de dosificación y fuerza
CASODEX® (bicalutamida) comprimidos de 50 mg para administración oral.
Los comprimidos recubiertos con película de color blanco (identificados en un lado con "CDX50" y en el reverso con el "logotipo CASODEX") se suministran en frascos monodosis de 30 comprimidos (0310-0705-30).
Almacenamiento y manipulación
Almacenar a temperatura ambiente controlada, 20°-25°C (68°-77°F).
Fabricado para: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850. Revisado: marzo de 2017.
EFECTOS SECUNDARIOS
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Experiencia en ensayos clínicos
En pacientes con cáncer de próstata avanzado tratados con CASODEX 50 mg en combinación con un análogo de LHRH, la reacción adversa más frecuente fueron los sofocos (53%).
En el ensayo clínico multicéntrico, doble ciego, controlado que comparó CASODEX 50 mg una vez al día con flutamida 250 mg tres veces al día, cada uno en combinación con un análogo de LHRH, las siguientes reacciones adversas con una incidencia del 5 % o más, independientemente de causalidad, han sido reportados.
Otras reacciones adversas (mayores o iguales al 2 %, pero menores al 5 %) informadas en el grupo de tratamiento con el análogo de CASODEX-LHRH se enumeran a continuación por sistema corporal y están en orden decreciente de frecuencia dentro de cada sistema corporal, independientemente de la causalidad.
Cuerpo como un todo: Neoplasma; Dolor de cuello; Fiebre; Escalofríos; Septicemia; Hernia; Quiste
Cardiovascular: Angina de pecho; Insuficiencia cardíaca congestiva; infarto de miocardio; paro cardíaco; Trastorno de la Arteria Coronaria; Síncope
Digestivo: Melena; hemorragia rectal; Boca seca; disfagia; Trastorno Gastrointestinal; absceso periodontal; Carcinoma gastrointestinal
Metabólicas y Nutricionales: Edema; BUN aumentado; Creatinina aumentada; Deshidración; Gota; Hipercolesterolemia
Musculoesquelético: Mialgia; Calambres en las piernas
Nervioso: hipertonía; Confusión; Somnolencia; Disminución de la libido; Neuropatía; Nerviosismo
Respiratorio: Trastorno Pulmonar; Asma; Epistaxis; Sinusitis
Piel y apéndices: Piel seca; Alopecia; Prurito; Infección de herpes; carcinoma de piel; Trastorno de la piel
Sentidos especiales: catarata especificado
urogenitales: disuria; Urgencia urinaria; hidronefrosis; Trastorno del tracto urinario
Valores anormales de las pruebas de laboratorio:
Anomalías de laboratorio que incluyen: elevación de AST, ALT, bilirrubina, BUN y creatinina; y disminución del recuento de hemoglobina y glóbulos blancos, tanto en pacientes tratados con el análogo de CASODEX-LHRH como con el análogo de flutamida-LHRH.
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de CASODEX. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Desórdenes respiratorios: Enfermedad pulmonar intersticial (algunas fatales) que incluyen neumonitis intersticial y fibrosis pulmonar, con mayor frecuencia en dosis superiores a 50 mg.
Trastornos de la piel y del tejido subcutáneo: fotosensibilidad
INTERACCIONES CON LA DROGAS
Los estudios clínicos no han mostrado ninguna interacción farmacológica entre la bicalutamida y los análogos de la LHRH (goserelina o leuprolida). No hay evidencia de que la bicalutamida induzca las enzimas hepáticas.
Los estudios in vitro han demostrado que la R-bicalutamida es un inhibidor de CYP 3A4 con efectos inhibidores menores sobre la actividad de CYP 2C9, 2C19 y 2D6. Los estudios clínicos han demostrado que con la administración conjunta de CASODEX, los niveles medios de midazolam (un sustrato de CYP 3A4) pueden aumentar 1,5 veces (para Cmax) y 1,9 veces (para AUC). Por lo tanto, se debe tener precaución cuando se coadministre CASODEX 50 mg con sustratos de CYP 3A4.
Los estudios de unión a proteínas in vitro han demostrado que la bicalutamida puede desplazar a los anticoagulantes cumarínicos de los sitios de unión. Los tiempos de protrombina deben controlarse de cerca en pacientes que ya reciben anticoagulantes cumarínicos que comienzan con CASODEX 50 mg y puede ser necesario ajustar la dosis del anticoagulante.
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Hepatitis
Se han notificado casos de muerte u hospitalización debido a lesión hepática grave (insuficiencia hepática) después de la comercialización en asociación con el uso de CASODEX. La hepatotoxicidad en estos informes generalmente ocurrió dentro de los primeros tres a cuatro meses de tratamiento. Aproximadamente el 1 % de los pacientes de CASODEX en ensayos clínicos controlados ocurrieron hepatitis o aumentos marcados en las enzimas hepáticas que llevaron a la suspensión del medicamento.
Los niveles de transaminasas séricas deben medirse antes de comenzar el tratamiento con CASODEX, a intervalos regulares durante los primeros cuatro meses de tratamiento y periódicamente a partir de entonces. Si se presentan síntomas o signos clínicos que sugieran una disfunción hepática (p. ej., náuseas, vómitos, dolor abdominal, fatiga, anorexia, síntomas “similares a la gripe”, orina oscura, ictericia o dolor a la palpación en el cuadrante superior derecho), las transaminasas séricas, en particular la ALT sérica, debe medirse inmediatamente. Si en algún momento un paciente tiene ictericia, o si su ALT se eleva por encima de dos veces el límite superior normal, CASODEX debe suspenderse inmediatamente con un seguimiento estricto de la función hepática.
Ginecomastia y dolor de mama
En ensayos clínicos con CASODEX 150 mg como agente único para el cáncer de próstata, se informaron ginecomastia y dolor de seno en hasta el 38 % y el 39 % de los pacientes, respectivamente.
Tolerancia a la glucosa
Se ha observado una reducción en la tolerancia a la glucosa en hombres que reciben agonistas de LHRH. Esto puede manifestarse como diabetes o pérdida del control glucémico en personas con diabetes preexistente. Por lo tanto, se debe considerar la monitorización de la glucosa en sangre en pacientes que reciben CASODEX 50 mg en combinación con agonistas LHRH.
Pruebas de laboratorio
Las evaluaciones periódicas del antígeno prostático específico (PSA) en suero pueden ser útiles para monitorear la respuesta del paciente. Si los niveles de PSA aumentan durante el tratamiento con CASODEX 50 mg, se debe evaluar al paciente para determinar la progresión clínica. Para los pacientes que tienen una progresión objetiva de la enfermedad junto con un PSA elevado, se puede considerar un período sin tratamiento con antiandrógenos, mientras se continúa con el análogo de LHRH.
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( INFORMACIÓN DEL PACIENTE ).
Dosis y horario
Informe a los pacientes que la terapia con CASODEX 50 mg y el análogo de LHRH debe iniciarse al mismo tiempo y que no deben interrumpir o dejar de tomar estos medicamentos sin consultar a su proveedor de atención médica [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Hepatitis
Informe a los pacientes que CASODEX puede causar hepatitis, lo que puede resultar en insuficiencia hepática y muerte. Aconseje a los pacientes que las pruebas de función hepática deben controlarse periódicamente durante el tratamiento y que notifiquen signos y síntomas de hepatitis [ver ADVERTENCIAS Y PRECAUCIONES ].
Tolerancia a la glucosa
Informe a los pacientes que se ha notificado diabetes o pérdida del control glucémico en pacientes con diabetes preexistente durante el tratamiento con agonistas de la LHRH. Por lo tanto, se debe considerar la monitorización de la glucosa en sangre en pacientes que reciben CASODEX en combinación con agonistas de la LHRH [ver ADVERTENCIAS Y PRECAUCIONES ].
Somnolencia
Durante el tratamiento con CASODEX, se ha informado somnolencia. Aconseje a los pacientes que experimentan este síntoma que tengan cuidado al conducir o utilizar máquinas [ver REACCIONES ADVERSAS ].
fotosensibilidad
Informar a los pacientes que se han notificado casos de fotosensibilidad durante el tratamiento con CASODEX y que deben evitar la exposición directa a la luz solar excesiva oa la luz ultravioleta. Se debe considerar el uso de protector solar [ver REACCIONES ADVERSAS ].
Anticoncepción y Fertilidad
Aconseje a los pacientes masculinos con parejas femeninas con potencial reproductivo que usen métodos anticonceptivos efectivos durante el tratamiento y durante 130 días después de la última dosis de CASODEX 50 mg. Advierta a los pacientes masculinos que CASODEX puede afectar la fertilidad [ver Uso en poblaciones específicas ].
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Se realizaron estudios de carcinogenicidad oral de dos años en ratas y ratones machos y hembras a dosis de 5, 15 o 75 mg/kg/día de bicalutamida. Se identificó una variedad de efectos de órganos diana tumorales y se atribuyeron a la antiandrogenicidad de la bicalutamida, a saber, tumores de células intersticiales benignas testiculares (Leydig) en ratas macho en todos los niveles de dosis (la concentración plasmática en estado estacionario con la dosis de 5 mg/kg/día). dosis es aproximadamente 0,7 veces la exposición humana a la dosis recomendada) y adenocarcinoma uterino en ratas hembra a 75 mg/kg/día (aproximadamente 1,5 veces la exposición humana a la dosis recomendada). No hay evidencia de hiperplasia de células de Leydig en pacientes; los tumores uterinos no son relevantes para la población de pacientes indicada.
Un pequeño aumento en la incidencia de carcinoma hepatocelular en ratones macho que recibieron 75 mg/kg/día de bicalutamida (aproximadamente 4 veces la exposición humana a la dosis recomendada) y un aumento en la incidencia de adenomas benignos de células foliculares tiroideas en ratas que recibieron 5 mg/kg /día (aproximadamente 0,7 veces la exposición humana a la dosis recomendada) y superiores. Estos cambios neoplásicos fueron progresiones de cambios no neoplásicos relacionados con la inducción de enzimas hepáticas observados en estudios de toxicidad en animales. No se ha observado inducción enzimática tras la administración de bicalutamida en humanos. No hubo efectos tumorigénicos sugestivos de carcinogénesis genotóxica.
Una batería completa de pruebas de genotoxicidad tanto in vitro como in vivo (conversión de genes de levadura, Ames, E. coli, CHO/HGPRT, citogenética de linfocitos humanos, micronúcleo de ratón y pruebas citogenéticas de médula ósea de rata) ha demostrado que la bicalutamida no tiene actividad genotóxica. .
En estudios toxicológicos de dosis repetidas, se ha observado atrofia de los túbulos seminíferos de los testículos para todas las especies examinadas, que es un efecto de clase predicho con los antiandrógenos. En el estudio con ratas de 6 y 12 meses, se observó atrofia testicular en aproximadamente 2 veces la exposición humana a la dosis recomendada. En el estudio con perros de 12 meses, la incidencia de atrofia testicular se observó en aproximadamente 7 veces la exposición humana a la dosis recomendada. En ratas macho a las que se administró 250 mg/kg/día (aproximadamente 2 veces la exposición humana a la dosis recomendada), el intervalo precoital y el tiempo hasta el apareamiento exitoso aumentaron en el primer apareamiento, pero no se observaron efectos sobre la fertilidad después del apareamiento exitoso. Estos efectos se revirtieron 7 semanas después del final de un período de dosificación de 11 semanas.
Las ratas hembra que recibieron dosis de 1, 10 y 250 mg/kg/día (menos de 2 veces la exposición humana a la dosis recomendada) aumentaron la irregularidad del ciclo estral, pero no hubo efecto sobre la fertilidad.
En un estudio de desarrollo perinatal y posnatal, las crías hembras de ratas que recibieron dosis de 10 mg/kg/día (aproximadamente 0,7 veces la exposición humana a la dosis clínica recomendada) y superiores tuvieron tasas de embarazo reducidas. La administración de bicalutamida a hembras preñadas resultó en la feminización de la descendencia masculina, lo que provocó hipospadias a dosis de 10 mg/kg/día (aproximadamente 0,7 veces la exposición humana a la dosis recomendada) y superiores. Los hijos varones afectados también eran impotentes.
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
CASODEX está contraindicado para su uso en mujeres embarazadas porque puede causar daño al feto. CASODEX 50 mg no está indicado para uso en mujeres. No hay datos en humanos sobre el uso de CASODEX 50 mg en mujeres embarazadas. En estudios de reproducción animal, la administración oral de bicalutamida a ratas preñadas durante la organogénesis provocó un desarrollo anormal de los órganos reproductores en fetos machos a exposiciones de aproximadamente 0,7 a 2 veces la exposición humana a la dosis recomendada (ver Datos ).
Datos
Datos de animales
En un estudio de desarrollo embriofetal en ratas preñadas que recibieron dosis durante el período de organogénesis de los días 6 a 15 de gestación, los fetos machos redujeron la distancia anogenital a dosis de 10 mg/kg/día y superiores (aproximadamente 0,7 a 2 veces la exposición humana en la dosis recomendada).
En un estudio de desarrollo prenatal y posnatal, se administró la dosis a ratas hembra desde el día 7 al 16 de gestación y se les permitió ensuciar y criar a sus crías hasta el destete. . Se observó que las crías macho de ratas que recibieron dosis de 10 mg/kg/día (aproximadamente 0,7 veces la exposición humana a la dosis recomendada) y superiores tenían una distancia anogenital reducida.
En un estudio de desarrollo perinatal y posnatal, se administró la dosis a ratas hembra desde el día 16 de gestación hasta el día 22 de lactancia y se les permitió poner cama y criar a sus crías hasta el destete. La supervivencia y el peso de las crías durante la lactancia se redujeron en las camadas de ratas maternas que recibieron dosis de 250 mg/kg/día (aproximadamente 2 veces la exposición humana a la dosis recomendada). Se observó que las crías macho de ratas que recibieron dosis de 10 mg/kg/día (aproximadamente 0,7 veces la exposición humana a la dosis recomendada) y superiores tenían una distancia anogenital reducida, órganos sexuales secundarios más pequeños, criptorquidia e hipospadias que resultaban en una incapacidad para aparearse. y embarazar a sus parejas femeninas. Las crías hembras de ratas que recibieron dosis de 10 mg/kg/día (aproximadamente 0,7 veces la exposición humana a la dosis recomendada) y superiores tuvieron tasas de embarazo reducidas.
Lactancia
Resumen de riesgos
CASODEX 50 mg no está indicado para uso en mujeres embarazadas. No hay información disponible sobre la presencia de bicalutamida en la leche humana, o sobre los efectos en el lactante o en la producción de leche. Se ha detectado bicalutamida en leche de rata.
Hembras y machos con potencial reproductivo
Anticoncepción
machos
La terapia antiandrogénica puede causar cambios morfológicos en los espermatozoides [ver Toxicología no clínica ]. Con base en los hallazgos de los estudios de reproducción animal y su mecanismo de acción, aconseje a los pacientes masculinos con parejas femeninas con potencial reproductivo que usen métodos anticonceptivos efectivos durante el tratamiento y durante 130 días después de la dosis final de CASODEX [ver El embarazo y FARMACOLOGÍA CLÍNICA ].
Esterilidad
machos

Según estudios en animales, CASODEX 50 mg puede conducir a la inhibición de la espermatogénesis y puede afectar la fertilidad en machos con potencial reproductivo. No se han estudiado los efectos a largo plazo de CASODEX 50 mg sobre la fertilidad masculina [ver Toxicología no clínica ].
Uso pediátrico
No se ha establecido la seguridad y eficacia de CASODEX 50 mg en pacientes pediátricos.
El comprimido bucodispersable CASODEX (bicalutamida) se estudió en combinación con el comprimido bucodispersable ARIMIDEX (anastrozol) en un estudio multicéntrico, abierto, no comparativo, que evaluó la eficacia y la seguridad de este régimen combinado durante 12 meses en el tratamiento de la gonadotropina independiente. pubertad precoz en niños con pubertad precoz familiar limitada a varones, también conocida como testotoxicosis. Los pacientes se inscribieron en el estudio si tenían una edad inicial ≥2 años y un diagnóstico de testotoxicosis basado en características clínicas de pubertad precoz progresiva, agrandamiento testicular simétrico, edad ósea avanzada, niveles puberales de testosterona sérica, patrón prepuberal de secreción de gonadotropina después de una Prueba de estimulación con GnRH y ausencia de otras causas clínicas y bioquímicas de exceso de testosterona. Trece de los 14 pacientes inscritos completaron 12 meses de tratamiento combinado (un paciente se perdió durante el seguimiento). Si se desarrollaba pubertad precoz central (CPP), se debía agregar un análogo de LHRH. Cuatro pacientes fueron diagnosticados con CPP durante el estudio de 12 meses y recibieron tratamiento con análogos de LHRH y 2 pacientes adicionales fueron diagnosticados al final de los 12 meses y recibieron tratamiento posteriormente. Las características medias ± DE al inicio del estudio fueron las siguientes: edad cronológica: 3,9 ± 1,9 años; edad ósea 8,8±2,5; relación edad ósea/edad cronológica: 2,06±0,51; tasa de crecimiento (cm/año): 10,81±4,22; puntuación de desviación estándar de la tasa de crecimiento (SDS): 0,41 ± 1,36.
La dosis inicial de CASODEX fue de 12,5 mg. CASODEX se ajustó en cada paciente hasta que la concentración plasmática mínima de R-bicalutamida (el isómero activo de bicalutamida) en estado estacionario alcanzó 5-15 mcg/mL, que es el rango de concentraciones terapéuticas alcanzadas en adultos con cáncer de próstata luego de la administración del actual dosis aprobada de CASODEX de 50 mg. La dosis diaria inicial de anastrozol fue de 0,5 mg. El anastrozol se tituló de forma independiente en cada paciente hasta que alcanzó una concentración sérica de estradiol en el estado estacionario de
El análisis de eficacia principal del estudio fue evaluar el cambio en la tasa de crecimiento después de 12 meses de tratamiento, en relación con la tasa de crecimiento durante los ≥6 meses anteriores al ingreso al estudio. Las tasas de crecimiento previas al estudio se obtuvieron retrospectivamente. No hubo evidencia estadística de que la tasa de crecimiento se redujera durante el tratamiento. Durante el tratamiento con CASODEX/ARIMIDEX, la tasa media de crecimiento (cm/año) disminuyó 1,6 cm/año, IC del 95 % (-4,7 a 1,5) p=0,28; la tasa media de crecimiento SDS disminuyó en 0,1 SD, IC del 95 % (–1,2 a 1,0) p=0,88. La Tabla 2 muestra los datos descriptivos de las tasas de crecimiento para la población general y para los subgrupos definidos por antecedentes de tratamiento previo para testotoxicosis con ketoconazol, espironolactona, anastrozol u otros inhibidores de la aromatasa.
Las concentraciones de testosterona total aumentaron en una media de 5 mmol/l durante los 12 meses de tratamiento desde una media inicial de 10 mmol/l. Las concentraciones de estradiol estaban en el nivel de cuantificación o por debajo de este (9,81 pmol/l) en 11 de 12 pacientes después de 12 meses de tratamiento. Seis de los 12 pacientes iniciaron el tratamiento con una concentración de estradiol por debajo del nivel de cuantificación.
No hubo muertes, eventos adversos graves o interrupciones debido a eventos adversos durante el estudio. De los 14 pacientes expuestos al tratamiento del estudio, 13 (92,9 %) experimentaron al menos un evento adverso. Los eventos adversos informados con mayor frecuencia (>3 pacientes) fueron ginecomastia (7/14, 50 %), pubertad precoz central (6/14, 43 %), vómitos (5/14, 36 %), dolor de cabeza (3/14, 21 %), pirexia (3/14, 21 %) e infección del tracto respiratorio superior (3/14, 21 %). Las reacciones adversas que los investigadores consideraron posiblemente relacionadas con bicalutamida incluyeron ginecomastia (6/14, 43 %), pubertad precoz central (2/14, 14 %), sensibilidad mamaria (2/14, 14 %), dolor mamario (1/14, 7 %), astenia (1/14, 7 %), alanina aminotransferasa elevada [ALT] (1/14, 7 %), aspartato aminotransferasa elevada [AST] (1/14, 7 %) y dolor torácico musculoesquelético (1 /14, 7%). El dolor de cabeza fue la única reacción adversa que los investigadores consideraron posiblemente relacionada con el anastrozol. Para el paciente que desarrolló ALT y AST elevadas, la elevación fue
Uso geriátrico
En dos estudios en pacientes que recibieron 50 o 150 mg diarios, no se demostró una relación significativa entre la edad y los niveles en estado estacionario de bicalutamida total o del enantiómero R activo.
Deterioro hepático
CASODEX debe utilizarse con precaución en pacientes con insuficiencia hepática de moderada a grave. CASODEX se metaboliza extensamente en el hígado. Los datos limitados en sujetos con insuficiencia hepática grave sugieren que la excreción de CASODEX puede retrasarse y podría dar lugar a una mayor acumulación. Se deben considerar pruebas periódicas de función hepática para pacientes con insuficiencia hepática en terapia a largo plazo [ver ADVERTENCIAS Y PRECAUCIONES ].
No se observaron diferencias clínicamente significativas en la farmacocinética de cualquiera de los enantiómeros de bicalutamida en pacientes con enfermedad hepática de leve a moderada en comparación con los controles sanos. Sin embargo, la vida media del enantiómero R aumentó aproximadamente un 76 % (5,9 y 10,4 días para pacientes normales y con insuficiencia, respectivamente) en pacientes con enfermedad hepática grave (n=4).
Insuficiencia renal
La insuficiencia renal (medida por el aclaramiento de creatinina) no tuvo un efecto significativo sobre la eliminación de la bicalutamida total o del enantiómero R activo.
SOBREDOSIS
Se han realizado ensayos clínicos a largo plazo con dosis de hasta 200 mg de CASODEX 50 mg al día y estas dosis han sido bien toleradas. No se ha establecido una dosis única de CASODEX 50 mg que provoque síntomas de sobredosis que se consideren potencialmente mortales.
No hay un antídoto especifico; el tratamiento de una sobredosis debe ser sintomático.
En el manejo de una sobredosis con CASODEX 50 mg, se puede inducir el vómito si el paciente está alerta. Cabe recordar que, en esta población de pacientes, es posible que se hayan tomado múltiples fármacos. No es probable que la diálisis sea útil ya que CASODEX se une en gran medida a las proteínas y se metaboliza extensamente. Está indicada la atención de apoyo general, incluida la monitorización frecuente de los signos vitales y la observación estrecha del paciente.
CONTRAINDICACIONES
Casodex está contraindicado en:
Hipersensibilidad
CASODEX 50 mg está contraindicado en cualquier paciente que haya mostrado una reacción de hipersensibilidad al medicamento oa cualquiera de los componentes de la tableta. Se han informado reacciones de hipersensibilidad que incluyen edema angioneurótico y urticaria.
Mujeres
CASODEX 50 mg no tiene indicación para mujeres y no debe usarse en esta población.
El embarazo
CASODEX 50 mg puede causar daño fetal cuando se administra a una mujer embarazada [ver Uso en poblaciones específicas ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
CASODEX 50 mg es un inhibidor del receptor de andrógenos no esteroideo. Inhibe de manera competitiva la acción de los andrógenos al unirse a los receptores de andrógenos del citosol en el tejido objetivo. Se sabe que el carcinoma prostático es sensible a los andrógenos y responde al tratamiento que contrarresta el efecto de los andrógenos y/o elimina la fuente de andrógenos.
Cuando CASODEX 50 mg se combina con la terapia con análogos de LHRH, la supresión de la testosterona sérica inducida por el análogo de LHRH no se ve afectada. Sin embargo, en ensayos clínicos con CASODEX como agente único para el cáncer de próstata, se observaron aumentos en la testosterona y el estradiol séricos.
En un subgrupo de pacientes que han sido tratados con CASODEX y un agonista de la LHRH, y que interrumpen el tratamiento con CASODEX de 50 mg debido al cáncer de próstata avanzado progresivo, se puede observar una reducción del antígeno prostático específico (PSA) y/o una mejoría clínica (fenómeno de abstinencia de antiandrógenos). observado.
Farmacocinética
Absorción
La bicalutamida se absorbe bien después de la administración oral, aunque se desconoce la biodisponibilidad absoluta. La coadministración de bicalutamida con alimentos no tiene un efecto clínicamente significativo sobre la velocidad o el grado de absorción.
Distribución
La bicalutamida se une en gran medida a las proteínas (96 %) [ver INTERACCIONES CON LA DROGAS ].
Metabolismo/Eliminación
La bicalutamida sufre un metabolismo estereoespecífico. El isómero S (inactivo) se metaboliza principalmente por glucuronidación. El isómero R (activo) también sufre glucuronidación pero se oxida predominantemente a un metabolito inactivo seguido de glucuronidación. Tanto los glucurónidos originales como los metabolitos se eliminan en la orina y las heces. El enantiómero S se elimina rápidamente en relación con el enantiómero R, y el enantiómero R representa aproximadamente el 99% de los niveles plasmáticos totales en estado estacionario.
La farmacocinética del enantiómero activo de CASODEX 50 mg en hombres normales y pacientes con cáncer de próstata se presenta en la Tabla 3.
Estudios clínicos
CASODEX 50 mg diarios en combinación con un LHRH-A
En un ensayo clínico multicéntrico, doble ciego, controlado, 813 pacientes con cáncer de próstata avanzado sin tratamiento previo fueron aleatorizados para recibir CASODEX 50 mg una vez al día (404 pacientes) o flutamida 250 mg (409 pacientes) tres veces al día, cada uno en combinación con análogos de LHRH (ya sea implante de acetato de goserelina o depósito de acetato de leuprolida).
En un análisis realizado después de alcanzar una mediana de seguimiento de 160 semanas, 213 (52,7 %) pacientes tratados con terapia con análogos de CASODEX-LHRH y 235 (57,5 %) pacientes tratados con terapia con análogos de flutamida-LHRH habían muerto. No hubo diferencia significativa en la supervivencia entre los grupos de tratamiento (ver Figura 1). El cociente de riesgos instantáneos para el tiempo hasta la muerte (supervivencia) fue de 0,87 (intervalo de confianza del 95%: 0,72 a 1,05).
Figura 1 - La probabilidad de muerte de Kaplan-Meier para ambos grupos de tratamiento antiandrógeno. 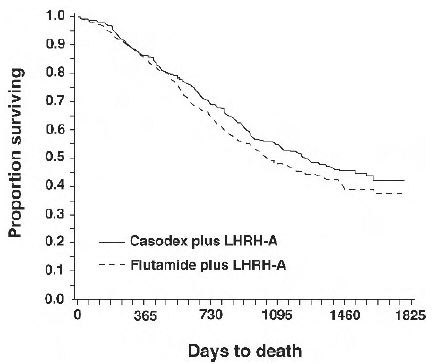
No hubo una diferencia significativa en el tiempo hasta la progresión objetiva del tumor entre los grupos de tratamiento (consulte la Figura 2). La progresión objetiva del tumor se definió como la aparición de cualquier metástasis ósea o el empeoramiento de cualquier metástasis ósea existente en la gammagrafía ósea atribuible a la enfermedad metastásica, o un aumento del 25 % o más de cualquier metástasis extraesquelética medible existente. El cociente de riesgos instantáneos para el tiempo hasta la progresión de CASODEX más análogo de LHRH con respecto a flutamida más análogo de LHRH fue de 0,93 (intervalo de confianza del 95 %, 0,79 a 1,10).
Figura 2 - Curva de Kaplan-Meier para el tiempo hasta la progresión para ambos grupos de tratamiento con antiandrógenos. 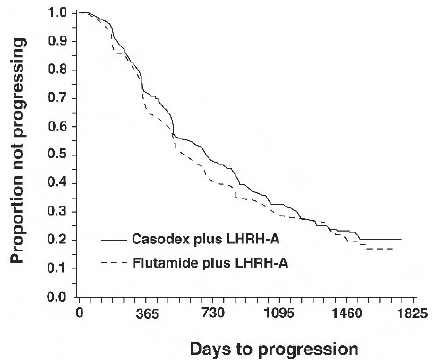
La calidad de vida se evaluó con cuestionarios autoadministrados de los pacientes sobre dolor, funcionamiento social, bienestar emocional, vitalidad, limitación de la actividad, discapacidad en la cama, salud general, capacidad física, síntomas generales y síntomas relacionados con el tratamiento. La evaluación de los cuestionarios de calidad de vida no indicó diferencias significativas consistentes entre los dos grupos de tratamiento.
Datos de seguridad de estudios clínicos con CASODEX 150 mg
CASODEX 150 mg no está aprobado para uso solo o con otros tratamientos.
Se realizaron dos ensayos multicéntricos, aleatorizados y abiertos idénticos que compararon CASODEX 150 mg diarios en monoterapia con la castración en pacientes con cáncer de próstata localmente avanzado (T3-4, NX, M0) o metastásico (M1).
Monoterapia – Grupo M1
CASODEX 150 mg diarios no está aprobado para su uso en pacientes con cáncer de próstata M1. Sobre la base de un análisis intermedio de los dos ensayos de supervivencia, la Junta de Supervisión de la Seguridad de los Datos recomendó suspender el tratamiento con CASODEX en los pacientes M1 porque el riesgo de muerte era del 25 % (HR 1,25, IC del 95 %: 0,87 a 1,81) y del 31 % ( HR 1,31, IC del 95 %: 0,97 a 1,77) mayor en el grupo tratado con CASODEX 50 mg en comparación con el grupo castrado, respectivamente.
Grupo localmente avanzado (T3-4, NX, M0)
CASODEX 150 mg diarios no está aprobado para su uso en pacientes con cáncer de próstata localmente avanzado (T3-4, NX, M0). Después de la interrupción de todos los pacientes M1, los ensayos continuaron con los pacientes T3-4, NX, M0 hasta la finalización del estudio. En el ensayo más grande (N=352), el riesgo de muerte fue un 25 % (HR 1,25, IC del 95 %: 0,92 a 1,71) más alto en el grupo CASODEX y en el ensayo más pequeño (N=140), el riesgo de muerte fue 36 % (HR 0,64, IC del 95 %, 0,39 a 1,03) menor en el grupo de CASODEX 50 mg.
Además de los dos estudios anteriores, hay otros tres estudios clínicos en curso que brindan información de seguridad adicional para CASODEX 150 mg, una dosis que no está aprobada para su uso. Estos son tres ensayos multicéntricos, aleatorizados, doble ciego, de grupos paralelos que comparan CASODEX 150 mg diarios en monoterapia (adyuvante a la terapia previa o en espera vigilante) con placebo, para la muerte o el tiempo hasta la progresión de la enfermedad, en una población de 8113 pacientes con cáncer de próstata localizado o localmente avanzado.
CASODEX 150 mg diarios no está aprobado para su uso como terapia para pacientes con cáncer de próstata localizado que son candidatos para conducta expectante. Los datos de un análisis de subgrupos planificado de dos de estos ensayos en 1627 pacientes con cáncer de próstata localizado que estaban en espera vigilante revelaron una tendencia hacia una menor supervivencia en el brazo de CASODEX después de una mediana de seguimiento de 7,4 años. Hubo 294 (37,7 %) muertes en los pacientes tratados con CASODEX frente a 279 (32,9 %) muertes en los pacientes tratados con placebo (grupo de espera vigilante localizada) para un cociente de riesgos instantáneos de 1,16 (IC del 95 %: 0,99 a 1,37).
INFORMACIÓN DEL PACIENTE
CASODEX® [cas–o–dex] (bicalutamida) Tableta
Lea esta información para el paciente antes de comenzar a tomar CASODEX 50 mg y cada vez que renueve su receta. Es posible que haya nueva información. Este folleto no reemplaza la conversación con su proveedor de atención médica sobre su condición médica o su tratamiento.
¿Qué es CASODEX 50mg?
CASODEX es un medicamento recetado llamado inhibidor del receptor de andrógenos, que se usa en combinación con medicamentos de la hormona liberadora de hormona luteinizante (LHRH) para tratar el cáncer de próstata metastásico en etapa D2.
CASODEX no es para uso en mujeres.
No se sabe si CASODEX es seguro y efectivo en niños.
¿Quién no debe tomar CASODEX 50mg?
No tome CASODEX 50 mg si usted:
- eres una mujer
- está embarazada o puede quedar embarazada. CASODEX puede dañar a su bebé por nacer.
- es alérgico a alguno de los ingredientes de CASODEX. Consulte el final de este folleto para obtener una lista completa de los ingredientes de CASODEX. Busque ayuda médica de inmediato si tiene alguno de los siguientes síntomas de una reacción alérgica: picazón, urticaria (protuberancias), hinchazón de la cara, los labios o la lengua, dificultad para respirar o tragar.
¿Qué debo decirle a mi proveedor de atención médica antes de tomar CASODEX?
Antes de tomar CASODEX 50 mg, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si:
- tiene problemas hepáticos.
- tomar un medicamento para diluir la sangre. Pregúntele a su proveedor de atención médica o farmacéutico si no está seguro de si su medicamento es un anticoagulante.
- tiene diabetes (se ha notificado un control deficiente del azúcar en sangre en personas que toman CASODEX en combinación con medicamentos LHRH).
- tener una pareja embarazada o que pueda quedar embarazada. Debe usar métodos anticonceptivos efectivos mientras esté tomando CASODEX 50 mg y durante 130 días después de dejar de tomar CASODEX. Hable con su médico si tiene alguna pregunta sobre el control de la natalidad.
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos a base de hierbas. CASODEX 50 mg y otros medicamentos pueden afectarse entre sí y causar efectos secundarios. CASODEX puede afectar el funcionamiento de otros medicamentos, y otros medicamentos pueden afectar el funcionamiento de CASODEX 50 mg.
Conozca los medicamentos que toma. Mantenga una lista de sus medicamentos con usted para mostrársela a sus proveedores de atención médica cuando obtenga un nuevo medicamento.
¿Cómo debo tomar CASODEX 50mg?
- Tome CASODEX exactamente como se lo indique su proveedor de atención médica.
- Tome CASODEX a la misma hora todos los días.
- Su tratamiento con CASODEX 50 mg debe comenzar al mismo tiempo que su tratamiento con el medicamento LHRH.
- Si olvida una dosis, no tome una dosis adicional, tome la siguiente dosis a la hora habitual. No tome 2 dosis al mismo tiempo.
- CASODEX 50 mg se puede tomar con o sin alimentos.
- Si toma demasiado CASODEX, llame a su proveedor de atención médica o al centro de toxicología o vaya de inmediato a la sala de emergencias del hospital más cercano.
- No deje de tomar CASODEX a menos que su proveedor de atención médica se lo indique.
- Su proveedor de atención médica puede realizar análisis de sangre mientras toma CASODEX.
- Su cáncer de próstata puede empeorar mientras toma CASODEX en combinación con medicamentos LHRH.
El control regular de su cáncer de próstata con su proveedor de atención médica es importante para determinar si su enfermedad empeora.
¿Qué debo evitar mientras tomo casodex 50 mg?
No conduzca, opere maquinaria ni realice otras actividades peligrosas hasta que sepa cómo le afecta CASODEX.
Algunas personas han tenido sensibilidad de la piel a la luz solar mientras tomaban CASODEX. Debe evitar la luz solar o las lámparas solares y las camas de bronceado y considerar el uso de protector solar mientras recibe tratamiento con CASODEX.
¿Cuáles son los posibles efectos secundarios de CASODEX 50mg?
CASODEX puede causar efectos secundarios graves, que incluyen:
- Problemas hepáticos, incluida la insuficiencia hepática que puede necesitar tratamiento en un hospital o que puede provocar la muerte. Su proveedor de atención médica debe realizar análisis de sangre para verificar su función hepática antes y durante el tratamiento con CASODEX. Informe a su proveedor de atención médica de inmediato si tiene alguno de estos síntomas de un problema hepático durante el tratamiento:
- coloración amarillenta de la piel y los ojos (ictericia)
- orina oscura
- dolor de estomago superior derecho
- náuseas
- vómitos
- cansancio
- pérdida de apetito
- escalofríos
- fiebre
- Dificultad para respirar con o sin tos o fiebre. Algunas personas que toman CASODEX 50 mg desarrollan una inflamación en los pulmones llamada enfermedad pulmonar intersticial.
- Una reacción alérgica. Los síntomas de una reacción alérgica incluyen: picazón en la piel, urticaria (protuberancias), hinchazón de la cara, labios, lengua, garganta o dificultad para tragar.
- Agrandamiento de los senos (ginecomastia) y dolor en los senos.
- Puede ocurrir un control deficiente del azúcar en la sangre en personas que toman CASODEX 50 mg en combinación con medicamentos LHRH. Su proveedor de atención médica puede controlar su nivel de azúcar en la sangre durante la terapia con CASODEX de 50 mg.
Los efectos secundarios más comunes de CASODEX 50 mg incluyen:
- sofocos, o períodos cortos de sensación de calor y sudoración
- dolor en todo el cuerpo en la espalda, la pelvis, el estómago
- sintiéndose débil
- estreñimiento
- infección
- náuseas
- hinchazón en los tobillos, las piernas o los pies
- Diarrea
- sangre en tu orina
- despertarse del sueño para orinar por la noche
- una disminución de los glóbulos rojos (anemia)
- sintiéndose mareado
Informe a su proveedor de atención médica si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de CASODEX. Para obtener más información, consulte a su proveedor de atención médica o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar CASODEX?
Guarde CASODEX a temperatura ambiente entre 68 °F y 77 °F (20 °C y 25 °C).
Mantenga CASODEX 50 mg y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de CASODEX.
A veces, los medicamentos se prescriben para fines distintos a los enumerados en el prospecto de información para el paciente. No use CASODEX para una condición para la cual no fue recetado. No le dé CASODEX 50 mg a otras personas, incluso si tienen los mismos síntomas que usted tiene. Puede que les haga daño.
Este folleto de información para el paciente resume la información más importante sobre CASODEX. Si desea obtener más información sobre CASODEX, hable con su proveedor de atención médica. Puede pedirle a su proveedor de atención médica o farmacéutico información sobre CASODEX escrita para profesionales de la salud. Para obtener más información, visite www.CASODEX.com o llame al 1-800-236-9933.
¿Cuáles son los ingredientes de CASODEX 50mg?
Ingrediente activo: bicalutamida.
Ingredientes inactivos: lactosa, estearato de magnesio, hipromelosa, polietilenglicol, polividona, glicolato de almidón de sodio, dióxido de titanio.
Esta información para el paciente ha sido aprobada por la Administración de Drogas y Alimentos de los Estados Unidos.
