Ceftin 250mg, 500mg, 125mg Cefuroxime Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Ceftin 500 mg y cómo se usa?
Ceftin 500 mg es un medicamento recetado que se usa para tratar los síntomas de infecciones bacterianas. Ceftin se puede usar solo o con otros medicamentos.
Ceftin 250 mg es un antibiótico de cefalosporina.
No se sabe si Ceftin es seguro y efectivo en niños menores de 3 meses de edad.
¿Cuáles son los posibles efectos secundarios de Ceftin?
Ceftin 250 mg puede causar efectos secundarios graves, que incluyen:
- dolor de estómago severo,
- diarrea (con o sin sangre),
- coloración amarillenta de la piel o los ojos,
- erupción cutanea,
- hematomas,
- hormigueo intenso o entumecimiento,
- convulsiones (convulsiones),
- micción difícil o dolorosa,
- hinchazón en los pies, tobillos, cara o lengua,
- cansancio,
- dificultad para respirar,
- fiebre,
- dolor de garganta,
- ardiendo en tus ojos,
- dolor en la piel con una erupción roja o morada,
- ampollas y descamación de la piel
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Ceftin incluyen:
- Diarrea,
- náuseas,
- vómitos,
- sabor inusual o desagradable en la boca,
- dermatitis del pañal en un bebé,
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Ceftin. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
Los comprimidos de CEFTIN de 500 mg y CEFTIN para suspensión oral contienen cefuroxima como cefuroxima axetilo. CEFTIN es un fármaco antibacteriano de cefalosporina semisintético para administración oral.
El nombre químico de cefuroxima axetil (1-(acetiloxi) etil éster de cefuroxima) es (RS)-1-hidroxietilo (6R,7R)-7-[2-(2-furil)glioxil-amido]-3-(hidroximetil )-8-oxo-5-tia-1-azabiciclo[4.2.0]-oct-2-eno-2-carboxilato, 72-(Z)-(O-metil-oxima), 1-acetato 3-carbamato. Su fórmula molecular es C20H22N4O10S y tiene un peso molecular de 510,48.
Cefuroxima axetil está en forma amorfa y tiene la siguiente fórmula estructural:
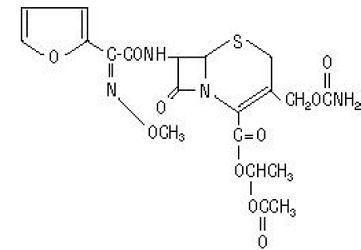
Los comprimidos están recubiertos con película y contienen el equivalente a 250 o 500 mg de cefuroxima como cefuroxima axetilo. Las tabletas contienen los ingredientes inactivos dióxido de silicio coloidal, croscarmelosa de sodio, aceite vegetal hidrogenado, hipromelosa, metilparabeno, celulosa microcristalina, propilenglicol, propilparabeno, benzoato de sodio, lauril sulfato de sodio y dióxido de titanio.
La suspensión oral, cuando se reconstituye con agua, proporciona el equivalente a 125 mg o 250 mg de cefuroxima (como cefuroxima axetilo) por 5 ml. La suspensión oral contiene los ingredientes inactivos acesulfamo de potasio, aspartamo, povidona K30, ácido esteárico, sacarosa, saborizante de tutti-frutti y goma de xantano.
INDICACIONES
Faringitis/Amigdalitis
Los comprimidos de 125 mg de CEFTIN están indicados para el tratamiento de pacientes adultos y pacientes pediátricos (a partir de los 13 años) con faringitis/amigdalitis de leve a moderada causada por cepas sensibles de Streptococcus pyogenes.
CEFTIN 500 mg para suspensión oral está indicado para el tratamiento de pacientes pediátricos de 3 meses a 12 años con faringitis/amigdalitis de leve a moderada causada por cepas sensibles de Streptococcus pyogenes.
Limitaciones de uso
- La eficacia de CEFTIN en la prevención de la fiebre reumática no se estableció en ensayos clínicos.
- La eficacia de CEFTIN 125 mg en el tratamiento de cepas de Streptococcus pyogenes resistentes a la penicilina no ha sido demostrada en ensayos clínicos.
Otitis media bacteriana aguda
Los comprimidos de 125 mg de CEFTIN están indicados para el tratamiento de pacientes pediátricos (que pueden tragar los comprimidos enteros) con otitis media bacteriana aguda causada por cepas sensibles de Streptococcus pneumoniae, Haemophilus influenzae (incluidas las cepas productoras de β-lactamasa), Moraxella catarrhalis (incluidas las cepas de β-lactamasa). -cepas productoras), o Streptococcus pyogenes.
CEFTIN para suspensión oral está indicado para el tratamiento de pacientes pediátricos de 3 meses a 12 años con otitis media bacteriana aguda causada por cepas sensibles de Streptococcus pneumoniae, Haemophilus influenzae (incluyendo cepas productoras de β-lactamasa), Moraxella catarrhalis (incluyendo β-lactamasa -cepas productoras), o Streptococcus pyogenes.
Sinusitis maxilar bacteriana aguda
Los comprimidos de CEFTIN están indicados para el tratamiento de pacientes adultos y pediátricos (13 años y mayores) con sinusitis maxilar bacteriana aguda de leve a moderada causada por cepas sensibles de Streptococcus pneumoniae o Haemophilus influenzae (cepas no productoras de β-lactamasa únicamente).
CEFTIN 250 mg para suspensión oral está indicado para el tratamiento de pacientes pediátricos de 3 meses a 12 años con sinusitis maxilar bacteriana aguda de leve a moderada causada por cepas sensibles de Streptococcus pneumoniae o Haemophilus influenzae (cepas no productoras de β-lactamasa únicamente) .
Limitaciones de uso
No se estableció la eficacia de CEFTIN para las infecciones de los senos paranasales causadas por Haemophilus influenzae o Moraxella catarrhalis productoras de β-lactamasas en pacientes con sinusitis maxilar bacteriana aguda debido al número insuficiente de estos aislamientos en los ensayos clínicos [ver Estudios clínicos ].
Exacerbaciones bacterianas agudas de la bronquitis crónica
Los comprimidos de CEFTIN están indicados para el tratamiento de pacientes adultos y pacientes pediátricos (mayores de 13 años) con exacerbaciones bacterianas agudas de leves a moderadas de bronquitis crónica causadas por cepas sensibles de Streptococcus pneumoniae, Haemophilus influenzae (cepas negativas a β-lactamasa), o Haemophilus para influenzae (cepas negativas a β-lactamasa).
Infecciones de la piel y de la estructura de la piel no complicadas
Los comprimidos de CEFTIN de 250 mg están indicados para el tratamiento de pacientes adultos y pacientes pediátricos (a partir de 13 años) con infecciones de la piel y de la estructura de la piel sin complicaciones causadas por cepas sensibles de Staphylococcus aureus (incluidas las cepas productoras de β-lactamasa) o Streptococcus pyogenes.
Infecciones del tracto urinario no complicadas
Los comprimidos de CEFTIN de 500 mg están indicados para el tratamiento de pacientes adultos y pacientes pediátricos (mayores de 13 años) con infecciones del tracto urinario sin complicaciones causadas por cepas sensibles de Escherichia coli o Klebsiella pneumoniae.
Gonorrea sin complicaciones
Los comprimidos de CEFTIN están indicados para el tratamiento de pacientes adultos y pacientes pediátricos (a partir de los 13 años) con gonorrea uretral y endocervical no complicada, causada por cepas sensibles productoras y no productoras de penicilinasa de Neisseria gonorrhoeae y gonorrea rectal no complicada en mujeres. , causada por cepas sensibles de Neisseria gonorrhoeae no productoras de penicilinasa.
Enfermedad de Lyme temprana (eritema migrans)
Los comprimidos de CEFTIN están indicados para el tratamiento de pacientes adultos y pacientes pediátricos (mayores de 13 años) con enfermedad de Lyme temprana (eritema migratorio) causada por cepas sensibles de Borrelia burgdorferi.
Impétigo
CEFTIN 250 mg para suspensión oral está indicado para el tratamiento de pacientes pediátricos de 3 meses a 12 años con impétigo causado por cepas sensibles de Staphylococcus aureus (incluidas las cepas productoras de plactamasa) o Streptococcus pyogenes.
Uso
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de CEFTIN y otros medicamentos antibacterianos, CEFTIN 500 mg debe usarse solo para tratar o prevenir infecciones que se compruebe o se sospeche que son causadas por bacterias susceptibles. Cuando la información de cultivo y susceptibilidad esté disponible, se debe considerar al seleccionar o modificar la terapia antibacteriana. En ausencia de tales datos, la epidemiología local y los patrones de susceptibilidad pueden contribuir a la selección empírica de la terapia.
DOSIFICACIÓN Y ADMINISTRACIÓN
Instrucciones de administración importantes
- Las tabletas de CEFTIN y la suspensión oral de CEFTIN no son bioequivalentes y, por lo tanto, no son sustituibles en una base de miligramo por miligramo [ver FARMACOLOGÍA CLÍNICA ].
- Administre las tabletas o la suspensión oral de CEFTIN como se describe en las pautas de dosificación apropiadas [ver Dosis de CEFTIN 500mg Tabletas, Dosis de CEFTIN 250mg Para Suspensión Oral y Preparación Y Administración De CEFTIN 125mg Para Suspensión Oral ].
- Administre las tabletas de 500 mg de CEFTIN con o sin alimentos.
- Administrar CEFTIN 500 mg para suspensión oral con alimentos.
- Los pacientes pediátricos (mayores de 13 años) que no pueden tragar las tabletas de CEFTIN de 125 mg enteras deben recibir CEFTIN para suspensión oral porque la tableta tiene un sabor amargo fuerte y persistente cuando se tritura [ver Dosis de CEFTIN Tabletas ].
Dosis para CEFTIN 500mg Tabletas
Administre las tabletas de 250 mg de CEFTIN como se describe en la tabla de pautas de dosificación a continuación con o sin alimentos.
Dosis de CEFTIN para suspensión oral
Administre CEFTIN para suspensión oral como se describe en la siguiente tabla de pautas de dosificación con alimentos.
Preparación y administración de CEFTIN para suspensión oral
Prepare una suspensión en el momento de la dispensación de la siguiente manera:
- Agite bien la suspensión oral antes de cada uso.
- Vuelva a colocar la tapa de forma segura después de cada apertura.
- Guarde la suspensión reconstituida refrigerada entre 2° y 8°C (36° y 46°F).
- Desechar la suspensión reconstituida después de 10 días.
Posología en pacientes con insuficiencia renal
Se requiere un ajuste del intervalo de dosis para los pacientes cuyo aclaramiento de creatinina es inferior a 30 ml/min, como se indica en la Tabla 4 a continuación, porque la cefuroxima se elimina principalmente por vía renal [ver FARMACOLOGÍA CLÍNICA ].
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Los comprimidos de CEFTIN son comprimidos recubiertos con película de color blanco, en forma de cápsula, disponibles en las siguientes concentraciones:
- 250 mg de cefuroxima (como cefuroxima axetil) con "GX ES7" grabado en un lado y en blanco en el otro lado.
- 500 mg de cefuroxima (como cefuroxima axetilo) con "GX EG2" grabado en un lado y en blanco en el otro lado.
CEFTIN para suspensión oral se presenta en forma de polvo seco, de color blanco a blanquecino, con sabor a tutti-frutti. Cuando se reconstituye según las indicaciones, la suspensión proporciona el equivalente a 125 mg o 250 mg de cefuroxima (como cefuroxima axetilo) por 5 ml.
Almacenamiento y manipulación
Los comprimidos de CEFTIN, 250 mg de cefuroxima (como cefuroxima axetil), son comprimidos recubiertos con película, en forma de cápsula, blancos, grabados con "GX ES7" en un lado y en blanco en el otro lado de la siguiente manera: 20 comprimidos/frasco CDN 0173-0387-00
Los comprimidos de CEFTIN, 500 mg de cefuroxima (como cefuroxima axetilo), son comprimidos recubiertos con película, blancos, en forma de cápsula, grabados con "GX EG2" en un lado y en blanco en el otro lado de la siguiente manera: 20 comprimidos/frasco CDN 0173-0394-00
Guarde las tabletas entre 15° y 30°C (59° y 86°F). Vuelva a colocar la tapa de forma segura después de cada apertura.
CEFTIN 500 mg para suspensión oral se presenta como un polvo seco, de color blanco a blanquecino, con sabor a tutti-frutti. Cuando se reconstituye según las indicaciones, la suspensión proporciona el equivalente a 125 mg o 250 mg de cefuroxima (como cefuroxima axetilo) por 5 ml. Se presenta en frascos de vidrio color ámbar de la siguiente manera:
125 mg/5 ml
Suspensión de 100 ml CDN 0173-0740-00
250 mg/5 ml
Suspensión de 50 ml CDN 0173-0741-10 Suspensión de 100 ml CDN 0173-0741-00
Antes de la reconstitución, almacene el polvo seco entre 2° y 30°C (36° y 86°F).
Después de la reconstitución, almacene inmediatamente la suspensión refrigerada entre 2° y 8°C (36° y 46°F). DESECHAR DESPUÉS DE 10 DÍAS.
GlaxoSmithKline, Research Triangle Park, NC 27709. Revisado: octubre de 2017
EFECTOS SECUNDARIOS
La siguiente reacción adversa grave y de otro modo importante se describe con mayor detalle en la sección de Advertencias y Precauciones de la etiqueta:
Reacciones anafilácticas [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
tabletas
Regímenes de dosificación de dosis múltiples con una duración de 7 a 10 días
En ensayos clínicos de dosis múltiples, 912 sujetos fueron tratados con CEFTIN (125 a 500 mg dos veces al día). Se observa que 125 mg dos veces al día no es una dosis aprobada. Veinte (2,2%) sujetos suspendieron la medicación debido a reacciones adversas. Diecisiete (85%) de los 20 sujetos que interrumpieron el tratamiento lo hicieron debido a trastornos gastrointestinales, como diarrea, náuseas, vómitos y dolor abdominal. El porcentaje de sujetos tratados con CEFTIN que interrumpieron el fármaco del estudio debido a reacciones adversas fue similar con dosis diarias de 1000, 500 y 250 mg (2,3 %, 2,1 % y 2,2 %, respectivamente). Sin embargo, la incidencia de reacciones adversas gastrointestinales aumentó con las dosis más altas recomendadas.
Las reacciones adversas en la Tabla 5 son para sujetos (n = 912) tratados con CEFTIN 250 mg en ensayos clínicos de dosis múltiples.
Las siguientes reacciones adversas ocurrieron en menos del 1 % pero en más del 0,1 % de los sujetos (n = 912) tratados con CEFTIN en ensayos clínicos de dosis múltiples.
Trastornos del sistema inmunológico Urticaria, lengua hinchada.
Trastornos del metabolismo y la nutrición : Anorexia.
Trastornos del sistema nervioso : Dolor de cabeza.
Trastornos cardíacos : Dolor de pecho.
Desórdenes respiratorios : Dificultad para respirar.
Desórdenes gastrointestinales : Dolor abdominal, calambres abdominales, flatulencia, indigestión, úlceras bucales.
Trastornos de la piel y del tejido subcutáneo : Erupción, picazón.
Trastornos renales y urinarios : Disuria.
Trastornos del sistema reproductivo y de la mama : Vaginitis, picor vulvar.
Desordenes generales y condiciones administrativas del sitio : Escalofríos, somnolencia, sed.
Investigaciones : Prueba de Coombs positiva.
Enfermedad de Lyme temprana con régimen de 20 días
Dos ensayos multicéntricos evaluaron CEFTIN 500 mg dos veces al día durante 20 días. Las experiencias adversas relacionadas con el medicamento más comunes fueron diarrea (10,6 %), reacción de Jarisch-Herxheimer (5,6 %) y vaginitis (5,4 %). Otras experiencias adversas ocurrieron con frecuencias comparables a las reportadas con dosis de 7 a 10 días.
Régimen de dosis única para la gonorrea no complicada
En ensayos clínicos que utilizaron una dosis única de 1000 mg de CEFTIN 250 mg, 1061 sujetos fueron tratados por gonorrea sin complicaciones. Las reacciones adversas en la Tabla 6 fueron para sujetos tratados con una dosis única de 1000 mg de CEFTIN en ensayos clínicos en EE. UU.
Las siguientes reacciones adversas ocurrieron en menos del 1 % pero en más del 0,1 % de los sujetos (n = 1061) tratados con una dosis única de CEFTIN de 1000 mg para la gonorrea no complicada en ensayos clínicos en EE. UU.
Infecciones e Infestaciones : Candidiasis vaginal.
Trastornos del sistema nervioso : Dolor de cabeza, mareos, somnolencia.
Trastornos cardíacos : Opresión/dolor en el pecho, taquicardia.
Desórdenes gastrointestinales : Dolor abdominal, dispepsia.
Trastornos de la piel y del tejido subcutáneo : Eritema, exantema, prurito.
Trastornos musculoesqueléticos y del tejido conectivo : Calambres musculares, rigidez muscular, espasmo muscular del cuello, reacción de tipo trismo.
Trastornos renales y urinarios : Sangrado/dolor en la uretra, dolor renal.
Trastornos del sistema reproductivo y de la mama : Picazón vaginal, flujo vaginal.
Suspensión oral
En ensayos clínicos que utilizaron dosis múltiples de CEFTIN 250 mg, los sujetos pediátricos (96,7 % eran menores de 12 años) fueron tratados con CEFTIN (20 a 30 mg/kg/día divididos dos veces al día hasta una dosis máxima de 500 o 1000 mg/día, respectivamente). Once (1,2%) sujetos de EE. UU. suspendieron la medicación debido a reacciones adversas. Las interrupciones se debieron principalmente a trastornos gastrointestinales, generalmente diarrea o vómitos. Trece (1,4 %) sujetos pediátricos de EE. UU. interrumpieron el tratamiento debido al sabor y/o problemas con la administración del fármaco.
Las reacciones adversas en la Tabla 7 son para sujetos estadounidenses (n = 931) tratados con CEFTIN en ensayos clínicos de dosis múltiples.
Las siguientes reacciones adversas ocurrieron en menos del 1 % pero en más del 0,1 % de los sujetos estadounidenses (n = 931) tratados con CEFTIN para suspensión oral en ensayos clínicos de dosis múltiples.
Infecciones e Infestaciones : Infección gastrointestinal, candidiasis, enfermedad viral, infección de las vías respiratorias superiores, sinusitis, infección del tracto urinario.
Trastornos de la sangre y del sistema linfático : Eosinofilia.
Desórdenes psiquiátricos : Hiperactividad, comportamiento irritable.
Desórdenes gastrointestinales : Dolor abdominal, flatulencia, ptialismo.
Trastornos de la piel y del tejido subcutáneo : Sarpullido.
Trastornos musculoesqueléticos y del tejido conectivo : Hinchazón de las articulaciones, artralgia.
Trastornos del sistema reproductivo y de la mama : Irritación vaginal.
Desordenes generales y condiciones administrativas del sitio : Tos, fiebre.
Investigaciones : Enzimas hepáticas elevadas, prueba de Coombs positiva.
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de CEFTIN. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Trastornos de la sangre y del sistema linfático
Anemia hemolítica, leucopenia, pancitopenia, trombocitopenia.
Desórdenes gastrointestinales
Colitis pseudomembranosa [ver ADVERTENCIAS Y PRECAUCIONES ].
Trastornos hepatobiliares
Insuficiencia hepática incluyendo hepatitis y colestasis, ictericia.
Trastornos del sistema inmunológico
Anafilaxia, reacción similar a la enfermedad del suero.
Investigaciones
Aumento del tiempo de protrombina.
Trastornos del sistema nervioso
Convulsiones, encefalopatía.
Trastornos renales y urinarios
Disfuncion renal.
Trastornos de la piel y del tejido subcutáneo
Angioedema, eritema multiforme, síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, urticaria.
INTERACCIONES CON LA DROGAS
Anticonceptivos orales
Cefuroxima axetilo puede afectar la flora intestinal, lo que conduce a una menor reabsorción de estrógenos y a una reducción de la eficacia de los anticonceptivos orales combinados de estrógeno/progesterona. Aconseje a los pacientes que consideren medidas anticonceptivas complementarias alternativas (no hormonales) durante el tratamiento.
Medicamentos que reducen la acidez gástrica
Los medicamentos que reducen la acidez gástrica pueden resultar en una menor biodisponibilidad de CEFTIN en comparación con la administración en ayunas. La administración de medicamentos que reducen la acidez gástrica puede anular el efecto alimentario de una mayor absorción de CEFTIN 250 mg cuando se administra en el estado posprandial. Administre CEFTIN al menos 1 hora antes o 2 horas después de la administración de antiácidos de acción corta. Deben evitarse los antagonistas de la histamina-2 (H2) y los inhibidores de la bomba de protones.
probenecid
La administración concomitante de probenecid con comprimidos de cefuroxima axetil aumenta las concentraciones séricas de cefuroxima [ver FARMACOLOGÍA CLÍNICA ]. No se recomienda la coadministración de probenecid con cefuroxima axetilo.
Interacciones entre medicamentos y pruebas de laboratorio
Puede ocurrir una reacción positiva falsa para la glucosa en la orina con las pruebas de reducción de cobre (p. ej., solución de Benedict o Fehling), pero no con las pruebas basadas en enzimas para la glucosuria. Como puede ocurrir un resultado falso negativo en la prueba de ferricianuro, se recomienda usar el método de glucosa oxidasa o hexoquinasa para determinar los niveles de glucosa en sangre/plasma en pacientes que reciben cefuroxima axetilo. La presencia de cefuroxima no interfiere con el ensayo de creatinina en suero y orina por el método de picrato alcalino.
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Reacciones anafilácticas
Se han notificado reacciones de hipersensibilidad (anafilácticas) graves y, en ocasiones, mortales en pacientes tratados con antibacterianos β-lactámicos. Es más probable que estas reacciones ocurran en personas con antecedentes de hipersensibilidad a los β-lactámicos y/o antecedentes de sensibilidad a múltiples alérgenos. Ha habido informes de personas con antecedentes de hipersensibilidad a la penicilina que han experimentado reacciones graves cuando se les trata con cefalosporinas. CEFTIN 500 mg está contraindicado en pacientes con hipersensibilidad conocida a CEFTIN u otros fármacos antibacterianos β-lactámicos [ver CONTRAINDICACIONES ]. Antes de iniciar la terapia con CEFTIN, pregunte acerca de las reacciones previas de hipersensibilidad a las penicilinas, cefalosporinas u otros alérgenos. Si ocurre una reacción alérgica, suspenda CEFTIN e instituya la terapia apropiada.
Diarrea asociada a Clostridium difficile
Se ha informado diarrea asociada a Clostridium difficile (CDAD) con el uso de casi todos los agentes antibacterianos, incluido CEFTIN, y puede variar en gravedad desde diarrea leve hasta colitis fatal. El tratamiento con agentes antibacterianos altera la flora normal del colon y conduce al crecimiento excesivo de C. difficile.
C. difficile produce toxinas A y B que contribuyen al desarrollo de CDAD. Las cepas de C. difficile productoras de hipertoxina causan una mayor morbilidad y mortalidad, ya que estas infecciones pueden ser refractarias a la terapia antimicrobiana y pueden requerir colectomía. Se debe considerar CDAD en todos los pacientes que presenten diarrea después del uso de antibióticos. Es necesaria una cuidadosa historia clínica ya que se ha informado que la CDAD ocurre más de 2 meses después de la administración de agentes antibacterianos.
Si se sospecha o se confirma CDAD, es posible que deba suspenderse el uso continuo de antibióticos no dirigidos contra C. difficile. Se debe instituir el manejo adecuado de líquidos y electrolitos, la suplementación con proteínas, el tratamiento con antibióticos de C. difficile y la evaluación quirúrgica según esté clínicamente indicado.
Potencial de sobrecrecimiento microbiano
Se debe considerar la posibilidad de sobreinfecciones con patógenos fúngicos o bacterianos durante la terapia.
Desarrollo de bacterias resistentes a los medicamentos
Es poco probable que la prescripción de CEFTIN, ya sea en ausencia de una infección bacteriana comprobada o fuertemente sospechada o una indicación profiláctica, brinde beneficios al paciente y aumente el riesgo de desarrollo de bacterias resistentes a los medicamentos.
Fenilcetonuria
CEFTIN 125 mg para suspensión oral 125 mg/5 ml contiene 11,8 mg de fenilalanina por 5 ml (1 cucharadita) de suspensión reconstituida. CEFTIN 250 mg para suspensión oral 250 mg/5 ml contiene 25,2 mg de fenilalanina por 5 ml (1 cucharadita) de suspensión reconstituida.
Interferencia con las pruebas de glucosa
Puede ocurrir un resultado falso positivo de glucosa en la orina con las pruebas de reducción de cobre, y un resultado falso negativo de glucosa en sangre/plasma puede ocurrir con las pruebas de ferricianuro en sujetos que reciben CEFTIN [ver INTERACCIONES CON LA DROGAS ].
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Aunque no se han realizado estudios de por vida en animales para evaluar el potencial carcinogénico, no se encontró actividad mutagénica para cefuroxima axetilo en una serie de pruebas de mutación bacteriana. Se obtuvieron resultados positivos en un ensayo de aberración cromosómica in vitro; sin embargo, se encontraron resultados negativos en una prueba de micronúcleos in vivo a dosis de hasta 1,5 g/kg. Los estudios de reproducción en ratas a dosis de hasta 1000 mg/kg/día (9 veces la dosis máxima recomendada en humanos según el área de superficie corporal) no han revelado alteraciones de la fertilidad.
Uso en poblaciones específicas
El embarazo
Embarazo Categoría B. No existen estudios adecuados y bien controlados en mujeres embarazadas. Debido a que los estudios de reproducción en animales no siempre predicen la respuesta humana, CEFTIN debe usarse durante el embarazo solo si es claramente necesario.
Se han realizado estudios de reproducción en ratones con dosis de hasta 3200 mg/kg/día (14 veces la dosis máxima recomendada en humanos según el área de superficie corporal) y en ratas con dosis de hasta 1000 mg/kg/día (9 veces la dosis máxima recomendada). dosis humana basada en el área de superficie corporal) y no han revelado evidencia de alteración de la fertilidad o daño al feto debido a cefuroxima axetilo.
Madres lactantes
Debido a que la cefuroxima se excreta en la leche humana, se debe tener precaución cuando se administre CEFTIN 500 mg a una mujer lactante.
Uso pediátrico
La seguridad y eficacia de CEFTIN 250 mg se han establecido para pacientes pediátricos de 3 meses a 12 años de edad con sinusitis maxilar bacteriana aguda en base a su aprobación en adultos. El uso de CEFTIN en pacientes pediátricos está respaldado por datos farmacocinéticos y de seguridad en adultos y pacientes pediátricos, y por datos clínicos y microbiológicos de ensayos adecuados y bien controlados del tratamiento de la sinusitis maxilar bacteriana aguda en adultos y de la otitis media aguda con derrame en pacientes pediátricos. También está respaldado por la vigilancia de eventos adversos posteriores a la comercialización. [Ver INDICACIONES Y USO , DOSIFICACIÓN Y ADMINISTRACIÓN , REACCIONES ADVERSAS , FARMACOLOGÍA CLÍNICA ]
Uso geriátrico
Del número total de sujetos que recibieron CEFTIN 250 mg en 20 ensayos clínicos, 375 tenían 65 años o más, mientras que 151 tenían 75 años o más. No se observaron diferencias generales en seguridad o eficacia entre estos sujetos y sujetos adultos más jóvenes. La experiencia clínica informada no ha identificado diferencias en las respuestas entre los pacientes de edad avanzada y los adultos más jóvenes, pero no se puede descartar una mayor sensibilidad de algunas personas mayores.
La cefuroxima se excreta sustancialmente por vía renal y el riesgo de reacciones adversas puede ser mayor en pacientes con insuficiencia renal. Debido a que es más probable que los pacientes de edad avanzada tengan una función renal disminuida, se debe tener cuidado en la selección de la dosis y puede ser útil monitorear la función renal.
Insuficiencia renal
Se recomienda reducir la dosis de CEFTIN 125 mg para pacientes adultos con insuficiencia renal grave (aclaramiento de creatinina DOSIFICACIÓN Y ADMINISTRACIÓN , FARMACOLOGÍA CLÍNICA ].
SOBREDOSIS
La sobredosis de cefalosporinas puede causar irritación cerebral que conduce a convulsiones o encefalopatía. Los niveles séricos de cefuroxima pueden reducirse mediante hemodiálisis y diálisis peritoneal.
CONTRAINDICACIONES
CEFTIN está contraindicado en pacientes con hipersensibilidad conocida (p. ej., anafilaxia) a CEFTIN oa otros fármacos antibacterianos β-lactámicos (p. ej., penicilinas y cefalosporinas).
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
CEFTIN 250 mg es un fármaco antibacteriano [ver Microbiología ].
Farmacocinética
Absorción
Después de la administración oral, la cefuroxima axetilo se absorbe en el tracto gastrointestinal y se hidroliza rápidamente a cefuroxima por esterasas inespecíficas en la mucosa intestinal y la sangre. Los parámetros farmacocinéticos séricos para cefuroxima luego de la administración de tabletas de 250 mg de CEFTIN a adultos se muestran en la Tabla 8.
Efecto de la comida
La absorción del comprimido es mayor cuando se toma después de las comidas (la biodisponibilidad absoluta aumenta del 37 % al 52 %). A pesar de esta diferencia en la absorción, las respuestas clínicas y bacteriológicas de los sujetos fueron independientes de la ingesta de alimentos en el momento de la administración del comprimido en 2 ensayos en los que se evaluó esto.
Todos los ensayos farmacocinéticos y de eficacia clínica y seguridad en sujetos pediátricos que utilizaron la formulación en suspensión se realizaron en estado posprandial. No hay datos disponibles sobre la cinética de absorción de la formulación en suspensión cuando se administra a sujetos pediátricos en ayunas.
Falta de bioequivalencia
La suspensión oral no fue bioequivalente a las tabletas cuando se probó en adultos sanos. Las formulaciones de tabletas y suspensión oral NO son sustituibles en una base de miligramo por miligramo. El área bajo la curva de la suspensión promedió el 91 % de la del comprimido, y la concentración plasmática máxima de la suspensión promedió el 71 % de la concentración plasmática máxima de los comprimidos. Por lo tanto, la seguridad y la eficacia de las formulaciones de tabletas y suspensión oral se establecieron en ensayos clínicos separados.
Distribución
La cefuroxima se distribuye por los fluidos extracelulares. Aproximadamente el 50% de la cefuroxima sérica se une a proteínas.
Metabolismo
El resto axetilo se metaboliza a acetaldehído y ácido acético.
Excreción
La cefuroxima se excreta sin cambios en la orina; en adultos, aproximadamente el 50% de la dosis administrada se recupera en la orina en 12 horas. No se ha estudiado la farmacocinética de cefuroxima en sujetos pediátricos. Hasta que se disponga de más datos, la eliminación renal de cefuroxima axetilo establecida en adultos no debe extrapolarse a sujetos pediátricos.
Poblaciones Específicas
Insuficiencia renal
En un ensayo de 28 adultos con función renal normal o insuficiencia renal grave (aclaramiento de creatinina DOSIFICACIÓN Y ADMINISTRACIÓN ].
Pacientes pediátricos
Los parámetros farmacocinéticos séricos para cefuroxima en sujetos pediátricos a los que se les administró CEFTIN para suspensión oral se muestran en la Tabla 9.
Pacientes geriátricos
En un ensayo de 20 sujetos de edad avanzada (edad media = 83,9 años) con un aclaramiento de creatinina medio de 34,9 ml/min, la semivida de eliminación sérica media se prolongó a 3,5 horas; sin embargo, a pesar de la menor eliminación de cefuroxima en pacientes geriátricos, no es necesario ajustar la dosis en función de la edad [ver Uso en poblaciones específicas ].
Interacciones con la drogas
La administración concomitante de probenecid con comprimidos de cefuroxima axetil aumenta el área de cefuroxima bajo la curva de concentración sérica versus tiempo y la concentración sérica máxima en un 50 % y un 21 %, respectivamente.
Microbiología
Mecanismo de acción
Cefuroxima axetilo es un agente bactericida que actúa inhibiendo la síntesis de la pared celular bacteriana. Cefuroxima axetilo tiene actividad en presencia de algunas β-lactamasas, tanto penicilinasas como cefalosporinasas, de bacterias gramnegativas y grampositivas.
mecanismo de resistencia
La resistencia a la cefuroxima axetilo se debe principalmente a la hidrólisis por la β-lactamasa, la alteración de las proteínas de unión a penicilina (PBP), la disminución de la permeabilidad y la presencia de bombas de salida bacterianas.
La susceptibilidad a la cefuroxima axetil variará con la geografía y el tiempo; se deben consultar los datos locales de susceptibilidad, si están disponibles. Los aislamientos de H. influenzae beta-lactamasa negativos, resistentes a la ampicilina (BLNAR) deben considerarse resistentes a la cefuroxima axetilo.
Se ha demostrado que cefuroxima axetilo es activo contra la mayoría de los aislados de las siguientes bacterias, tanto in vitro como en infecciones clínicas [ver INDICACIONES Y USO ]:
bacterias grampositivas
Staphylococcus aureus (solo aislados sensibles a la meticilina) Streptococcus pneumoniae Streptococcus pyogenes
Bacterias Gram-negativo
Escherichia coli Klebsiella pneumoniaea Haemophilus influenzae Haemophilus parainfluenzae Moraxella catarrhalis Neisseria gonorrhoeae a La mayoría de los aislados productores de β-lactamasas de espectro extendido (BLEE) y productores de carbapenemasas son resistentes a la cefuroxima axetilo. Espiroquetas Borrelia Burgdorferi
Los siguientes datos in vitro están disponibles, pero se desconoce su importancia clínica. Al menos el 90 por ciento de los siguientes microorganismos exhiben una concentración inhibitoria mínima (MIC) in vitro menor o igual al punto de corte susceptible para cefuroxima axetilo de 1 mcg/mL. Sin embargo, la eficacia de cefuroxima axetilo en el tratamiento de infecciones clínicas debidas a estos microorganismos no se ha establecido en ensayos clínicos adecuados y bien controlados.
bacterias grampositivas
Staphylococcus epidermidis (solo aislados sensibles a la meticilina) Staphylococcus saprophyticus (solo aislados sensibles a la meticilina) Streptococcus agalactiae
Bacterias Gram-negativo
Morganella morganii Proteus inconstans Proteus mirabilis Providencia rettgeri Bacterias anaerobias Peptococcus niger
Métodos de prueba de susceptibilidad
Cuando esté disponible, el laboratorio de microbiología clínica debe proporcionar al médico los resultados de las pruebas de susceptibilidad in vitro para los medicamentos antimicrobianos utilizados en hospitales locales y áreas de práctica como informes periódicos que describen el perfil de susceptibilidad de los patógenos nosocomiales y adquiridos en la comunidad. Estos informes deberían ayudar al médico a seleccionar un medicamento antibacteriano para el tratamiento.
Técnicas de dilución
Se utilizan métodos cuantitativos para determinar las CIM antimicrobianas. Estos MIC proporcionan estimaciones reproducibles de la susceptibilidad de las bacterias a los compuestos antimicrobianos. Las CIM deben determinarse utilizando un método de prueba estandarizado (caldo o agar).1, 2 Los valores de la CIM deben interpretarse de acuerdo con los criterios proporcionados en la Tabla 10.2,3
Técnicas de difusión
Los métodos cuantitativos que requieren la medición de los diámetros de las zonas también proporcionan estimaciones reproducibles de la susceptibilidad de las bacterias a los compuestos antimicrobianos. El tamaño de la zona proporciona una estimación de la susceptibilidad de las bacterias a los compuestos antimicrobianos. El tamaño de la zona debe determinarse utilizando un método de prueba estandarizado.4 Este procedimiento utiliza discos de papel impregnados con 30 mcg de cefuroxima axetilo para probar la susceptibilidad de los microorganismos a la cefuroxima axetilo. Los criterios de interpretación de la difusión por disco se proporcionan en la Tabla 10.3
La susceptibilidad de los estafilococos a la cefuroxima puede deducirse analizando solo penicilina y cefoxitina u oxacilina.
La susceptibilidad de Streptococcus pyogenes puede deducirse de la prueba de penicilina.3
Un informe de "Sensible" indica que es probable que el fármaco antimicrobiano inhiba el crecimiento del patógeno si el fármaco antimicrobiano alcanza la concentración que normalmente se alcanza en el sitio de la infección. Un informe de "Intermedio" indica que el resultado debe considerarse equívoco, y si el microorganismo no es completamente susceptible a fármacos alternativos clínicamente factibles, la prueba debe repetirse. Esta categoría implica una posible aplicabilidad clínica en sitios del cuerpo donde el fármaco se concentra fisiológicamente o en situaciones en las que se puede utilizar una dosis alta del fármaco. Esta categoría también proporciona una zona de amortiguamiento que evita que pequeños factores técnicos no controlados causen grandes discrepancias en la interpretación. Un informe de "Resistente" indica que no es probable que el fármaco antimicrobiano inhiba el crecimiento del patógeno si el fármaco antimicrobiano alcanza las concentraciones que normalmente se alcanzan en el sitio de la infección; debe seleccionarse otra terapia.
Control de calidad
Los procedimientos de prueba de susceptibilidad estandarizados requieren el uso de controles de laboratorio para monitorear y garantizar la exactitud y precisión de los suministros y reactivos utilizados en el ensayo, y las técnicas de la persona que realiza la prueba.1,2,4 Los rangos de control de calidad para MIC y difusión en disco las pruebas con el disco de 30 mcg se proporcionan en la Tabla 11.3
Estudios clínicos
Sinusitis maxilar bacteriana aguda
Se realizó un ensayo adecuado y bien controlado en sujetos con sinusitis maxilar bacteriana aguda. En este ensayo, a cada sujeto se le realizó un aspirado del seno maxilar por punción sinusal antes de iniciar el tratamiento por presunta sinusitis bacteriana aguda. Todos los sujetos tenían evidencia radiográfica y clínica de sinusitis maxilar aguda. En el ensayo, la eficacia clínica de CEFTIN en el tratamiento de la sinusitis maxilar aguda fue comparable a la de un agente antimicrobiano oral que contiene un inhibidor específico de la β-lactamasa. Sin embargo, los datos microbiológicos demostraron que CEFTIN es eficaz en el tratamiento de la sinusitis maxilar bacteriana aguda debida únicamente a Streptococcus pneumoniae o Haemophilus influenzae no productor de β-lactamasa. En este ensayo, se obtuvieron cantidades insuficientes de aislamientos de Haemophilus influenzae y Moraxella catarrhalis productores de β-lactamasa para evaluar adecuadamente la eficacia de CEFTIN en el tratamiento de la sinusitis maxilar bacteriana aguda debida a estos 2 organismos.
Este ensayo asignó al azar a 317 sujetos adultos, 132 sujetos en los EE. UU. y 185 sujetos en América del Sur. La Tabla 12 muestra los resultados del análisis por intención de tratar.
En este ensayo y en un ensayo de punción maxilar de apoyo, 15 sujetos evaluables tenían Haemophilus influenzae no productor de β-lactamasa como patógeno identificado. De estos, el 67% (10/15) tenían erradicado este patógeno. Dieciocho (18) sujetos evaluables tenían Streptococcus pneumoniae como patógeno identificado. De estos, el 83% (15/18) tenían erradicado este patógeno.
Enfermedad de Lyme temprana
Se realizaron dos ensayos adecuados y bien controlados en sujetos con enfermedad de Lyme temprana. Todos los sujetos presentaron eritema migratorio documentado por un médico, con o sin manifestaciones sistémicas de infección. Los sujetos fueron evaluados 1 mes después del tratamiento para el éxito en el tratamiento de la enfermedad de Lyme temprana (Parte I) y 1 año después del tratamiento para el éxito en la prevención de la progresión a las secuelas de la enfermedad de Lyme tardía (Parte II).
Un total de 355 sujetos adultos (181 tratados con cefuroxima axetilo y 174 tratados con doxiciclina) fueron aleatorizados en los 2 ensayos, y se confirmó el diagnóstico de enfermedad de Lyme temprana en el 79 % (281/355). El diagnóstico clínico de la enfermedad de Lyme temprana en estos sujetos fue validado por 1) lectura experta ciega de fotografías, cuando estaban disponibles, de la lesión cutánea de eritema migratorio previa al tratamiento, y 2) confirmación serológica (usando ensayo inmunoabsorbente ligado a enzimas [ELISA] y ensayo de inmunotransferencia). [“Western” blot]) de la presencia de anticuerpos específicos contra Borrelia burgdorferi, el agente etiológico de la enfermedad de Lyme. Los datos de eficacia en la Tabla 13 son específicos para este subconjunto de pacientes "validados", mientras que los datos de seguridad a continuación reflejan la población completa de pacientes para los 2 ensayos. Los datos clínicos de los sujetos evaluables en el subconjunto de pacientes "validados" se muestran en la Tabla 13.
CEFTIN y doxiciclina fueron efectivos en la prevención del desarrollo de secuelas de la enfermedad de Lyme tardía.
Mientras que la incidencia de reacciones adversas gastrointestinales relacionadas con el fármaco fue similar en los 2 grupos de tratamiento (cefuroxima axetilo - 13 %; doxiciclina - 11 %), la incidencia de diarrea relacionada con el fármaco fue mayor en el brazo de cefuroxima axetilo que en el brazo de doxiciclina (11 % versus 3%, respectivamente).
REFERENCIAS
1. Instituto de Normas Clínicas y de Laboratorio (CLSI). Métodos para pruebas de susceptibilidad antimicrobiana por dilución para bacterias que crecen aeróbicamente; Norma Aprobada - Décima Edición. 2015. Documento CLSI M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, EE. UU.
2. Instituto de Normas Clínicas y de Laboratorio (CLSI). Métodos para dilución de antimicrobianos y pruebas de susceptibilidad de disco para bacterias fastidiosas o aisladas con poca frecuencia: Directrices aprobadas - Segunda edición. 2010. Documento CLSI M45-A2, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, EE. UU.
3. Instituto de Normas Clínicas y de Laboratorio (CLSI). Estándares de Desempeño para Pruebas de Susceptibilidad Antimicrobiana; Vigésimo Quinto Suplemento Informativo. 2015. Documento CLSI M100-S25, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, EE. UU.
4. Instituto de Normas Clínicas y de Laboratorio (CLSI). Normas de rendimiento para las pruebas de susceptibilidad a la difusión por disco de antimicrobianos; Norma Aprobada - Duodécima Edición. 2015. Documento CLSI M02-A12, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, EE. UU.
INFORMACIÓN DEL PACIENTE
Reacciones alérgicas
Informe a los pacientes que CEFTIN es una cefalosporina que puede causar reacciones alérgicas en algunas personas [ver ADVERTENCIAS Y PRECAUCIONES ].
Diarrea asociada a Clostridium difficile
Informe a los pacientes que la diarrea es un problema común causado por los antibacterianos y que, por lo general, desaparece cuando se suspende el antibacteriano. A veces, después de comenzar el tratamiento con antibacterianos, los pacientes pueden desarrollar heces acuosas y sanguinolentas (con o sin calambres estomacales y fiebre) incluso 2 o más meses después de haber tomado la última dosis del antibacteriano. Si esto ocurre, aconseje a los pacientes que se comuniquen con su médico lo antes posible.
Fenilcetonuria
Informe a los pacientes y cuidadores que CEFTIN 125 mg para suspensión oral contiene fenilalanina (un componente del aspartamo) [ver ADVERTENCIAS Y PRECAUCIONES ].
Triturar tabletas
Indique a los pacientes que traguen la tableta entera, sin triturarla. Los pacientes que no puedan tragar el comprimido entero deben recibir la suspensión oral.
Suspensión oral
Indique a los pacientes que agiten bien la suspensión oral antes de cada uso, guárdela en el refrigerador y deséchela después de 10 días. La suspensión oral debe tomarse con alimentos.
Resistencia a las drogas
Informe a los pacientes que los medicamentos antibacterianos, incluido CEFTIN, solo deben usarse para tratar infecciones bacterianas. No tratan infecciones virales (p. ej., el resfriado común). Cuando se prescribe CEFTIN 250 mg para tratar una infección bacteriana, informe a los pacientes que, aunque es común sentirse mejor al comienzo de la terapia, el medicamento debe tomarse exactamente como se indica. Omitir dosis o no completar el curso completo de la terapia puede: (1) disminuir la eficacia del tratamiento inmediato y (2) aumentar la probabilidad de que las bacterias desarrollen resistencia y no se puedan tratar con CEFTIN 500 mg u otros medicamentos antibacterianos en el futuro. .
