Copegus 100mg Ribavirin Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Copegus 100 mg y cómo se usa?
Copegus 100 mg es un medicamento recetado que se usa para tratar los síntomas de la hepatitis C crónica. Copegus 100 mg se puede usar solo o con otros medicamentos.
Copegus pertenece a una clase de medicamentos llamados Agentes de Hepatitis B/Hepatitis C; Agentes RSV.
¿Cuáles son los posibles efectos secundarios de Copegus?
Copegus puede causar efectos secundarios graves que incluyen:
- urticaria,
- respiración dificultosa,
- hinchazón de la cara, los labios, la lengua o la garganta,
- problemas con su visión,
- dolor intenso en la parte superior del estómago que se extiende a la espalda,
- náuseas,
- vómitos,
- Diarrea,
- tos nueva o que empeora,
- fiebre,
- dolor punzante en el pecho,
- sibilancias,
- dificultad para respirar,
- depresión severa,
- pensamientos de autolesión o de dañar a otra persona,
- piel pálida o amarillenta,
- orina de color oscuro,
- confusión,
- debilidad,
- escalofríos,
- síntomas similares a la gripe,
- encías hinchadas,
- úlceras de boca,
- llagas en la piel,
- moretones con facilidad,
- sangrado inusual y
- aturdimiento
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Copegus incluyen:
- náuseas,
- vómitos,
- pérdida de apetito,
- fiebre,
- escalofríos o temblores,
- recuentos bajos de glóbulos,
- anemia,
- debilidad,
- cansancio,
- dolor de cabeza,
- dolor muscular,
- cambios de humor,
- ansiedad, y
- irritabilidad
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Copegus. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
ADVERTENCIA
RIESGO DE TRASTORNOS GRAVES Y EFECTOS ASOCIADOS A LA RIBAVIRINA
La monoterapia con COPEGUS (ribavirina) no es eficaz para el tratamiento de la infección crónica por el virus de la hepatitis C y no debe utilizarse solo para esta indicación.
La principal toxicidad clínica de la ribavirina es la anemia hemolítica. La anemia asociada con la terapia con ribavirina puede provocar un empeoramiento de la enfermedad cardíaca y provocar infartos de miocardio fatales y no fatales. Los pacientes con antecedentes de enfermedad cardíaca importante o inestable no deben recibir tratamiento con COPEGUS [ver ADVERTENCIAS Y PRECAUCIONES, REACCIONES ADVERSAS y POSOLOGÍA Y ADMINISTRACIÓN].
Se han demostrado efectos teratogénicos y/o embriocidas significativos en todas las especies animales expuestas a la ribavirina. Además, la ribavirina tiene una vida media de dosis múltiples de 12 días y puede persistir en compartimentos no plasmáticos hasta por 6 meses. Por lo tanto, la ribavirina, incluido COPEGUS 100 mg, está contraindicada en mujeres embarazadas y en las parejas masculinas de mujeres embarazadas. Se debe tener mucho cuidado para evitar el embarazo durante la terapia y durante los 6 meses posteriores a la finalización de la terapia tanto en pacientes femeninas como en las parejas femeninas de pacientes masculinos que están tomando ribavirina. Se deben utilizar al menos dos formas confiables de anticoncepción efectiva durante el tratamiento y durante el período de seguimiento posterior al tratamiento de 6 meses [consulte CONTRAINDICACIONES, ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas].
DESCRIPCIÓN
COPEGUS 100mg, ribavirina, es un análogo de nucleósido con actividad antiviral. El nombre químico de la ribavirina es 1-β-Dribofuranosyl-1H-1,2,4-triazole-3-carboxamide y tiene la siguiente fórmula estructural:
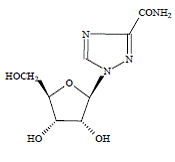
La fórmula empírica de la ribavirina es C8H12N4O5 y el peso molecular es 244,2. La ribavirina es un polvo de color blanco a blanquecino. Es libremente soluble en agua y ligeramente soluble en alcohol anhidro.
COPEGUS (ribavirina) está disponible en comprimidos recubiertos con película, planos, de forma ovalada, de color rosa claro a rosa para administración oral. Cada tableta contiene 200 mg de ribavirina y los siguientes ingredientes inactivos: almidón pregelatinizado, celulosa microcristalina, glicolato de almidón de sodio, almidón de maíz y estearato de magnesio. El recubrimiento de la tableta contiene Chromatone-P u Opadry Pink (fabricado con hidroxipropilmetilcelulosa, talco, dióxido de titanio, óxido de hierro amarillo sintético y óxido de hierro rojo sintético), etilcelulosa (ECD-30) y triacetina.
INDICACIONES
COPEGUS 100 mg en combinación con PEGASYS (peginterferón alfa-2a) está indicado para el tratamiento de pacientes de 5 años de edad y mayores con infección crónica por el virus de la hepatitis C (CHC) que tienen enfermedad hepática compensada y no han sido tratados previamente con interferón alfa.
Se deben considerar los siguientes puntos al iniciar la terapia combinada de COPEGUS 100 mg con PEGASYS:
- Esta indicación se basa en ensayos clínicos de terapia combinada en pacientes con CHC y enfermedad hepática compensada, algunos de los cuales tenían evidencia histológica de cirrosis (Child-Pugh clase A), y en pacientes adultos con enfermedad por VIH clínicamente estable y recuento de CD4 superior a 100 células/mm³.
- Esta indicación se basa en lograr un ARN del VHC indetectable después del tratamiento durante 24 o 48 semanas, según el genotipo del VHC, y mantener una respuesta virológica sostenida (RVS) 24 semanas después de la última dosis.
- Los datos de seguridad y eficacia no están disponibles para tratamientos de más de 48 semanas.
- No se ha establecido la seguridad y eficacia de COPEGUS 100 mg y la terapia con PEGASYS en receptores de trasplante de hígado u otros órganos, pacientes con enfermedad hepática descompensada o pacientes que no respondieron previamente a la terapia con interferón.
- No se ha establecido la seguridad y eficacia de la terapia con COPEGUS para el tratamiento de infecciones por adenovirus, RSV, parainfluenza o influenza. COPEGUS no debe utilizarse para estas indicaciones. La ribavirina para inhalación tiene un prospecto separado, que debe consultarse si se está considerando la terapia de inhalación de ribavirina.
DOSIFICACIÓN Y ADMINISTRACIÓN
COPEGUS 100 mg debe tomarse con alimentos. COPEGUS debe administrarse en combinación con PEGASYS; es importante señalar que COPEGUS 100 mg nunca debe administrarse como monoterapia. Ver Prospecto del paquete de PEGASYS para todas las instrucciones relacionadas con la dosificación y la administración de PEGASYS.
Monoinfección por hepatitis C crónica
Pacientes adultos
La dosis recomendada de COPEGUS comprimidos de 100 mg se proporciona en la Tabla 1. La duración recomendada del tratamiento para pacientes que no han sido tratados previamente con ribavirina e interferón es de 24 a 48 semanas.
La dosis diaria de COPEGUS 100 mg es de 800 mg a 1200 mg administrados por vía oral en dos tomas divididas. La dosis debe individualizarse para el paciente según las características basales de la enfermedad (p. ej., genotipo), la respuesta a la terapia y la tolerabilidad del régimen (ver ).
Pacientes pediátricos
PEGASYS se administra como 180 mcg/1,73 m² x BSA una vez a la semana por vía subcutánea, hasta una dosis máxima de 180 mcg, y debe administrarse en combinación con ribavirina. La duración recomendada del tratamiento para pacientes con genotipo 2 o 3 es de 24 semanas y para otros genotipos es de 48 semanas.
COPEGUS debe administrarse en combinación con PEGASYS. COPEGUS 100 mg está disponible solo en tabletas de 200 mg y, por lo tanto, el proveedor de atención médica debe determinar si el paciente pediátrico puede tragar este tamaño de tableta. Las dosis recomendadas para COPEGUS se proporcionan en la Tabla 2. Los pacientes que inician el tratamiento antes de cumplir 18 años deben mantener la dosificación pediátrica hasta completar la terapia.
Coinfección de hepatitis C crónica con VIH
Pacientes adultos
La dosis recomendada para el tratamiento de la hepatitis C crónica en pacientes coinfectados por el VIH es de 180 mcg de PEGASYS por vía subcutánea una vez a la semana y de 800 mg de COPEGUS por vía oral al día durante un total de 48 semanas, independientemente del genotipo del VHC.
Modificaciones de dosis
Pacientes adultos y pediátricos
Si se desarrollan reacciones adversas graves o anormalidades de laboratorio durante la terapia combinada con COPEGUS/PEGASYS, se debe modificar o suspender la dosis, si corresponde, hasta que las reacciones adversas disminuyan o disminuyan en gravedad. Si la intolerancia persiste después del ajuste de la dosis, se debe interrumpir el tratamiento con COPEGUS/PEGASYS. La Tabla 3 proporciona pautas para las modificaciones de la dosis y la interrupción en función de la concentración de hemoglobina y el estado cardíaco del paciente.
COPEGUS 100 mg debe administrarse con precaución a pacientes con cardiopatía preexistente. Los pacientes deben ser evaluados antes de comenzar la terapia y deben ser monitoreados apropiadamente durante la terapia. Si hay algún deterioro del estado cardiovascular, se debe suspender la terapia [ver ADVERTENCIAS Y PRECAUCIONES ].
Las pautas para las modificaciones de la dosis de COPEGUS de 100 mg descritas en esta tabla también se aplican a anomalías de laboratorio o reacciones adversas que no sean disminuciones en los valores de hemoglobina.
Pacientes adultos
Una vez que se suspendió COPEGUS 100 mg debido a una anomalía de laboratorio o una reacción adversa clínica, se puede intentar reiniciar COPEGUS 100 mg a 600 mg diarios y aumentar aún más la dosis a 800 mg diarios. Sin embargo, no se recomienda aumentar COPEGUS a la dosis original asignada (1000 mg a 1200 mg).
Pacientes pediátricos
Una vez resuelta una anomalía de laboratorio o una reacción adversa clínica, se puede intentar aumentar la dosis de COPEGUS de 100 mg a la dosis original, según el criterio del médico. Si se suspendió COPEGUS debido a una anomalía de laboratorio o una reacción adversa clínica, se puede intentar reiniciar COPEGUS 100 mg a la mitad de la dosis completa.
Insuficiencia renal
La dosis diaria total de COPEGUS debe reducirse para pacientes con depuración de creatinina menor o igual a 50 ml/min; y la dosis semanal de PEGASYS debe reducirse para un aclaramiento de creatinina inferior a 30 ml/min como se indica en la Tabla 4 [ver Uso en poblaciones específicas , Farmacocinética , y Prospecto del paquete PEGASYS ].
La dosis de COPEGUS 100 mg no debe modificarse más en pacientes con insuficiencia renal. Si se desarrollan reacciones adversas graves o anormalidades de laboratorio, se debe suspender COPEGUS, si corresponde, hasta que las reacciones adversas disminuyan o disminuyan en gravedad. Si la intolerancia persiste después de reiniciar COPEGUS 100 mg, se debe suspender la terapia con COPEGUS/PEGASYS.
No hay datos disponibles para sujetos pediátricos con insuficiencia renal.
Interrupción de la dosificación
Se debe considerar la interrupción del tratamiento con PEGASYS/COPEGUS 100 mg si el paciente no ha demostrado una reducción de al menos 2 log10 desde el inicio en el ARN del VHC a las 12 semanas de tratamiento, o niveles indetectables de ARN del VHC después de 24 semanas de tratamiento.
El tratamiento con PEGASYS/COPEGUS 100 mg debe suspenderse en pacientes que desarrollen descompensación hepática durante el tratamiento [ver ADVERTENCIAS Y PRECAUCIONES ].
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
COPEGUS (ribavirina) está disponible en comprimidos recubiertos con película, planos, de forma ovalada, de color rosa claro a rosa para administración oral. Cada comprimido contiene 200 mg de ribavirina.
COPEGUS® (ribavirina) está disponible en forma de tabletas para administración oral. Cada comprimido contiene 200 mg de ribavirina y es de color rosa claro a rosa, plano, de forma ovalada, recubierto con una película y grabado con RIB 200 en un lado y ROCHE en el otro. Se envasan en frascos de 168 comprimidos ( CDN 0004-0086-94).
Almacenamiento y manipulación
Guarde el frasco de COPEGUS®Tablets a 25°C (77°F); se permiten excursiones entre 15°C y 30°C (59°F y 86°F) [ver Temperatura ambiente controlada por USP ]. Mantenga la botella bien cerrada.
Fabricado por: Hoffmann-La Roche, Inc. c/o Genentech, Inc. Miembro del Grupo Roche, 1 DNA Way, South San Francisco, CA 94080-4990. Revisado: agosto de 2015
EFECTOS SECUNDARIOS
PEGASYS en combinación con COPEGUS provoca una amplia variedad de reacciones adversas graves [ver ADVERTENCIA EN CAJA y ADVERTENCIAS Y PRECAUCIONES ]. Las reacciones adversas graves o potencialmente mortales más comunes inducidas o agravadas por COPEGUS/PEGASYS incluyen depresión, suicidio, recaída en el abuso/sobredosis de drogas e infecciones bacterianas, cada una de las cuales ocurre con una frecuencia inferior al 1%. La descompensación hepática ocurrió en el 2% (10/574) de los pacientes con CHC/VIH [ver ADVERTENCIAS Y PRECAUCIONES ].
Experiencia en estudios clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica clínica.
Pacientes adultos
En los ensayos pivotales de registro NV15801 y NV15942, 886 pacientes recibieron COPEGUS durante 48 semanas en dosis de 1000/1200 mg según el peso corporal. En estos ensayos, se produjeron una o más reacciones adversas graves en el 10 % de los sujetos monoinfectados con CHC y en el 19 % de los sujetos con CHC/VIH que recibieron PEGASYS solo o en combinación con COPEGUS. El evento adverso grave más frecuente (3 % en CHC y 5 % en CHC/VIH) fue la infección bacteriana (p. ej., sepsis, osteomielitis, endocarditis, pielonefritis, neumonía).
Otras reacciones adversas graves ocurrieron con una frecuencia inferior al 1% e incluyeron: suicidio, ideación suicida, psicosis, agresión, ansiedad, abuso de drogas y sobredosis de drogas, angina, disfunción hepática, hígado graso, colangitis, arritmia, diabetes mellitus, fenómenos autoinmunitarios (p. ej., hipertiroidismo, hipotiroidismo, sarcoidosis, lupus eritematoso sistémico, artritis reumatoide), neuropatía periférica, anemia aplásica, úlcera péptica, hemorragia gastrointestinal, pancreatitis, colitis, úlcera corneal, embolia pulmonar, coma, miositis, hemorragia cerebral, púrpura trombocitopénica trombótica, trastorno psicótico y alucinaciones.
El porcentaje de pacientes en ensayos clínicos que experimentaron uno o más eventos adversos fue del 98%. Las reacciones adversas notificadas con mayor frecuencia fueron reacciones psiquiátricas, que incluyen depresión, insomnio, irritabilidad, ansiedad y síntomas similares a los de la gripe, como fatiga, pirexia, mialgia, dolor de cabeza y escalofríos. Otras reacciones comunes fueron anorexia, náuseas y vómitos, diarrea, artralgias, reacciones en el lugar de la inyección, alopecia y prurito.
muestra las tasas de eventos adversos que ocurren en un 5 % o más de los sujetos que reciben terapia combinada de interferón pegilado y ribavirina en el ensayo clínico CHC, NV15801.
El diez por ciento de los pacientes monoinfectados con CHC que recibieron 48 semanas de terapia con PEGASYS en combinación con COPEGUS 100 mg suspendieron la terapia; El 16 % de los pacientes coinfectados con CHC/VIH interrumpieron el tratamiento. Las razones más comunes para la interrupción de la terapia fueron psiquiátricas, síndrome seudogripal (p. ej., letargo, fatiga, dolor de cabeza), trastornos dermatológicos y gastrointestinales y anomalías de laboratorio (trombocitopenia, neutropenia y anemia).
En general, el 39 % de los pacientes con CHC o CHC/VIH requirieron una modificación del tratamiento con PEGASYS y/o COPEGUS. La razón más común para la modificación de la dosis de PEGASYS en pacientes con CHC y CHC/VIH fue por anormalidades de laboratorio; neutropenia (20% y 27%, respectivamente) y trombocitopenia (4% y 6%, respectivamente). La razón más común para modificar la dosis de COPEGUS en pacientes con CHC y CHC/VIH fue la anemia (22 % y 16 %, respectivamente).
La dosis de PEGASYS se redujo en el 12 % de los pacientes que recibieron 1000 mg a 1200 mg de COPEGUS de 100 mg durante 48 semanas y en el 7 % de los pacientes que recibieron 800 mg de COPEGUS durante 24 semanas. La dosis de COPEGUS se redujo en el 21 % de los pacientes que recibieron 1000 mg a 1200 mg de COPEGUS 100 mg durante 48 semanas y en el 12 % de los pacientes que recibieron 800 mg de COPEGUS 100 mg durante 24 semanas.
Se observó que los pacientes monoinfectados con hepatitis C crónica tratados durante 24 semanas con PEGASYS y 800 mg de COPEGUS 100 mg tenían una menor incidencia de eventos adversos graves (3 % frente a 10 %), hemoglobina inferior a 10 g/dL (3 % frente a 15 %) , modificación de dosis de PEGASYS (30% vs. 36%) y COPEGUS (19% vs. 38%), y de abandono del tratamiento (5% vs. 15%) en comparación con pacientes tratados durante 48 semanas con PEGASYS y 1000 mg o COPEGUS 1200 mg. Por otro lado, la incidencia general de eventos adversos pareció ser similar en los dos grupos de tratamiento.
Pacientes pediátricos
En un ensayo clínico con 114 sujetos pediátricos (5 a 17 años de edad) tratados con PEGASYS solo o en combinación con COPEGUS 100 mg, se requirieron modificaciones de dosis en aproximadamente un tercio de los sujetos, más comúnmente por neutropenia y anemia. En general, el perfil de seguridad observado en sujetos pediátricos fue similar al observado en adultos. En el estudio pediátrico, los eventos adversos más comunes en sujetos tratados con la terapia combinada de PEGASYS y COPEGUS de 100 mg durante un máximo de 48 semanas fueron enfermedad similar a la influenza (91 %), infección del tracto respiratorio superior (60 %), dolor de cabeza (64 %), trastorno gastrointestinal (56 %), trastorno de la piel (47 %) y reacción en el lugar de la inyección (45 %). Siete sujetos que recibieron tratamiento combinado con PEGASYS y COPEGUS durante 48 semanas suspendieron el tratamiento por razones de seguridad (depresión, evaluación psiquiátrica anormal, ceguera transitoria, exudados retinianos, hiperglucemia, diabetes mellitus tipo 1 y anemia). Se informaron eventos adversos graves en 2 sujetos en el grupo de tratamiento combinado de PEGASYS más COPEGUS 100 mg (hiperglucemia y colecistectomía).
En sujetos pediátricos aleatorizados a la terapia de combinación, la incidencia de la mayoría de las reacciones adversas fue similar durante todo el período de tratamiento (hasta 48 semanas más 24 semanas de seguimiento) en comparación con las primeras 24 semanas, y aumentó solo ligeramente para dolor de cabeza, trastornos gastrointestinales , irritabilidad y sarpullido. La mayoría de las reacciones adversas ocurrieron en las primeras 24 semanas de tratamiento.
Inhibición del crecimiento en sujetos pediátricos
[ver ADVERTENCIAS Y PRECAUCIONES ].
Los sujetos pediátricos tratados con la terapia combinada de PEGASYS más ribavirina mostraron un retraso en los aumentos de peso y altura con hasta 48 semanas de terapia en comparación con el valor inicial. Tanto el peso para la edad como la talla para la edad, las puntuaciones z, así como los percentiles de la población normativa para el peso y la talla del sujeto, disminuyeron durante el tratamiento. Al final de los 2 años de seguimiento después del tratamiento, la mayoría de los sujetos habían regresado a los percentiles de la curva normativa basal para el peso (percentil medio 64 al inicio, percentil medio 60 a los 2 años posteriores al tratamiento) y altura (percentil medio 54 al inicio, percentil 56 percentil medio a los 2 años postratamiento). Al final del tratamiento, el 43 % (23 de 53) de los sujetos experimentó una disminución del percentil de peso de más de 15 percentiles, y el 25 % (13 de 53) experimentó una disminución del percentil de altura de más de 15 percentiles en las curvas de crecimiento normativas. Dos años después del tratamiento, el 16 % (6 de 38) de los sujetos estaba más de 15 percentiles por debajo de su curva de peso inicial y el 11 % (4 de 38) estaba más de 15 percentiles por debajo de su curva de altura inicial.
Treinta y ocho de los 114 sujetos se inscribieron en el estudio de seguimiento a largo plazo, que se extendió hasta 6 años después del tratamiento. Para la mayoría de los sujetos, la recuperación del crecimiento posterior al tratamiento a los 2 años posteriores al tratamiento se mantuvo hasta los 6 años posteriores al tratamiento.
Reacciones adversas comunes en CHC con coinfección por VIH (adultos)
El perfil de eventos adversos de los pacientes coinfectados tratados con PEGASYS/COPEGUS en el Estudio NR15961 fue generalmente similar al mostrado para los pacientes monoinfectados en el Estudio NV15801 (Tabla 5). Los eventos que ocurrieron con mayor frecuencia en pacientes coinfectados fueron neutropenia (40 %), anemia (14 %), trombocitopenia (8 %), disminución de peso (16 %) y alteración del estado de ánimo (9 %).
Anomalías en las pruebas de laboratorio
Pacientes adultos
La anemia debida a hemólisis es la toxicidad más importante del tratamiento con ribavirina. Se observó anemia (hemoglobina inferior a 10 g/dl) en el 13 % de todos los pacientes tratados con la combinación de COPEGUS y PEGASYS en ensayos clínicos. La caída máxima en la hemoglobina ocurrió durante las primeras 8 semanas de inicio de la terapia con ribavirina [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Pacientes pediátricos
Las disminuciones en la hemoglobina, los neutrófilos y las plaquetas pueden requerir una reducción de la dosis o la suspensión permanente del tratamiento [ver DOSIFICACIÓN Y ADMINISTRACIÓN ]. La mayoría de las anomalías de laboratorio observadas durante el ensayo clínico volvieron a los niveles iniciales poco después de la interrupción del tratamiento.
En pacientes aleatorizados a terapia combinada, la incidencia de anomalías durante toda la fase de tratamiento (hasta 48 semanas más 24 semanas de seguimiento) en comparación con las primeras 24 semanas aumentó ligeramente para neutrófilos entre 500 y 1000 células/mm³ y valores de hemoglobina entre 8,5 y 10 g/dl. La mayoría de las anomalías hematológicas ocurrieron en las primeras 24 semanas de tratamiento.
Experiencia posterior a la comercialización
Se identificaron y notificaron las siguientes reacciones adversas durante el uso posterior a la aprobación de la terapia combinada de 100 mg de PEGASYS/COPEGUS. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Trastornos de la sangre y del sistema linfático
Aplasia pura de glóbulos rojos
Trastornos del oído y del laberinto
Discapacidad auditiva, pérdida de audición
Trastornos oculares
Desprendimiento de retina seroso
Trastornos inmunológicos
Rechazo de injertos hepáticos y renales
Trastornos del metabolismo y la nutrición
Deshidración
Trastornos de la piel y del tejido subcutáneo
Síndrome de Stevens-Johnson (SJS)
Necrólisis epidérmica tóxica (NET)
INTERACCIONES CON LA DROGAS
Los resultados de un subestudio farmacocinético no demostraron interacción farmacocinética entre PEGASYS (peginterferón alfa-2a) y ribavirina.
Inhibidores de la transcriptasa inversa de nucleósidos (INTI)
Los datos in vitro indican que la ribavirina reduce la fosforilación de lamivudina, estavudina y zidovudina. Sin embargo, no se observó interacción farmacocinética (p. ej., concentraciones plasmáticas o concentraciones de metabolitos activos trifosforilados intracelulares) ni farmacodinámica (p. ej., pérdida de la supresión virológica del VIH/VHC) cuando se observó ribavirina y lamivudina (n=18), estavudina (n=10) o Se coadministró zidovudina (n=6) como parte de un régimen de múltiples fármacos a pacientes coinfectados con VHC/VIH.
En el estudio NR15961 entre los pacientes cirróticos coinfectados con CHC/VIH que recibieron NRTI, se observaron casos de descompensación hepática (algunos fatales) [ver ADVERTENCIAS Y PRECAUCIONES ].
Los pacientes que reciben PEGASYS/COPEGUS 100 mg e NRTI deben ser monitoreados de cerca para detectar toxicidades asociadas al tratamiento. Los médicos deben consultar la información de prescripción de los respectivos NRTI para obtener orientación sobre el manejo de la toxicidad. Además, también se debe considerar la reducción de la dosis o la interrupción de PEGASYS, COPEGUS 100 mg o ambos si se observa un empeoramiento de las toxicidades, incluida la descompensación hepática (p. ej., Child-Pugh mayor o igual a 6) [ver ADVERTENCIAS Y PRECAUCIONES y DOSIFICACIÓN Y ADMINISTRACIÓN ].
didanosina
Está contraindicada la coadministración de COPEGUS y didanosina. Las concentraciones de didanosina o su metabolito activo (didesoxiadenosina 5'-trifosfato) aumentan cuando se administra didanosina junto con ribavirina, lo que podría causar o empeorar las toxicidades clínicas. Se han informado informes de insuficiencia hepática mortal, así como de neuropatía periférica, pancreatitis e hiperlactatemia/acidosis láctica sintomática en ensayos clínicos [ver CONTRAINDICACIONES ].
Zidovudina
En el estudio NR15961, los pacientes a los que se les administró zidovudina en combinación con PEGASYS/COPEGUS desarrollaron neutropenia grave (RAN inferior a 500) y anemia grave (hemoglobina inferior a 8 g/dl) con mayor frecuencia que pacientes similares que no recibieron zidovudina (neutropenia 15 % frente a 0,00 %). 9%) (anemia 5% vs. 1%). La interrupción de la zidovudina debe considerarse médicamente adecuada.
Fármacos metabolizados por el citocromo P450
Los estudios in vitro indican que la ribavirina no inhibe CYP 2C9, CYP 2C19, CYP 2D6 o CYP 3A4.
azatioprina
Se ha informado que el uso de ribavirina para tratar la hepatitis C crónica en pacientes que reciben azatioprina induce pancitopenia grave y puede aumentar el riesgo de mielotoxicidad relacionada con azatioprina. La inosina monofosfato deshidrogenasa (IMDH) es necesaria para una de las vías metabólicas de la azatioprina. Se sabe que la ribavirina inhibe la IMDH, lo que conduce a la acumulación de un metabolito de azatioprina, el monofosfato de 6-metiltioinosina (6-MTITP), que se asocia con mielotoxicidad (neutropenia, trombocitopenia y anemia). Los pacientes que reciben azatioprina con ribavirina deben tener hemogramas completos, incluidos los recuentos de plaquetas, monitoreados semanalmente durante el primer mes, dos veces al mes durante el segundo y tercer mes de tratamiento, luego mensualmente o con mayor frecuencia si es necesario cambiar la dosis u otro tratamiento [ver ADVERTENCIAS Y PRECAUCIONES ].
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Las reacciones adversas significativas asociadas con la terapia combinada de COPEGUS/PEGASYS incluyen depresión severa e ideación suicida, anemia hemolítica, supresión de la función de la médula ósea, trastornos autoinmunitarios e infecciosos, trastornos oftalmológicos, trastornos cerebrovasculares, disfunción pulmonar, colitis, pancreatitis y diabetes.
El prospecto de PEGASYS debe revisarse en su totalidad para obtener información de seguridad adicional antes de iniciar el tratamiento combinado.
El embarazo
COPEGUS 100 mg puede causar defectos de nacimiento y/o la muerte del feto expuesto. La ribavirina ha demostrado efectos teratogénicos y/o embriocidas significativos en todas las especies animales en las que se han realizado estudios adecuados. Estos efectos ocurrieron en dosis tan bajas como una vigésima parte de la dosis humana recomendada de ribavirina.
La terapia con COPEGUS no debe iniciarse a menos que se haya obtenido un informe de una prueba de embarazo negativa inmediatamente antes del inicio planificado de la terapia. Se debe tener sumo cuidado para evitar el embarazo en pacientes mujeres y en las parejas femeninas de pacientes varones. Se debe instruir a los pacientes para que usen al menos dos métodos anticonceptivos efectivos durante el tratamiento y durante los 6 meses posteriores a la interrupción del tratamiento. Las pruebas de embarazo deben realizarse mensualmente durante el tratamiento con COPEGUS de 100 mg y durante los 6 meses posteriores a la finalización del tratamiento [ver ADVERTENCIA EN CAJA , CONTRAINDICACIONES , Uso en poblaciones específicas , y INFORMACIÓN DEL PACIENTE ].
Anemia
La principal toxicidad de la ribavirina es la anemia hemolítica, que se observó en aproximadamente el 13 % de todos los sujetos tratados con COPEGUS/PEGASYS en ensayos clínicos. La anemia asociada con COPEGUS 100 mg ocurre dentro de 1 a 2 semanas del inicio de la terapia. Debido a que la caída inicial de la hemoglobina puede ser significativa, se recomienda obtener la hemoglobina o el hematocrito antes del tratamiento y en las semanas 2 y 4 de la terapia o con mayor frecuencia si está clínicamente indicado. A continuación, se debe realizar el seguimiento de los pacientes según corresponda desde el punto de vista clínico. Se debe tener precaución al iniciar el tratamiento en cualquier paciente con riesgo inicial de anemia grave (p. ej., esferocitosis, antecedentes de hemorragia gastrointestinal) [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Se han informado infartos de miocardio fatales y no fatales en pacientes con anemia causada por COPEGUS. Se debe evaluar a los pacientes para detectar enfermedades cardíacas subyacentes antes de iniciar el tratamiento con ribavirina. A los pacientes con enfermedades cardíacas preexistentes se les debe administrar electrocardiogramas antes del tratamiento y se les debe monitorear adecuadamente durante la terapia. Si hay algún deterioro del estado cardiovascular, la terapia debe suspenderse o descontinuarse [ver DOSIFICACIÓN Y ADMINISTRACIÓN ]. Debido a que la enfermedad cardíaca puede empeorar con la anemia inducida por medicamentos, los pacientes con antecedentes de enfermedad cardíaca significativa o inestable no deben usar COPEGUS [ver ADVERTENCIA EN CAJA y DOSIFICACIÓN Y ADMINISTRACIÓN ].
Falla hepática
Los pacientes con hepatitis C crónica (HCC) con cirrosis pueden correr riesgo de descompensación hepática y muerte cuando se tratan con interferones alfa, incluido PEGASYS. Los pacientes con CHC cirróticos coinfectados con VIH que reciben terapia antirretroviral altamente activa (HAART) e interferón alfa-2a con o sin ribavirina parecen tener un mayor riesgo de desarrollar descompensación hepática en comparación con los pacientes que no reciben HAART. En el estudio NR15961 [ver Estudios clínicos ], entre 129 pacientes cirróticos con CHC/VIH que recibieron TARGA, 14 (11 %) de estos pacientes en todos los brazos de tratamiento desarrollaron descompensación hepática que resultó en 6 muertes. Los 14 pacientes estaban tomando NRTI, incluidos estavudina, didanosina, abacavir, zidovudina y lamivudina. Este pequeño número de pacientes no permite discriminar entre NRTI específicos o el riesgo asociado. Durante el tratamiento, se debe controlar de cerca el estado clínico y la función hepática de los pacientes para detectar signos y síntomas de descompensación hepática. El tratamiento con PEGASYS/COPEGUS 100 mg debe suspenderse inmediatamente en pacientes con descompensación hepática [ver CONTRAINDICACIONES ].
Hipersensibilidad
Se han observado reacciones graves de hipersensibilidad aguda (p. ej., urticaria, angioedema, broncoconstricción y anafilaxia) durante el tratamiento con interferón alfa y ribavirina. Si se produce una reacción de este tipo, se debe interrumpir inmediatamente el tratamiento con PEGASYS y COPEGUS 100 mg y se debe instaurar el tratamiento médico adecuado. Se han informado reacciones cutáneas graves que incluyen erupciones vesiculoampollosas, reacciones en el espectro del síndrome de Stevens-Johnson (eritema multiforme mayor) con diversos grados de afectación de la piel y las mucosas y dermatitis exfoliativa (eritrodermia) en pacientes que reciben PEGASYS con y sin ribavirina. Los pacientes que desarrollen signos o síntomas de reacciones cutáneas graves deben interrumpir el tratamiento [ver REACCIONES ADVERSAS ].
Trastornos pulmonares
Se han informado disnea, infiltrados pulmonares, neumonitis, hipertensión pulmonar y neumonía durante el tratamiento con ribavirina e interferón. Se han producido casos ocasionales de neumonía mortal. Además, se ha informado sarcoidosis o la exacerbación de la sarcoidosis. Si hay evidencia de infiltrados pulmonares o deterioro de la función pulmonar, se debe monitorear de cerca a los pacientes y, si corresponde, se debe suspender el tratamiento combinado con COPEGUS/PEGASYS.
Supresión de la médula ósea
Se ha informado en la literatura que se produce pancitopenia (disminución marcada de glóbulos rojos, neutrófilos y plaquetas) y supresión de la médula ósea dentro de las 3 a 7 semanas posteriores a la administración concomitante de interferón pegilado/ribavirina y azatioprina. En este número limitado de pacientes (n = 8), la mielotoxicidad fue reversible dentro de las 4 a 6 semanas posteriores a la suspensión de la terapia antiviral contra el VHC y la azatioprina concomitante y no volvió a aparecer con la reintroducción de cualquiera de los tratamientos solos. Se debe suspender PEGASYS, COPEGUS 100 mg y azatioprina por pancitopenia, y no se debe reintroducir interferón pegilado/ribavirina con azatioprina concomitante [ver INTERACCIONES CON LA DROGAS ].
pancreatitis
El tratamiento con COPEGUS y PEGASYS debe suspenderse en pacientes con signos y síntomas de pancreatitis y discontinuarse en pacientes con pancreatitis confirmada.
Impacto sobre el crecimiento en pacientes pediátricos
Durante la terapia de combinación de hasta 48 semanas con PEGASYS más ribavirina, se observó inhibición del crecimiento en sujetos pediátricos de 5 a 17 años de edad. Se observaron disminuciones en el peso para la puntuación z de la edad y la altura para la puntuación z de la edad hasta 48 semanas de tratamiento en comparación con el valor inicial. Dos años después del tratamiento, el 16 % de los sujetos pediátricos estaba más de 15 percentiles por debajo de su curva de peso inicial y el 11 % estaba más de 15 percentiles por debajo de su curva de altura inicial.
Los datos disponibles a más largo plazo sobre sujetos que fueron seguidos hasta 6 años después del tratamiento son demasiado limitados para determinar el riesgo de reducción de la estatura adulta en algunos pacientes [ver Experiencia en estudios clínicos ].
Pruebas de laboratorio
Antes de comenzar la terapia combinada con PEGASYS/COPEGUS, se recomiendan pruebas de laboratorio hematológicas y bioquímicas estándar para todos los pacientes. Se debe realizar un cribado de embarazo para mujeres en edad fértil. Los pacientes que tienen anomalías cardíacas preexistentes deben someterse a electrocardiogramas antes del tratamiento con PEGASYS/COPEGUS.
Después del inicio de la terapia, se deben realizar pruebas hematológicas a las 2 y 4 semanas y pruebas bioquímicas a las 4 semanas. Se deben realizar pruebas adicionales periódicamente durante la terapia. En estudios clínicos en adultos, se midieron el CBC (incluido el nivel de hemoglobina y los recuentos de glóbulos blancos y plaquetas) y los parámetros químicos (incluidas las pruebas de función hepática y el ácido úrico) a las 1, 2, 4, 6 y 8 semanas, y luego cada 4 a 6 semanas o más frecuentemente si se encontraron anomalías. En el ensayo clínico pediátrico, las evaluaciones hematológicas y químicas se realizaron a las 1, 3, 5 y 8 semanas, y luego cada 4 semanas. La hormona estimulante de la tiroides (TSH) se midió cada 12 semanas. Se deben realizar pruebas de embarazo mensuales durante la terapia combinada y durante 6 meses después de suspender la terapia.
Los criterios de ingreso utilizados para los estudios clínicos de COPEGUS 100 mg y PEGASYS pueden considerarse como una guía de valores iniciales aceptables para el inicio del tratamiento:
- Recuento de plaquetas superior o igual a 90 000 células/mm³ (tan bajo como 75 000 células/mm³ en pacientes con VHC con cirrosis o 70 000 células/mm³ en pacientes con CHC y VIH)
- Recuento absoluto de neutrófilos (RAN) mayor o igual a 1500 células/mm³
- TSH y T4 dentro de los límites normales o función tiroidea adecuadamente controlada
- Recuento de células CD4+ superior o igual a 200 células/mm³ o recuento de células CD4+ superior o igual a 100 células/mm³ pero inferior a 200 células/mm³ y ARN del VIH-1 inferior a 5000 copias/ml en pacientes coinfectados por el VIH
- Hemoglobina mayor o igual a 12 g/dL para mujeres y mayor o igual a 13 g/dL para hombres en pacientes monoinfectados con CHC
- Hemoglobina mayor o igual a 11 g/dL para mujeres y mayor o igual a 12 g/dL para hombres en pacientes con CHC y VIH
Información de asesoramiento para pacientes
- Ver Etiquetado para pacientes aprobado por la FDA (guía del medicamento)
El embarazo
Se debe informar a los pacientes que la ribavirina puede causar defectos de nacimiento y/o la muerte del feto expuesto. La terapia con COPEGUS 100 mg no debe ser utilizada por mujeres embarazadas ni por hombres cuyas parejas femeninas estén embarazadas. Se debe tener extremo cuidado para evitar el embarazo en pacientes femeninas y en las parejas femeninas de pacientes masculinos que toman la terapia con COPEGUS y durante los 6 meses posteriores a la terapia. Los pacientes deben usar dos métodos confiables de control de la natalidad mientras reciben la terapia con COPEGUS y durante los 6 meses posteriores a la terapia. La terapia con COPEGUS no debe iniciarse hasta que se haya obtenido un informe de una prueba de embarazo negativa inmediatamente antes del inicio de la terapia. Los pacientes deben realizar una prueba de embarazo mensualmente durante la terapia y durante los 6 meses posteriores a la terapia.
Se debe advertir a las pacientes en edad fértil y a los hombres con parejas femeninas en edad fértil sobre los riesgos teratogénicos/embriocidas y se les debe instruir para que practiquen métodos anticonceptivos efectivos durante la terapia con COPEGUS y durante los 6 meses posteriores a la terapia. Se debe recomendar a los pacientes que notifiquen al proveedor de atención médica de inmediato en caso de embarazo [ver CONTRAINDICACIONES y ADVERTENCIAS Y PRECAUCIONES ].
Anemia
El evento adverso más común asociado con la ribavirina es la anemia, que puede ser grave [ver ADVERTENCIA EN CAJA , ADVERTENCIAS Y PRECAUCIONES y REACCIONES ADVERSAS ]. Se debe advertir a los pacientes que se requieren evaluaciones de laboratorio antes de comenzar la terapia con COPEGUS y periódicamente a partir de entonces [ver ADVERTENCIAS Y PRECAUCIONES ]. Se recomienda que los pacientes estén bien hidratados, especialmente durante las etapas iniciales del tratamiento.
Se debe advertir a los pacientes que desarrollen mareos, confusión, somnolencia y fatiga que eviten conducir vehículos u operar maquinaria.
Se debe recomendar a los pacientes que tomen COPEGUS 100 mg con alimentos.
Se debe preguntar a los pacientes sobre antecedentes de abuso de drogas antes de iniciar el tratamiento con COPEGUS/PEGASYS, ya que se han informado recaídas de adicción a las drogas y sobredosis de drogas en pacientes tratados con interferones.
Se debe advertir a los pacientes que no beban alcohol, ya que el alcohol puede exacerbar la infección crónica por hepatitis C.
Se debe informar a los pacientes sobre qué hacer en caso de que olviden una dosis de COPEGUS. Las dosis olvidadas deben tomarse lo antes posible durante el mismo día. Los pacientes no deben duplicar la siguiente dosis. Se debe recomendar a los pacientes que llamen a su proveedor de atención médica si tienen preguntas.
Se debe informar a los pacientes que se desconoce el efecto del tratamiento de la infección por hepatitis C con PEGASYS/COPEGUS sobre la transmisión, y que se deben tomar las precauciones adecuadas para prevenir la transmisión del virus de la hepatitis C durante el tratamiento o en caso de que falle el tratamiento.
Se debe informar a los pacientes sobre los posibles beneficios y riesgos relacionados con el uso de COPEGUS. Se deben dar instrucciones sobre el uso apropiado, incluida la revisión del contenido del paquete adjunto. GUÍA DE MEDICAMENTOS , que no es una divulgación de todos los posibles efectos adversos.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Carcinogénesis
En un estudio de carcinogenicidad en ratones p53 (+/-) hasta la dosis máxima tolerada de 100 mg/kg/día, la ribavirina no fue oncogénica. La ribavirina tampoco fue oncogénica en un estudio de carcinogenicidad de 2 años en ratas a dosis de hasta la dosis máxima tolerada de 60 mg/kg/día. Sobre la base del área de superficie corporal, estas dosis son aproximadamente 0,5 y 0,6 veces la dosis diaria máxima recomendada de ribavirina en humanos, respectivamente.
mutagénesis
La ribavirina demostró actividad mutagénica en el ensayo de linfoma de ratón in vitro. No se observó actividad clastogénica en un ensayo de micronúcleo de ratón in vivo a dosis de hasta 2000 mg/kg. Sin embargo, los resultados de los estudios publicados en la literatura muestran actividad clastogénica en el ensayo de micronúcleos de ratón in vivo a dosis orales de hasta 2000 mg/kg. Un ensayo letal dominante en ratas fue negativo, lo que indica que si ocurrieron mutaciones en ratas, no se transmitieron a través de gametos masculinos.
Deterioro de la fertilidad
En un estudio de fertilidad en ratas, la ribavirina mostró una reducción marginal en el recuento de espermatozoides a la dosis de 100 mg/kg/día sin efecto sobre la fertilidad. Al suspender el tratamiento, se produjo una recuperación total después de 1 ciclo de espermatogénesis. Se observaron anomalías en los espermatozoides en estudios en ratones diseñados para evaluar el curso temporal y la reversibilidad de la degeneración testicular inducida por ribavirina en dosis de 15 a 150 mg/kg/día (aproximadamente 0,1 a 0,8 veces la dosis diaria máxima recomendada de ribavirina en humanos) administrada durante 3 a 6 meses. Tras la interrupción del tratamiento, la recuperación esencialmente total de la toxicidad testicular inducida por ribavirina fue evidente en 1 o 2 ciclos espermatogénicos.
Las mujeres en edad fértil y los hombres con parejas femeninas en edad fértil no deben recibir COPEGUS a menos que la paciente y su pareja estén usando métodos anticonceptivos efectivos (dos formas confiables). Sobre la base de una vida media de dosis múltiples (t½) de ribavirina de 12 días, se debe utilizar un método anticonceptivo eficaz durante 6 meses después de la terapia (es decir, 15 vidas medias de depuración de ribavirina).
No se han realizado estudios de toxicología reproductiva usando PEGASYS en combinación con COPEGUS. Sin embargo, peginterferón alfa-2a y ribavirina cuando se administran por separado, cada uno tiene efectos adversos sobre la reproducción. Debe suponerse que los efectos producidos por cualquiera de los agentes solos también serían causados por la combinación de los dos agentes.
Uso en poblaciones específicas
El embarazo
Categoría X [ver CONTRAINDICACIONES ]. La ribavirina produjo efectos embriocidas y/o teratogénicos significativos en todas las especies animales en las que se han realizado estudios adecuados. Se observaron malformaciones del cráneo, paladar, ojo, mandíbula, extremidades, esqueleto y tracto gastrointestinal. La incidencia y la gravedad de los efectos teratogénicos aumentaron con el aumento de la dosis del fármaco. Se redujo la supervivencia de fetos y crías [ver CONTRAINDICACIONES y ADVERTENCIAS Y PRECAUCIONES ].
En estudios convencionales de embriotoxicidad/teratogenicidad en ratas y conejos, los niveles de dosis sin efecto observados fueron muy inferiores a los del uso clínico propuesto (0,3 mg/kg/día tanto para ratas como para conejos; aproximadamente 0,06 veces la dosis diaria recomendada de ribavirina en humanos). . No se observó toxicidad materna ni efectos en la descendencia en un estudio de toxicidad peri/postnatal en ratas que recibieron dosis orales de hasta 1 mg/kg/día (aproximadamente 0,01 veces la dosis diaria máxima recomendada de ribavirina en humanos).
Tratamiento y postratamiento: riesgo potencial para el feto
Se sabe que la ribavirina se acumula en los componentes intracelulares de donde se elimina muy lentamente. No se sabe si la ribavirina está contenida en el esperma y, de ser así, ejercerá un efecto teratogénico potencial sobre la fertilización de los óvulos. Sin embargo, debido a los posibles efectos teratogénicos humanos de la ribavirina, se debe recomendar a los pacientes varones que tomen todas las precauciones necesarias para evitar el riesgo de embarazo para sus parejas femeninas.
COPEGUS no debe ser utilizado por mujeres embarazadas ni por hombres cuyas parejas femeninas estén embarazadas. Las mujeres en edad fértil y los hombres con parejas femeninas en edad fértil no deben recibir COPEGUS a menos que la paciente y su pareja estén usando métodos anticonceptivos efectivos (dos formas confiables) durante la terapia y durante los 6 meses posteriores a la terapia [ver CONTRAINDICACIONES ].
Registro de Embarazo de Ribavirina
Se ha establecido un registro de embarazos con ribavirina para monitorear los resultados materno-fetales de los embarazos de pacientes mujeres y parejas mujeres de pacientes varones expuestos a ribavirina durante el tratamiento y durante los 6 meses posteriores a la interrupción del tratamiento. Se recomienda a los proveedores de atención médica y a los pacientes que informen tales casos llamando al 1-800-593-2214.
Madres lactantes
No se sabe si la ribavirina se excreta en la leche humana. Debido a que muchos medicamentos se excretan en la leche humana y para evitar cualquier posible reacción adversa grave en los lactantes a causa de la ribavirina, se debe tomar la decisión de suspender la lactancia o el tratamiento con COPEGUS 100 mg, en función de la importancia del tratamiento para la madre.
Uso pediátrico
No se han realizado evaluaciones farmacocinéticas en pacientes pediátricos.
No se ha establecido la seguridad y eficacia de COPEGUS en pacientes menores de 5 años.
Uso geriátrico
Los estudios clínicos de COPEGUS 100 mg y PEGASYS no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes. No se han realizado evaluaciones farmacocinéticas específicas para ribavirina en ancianos. El riesgo de reacciones tóxicas a este fármaco puede ser mayor en pacientes con insuficiencia renal. La dosis de COPEGUS 100mg debe reducirse en pacientes con aclaramiento de creatinina menor o igual a 50 mL/min; y la dosis de PEGASYS debe reducirse en pacientes con aclaramiento de creatinina inferior a 30 ml/min [ver DOSIFICACIÓN Y ADMINISTRACIÓN ; Uso en poblaciones específicas ].
La raza
Un estudio farmacocinético en 42 sujetos demostró que no existe una diferencia clínicamente significativa en la farmacocinética de ribavirina entre sujetos negros (n=14), hispanos (n=13) y caucásicos (n=15).
Insuficiencia renal
La función renal debe evaluarse en todos los pacientes antes del inicio de COPEGUS mediante la estimación de la depuración de creatinina del paciente.
Un ensayo clínico evaluó el tratamiento con COPEGUS y PEGASYS en 50 sujetos con CHC con insuficiencia renal moderada (aclaramiento de creatinina de 30 a 50 ml/min) o grave (aclaramiento de creatinina inferior a 30 ml/min) o enfermedad renal en etapa terminal (ESRD) que requería hemodiálisis crónica. (HD). En 18 sujetos con ESRD que recibían HD crónica, se administró COPEGUS a una dosis de 200 mg diarios sin diferencia aparente en el perfil de eventos adversos en comparación con sujetos con función renal normal. Se observaron reducciones de dosis e interrupciones temporales de COPEGUS (debido a reacciones adversas relacionadas con COPEGUS, principalmente anemia) en hasta un tercio de los sujetos con ESRD/HD durante el tratamiento; y solo un tercio de estos sujetos recibieron COPEGUS durante 48 semanas. Las exposiciones plasmáticas de ribavirina fueron aproximadamente un 20 % más bajas en sujetos con ESRD en HD en comparación con sujetos con función renal normal que recibieron la dosis diaria estándar de 1000/1200 mg de COPEGUS.
Los sujetos con insuficiencia renal moderada (n=17) o grave (n=14) no toleraron dosis diarias de 600 mg o 400 mg de COPEGUS, respectivamente, debido a reacciones adversas relacionadas con COPEGUS, principalmente anemia, y exhibieron del 20 % al 30 % exposiciones plasmáticas de ribavirina más altas (a pesar de las frecuentes modificaciones de la dosis) en comparación con sujetos con función renal normal (aclaramiento de creatinina superior a 80 ml/min) que reciben la dosis estándar de COPEGUS. Las tasas de interrupción fueron más altas en sujetos con insuficiencia renal grave en comparación con las observadas en sujetos con insuficiencia renal moderada o función renal normal. El modelo y la simulación farmacocinética indican que una dosis de 200 mg al día en pacientes con insuficiencia renal grave y una dosis de 200 mg al día alternada con 400 mg al día siguiente en pacientes con insuficiencia renal moderada proporcionará una exposición a la ribavirina plasmática similar a la de los pacientes con función renal normal. recibiendo el régimen aprobado de COPEGUS. Estas dosis no han sido estudiadas en pacientes [ver DOSIFICACIÓN Y ADMINISTRACIÓN y FARMACOLOGÍA CLÍNICA ].
Según los resultados farmacocinéticos y de seguridad de este ensayo, los pacientes con aclaramiento de creatinina menor o igual a 50 ml/min deben recibir una dosis reducida de COPEGUS; y los pacientes con aclaramiento de creatinina inferior a 30 ml/min deben recibir una dosis reducida de PEGASYS. El estado clínico y hematológico de los pacientes con depuración de creatinina menor o igual a 50 ml/min que reciben COPEGUS 100 mg debe ser monitoreado cuidadosamente. Los pacientes con anomalías de laboratorio clínicamente significativas o reacciones adversas persistentemente graves o que empeoran deben suspender el tratamiento [ver DOSIFICACIÓN Y ADMINISTRACIÓN , FARMACOLOGÍA CLÍNICA , y Prospecto del paquete PEGASYS ].
Deterioro hepático
No se ha evaluado el efecto de la insuficiencia hepática sobre la farmacocinética de la ribavirina después de la administración de COPEGUS. Los ensayos clínicos de COPEGUS 100 mg se restringieron a pacientes con enfermedad de Child-Pugh clase A.
Género
No se observaron diferencias clínicamente significativas en la farmacocinética de ribavirina entre sujetos masculinos y femeninos.
La farmacocinética de la ribavirina, cuando se corrige por el peso, es similar en pacientes masculinos y femeninos.
Receptores de trasplantes de órganos
No se ha establecido la seguridad y eficacia del tratamiento con PEGASYS y COPEGUS 100 mg en pacientes con trasplante de hígado y otros trasplantes. Al igual que con otros interferones alfa, se han informado rechazos de injertos hepáticos y renales con PEGASYS, solo o en combinación con COPEGUS [ver REACCIONES ADVERSAS ].
SOBREDOSIS
No se han notificado casos de sobredosis con COPEGUS en ensayos clínicos. Se ha observado hipocalcemia e hipomagnesemia en personas a las que se les administró una dosis de ribavirina superior a la recomendada. En la mayoría de estos casos, la ribavirina se administró por vía intravenosa en dosis de hasta cuatro veces la dosis oral diaria máxima recomendada y, en algunos casos, superándola.
CONTRAINDICACIONES
COPEGUS (ribavirina) está contraindicado en:
- Mujeres que están embarazadas. COPEGUS puede causar daño fetal cuando se administra a una mujer embarazada. COPEGUS está contraindicado en mujeres que están o pueden quedar embarazadas. Si este medicamento se usa durante el embarazo, o si la paciente queda embarazada mientras toma este medicamento, se debe informar a la paciente sobre el peligro potencial para el feto [ver ADVERTENCIAS Y PRECAUCIONES , Uso en poblaciones específicas , y INFORMACIÓN DEL PACIENTE ].
- Hombres cuyas parejas femeninas están embarazadas.
- Pacientes con hemoglobinopatías (p. ej., talasemia mayor o anemia de células falciformes).
- En combinación con didanosina. Se han notificado informes de insuficiencia hepática mortal, así como de neuropatía periférica, pancreatitis e hiperlactatemia/acidosis láctica sintomática en ensayos clínicos [ver INTERACCIONES CON LA DROGAS ].
La terapia combinada de COPEGUS y PEGASYS está contraindicada en pacientes con:
- Hepatitis autoinmune.
- Descompensación hepática (puntuación de Child-Pugh superior a 6; clase B y C) en pacientes cirróticos monoinfectados con CHC antes del tratamiento [ver ADVERTENCIAS Y PRECAUCIONES ].
- Descompensación hepática (puntuación de Child-Pugh mayor o igual a 6) en pacientes con CHC cirróticos coinfectados con VIH antes del tratamiento [ver ADVERTENCIAS Y PRECAUCIONES ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
La ribavirina es un fármaco antiviral [ver Microbiología ].
Farmacocinética
Se dispone de datos farmacocinéticos de dosis múltiples de ribavirina para pacientes con VHC que recibieron ribavirina en combinación con peginterferón alfa-2a. Después de la administración de 1200 mg/día con alimentos durante 12 semanas con una media ± DE (n = 39; peso corporal superior a 75 kg), el AUC0-12 h fue de 25 361 ± 7110 ng·h/mL y la Cmax fue de 2748 ± 818 ng/mL. El tiempo promedio para alcanzar la Cmax fue de 2 horas. Las concentraciones plasmáticas mínimas de ribavirina después de 12 semanas de dosificación con alimentos fueron 1662±545 ng/mL en pacientes infectados con VHC que recibieron 800 mg/día (n=89) y 2112±810 ng/mL en pacientes que recibieron 1200 mg/día ( n=75; peso corporal superior a 75 kg).
La vida media terminal de la ribavirina luego de la administración de una dosis oral única de COPEGUS es de aproximadamente 120 a 170 horas. El aclaramiento aparente total tras la administración de una dosis oral única de COPEGUS 100 mg es de aproximadamente 26 l/h. Hay una gran acumulación de ribavirina después de dosis múltiples (dos veces al día), de modo que la Cmax en el estado estacionario fue cuatro veces mayor que la de una dosis única.
Efecto de los alimentos sobre la absorción de ribavirina
La biodisponibilidad de una dosis oral única de ribavirina aumentó con la administración conjunta con una comida rica en grasas. La absorción se hizo más lenta (se duplicó la Tmax) y el AUC0-192h y la Cmax aumentaron un 42 % y un 66 %, respectivamente, cuando se tomó COPEGUS con una comida rica en grasas en comparación con las condiciones de ayuno [ver DOSIFICACIÓN Y ADMINISTRACIÓN y INFORMACIÓN DEL PACIENTE ].
Eliminación y Metabolismo
Se desconoce la contribución de las vías renal y hepática a la eliminación de ribavirina tras la administración de COPEGUS 100 mg. Los estudios in vitro indican que la ribavirina no es un sustrato de las enzimas CYP450.
Insuficiencia renal
Un ensayo clínico evaluó a 50 sujetos con CHC con insuficiencia renal moderada (aclaramiento de creatinina de 30 a 50 ml/min) o grave (aclaramiento de creatinina inferior a 30 ml/min) o enfermedad renal en etapa terminal (ESRD) que requería hemodiálisis crónica (HD). El aclaramiento aparente de ribavirina se redujo en sujetos con aclaramiento de creatinina menor o igual a 50 ml/min, incluidos los sujetos con ESRD en HD, presentando aproximadamente un 30 % del valor encontrado en sujetos con función renal normal. El modelo y la simulación farmacocinética indican que una dosis de 200 mg al día en pacientes con insuficiencia renal grave y una dosis de 200 mg al día alternada con 400 mg al día siguiente en pacientes con insuficiencia renal moderada proporcionará exposiciones de ribavirina en plasma similares a las observadas en pacientes con función renal normal recibiendo la dosis diaria estándar de 1000/1200 mg de COPEGUS. Estas dosis no han sido estudiadas en pacientes.
En 18 sujetos con ERT que recibían HD crónica, se administró COPEGUS a una dosis de 200 mg diarios. Las exposiciones plasmáticas de ribavirina en estos sujetos fueron aproximadamente un 20 % más bajas en comparación con los sujetos con función renal normal que recibieron la dosis diaria estándar de 1000/1200 mg de COPEGUS [ver DOSIFICACIÓN Y ADMINISTRACIÓN , Uso en poblaciones específicas ].
La ribavirina plasmática se elimina por hemodiálisis con una tasa de extracción de aproximadamente el 50%; sin embargo, debido al gran volumen de distribución de la ribavirina, no se espera que la exposición plasmática cambie con la hemodiálisis.
Microbiología
Mecanismo de acción
El mecanismo por el cual la ribavirina contribuye a su eficacia antiviral en la clínica no se comprende completamente. La ribavirina tiene actividad antiviral directa en cultivo de tejidos contra muchos virus de ARN. La ribavirina aumenta la frecuencia de mutación en los genomas de varios virus de ARN y el trifosfato de ribavirina inhibe la polimerasa del VHC en una reacción bioquímica.
Actividad antiviral en cultivo celular
En el sistema modelo estable de cultivo celular del VHC (replicón del VHC), la ribavirina inhibió la replicación autónoma del ARN del VHC con un valor de concentración efectiva del 50 % (EC50) de 11-21 mcM. En el mismo modelo, PEG-IFN α-2a también inhibió la replicación del ARN del VHC, con un valor de CE50 de 0,1-3 ng/mL. La combinación de PEG-IFN α-2a y ribavirina fue más eficaz para inhibir la replicación del ARN del VHC que cualquiera de los dos agentes por separado.
Resistencia
Los diferentes genotipos del VHC muestran una variabilidad clínica considerable en su respuesta al tratamiento con PEG-IFN-α y ribavirina. Los determinantes genéticos virales asociados con la respuesta variable no se han identificado definitivamente.
Resistencia cruzada
No se ha observado resistencia cruzada entre IFN α y ribavirina.
Toxicología Animal
En un estudio en ratas, se concluyó que la letalidad dominante no fue inducida por ribavirina en dosis de hasta 200 mg/kg durante 5 días (hasta 1,7 veces la dosis máxima recomendada de ribavirina en humanos).
Los estudios a largo plazo en ratones y ratas (18 a 24 meses; dosis de 20 a 75 y de 10 a 40 mg/kg/día, respectivamente, aproximadamente 0,1 a 0,4 veces la dosis diaria máxima de ribavirina en humanos) han demostrado una relación entre exposición crónica a ribavirina y una mayor incidencia de lesiones vasculares (hemorragias microscópicas) en ratones. En ratas, se produjo degeneración de la retina en los controles, pero la incidencia aumentó en las ratas tratadas con ribavirina.
Estudios clínicos
Pacientes con hepatitis C crónica
Pacientes adultos
La seguridad y eficacia de PEGASYS en combinación con COPEGUS para el tratamiento de la infección por el virus de la hepatitis C se evaluaron en dos ensayos clínicos controlados aleatorios. Todos los pacientes eran adultos, tenían enfermedad hepática compensada, virus de la hepatitis C detectable, diagnóstico de hepatitis crónica por biopsia hepática y no habían sido tratados previamente con interferón. Aproximadamente el 20% de los pacientes en ambos estudios tenían cirrosis compensada (Child-Pugh clase A). Los pacientes coinfectados con VIH fueron excluidos de estos estudios.
En el estudio NV15801, los pacientes fueron aleatorizados para recibir PEGASYS 180 mcg por vía subcutánea una vez a la semana con un placebo oral, PEGASYS 180 mcg una vez a la semana con COPEGUS 1000 mg por vía oral (peso corporal inferior a 75 kg) o 1200 mg por vía oral (peso corporal superior a o igual a 75 kg) o interferón alfa-2b 3 MUI subcutáneo tres veces por semana más ribavirina 1000 mg o 1200 mg por vía oral. Todos los pacientes recibieron 48 semanas de terapia seguidas de 24 semanas de seguimiento sin tratamiento. La asignación del tratamiento con COPEGUS o con placebo fue cegada. La respuesta virológica sostenida se definió como ARN del VHC indetectable (menos de 50 UI/mL) en o después de la semana 68 del estudio. PEGASYS en combinación con COPEGUS 100 mg resultó en una RVS más alta en comparación con PEGASYS solo o interferón alfa-2b y ribavirina (Tabla 9) . En todos los brazos de tratamiento, los pacientes con el genotipo viral 1, independientemente de la carga viral, tuvieron una tasa de respuesta más baja a PEGASYS en combinación con COPEGUS 100 mg en comparación con los pacientes con otros genotipos virales.
La diferencia en la respuesta general al tratamiento (PEGASYS/COPEGUS – interferón alfa-2b/ribavirina) fue del 9 % (IC del 95 %: 2,3, 15,3).
En el estudio NV15942, todos los pacientes recibieron PEGASYS 180 mcg por vía subcutánea una vez a la semana y se aleatorizaron al tratamiento durante 24 o 48 semanas y a una dosis de COPEGUS de 800 mg o 1000 mg/1200 mg (para peso corporal inferior a 75 kg/superior a o igual a 75 kg). La asignación a los cuatro brazos de tratamiento se estratificó por genotipo viral y título viral del VHC inicial. Los pacientes con genotipo 1 y títulos virales altos (definidos como más de 2 x 106 copias de ARN del VHC/ml de suero) se asignaron preferentemente al tratamiento durante 48 semanas.
Respuesta virológica sostenida (RVS) y genotipo del VHC
AVC 1 y 4 — Independientemente del título viral inicial, el tratamiento durante 48 semanas con PEGASYS y 1000 mg o 1200 mg de COPEGUS resultó en una RVS más alta (definida como ARN del VHC indetectable al final del período de seguimiento de 24 semanas sin tratamiento) en comparación con un tratamiento más corto (24 semanas) y/o 800 mg de COPEGUS.
AVC 2 y 3 — Independientemente del título viral inicial, el tratamiento durante 24 semanas con PEGASYS y 800 mg de COPEGUS resultó en una RVS similar en comparación con el tratamiento más prolongado (48 semanas) y/o 1000 mg o 1200 mg de COPEGUS (consulte la Tabla 10).
El número de pacientes con genotipo 5 y 6 fue demasiado bajo para permitir una evaluación significativa.
Pacientes pediátricos
Sujetos pediátricos de 5 a 17 años de edad (55 % menores de 12 años) que no habían recibido tratamiento previo y que tenían hepatitis C crónica, enfermedad hepática compensada y ARN del VHC detectable fueron tratados con COPEGUS 100 mg aproximadamente 15 mg/kg/día más PEGASYS 180 mcg/1,73 m² x área de superficie corporal una vez por semana durante 48 semanas. Todos los sujetos fueron seguidos durante 24 semanas después del tratamiento. La respuesta virológica sostenida (RVS) se definió como ARN del VHC indetectable (menos de 50 UI/mL) en la semana 68 del estudio o después. Se aleatorizó un total de 114 sujetos para recibir un tratamiento combinado de COPEGUS más PEGASYS o monoterapia con PEGASYS; los sujetos que fracasaron en la monoterapia con PEGASYS a las 24 semanas o más tarde podrían recibir COPEGUS más PEGASYS de etiqueta abierta. Los brazos aleatorios iniciales se equilibraron por factores demográficos; 55 sujetos recibieron tratamiento combinado inicial de COPEGUS 100 mg más PEGASYS y 59 recibieron PEGASYS más placebo; en la población general por intención de tratar, el 45 % eran mujeres, el 80 % eran caucásicos y el 81 % estaban infectados con el genotipo 1 del VHC. Los resultados de la RVS se resumen en la Tabla 11.
Otros predictores de respuesta al tratamiento
Las tasas de respuesta al tratamiento son más bajas en pacientes con factores de mal pronóstico que reciben tratamiento con interferón alfa pegilado. En los estudios NV15801 y NV15942, las tasas de respuesta al tratamiento fueron menores en pacientes mayores de 40 años (50 % frente a 66 %), en pacientes con cirrosis (47 % frente a 59 %), en pacientes que pesaban más de 85 kg (49 % frente a 50 kg). 60%), y en pacientes con genotipo 1 con carga viral alta vs. baja (43% vs. 56%). Los pacientes afroamericanos tuvieron tasas de respuesta más bajas en comparación con los caucásicos.
En los estudios NV15801 y NV15942, la falta de respuesta virológica temprana a las 12 semanas (definida como ARN del VHC indetectable o más de 2 log10 por debajo del valor inicial) fue motivo para interrumpir el tratamiento. De los pacientes que carecían de una respuesta viral temprana a las 12 semanas y completaron un ciclo de tratamiento recomendado a pesar de la opción definida en el protocolo de interrumpir el tratamiento, 5/39 (13 %) lograron una RVS. De los pacientes que carecían de una respuesta viral temprana a las 24 semanas, 19 completaron un curso completo de terapia y ninguno logró una RVS.
Pacientes coinfectados con hepatitis C crónica/VIH
En el estudio NR15961, los pacientes con CHC/VIH fueron aleatorizados para recibir 180 mcg de PEGASYS por vía subcutánea una vez por semana más un placebo oral, 180 mcg de PEGASYS una vez por semana más 800 mg de COPEGUS por vía oral al día o interferón alfa-2a, 3 MUI por vía subcutánea tres veces por semana más COPEGUS 800 mg por vía oral al día. Todos los pacientes recibieron 48 semanas de tratamiento y se evaluó la respuesta virológica sostenida (RVS) a las 24 semanas de seguimiento sin tratamiento. La asignación de tratamiento con COPEGUS 100 mg o con placebo fue cegada en los brazos de tratamiento con PEGASYS. Todos los pacientes eran adultos, tenían enfermedad hepática compensada, virus de la hepatitis C detectable, diagnóstico de hepatitis C crónica por biopsia hepática y no habían sido tratados previamente con interferón. Los pacientes también tenían un recuento de células CD4+ superior o igual a 200 células/mm³ o un recuento de células CD4+ superior o igual a 100 células/mm³ pero inferior a 200 células/mm³ y ARN del VIH-1 inferior a 5000 copias/ml, y un estado estable del VIH Aproximadamente el 15% de los pacientes del estudio tenían cirrosis. Los resultados se muestran en la Tabla 12.
Las tasas de respuesta al tratamiento fueron más bajas en pacientes con CHC/VIH con factores de mal pronóstico (incluido el genotipo 1 del VHC, ARN del VHC superior a 800 000 UI/mL y cirrosis) que recibieron tratamiento con interferón alfa pegilado.
De los pacientes que no demostraron ARN del VHC indetectable o al menos una reducción de 2 log10 desde el inicio en el título de ARN del VHC a las 12 semanas de tratamiento combinado con PEGASYS y COPEGUS, el 2 % (2/85) logró una RVS.
En pacientes CHC con coinfección por VIH que recibieron 48 semanas de tratamiento con PEGASYS solo o en combinación con COPEGUS de 100 mg, la media y la mediana de los títulos de ARN del VIH no aumentaron por encima del valor inicial durante el tratamiento o 24 semanas después del tratamiento.
INFORMACIÓN DEL PACIENTE
COPEGUS® (Co-PEG-UHS) (ribavirina) Tabletas
Lea esta Guía del medicamento detenidamente antes de comenzar a tomar COPEGUS 100 mg y lea la Guía del medicamento cada vez que tome más COPEGUS. Es posible que haya nueva información. Esta información no reemplaza la conversación con su proveedor de atención médica sobre su condición médica o su tratamiento.
Lea también la Guía del medicamento para PEGASYS (peginterferón alfa-2a).
¿Cuál es la información más importante que debo saber sobre COPEGUS?
- Las mujeres deben hacerse una prueba de embarazo antes de comenzar con COPEGUS, todos los meses durante el tratamiento con COPEGUS 100 mg y todos los meses durante los 6 meses posteriores al tratamiento con COPEGUS.
- Si usted o su pareja sexual femenina quedan embarazadas mientras toma COPEGUS 100 mg o dentro de los 6 meses posteriores a que deje de tomar COPEGUS, informe a su proveedor de atención médica de inmediato. Usted o su proveedor de atención médica deben comunicarse con el Registro de embarazos con ribavirina llamando al 1-800-593-2214. El Registro de Embarazo de Ribavirin recopila información sobre lo que les sucede a las madres y sus bebés si la madre toma COPEGUS mientras está embarazada.
¿Qué es COPEGUS 100mg?
COPEGUS 100 mg es un medicamento recetado que se usa con otro medicamento llamado PEGASYS (peginterferón alfa-2a) para tratar la infección crónica (que dura mucho tiempo) por hepatitis C en personas mayores de 5 años cuyo hígado todavía funciona normalmente y que no han sido tratados antes con un medicamento llamado interferón alfa. No se sabe si COPEGUS es seguro y funcionará en niños menores de 5 años.
¿Quién no debe tomar COPEGUS 100mg?
Ver “¿Cuál es la información más importante que debo saber sobre COPEGUS 100mg?”
No tome COPEGUS si usted:
- tiene ciertos tipos de hepatitis causada por el ataque del sistema inmunitario al hígado (hepatitis autoinmune)
- tiene ciertos trastornos sanguíneos, como talasemia mayor o anemia de células falciformes (hemoglobinopatías)
- tomar didanosina (Videx o Videx CE)
Hable con su proveedor de atención médica antes de comenzar el tratamiento con COPEGUS 100 mg si tiene alguna de estas condiciones médicas.
¿Qué debo decirle a mi proveedor de atención médica antes de tomar COPEGUS 100 mg?
Antes de tomar COPEGUS, informe a su proveedor de atención médica si tiene o ha tenido:
- tratamiento para la hepatitis C que no funcionó para usted
- reacciones alérgicas graves a COPEGUS o a cualquiera de los componentes de COPEGUS. Consulte el final de esta Guía del medicamento para obtener una lista de ingredientes.
- problemas respiratorios. COPEGUS 100mg puede causar o empeorar los problemas respiratorios que ya tiene.
- problemas de la vista. COPEGUS puede causar problemas oculares o empeorar los problemas oculares que ya tiene. Debe hacerse un examen de la vista antes de comenzar el tratamiento con COPEGUS.
- ciertos trastornos de la sangre como la anemia
- presión arterial alta, problemas cardíacos o ha tenido un ataque al corazón. Su proveedor de atención médica debe analizar su sangre y su corazón antes de comenzar el tratamiento con COPEGUS.
- problemas tiroideos
- diabetes. La terapia combinada de COPEGUS 100 mg y PEGASYS puede empeorar su diabetes o hacerla más difícil de tratar.
- problemas hepáticos aparte de la infección por el virus de la hepatitis C
- virus de inmunodeficiencia humana (VIH) u otros problemas de inmunidad
- problemas de salud mental, incluyendo depresión o pensamientos de suicidio
- problemas de riñon
- un trasplante de organo
- adicción o abuso de drogas
- infección por el virus de la hepatitis B
- cualquier otra condición médica
- están amamantando. No se sabe si COPEGUS 100 mg pasa a la leche materna. Usted y su proveedor de atención médica deben decidir si tomará COPEGUS o amamantará.
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos herbales. Algunos medicamentos pueden causar efectos secundarios graves si se toman mientras toma COPEGUS. Algunos medicamentos pueden afectar el funcionamiento de COPEGUS 100 mg o COPEGUS 100 mg puede afectar el funcionamiento de sus otros medicamentos.
Informe especialmente a su proveedor de atención médica si toma algún medicamento para tratar el VIH, incluida didanosina (Videx o Videx EC), o si toma azatioprina (Imuran o Azasan).
Conozca los medicamentos que toma. Mantenga una lista de ellos para mostrársela a su proveedor de atención médica o farmacéutico cuando obtenga un medicamento nuevo.
¿Cómo debo tomar COPEGUS 100mg?
- Tome COPEGUS exactamente como se lo indique su proveedor de atención médica. Su proveedor de atención médica le dirá cuánto COPEGUS debe tomar y cuándo tomarlo. Para niños mayores de 5 años, su proveedor de atención médica le recetará la dosis de COPEGUS de 100 mg según el peso.
- Tome COPEGUS con alimentos.
- Si olvida una dosis de COPEGUS 100 mg, tome la dosis olvidada lo antes posible durante el mismo día. No duplique la siguiente dosis. Si tiene preguntas sobre qué hacer, llame a su proveedor de atención médica.
- Si toma demasiado COPEGUS 100 mg, llame de inmediato a su proveedor de atención médica o al centro local de control de intoxicaciones, o acuda de inmediato a la sala de emergencias del hospital más cercano.
- Su proveedor de atención médica debe realizar análisis de sangre antes de que comience el tratamiento con COPEGUS, en las semanas 2 y 4 de tratamiento, y luego, según sea necesario, para ver qué tan bien está tolerando el tratamiento y para detectar efectos secundarios. Su proveedor de atención médica puede cambiar su dosis de COPEGUS 100 mg según los resultados de los análisis de sangre o los efectos secundarios que pueda tener.
- Si tiene problemas cardíacos, su proveedor de atención médica debe revisar su corazón mediante un electrocardiograma antes de comenzar el tratamiento con COPEGUS y, si es necesario, durante el tratamiento.
¿Qué debo evitar mientras tomo COPEGUS?
COPEGUS 100 mg puede hacerle sentir cansado, mareado o confundido. No debe conducir ni manejar maquinaria si tiene alguno de estos síntomas.
No tomes alcohol, incluyendo cerveza, vino y licor. Esto puede empeorar su enfermedad hepática.
¿Cuáles son los posibles efectos secundarios de COPEGUS?
COPEGUS 100 mg puede causar efectos secundarios graves que incluyen:
Ver “¿Cuál es la información más importante que debo saber sobre COPEGUS 100mg?”
- Hinchazón e irritación de su páncreas (pancreatitis). Puede tener dolor de estómago, náuseas, vómitos o diarrea.
- Reacciones alérgicas graves. Los síntomas pueden incluir urticaria, sibilancias, dificultad para respirar, dolor de pecho, hinchazón de la boca, la lengua o los labios, o sarpullido intenso.
- Problemas respiratorios graves. La dificultad para respirar puede ser un signo de una infección pulmonar grave (neumonía) que puede provocar la muerte.
- Problemas oculares graves que puede conducir a la pérdida de la visión o ceguera.
- Problemas hepáticos. Algunas personas pueden experimentar un empeoramiento de la función hepática. Informe a su proveedor de atención médica de inmediato si tiene alguno de estos síntomas: distensión estomacal, confusión, orina marrón y ojos amarillos.
- Depresión severa
- Pensamientos e intentos suicidas
- Efecto sobre el crecimiento en los niños. Los niños pueden experimentar un retraso en el aumento de peso y aumento de estatura mientras reciben tratamiento con PEGASYS y COPEGUS. La recuperación del crecimiento ocurre después de que se detiene el tratamiento, pero es posible que algunos niños no alcancen la altura que se esperaba que tuvieran antes del tratamiento. Hable con su proveedor de atención médica si le preocupa el crecimiento de su hijo durante el tratamiento con PEGASYS y COPEGUS.
Llame a su proveedor de atención médica u obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente. Estos pueden ser signos de un efecto secundario grave del tratamiento con COPEGUS 100 mg.
Los efectos secundarios comunes de COPEGUS tomado con PEGASYS incluyen:
- síntomas similares a los de la gripe: cansancio, dolor de cabeza, temblores junto con temperatura alta (fiebre) y dolores musculares o articulares
- cambios de humor, sensación de irritabilidad, ansiedad y dificultad para dormir
- pérdida de apetito, náuseas, vómitos y diarrea
- perdida de cabello
- Comezón
Informe a su proveedor de atención médica sobre cualquier efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios del tratamiento con COPEGUS. Para obtener más información, consulte a su proveedor de atención médica o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
También puede informar los efectos secundarios a Genentech al 1-888-835-2555.
¿Cómo debo conservar COPEGUS 100mg?
- Guarde las tabletas de COPEGUS entre 59 °F y 86 °F (15 °C y 30 °C).
- Mantenga la botella bien cerrada.
Mantenga COPEGUS 100 mg y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de COPEGUS
No se sabe si el tratamiento con COPEGUS 100 mg en combinación con PEGASYS evitará que una persona infectada transmita el virus de la hepatitis C a otra persona durante el tratamiento.
veces, los medicamentos se recetan para fines distintos a los enumerados en la Guía del medicamento. No use COPEGUS 100mg para una condición para la cual no fue recetado. No le dé COPEGUS a otras personas, incluso si tienen los mismos síntomas que usted tiene. Puede que les haga daño.
Esta Guía del medicamento resume la información más importante sobre COPEGUS. Si desea obtener más información, hable con su proveedor de atención médica. Puede pedirle a su proveedor de atención médica o farmacéutico información sobre COPEGUS que está escrita para profesionales de la salud.
¿Cuáles son los ingredientes de COPEGUS 100mg?
Ingrediente activo: ribavirina
Ingredientes inactivos: el núcleo de la tableta contiene almidón pregelatinizado, celulosa microcristalina, glicolato de almidón de sodio, almidón de maíz y estearato de magnesio. El recubrimiento de la tableta contiene Chromatone-P u Opadry Pink (fabricado con hidroxipropilmetilcelulosa, talco, dióxido de titanio, óxido de hierro amarillo sintético y óxido de hierro rojo sintético), etilcelulosa (ECD-30) y triacetina.
Esta Guía del medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de EE. UU.
