Famvir 250mg, 500mg Famciclovir Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Famvir y cómo se usa?
Famvir es un medicamento recetado que se usa para tratar los síntomas del herpes zóster agudo (culebrilla), herpes labial y herpes genital. Famvir 250 mg se puede usar solo o con otros medicamentos.
Famvir 250mg pertenece a una clase de medicamentos llamados Antivirales, Otros.
No se sabe si Famvir es seguro y efectivo en niños menores de 18 años.
¿Cuáles son los posibles efectos secundarios de Famvir 250 mg?
Famvir 250 mg puede causar efectos secundarios graves que incluyen:
- confusión,
- orinar poco o nada,
- hinchazón en los pies o los tobillos,
- cansancio, y
- dificultad para respirar
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Famvir 500 mg incluyen:
- dolor de cabeza, y
- náuseas
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Famvir. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
El ingrediente activo de las tabletas de 500 mg de FAMVIR es famciclovir, un profármaco administrado por vía oral del agente antiviral penciclovir. Químicamente, el famciclovir se conoce como diacetato de 2-[2-(2-amino-9H-purin-9-il)etil]-1,3-propanodiol. Su fórmula molecular es C14H19N5O4; su peso molecular es 321,3. Es un derivado de guanina acíclico sintético y tiene la siguiente estructura
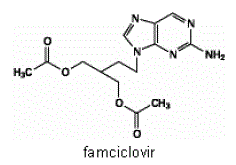
El famciclovir es un sólido de color blanco a amarillo pálido. Es libremente soluble en acetona y metanol, y escasamente soluble en etanol e isopropanol. A 25°C, el famciclovir es libremente soluble (>25% p/v) en agua inicialmente, pero precipita rápidamente como el monohidrato escasamente soluble (2%-3% p/v). Famciclovir no es higroscópico por debajo del 85% de humedad relativa. Los coeficientes de reparto son: octanol/agua (pH 4,8) P=1,09 y octanol/tampón fosfato (pH 7,4) P=2,08.
Los comprimidos de FAMVIR de 250 mg contienen 125 mg, 250 mg o 500 mg de famciclovir, junto con los siguientes ingredientes inactivos: hidroxipropilcelulosa, hidroxipropilmetilcelulosa, lactosa, estearato de magnesio, polietilenglicoles, glicolato de almidón sódico y dióxido de titanio.
INDICACIONES
Pacientes adultos inmunocompetentes
Herpes labial (herpes labial)
FAMVIR está indicado para el tratamiento del herpes labial recurrente.
Herpes genital
Episodios recurrentes:
FAMVIR está indicado para el tratamiento de episodios recurrentes de herpes genital. No se ha establecido la eficacia de FAMVIR cuando se inicia más de 6 horas después del inicio de los síntomas o lesiones.
Terapia supresiva:
FAMVIR 250 mg está indicado para la terapia de supresión crónica de episodios recurrentes de herpes genital. No se ha establecido la eficacia y seguridad de FAMVIR para la supresión del herpes genital recurrente más allá de 1 año.
Herpes Zoster (culebrilla)
FAMVIR 500mg está indicado para el tratamiento del herpes zoster. No se ha establecido la eficacia de FAMVIR cuando se inicia más de 72 horas después de la aparición de la erupción.
Pacientes adultos infectados por el VIH
Herpes orolabial o genital recurrente
FAMVIR está indicado para el tratamiento de episodios recurrentes de herpes orolabial o genital en adultos infectados por el VIH. No se ha establecido la eficacia de FAMVIR cuando se inicia más de 48 horas después del inicio de los síntomas o lesiones.
Limitación de uso
No se ha establecido la eficacia y seguridad de FAMVIR para:
- Pacientes
- Pacientes con primer episodio de herpes genital
- Pacientes con zóster oftálmico
- Pacientes inmunocomprometidos que no sean para el tratamiento del herpes bucolabial o genital recurrente en pacientes infectados por el VIH
- Pacientes negros y afroamericanos con herpes genital recurrente
DOSIFICACIÓN Y ADMINISTRACIÓN
FAMVIR 500 mg se puede tomar con o sin alimentos.
Recomendación de dosificación en pacientes adultos inmunocompetentes
Herpes labial (herpes labial)
La dosis recomendada de FAMVIR 500 mg para el tratamiento del herpes labial recurrente es de 1500 mg en dosis única. La terapia debe iniciarse ante el primer signo o síntoma de herpes labialis (p. ej., hormigueo, picazón, ardor, dolor o lesión).
Herpes genital
Episodios recurrentes
La dosis recomendada de FAMVIR para el tratamiento de episodios recurrentes de herpes genital es de 1000 mg dos veces al día durante 1 día. La terapia debe iniciarse ante el primer signo o síntoma de un episodio recurrente (p. ej., hormigueo, picazón, ardor, dolor o lesión).
terapia supresiva
La dosis recomendada de FAMVIR 500 mg para la terapia de supresión crónica de episodios recurrentes de herpes genital es de 250 mg dos veces al día.
Herpes Zoster (culebrilla)
La dosis recomendada de FAMVIR 250 mg para el tratamiento del herpes zoster es de 500 mg cada 8 horas durante 7 días. La terapia debe iniciarse tan pronto como se diagnostique herpes zoster.
Recomendación de dosificación en pacientes adultos infectados por el VIH
Herpes orolabial o genital recurrente
La dosis recomendada de FAMVIR para el tratamiento del herpes bucolabial o genital recurrente en pacientes infectados por el VIH es de 500 mg dos veces al día durante 7 días. La terapia debe iniciarse ante el primer signo o síntoma de un episodio recurrente (p. ej., hormigueo, picazón, ardor, dolor o lesión).
Recomendación de dosificación en pacientes con insuficiencia renal
Las recomendaciones de dosificación para pacientes adultos con insuficiencia renal se proporcionan en la Tabla 1 [ver Uso en poblaciones específicas , FARMACOLOGÍA CLÍNICA ].
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Las tabletas FAMVIR están disponibles en 3 concentraciones:
- 125 mg: blanco, redondo, recubierto con película, biconvexo, bordes biselados, grabado con "FAMVIR" en un lado y "125" en el otro lado
- 250 mg: blanco, redondo, recubierto con película, biconvexo, bordes biselados, grabado con "FAMVIR" en un lado y "250" en el otro lado
- 500 mg: blanco, ovalado, recubierto con película, biconvexo, grabado con “FAMVIR” en un lado y “500” en el otro lado
Almacenamiento y manipulación
FAMVIR Los comprimidos se suministran como comprimidos recubiertos con película de la siguiente manera: 125 mg en frascos de 30; 250 mg en frascos de 30; 500 mg en frascos de 30 y Paquetes de Unidades Individuales de 50 (para uso institucional únicamente).
- Comprimido de FAMVIR 125 mg: blanco, redondo, recubierto con película, biconvexo, bordes biselados, grabado con "FAMVIR" en un lado y "125" en el otro. 125 mg 30's CDN 0078-0366-15
- FAMVIR tableta de 250 mg : Blanco, redondo film estucado, biconvexo, cantos biselados, grabado “FAMVIR” por una cara y “250” por la otra. 250 mg 30's CDN 0078-0367-15
- FAMVIR tableta de 500 mg : Blanco, ovalado, film estucado, biconvexo, grabado “FAMVIR” por una cara y “500” por la otra. 500 mg 30's CDN 0078-0368-15 500 mg SUP 50's CDN 0078-0368-64
Almacenar a 25°C (77°F); excursiones permitidas a 15-30°C (59-86°F) [consulte Temperatura ambiente controlada por USP].
Distribuido por: Novartis Pharmaceuticals Corporation, East Hanover, New Jersey 07936. Revisado: septiembre de 2016
EFECTOS SECUNDARIOS
La insuficiencia renal aguda se analiza con mayor detalle en otras secciones de la etiqueta [ver ADVERTENCIAS Y PRECAUCIONES ].
Los eventos adversos más comunes informados en al menos 1 indicación por >10 % de los pacientes adultos tratados con FAMVIR 250 mg son dolor de cabeza y náuseas.
Experiencia en ensayos clínicos en pacientes adultos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Pacientes inmunocompetentes
La seguridad de FAMVIR 250 mg se evaluó en estudios clínicos controlados con placebo y activo en los que participaron 816 pacientes con herpes zoster tratados con FAMVIR (FAMVIR, 250 mg tres veces al día a 750 mg tres veces al día); 163 pacientes tratados con FAMVIR con herpes genital recurrente (FAMVIR, 1000 mg dos veces al día); 1197 pacientes con herpes genital recurrente tratados con FAMVIR 250 mg como terapia de supresión (125 mg una vez al día a 250 mg tres veces al día) de los cuales 570 pacientes recibieron FAMVIR (de etiqueta abierta y/o doble ciego) durante al menos 10 meses; y 447 pacientes con herpes labial tratados con FAMVIR (FAMVIR 500 mg, 1500 mg una vez al día o 750 mg dos veces al día). La Tabla 2 enumera los eventos adversos seleccionados.
La Tabla 3 enumera las anomalías de laboratorio seleccionadas en los ensayos de supresión del herpes genital.
Pacientes infectados por el VIH
En pacientes infectados por el VIH, los eventos adversos informados con mayor frecuencia para FAMVIR (500 mg dos veces al día; n=150) y aciclovir (400 mg, 5x/día; n=143), respectivamente, fueron dolor de cabeza (17 % frente a 15 % ), náuseas (11 % frente a 13 %), diarrea (7 % frente a 11 %), vómitos (5 % frente a 4 %), fatiga (4 % frente a 2 %) y dolor abdominal (3 % frente a 4 %). 6%).
Experiencia posterior a la comercialización
Los eventos adversos enumerados a continuación se informaron durante el uso posterior a la aprobación de FAMVIR. Debido a que estos eventos son informados voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco:
Trastornos de la sangre y del sistema linfático : Trombocitopenia
Trastornos hepatobiliares : pruebas de función hepática anormales, ictericia colestática
Trastornos del sistema inmunológico : Shock anafiláctico, reacción anafiláctica
Trastornos del sistema nervioso : Mareos, somnolencia, convulsiones
Desórdenes psiquiátricos Confusión (incluyendo delirio, desorientación y estado de confusión que ocurre predominantemente en ancianos), alucinaciones
Trastornos de la piel y del tejido subcutáneo : Urticaria, eritema multiforme, síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, angioedema (p. ej., edema facial, palpebral, periorbitario y faríngeo), vasculitis por hipersensibilidad
Trastornos cardiacos : palpitaciones
INTERACCIONES CON LA DROGAS
Potencial de FAMVIR 250 mg para afectar a otras drogas
La farmacocinética en estado estacionario de la digoxina no se vio alterada por la administración concomitante de dosis múltiples de famciclovir (500 mg tres veces al día). No se observó ningún efecto clínicamente significativo sobre la farmacocinética de zidovudina, su metabolito glucurónido de zidovudina o emtricitabina después de una dosis oral única de 500 mg de famciclovir coadministrada con zidovudina o emtricitabina.
Un estudio in vitro con microsomas hepáticos humanos sugiere que famciclovir no es un inhibidor de las enzimas CYP3A4.
Potencial de que otras drogas afecten al penciclovir
No se observaron alteraciones clínicamente significativas en la farmacocinética de penciclovir después de la administración de una dosis única de 500 mg de famciclovir después del pretratamiento con dosis múltiples de alopurinol, cimetidina, teofilina, zidovudina, prometazina, cuando se administró poco después de un antiácido (hidróxido de magnesio y aluminio) o concomitantemente con emtricitabina. No se observó ningún efecto clínicamente significativo sobre la farmacocinética de penciclovir luego de la administración de dosis múltiples (tres veces al día) de famciclovir (500 mg) con dosis múltiples de digoxina.
El uso concomitante con probenecid u otros fármacos eliminados significativamente por la secreción tubular renal activa puede dar lugar a un aumento de las concentraciones plasmáticas de penciclovir.
La conversión de 6-desoxi penciclovir a penciclovir es catalizada por la aldehído oxidasa. Potencialmente podrían ocurrir interacciones con otros medicamentos metabolizados por esta enzima y/o inhibidores de esta enzima. Los estudios de interacción clínica de famciclovir con cimetidina y prometazina, inhibidores in vitro de la aldehído oxidasa, no mostraron efectos relevantes sobre la formación de penciclovir. El raloxifeno, un potente inhibidor de la aldehído oxidasa in vitro, podría disminuir la formación de penciclovir. Sin embargo, no se ha realizado un estudio clínico de interacción farmacológica para determinar la magnitud de la interacción entre penciclovir y raloxifeno.
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Fallo renal agudo
Se han notificado casos de insuficiencia renal aguda en pacientes con enfermedad renal subyacente que recibieron dosis de FAMVIR inapropiadamente altas para su nivel de función renal. Se recomienda reducir la dosis cuando se administra FAMVIR a pacientes con insuficiencia renal [ver DOSIFICACIÓN Y ADMINISTRACIÓN , Uso en poblaciones específicas ].
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA (Información para el paciente).
No hay evidencia de que FAMVIR afecte la capacidad de un paciente para conducir o utilizar máquinas. Sin embargo, los pacientes que experimentan mareos, somnolencia, confusión u otras alteraciones del sistema nervioso central mientras toman FAMVIR 500 mg deben abstenerse de conducir o manejar maquinaria.
Debido a que FAMVIR contiene lactosa (las tabletas de FAMVIR de 125 mg, 250 mg y 500 mg contienen 26,9 mg, 53,7 mg y 107,4 mg de lactosa, respectivamente), los pacientes con intolerancia hereditaria a la galactosa, deficiencia grave de lactasa o problemas de absorción de glucosa o galactosa deben ser aconseja hablar con su proveedor de atención médica antes de tomar FAMVIR.
Herpes labial (herpes labial)
Se debe aconsejar a los pacientes que inicien el tratamiento ante el primer signo o síntoma de recurrencia del herpes labial (p. ej., hormigueo, picazón, ardor, dolor o lesión). Se debe indicar a los pacientes que el tratamiento para el herpes labial no debe exceder de 1 dosis. Se debe informar a los pacientes que FAMVIR no es una cura para el herpes labial.
Herpes genital
Se debe informar a los pacientes que FAMVIR no es una cura para el herpes genital. No hay datos que evalúen si FAMVIR evitará la transmisión de la infección a otras personas. Debido a que el herpes genital es una enfermedad de transmisión sexual, los pacientes deben evitar el contacto con las lesiones o las relaciones sexuales cuando las lesiones y/o los síntomas están presentes para evitar infectar a sus parejas. El herpes genital se transmite con frecuencia en ausencia de síntomas a través de la diseminación viral asintomática. Por lo tanto, se debe aconsejar a los pacientes que utilicen prácticas sexuales más seguras.
Si está indicada la terapia episódica para el herpes genital recurrente, se debe recomendar a los pacientes que inicien la terapia al primer signo o síntoma de un episodio.
No hay datos sobre la seguridad o la eficacia de la terapia de supresión crónica de más de 1 año de duración.
Herpes Zoster (culebrilla)
No hay datos sobre el tratamiento iniciado más de 72 horas después de la aparición de la erupción por herpes zoster. Se debe recomendar a los pacientes que inicien el tratamiento lo antes posible después de un diagnóstico de herpes zóster.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Carcinogénesis
Se realizaron estudios de carcinogenicidad dietética de dos años con famciclovir en ratas y ratones. Se observó un aumento en la incidencia de adenocarcinoma mamario (un tumor común en animales de esta cepa) en ratas hembra que recibieron la dosis alta de 600 mg/kg/día (1,1 a 4,5 veces la exposición sistémica humana a la dosis oral diaria total recomendada). oscilando entre 500 mg y 2000 mg, según las comparaciones del área bajo la curva de concentración plasmática [24 horas AUC] para penciclovir). No se informaron aumentos en la incidencia de tumores en ratas macho tratadas con dosis de hasta 240 mg/kg/día (0,7 a 2,7 veces el AUC humano), o en ratones macho y hembra con dosis de hasta 600 mg/kg/día (0,3 a 2,7 veces el AUC humano). 1.2x el AUC humano).
mutagénesis
Se analizó el potencial genotóxico de famciclovir y penciclovir (el metabolito activo de famciclovir) en una batería de ensayos in vitro e in vivo. Famciclovir y penciclovir fueron negativos en pruebas in vitro para mutaciones genéticas en bacterias (S. typhimurium y E. coli) y síntesis de ADN no programada en células HeLa 83 de mamíferos (a dosis de hasta 10.000 y 5.000 mcg/placa, respectivamente). Famciclovir también fue negativo en el ensayo de linfoma de ratón L5178Y (5000 mcg/mL), la prueba de micronúcleo de ratón in vivo (4800 mg/kg) y el estudio letal dominante en rata (5000 mg/kg). Famciclovir indujo aumentos en la poliploidía en linfocitos humanos in vitro en ausencia de daño cromosómico (1200 mcg/mL). Penciclovir fue positivo en el ensayo de linfoma de ratón L5178Y para mutaciones genéticas/aberraciones cromosómicas, con y sin activación metabólica (1000 mcg/mL). En linfocitos humanos, penciclovir provocó aberraciones cromosómicas en ausencia de activación metabólica (250 mcg/mL). Penciclovir provocó un aumento de la incidencia de micronúcleos en la médula ósea de ratón in vivo cuando se administró por vía intravenosa en dosis altamente tóxicas para la médula ósea (500 mg/kg), pero no cuando se administró por vía oral.
Deterioro de la fertilidad
Se observó toxicidad testicular en ratas, ratones y perros tras la administración repetida de famciclovir o penciclovir. Los cambios testiculares incluyeron atrofia de los túbulos seminíferos, reducción en el conteo de espermatozoides y/o aumento en la incidencia de espermatozoides con morfología anormal o motilidad reducida. El grado de toxicidad para la reproducción masculina estuvo relacionado con la dosis y la duración de la exposición. En ratas macho, se observó una disminución de la fertilidad después de 10 semanas de dosificación de 500 mg/kg/día (1,4 a 5,7 veces el AUC humano). El nivel de efecto no observable para la toxicidad testicular y de esperma en ratas después de la administración crónica (26 semanas) fue de 50 mg/kg/día (0,15 a 0,6x la exposición sistémica humana según las comparaciones del AUC). Se observó toxicidad testicular tras la administración crónica a ratones (104 semanas) y perros (26 semanas) a dosis de 600 mg/kg/día (0,3 a 1,2x el AUC humano) y 150 mg/kg/día (1,3 a 5,1x el AUC humana), respectivamente.
Famciclovir no tuvo efecto sobre el rendimiento reproductivo general o la fertilidad en ratas hembra en dosis de hasta 1000 mg/kg/día (2,7 a 10,8 veces el AUC humano).
Dos estudios controlados con placebo en un total de 130 hombres por lo demás sanos con un perfil de esperma normal durante un período inicial de 8 semanas y herpes genital recurrente que recibieron FAMVIR oral (250 mg dos veces al día) (n=66) o placebo (n=64) la terapia durante 18 semanas no mostró evidencia de efectos significativos sobre el recuento, la motilidad o la morfología de los espermatozoides durante el tratamiento o durante un seguimiento de 8 semanas.
Uso en poblaciones específicas
El embarazo
Embarazo Categoría B
Después de la administración oral, el famciclovir (profármaco) se convierte en penciclovir (fármaco activo). No existen estudios adecuados y bien controlados sobre el uso de famciclovir o penciclovir en mujeres embarazadas. No se observaron efectos adversos sobre el desarrollo embriofetal en estudios de reproducción animal usando famciclovir y penciclovir en dosis superiores a la dosis humana máxima recomendada (MRHD) y la exposición humana. Debido a que los estudios de reproducción en animales no siempre predicen la respuesta humana, el famciclovir debe usarse durante el embarazo solo si es necesario.
En estudios de reproducción en animales, ratas y conejas preñadas recibieron famciclovir oral en dosis (hasta 1000 mg/kg/día) que proporcionaron de 2,7 a 10,8 veces (ratas) y de 1,4 a 5,4 veces (conejos) la exposición sistémica en humanos según el AUC. No se observaron efectos adversos sobre el desarrollo embriofetal. En otros estudios, ratas y conejas preñadas recibieron famciclovir intravenoso a dosis (360 mg/kg/día) de 1,5 a 6 veces (ratas) y (120 mg/kg/día) de 1,1 a 4,5 veces (conejas) o penciclovir a dosis (80 mg/kg/día) 0,3 a 1,3 veces (ratas) y (60 mg/kg/día) 0,5 a 2,1 veces (conejos) la MRHD según las comparaciones del área de superficie corporal. No se observaron efectos adversos sobre el desarrollo embriofetal.
Informes de exposición durante el embarazo
Para monitorear los resultados materno-fetales de las mujeres embarazadas expuestas a FAMVIR 500 mg, Novartis Pharmaceuticals Corporation mantiene un sistema de notificación de embarazo FAMVIR. Se alienta a los médicos a informar a sus pacientes llamando al 1-888-NOW-NOVA (669-6682).
Madres lactantes
No se sabe si famciclovir (profármaco) o penciclovir (fármaco activo) se excretan en la leche humana. Tras la administración oral de famciclovir a ratas lactantes, el penciclovir se excretó en la leche materna en concentraciones superiores a las observadas en el plasma. No hay datos sobre la seguridad de FAMVIR 250 mg en lactantes. FAMVIR 500 mg no debe usarse en madres lactantes a menos que se considere que los beneficios potenciales superan los riesgos potenciales asociados con el tratamiento.
Uso pediátrico
No se ha establecido la eficacia de FAMVIR 250 mg en pacientes pediátricos. El perfil farmacocinético y la seguridad de famciclovir (gránulos experimentales mezclados con OraSweet® o comprimidos) se estudiaron en 3 estudios abiertos.
El estudio 1 fue un estudio farmacocinético y de seguridad de dosis única en bebés de 1 mes a
El estudio 2 fue un estudio abierto, de farmacocinética de dosis única y de seguridad de dosis múltiples de gránulos experimentales de famciclovir mezclados con OraSweet en niños de 1 a
Se inscribió un total de 100 pacientes en la parte de seguridad de dosis múltiples del estudio; 47 sujetos con infección activa o latente por VHS y 53 sujetos con varicela. Los pacientes con infección por VHS activa o latente recibieron famciclovir dos veces al día durante 7 días. La dosis diaria de famciclovir osciló entre 150 mg y 500 mg dos veces al día, según el peso corporal del paciente. Los pacientes con varicela recibieron famciclovir tres veces al día durante 7 días. La dosis diaria de famciclovir osciló entre 150 mg y 500 mg tres veces al día, según el peso corporal del paciente. Los eventos adversos clínicos y las anomalías en las pruebas de laboratorio observadas en este estudio fueron similares a las observadas en adultos. Los datos disponibles son insuficientes para respaldar el uso de famciclovir para el tratamiento de niños de 1 a
Varicela
No se ha establecido la eficacia de famciclovir para el tratamiento de la varicela en pacientes pediátricos o adultos. Famciclovir está aprobado para el tratamiento del herpes zoster en pacientes adultos. Sin embargo, la extrapolación de datos de eficacia de adultos con herpes zoster a niños con varicela no sería apropiada. Aunque la varicela y el herpes zoster son causados por el mismo virus, las enfermedades son diferentes.
Herpes genital
La información clínica sobre el herpes genital en niños es limitada. Por lo tanto, los datos de eficacia de adultos no pueden extrapolarse a esta población. Además, el famciclovir no se ha estudiado en niños de 1 a
Herpes labial
No existen datos farmacocinéticos y de seguridad en niños de 1 a
El estudio 3 fue un estudio abierto de un solo brazo para evaluar la farmacocinética, la seguridad y la actividad antiviral de una dosis única de 1500 mg (tres tabletas de 500 mg) de famciclovir en niños de 12 a
En un ensayo de fase 3 en adultos en el que los pacientes recibieron una dosis única de 1500 mg de famciclovir o placebo, la mediana de tiempo hasta la cicatrización entre los pacientes con lesiones no abortadas fue de 4,4 días en el grupo de dosis única de 1500 mg de famciclovir y de 6,2 días en el grupo de grupo placebo. Cabe señalar que, en el estudio de adultos, los pacientes iniciaron el tratamiento en el plazo de 1 hora después de la aparición de los síntomas [ver Estudios clínicos ]. Según los resultados de eficacia del Estudio 3, no se recomienda famciclovir en niños de 12 a
Uso geriátrico
De 816 pacientes con herpes zoster en estudios clínicos que fueron tratados con FAMVIR, 248 (30,4 %) tenían ≥65 años y 103 (13 %) tenían ≥75 años. No se observaron diferencias generales en la incidencia o tipos de eventos adversos entre pacientes más jóvenes y mayores. De 610 pacientes con herpes simple recurrente (tipo 1 o tipo 2) en estudios clínicos que fueron tratados con FAMVIR 500 mg, 26 (4,3 %) tenían >65 años y 7 (1,1 %) tenían >75 años. Los estudios clínicos de FAMVIR 500 mg en pacientes con herpes genital recurrente no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente en comparación con sujetos más jóvenes.
No se recomienda ajustar la dosis de famciclovir en función de la edad a menos que la función renal esté alterada [ver DOSIFICACIÓN Y ADMINISTRACIÓN , FARMACOLOGÍA CLÍNICA ]. En general, se debe tener la debida precaución en la administración y seguimiento de FAMVIR 250 mg en pacientes de edad avanzada, lo que refleja la mayor frecuencia de disminución de la función renal y el uso concomitante de otros medicamentos.
Pacientes con insuficiencia renal
El aclaramiento plasmático aparente, el aclaramiento renal y la tasa constante de eliminación plasmática de penciclovir disminuyeron linealmente con la reducción de la función renal. Tras la administración de una dosis oral única de 500 mg de famciclovir (n=27) a voluntarios sanos y a voluntarios con diversos grados de insuficiencia renal (CLCR osciló entre 6,4 y 138,8 ml/min), se obtuvieron los siguientes resultados (tabla 4):
En un estudio de dosis múltiples de famciclovir realizado en sujetos con diversos grados de insuficiencia renal (n=18), la farmacocinética de penciclovir fue comparable a la de dosis únicas.
Se recomienda un ajuste de dosis para pacientes con insuficiencia renal [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Pacientes con insuficiencia hepática
La insuficiencia hepática leve o moderada (hepatitis crónica [n=6], abuso crónico de etanol [n=8] o cirrosis biliar primaria [n=1]) no tuvo efecto sobre el grado de disponibilidad (AUC) de penciclovir después de una dosis única de 500 mg de famciclovir. Sin embargo, hubo una disminución del 44% en la concentración plasmática máxima media (Cmax) de penciclovir y el tiempo hasta la concentración plasmática máxima (tmax) aumentó en 0,75 horas en pacientes con insuficiencia hepática en comparación con voluntarios normales. No se recomienda ajustar la dosis en pacientes con insuficiencia hepática leve o moderada. No se ha evaluado la farmacocinética de penciclovir en pacientes con insuficiencia hepática grave. La conversión de famciclovir al metabolito activo penciclovir puede verse afectada en estos pacientes, lo que da como resultado concentraciones plasmáticas de penciclovir más bajas y, por lo tanto, posiblemente una disminución de la eficacia de famciclovir [ver FARMACOLOGÍA CLÍNICA ].
Pacientes negros y afroamericanos
En un ensayo aleatorizado, doble ciego, controlado con placebo realizado en 304 adultos negros y afroamericanos inmunocompetentes con herpes genital recurrente, no hubo diferencia en la mediana del tiempo de curación entre los pacientes que recibieron FAMVIR o placebo. En general, el perfil de reacciones adversas fue similar al observado en otros ensayos clínicos de FAMVIR para pacientes adultos [ver REACCIONES ADVERSAS ]. Se desconoce la relevancia de los resultados de este estudio para otras indicaciones en pacientes negros y afroamericanos [ver Estudios clínicos ].
SOBREDOSIS
Se debe administrar una terapia sintomática y de apoyo adecuada. El penciclovir se elimina por hemodiálisis.
CONTRAINDICACIONES
FAMVIR 250mg está contraindicado en pacientes con hipersensibilidad conocida al producto, sus componentes o Denavir® (crema de penciclovir).
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
Famciclovir es un profármaco administrado por vía oral del agente antiviral penciclovir [ver Microbiología ].
Farmacocinética
Famciclovir es el análogo diacetil 6-desoxi del compuesto antiviral activo penciclovir. Después de la administración oral, famciclovir experimenta un metabolismo rápido y extenso a penciclovir y se detecta poco o nada de famciclovir en plasma u orina. El penciclovir se elimina predominantemente sin cambios por vía renal. Por lo tanto, la dosis de FAMVIR 500 mg debe ajustarse en pacientes con diferentes grados de insuficiencia renal [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Farmacocinética en adultos
Absorción y biodisponibilidad:
La biodisponibilidad absoluta de penciclovir es del 77 ± 8 %, según se determina tras la administración de una dosis oral de 500 mg de famciclovir y una dosis intravenosa de 400 mg de penciclovir a 12 sujetos masculinos sanos.
Las concentraciones de penciclovir aumentaron en proporción a la dosis en un rango de dosis de famciclovir de 125 mg a 1000 mg administrados como dosis única. La Tabla 5 muestra los parámetros farmacocinéticos medios de penciclovir después de la administración única de FAMVIR a voluntarios varones sanos.
Después de la administración oral de una dosis única de 500 mg de famciclovir a 7 pacientes con herpes zoster, el AUC (media ± DE), Cmax y tmax fueron 12,1±1,7 mcg h/mL, 4,0±0,7 mcg/mL y 0,7±0,2 horas , respectivamente. El AUC de penciclovir fue aproximadamente un 35% mayor en pacientes con herpes zoster en comparación con voluntarios sanos. Parte de esta diferencia puede deberse a diferencias en la función renal entre los 2 grupos.
No hay acumulación de penciclovir tras la administración de 500 mg de famciclovir tres veces al día durante 7 días.
La Cmáx de penciclovir disminuyó aproximadamente un 50 % y el tmáx se retrasó 1,5 horas cuando se administró una formulación en cápsula de famciclovir con alimentos (el contenido nutricional fue de aproximadamente 910 Kcal y 26 % de grasa). No hubo efecto sobre el grado de disponibilidad (AUC) de penciclovir. Hubo una disminución del 18 % en la Cmax y un retraso en el tmax de aproximadamente 1 hora cuando se administró famciclovir 2 horas después de una comida en comparación con su administración 2 horas antes de una comida. Debido a que no hubo efecto sobre el grado de disponibilidad sistémica de penciclovir, FAMVIR 250 mg puede tomarse sin tener en cuenta las comidas.
Distribución:
El volumen de distribución (Vdβ) fue de 1,08±0,17 l/kg en 12 varones sanos después de una dosis intravenosa única de penciclovir de 400 mg administrada como perfusión intravenosa de 1 hora. El penciclovir se une en
Metabolismo:
Después de la administración oral, el famciclovir se desacetila y oxida para formar penciclovir. Los metabolitos inactivos incluyen 6-desoxi penciclovir, penciclovir monoacetilado y 6-desoxi penciclovir monoacetilado (5 %, INTERACCIONES CON LA DROGAS ].
Eliminación:
Aproximadamente el 94 % de la radiactividad administrada se recuperó en la orina durante 24 horas (83 % de la dosis se excretó en las primeras 6 horas) después de la administración de 5 mg/kg de penciclovir radiomarcado en una infusión de 1 hora a 3 voluntarios varones sanos. El penciclovir representó el 91% de la radiactividad excretada en la orina.
Tras la administración oral de una dosis única de 500 mg de famciclovir radiomarcado a 3 voluntarios varones sanos, el 73 % y el 27 % de la radiactividad administrada se recuperó en la orina y las heces durante 72 horas, respectivamente. El penciclovir representó el 82 % y el 6-desoxi penciclovir el 7 % de la radiactividad excretada en la orina. Aproximadamente el 60% de la dosis radiomarcada administrada se recogió en la orina en las primeras 6 horas.
Después de la administración intravenosa de penciclovir en 48 voluntarios varones sanos, el aclaramiento plasmático total medio ± DE de penciclovir fue de 36,6 ± 6,3 l/h (0,48 ± 0,09 l/h/kg). El aclaramiento renal de penciclovir representó el 74,5±8,8% del aclaramiento plasmático total.
El aclaramiento renal de penciclovir luego de la administración oral de una dosis única de 500 mg de famciclovir a 109 voluntarios varones sanos fue de 27,7 ± 7,6 l/h. La secreción tubular activa contribuye a la eliminación renal de penciclovir.
La vida media de eliminación plasmática de penciclovir fue de 2,0 ± 0,3 horas después de la administración intravenosa de penciclovir a 48 voluntarios varones sanos y de 2,3 ± 0,4 horas después de la administración oral de 500 mg de famciclovir a 124 voluntarios varones sanos. La vida media en 17 pacientes con herpes zoster fue de 2,8±1,0 horas y 2,7±1,0 horas después de dosis únicas y repetidas, respectivamente.
Poblaciones Especiales
Pacientes geriátricos
Según la comparación de estudios cruzados, el AUC de penciclovir fue un 40 % mayor y el aclaramiento renal de penciclovir fue un 22 % menor en sujetos de edad avanzada (n=18, edad 65-79 años) en comparación con sujetos más jóvenes. Parte de esta diferencia puede deberse a diferencias en la función renal entre los 2 grupos. No se recomienda ajustar la dosis de famciclovir en función de la edad a menos que la función renal esté alterada [ver DOSIFICACIÓN Y ADMINISTRACIÓN , Uso en poblaciones específicas ]
Pacientes con insuficiencia renal
En sujetos con diversos grados de insuficiencia renal, el aclaramiento plasmático aparente, el aclaramiento renal y la tasa constante de eliminación plasmática de penciclovir disminuyeron linealmente con reducciones en la función renal, después de dosis únicas y repetidas [ver Uso en poblaciones específicas ]. Se recomienda un ajuste de dosis para pacientes con insuficiencia renal [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Pacientes con insuficiencia hepática
La insuficiencia hepática leve o moderada no tuvo efecto sobre el grado de disponibilidad (AUC) de penciclovir [ver Uso en poblaciones específicas ]. No se recomienda ajustar la dosis en pacientes con insuficiencia hepática leve o moderada. No se ha evaluado el efecto de la insuficiencia hepática grave sobre la farmacocinética de penciclovir.
Pacientes infectados por el VIH
Tras la administración oral de una dosis única de 500 mg de famciclovir a pacientes con VIH, los parámetros farmacocinéticos de penciclovir fueron comparables a los observados en sujetos sanos.
Género
La farmacocinética de penciclovir se evaluó en 18 voluntarios sanos de sexo masculino y 18 voluntarios sanos de sexo femenino después de la administración oral de una dosis única de 500 mg de famciclovir. El AUC de penciclovir fue de 9,3±1,9 mcg h/mL y 11,1±2,1 mcg h/mL en hombres y mujeres, respectivamente. El aclaramiento renal de penciclovir fue de 28,5±8,9 l/h y 21,8±4,3 l/h, respectivamente. Estas diferencias se atribuyeron a diferencias en la función renal entre los 2 grupos. No se recomienda ajustar la dosis de famciclovir en función del género.
La raza
Se realizó una evaluación retrospectiva para comparar los parámetros farmacocinéticos obtenidos en sujetos negros y caucásicos después de la administración única y repetida una, dos o tres veces al día de 500 mg de famciclovir. Los datos de un estudio en voluntarios sanos (dosis única), un estudio en sujetos con diversos grados de insuficiencia renal (dosis única y repetida) y un estudio en sujetos con insuficiencia hepática (dosis única) no indicaron diferencias significativas en la farmacocinética de penciclovir entre sujetos negros y caucásicos.
Microbiología
Mecanismo de acción
El famciclovir es un profármaco del penciclovir, que ha demostrado actividad inhibitoria contra el virus del herpes simple tipo 1 (HSV-1) y 2 (HSV-2) y el virus de la varicela zoster (VZV). En las células infectadas con HSV-1, HSV-2 o VZV, la timidina cinasa viral fosforila el penciclovir a una forma de monofosfato que, a su vez, es convertida por las cinasas celulares en la forma activa trifosfato de penciclovir. Los estudios bioquímicos demuestran que el trifosfato de penciclovir inhibe la ADN polimerasa del HSV-2 de manera competitiva con el trifosfato de desoxiguanosina. En consecuencia, la síntesis de ADN viral del herpes y, por lo tanto, la replicación se inhiben selectivamente. El trifosfato de penciclovir tiene una vida media intracelular de 10 horas en HSV-1, 20 horas en HSV-2 y 7 horas en células infectadas con VZV cultivadas. Sin embargo, se desconoce el significado clínico de la vida media intracelular.
Actividad antiviral
En estudios de cultivos celulares, el penciclovir inhibe los siguientes virus del herpes: HSV-1, HSV-2 y VZV. La actividad antiviral del penciclovir contra las cepas de tipo salvaje cultivadas en fibroblastos de prepucio humano se evaluó con un ensayo de reducción de placa y tinción con cristal violeta 3 días después de la infección para HSV y 10 días después de la infección para VZV. Los valores medios de CE50 de penciclovir frente a aislados clínicos y de laboratorio de HSV-1, HSV-2 y VZV fueron 2 μM (rango de 1,2 a 2,4 μM, n=7), 2,6 μM (rango de 1,6 a 11 μM, n=6) , y 34 μM (rango 6,7 a 71 μM, n=6), respectivamente.
Resistencia
Los mutantes resistentes a penciclovir de HSV y VZV pueden resultar de mutaciones en los genes de la timidina quinasa (TK) viral y de la ADN polimerasa. Las mutaciones en el gen TK viral pueden conducir a la pérdida completa de la actividad TK (TK negativo), niveles reducidos de actividad TK (TK parcial) o alteración en la capacidad del TK viral para fosforilar el fármaco sin una pérdida equivalente en la capacidad de fosforilar timidina (TK alterada). Los valores medios de EC50 observados en un ensayo de reducción de placa con HSV-1, HSV-2 y VZV resistentes a penciclovir fueron 69 μM (rango de 14 a 115 μM, n=6), 46 μM (rango de 4 a >395 μM, n= 9) y 92 μM (rango 51 a 148 μM, n=4), respectivamente. Se debe considerar la posibilidad de resistencia viral al penciclovir en pacientes que no responden o experimentan excreción viral recurrente durante la terapia.
Resistencia cruzada
Se ha observado resistencia cruzada entre los inhibidores de la ADN polimerasa del HSV. Los mutantes resistentes al aciclovir que se encuentran con mayor frecuencia que son TK negativos también son resistentes al penciclovir.
Estudios clínicos
Herpes labial (herpes labial)
Se realizó un ensayo aleatorizado, doble ciego, controlado con placebo en 701 adultos inmunocompetentes con herpes labial recurrente. Los pacientes iniciaron la terapia por sí mismos dentro de la primera hora de la aparición de los primeros signos o síntomas de un episodio recurrente de herpes labial con FAMVIR 1500 mg como dosis única (n=227), FAMVIR 750 mg dos veces al día (n=220) o placebo (n= 254) durante 1 día. La mediana del tiempo de curación entre los pacientes con lesiones no abortadas (que progresan más allá de la etapa de pápula) fue de 4,4 días en el grupo de dosis única de 1500 mg de FAMVIR (n=152) en comparación con 6,2 días en el grupo de placebo (n=168) . La mediana de la diferencia en el tiempo de curación entre los grupos tratados con placebo y FAMVIR 1500 mg fue de 1,3 días (IC del 95 %: 0,6–2,0). No se observaron diferencias en la proporción de pacientes con lesiones abortadas (que no progresaron más allá de la etapa de pápula) entre los pacientes que recibieron FAMVIR 250 mg o placebo: 33 % para FAMVIR 1500 mg en dosis única y 34 % para placebo. La mediana del tiempo hasta la pérdida del dolor y la sensibilidad fue de 1,7 días en los pacientes tratados con una dosis única de 1500 mg de FAMVIR frente a 2,9 días en los pacientes tratados con placebo.
Herpes genital
Episodios recurrentes
Se realizó un ensayo aleatorizado, doble ciego, controlado con placebo en 329 adultos inmunocompetentes con herpes genital recurrente. Los pacientes iniciaron el tratamiento por sí mismos dentro de las 6 horas posteriores al primer signo o síntoma de un episodio de herpes genital recurrente con FAMVIR 1000 mg dos veces al día (n=163) o placebo (n=166) durante 1 día. La mediana del tiempo de curación entre los pacientes con lesiones no abortadas (que progresan más allá de la etapa de pápula) fue de 4,3 días en los pacientes tratados con FAMVIR (n=125) en comparación con 6,1 días en los pacientes tratados con placebo (n=145). La mediana de la diferencia en el tiempo de curación entre los grupos tratados con placebo y FAMVIR fue de 1,2 días (IC del 95 %: 0,5 a 2,0). El veintitrés por ciento de los pacientes tratados con FAMVIR tuvieron lesiones abortadas (sin desarrollo de lesiones más allá del eritema) frente al 13 % de los pacientes tratados con placebo. La mediana del tiempo hasta la desaparición de todos los síntomas (p. ej., hormigueo, picazón, ardor, dolor o sensibilidad) fue de 3,3 días en los pacientes tratados con FAMVIR frente a 5,4 días en los pacientes tratados con placebo.
Se realizó un ensayo aleatorizado (2:1), doble ciego, controlado con placebo en 304 adultos negros y afroamericanos inmunocompetentes con herpes genital recurrente. Los pacientes iniciaron el tratamiento por sí mismos dentro de las 6 horas posteriores al primer signo o síntoma de un episodio recurrente de herpes genital con FAMVIR 1000 mg dos veces al día (n=206) o placebo (n=98) durante 1 día. La mediana del tiempo de curación entre los pacientes con lesiones no abortadas fue de 5,4 días en los pacientes tratados con FAMVIR (n=152) en comparación con 4,8 días en los pacientes tratados con placebo (n=78). La mediana de la diferencia en el tiempo de curación entre los grupos tratados con placebo y FAMVIR fue de -0,26 días (IC del 95 %: -0,98 a 0,40).
Terapia supresiva
Se realizaron dos ensayos aleatorios, doble ciego, controlados con placebo, de 12 meses en 934 adultos inmunocompetentes con antecedentes de 6 o más recurrencias de episodios de herpes genital por año. Las comparaciones incluyeron FAMVIR 125 mg tres veces al día, 250 mg dos veces al día, 250 mg tres veces al día y placebo. A los 12 meses, entre el 60 % y el 65 % de los pacientes seguían recibiendo FAMVIR y el 25 % recibían tratamiento con placebo. Las tasas de recurrencia a los 6 y 12 meses en pacientes tratados con la dosis de 250 mg dos veces al día se muestran en la Tabla 6.
Los pacientes tratados con FAMVIR tuvieron aproximadamente 1/5 de la mediana del número de recurrencias en comparación con los pacientes tratados con placebo. Las dosis más altas de FAMVIR 250 mg no se asociaron con un aumento de la eficacia.
Herpes orolabial o genital recurrente en pacientes infectados por el VIH
Un ensayo aleatorizado, doble ciego, comparó famciclovir 500 mg dos veces al día durante 7 días (n=150) con aciclovir oral 400 mg 5 veces al día durante 7 días (n=143) en pacientes infectados por el VIH con herpes bucolabial o genital recurrente tratados dentro 48 horas desde el inicio de la lesión. Aproximadamente el 40% de los pacientes tenían un recuento de CD4+ por debajo de 200 células/mm3, el 54% de los pacientes tenían lesiones anogenitales y el 35% tenían lesiones bucolabiales. La terapia con famciclovir fue comparable al aciclovir oral en la reducción de la formación de nuevas lesiones y en el tiempo hasta la curación completa.
Herpes Zoster (culebrilla)
Se realizaron dos ensayos aleatorizados, doble ciego, 1 controlado con placebo y 1 con control activo, en 964 adultos inmunocompetentes con herpes zoster sin complicaciones. El tratamiento se inició dentro de las 72 horas de la aparición de la primera lesión y se continuó durante 7 días.
En el ensayo controlado con placebo, 419 pacientes fueron tratados con FAMVIR 500 mg tres veces al día (n=138), FAMVIR 750 mg tres veces al día (n=135) o placebo (n=146). La mediana del tiempo hasta la formación de costras completas fue de 5 días entre los pacientes tratados con FAMVIR 500 mg en comparación con 7 días en los pacientes tratados con placebo. Los tiempos hasta la formación de costras, la pérdida de vesículas, la pérdida de úlceras y la pérdida de costras fueron más cortos para los pacientes tratados con FAMVIR 500 mg que para los pacientes tratados con placebo en la población general del estudio. Los efectos de FAMVIR 500 mg fueron mayores cuando la terapia se inició dentro de las 48 horas posteriores al inicio de la erupción; también fue más profunda en pacientes de 50 años o más. Entre el 65,2 % de los pacientes con al menos 1 cultivo viral positivo, los pacientes tratados con FAMVIR tuvieron una mediana de duración más corta de excreción viral que los pacientes tratados con placebo (1 día y 2 días, respectivamente).
No hubo diferencias generales en la duración del dolor antes de la curación del sarpullido entre los grupos tratados con FAMVIR y con placebo. Además, no hubo diferencia en la incidencia de dolor después de la curación de la erupción (neuralgia posherpética) entre los grupos de tratamiento. En los 186 pacientes (44,4 % de la población total del estudio) que desarrollaron neuralgia posherpética, la mediana de duración de la neuralgia posherpética fue más corta en los pacientes tratados con FAMVIR 500 mg que en los tratados con placebo (63 días y 119 días, respectivamente). No se demostró eficacia adicional con dosis más altas de FAMVIR.
En el ensayo con control activo, 545 pacientes fueron tratados con 1 de 3 dosis de FAMVIR tres veces al día o con aciclovir 800 mg cinco veces al día. Los tiempos hasta la formación de costras en la lesión completa y los tiempos hasta la desaparición del dolor agudo fueron comparables para todos los grupos y no hubo diferencias estadísticamente significativas en el tiempo hasta la desaparición de la neuralgia posherpética entre los grupos tratados con FAMVIR y con aciclovir.
INFORMACIÓN DEL PACIENTE
FAMVIR® (Fam'-veer) (famciclovir) Comprimidos
Lea esta información para el paciente antes de comenzar a tomar FAMVIR y cada vez que renueve su receta. Es posible que haya nueva información. Esta información no reemplaza la conversación con su proveedor de atención médica sobre su condición médica o tratamiento.
¿Qué es FAMVIR?
Famvir es un medicamento antiviral recetado que se usa para:
- tratar los brotes de herpes labial (ampollas de fiebre) en adultos sanos
- tratar los brotes de herpes genital en adultos sanos
- disminuir el número de brotes de herpes genital en adultos sanos
- tratar brotes de lesiones de herpes simple en o alrededor de la boca, los genitales y el área anal en personas infectadas con el VIH
- tratar la culebrilla (herpes zóster) en adultos con un sistema inmunitario normal
No se sabe si FAMVIR 500 mg es seguro y efectivo en niños menores de 18 años.
FAMVIR 250 mg no es una cura para el herpes. No se sabe si FAMVIR puede detener la propagación del herpes a otras personas. Si es sexualmente activo, puede transmitir el herpes a su pareja incluso si está tomando FAMVIR. El herpes se puede transmitir incluso si no tiene síntomas activos. Debe continuar practicando sexo más seguro para reducir las posibilidades de contagiar el herpes genital a otras personas. No tenga contacto sexual con su pareja durante un brote de herpes genital o si tiene algún síntoma de herpes genital. Use un condón de látex o poliuretano cuando tenga un contacto sexual. Pídale a su proveedor de atención médica más información sobre prácticas sexuales más seguras.
¿Quién no debe tomar FAMVIR?
No tome FAMVIR 250mg si es alérgico a alguno de sus ingredientes o al Denavir® (crema de penciclovir). Consulte el final de este folleto de información para el paciente para obtener una lista completa de los ingredientes de FAMVIR.
¿Qué debo decirle a mi proveedor de atención médica antes de tomar FAMVIR 500 mg?
Antes de comenzar a tomar FAMVIR 500 mg, informe a su proveedor de atención médica si:
- tiene problemas renales o hepáticos
- tiene un problema genético raro con intolerancia a la galactosa, una deficiencia grave de lactasa o no absorbe glucosa-galactosa (malabsorción)
- está embarazada o planea quedar embarazada. No se sabe si FAMVIR 250mg dañará a su bebé nonato
- Informes de exposición durante el embarazo: Novartis Pharmaceuticals Corporation recopila informes de embarazo que se informan de forma voluntaria. En caso de embarazo, hable con su proveedor de atención médica sobre cómo informar su embarazo.
- está amamantando o planea amamantar
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos recetados y de venta libre, las vitaminas y los suplementos a base de hierbas. Informe especialmente a su proveedor de atención médica si toma:
- cualquier otro medicamento y producto que utilice para tratar los brotes de herpes
- probenecid (Probalán)
Conozca los medicamentos que toma. Mantenga una lista de ellos para mostrársela a su proveedor de atención médica y farmacéutico cada vez que obtenga un medicamento nuevo.
¿Cómo debo tomar FAMVIR?
- Tome FAMVIR exactamente según lo prescrito
- Su proveedor de atención médica le dirá cuántos FAMVIR debe tomar y cuándo tomarlos. Su dosis de FAMVIR 250 mg y la frecuencia con la que lo toma pueden ser diferentes dependiendo de su condición
- Famvir se puede tomar con o sin alimentos
- Es importante que termine todo el medicamento según lo recetado, incluso si comienza a sentirse mejor.
- Sus síntomas pueden continuar incluso después de que termine todo su FAMVIR. Esto no significa que necesite más medicamento, ya que ya ha terminado un curso completo de FAMVIR 500 mg y seguirá funcionando en su cuerpo. Hable con su proveedor de atención médica si tiene alguna pregunta sobre su afección y su tratamiento.
¿Cuáles son los posibles efectos secundarios de FAMVIR 250 mg?
Los efectos secundarios más comunes de FAMVIR 500 mg incluyen:
- dolor de cabeza
- náuseas
Hable con su proveedor de atención médica si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de FAMVIR. Consulte a su proveedor de atención médica o farmacéutico para obtener más información.
Llame a su proveedor de atención médica para recibir asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA1088.
¿Cómo debo almacenar FAMVIR 500 mg?
- Guarde FAMVIR a temperatura ambiente, entre 59 °F y 86 °F (15 °C y 30 °C).
Mantenga FAMVIR y todos los medicamentos fuera del alcance de los niños.
Información general sobre FAMVIR
A veces, los medicamentos se prescriben para fines distintos a los que se enumeran en los folletos de información para el paciente. No use FAMVIR para una condición para la cual no fue recetado. No le dé FAMVIR 500 mg a otras personas, incluso si tienen los mismos síntomas que usted. Puede que les haga daño.
Este folleto resume la información más importante sobre FAMVIR. Si desea obtener más información, hable con su proveedor de atención médica. Su proveedor de atención médica o farmacéutico puede brindarle información sobre FAMVIR 500 mg escrita para profesionales de la salud. Para obtener más información, visite www.FAMVIR.com o llame al 1-888-669-6682.
¿Cuáles son los ingredientes de FAMVIR?
Ingrediente activo: famciclovir
Ingredientes inactivos: hidroxipropilcelulosa, hidroxipropilmetilcelulosa, lactosa, estearato de magnesio, polietilenglicoles, glicolato de almidón de sodio y dióxido de titanio
