Feldene 10mg, 20mg Piroxicam Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Feldene 20 mg y cómo se usa?
Piroxicam es un medicamento recetado que se usa para tratar el dolor o la inflamación de la artritis reumatoide (incluida la artritis juvenil) o la osteoartritis. Piroxicam se puede usar solo o con otros medicamentos.
El piroxicam es un fármaco antiinflamatorio no esteroideo (AINE).
No se sabe si Piroxicam es seguro y eficaz en niños menores de 12 años.
¿Cuáles son los posibles efectos secundarios de Feldene?
Feldene 10 mg puede causar efectos secundarios graves, que incluyen:
- palpitaciones en el cuello o en las orejas,
- somnolencia,
- visión borrosa,
- hinchazón,
- rápido aumento de peso,
- dificultad para respirar,
- pérdida de apetito,
- dolor de estómago,
- cansancio,
- Comezón,
- orina oscura ,
- taburetes de color arcilla,
- coloración amarillenta de la piel o los ojos (ictericia),
- heces con sangre o alquitranadas,
- tos con sangre o vómito que parece café molido,
- orinar poco o nada,
- hinchazón en los pies o los tobillos,
- sentirse mareado,
- manos o pies fríos,
- piel pálida, y
- dolor de cabeza intenso,
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Feldene incluyen:
- pruebas de función hepática anormales,
- dificultad para orinar,
- dolor de barriga,
- acidez,
- pérdida de apetito,
- dolor de estómago,
- náuseas,
- vómitos,
- gas,
- Diarrea ,
- estreñimiento,
- mareo,
- dolor de cabeza,
- picazón o sarpullido, y
- zumbido en los oídos,
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Feldene. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
ADVERTENCIA
RIESGO DE EVENTOS GRAVES CARDIOVASCULARES Y GASTROINTESTINALES
Eventos trombóticos cardiovasculares
- Los medicamentos antiinflamatorios no esteroideos (AINE) aumentan el riesgo de eventos trombóticos cardiovasculares graves, incluidos infarto de miocardio y accidente cerebrovascular, que pueden ser fatales. Este riesgo puede ocurrir temprano en el tratamiento y puede aumentar con la duración del uso. [ver ADVERTENCIAS Y PRECAUCIONES ].
- FELDENE 20 mg está contraindicado en el contexto de una cirugía de injerto de bypass de arteria coronaria (CABG) [ver CONTRAINDICACIONES y ADVERTENCIAS Y PRECAUCIONES ].
Sangrado gastrointestinal, ulceración y perforación
- Los AINE causan un mayor riesgo de eventos adversos gastrointestinales (GI) graves que incluyen sangrado, ulceración y perforación del estómago o los intestinos, que pueden ser fatales. Estos eventos pueden ocurrir en cualquier momento durante el uso y sin síntomas de advertencia. Los pacientes de edad avanzada y los pacientes con antecedentes de enfermedad de úlcera péptica y/o sangrado GI tienen un mayor riesgo de eventos GI graves [ver ADVERTENCIAS Y PRECAUCIONES ].
DESCRIPCIÓN
La cápsula de FELDENE (piroxicam) es un fármaco antiinflamatorio no esteroideo, disponible en cápsulas granate y azul n.° 322 de 10 mg y en cápsulas granate n.° 323 de 20 mg para administración oral. El nombre químico es 4-hidroxil-2-metil-N-2-piridinil-2H-1,2,-benzotiazina-3-carboxamida 1,1-dióxido. El peso molecular es 331,35. Su fórmula molecular es C15H13N3O4S y tiene la siguiente estructura química.
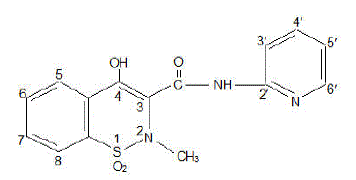
El piroxicam se presenta como un sólido cristalino blanco, escasamente soluble en agua, ácido diluido y la mayoría de los solventes orgánicos. Es ligeramente soluble en alcohol y en soluciones acuosas. Presenta un protón 4-hidroxi débilmente ácido (pKa 5,1) y un nitrógeno piridílico débilmente básico (pKa 1,8).
Los ingredientes inactivos en FELDENE 10mg incluyen: Azul 1, Rojo 3, lactosa, estearato de magnesio, laurilsulfato de sodio, almidón.
INDICACIONES
FELDENE está indicado:
- Para el alivio de los signos y síntomas de la artrosis.
- Para el alivio de los signos y síntomas de la artritis reumatoide.
DOSIFICACIÓN Y ADMINISTRACIÓN
Considere cuidadosamente los beneficios y riesgos potenciales de FELDENE 20 mg y otras opciones de tratamiento antes de decidir usar FELDENE. Utilice la dosis eficaz más baja durante el menor tiempo posible de acuerdo con los objetivos de tratamiento de cada paciente [ver ADVERTENCIAS Y PRECAUCIONES ].
Después de observar la respuesta a la terapia inicial con FELDENE 20 mg, la dosis y la frecuencia deben ajustarse para adaptarse a las necesidades individuales de cada paciente.
Para el alivio de la artritis reumatoide y la osteoartritis, la dosis es de 20 mg administrados por vía oral una vez al día. Si lo desea, la dosis diaria puede dividirse. Debido a la larga vida media de FELDENE, los niveles sanguíneos en estado estacionario no se alcanzan durante 7 a 12 días. Por lo tanto, aunque los efectos terapéuticos de FELDENE son evidentes al inicio del tratamiento, hay un aumento progresivo en la respuesta durante varias semanas y el efecto de la terapia no debe evaluarse durante dos semanas.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Cápsulas de FELDENE (piroxicam)
10 mg granate y azul #322 20 mg granate #323
Almacenamiento y manipulación
FELDENE® (piroxicam) cápsulas de 10 mg son granate y azul #322, suministrados como:
FELDENE® (piroxicam) cápsulas de 20 mg son granate #323, suministrados como:
Almacenamiento
Almacenar a temperatura ambiente de 20 °C a 25 °C (68 °F a 77 °F); excursiones permitidas entre 15 °C y 30 °C (59 °F y 86 °F) [consulte Temperatura ambiente controlada por USP].
Distribuido por: Pfizer Labs, Division of Pfizer Inc., 235 East 42nd Street, New York, NY 10017. Revisado: abril de 2017.
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas se analizan con mayor detalle en otras secciones de la etiqueta:
- Eventos trombóticos cardiovasculares [ver ADVERTENCIAS Y PRECAUCIONES ]
- Sangrado gastrointestinal, ulceración y perforación [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hepatotoxicidad [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hipertensión [ver ADVERTENCIAS Y PRECAUCIONES ]
- Insuficiencia cardíaca y edema [ver ADVERTENCIAS Y PRECAUCIONES ]
- Toxicidad renal e hiperpotasemia [ver ADVERTENCIAS Y PRECAUCIONES ]
- Reacciones anafilácticas [ver ADVERTENCIAS Y PRECAUCIONES ]
- Reacciones cutáneas graves [ver ADVERTENCIAS Y PRECAUCIONES ]
- Toxicidad hematológica [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
En pacientes que toman FELDENE 10 mg u otros AINE, las experiencias adversas notificadas con mayor frecuencia que ocurren en aproximadamente el 1-10 % de los pacientes son:
Sistema cardiovascular: Edema
Sistema digestivo: Anorexia, dolor abdominal, estreñimiento, diarrea, flatulencia, náuseas, vómitos
Sistema nervioso : Mareos, dolor de cabeza, vértigo
Piel y apéndices: Prurito, erupción
Sentidos especiales: Tinnitus
Las experiencias adversas adicionales informadas ocasionalmente incluyen:
Sistema cardiovascular: palpitaciones
Sistema digestivo: Estomatitis
Sistema nervioso: Somnolencia
Sentidos especiales: Visión borrosa
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de FELDENE. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Cuerpo como un todo: Fiebre, infección, sepsis, reacciones anafilácticas, cambios en el apetito, muerte, síndrome gripal, dolor (cólico), enfermedad del suero
Sistema cardiovascular: Insuficiencia cardíaca congestiva, hipertensión, taquicardia, síncope, arritmia, exacerbación de angina, hipotensión, infarto de miocardio, vasculitis
Sistema digestivo: Dispepsia, enzimas hepáticas elevadas, hemorragia/perforación importante, acidez estomacal, úlceras (gástricas/duodenales), sequedad de boca, esofagitis, gastritis, glositis, hematemesis, hepatitis, ictericia, melena, rectorragia, eructos, insuficiencia hepática, pancreatitis
Sistema Hemático y Linfático: Anemia, aumento del tiempo de sangrado, mi quimosis, eosinofilia, epistaxis, leucopenia, púrpura, erupción petequial, trombocitopenia, agranulocitosis, anemia hemolítica, anemia aplásica, linfadenopatía, pancitopenia
Hipersensibilidad: ANA positivo
Metabólicas y Nutricionales: Cambios de peso, retención de líquidos, hiperglucemia, hipoglucemia
Sistema nervioso: Ansiedad, astenia, confusión, depresión, alteraciones del sueño, insomnio, malestar general, nerviosismo, parestesia, somnolencia, temblores, acatisia, convulsiones, coma, alucinaciones, meningitis, alteraciones del humor
Sistema respiratorio: Asma, disnea, depresión respiratoria, neumonía
Piel y apéndices: Alopecia, hematomas, descamación, eritema, fotosensibilidad, sudor, angioedema, necrosis epidérmica tóxica, eritema multiforme, dermatitis exfoliativa, onicólisis, síndrome de Stevens Johnson, urticaria, reacción vesiculoampollosa
Sentidos especiales: Conjuntivitis, deficiencia auditiva, ojos hinchados
Sistema urogenital: Función renal anormal, C ystitis, disuria, hematuria, hiperpotasemia, nefritis intersticial, síndrome nefrótico, oliguria/poliuria, proteinuria, insuficiencia renal, glomerulonefritis
Trastornos del aparato reproductor y de la mama: Disminución de la fertilidad femenina
INTERACCIONES CON LA DROGAS
Consulte la Tabla 1 para conocer las interacciones farmacológicas clínicamente significativas con piroxicam.
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Eventos trombóticos cardiovasculares
Los ensayos clínicos de varios AINE selectivos y no selectivos de COX-2 de hasta tres años de duración han mostrado un mayor riesgo de eventos trombóticos cardiovasculares (CV) graves, incluido infarto de miocardio (IM) y accidente cerebrovascular, que pueden ser fatales. Según los datos disponibles, no está claro que el riesgo de eventos trombóticos cardiovasculares sea similar para todos los AINE. El aumento relativo de eventos trombóticos cardiovasculares graves con respecto al inicio conferido por el uso de AINE parece ser similar en aquellos con y sin enfermedad cardiovascular conocida o factores de riesgo de enfermedad cardiovascular. Sin embargo, los pacientes con enfermedad cardiovascular conocida o factores de riesgo tuvieron una incidencia absoluta más alta de eventos trombóticos cardiovasculares graves en exceso, debido a su mayor tasa inicial. Algunos estudios observacionales encontraron que este aumento del riesgo de eventos trombóticos cardiovasculares graves comenzó ya en las primeras semanas de tratamiento. El aumento del riesgo trombótico CV se ha observado de forma más consistente con dosis más altas.
Para minimizar el riesgo potencial de un evento cardiovascular adverso en pacientes tratados con AINE, use la dosis efectiva más baja durante el menor tiempo posible. Los médicos y los pacientes deben permanecer atentos al desarrollo de tales eventos durante todo el curso del tratamiento, incluso en ausencia de síntomas CV previos. Se debe informar a los pacientes sobre los síntomas de eventos CV graves y los pasos a seguir si ocurren.
No existe evidencia consistente de que el uso concurrente de aspirina mitigue el mayor riesgo de eventos trombóticos cardiovasculares graves asociados con el uso de AINE. El uso simultáneo de aspirina y un AINE, como piroxicam, aumenta el riesgo de eventos gastrointestinales (GI) graves [ver Sangrado gastrointestinal, ulceración y perforación ].
Estado posterior a la cirugía de injerto de derivación de la arteria coronaria (CABG)
Dos grandes ensayos clínicos controlados de un AINE selectivo de la COX-2 para el tratamiento del dolor en los primeros 10 a 14 días posteriores a la cirugía de CABG encontraron una mayor incidencia de infarto de miocardio y accidente cerebrovascular. Los AINE están contraindicados en el contexto de CABG [ver CONTRAINDICACIONES ].
Pacientes post-IM
Los estudios observacionales realizados en el Registro Nacional Danés han demostrado que los pacientes tratados con AINE en el período posterior al IM tenían un mayor riesgo de reinfarto, muerte relacionada con CV y mortalidad por todas las causas a partir de la primera semana de tratamiento. En esta misma cohorte, la incidencia de muerte en el primer año posterior al IM fue de 20 por 100 años-persona en pacientes tratados con AINE en comparación con 12 por 100 años-persona en pacientes no expuestos a AINE. Aunque la tasa absoluta de muerte disminuyó un poco después del primer año posterior al IM, el aumento del riesgo relativo de muerte en los usuarios de AINE persistió durante al menos los siguientes cuatro años de seguimiento.
Evite el uso de FELDENE 10 mg en pacientes con un infarto de miocardio reciente a menos que se espere que los beneficios superen el riesgo de eventos trombóticos cardiovasculares recurrentes. Si se usa FELDENE en pacientes con un infarto de miocardio reciente, controle a los pacientes para detectar signos de isquemia cardíaca.
Sangrado gastrointestinal, ulceración y perforación
Los AINE, incluido FELDENE, causan eventos adversos gastrointestinales (GI) graves, como inflamación, sangrado, ulceración y perforación del esófago, el estómago, el intestino delgado o el intestino grueso, que pueden ser fatales. Estos eventos adversos graves pueden ocurrir en cualquier momento, con o sin síntomas de advertencia, en pacientes tratados con AINE. Solo uno de cada cinco pacientes que desarrollan un evento adverso GI superior grave en la terapia con AINE es sintomático. Las úlceras gastrointestinales superiores, el sangrado macroscópico o la perforación causados por AINE ocurrieron en aproximadamente el 1 % de los pacientes tratados durante 3 a 6 meses y en aproximadamente el 2 % al 4 % de los pacientes tratados durante un año. Sin embargo, incluso la terapia con AINE a corto plazo no está exenta de riesgos.
Factores de riesgo de sangrado, ulceración y perforación GI
Los pacientes con antecedentes de enfermedad de úlcera péptica y/o sangrado gastrointestinal que usaron AINE tenían un riesgo más de 10 veces mayor de desarrollar sangrado gastrointestinal en comparación con los pacientes sin estos factores de riesgo. Otros factores que aumentan el riesgo de hemorragia GI en pacientes tratados con NSAID incluyen una mayor duración de la terapia con NSAID; uso concomitante de corticosteroides orales, aspirina, anticoagulantes o inhibidores selectivos de la recaptación de serotonina (ISRS); de fumar; consumo de alcohol; mayor edad; y mal estado general de salud. La mayoría de los informes posteriores a la comercialización de eventos GI fatales ocurrieron en pacientes ancianos o debilitados. Además, los pacientes con enfermedad hepática avanzada y/o coagulopatía tienen un mayor riesgo de hemorragia gastrointestinal.
Estrategias para minimizar los riesgos gastrointestinales en pacientes tratados con AINE
- Use la dosis efectiva más baja durante el menor tiempo posible.
- Evite la administración de más de un AINE a la vez.
- Evite el uso en pacientes con mayor riesgo a menos que se espere que los beneficios superen el mayor riesgo de hemorragia. Para tales pacientes, así como para aquellos con sangrado GI activo, considere terapias alternativas distintas a los AINE.
- Permanezca alerta a los signos y síntomas de ulceración gastrointestinal y sangrado durante la terapia con AINE.
- Si se sospecha un evento adverso GI grave, inicie de inmediato la evaluación y el tratamiento, y suspenda FELDENE hasta que se descarte un evento adverso GI grave.
- En el contexto del uso concomitante de aspirina en dosis bajas para la profilaxis cardíaca, controle más de cerca a los pacientes para detectar evidencia de hemorragia GI [ver INTERACCIONES CON LA DROGAS ].
hepatotoxicidad
Se han informado elevaciones de ALT o AST (tres o más veces el límite superior normal [LSN]) en aproximadamente el 1 % de los pacientes tratados con AINE en ensayos clínicos. Además, se han informado casos raros, a veces fatales, de daño hepático severo, incluyendo hepatitis fulminante, necrosis hepática e insuficiencia hepática.
Pueden ocurrir elevaciones de ALT o AST (menos de tres veces el ULN) hasta en el 15% de los pacientes tratados con AINE, incluido piroxicam.
Informe a los pacientes sobre los signos y síntomas de advertencia de hepatotoxicidad (p. ej., náuseas, fatiga, letargo, diarrea, prurito, ictericia, sensibilidad en el cuadrante superior derecho y síntomas "similares a la gripe"). Si se desarrollan signos y síntomas clínicos consistentes con una enfermedad hepática, o si ocurren manifestaciones sistémicas (p. ej., eosinofilia, sarpullido, etc.), suspenda FELDENE de inmediato y realice una evaluación clínica del paciente.
Hipertensión
Los AINE, incluido FELDENE, pueden provocar una nueva aparición de hipertensión o un empeoramiento de la hipertensión preexistente, cualquiera de los cuales puede contribuir al aumento de la incidencia de eventos cardiovasculares. Los pacientes que toman inhibidores de la enzima convertidora de angiotensina (ECA), diuréticos tiazídicos o diuréticos de asa pueden tener una respuesta deficiente a estas terapias cuando toman AINE [ver INTERACCIONES CON LA DROGAS ].
Controle la presión arterial (PA) durante el inicio del tratamiento con AINE y durante el curso de la terapia.
Insuficiencia cardíaca y edema
El metanálisis de ensayos controlados aleatorizados de Coxib y de la Colaboración de ensayos de NSAID tradicionales demostró un aumento de aproximadamente el doble en las hospitalizaciones por insuficiencia cardíaca en pacientes tratados selectivamente con COX-2 y pacientes tratados con AINE no selectivos en comparación con los pacientes tratados con placebo. En un estudio del Registro Nacional Danés de pacientes con insuficiencia cardíaca, el uso de AINE aumentó el riesgo de infarto de miocardio, hospitalización por insuficiencia cardíaca y muerte.
Además, se ha observado retención de líquidos y edema en algunos pacientes tratados con AINE. El uso de piroxicam puede atenuar los efectos CV de varios agentes terapéuticos utilizados para tratar estas afecciones médicas (p. ej., diuréticos, inhibidores de la ECA o bloqueadores de los receptores de angiotensina [BRA]) [ver INTERACCIONES CON LA DROGAS ].
Evite el uso de FELDENE 10 mg en pacientes con insuficiencia cardíaca grave a menos que se espere que los beneficios superen el riesgo de empeoramiento de la insuficiencia cardíaca. Si FELDENE se usa en pacientes con insuficiencia cardíaca grave, controle a los pacientes para detectar signos de empeoramiento de la insuficiencia cardíaca.
Toxicidad renal e hiperpotasemia
Toxicidad renal
La administración a largo plazo de NSAID ha resultado en necrosis papilar renal y otras lesiones renales.
También se ha observado toxicidad renal en pacientes en los que las prostaglandinas renales tienen un papel compensatorio en el mantenimiento de la perfusión renal. En estos pacientes, la administración de un AINE puede causar una reducción dependiente de la dosis en la formación de prostaglandinas y, secundariamente, en el flujo sanguíneo renal, lo que puede precipitar una descompensación renal manifiesta. Los pacientes con mayor riesgo de esta reacción son aquellos con función renal alterada, deshidratación, hipovolemia, insuficiencia cardíaca, disfunción hepática, aquellos que toman diuréticos e inhibidores de la ECA o BRA y los ancianos. La interrupción del tratamiento con AINE suele ir seguida de la recuperación al estado previo al tratamiento.
No hay información disponible de estudios clínicos controlados sobre el uso de FELDENE 20 mg en pacientes con enfermedad renal avanzada. Los efectos renales de FELDENE 20 mg pueden acelerar la progresión de la disfunción renal en pacientes con enfermedad renal preexistente.
Corrija el estado de volumen en pacientes deshidratados o hipovolémicos antes de iniciar FELDENE. Controle la función renal en pacientes con insuficiencia renal o hepática, insuficiencia cardíaca, deshidratación o hipovolemia durante el uso de FELDENE [ver INTERACCIONES CON LA DROGAS ]. Evite el uso de FELDENE en pacientes con enfermedad renal avanzada a menos que se espere que los beneficios superen el riesgo de empeoramiento de la función renal. Si FELDENE se usa en pacientes con enfermedad renal avanzada, controle a los pacientes para detectar signos de empeoramiento de la función renal.
hiperpotasemia
Se han informado aumentos en la concentración sérica de potasio, incluida la hiperpotasemia, con el uso de AINE, incluso en algunos pacientes sin insuficiencia renal. En pacientes con función renal normal, estos efectos se han atribuido a un estado de hiporreninemia-hipoaldosteronismo.
Reacciones anafilácticas
El piroxicam se ha asociado con reacciones anafilácticas en pacientes con y sin hipersensibilidad conocida al piroxicam y en pacientes con asma sensible a la aspirina [ver CONTRAINDICACIONES y Exacerbación del asma relacionada con la sensibilidad a la aspirina ].
Busque ayuda de emergencia si se produce una reacción anafiláctica.
Exacerbación del asma relacionada con la sensibilidad a la aspirina
Una subpoblación de pacientes con asma puede tener asma sensible a la aspirina que puede incluir rinosinusitis crónica complicada con pólipos nasales; broncoespasmo severo, potencialmente fatal; y/o intolerancia a la aspirina y otros AINE. Debido a que se ha informado de reactividad cruzada entre la aspirina y otros AINE en pacientes sensibles a la aspirina, FELDENE 20 mg está contraindicado en pacientes con esta forma de sensibilidad a la aspirina [ver CONTRAINDICACIONES ]. Cuando FELDENE se usa en pacientes con asma preexistente (sin sensibilidad conocida a la aspirina), controle a los pacientes para detectar cambios en los signos y síntomas del asma.
Reacciones cutáneas graves
Los AINE, incluido el piroxicam, pueden causar reacciones adversas graves en la piel, como dermatitis exfoliativa, síndrome de Stevens-Johnson (SJS) y necrólisis epidérmica tóxica (NET), que pueden ser fatales. Estos eventos graves pueden ocurrir sin previo aviso. Informar a los pacientes sobre los signos y síntomas de reacciones cutáneas graves y suspender el uso de FELDENE 10 mg ante la primera aparición de erupción cutánea o cualquier otro signo de hipersensibilidad. FELDENE 20 mg está contraindicado en pacientes con reacciones cutáneas graves previas a los AINE [ver CONTRAINDICACIONES ].
Cierre prematuro del conducto arterioso fetal
Piroxicam puede causar el cierre prematuro del conducto arterioso fetal. Evite el uso de AINE, incluido FELDENE 20 mg, en mujeres embarazadas a partir de las 30 semanas de gestación (tercer trimestre) [ver Uso en poblaciones específicas ].
Toxicidad hematológica
Se ha producido anemia en pacientes tratados con AINE. Esto puede deberse a una pérdida de sangre oculta o macroscópica, retención de líquidos o un efecto descrito de forma incompleta sobre la eritropoyesis. Si un paciente tratado con FELDENE tiene signos o síntomas de anemia, controle la hemoglobina o el hematocrito.
Los AINE, incluido FELDENE, pueden aumentar el riesgo de eventos hemorrágicos. Condiciones comórbidas como trastornos de la coagulación, el uso concomitante de warfarina, otros anticoagulantes, agentes antiplaquetarios (p. ej., aspirina), inhibidores de la recaptación de serotonina (ISRS) e inhibidores de la recaptación de serotonina y norepinefrina (IRSN) pueden aumentar este riesgo. Vigile a estos pacientes en busca de signos de sangrado [ver INTERACCIONES CON LA DROGAS ].
Enmascaramiento de inflamación y fiebre
La actividad farmacológica de FELDENE 10 mg para reducir la inflamación y posiblemente la fiebre, puede disminuir la utilidad de los signos diagnósticos para detectar infecciones.
Monitoreo de laboratorio
Debido a que pueden ocurrir hemorragias gastrointestinales graves, hepatotoxicidad y lesiones renales sin síntomas o signos de advertencia, considere monitorear periódicamente a los pacientes en tratamiento con AINE a largo plazo con un hemograma completo y un perfil químico [ver Sangrado gastrointestinal, ulceración y perforación, hepatotoxicidad, toxicidad renal e hiperpotasemia ] .
Efectos oftalmológicos
Debido a los informes de hallazgos oculares adversos con agentes antiinflamatorios no esteroideos, se recomienda que los pacientes que desarrollen molestias visuales durante el tratamiento con FELDENE se sometan a evaluaciones oftalmológicas.

Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( Guía de medicamentos ) que acompaña a cada receta dispensada. Informe a los pacientes, familiares o cuidadores de la siguiente información antes de iniciar la terapia con FELDENE y periódicamente durante el curso de la terapia en curso.
Eventos trombóticos cardiovasculares
Aconseje a los pacientes que estén atentos a los síntomas de eventos trombóticos cardiovasculares, incluidos dolor torácico, dificultad para respirar, debilidad o dificultad para hablar, y que informen de inmediato cualquiera de estos síntomas a su proveedor de atención médica [ver ADVERTENCIAS Y PRECAUCIONES ].
Sangrado gastrointestinal, ulceración y perforación
Aconseje a los pacientes que informen a su proveedor de atención médica sobre los síntomas de ulceraciones y sangrado, incluidos dolor epigástrico, dispepsia, melena y hematemesis. En el contexto del uso concomitante de aspirina en dosis bajas para la profilaxis cardíaca, informar a los pacientes sobre el aumento del riesgo y los signos y síntomas de hemorragia GI [ver ADVERTENCIAS Y PRECAUCIONES ].
hepatotoxicidad
Informar a los pacientes sobre los signos y síntomas de advertencia de hepatotoxicidad (p. ej., náuseas, fatiga, letargo, prurito, diarrea, ictericia, sensibilidad en el cuadrante superior derecho y síntomas "similares a la gripe"). Si esto ocurre, indique a los pacientes que suspendan FELDENE y busquen tratamiento médico inmediato [ver ADVERTENCIAS Y PRECAUCIONES ].
Insuficiencia cardíaca y edema
Aconseje a los pacientes que estén atentos a los síntomas de insuficiencia cardíaca congestiva, como dificultad para respirar, aumento de peso inexplicable o edema, y que se comuniquen con su proveedor de atención médica si se presentan tales síntomas [ver ADVERTENCIAS Y PRECAUCIONES ].
Reacciones anafilácticas
Informe a los pacientes sobre los signos de una reacción anafiláctica (p. ej., dificultad para respirar, hinchazón de la cara o la garganta). Indique a los pacientes que busquen ayuda de emergencia inmediata si esto ocurre [ver CONTRAINDICACIONES y ADVERTENCIAS Y PRECAUCIONES ].
Reacciones cutáneas graves
Aconseje a los pacientes que dejen de FELDENE inmediatamente si desarrollan algún tipo de erupción cutánea y que se comuniquen con su proveedor de atención médica lo antes posible [ver ADVERTENCIAS Y PRECAUCIONES ].
Fertilidad Femenina
Aconseje a las mujeres con potencial reproductivo que deseen quedar embarazadas que los AINE, incluido FELDENE 20 mg, pueden estar asociados con un retraso reversible en la ovulación [ver Uso en poblaciones específicas ].
Toxicidad Fetal
Informe a las mujeres embarazadas que eviten el uso de FELDENE y otros AINE a partir de las 30 semanas de gestación debido al riesgo de cierre prematuro del conducto arterioso fetal [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
Evite el uso concomitante de AINE
Informe a los pacientes que no se recomienda el uso concomitante de FELDENE con otros AINE o salicilatos (p. ej., diflunisal, salsalato) debido al mayor riesgo de toxicidad gastrointestinal y poco o ningún aumento en la eficacia [ver ADVERTENCIAS Y PRECAUCIONES y INTERACCIONES CON LA DROGAS ]. Alerte a los pacientes que los AINE pueden estar presentes en medicamentos "de venta libre" para el tratamiento de resfriados, fiebre o insomnio.
Uso de AINE y aspirina en dosis bajas
Informe a los pacientes que no usen aspirina en dosis bajas de forma concomitante con FELDENE hasta que hablen con su proveedor de atención médica [ver INTERACCIONES CON LA DROGAS ].
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Carcinogénesis
No se han realizado estudios a largo plazo en animales para caracterizar el potencial carcinogénico de piroxicam.
mutagénesis
Piroxicam no fue mutagénico en un ensayo de mutación inversa bacteriana Ames, o en un ensayo de mutación letal dominante en ratones, y no fue clastogénico en un ensayo de aberración cromosómica in vivo en ratones.
Deterioro de la fertilidad
Estudios reproductivos en los que se administró piroxicam a ratas en dosis de 2, 5 o 10 mg/kg/día (hasta 5 veces la dosis humana máxima recomendada [MRHD] de 20 mg en base a mg/m2 de área de superficie corporal [BSA]) no reveló ningún deterioro de la fertilidad masculina o femenina.
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
El uso de AINE, incluido FELDENE 20 mg, durante el tercer trimestre del embarazo aumenta el riesgo de cierre prematuro del conducto arterioso fetal. Evite el uso de AINE, incluido FELDENE 10 mg, en mujeres embarazadas a partir de las 30 semanas de gestación (tercer trimestre).
No hay estudios adecuados y bien controlados de FELDENE 20 mg en mujeres embarazadas.
Los datos de los estudios observacionales sobre los posibles riesgos embriofetales del uso de AINE en mujeres en el primer o segundo trimestre del embarazo no son concluyentes. En la población general de los EE. UU., todos los embarazos reconocidos clínicamente, independientemente de la exposición al fármaco, tienen una tasa de fondo de 2 a 4% para malformaciones importantes y de 15 a 20% para pérdidas de embarazo.
En estudios de reproducción animal en ratas y conejos, no hubo evidencia de teratogenicidad en exposiciones de hasta 5 y 10 veces la MRHD, respectivamente. En estudios con ratas con piroxicam, se observó fetotoxicidad (pérdida posterior a la implantación) con exposiciones 2 veces superiores a la MRHD, y se observaron retrasos en el parto y una mayor incidencia de muerte fetal con dosis equivalentes a la MRHD de piroxicam. Con base en datos en animales, se ha demostrado que las prostaglandinas tienen un papel importante en la permeabilidad vascular endometrial, la implantación de blastocistos y la decidualización. En estudios con animales, la administración de inhibidores de la síntesis de prostaglandinas, como piroxicam, resultó en un aumento de las pérdidas antes y después de la implantación.
Consideraciones clínicas
Trabajo de parto o Parto
No hay estudios sobre los efectos de FELDENE durante el trabajo de parto o el parto. En estudios con animales, los AINE, incluido el piroxicam, inhiben la síntesis de prostaglandinas, retrasan el parto y aumentan la incidencia de muerte fetal.
Datos
Datos de animales
Las ratas preñadas a las que se les administró piroxicam en dosis de 2, 5 o 10 mg/kg/día durante el período de organogénesis (días de gestación 6 a 15) demostraron un aumento de las pérdidas posteriores a la implantación con 5 y 10 mg/kg/día de piroxicam (equivalente a 2 y 5 veces la dosis humana máxima recomendada [MRHD], de 20 mg respectivamente, en base a un área de superficie corporal mg/m2 [BSA]). No se observaron anomalías del desarrollo relacionadas con el fármaco en la descendencia. La toxicidad del tracto gastrointestinal aumentó en ratas preñadas en el último trimestre del embarazo en comparación con ratas no preñadas o ratas en los primeros trimestres del embarazo. Las conejas preñadas a las que se administró piroxicam en dosis de 2, 5 o 10 mg/kg/día durante el período de organogénesis (días 7 a 18 de gestación) no demostraron anomalías del desarrollo relacionadas con el fármaco en las crías (hasta 10 veces la MRHD basada en mg/m2). BSA).
En un estudio de desarrollo prenatal y posnatal en el que se administró piroxicam a ratas preñadas en dosis de 2, 5 o 10 mg/kg/día el día 15 de gestación hasta el parto y el destete de las crías, se observó una reducción del aumento de peso y muerte en las madres en 10 mg/kg/día (5 veces la MRHD basada en mg/m2 BSA) a partir del día 20 de gestación. Las madres tratadas revelaron peritonitis, adherencias, sangrado gástrico, enteritis hemorrágica y fetos muertos en el útero. El parto se retrasó y hubo una mayor incidencia de mortinatos en todos los grupos tratados con piroxicam (a dosis equivalentes a la MRHD). El desarrollo posnatal no pudo evaluarse de manera confiable debido a la ausencia de atención materna secundaria a la toxicidad materna grave.
Lactancia
Resumen de riesgos
Los datos limitados de 2 informes publicados que incluyeron un total de 6 mujeres lactantes y 2 bebés mostraron que el piroxicam se excreta en la leche humana en aproximadamente 1% a 3% de la concentración materna. No se produjo acumulación de piroxicam en la leche en relación con la del plasma materno durante el tratamiento. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de la madre de FELDENE 20 mg y cualquier posible efecto adverso en el lactante a causa de FELDENE o de la afección materna subyacente.
Hembras y machos con potencial reproductivo
Esterilidad
Hembras
Según el mecanismo de acción, el uso de AINE mediados por prostaglandinas, incluido FELDENE, puede retrasar o prevenir la ruptura de los folículos ováricos, que se ha asociado con infertilidad reversible en algunas mujeres. Los estudios publicados en animales han demostrado que la administración de inhibidores de la síntesis de prostaglandinas tiene el potencial de interrumpir la ruptura folicular mediada por prostaglandinas necesaria para la ovulación. Pequeños estudios en mujeres tratadas con AINE también han mostrado un retraso reversible en la ovulación. Considere la suspensión de los AINE, incluido FELDENE, en mujeres que tienen dificultades para concebir o que están siendo investigadas por infertilidad.
Uso pediátrico
FELDENE 20 mg no se ha investigado en pacientes pediátricos. No se ha establecido la seguridad y eficacia de FELDENE 10 mg.
Uso geriátrico
Los pacientes de edad avanzada, en comparación con los pacientes más jóvenes, tienen un mayor riesgo de reacciones adversas cardiovasculares, gastrointestinales y/o renales graves asociadas a los AINE. Si el beneficio anticipado para el paciente anciano supera estos riesgos potenciales, comience la dosificación en el extremo inferior del rango de dosificación y controle a los pacientes para detectar efectos adversos [ver ADVERTENCIAS Y PRECAUCIONES ].
SOBREDOSIS
Los síntomas que siguen a las sobredosis agudas de AINE generalmente se han limitado a letargo, somnolencia, náuseas, vómitos y dolor epigástrico, que generalmente son reversibles con atención de apoyo. Ha ocurrido sangrado gastrointestinal. Se han producido hipertensión, insuficiencia renal aguda, depresión respiratoria y coma, pero fueron poco frecuentes [ver ADVERTENCIAS Y PRECAUCIONES ].
Maneje a los pacientes con atención sintomática y de apoyo después de una sobredosis de AINE. No hay antídotos específicos. Considere emesis y/o carbón activado (60 a 100 gramos en adultos, 1 a 2 gramos por kg de peso corporal en pacientes pediátricos) y/o catártico osmótico en pacientes sintomáticos vistos dentro de las cuatro horas de la ingestión o en pacientes con una sobredosis grande ( 5 a 10 veces la dosis recomendada).
Se debe considerar la vida media plasmática prolongada de piroxicam cuando se trata una sobredosis de piroxicam. La diuresis forzada, la alcalinización de la orina, la hemodiálisis o la hemoperfusión pueden no ser útiles debido a la alta unión a proteínas.
Para obtener información adicional sobre el tratamiento de sobredosis, comuníquese con un centro de control de intoxicaciones (1-800-222-1222).
CONTRAINDICACIONES
FELDENE 10 mg está contraindicado en los siguientes pacientes:
- Hipersensibilidad conocida (p. ej., reacciones anafilácticas y reacciones cutáneas graves) al piroxicam o a cualquiera de los componentes del medicamento [ver ADVERTENCIAS Y PRECAUCIONES ]
- Antecedentes de asma, urticaria u otras reacciones de tipo alérgico después de tomar aspirina u otros AINE. Se han notificado reacciones anafilácticas graves, a veces mortales, a los AINE en estos pacientes [ver ADVERTENCIAS Y PRECAUCIONES ]
- En el marco de la cirugía de injerto de derivación de arteria coronaria (CABG) [ver ADVERTENCIAS Y PRECAUCIONES ]
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
El piroxicam tiene propiedades analgésicas, antiinflamatorias y antipiréticas.
El mecanismo de acción de FELDENE 20 mg, al igual que el de otros AINE, no se comprende por completo, pero implica la inhibición de la ciclooxigenasa (COX-1 y COX-2).
Piroxicam es un potente inhibidor de la síntesis de prostaglandinas (PG) in vitro. Las concentraciones de piroxicam alcanzadas durante la terapia han producido efectos in vivo. Las prostaglandinas sensibilizan los nervios aferentes y potencian la acción de la bradicinina en la inducción del dolor en modelos animales. Las prostaglandinas son mediadores de la inflamación. Debido a que el piroxicam es un inhibidor de la síntesis de prostaglandinas, su modo de acción puede deberse a una disminución de las prostaglandinas en los tejidos periféricos.
Farmacocinética
Características farmacocinéticas generales
La farmacocinética de piroxicam se ha caracterizado en sujetos sanos, poblaciones especiales y pacientes. La farmacocinética de piroxicam es lineal. Se observa un aumento proporcional en la exposición con dosis crecientes. La vida media prolongada (50 horas) da como resultado el mantenimiento de concentraciones plasmáticas relativamente estables a lo largo del día con dosis únicas al día y una acumulación significativa con dosis múltiples. La mayoría de los pacientes se aproximan a los niveles plasmáticos en estado estacionario en 7 a 12 días. Se han observado niveles más altos, que se aproximan al estado estacionario a las dos o tres semanas, en pacientes en los que se produjeron semividas plasmáticas más prolongadas de piroxicam.
Absorción
El piroxicam se absorbe bien después de la administración oral. Las concentraciones plasmáticas del fármaco son proporcionales para las dosis de 10 y 20 mg y, por lo general, alcanzan su punto máximo entre tres y cinco horas después de la administración. Una dosis única de 20 mg generalmente produce concentraciones plasmáticas máximas de piroxicam de 1.5 a 2 mcg/mL, mientras que las concentraciones plasmáticas máximas del fármaco, después de la administración diaria repetida de 20 mg de piroxicam, por lo general se estabilizan en 3 a 8 mcg/mL.
Con los alimentos hay un ligero retraso en la velocidad pero no en el grado de absorción después de la administración oral. Se ha demostrado que la administración concomitante de antiácidos (hidróxido de aluminio o hidróxido de aluminio con hidróxido de magnesio) no tiene efecto sobre los niveles plasmáticos de piroxicam administrado por vía oral.
Distribución
El volumen aparente de distribución de piroxicam es de aproximadamente 0,14 l/kg. El noventa y nueve por ciento del piroxicam plasmático se une a las proteínas plasmáticas. El piroxicam se excreta en la leche humana. Se ha determinado la presencia en leche materna en condiciones iniciales y a largo plazo (52 días). Piroxicam apareció en la leche materna en aproximadamente 1% a 3% de la concentración materna. No se produjo acumulación de piroxicam en la leche en relación con la del plasma durante el tratamiento.
Eliminación
Metabolismo
El metabolismo de piroxicam ocurre por hidroxilación en la posición 5 de la cadena lateral de piridilo y conjugación de este producto; por ciclodeshidratación; y por una secuencia de reacciones que implican hidrólisis del enlace amida, descarboxilación, contracción del anillo y N-desmetilación. Los estudios in vitro indican que el citocromo P4502C9 (CYP2C9) es la principal enzima involucrada en la formación del 5'-hidroxi-piroxicam, el principal metabolito [ver farmacogenómica ]. Se informa que los productos de biotransformación del metabolismo del piroxicam no tienen ninguna actividad antiinflamatoria.
Se ha observado una mayor exposición sistémica a piroxicam en sujetos con polimorfismos CYP2C9 en comparación con sujetos de tipo metabolizador normal [ver farmacogenómica ].
Excreción
El piroxicam y sus productos de biotransformación se excretan en la orina y las heces, apareciendo aproximadamente el doble en la orina que en las heces. Aproximadamente el 5% de una dosis de 10 mg de FELDENE se excreta sin cambios. La vida media plasmática (t½) de piroxicam es de aproximadamente 50 horas.
Poblaciones Específicas
Pediátrico
Piroxicam no ha sido investigado en pacientes pediátricos.
La raza
No se han identificado diferencias farmacocinéticas debidas a la raza.
Deterioro hepático
No se han establecido los efectos de la enfermedad hepática sobre la farmacocinética de piroxicam. Sin embargo, una parte sustancial de la eliminación de piroxicam ocurre por metabolismo hepático. En consecuencia, los pacientes con enfermedad hepática pueden requerir dosis reducidas de piroxicam en comparación con los pacientes con función hepática normal.
Insuficiencia renal
Se ha investigado la farmacocinética de piroxicam en pacientes con insuficiencia renal. Los estudios indican que los pacientes con insuficiencia renal de leve a moderada pueden no requerir ajustes de dosis. Sin embargo, se desconocen las propiedades farmacocinéticas de piroxicam en pacientes con insuficiencia renal grave o que reciben hemodiálisis.
Estudios de interacción farmacológica
antiácidos
La administración concomitante de antiácidos no tuvo efecto sobre los niveles plasmáticos de piroxicam.
Aspirina
Cuando se administró piroxicam con aspirina, se redujo su unión a proteínas, aunque no se alteró el aclaramiento de FELDENE 20 mg libre. Los niveles plasmáticos de piroxicam se redujeron a aproximadamente el 80 % de sus valores normales cuando se administró FELDENE (20 mg/día) junto con aspirina (3900 mg/día). Se desconoce la importancia clínica de esta interacción [ver INTERACCIONES CON LA DROGAS ].
farmacogenómica
La actividad de CYP2C9 se reduce en individuos con polimorfismos genéticos, como los polimorfismos CYP2C9*2 y CYP2C9*3. Los datos limitados de dos informes publicados mostraron que los sujetos con genotipos heterocigotos CYP2C9*1/*2 (n=9), heterocigotos CYP2C9*1/*3 (n=9) y homocigotos CYP2C9*3/*3 (n=1) mostraron niveles sistémicos de piroxicam 1,7, 1,7 y 5,3 veces más altos, respectivamente, que los sujetos con CYP2C9*1/*1 (n=17, genotipo metabolizador normal) después de la administración de una dosis oral única. Los valores medios de la vida media de eliminación de piroxicam para sujetos con genotipos CYP2C9*1/*3 (n=9) y CYP2C9*3/*3 (n=1) fueron 1,7 y 8,8 veces mayores que los sujetos con CYP2C9*1 /*1 (n=17). Se estima que la frecuencia del genotipo homocigoto*3/*3 es del 0% al 1% en la población general; sin embargo, se han informado frecuencias de hasta 5,7% en ciertos grupos étnicos.
Metabolizadores deficientes de sustratos CYP2C9
En pacientes que se sabe o se sospecha que son metabolizadores lentos de CYP2C9 según el genotipo o antecedentes/experiencia con otros sustratos de CYP2C9 (como warfarina y fenitoína), considere la reducción de la dosis, ya que pueden tener niveles plasmáticos anormalmente altos debido a la reducción del aclaramiento metabólico.
Estudios clínicos
En ensayos clínicos controlados, se ha establecido la eficacia de FELDENE tanto para las exacerbaciones agudas como para el tratamiento a largo plazo de la artritis reumatoide y la osteoartritis.
Los efectos terapéuticos de FELDENE 20 mg son evidentes al comienzo del tratamiento de ambas enfermedades con un aumento progresivo de la respuesta durante varias (8 a 12) semanas. La eficacia se observa en términos de alivio del dolor y, cuando está presente, disminución de la inflamación.
Las dosis de 20 mg/día de FELDENE 20 mg muestran un efecto terapéutico comparable a las dosis terapéuticas de aspirina, con una menor incidencia de efectos gastrointestinales menores y tinnitus.
FELDENE 10 mg se ha administrado concomitantemente con dosis fijas de oro y corticoides. La existencia de un efecto de "ahorro de esteroides" no se ha estudiado adecuadamente hasta la fecha.
INFORMACIÓN DEL PACIENTE
¿Cuál es la información más importante que debo saber sobre los medicamentos denominados antiinflamatorios no esteroideos (AINE)?
Los AINE pueden causar efectos secundarios graves, que incluyen:
- Mayor riesgo de sufrir un ataque al corazón o un derrame cerebral que puede conducir a la muerte. Este riesgo puede ocurrir temprano en el tratamiento y puede aumentar:
- con dosis crecientes de AINE
- con un uso prolongado de AINE
- Mayor riesgo de sangrado, úlceras y desgarros (perforación) del esófago (conducto que va de la boca al estómago), estómago e intestinos:
- en cualquier momento durante el uso
- sin síntomas de advertencia
- que puede causar la muerte
El riesgo de desarrollar una úlcera o sangrado aumenta con:
- antecedentes de úlceras estomacales o sangrado estomacal o intestinal con el uso de AINE
- tomando medicamentos llamados "corticosteroides", "anticoagulantes", "ISRS" o "IRSN"
- dosis crecientes de AINE
- uso prolongado de AINE
- de fumar
- bebiendo alcohol
- mayor edad
- pobre salud
- enfermedad hepática avanzada
- problemas de sangrado
Los AINE solo deben usarse:
- exactamente como se prescribe
- a la dosis más baja posible para su tratamiento
- por el menor tiempo necesario
No tome AINE justo antes o después de una cirugía cardíaca llamada "injerto de derivación de arteria coronaria (CABG)".
Evite tomar AINE después de un ataque cardíaco reciente, a menos que su proveedor de atención médica se lo indique. Puede tener un mayor riesgo de sufrir otro ataque al corazón si toma AINE después de un ataque al corazón reciente.
¿Qué son los AINE?
Los AINE se usan para tratar el dolor y el enrojecimiento, la hinchazón y el calor (inflamación) de afecciones médicas como diferentes tipos de artritis, cólicos menstruales y otros tipos de dolor a corto plazo.
¿Quién no debe tomar AINE?
No tome AINE:
- si ha tenido un ataque de asma, urticaria u otra reacción alérgica con aspirina o cualquier otro AINE.
- justo antes o después de la cirugía de derivación cardíaca.
Antes de tomar AINE, infórmele a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si usted:
- tiene problemas hepáticos o renales
- tiene presión arterial alta
- tener asma
- está embarazada o planea quedar embarazada. Hable con su proveedor de atención médica si está considerando tomar AINE durante el embarazo. No debe tomar AINE después de las 29 semanas de embarazo
- está amamantando o planea amamantar.
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos recetados o de venta libre, las vitaminas o los suplementos a base de hierbas. Los AINE y algunos otros medicamentos pueden interactuar entre sí y causar efectos secundarios graves. No empiece a tomar ningún medicamento nuevo sin hablar primero con su proveedor de atención médica.
¿Cuáles son los posibles efectos secundarios de los AINE?
Los AINE pueden causar efectos secundarios graves, que incluyen:
Consulte "¿Cuál es la información más importante que debo saber sobre los medicamentos denominados antiinflamatorios no esteroideos (AINE)?
- presión arterial alta nueva o peor
- insuficiencia cardiaca
- problemas hepáticos, incluida la insuficiencia hepática
- problemas renales, incluida la insuficiencia renal
- glóbulos rojos bajos (anemia)
- reacciones cutáneas potencialmente mortales
- reacciones alérgicas potencialmente mortales
- Otros efectos secundarios de los AINE incluyen: dolor de estómago, estreñimiento, diarrea, gases, acidez estomacal, náuseas, vómitos y mareos.
Obtenga ayuda de emergencia de inmediato si tiene alguno de los siguientes síntomas:
- dificultad para respirar o dificultad para respirar
- Dolor de pecho
- debilidad en una parte o lado de su cuerpo
- dificultad para hablar
- hinchazón de la cara o la garganta
Deje de tomar su AINE y llame a su proveedor de atención médica de inmediato si presenta alguno de los siguientes síntomas:
- náuseas
- más cansado o más débil de lo habitual
- Diarrea
- Comezón
- tu piel o tus ojos se ven amarillos
- indigestión o dolor de estómago
- síntomas similares a la gripe
- vomitar sangre
- hay sangre en su evacuación intestinal o es negra y pegajosa como alquitrán
- aumento de peso inusual
- erupción cutánea o ampollas con fiebre
- hinchazón de brazos, piernas, manos y pies
Si toma demasiado AINE, llame a su proveedor de atención médica o busque ayuda médica de inmediato.
Estos no son todos los posibles efectos secundarios de los AINE. Para obtener más información, consulte a su proveedor de atención médica o farmacéutico acerca de los AINE.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
Otra información sobre los AINE
- La aspirina es un AINE pero no aumenta la posibilidad de un ataque al corazón. La aspirina puede causar sangrado en el cerebro, el estómago y los intestinos. La aspirina también puede causar úlceras en el estómago y los intestinos.
- Algunos AINE se venden en dosis más bajas sin receta médica (de venta libre). Hable con su proveedor de atención médica antes de usar AINE de venta libre durante más de 10 días.
Información general sobre el uso seguro y eficaz de los AINE
veces, los medicamentos se recetan para fines distintos a los enumerados en la Guía del medicamento. No use NSAID para una condición para la cual no fue recetado. No le dé AINE a otras personas, incluso si tienen los mismos síntomas que usted. Puede que les haga daño.
Si desea obtener más información sobre los AINE, hable con su proveedor de atención médica. Puede pedirle a su farmacéutico o proveedor de atención médica información sobre los AINE escrita para profesionales de la salud.
Esta Guía del medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de EE. UU.
