Furadantin 100mg Nitrofurantoin Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es furadantina 100 mg y cómo se usa?
Furadantin (suspensión oral de nitrofurantoína) es un antibiótico que se usa para tratar infecciones del tracto urinario. Furadantin está disponible en forma genérica.
¿Cuáles son los efectos secundarios de furadantina?
Los efectos secundarios comunes de Furadantin incluyen:
- náuseas,
- vómitos,
- pérdida de apetito,
- dolor de barriga,
- Diarrea,
- dolor de cabeza,
- mareo,
- somnolencia,
- orina de color óxido o marrón, o
- picazón o secreción vaginal.
Informe a su médico si tiene efectos secundarios raros pero muy graves de Furadantin, incluidos:
- dolor de ojo,
- cambios de visión,
- cambios mentales/anímicos,
- dolores de cabeza persistentes o severos,
- nuevos signos de infección (p. ej., fiebre, dolor de garganta persistente), o
- moretones o sangrado fácil.
DESCRIPCIÓN
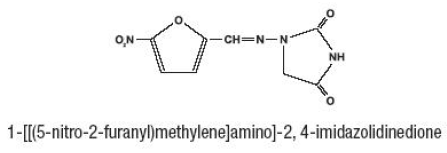
La furadantina (nitrofurantoína), una sustancia química sintética, es un compuesto cristalino amarillo estable. Furadantin es un agente antibacteriano para infecciones específicas del tracto urinario. Furadantin está disponible en suspensión líquida de 25 mg/5 ml para administración oral.
ingredientes inactivos
Furadantin Oral Suspension contiene carboximetilcelulosa sódica, ácido cítrico, sabores, glicerina, silicato de magnesio y aluminio, metilparabeno, propilparabeno, agua purificada, citrato de sodio y sorbitol.
INDICACIONES
furadantina está específicamente indicado para el tratamiento de infecciones del tracto urinario cuando se deben a cepas susceptibles de Escherichia coli, enterococos, Staphylococcus aureus y ciertas cepas susceptibles de especies de Klebsiella y Enterobacter.
La nitrofurantoína no está indicada para el tratamiento de pielonefritis o abscesos perirrenales.
Las nitrofurantoínas carecen de la distribución tisular más amplia de otros agentes terapéuticos aprobados para infecciones del tracto urinario. En consecuencia, muchos pacientes que son tratados con furadantina están predispuestos a la persistencia o reaparición de bacteriuria. Se deben obtener muestras de orina para cultivo y pruebas de susceptibilidad antes y después de completar la terapia. Si se produce persistencia o reaparición de bacteriuria tras el tratamiento con furadantina , se deben seleccionar otros agentes terapéuticos con una distribución tisular más amplia. Al considerar el uso de furadantina , las tasas de erradicación más bajas deben equilibrarse con el mayor potencial de toxicidad sistémica y de desarrollo de resistencia a los antimicrobianos cuando se utilizan agentes con una distribución tisular más amplia.
DOSIFICACIÓN Y ADMINISTRACIÓN
furadantina debe administrarse con alimentos para mejorar la absorción del fármaco y, en algunos pacientes, la tolerancia.
Adultos
50-100 mg cuatro veces al día: se recomienda el nivel de dosis más bajo para infecciones del tracto urinario sin complicaciones.
Pacientes pediátricos
5-7 mg/kg de peso corporal por 24 horas, administrado en cuatro dosis divididas (contraindicado en menores de un mes de edad).
La siguiente tabla se basa en un peso promedio en cada rango que recibe de 5 a 6 mg/kg de peso corporal por 24 horas, administrado en cuatro dosis divididas. Se puede utilizar para calcular una dosis media de furadantina Suspensión Oral (25 mg/5 mL) para pacientes pediátricos.
La terapia debe continuarse durante una semana o al menos 3 días después de obtener la esterilidad de la orina. La infección continua indica la necesidad de una reevaluación.
Para la terapia de supresión a largo plazo en adultos, puede ser adecuada una reducción de la dosis a 50-100 mg al acostarse. Para la terapia de supresión a largo plazo en pacientes pediátricos, pueden ser adecuadas dosis tan bajas como 1 mg/kg por 24 horas, administradas en una sola dosis o en dos dosis divididas. VER SECCIÓN DE ADVERTENCIAS SOBRE RIESGOS ASOCIADOS CON LA TERAPIA A LARGO PLAZO .
CÓMO SUMINISTRADO
furadantina La suspensión oral está disponible en:
CDN 70199-006-32 Botella PET ámbar de 230 mL
Evite la exposición a la luz fuerte que puede oscurecer la droga. Es estable cuando se almacena entre 20 y 25 °C (68 y 77 °F); excursiones permitidas a 15°-30°C (59°-86°F) [Ver Temperatura ambiente controlada por USP ]. Proteger de la congelación. Agite vigorosamente. Dispensar en recipiente hermético, resistente a la luz, de plástico (PET) o de vidrio.
Usar dentro de los 30 días.
Mantener fuera del alcance de los niños.
Fabricado para: Casper Pharma LLC, East Brunswick NJ 08816. Revisado: diciembre de 2020
EFECTOS SECUNDARIOS
Respiratorio
PUEDEN OCURRIR REACCIONES DE HIPERSENSIBILIDAD PULMONAR CRÓNICA, SUBAGUDA O AGUDA.
LAS REACCIONES PULMONAR CRÓNICAS PUEDEN OCURRIR GENERALMENTE EN PACIENTES QUE HAN RECIBIDO TRATAMIENTO CONTINUO DURANTE SEIS MESES O MÁS. MALESTAR, DISNEA DE ESFUERZO, TOS Y FUNCIÓN PULMONAR ALTERADA SON MANIFESTACIONES COMUNES QUE PUEDEN OCURRIR DE MANERA INSIDIADA. LOS HALLAZGOS RADIOLÓGICOS E HISTOLÓGICOS DE NEUMONITIS INTERSTICIAL DIFUSA O FIBROSIS, O AMBAS, TAMBIÉN SON MANIFESTACIONES COMUNES DE LA REACCIÓN PULMONAR CRÓNICA. LA FIEBRE RARAMENTE ES PROMINENTE.
LA GRAVEDAD DE LAS REACCIONES PULMONAR CRÓNICAS Y SUS GRADOS DE RESOLUCIÓN PARECEN ESTAR RELACIONADOS CON LA DURACIÓN DE LA TERAPIA DESPUÉS DE QUE APARECEN LOS PRIMEROS SIGNOS CLÍNICOS. LA FUNCIÓN PULMONAR PUEDE SER DETERIORADA PERMANENTEMENTE, INCLUSO DESPUÉS DE LA TERMINACIÓN DE LA TERAPIA. EL RIESGO ES MAYOR CUANDO LAS REACCIONES PULMONAR CRÓNICAS NO SE RECONOCEN TEMPRANO.
En las reacciones pulmonares subagudas, la fiebre y la eosinofilia ocurren con menos frecuencia que en la forma aguda. Tras el cese de la terapia, la recuperación puede requerir varios meses. Si no se reconoce que los síntomas están relacionados con el medicamento y no se detiene la terapia con nitrofurantoína, los síntomas pueden volverse más severos.
Las reacciones pulmonares agudas se manifiestan comúnmente por fiebre, escalofríos, tos, dolor torácico, disnea, infiltración pulmonar con consolidación de derrame pleural en la radiografía y eosinofilia.
Las reacciones agudas generalmente ocurren dentro de la primera semana de tratamiento y son reversibles con la interrupción de la terapia. La resolución a menudo es dramática. (ver ADVERTENCIAS )
Se han informado cambios en el EKG (p. ej., cambios de onda ST/T no específicos, bloqueo de rama del haz) en asociación con reacciones pulmonares.
Rara vez se ha informado cianosis.
Hepático
Las reacciones hepáticas, que incluyen hepatitis, ictericia colestática, hepatitis activa crónica y neurosis hepática, ocurren raramente. (ver ADVERTENCIAS )
neurológico
Se ha producido una neuropatía periférica, que puede volverse grave o irreversible. Se han reportado muertes. Condiciones tales como insuficiencia renal (depuración de creatinina inferior a 60 ml por minuto o creatinina sérica elevada clínicamente significativa), anemia, diabetes mellitus, desequilibrio electrolítico, deficiencia de vitamina B y enfermedades debilitantes pueden aumentar la posibilidad de neuropatía periférica (ver ADVERTENCIAS )
También se han informado astenia, vértigo, nistagmo, mareos, dolor de cabeza y somnolencia con el uso de nitrofurantoína.
En raras ocasiones se han notificado casos de hipertensión intracraneal benigna (pseudotumor cerebral), confusión, depresión, neuritis óptica y reacciones psicóticas. En raras ocasiones se han notificado fontanelas abultadas, como signo de hipertensión intracraneal benigna en lactantes.
dermatológico
En raras ocasiones se han notificado dermatitis exfoliativa y eritema multiforme (incluido el síndrome de Stevens-Johnson). También se ha informado alopecia transitoria.
Alérgico
Se ha informado un síndrome similar al lupus asociado con reacciones pulmonares a la nitrofurantoína. Además, angioedema; erupciones maculopapulares, eritematosas o eccematosas; prurito; urticaria; anafilaxia; artralgia; mialgia; fiebre por drogas; y vasculitis (a veces asociada con reacciones pulmonares). Las reacciones de hipersensibilidad presentan los eventos adversos informados espontáneamente con mayor frecuencia en la experiencia posterior a la comercialización en todo el mundo con formulaciones de nitrofurantoína.
Gastrointestinal
Las náuseas, los vómitos y la anorexia ocurren con mayor frecuencia. El dolor abdominal y la diarrea son reacciones gastrointestinales menos comunes. Estas reacciones relacionadas con la dosis se pueden minimizar mediante la reducción de la dosis. Se han notificado sialadenitis y pancreatitis. Ha habido informes esporádicos de colitis pseudomembranosa con el uso de nitrofurantoína. La aparición de los síntomas de la colitis pseudomembranosa puede ocurrir durante o después del tratamiento antimicrobiano. (ver ADVERTENCIAS )
hematológico
En raras ocasiones se ha informado cianosis secundaria a metahemoglobinemia.
Misceláneas
Al igual que con otros agentes antimicrobianos, pueden ocurrir superinfecciones causadas por organismos resistentes, por ejemplo, especies de Pseudomonas o especies de Candida. Hay informes esporádicos de sobreinfecciones por Clostridium difficile, o colitis pseudomembranosa, con el uso de nitrofurantoína.
Eventos adversos de laboratorio
Se informaron los siguientes eventos adversos de laboratorio con el uso de nitrofurantoína; aumento de AST (SGOT), aumento de ALT (SGPT), disminución de hemoglobina, aumento de fósforo sérico, eosinofilia, anemia por deficiencia de glucosa-6-fosfato deshidrogenasa (ver ADVERTENCIAS ), agranulocitosis, leucopenia, granulocitopenia, anemia hemolítica, trombocitopenia, anemia megaloblástica. En la mayoría de los casos, estas anomalías hematológicas se resolvieron tras la interrupción del tratamiento. Rara vez se ha informado anemia aplásica.
Para informar SOSPECHAS DE REACCIONES ADVERSAS, comuníquese con Casper Pharma LLC. al 1-844-5-CASPER (1-844-522-7737) o FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
INTERACCIONES CON LA DROGAS
Los antiácidos que contienen trisilicato de magnesio, cuando se administran concomitantemente con nitrofurantoína, reducen tanto la velocidad como el grado de absorción. El mecanismo de esta interacción probablemente sea la adsorción de nitrofurantoína en la superficie del trisilicato de magnesio.
Los fármacos uricosúricos, como el probenecid y la sulfinpirazona, pueden inhibir la secreción tubular renal de nitrofurantoína. El aumento resultante de los niveles séricos de nitrofurantoína puede aumentar la toxicidad, y la disminución de los niveles urinarios podría disminuir su eficacia como antibacteriano del tracto urinario.
Interacciones entre fármacos y pruebas de laboratorio
Como resultado de la presencia de nitrofurantoína, puede ocurrir una reacción falsa positiva de glucosa en la orina. Esto se ha observado con las soluciones de Benedict y Fehling, pero no con la prueba enzimática de glucosa.
ADVERTENCIAS
Reacciones pulmonares
SE HAN OBSERVADO REACCIONES PULMONAR AGUDAS, SUBAGUDAS O CRÓNICAS EN PACIENTES TRATADOS CON NITROFURANTOÍNA. SI SE PRODUCEN ESTAS REACCIONES, SE DEBE SUSPENDER FURADANTIN 100 mg Y TOMAR LAS MEDIDAS APROPIADAS. LOS INFORMES HAN CITADO LAS REACCIONES PULMONAR COMO UNA CAUSA QUE CONTRIBUYE A LA MUERTE.
LAS REACCIONES PULMONAR CRÓNICAS (NEUMONITIS INTERSTICIAL DIFUSA O FIBROSIS PULMONAR, O AMBAS) PUEDEN DESARROLLARSE DE MANERA INSIDIOSA. ESTAS REACCIONES OCURREN RARAMENTE Y GENERALMENTE EN PACIENTES QUE RECIBEN TERAPIA DURANTE SEIS MESES O MÁS. SE GARANTIZA UNA SUPERVISIÓN ESTRECHA DE LA CONDICIÓN PULMONAR DE LOS PACIENTES QUE RECIBEN TERAPIA A LARGO PLAZO Y REQUIERE QUE LOS BENEFICIOS DE LA TERAPIA SE SOPENSEN CONTRA LOS RIESGOS POTENCIALES. (ver REACCIONES RESPIRATORIAS.)
hepatotoxicidad
Las reacciones hepáticas, que incluyen hepatitis, ictericia colestásica, hepatitis crónica activa y necrosis hepática, ocurren raramente. Se han reportado muertes. El inicio de la hepatitis activa crónica puede ser insidioso y los pacientes deben ser monitoreados periódicamente para detectar cambios en las pruebas bioquímicas que indiquen daño hepático. Si se produce hepatitis, el fármaco debe retirarse inmediatamente y se deben tomar las medidas adecuadas.
Neuropatía
Se ha producido una neuropatía periférica, que puede volverse grave o irreversible. Se han reportado muertes. Condiciones tales como insuficiencia renal (depuración de creatinina inferior a 60 ml por minuto o creatinina sérica elevada clínicamente significativa), anemia, diabetes mellitus, desequilibrio electrolítico, deficiencia de vitamina B y enfermedades debilitantes pueden aumentar la aparición de neuropatía periférica. Los pacientes que reciben terapia a largo plazo deben ser monitoreados periódicamente para detectar cambios en la función renal.
La neuritis óptica se ha informado raramente en la experiencia posterior a la comercialización con formulaciones de nitrofurantoína.
Anemia hemolítica
La nitrofurantoína ha inducido casos de anemia hemolítica del tipo sensible a la primaquina. La hemólisis parece estar relacionada con una deficiencia de glucosa-6-fosfato deshidrogenasa en los glóbulos rojos de los pacientes afectados. Esta deficiencia se encuentra en el 10 por ciento de los negros y un pequeño porcentaje de grupos étnicos de origen mediterráneo y del Cercano Oriente. La hemólisis es una indicación para suspender furadantina la hemólisis cesa cuando se retira el fármaco.
Diarrea asociada a Clostridium difficile
Se ha notificado diarrea asociada a Clostridium difficile (CDAD) con el uso de casi todos los agentes antibacterianos, incluidos furadantina Suspensión oral, y puede variar en severidad desde diarrea leve hasta colitis fatal. El tratamiento con agentes antibacterianos altera la flora normal del colon y conduce al crecimiento excesivo de C. difficile.
C. difficile produce toxinas A y B que contribuyen al desarrollo de CDAD. Las cepas de C. difficile productoras de hipertoxina causan mayor morbilidad y mortalidad, ya que estas infecciones pueden ser refractarias a la terapia antimicrobiana y pueden requerir colectomía. Se debe considerar CDAD en todos los pacientes que presenten diarrea después del uso de antibióticos. Es necesaria una cuidadosa historia clínica ya que se ha informado que la CDAD ocurre más de dos meses después de la administración de agentes antibacterianos.
Si se sospecha o se confirma CDAD, es posible que deba suspenderse el uso continuo de antibióticos no dirigidos contra C. difficile. Se debe instituir el manejo adecuado de líquidos y electrolitos, la suplementación con proteínas, el tratamiento con antibióticos de C. difficile y la evaluación quirúrgica según esté clínicamente indicado.
PRECAUCIONES
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
La nitrofurantoína no fue cancerígena cuando se administró a ratas Holtzman hembra durante 44,5 semanas oa ratas Sprague-Dawley hembra durante 75 semanas. Dos bioensayos crónicos en roedores que utilizaron ratas Sprague-Dawley macho y hembra y dos bioensayos crónicos en ratones Swiss y en ratones BDF1 no revelaron evidencia de carcinogenicidad.
La nitrofurantoína presentó evidencia de actividad carcinogénica en ratones hembra B6C3F1, como lo demuestra el aumento de la incidencia de adenomas tubulares, tumores mixtos benignos y tumores de células de la granulosa del ovario. En ratas macho F344/N, hubo una mayor incidencia de neoplasias poco comunes de células tubulares renales, osteosarcomas del hueso y neoplasias del tejido subcutáneo. En un estudio que involucró la administración subcutánea de 75 mg/kg de nitrofurantoína a ratones hembra embarazadas, se observaron adenomas papilares pulmonares de significado desconocido en la generación F1.
Se ha demostrado que la nitrofurantoína induce mutaciones puntuales en ciertas cepas de Salmonella typhimurium y mutaciones directas en células de linfoma de ratón L5178Y. La nitrofurantoína indujo un mayor número de intercambios de cromátidas hermanas y aberraciones cromosómicas en células de ovario de hámster chino, pero no en células humanas en cultivo. Los resultados del ensayo letal recesivo ligado al sexo en Drosophila fueron negativos después de la administración de nitrofurantoína por alimentación o por inyección. La nitrofurantoína no indujo mutaciones hereditarias en los modelos de roedores examinados.
Se desconoce la importancia de los hallazgos de carcinogenicidad y mutagenicidad en relación con el uso terapéutico de nitrofurantoína en humanos.
La administración de altas dosis de nitrofurantoína a ratas provoca una detención temporal de la espermatogenia; esto es reversible al suspender el fármaco. Las dosis de 10 mg/kg/día o mayores en varones humanos sanos pueden, en ciertos casos impredecibles, producir una detención espermatogénica de leve a moderada con una disminución en el conteo de espermatozoides.
El embarazo
Efectos teratogénicos
Se han realizado varios estudios de reproducción en conejos y ratas a dosis de hasta seis veces la dosis humana y no han revelado evidencia de alteración de la fertilidad o daño al feto debido a la nitrofurantoína. En un único estudio publicado realizado en ratones a 68 veces la dosis humana (basada en mg/kg administrados a la madre), se observó retraso en el crecimiento y una baja incidencia de malformaciones menores y comunes. Sin embargo, a 25 veces la dosis humana, no se observaron malformaciones fetales; la relevancia de estos hallazgos para los humanos es incierta. Sin embargo, no existen estudios adecuados y bien controlados en mujeres embarazadas. Debido a que los estudios de reproducción en animales no siempre predicen la respuesta humana, este medicamento debe usarse durante el embarazo solo si es claramente necesario.
Efectos no teratogénicos
En un estudio de carcinogenicidad transplacentaria publicado, se demostró que la nitrofurantoína induce adenomas papilares pulmonares en ratones de la generación F1 en dosis 19 veces superiores a la dosis humana en mg/kg. Actualmente se desconoce la relación de este hallazgo con la carcinogénesis humana potencial. Debido a la incertidumbre con respecto a las implicaciones humanas de estos datos en animales, este medicamento debe usarse durante el embarazo solo si es claramente necesario.
Trabajo y entrega
Ver CONTRAINDICACIONES .
Madres lactantes
Se ha detectado nitrofurantoína en la leche materna humana en cantidades mínimas. Debido al potencial de reacciones adversas graves de la nitrofurantoína en lactantes menores de un mes de edad, se debe tomar la decisión de suspender la lactancia o suspender el fármaco, teniendo en cuenta la importancia del fármaco para la madre. (ver CONTRAINDICACIONES )
Uso pediátrico
Seguridad y eficacia de furadantina en neonatos menores de un mes no se han establecido. (ver CONTRAINDICACIONES )
SOBREDOSIS
Incidentes ocasionales de sobredosis aguda de furadantina no han dado lugar a ningún síntoma específico aparte de los vómitos. Se recomienda la inducción de la emesis. No existe un antídoto específico, pero se debe mantener una ingesta elevada de líquidos para favorecer la excreción urinaria del fármaco. Es dializable.
CONTRAINDICACIONES
La anuria, la oliguria o el deterioro significativo de la función renal (depuración de creatinina inferior a 60 ml por minuto o creatinina sérica elevada clínicamente significativa) son contraindicaciones. El tratamiento de este tipo de pacientes conlleva un mayor riesgo de toxicidad debido a la alteración de la excreción del fármaco.
Debido a la posibilidad de anemia hemolítica debido a la inmadurez de los sistemas enzimáticos de los eritrocitos (inestabilidad del glutatión), el fármaco está contraindicado en pacientes embarazadas a término (38 a 42 semanas de gestación), durante el trabajo de parto y el parto, o cuando el inicio del trabajo de parto es inminente. Por la misma razón, el fármaco está contraindicado en recién nacidos menores de un mes.
furadantina está contraindicado en pacientes con antecedentes de ictericia colestásica/disfunción hepática asociada con nitrofurantoína. furadantina también está contraindicado en aquellos pacientes con hipersensibilidad conocida a la nitrofurantoína.
FARMACOLOGÍA CLÍNICA
administrado por vía oral furadantina se absorbe fácilmente y se excreta rápidamente en la orina. Las concentraciones en sangre a dosis terapéuticas suelen ser bajas. Es muy soluble en la orina, a la que puede impartir un color marrón.
Después de un régimen de dosis de 100 mg cuatro veces al día durante 7 días, las recuperaciones promedio de fármaco urinario (0-24 horas) en el día 1 y el día 7 fueron del 42,7 % y el 43,6 %.
A diferencia de muchos medicamentos, la presencia de alimentos o agentes que retrasan el vaciado gástrico puede aumentar la biodisponibilidad de furadantina , presumiblemente al permitir una mejor disolución en los jugos gástricos.
Microbiología
Modo de acción
La nitrofurantoína es reducida por una amplia gama de enzimas, incluidas las flavoproteínas bacterianas, a intermediarios reactivos que dañan macromoléculas como el ADN y las proteínas.
Resistencia cruzada
Aunque puede ocurrir resistencia cruzada con otros antimicrobianos, no se ha observado resistencia cruzada con sulfonamidas.
Interacción con otros antimicrobianos
Se ha demostrado antagonismo in vitro entre nitrofurantoína y agentes antimicrobianos de quinolona. Se ha demostrado que la nitrofurantoína, en forma de suspensión oral de nitrofurantoína, es activa contra la mayoría de las siguientes bacterias tanto in vitro como en infecciones clínicas: (Ver INDICACIONES Y USO ).
Aerobios Gram-positivos
Staphylococcus aureusEspecies de Enterococcus
Aerobios Gram-negativos
Escherichia coli
NOTA: Algunas cepas de especies de Enterobacter y especies de Klebsiella son resistentes a la nitrofurantoína.
Los siguientes datos in vitro están disponibles, pero se desconoce su importancia clínica. La nitrofurantoína exhibe actividad in vitro contra las siguientes bacterias; sin embargo, la seguridad y la eficacia de la nitrofurantoína en el tratamiento de infecciones clínicas debidas a estas bacterias no se han establecido en ensayos clínicos adecuados y bien controlados.
Aerobios Gram-positivos
Estafilococos coagulasa negativos (incluidos Staphylococcus epidermidis y Staphylococcus saprophyticus) Streptococcus agalactiaeEstreptococos del grupo Viridans
Aerobios Gram-negativos
Citrobacter koseriCitrobacter freundiiKlebsiella oxytoca
La nitrofurantoína no es activa contra la mayoría de las cepas de las especies Proteus o Serratia. No tiene actividad contra especies de Pseudomonas.
Pruebas de susceptibilidad
Para obtener información específica sobre los criterios de interpretación de las pruebas de susceptibilidad y los métodos de prueba asociados y los estándares de control de calidad reconocidos por la FDA para este medicamento, consulte: http://www.fda.gov/STIC.
INFORMACIÓN DEL PACIENTE
Se debe recomendar a los pacientes que tomen furadantina con alimentos para aumentar aún más la tolerancia y mejorar la absorción del fármaco. Se debe instruir a los pacientes para que completen el curso completo de la terapia; sin embargo, se les debe recomendar que se comuniquen con su médico si se presentan síntomas inusuales durante la terapia.
La diarrea es un problema común causado por los antibióticos que generalmente termina cuando se suspende el antibiótico. A veces, después de comenzar el tratamiento con antibióticos, los pacientes pueden desarrollar heces acuosas y sanguinolentas (con o sin calambres estomacales y fiebre) incluso dos o más meses después de haber tomado la última dosis del antibiótico. Si esto ocurre, los pacientes deben comunicarse con su médico lo antes posible.
Se debe advertir a los pacientes que no usen preparaciones antiácidas que contengan trisilicato de magnesio mientras toman furadantina .
