Geodon 40mg, 80mg, 20mg Ziprasidone Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Geodon y cómo se usa?
Geodon es un medicamento recetado que se usa para tratar los síntomas de la esquizofrenia, la agitación aguda con esquizofrenia y el trastorno bipolar I. Geodon se puede usar solo o con otros medicamentos.
Geodon 20mg pertenece a una clase de medicamentos llamados antipsicóticos.
No se sabe si Geodon es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Geodon?
Geodon 20 mg puede causar efectos secundarios graves, que incluyen:
- latidos del corazón rápidos o fuertes,
- revoloteando en tu pecho,
- dificultad para respirar,
- mareo repentino,
- movimientos musculares incontrolados en la cara (masticar, relamerse los labios, fruncir el ceño, mover la lengua, parpadear o mover los ojos),
- cualquier erupción cutánea,
- fiebre,
- úlceras de boca,
- llagas en la piel,
- dolor de garganta,
- tos,
- dificultad para respirar,
- aumento de la sed,
- aumento de la micción
- boca seca,
- aliento con olor afrutado,
- músculos muy rígidos,
- fiebre alta,
- transpiración,
- agitación, y
- confusión
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Geodon 40 mg incluyen:
- mareo,
- somnolencia,
- debilidad,
- náuseas,
- vómitos,
- dificultad al tragar,
- sentirse inquieto,
- temblores,
- problemas de la vista,
- secreción nasal, y
- tos nueva o que empeora
Informe a su médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Prometrium. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
ADVERTENCIA
AUMENTO DE LA MORTALIDAD EN PACIENTES ANCIANOS CON PSICOSIS RELACIONADA CON DEMENCIA
Los pacientes de edad avanzada con psicosis relacionada con la demencia tratados con medicamentos antipsicóticos tienen un mayor riesgo de muerte. GEODON no está aprobado para el tratamiento de la psicosis relacionada con la demencia [ver ADVERTENCIAS Y PRECAUCIONES].
DESCRIPCIÓN
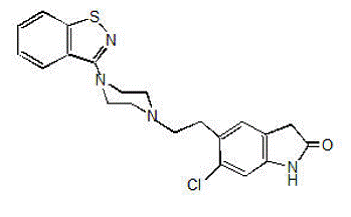
GEODON 40 mg está disponible en forma de cápsulas (clorhidrato de ziprasidona) para administración oral y como inyección (mesilato de ziprasidona) solo para uso intramuscular. La ziprasidona es un agente psicotrópico que no tiene relación química con los agentes antipsicóticos de fenotiazina o butirofenona. Tiene un peso molecular de 412,94 (base libre), con el siguiente nombre químico: 5-[2-[4-(1,2-benzisotiazol-3-il)-1-piperazinil]etil]-6-cloro-1 ,3-dihidro-2H-indol-2-ona. La fórmula empírica de C21H21ClN4OS (base libre de ziprasidona) representa la siguiente fórmula estructural:
Las cápsulas de GEODON contienen una sal monohidrocloruro, monohidrato de ziprasidona. Químicamente, el clorhidrato de ziprasidona monohidrato es 5-[2-[4-(1,2- benzisotiazol-3-il)-1-piperazinil]etil]-6-cloro-1,3-dihidro-2H-indol-2-ona , monoclorhidrato, monohidrato. La fórmula empírica es C21H21ClN4OS• HCl• H2O y su peso molecular es 467,42. El clorhidrato de ziprasidona monohidrato es un polvo de color blanco a ligeramente rosado.
Las cápsulas de 20 mg de GEODON se suministran para administración oral en cápsulas de 20 mg (azul/blanco), 40 mg (azul/azul), 60 mg (blanco/blanco) y 80 mg (azul/blanco). Las cápsulas de 40 mg de GEODON contienen monohidrato de clorhidrato de ziprasidona, lactosa, almidón pregelatinizado y estearato de magnesio.
GEODON para inyección contiene una forma liofilizada de trihidrato de mesilato de ziprasidona. Químicamente, el mesilato de ziprasidona trihidrato es 5-[2-[4-(1,2- benzisotiazol-3-il)-1-piperazinil]etil]-6-cloro-1,3-dihidro-2H-indol-2-ona , metanosulfonato, trihidrato. La fórmula empírica es C21H21ClN4OS • CH3SO3H • 3H2O y su peso molecular es 563,09.
GEODON 40 mg para inyección está disponible en un vial de dosis única como mesilato de ziprasidona (20 mg de ziprasidona/mL cuando se reconstituye de acuerdo con las instrucciones de la etiqueta) [ver DOSIFICACIÓN Y ADMINISTRACIÓN ]. Cada ml de mesilato de ziprasidona para inyección (cuando se reconstituye) contiene 20 mg de ziprasidona y 4,7 mg de ácido metanosulfónico solubilizados por 294 mg de sulfobutiléter β-ciclodextrina sódica (SBECD).
INDICACIONES
GEODON está indicado para el tratamiento de la esquizofrenia, como monoterapia para el tratamiento agudo de episodios bipolares maníacos o mixtos, y como complemento del litio o el valproato para el tratamiento de mantenimiento del trastorno bipolar. GEODON intramuscular está indicado para la agitación aguda en pacientes esquizofrénicos. Al decidir entre los tratamientos alternativos disponibles para la afección que requiere tratamiento, el prescriptor debe considerar la mayor capacidad de ziprasidona para prolongar el intervalo QT/QTc en comparación con otros fármacos antipsicóticos [ver ADVERTENCIAS Y PRECAUCIONES ]. La prolongación del intervalo QTc se asocia en algunos otros fármacos con la capacidad de causar arritmia tipo torsade de pointes, una taquicardia ventricular polimórfica potencialmente fatal y muerte súbita. En muchos casos, esto llevaría a la conclusión de que primero se deben probar otras drogas. Aún no se sabe si ziprasidona causará torsade de pointes o aumentará la tasa de muerte súbita [ver ADVERTENCIAS Y PRECAUCIONES ]
Esquizofrenia
- GEODON está indicado para el tratamiento de la esquizofrenia en adultos [ver Estudios clínicos ].
Trastorno bipolar I (episodios maníacos o mixtos agudos y tratamiento de mantenimiento como complemento del litio o el valproato)
- GEODON está indicado como monoterapia para el tratamiento agudo de adultos con episodios maníacos o mixtos asociados con el trastorno bipolar I [ver Estudios clínicos ].
- GEODON 40 mg está indicado como complemento del litio o el valproato para el tratamiento de mantenimiento del trastorno bipolar I en adultos [ver Estudios clínicos ].
Tratamiento agudo de la agitación en la esquizofrenia
- GEODON 40 mg por vía intramuscular está indicado para el tratamiento de la agitación aguda en pacientes esquizofrénicos adultos para los que es apropiado el tratamiento con ziprasidona y que necesitan medicación antipsicótica intramuscular para el control rápido de la agitación [ver Estudios clínicos ].
Dado que no hay experiencia sobre la seguridad de administrar ziprasidona intramuscular a pacientes esquizofrénicos que ya toman ziprasidona oral, no se recomienda la práctica de la administración conjunta.
DOSIFICACIÓN Y ADMINISTRACIÓN
Esquizofrenia
Selección de dosis
Las cápsulas de 40 mg de GEODON deben administrarse a una dosis diaria inicial de 20 mg dos veces al día con alimentos. En algunos pacientes, la dosis diaria puede ajustarse posteriormente en función del estado clínico individual hasta 80 mg dos veces al día. Los ajustes de dosis, si están indicados, generalmente deben ocurrir a intervalos de no menos de 2 días, ya que el estado de equilibrio se alcanza dentro de 1 a 3 días. Con el fin de asegurar el uso de la dosis eficaz más baja, normalmente se debe observar a los pacientes para ver si mejoran durante varias semanas antes de aumentar la dosis.
La eficacia en la esquizofrenia se demostró en un rango de dosis de 20 mg a 100 mg dos veces al día en ensayos clínicos a corto plazo controlados con placebo. Hubo tendencias hacia la respuesta a la dosis dentro del rango de 20 mg a 80 mg dos veces al día, pero los resultados no fueron consistentes. Por lo general, no se recomienda un aumento a una dosis superior a 80 mg dos veces al día. La seguridad de dosis superiores a 100 mg dos veces al día no ha sido evaluada sistemáticamente en ensayos clínicos [ver Estudios clínicos ].
Tratamiento de mantenimiento
Si bien no hay un cuerpo de evidencia disponible para responder a la pregunta de cuánto tiempo debe permanecer un paciente tratado con ziprasidona, un estudio de mantenimiento en pacientes que habían estado sintomáticamente estables y luego aleatorizados para continuar con ziprasidona o cambiar a placebo demostró un retraso en el tiempo. recaída para los pacientes que reciben GEODON [ver Estudios clínicos ]. No se demostró ningún beneficio adicional con dosis superiores a 20 mg dos veces al día. Los pacientes deben ser reevaluados periódicamente para determinar la necesidad de un tratamiento de mantenimiento.
Trastorno bipolar I (episodios maníacos o mixtos agudos y tratamiento de mantenimiento como complemento del litio o el valproato)
Tratamiento agudo de episodios maníacos o mixtos
Selección de dosis: la ziprasidona oral debe administrarse en una dosis diaria inicial de 40 mg dos veces al día con alimentos. Luego, la dosis puede aumentarse a 60 mg u 80 mg dos veces al día el segundo día de tratamiento y luego ajustarse en función de la tolerancia y la eficacia dentro del rango de 40 mg a 80 mg dos veces al día. En los ensayos clínicos de dosis flexible, la dosis diaria media administrada fue de aproximadamente 120 mg [ver Estudios clínicos ].
Tratamiento de mantenimiento (como complemento del litio o el valproato)
Continúe el tratamiento con la misma dosis con la que se estabilizó inicialmente al paciente, dentro del rango de 40 mg a 80 mg dos veces al día con alimentos. Los pacientes deben ser reevaluados periódicamente para determinar la necesidad de un tratamiento de mantenimiento [ver Estudios clínicos ].
Tratamiento agudo de la agitación en la esquizofrenia
Dosificación intramuscular
La dosis recomendada es de 10 mg a 20 mg administrados según necesidad hasta una dosis máxima de 40 mg al día. Se pueden administrar dosis de 10 mg cada dos horas; se pueden administrar dosis de 20 mg cada cuatro horas hasta un máximo de 40 mg/día. No se ha estudiado la administración intramuscular de ziprasidona durante más de tres días consecutivos.
Si está indicada una terapia a largo plazo, las cápsulas orales de clorhidrato de ziprasidona deben reemplazar la administración intramuscular lo antes posible.
Dado que no hay experiencia sobre la seguridad de administrar ziprasidona intramuscular a pacientes esquizofrénicos que ya toman ziprasidona oral, no se recomienda la práctica de la administración conjunta.
Ziprasidone intramuscular está destinado únicamente para uso intramuscular y no debe administrarse por vía intravenosa.
Preparación intramuscular para administración
GEODON para inyección (mesilato de ziprasidona) solo debe administrarse mediante inyección intramuscular y no debe administrarse por vía intravenosa. Los viales de dosis única requieren reconstitución antes de la administración.
Agregue 1,2 ml de agua estéril para inyección al vial y agite vigorosamente hasta que se disuelva todo el fármaco. Cada ml de solución reconstituida contiene 20 mg de ziprasidona. Para administrar una dosis de 10 mg, extraiga 0,5 ml de la solución reconstituida. Para administrar una dosis de 20 mg, extraiga 1,0 ml de la solución reconstituida. Cualquier porción no utilizada debe desecharse. Dado que este producto no contiene conservantes ni agentes bacteriostáticos, se debe utilizar una técnica aséptica en la preparación de la solución final. Este medicamento no debe mezclarse con otros medicamentos o disolventes que no sean agua estéril para inyección. Los productos farmacéuticos parenterales deben inspeccionarse visualmente en busca de partículas y decoloración antes de la administración, siempre que la solución y el envase lo permitan.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Cápsulas GEODON se diferencian por el color/tamaño de la cápsula y están impresos en tinta negra con "Pfizer y ZDX [dosificación]" o "Pfizer" y un número único. Las cápsulas de 40 mg de GEODON se suministran para administración oral en cápsulas de 20 mg (azul/blanco), 40 mg (azul/azul), 60 mg (blanco/blanco) y 80 mg (azul/blanco). Se suministran en las siguientes potencias y configuraciones de paquetes:
GEODON para inyección está disponible en un vial de dosis única como mesilato de ziprasidona (20 mg de ziprasidona/ml cuando se reconstituye según las instrucciones de la etiqueta) [ver DOSIFICACIÓN Y ADMINISTRACIÓN ]. Cada ml de mesilato de ziprasidona inyectable (cuando se reconstituye) produce una solución de incolora a rosa pálido que contiene 20 mg de ziprasidona y 4,7 mg de ácido metanosulfónico solubilizados por 294 mg de sulfobutiléter β-ciclodextrina sódica (SBECD).
Almacenamiento y manipulación
Cápsulas GEODON se diferencian por el color/tamaño de la cápsula y están impresos en tinta negra con "Pfizer y ZDX [dosificación]" o con "Pfizer" y un número único. Las cápsulas de 20 mg de GEODON se suministran para administración oral en cápsulas de 20 mg (azul/blanco), 40 mg (azul/azul), 60 mg (blanco/blanco) y 80 mg (azul/blanco). Se suministran en las siguientes potencias y configuraciones de paquetes:
O
Las cápsulas de GEODON deben almacenarse a 25 °C (77 °F); excursiones permitidas a 15°C a 30°C (59°F a 86°F) [ver Temperatura ambiente controlada por USP ].
GEODON 80 mg para inyección está disponible en un vial de dosis única como mesilato de ziprasidona (20 mg de ziprasidona/mL cuando se reconstituye de acuerdo con las instrucciones de la etiqueta) [ver DOSIFICACIÓN Y ADMINISTRACIÓN ]. Cada ml de mesilato de ziprasidona inyectable (cuando se reconstituye) produce una solución de incolora a rosa pálido que contiene 20 mg de ziprasidona y 4,7 mg de ácido metanosulfónico solubilizados por 294 mg de sulfobutiléter β-ciclodextrina sódica (SBECD).
GEODON 40 mg para inyección debe almacenarse a 25 °C (77 °F); excursiones permitidas a 15°C a 30°C (59°F a 86°F) [ver Temperatura ambiente controlada por USP en forma seca. Proteger de la luz. Después de la reconstitución, GEODON 40 mg para inyección se puede almacenar, protegido de la luz, hasta 24 horas a 15 °C a 30 °C (59 °F a 86 °F) o hasta 7 días refrigerado, 2 °C a 8 °C (36 °F a 46 °F).
Distribuido por: Roerig Division of Pfizer Inc, NY, NY 10017. Revisado: octubre de 2020
EFECTOS SECUNDARIOS
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Los ensayos clínicos de ziprasidona oral incluyeron aproximadamente 5700 pacientes y/o sujetos normales expuestos a una o más dosis de ziprasidona. De estos 5700, más de 4800 eran pacientes que participaron en ensayos de eficacia de dosis múltiples y su experiencia correspondía a aproximadamente 1831 años-paciente. Estos pacientes incluyen: (1) 4331 pacientes que participaron en ensayos de dosis múltiples, predominantemente en esquizofrenia, lo que representa aproximadamente 1698 años-paciente de exposición al 5 de febrero de 2000; y (2) 472 pacientes que participaron en ensayos de manía bipolar que representan aproximadamente 133 años-paciente de exposición. Otros 127 pacientes con trastorno bipolar participaron en un estudio de tratamiento de mantenimiento a largo plazo que representa aproximadamente 74,7 años-paciente de exposición a ziprasidona. Las condiciones y la duración del tratamiento con ziprasidona incluyeron estudios abiertos y doble ciego, estudios con pacientes hospitalizados y ambulatorios, y exposición a corto y largo plazo.
Los ensayos clínicos de ziprasidona intramuscular incluyeron a 570 pacientes y/o sujetos normales que recibieron una o más inyecciones de ziprasidona. Más de 325 de estos sujetos participaron en ensayos que implicaban la administración de dosis múltiples.
Las reacciones adversas durante la exposición se obtuvieron mediante la recopilación de experiencias adversas informadas voluntariamente, así como los resultados de exámenes físicos, signos vitales, pesos, análisis de laboratorio, ECG y resultados de exámenes oftalmológicos.
Las frecuencias indicadas de reacciones adversas representan la proporción de personas que experimentaron, al menos una vez, una reacción adversa emergente del tratamiento del tipo enumerado. Una reacción se consideró emergente del tratamiento si ocurría por primera vez o empeoraba mientras recibía la terapia después de la evaluación inicial.
Hallazgos adversos observados en ensayos controlados con placebo a corto plazo con ziprasidona oral
Los siguientes hallazgos se basan en los ensayos previos a la comercialización controlados con placebo a corto plazo para la esquizofrenia (un conjunto de dos ensayos de dosis fija de 6 semanas y dos de 4 semanas) y la manía bipolar (un conjunto de dos ensayos de dosis flexible de 3 semanas). ensayos) en los que se administró ziprasidona en dosis que oscilaron entre 10 y 200 mg/día.
Reacciones adversas comúnmente observadas en ensayos controlados con placebo a corto plazo
Las siguientes reacciones adversas fueron las reacciones adversas observadas con mayor frecuencia asociadas con el uso de ziprasidona (incidencia del 5 % o más) y no se observaron con una incidencia equivalente entre los pacientes tratados con placebo (incidencia de ziprasidona al menos el doble que la del placebo):
Ensayos de esquizofrenia (ver Tabla 11)
- Somnolencia
- Infección del tracto respiratorio
Ensayos bipolares (ver Tabla 12)
- Somnolencia
- Síntomas extrapiramidales que incluye los siguientes términos de reacciones adversas: síndrome extrapiramidal, hipertonía, distonía, discinesia, hipocinesia, temblor, parálisis y espasmos. Ninguna de estas reacciones adversas ocurrió individualmente con una incidencia superior al 10 % en los ensayos de manía bipolar.
- Mareos que incluye los términos de reacción adversa mareos y aturdimiento.
- Acatisia
- Visión anormal
- Astenia
- vómitos
Esquizofrenia
Reacciones adversas asociadas con la interrupción del tratamiento en ensayos controlados con placebo a corto plazo de ziprasidona oral
Aproximadamente el 4,1 % (29/702) de los pacientes tratados con ziprasidona en estudios a corto plazo controlados con placebo interrumpieron el tratamiento debido a una reacción adversa, en comparación con aproximadamente el 2,2 % (6/273) con placebo. La reacción más común asociada con el abandono fue el sarpullido, incluidos 7 abandonos por sarpullido entre los pacientes que recibieron ziprasidona (1 %) en comparación con los pacientes que no recibieron placebo [ver ADVERTENCIAS Y PRECAUCIONES ].
Reacciones adversas que ocurren con una incidencia del 2 % o más entre los pacientes tratados con ziprasidona en ensayos a corto plazo, orales y controlados con placebo
La Tabla 11 enumera la incidencia, redondeada al porcentaje más cercano, de reacciones adversas emergentes del tratamiento que ocurrieron durante la terapia aguda (hasta 6 semanas) en pacientes predominantemente con esquizofrenia, incluidas solo aquellas reacciones que ocurrieron en el 2% o más de los pacientes tratados con ziprasidona y cuya incidencia en pacientes tratados con ziprasidona fue mayor que la incidencia en pacientes tratados con placebo.
Dependencia de la dosis de las reacciones adversas en ensayos a corto plazo, de dosis fija y controlados con placebo
Un análisis de la respuesta a la dosis en el grupo de 4 estudios de esquizofrenia reveló una relación aparente entre la reacción adversa y la dosis para las siguientes reacciones: astenia, hipotensión postural, anorexia, sequedad de boca, aumento de la salivación, artralgia, ansiedad, mareos, distonía, hipertonía, somnolencia , temblor, rinitis, sarpullido y visión anormal.
Síntomas extrapiramidales (EPS)
La incidencia de SEP informados (que incluyeron los términos de reacción adversa síndrome extrapiramidal, hipertonía, distonía, discinesia, hipocinesia, temblor, parálisis y espasmos) para los pacientes tratados con ziprasidona en los ensayos de esquizofrenia a corto plazo controlados con placebo fue del 14 % vs. 8% para placebo. Los datos recopilados objetivamente de esos ensayos en la escala de calificación de Simpson-Angus (para EPS) y la escala de acatisia de Barnes (para acatisia) generalmente no mostraron una diferencia entre ziprasidona y placebo.
distonía
Efecto de Clase: Los síntomas de distonía, contracciones anormales prolongadas de grupos musculares, pueden ocurrir en individuos susceptibles durante los primeros días de tratamiento. Los síntomas distónicos incluyen: espasmo de los músculos del cuello, que a veces progresa a opresión en la garganta, dificultad para tragar, dificultad para respirar y/o protrusión de la lengua. Si bien estos síntomas pueden ocurrir en dosis bajas, ocurren con mayor frecuencia y con mayor gravedad con alta potencia y en dosis más altas de fármacos antipsicóticos de primera generación. Se observa un riesgo elevado de distonía aguda en hombres y grupos de edad más jóvenes.
Cambios en los signos vitales
La ziprasidona se asocia con hipotensión ortostática [ver ADVERTENCIAS Y PRECAUCIONES ]
Cambios en el ECG
La ziprasidona se asocia con un aumento en el intervalo QTc [ver ADVERTENCIAS Y PRECAUCIONES ]. En los ensayos de esquizofrenia, ziprasidona se asoció con un aumento medio de la frecuencia cardíaca de 1,4 latidos por minuto en comparación con una disminución de 0,2 latidos por minuto entre los pacientes que recibieron placebo.
Otras reacciones adversas observadas durante la evaluación previa a la comercialización de ziprasidona oral
A continuación se incluye una lista de términos de COSTART que reflejan las reacciones adversas emergentes del tratamiento tal como se definen en la introducción de la sección REACCIONES ADVERSAS informadas por pacientes tratados con ziprasidona en ensayos de esquizofrenia en dosis múltiples >4 mg/día dentro de la base de datos de 3834 pacientes. Se incluyen todas las reacciones informadas, excepto las que ya se enumeran en la Tabla 11 o en otra parte del etiquetado, los términos de reacción que eran tan generales que no eran informativos, las reacciones informadas solo una vez y que no tenían una probabilidad sustancial de ser una amenaza aguda para la vida, las reacciones que son parte de la enfermedad que se está tratando o son comunes como reacciones de fondo y reacciones que se considera poco probable que estén relacionadas con el medicamento. Es importante recalcar que, aunque las reacciones reportadas ocurrieron durante el tratamiento con ziprasidona, no necesariamente fueron causadas por éste.
Las reacciones adversas se clasifican además por sistema corporal y se enumeran en orden decreciente de frecuencia de acuerdo con las siguientes definiciones:
Frecuentes: reacciones adversas que ocurren en al menos 1/100 pacientes (≥1,0 % de los pacientes) (en esta lista solo aparecen las que no se enumeran en los resultados tabulados de los ensayos controlados con placebo);
Poco frecuentes: reacciones adversas que ocurren en 1/100 a 1/1000 pacientes (en 0.1-1.0% de los pacientes)
Raros: reacciones adversas que ocurren en menos de 1/1000 pacientes (
cuerpo como un todo
Dolor abdominal frecuente, síndrome gripal, fiebre, caída accidental, edema facial, escalofríos, reacción de fotosensibilidad, dolor en el costado, hipotermia, accidente automovilístico
Sistema cardiovascular
Taquicardia frecuente, hipertensión, hipotensión postural
Bradicardia poco frecuente, angina de pecho, fibrilación auricular
Raros bloqueo AV de primer grado, bloqueo de rama del haz de His, flebitis, embolia pulmonar, cardiomegalia, infarto cerebral, accidente cerebrovascular, tromboflebitis profunda, miocarditis, tromboflebitis
Sistema digestivo
Anorexia frecuente, vómitos
Hemorragia rectal poco frecuente, disfagia, edema de la lengua
Raros hemorragia de las encías, ictericia, impactación fecal, aumento de gamma glutamil transpeptidasa, hematemesis, ictericia colestásica, hepatitis, hepatomegalia, leucoplasia bucal, depósito de hígado graso, melena
Endocrino
Raros hipotiroidismo, hipertiroidismo, tiroiditis
Sistema Hemático y Linfático
Infrecuente anemia, equimosis, leucocitosis, leucopenia, eosinofilia, linfadenopatía
Raros trombocitopenia, anemia hipocrómica, linfocitosis, monocitosis, basofilia, linfedema, policitemia, trombocitemia
Trastornos metabólicos y nutricionales
Sed infrecuente, aumento de transaminasas, edema periférico, hiperglucemia, aumento de creatina fosfocinasa, aumento de fosfatasa alcalina, hipercolesterolemia, deshidratación, aumento de deshidrogenasa láctica, albuminuria, hipopotasemia
Raros Aumento de BUN, aumento de creatinina, hiperlipemia, hipocolesterolemia, hiperpotasemia, hipocloremia, hipoglucemia, hiponatremia, hipoproteinemia, disminución de la tolerancia a la glucosa, gota, hipercloremia, hiperuricemia, hipocalcemia, hipoglucemia, hipomagnesemia, cetosis, alcalosis respiratoria
Sistema musculoesquelético
mialgia frecuente
Tenosinovitis infrecuente
miopatía rara
Sistema nervioso
Agitación frecuente, síndrome extrapiramidal, temblor, distonía, hipertonía, discinesia, hostilidad, espasmos, parestesia, confusión, vértigo, hipocinesia, hipercinesia, marcha anormal, crisis oculógira, hipoestesia, ataxia, amnesia, rigidez en rueda dentada, delirio, hipotonía, acinesia, disartria, síndrome de abstinencia, síndrome bucogloso, coreoatetosis, diplopía, falta de coordinación, neuropatía
parálisis poco frecuentes
Raros mioclono, nistagmo, tortícolis, parestesia peribucal, opistótonos, reflejos aumentados, trismo
Sistema respiratorio
disnea frecuente
Neumonía poco frecuente, epistaxis
Raros hemoptisis, laringismo
Piel y Apéndices
Erupción maculopapular poco frecuente, urticaria, alopecia, eccema, dermatitis exfoliativa, dermatitis de contacto, erupción vesiculoampollosa
Sentidos especiales
Dermatitis fúngica frecuente
Infrecuentes conjuntivitis, ojos secos, tinnitus, blefaritis, cataratas, fotofobia
Raros hemorragia ocular, defecto del campo visual, queratitis, queratoconjuntivitis
Sistema urogenital
Impotencia poco frecuente, eyaculación anormal, amenorrea, hematuria, menorragia, lactancia femenina, poliuria, retención urinaria metrorragia, disfunción sexual masculina, anorgasmia, glucosuria
Raros ginecomastia, hemorragia vaginal, nicturia, oliguria, disfunción sexual femenina, hemorragia uterina
Trastorno bipolar
Tratamiento agudo de episodios maníacos o mixtos
Reacciones adversas asociadas con la interrupción del tratamiento en ensayos controlados con placebo a corto plazo
Aproximadamente el 6,5 % (18/279) de los pacientes tratados con ziprasidona en estudios a corto plazo controlados con placebo interrumpieron el tratamiento debido a una reacción adversa, en comparación con aproximadamente el 3,7 % (5/136) con placebo. Las reacciones más comunes asociadas con el abandono en los pacientes tratados con ziprasidona fueron acatisia, ansiedad, depresión, mareos, distonía, sarpullido y vómitos, con 2 abandonos para cada una de estas reacciones entre los pacientes tratados con ziprasidona (1 %) en comparación con un paciente con placebo en cada uno de ellos. distonía y erupción (1%) y ningún paciente con placebo para las reacciones adversas restantes.
Reacciones adversas que ocurren con una incidencia del 2 % o más entre los pacientes tratados con ziprasidona en ensayos a corto plazo, orales y controlados con placebo
La Tabla 12 enumera la incidencia, redondeada al porcentaje más cercano, de reacciones adversas emergentes del tratamiento que ocurrieron durante la terapia aguda (hasta 3 semanas) en pacientes con manía bipolar, incluidas solo aquellas reacciones que ocurrieron en el 2% o más de los pacientes tratados con ziprasidona y cuya incidencia en pacientes tratados con ziprasidona fue mayor que la incidencia en pacientes tratados con placebo.
Las exploraciones de las interacciones en función del género no revelaron diferencias clínicamente significativas en la aparición de reacciones adversas en función de este factor demográfico.
Ziprasidona intramuscular
Reacciones adversas que ocurren con una incidencia del 1 % o más entre pacientes tratados con ziprasidona en ensayos a corto plazo de ziprasidona intramuscular
La Tabla 13 enumera la incidencia, redondeada al porcentaje más cercano, de reacciones adversas emergentes del tratamiento que ocurrieron durante la terapia aguda con ziprasidona intramuscular en el 1 % o más de los pacientes.
En estos estudios, las reacciones adversas más comúnmente observadas asociadas con el uso de ziprasidona intramuscular (incidencia del 5 % o más) y observadas a una tasa de ziprasidona intramuscular (en los grupos de dosis más altas) al menos el doble que en el grupo de ziprasidona intramuscular más baja fueron dolor de cabeza (13%), náuseas (12%) y somnolencia (20%).
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de GEODON. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Los informes de reacciones adversas no enumerados anteriormente que se han recibido desde la introducción en el mercado incluyen ocurrencias raras de lo siguiente: Trastornos cardíacos: taquicardia, torsade de pointes (en presencia de múltiples factores de confusión), [ver ADVERTENCIAS Y PRECAUCIONES ]; Trastornos del sistema digestivo: lengua hinchada; Trastornos del sistema reproductivo y de la mama: galactorrea, priapismo; Trastornos del sistema nervioso: caída facial, síndrome neuroléptico maligno, síndrome serotoninérgico (solo o en combinación con medicamentos serotoninérgicos), discinesia tardía; Trastornos psiquiátricos: insomnio, manía/hipomanía; Trastornos de la piel y del tejido subcutáneo: reacción alérgica (como dermatitis alérgica, angioedema, edema orofacial, urticaria), erupción cutánea, reacción a medicamentos con eosinofilia y síntomas sistémicos (DRESS); Trastornos del sistema urogenital: enuresis, incontinencia urinaria; Trastornos vasculares: Hipotensión postural, síncope.
INTERACCIONES CON LA DROGAS
Las interacciones farmacológicas pueden ser farmacodinámicas (efectos farmacológicos combinados) o farmacocinéticas (alteración de los niveles plasmáticos). Los riesgos de usar ziprasidona en combinación con otros medicamentos se evaluaron como se describe a continuación. Todos los estudios de interacciones se han realizado con ziprasidona oral. Según el perfil farmacodinámico y farmacocinético de ziprasidona, se pueden anticipar posibles interacciones:
Camino metabólico
Aproximadamente dos tercios de ziprasidona se metaboliza a través de una combinación de reducción química por glutatión y reducción enzimática por aldehído oxidasa. No se conocen inhibidores o inductores clínicamente relevantes de la aldehído oxidasa. Menos de un tercio del aclaramiento metabólico de ziprasidona está mediado por la oxidación catalizada por el citocromo P450.
Estudios in vitro
Un estudio de inhibición enzimática in vitro que utilizó microsomas hepáticos humanos mostró que ziprasidona tenía poco efecto inhibidor sobre CYP1A2, CYP2C9, CYP2C19, CYP2D6 y CYP3A4 y, por lo tanto, probablemente no interferiría con el metabolismo de fármacos metabolizados principalmente por estas enzimas. Hay poco potencial de interacciones farmacológicas con ziprasidona debido al desplazamiento [ver FARMACOLOGÍA CLÍNICA ].
Interacciones farmacodinámicas
La ziprasidona no debe usarse con ningún fármaco que prolongue el intervalo QT [ver CONTRAINDICACIONES ].
Dados los efectos primarios de ziprasidona sobre el SNC, se debe tener precaución cuando se toma en combinación con otros medicamentos de acción central.
Debido a su potencial para inducir hipotensión, ziprasidona puede potenciar los efectos de ciertos agentes antihipertensivos.
La ziprasidona puede antagonizar los efectos de la levodopa y los agonistas de la dopamina.
Interacciones farmacocinéticas
Carbamazepina
La carbamazepina es un inductor de CYP3A4; la administración de 200 mg dos veces al día durante 21 días resultó en una disminución de aproximadamente un 35 % en el AUC de ziprasidona. Este efecto puede ser mayor cuando se administran dosis más altas de carbamazepina.
ketoconazol
El ketoconazol, un potente inhibidor de CYP3A4, en una dosis de 400 mg una vez al día durante 5 días, aumentó el AUC y la Cmax de ziprasidona en aproximadamente un 35-40 %. Se esperaría que otros inhibidores de CYP3A4 tuvieran efectos similares.
cimetidina
La cimetidina a una dosis de 800 mg QD durante 2 días no afectó la farmacocinética de ziprasidona.
Neutralizador de acidez
La coadministración de 30 ml de Maalox® con ziprasidona no afectó la farmacocinética de ziprasidona.
Litio
Ziprasidona a una dosis de 40 mg dos veces al día administrada concomitantemente con litio a una dosis de 450 mg dos veces al día durante 7 días no afectó el nivel de equilibrio o la depuración renal de litio. La ziprasidona administrada junto con litio en un ensayo de mantenimiento de pacientes bipolares no afectó los niveles terapéuticos medios de litio.
Anticonceptivos orales
Los estudios in vivo no han revelado ningún efecto de ziprasidona sobre la farmacocinética de los componentes de estrógeno o progesterona. Ziprasidona a una dosis de 20 mg dos veces al día no afectó la farmacocinética de los anticonceptivos orales administrados concomitantemente, etinilestradiol (0,03 mg) y levonorgestrel (0,15 mg).
dextrometorfano
De acuerdo con los resultados in vitro, un estudio en voluntarios sanos normales mostró que la ziprasidona no alteró el metabolismo del dextrometorfano, un sustrato modelo de CYP2D6, a su principal metabolito, el dextrorfano. No hubo cambios estadísticamente significativos en la relación dextrometorfano/dextrorfano urinario.
Valproato
Es improbable una interacción farmacocinética de ziprasidona con valproato debido a la falta de vías metabólicas comunes para los dos fármacos. La ziprasidona administrada junto con el valproato en un ensayo de mantenimiento de pacientes bipolares no afectó los niveles terapéuticos medios de valproato.
Otra terapia farmacológica concomitante
El análisis farmacocinético poblacional de pacientes esquizofrénicos inscritos en ensayos clínicos controlados no ha revelado evidencia de ninguna interacción farmacocinética clínicamente significativa con benztropina, propranolol o lorazepam.
Interacción de alimentos
La biodisponibilidad absoluta de una dosis de 20 mg en condiciones de alimentación es de aproximadamente el 60 %. La absorción de ziprasidona aumenta hasta dos veces en presencia de alimentos [ver FARMACOLOGÍA CLÍNICA ].
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Aumento de la mortalidad en pacientes ancianos con psicosis relacionada con demencia
Los pacientes de edad avanzada con psicosis relacionada con la demencia tratados con medicamentos antipsicóticos tienen un mayor riesgo de muerte. Los análisis de 17 ensayos controlados con placebo (duración modal de 10 semanas), principalmente en pacientes que tomaban fármacos antipsicóticos atípicos, revelaron un riesgo de muerte en pacientes tratados con fármacos de entre 1,6 y 1,7 veces el riesgo de muerte en pacientes tratados con placebo. En el transcurso de un ensayo controlado típico de 10 semanas, la tasa de muerte en los pacientes tratados con medicamentos fue de alrededor del 4,5 %, en comparación con una tasa de alrededor del 2,6 % en el grupo de placebo.
Aunque las causas de muerte fueron variadas, la mayoría de las muertes parecían ser de naturaleza cardiovascular (p. ej., insuficiencia cardíaca, muerte súbita) o infecciosa (p. ej., neumonía). GEODON no está aprobado para el tratamiento de pacientes con psicosis relacionada con la demencia. [ver CUADRO DE ADVERTENCIA , Reacciones adversas cerebrovasculares, incluido el accidente cerebrovascular, en pacientes ancianos con psicosis relacionada con demencia ].
Reacciones adversas cerebrovasculares, incluido el accidente cerebrovascular, en pacientes ancianos con psicosis relacionada con demencia
En ensayos controlados con placebo en sujetos de edad avanzada con demencia, los pacientes asignados al azar a risperidona, aripiprazol y olanzapina tuvieron una mayor incidencia de accidente cerebrovascular y ataque isquémico transitorio, incluido el accidente cerebrovascular fatal. GEODON no está aprobado para el tratamiento de pacientes con psicosis relacionada con demencia [ver CUADRO DE ADVERTENCIA y Aumento de la mortalidad en pacientes ancianos con psicosis relacionada con demencia ].
Prolongación del intervalo QT y riesgo de muerte súbita
Se debe evitar el uso de ziprasidona en combinación con otros medicamentos que prolongan el intervalo QTc [ver CONTRAINDICACIONES y INTERACCIONES CON LA DROGAS ]. Además, los médicos deben estar atentos a la identificación de otros fármacos que se ha observado consistentemente que prolongan el intervalo QTc. Dichos medicamentos no deben prescribirse con ziprasidona. La ziprasidona también debe evitarse en pacientes con síndrome de QT largo congénito y en pacientes con antecedentes de arritmias cardíacas [ver CONTRAINDICACIONES ].
Se realizó un estudio en pacientes voluntarios que comparó directamente el efecto de prolongación de QT/QTc de ziprasidona oral con varios otros medicamentos efectivos en el tratamiento de la esquizofrenia. En la primera fase del ensayo, se obtuvieron ECG en el momento de máxima concentración plasmática cuando se administraba el fármaco solo. En la segunda fase del ensayo, se obtuvieron ECG en el momento de la concentración plasmática máxima mientras se administraba el fármaco junto con un inhibidor del metabolismo del fármaco CYP4503A4.
En la primera fase del estudio, se calculó el cambio medio en QTc desde el inicio para cada fármaco mediante una corrección basada en muestras que elimina el efecto de la frecuencia cardíaca en el intervalo QT. El aumento medio del QTc desde el inicio para ziprasidona osciló entre aproximadamente 9 y 14 mseg más que para cuatro de los fármacos de comparación (risperidona, olanzapina, quetiapina y haloperidol), pero fue aproximadamente 14 mseg menos que la prolongación observada para tioridazina.
En la segunda fase del estudio, el efecto de ziprasidona sobre la duración del intervalo QTc no aumentó con la presencia de un inhibidor metabólico (ketoconazol 200 mg dos veces al día).
En ensayos controlados con placebo, la ziprasidona oral aumentó el intervalo QTc en comparación con el placebo en aproximadamente 10 ms con la dosis diaria más alta recomendada de 160 mg. En ensayos clínicos con ziprasidona oral, los electrocardiogramas de 2/2988 (0,06 %) pacientes que recibieron GEODON 80 mg y 1/440 (0,23 %) pacientes que recibieron placebo revelaron intervalos QTc que superaban el umbral potencialmente clínicamente relevante de 500 mseg. En los pacientes tratados con ziprasidona, ningún caso sugirió un papel de ziprasidona. Un paciente tenía antecedentes de QTc prolongado y una medición de detección de 489 mseg; QTc fue de 503 mseg durante el tratamiento con ziprasidona. El otro paciente tenía un QTc de 391 mseg al final del tratamiento con ziprasidona y al cambiar a tioridazina experimentó mediciones de QTc de 518 y 593 mseg.
Algunos fármacos que prolongan el intervalo QT/QTc se han asociado con la aparición de torsade de pointes y con muerte súbita inexplicable. La relación entre la prolongación del intervalo QT y la torsade de pointes es más clara para aumentos más grandes (20 mseg y más), pero es posible que las prolongaciones más pequeñas de QT/QTc también puedan aumentar el riesgo o aumentarlo en individuos susceptibles. Aunque no se ha observado torsade de pointes en asociación con el uso de ziprasidona en estudios previos a la comercialización y la experiencia es demasiado limitada para descartar un mayor riesgo, ha habido informes posteriores a la comercialización raros (en presencia de múltiples factores de confusión) [ver REACCIONES ADVERSAS ].
Se realizó un estudio en pacientes voluntarios que evaluó el efecto de prolongación de QT/QTc de ziprasidona intramuscular, con haloperidol intramuscular como control. En el ensayo, los ECG se obtuvieron en el momento de la concentración plasmática máxima después de dos inyecciones de ziprasidona (20 mg y luego 30 mg) o haloperidol (7,5 mg y luego 10 mg) administradas con cuatro horas de diferencia. Tenga en cuenta que una dosis de 30 mg de ziprasidona intramuscular es un 50 % más alta que la dosis terapéutica recomendada. Se calculó el cambio medio en QTc desde el inicio para cada fármaco mediante una corrección basada en muestras que elimina el efecto de la frecuencia cardíaca en el intervalo QT. El aumento medio del QTc desde el valor inicial para ziprasidona fue de 4,6 ms después de la primera inyección y de 12,8 ms después de la segunda inyección. El aumento medio del QTc desde el inicio para haloperidol fue de 6,0 ms después de la primera inyección y de 14,7 ms después de la segunda inyección. En este estudio, ningún paciente tuvo un intervalo QTc superior a 500 mseg.
Al igual que con otros fármacos antipsicóticos y placebo, se han notificado muertes súbitas e inexplicables en pacientes que toman ziprasidona a las dosis recomendadas. La experiencia previa a la comercialización de ziprasidona no reveló un exceso de riesgo de mortalidad para ziprasidona en comparación con otros fármacos antipsicóticos o placebo, pero el grado de exposición fue limitado, especialmente para los fármacos utilizados como controles activos y placebo. No obstante, la mayor prolongación de la duración del intervalo QTc de ziprasidona en comparación con otros fármacos antipsicóticos plantea la posibilidad de que el riesgo de muerte súbita sea mayor para ziprasidona que para otros fármacos disponibles para tratar la esquizofrenia. Esta posibilidad debe tenerse en cuenta al decidir entre productos farmacéuticos alternativos [ver INDICACIONES ].
Ciertas circunstancias pueden aumentar el riesgo de ocurrencia de torsade de pointes y/o muerte súbita en asociación con el uso de medicamentos que prolongan el intervalo QTc, incluyendo (1) bradicardia; (2) hipopotasemia o hipomagnesemia; (3) uso concomitante de otros fármacos que prolonguen el intervalo QTc; y (4) presencia de prolongación congénita del intervalo QT.
Se recomienda que los pacientes que se consideren para el tratamiento con ziprasidona y que estén en riesgo de alteraciones electrolíticas significativas, hipopotasemia en particular, tengan mediciones basales de potasio y magnesio séricos. La hipopotasemia (y/o hipomagnesemia) puede aumentar el riesgo de prolongación del intervalo QT y arritmia. La hipopotasemia puede resultar de la terapia con diuréticos, diarrea y otras causas. Los pacientes con niveles bajos de potasio y/o magnesio en suero deben reponerse con esos electrolitos antes de continuar con el tratamiento. Es esencial controlar periódicamente los electrolitos séricos en pacientes a los que se les instaura un tratamiento con diuréticos durante el tratamiento con ziprasidona. Los intervalos QTc persistentemente prolongados también pueden aumentar el riesgo de una mayor prolongación y arritmia, pero no está claro que las medidas de ECG de rutina sean efectivas para detectar a estos pacientes. Más bien, la ziprasidona debe evitarse en pacientes con antecedentes de enfermedades cardiovasculares significativas, por ejemplo, prolongación del intervalo QT, infarto agudo de miocardio reciente, insuficiencia cardíaca no compensada o arritmia cardíaca. La ziprasidona debe interrumpirse en pacientes en los que se detecte que las mediciones de QTc persisten >500 mseg.
Para los pacientes que toman ziprasidona que experimentan síntomas que podrían indicar la aparición de torsade de pointes, por ejemplo, mareos, palpitaciones o síncope, el prescriptor debe iniciar una evaluación adicional, por ejemplo, la monitorización Holter puede ser útil.
Síndrome Neuroléptico Maligno (SNM)
Se ha notificado un complejo de síntomas potencialmente fatales, a veces denominado Síndrome Neuroléptico Maligno (SNM), en asociación con la administración de fármacos antipsicóticos. Las manifestaciones clínicas del SNM son hiperpirexia, rigidez muscular, estado mental alterado y evidencia de inestabilidad autonómica (pulso o presión arterial irregulares, taquicardia, diaforesis y arritmia cardíaca). Los signos adicionales pueden incluir creatinina fosfocinasa elevada, mioglobinuria (rabdomiólisis) e insuficiencia renal aguda.
La evaluación diagnóstica de los pacientes con este síndrome es complicada. Al llegar a un diagnóstico, es importante excluir los casos en los que la presentación clínica incluye tanto una enfermedad médica grave (p. ej., neumonía, infección sistémica, etc.) como signos y síntomas extrapiramidales (EPS) no tratados o tratados inadecuadamente. Otras consideraciones importantes en el diagnóstico diferencial incluyen toxicidad anticolinérgica central, golpe de calor, fiebre por fármacos y patología primaria del sistema nervioso central (SNC).
El manejo del SNM debe incluir: (1) suspensión inmediata de los medicamentos antipsicóticos y otros medicamentos que no sean esenciales para la terapia concurrente; (2) tratamiento sintomático intensivo y seguimiento médico; y (3) tratamiento de cualquier problema médico grave concomitante para el cual haya tratamientos específicos disponibles. No existe un acuerdo general sobre los regímenes de tratamiento farmacológico específicos para el SNM.
Si un paciente requiere tratamiento con medicamentos antipsicóticos después de la recuperación del SNM, se debe considerar cuidadosamente la posible reintroducción de la terapia con medicamentos. El paciente debe ser monitoreado cuidadosamente, ya que se han informado recurrencias de SNM.
Reacciones adversas cutáneas graves
Reacción a medicamentos con eosinofilia y síntomas sistémicos (DRESS)
Se ha informado una reacción al fármaco con eosinofilia y síntomas sistémicos (DRESS) con la exposición a ziprasidona. DRESS consiste en una combinación de tres o más de los siguientes: reacción cutánea (como erupción cutánea o dermatitis exfoliativa), eosinofilia, fiebre, linfadenopatía y una o más complicaciones sistémicas como hepatitis, nefritis, neumonitis, miocarditis y pericarditis. VESTIR es a veces fatal. Suspender ziprasidona si se sospecha de DRESS.
Otras reacciones adversas cutáneas graves
Se han informado otras reacciones adversas cutáneas graves, como el síndrome de Stevens-Johnson, con la exposición a ziprasidona. Las reacciones adversas cutáneas graves a veces son mortales. Suspender ziprasidona si se sospechan reacciones adversas cutáneas graves.
Discinesia tardía
Se puede desarrollar un síndrome de movimientos discinéticos involuntarios, potencialmente irreversibles, en pacientes sometidos a tratamiento con fármacos antipsicóticos. Aunque la prevalencia del síndrome parece ser mayor entre los ancianos, especialmente en las mujeres de edad avanzada, es imposible confiar en las estimaciones de prevalencia para predecir, al inicio del tratamiento antipsicótico, qué pacientes tienen probabilidades de desarrollar el síndrome. Se desconoce si los medicamentos antipsicóticos difieren en su potencial para causar discinesia tardía.
Se cree que el riesgo de desarrollar discinesia tardía y la probabilidad de que se vuelva irreversible aumentan a medida que aumenta la duración del tratamiento y la dosis total acumulada de fármacos antipsicóticos administrados al paciente. Sin embargo, el síndrome puede desarrollarse, aunque con mucha menos frecuencia, después de períodos de tratamiento relativamente breves con dosis bajas.
No existe un tratamiento conocido para los casos establecidos de discinesia tardía, aunque el síndrome puede remitir, parcial o completamente, si se retira el tratamiento antipsicótico. Sin embargo, el tratamiento antipsicótico en sí mismo puede suprimir (o suprimir parcialmente) los signos y síntomas del síndrome y, por lo tanto, posiblemente enmascare el proceso subyacente. Se desconoce el efecto que tiene la supresión sintomática sobre el curso a largo plazo del síndrome.
Teniendo en cuenta estas consideraciones, la ziprasidona se debe prescribir de la manera que sea más probable que minimice la aparición de discinesia tardía. El tratamiento antipsicótico crónico generalmente debe reservarse para pacientes que padecen una enfermedad crónica que (1) se sabe que responde a los medicamentos antipsicóticos y (2) para quienes tratamientos alternativos, igualmente efectivos, pero potencialmente menos dañinos, no están disponibles o no son apropiados. En pacientes que sí requieren tratamiento crónico, se debe buscar la menor dosis y la menor duración del tratamiento que produzca una respuesta clínica satisfactoria. La necesidad de continuar el tratamiento debe reevaluarse periódicamente.
Si aparecen signos y síntomas de discinesia tardía en un paciente que recibe ziprasidona, se debe considerar la interrupción del fármaco. Sin embargo, algunos pacientes pueden requerir tratamiento con ziprasidona a pesar de la presencia del síndrome.
Cambios metabólicos
Los fármacos antipsicóticos atípicos se han asociado con cambios metabólicos que pueden aumentar el riesgo cardiovascular/cerebrovascular. Estos cambios metabólicos incluyen hiperglucemia, dislipidemia y aumento de peso corporal. Si bien se ha demostrado que todos los medicamentos de la clase producen algunos cambios metabólicos, cada medicamento tiene su propio perfil de riesgo específico.
Hiperglucemia y Diabetes Mellitus
Se han notificado hiperglucemia y diabetes mellitus, en algunos casos extremas y asociadas a cetoacidosis o coma hiperosmolar o muerte, en pacientes tratados con antipsicóticos atípicos. Ha habido pocos informes de hiperglucemia o diabetes en pacientes tratados con GEODON. Aunque se han tratado menos pacientes con GEODON, no se sabe si esta experiencia más limitada es la única razón de la escasez de dichos informes. La evaluación de la relación entre el uso de antipsicóticos atípicos y las anomalías de la glucosa se complica por la posibilidad de un mayor riesgo de diabetes mellitus en pacientes con esquizofrenia y la creciente incidencia de diabetes mellitus en la población general. Dados estos factores de confusión, la relación entre el uso de antipsicóticos atípicos y las reacciones adversas relacionadas con la hiperglucemia no se comprende por completo. No se dispone de estimaciones precisas del riesgo de reacciones adversas relacionadas con la hiperglucemia en pacientes tratados con antipsicóticos atípicos.
Los pacientes con un diagnóstico establecido de diabetes mellitus que comienzan con antipsicóticos atípicos deben ser monitoreados regularmente para detectar un empeoramiento del control de la glucosa. Los pacientes con factores de riesgo de diabetes mellitus (p. ej., obesidad, antecedentes familiares de diabetes) que inician un tratamiento con antipsicóticos atípicos deben someterse a pruebas de glucosa en sangre en ayunas al comienzo del tratamiento y periódicamente durante el tratamiento. Cualquier paciente tratado con antipsicóticos atípicos debe ser monitoreado por síntomas de hiperglucemia que incluyen polidipsia, poliuria, polifagia y debilidad. Los pacientes que desarrollan síntomas de hiperglucemia durante el tratamiento con antipsicóticos atípicos deben someterse a pruebas de glucosa en sangre en ayunas. En algunos casos, la hiperglucemia se resolvió cuando se suspendió el antipsicótico atípico; sin embargo, algunos pacientes requirieron la continuación del tratamiento antidiabético a pesar de la interrupción del fármaco sospechoso.
Los datos agrupados de estudios a corto plazo controlados con placebo en esquizofrenia y trastorno bipolar se presentan en las tablas 1-4. Tenga en cuenta que para los estudios de dosis flexibles tanto en la esquizofrenia como en el trastorno bipolar, cada sujeto se categoriza como si hubiera recibido una dosis baja (20-40 mg BID) o alta (60-80 mg BID) según la dosis diaria modal del sujeto. En las tablas que muestran cambios categóricos, los porcentajes (columna %) se calculan como 100x(n/N).

En estudios a largo plazo (al menos 1 año), controlados con placebo, de dosis flexible en esquizofrenia, el cambio medio desde el inicio en glucosa aleatoria para ziprasidona 20-40 mg BID fue -3.4 mg/dL (N=122); para ziprasidona 60-80 mg BID fue +1.3 mg/dL (N=10); y para el placebo fue de +0,3 mg/dL (N=71).
dislipidemia
Se han observado alteraciones indeseables de los lípidos en pacientes tratados con antipsicóticos atípicos. Los datos agrupados de estudios a corto plazo controlados con placebo en esquizofrenia y trastorno bipolar se presentan en las tablas 5-8.
En estudios a largo plazo (al menos 1 año), controlados con placebo, de dosis flexible en esquizofrenia, el cambio medio desde el inicio en los triglicéridos aleatorios para ziprasidona 20-40 mg dos veces al día fue de +26,3 mg/dL (N=15); para ziprasidona 60-80 mg BID fue -39.3 mg/dL (N=10); y para el placebo fue de +12,9 mg/dL (N=9). En estudios a largo plazo (al menos 1 año), controlados con placebo, de dosis flexible en esquizofrenia, el cambio medio desde el inicio en el colesterol total aleatorio para ziprasidona 20-40 mg dos veces al día fue de +2,5 mg/dL (N=14); para ziprasidona 60-80 mg BID fue -19.7 mg/dL (N=10); y para el placebo fue de -28,0 mg/dL (N=9).
Aumento de peso
Se ha observado aumento de peso con el uso de antipsicóticos atípicos. Se recomienda controlar el peso. Los datos agrupados de estudios a corto plazo controlados con placebo en esquizofrenia y trastorno bipolar se presentan en las tablas 9-10.
En estudios a largo plazo (al menos 1 año), controlados con placebo, de dosis flexible en esquizofrenia, el cambio medio desde el peso inicial para ziprasidona 20-40 mg dos veces al día fue -2,3 kg (N=124); para ziprasidona 60-80 mg BID fue de +2,5 kg (N=10); y para el placebo fue de -2,9 kg (N=72). En los mismos estudios a largo plazo, la proporción de sujetos con un aumento de peso de ≥ 7 % desde el inicio para ziprasidona 20-40 mg dos veces al día fue del 5,6 % (N=124); para ziprasidona 60-80 mg BID fue 20,0% (N=10) y para placebo fue 5,6% (N=72). En un estudio a largo plazo (al menos 1 año), controlado con placebo, de dosis fija en esquizofrenia, el cambio medio desde el peso inicial para ziprasidona 20 mg dos veces al día fue -2,6 kg (N=72); para ziprasidona 40 mg BID fue -3,3 kg (N=69); para ziprasidona 80 mg dos veces al día fue -2,8 kg (N=70) y para placebo fue -3,8 kg (N=70). En el mismo estudio de esquizofrenia de dosis fija a largo plazo, la proporción de sujetos con un aumento de peso de ≥ 7 % desde el inicio para ziprasidona 20 mg dos veces al día fue del 5,6 % (N=72); para ziprasidona 40 mg BID fue 2,9% (N=69); para ziprasidona 80 mg dos veces al día fue del 5,7 % (N=70) y para el placebo fue del 2,9 % (N=70).
Esquizofrenia
Las proporciones de pacientes que cumplían con un criterio de aumento de peso de ≥ 7 % del peso corporal se compararon en un conjunto de cuatro ensayos clínicos de esquizofrenia controlados con placebo de 4 y 6 semanas de duración, lo que reveló una incidencia de aumento de peso estadísticamente significativamente mayor para ziprasidona (10 % ) en comparación con el placebo (4%). Se observó un aumento de peso medio de 0,5 kg en pacientes con ziprasidona en comparación con ningún cambio de peso medio en pacientes con placebo. En este conjunto de ensayos clínicos, el aumento de peso se informó como una reacción adversa en el 0,4 % y el 0,4 % de los pacientes con ziprasidona y placebo, respectivamente. Durante la terapia a largo plazo con ziprasidona, una categorización de los pacientes al inicio del estudio sobre la base del índice de masa corporal (IMC) reveló el mayor aumento de peso medio y la mayor incidencia de aumento de peso clínicamente significativo (> 7 % del peso corporal) en pacientes con bajo peso corporal. IMC (27). Hubo un aumento de peso medio de 1,4 kg para los pacientes con un IMC inicial "bajo", ningún cambio medio para los pacientes con un IMC "normal" y una pérdida de peso media de 1,3 kg para los pacientes que ingresaron al programa con un IMC "alto". IMC.
Trastorno bipolar
Durante un estudio de mantenimiento bipolar controlado con placebo de 6 meses en adultos con ziprasidona como complemento de litio o valproato, la incidencia de un aumento de peso clínicamente significativo (≥ 7 % del peso corporal) durante el período doble ciego fue del 5,6 % para ziprasidona y grupos de tratamiento con placebo que completaron los 6 meses de observación para la recaída. La interpretación de estos hallazgos debe tener en cuenta que solo los pacientes que toleraron adecuadamente la ziprasidona entraron en la fase doble ciego del estudio y hubo abandonos sustanciales durante la fase abierta.
Sarpullido
En ensayos previos a la comercialización con ziprasidona, alrededor del 5 % de los pacientes desarrollaron sarpullido y/o urticaria, con interrupción del tratamiento en alrededor de una sexta parte de estos casos. La aparición de erupción estuvo relacionada con la dosis de ziprasidona, aunque el hallazgo también podría explicarse por el mayor tiempo de exposición en los pacientes que recibieron dosis más altas. Varios pacientes con erupción cutánea tenían signos y síntomas de enfermedad sistémica asociada, por ejemplo, glóbulos blancos elevados. La mayoría de los pacientes mejoraron rápidamente con el tratamiento adyuvante con antihistamínicos o esteroides y/o al suspender ziprasidona, y se informó que todos los pacientes que experimentaron estas reacciones se recuperaron por completo. Si aparece una erupción para la cual no se puede identificar una etiología alternativa, se debe suspender la ziprasidona.
Hipotensión ortostática
La ziprasidona puede inducir hipotensión ortostática asociada con mareos, taquicardia y, en algunos pacientes, síncope, especialmente durante el período inicial de titulación de la dosis, lo que probablemente refleja sus propiedades antagonistas adrenérgicas α1. Se notificó síncope en el 0,6 % de los pacientes tratados con ziprasidona.
Ziprasidona debe usarse con especial precaución en pacientes con enfermedad cardiovascular conocida (antecedentes de infarto de miocardio o cardiopatía isquémica, insuficiencia cardíaca o anomalías de la conducción), enfermedad cerebrovascular o condiciones que predispongan a los pacientes a la hipotensión (deshidratación, hipovolemia y tratamiento con antihipertensivos). medicamentos).
Caídas
Los fármacos antipsicóticos (entre los que se incluye GEODON) pueden causar somnolencia, hipotensión postural e inestabilidad motora y sensorial, lo que podría provocar caídas y, en consecuencia, fracturas u otras lesiones. Para los pacientes con enfermedades, afecciones o medicamentos que podrían exacerbar estos efectos, complete las evaluaciones de riesgo de caídas al iniciar el tratamiento antipsicótico y de manera recurrente para los pacientes que reciben terapia antipsicótica a largo plazo.
Leucopenia, neutropenia y agranulocitosis
En ensayos clínicos y experiencia posterior a la comercialización, se han informado eventos de leucopenia/neutropenia temporalmente relacionados con agentes antipsicóticos. También se ha notificado agranulocitosis (incluidos casos mortales).
Los posibles factores de riesgo de leucopenia/neutropenia incluyen un recuento bajo de glóbulos blancos (WBC) preexistente y antecedentes de leucopenia/neutropenia inducida por fármacos. Los pacientes con un WBC bajo preexistente o antecedentes de leucopenia/neutropenia inducida por fármacos deben controlarse con frecuencia su hemograma completo (CBC) durante los primeros meses de terapia y deben suspender GEODON al primer signo de disminución de WBC en ausencia de de otros factores causales.
Los pacientes con neutropenia deben ser monitoreados cuidadosamente en busca de fiebre u otros síntomas o signos de infección y tratados de inmediato si se presentan tales síntomas o signos. Los pacientes con neutropenia grave (recuento absoluto de neutrófilos
convulsiones
Durante los ensayos clínicos, se produjeron convulsiones en el 0,4 % de los pacientes tratados con ziprasidona. Hubo factores de confusión que pueden haber contribuido a la aparición de convulsiones en muchos de estos casos. Al igual que con otros medicamentos antipsicóticos, la ziprasidona se debe usar con precaución en pacientes con antecedentes de convulsiones o con afecciones que potencialmente reduzcan el umbral convulsivo, por ejemplo, demencia de Alzheimer. Las condiciones que reducen el umbral de convulsiones pueden ser más frecuentes en una población de 65 años o más.
disfagia
La dismotilidad esofágica y la aspiración se han asociado con el uso de fármacos antipsicóticos. La neumonía por aspiración es una causa común de morbilidad y mortalidad en pacientes de edad avanzada, en particular aquellos con demencia de Alzheimer avanzada. La ziprasidona y otros fármacos antipsicóticos deben usarse con precaución en pacientes con riesgo de neumonía por aspiración [ver CUADRO DE ADVERTENCIA ].
Hiperprolactinemia
Al igual que con otros fármacos que antagonizan los receptores de dopamina D2, ziprasidona eleva los niveles de prolactina en humanos. También se observaron niveles elevados de prolactina en estudios con animales con este compuesto, y se asociaron con un aumento de la neoplasia de glándula mamaria en ratones; no se observó un efecto similar en ratas [ver Toxicología no clínica ]. Los experimentos de cultivo de tejidos indican que aproximadamente un tercio de los cánceres de mama humanos son dependientes de prolactina in vitro, un factor de importancia potencial si se contempla la prescripción de estos fármacos en un paciente con cáncer de mama detectado previamente. Ni los estudios clínicos ni los estudios epidemiológicos realizados hasta la fecha han demostrado una asociación entre la administración crónica de esta clase de fármacos y la tumorigénesis en humanos; la evidencia disponible se considera demasiado limitada para ser concluyente en este momento.
Aunque se han informado trastornos como galactorrea, amenorrea, ginecomastia e impotencia con compuestos que elevan la prolactina, se desconoce la importancia clínica de los niveles séricos elevados de prolactina para la mayoría de los pacientes. La hiperprolactinemia prolongada cuando se asocia con hipogonadismo puede conducir a una disminución de la densidad ósea.
Potencial de deterioro cognitivo y motor
La somnolencia fue una reacción adversa notificada con frecuencia en pacientes tratados con ziprasidona. En los ensayos controlados con placebo de 4 y 6 semanas, se notificó somnolencia en el 14 % de los pacientes que recibieron ziprasidona en comparación con el 7 % de los pacientes que recibieron placebo. La somnolencia condujo a la suspensión en el 0,3 % de los pacientes en los ensayos clínicos a corto plazo. Debido a que ziprasidona tiene el potencial de afectar el juicio, el pensamiento o las habilidades motoras, se debe advertir a los pacientes acerca de realizar actividades que requieran alerta mental, como operar un vehículo motorizado (incluidos automóviles) o manejar maquinaria peligrosa hasta que estén razonablemente seguros de que la terapia con ziprasidona no afectarlos negativamente.
priapismo
Se notificó un caso de priapismo en la base de datos previa a la comercialización. Si bien no se ha establecido la relación de la reacción con el uso de ziprasidona, se ha informado que otros medicamentos con efectos bloqueadores alfa-adrenérgicos inducen priapismo, y es posible que ziprasidona pueda compartir esta capacidad. El priapismo severo puede requerir una intervención quirúrgica.
Regulación de la temperatura corporal
Aunque no se informó con ziprasidona en ensayos previos a la comercialización, la interrupción de la capacidad del cuerpo para reducir la temperatura corporal central se ha atribuido a los agentes antipsicóticos. Se recomienda el cuidado adecuado cuando se prescriba ziprasidona a pacientes que experimentarán condiciones que pueden contribuir a una elevación de la temperatura corporal central, por ejemplo, ejercicio intenso, exposición a calor extremo, recibir medicación concomitante con actividad anticolinérgica o estar sujetos a deshidratación.
Suicidio
La posibilidad de un intento de suicidio es inherente a la enfermedad psicótica o al trastorno bipolar, y la terapia farmacológica debe acompañarse de una estrecha supervisión de los pacientes de alto riesgo. Las recetas de ziprasidona se deben escribir para la cantidad más pequeña de cápsulas compatible con un buen manejo del paciente para reducir el riesgo de sobredosis.
Pacientes con enfermedades concomitantes
La experiencia clínica con ziprasidona en pacientes con ciertas enfermedades sistémicas concomitantes es limitada [ver Uso en poblaciones específicas ].
La ziprasidona no ha sido evaluada ni utilizada de manera apreciable en pacientes con antecedentes recientes de infarto de miocardio o cardiopatía inestable. Los pacientes con estos diagnósticos fueron excluidos de los estudios clínicos previos a la comercialización. Debido al riesgo de prolongación del intervalo QTc e hipotensión ortostática con ziprasidona, se debe tener precaución en pacientes cardíacos. [ver Prolongación del intervalo QT y riesgo de muerte súbita, hipotensión ortostática ].
Pruebas de laboratorio
Los pacientes considerados para el tratamiento con ziprasidona que corren el riesgo de alteraciones electrolíticas significativas deben tener mediciones basales de potasio y magnesio séricos. Los niveles bajos de potasio y magnesio en suero deben reemplazarse antes de continuar con el tratamiento. Los pacientes que comienzan con diuréticos durante el tratamiento con ziprasidona necesitan un control periódico del potasio y el magnesio séricos. Se debe suspender la ziprasidona en pacientes en los que se detecte que las mediciones de QTc persisten >500 mseg [ver Prolongación del intervalo QT y riesgo de muerte súbita ].
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( INFORMACIÓN DEL PACIENTE ).
Información de administración para cápsulas
Aconseje a los pacientes que tomen las cápsulas de GEODON enteras. No abra, triture ni mastique las cápsulas. Indique a los pacientes que tomen las cápsulas de GEODON con alimentos para una absorción óptima. La absorción de ziprasidona aumenta hasta dos veces en presencia de alimentos [ver DOSIFICACIÓN Y ADMINISTRACIÓN , INTERACCIONES CON LA DROGAS , y FARMACOLOGÍA CLÍNICA ].
Prolongación QTc
Aconseje a los pacientes que informen a sus proveedores de atención médica sobre lo siguiente: Historial de prolongación del intervalo QT; infarto agudo de miocardio reciente; insuficiencia cardíaca no compensada; prescripción de otros fármacos que hayan demostrado prolongación del intervalo QT; riesgo de anomalías electrolíticas significativas; y antecedentes de arritmia cardiaca [ver CONTRAINDICACIONES y ADVERTENCIAS Y PRECAUCIONES ].
Indique a los pacientes que informen sobre la aparición de cualquier condición que los ponga en riesgo de alteraciones electrolíticas significativas, hipopotasemia en particular, que incluye, entre otros, el inicio de una terapia con diuréticos o diarrea prolongada. Además, indique a los pacientes que informen al médico sobre síntomas como mareos, palpitaciones o síncope [ver ADVERTENCIAS Y PRECAUCIONES ].
Reacciones adversas cutáneas graves
Indique a los pacientes que informen a su proveedor de atención médica lo antes posible sobre cualquier signo o síntoma que pueda estar asociado con la reacción al medicamento con eosinofilia y síntomas sistémicos (DRESS) o con reacciones adversas cutáneas graves, como el síndrome de Stevens-Johnson [ver ADVERTENCIAS Y PRECAUCIONES ].
El embarazo
Aconseje a las mujeres embarazadas que notifiquen a su proveedor de atención médica si quedan embarazadas o tienen la intención de quedar embarazadas durante el tratamiento con GEODON. Advierta a los pacientes que GEODON puede causar síntomas extrapiramidales y/o de abstinencia (agitación, hipertonía, hipotonía, temblores, somnolencia, dificultad respiratoria y trastornos de la alimentación) en un recién nacido. Informe a los pacientes que existe un registro de exposición durante el embarazo que monitorea los resultados del embarazo en mujeres expuestas a GEODON durante el embarazo [ver Uso en poblaciones específicas ].
Lactancia
Aconseje a las mujeres que amamantan que usan GEODON 20 mg que vigilen a los bebés por exceso de sedación, irritabilidad, mala alimentación y síntomas extrapiramidales (temblores y movimientos musculares anormales) y que busquen atención médica si notan estos signos [ver Uso en poblaciones específicas ].
Esterilidad
Advierta a las mujeres con potencial reproductivo que GEODON 80 mg puede afectar la fertilidad debido a un aumento en los niveles de prolactina sérica. Los efectos sobre la fertilidad son reversibles [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Carcinogénesis
Se realizaron estudios de carcinogenicidad de por vida con ziprasidona en ratas Long Evans y ratones CD-1. Se administró ziprasidona durante 24 meses en la dieta en dosis de 2, 6 o 12 mg/kg/día a ratas y 50, 100 o 200 mg/kg/día a ratones (0,1 a 0,6 y 1 a 5 veces la dosis humana máxima recomendada (MRHD) de 200 mg/día en base a mg/m2 de superficie corporal, respectivamente). En el estudio con ratas, no hubo evidencia de una mayor incidencia de tumores en comparación con los controles. En ratones machos, no hubo aumento en la incidencia de tumores en relación con los controles. En ratones hembra, hubo aumentos relacionados con la dosis en las incidencias de adenoma y carcinoma de la glándula pituitaria y adenocarcinoma de la glándula mamaria en todas las dosis probadas (50 a 200 mg/kg/día o 1 a 5 veces la MRHD basada en mg/m2 de concentración corporal). área de superficie). Se han observado cambios proliferativos en las glándulas pituitaria y mamaria de roedores después de la administración crónica de otros agentes antipsicóticos y se considera que están mediados por la prolactina. Se observaron aumentos en la prolactina sérica en un estudio dietético de 1 mes en ratones hembras, pero no machos, a 100 y 200 mg/kg/día (o 2,5 y 5 veces la MRHD basada en mg/m2 de superficie corporal). Ziprasidona no tuvo efecto sobre la prolactina sérica en ratas en un estudio dietético de 5 semanas a las dosis que se usaron en el estudio de carcinogenicidad. Se desconoce la relevancia para el riesgo humano de los hallazgos de tumores endocrinos mediados por prolactina en roedores [ver ADVERTENCIAS Y PRECAUCIONES ].
mutagénesis
La ziprasidona se probó en el ensayo de mutación bacteriana de Ames, el ensayo de linfoma de ratón con mutación genética de células de mamífero in vitro, el ensayo de aberración cromosómica in vitro en linfocitos humanos y el ensayo de aberración cromosómica in vivo en médula ósea de ratón. Hubo una respuesta mutagénica reproducible en el ensayo de Ames en una cepa de S. typhimurium en ausencia de activación metabólica. Se obtuvieron resultados positivos tanto en el ensayo de mutación genética de células de mamífero in vitro como en el ensayo de aberración cromosómica in vitro en linfocitos humanos.
Deterioro de la fertilidad
Se demostró que ziprasidona aumenta el tiempo hasta la cópula en ratas Sprague-Dawley en dos estudios de fertilidad y desarrollo embrionario temprano en dosis de 10 a 160 mg/kg/día (0,5 a 8 veces la MRHD de 200 mg/día en base a mg/m2 de cuerpo). área de superficie). La tasa de fertilidad se redujo a 160 mg/kg/día (8 veces la MRHD basada en mg/m2 de superficie corporal). No hubo efecto sobre la fertilidad con 40 mg/kg/día (2 veces la MRHD basada en mg/m2 de área de superficie corporal). El efecto sobre la fertilidad pareció estar en la hembra, ya que la fertilidad no se vio afectada cuando los machos que recibieron 160 mg/kg/día (8 veces la MRHD basada en mg/m2 de superficie corporal) se aparearon con hembras no tratadas.
Uso en poblaciones específicas
El embarazo
Registro de exposición durante el embarazo
Existe un registro de exposición durante el embarazo que monitorea los resultados del embarazo en mujeres expuestas a antipsicóticos atípicos, incluido GEODON 40 mg, durante el embarazo. Se alienta a los proveedores de atención médica a registrar pacientes comunicándose con el Registro Nacional de Embarazo para Antipsicóticos Atípicos al 1-866-961-2388 o en línea en http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/.
Resumen de riesgos
Los recién nacidos expuestos a fármacos antipsicóticos, incluido GEODON, durante el tercer trimestre corren el riesgo de presentar síntomas extrapiramidales y/o de abstinencia después del parto (ver Consideraciones clínicas ). Los datos generales disponibles de estudios epidemiológicos publicados de mujeres embarazadas expuestas a ziprasidona no han establecido un riesgo asociado con el fármaco de defectos congénitos importantes, aborto espontáneo o resultados maternos o fetales adversos (ver Datos ). Existen riesgos para la madre asociados con la esquizofrenia o el trastorno bipolar I no tratados y con la exposición a antipsicóticos, incluido GEODON, durante el embarazo (ver Consideraciones clínicas ).
En estudios con animales, la administración de ziprasidona a ratas y conejas preñadas durante la organogénesis causó toxicidad en el desarrollo a dosis similares a las dosis recomendadas para humanos y fue teratogénica en conejos a 3 veces la dosis máxima recomendada para humanos (MRHD). Las ratas expuestas a ziprasidona durante la gestación y la lactancia mostraron un aumento de la mortalidad perinatal de las crías y un retraso en el desarrollo neuroconductual y funcional de las crías a dosis menores o similares a las dosis terapéuticas en humanos (ver Datos ).
Se desconoce el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo para las poblaciones indicadas. Todos los embarazos tienen un riesgo de fondo de defecto congénito, pérdida u otros resultados adversos. En la población general de los EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 al 4 % y del 15 al 20 %, respectivamente.
Consideraciones clínicas
Riesgo materno y/o embrionario/fetal asociado a la enfermedad
Existe un riesgo para la madre debido a la esquizofrenia o al trastorno bipolar I no tratados, incluido un mayor riesgo de recaída, hospitalización y suicidio. La esquizofrenia y el trastorno bipolar I se asocian con mayores resultados perinatales adversos, incluido el parto prematuro. No se sabe si esto es un resultado directo de la enfermedad o de otros factores comórbidos.
Reacciones adversas fetales/neonatales
Se han informado síntomas extrapiramidales y/o de abstinencia, que incluyen agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria y trastornos de la alimentación en recién nacidos que estuvieron expuestos a medicamentos antipsicóticos, incluido GEODON, durante el tercer trimestre del embarazo. Estos síntomas han variado en severidad. Supervise a los recién nacidos para detectar síntomas extrapiramidales y/o de abstinencia y maneje los síntomas adecuadamente. Algunos neonatos se recuperaron en horas o días sin tratamiento específico; otros requirieron hospitalización prolongada.
Datos
Datos humanos
Los datos publicados de estudios observacionales, registros de nacimiento e informes de casos sobre el uso de antipsicóticos atípicos durante el embarazo no informan una asociación clara con los antipsicóticos y defectos congénitos importantes. Un estudio de cohorte retrospectivo de una base de datos de Medicaid de 9258 mujeres expuestas a antipsicóticos durante el embarazo no indicó un mayor riesgo general de defectos congénitos importantes.
Datos de animales
Cuando se administró ziprasidona a conejas preñadas durante el período de organogénesis, se observó una mayor incidencia de anomalías estructurales fetales (defectos del tabique ventricular y otras malformaciones cardiovasculares y alteraciones renales) a una dosis de 30 mg/kg/día (3 veces la MRHD de 200 mg/día en base a mg/m2 de superficie corporal). No hubo evidencia que sugiriera que estos efectos en el desarrollo fueran secundarios a la toxicidad materna. La dosis sin efecto en el desarrollo fue de 10 mg/kg/día (equivalente a la MRHD basada en mg/m2 de área de superficie corporal). En ratas, se observó toxicidad embriofetal (pesos fetales reducidos, osificación esquelética retardada) luego de la administración de 10 a 160 mg/kg/día (0.5 a 8 veces la MRHD basada en mg/m2 de área de superficie corporal) durante la organogénesis o durante la gestación, pero no hubo evidencia de teratogenicidad. Las dosis de 40 y 160 mg/kg/día (2 y 8 veces la MRHD en base a mg/m2 de superficie corporal) se asociaron con toxicidad materna. La dosis sin efecto en el desarrollo es de 5 mg/kg/día (0,2 veces la MRHD basada en mg/m2 de superficie corporal).
Hubo un aumento en el número de crías que nacieron muertas y una disminución en la supervivencia posnatal durante los primeros 4 días de lactancia entre las crías de ratas hembra tratadas durante la gestación y la lactancia con dosis de 10 mg/kg/día (0,5 veces la MRHD basada en en mg/m2 de superficie corporal) o mayor. Se observaron retrasos en el desarrollo de la descendencia (disminución del peso de las crías) y deterioro funcional neuroconductual (corrección del aire que abre los ojos) con dosis de 5 mg/kg/día (0,2 veces la MRHD basada en mg/m2 de área de superficie corporal) o mayores. No se estableció un nivel sin efecto para estos efectos.
Lactancia
Resumen de riesgos
Los datos limitados de un informe de caso publicado indican la presencia de ziprasidona en la leche humana. Aunque no hay informes de efectos adversos en un lactante expuesto a ziprasidona a través de la leche materna, existen informes de exceso de sedación, irritabilidad, mala alimentación y síntomas extrapiramidales (temblores y movimientos musculares anormales) en lactantes expuestos a otros antipsicóticos atípicos a través de la leche materna. leche (ver Consideraciones clínicas ). No hay información sobre los efectos de ziprasidona en la producción de leche. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de GEODON de la madre y cualquier efecto adverso potencial en el niño amamantado debido a GEODON 20 mg o de la afección subyacente de la madre.
Consideraciones clínicas
Los bebés expuestos a GEODON deben ser monitoreados por exceso de sedación, irritabilidad, mala alimentación y síntomas extrapiramidales (temblores y movimientos musculares anormales).
Hembras y machos con potencial reproductivo
Esterilidad
Hembras
Según la acción farmacológica de ziprasidona (antagonismo D2), el tratamiento con GEODON 40 mg puede provocar un aumento de los niveles de prolactina sérica, lo que puede conducir a una reducción reversible de la fertilidad en mujeres con potencial reproductivo [ver ADVERTENCIAS Y PRECAUCIONES y Toxicología no clínica ].
Uso pediátrico
No se ha establecido la seguridad y eficacia de ziprasidona en pacientes pediátricos.
Uso geriátrico
Del número total de sujetos en estudios clínicos de ziprasidona, el 2.4 por ciento tenía 65 años o más. No se observaron diferencias generales en la seguridad o la eficacia entre estos sujetos y los sujetos más jóvenes, y otra experiencia clínica notificada no ha identificado diferencias en las respuestas entre los ancianos y los pacientes más jóvenes, pero no se puede descartar una mayor sensibilidad de algunos individuos mayores. No obstante, la presencia de múltiples factores que podrían aumentar la respuesta farmacodinámica a ziprasidona, o causar una tolerancia u ortostasis más deficiente, debe llevar a considerar una dosis inicial más baja, una titulación más lenta y un control cuidadoso durante el período de dosificación inicial para algunos pacientes de edad avanzada.
Ziprasidona intramuscular no se ha evaluado sistemáticamente en pacientes de edad avanzada (65 años y mayores).
Insuficiencia renal
Debido a que ziprasidona se metaboliza altamente, con menos del 1% del fármaco excretado sin cambios, es poco probable que la insuficiencia renal por sí sola tenga un impacto importante en la farmacocinética de ziprasidona. La farmacocinética de ziprasidona después de 8 días de una dosis de 20 mg dos veces al día fue similar entre sujetos con diversos grados de insuficiencia renal (n=27) y sujetos con función renal normal, lo que indica que no es necesario ajustar la dosis según el grado de insuficiencia renal. . Ziprasidona no se elimina por hemodiálisis.
La ziprasidona intramuscular no se ha evaluado sistemáticamente en pacientes de edad avanzada o en pacientes con insuficiencia hepática o renal. Dado que el excipiente de ciclodextrina se elimina por filtración renal, ziprasidona intramuscular debe administrarse con precaución a pacientes con función renal alterada [ver FARMACOLOGÍA CLÍNICA ].
Deterioro hepático
Dado que ziprasidona es eliminada sustancialmente por el hígado, se esperaría que la presencia de insuficiencia hepática aumente el AUC de ziprasidona; un estudio de dosis múltiples de 20 mg dos veces al día durante 5 días en sujetos (n=13) con cirrosis clínicamente significativa (Childs-Pugh Clase A y B) reveló un aumento en el AUC 0-12 del 13% y 34% en Childs-Pugh. Clase A y B de Pugh, respectivamente, en comparación con un grupo de control emparejado (n = 14). Se observó una vida media de 7,1 horas en sujetos con cirrosis en comparación con 4,8 horas en el grupo de control.
Efectos de edad y género
En un estudio de dosis múltiples (8 días de tratamiento) que involucró a 32 sujetos, no hubo diferencias en la farmacocinética de ziprasidona entre hombres y mujeres o entre sujetos de edad avanzada (>65 años) y jóvenes (18 a 45 años). Además, la evaluación farmacocinética poblacional de pacientes en ensayos controlados no reveló evidencia de diferencias clínicamente significativas relacionadas con la edad o el sexo en la farmacocinética de ziprasidona. Por lo tanto, no se recomiendan modificaciones de dosis por edad o género.
De fumar
Basado en estudios in vitro que utilizan enzimas hepáticas humanas, ziprasidona no es un sustrato para CYP1A2; por lo tanto, fumar no debería afectar la farmacocinética de ziprasidona. De acuerdo con estos resultados in vitro, la evaluación farmacocinética de la población no ha revelado diferencias farmacocinéticas significativas entre fumadores y no fumadores.
SOBREDOSIS
Experiencia humana
En ensayos previos a la comercialización que involucraron a más de 5400 pacientes y/o sujetos normales, se documentó una sobredosis accidental o intencional de ziprasidona oral en 10 pacientes. Todos estos pacientes sobrevivieron sin secuelas. En el paciente que tomó la mayor cantidad confirmada, 3240 mg, los únicos síntomas informados fueron sedación mínima, dificultad para hablar e hipertensión transitoria (200/95).
Las reacciones adversas informadas con sobredosis de ziprasidona incluyeron síntomas extrapiramidales, somnolencia, temblor y ansiedad. [ver REACCIONES ADVERSAS ]
Manejo de sobredosis
En caso de sobredosis aguda, establezca y mantenga una vía aérea y asegure una oxigenación y ventilación adecuadas. Debe establecerse un acceso intravenoso y debe considerarse el lavado gástrico (después de la intubación, si el paciente está inconsciente) y la administración de carbón activado junto con un laxante. La posibilidad de obnubilación, convulsiones o reacción distónica de la cabeza y el cuello después de una sobredosis puede crear un riesgo de aspiración con emesis inducida.
La monitorización cardiovascular debe iniciarse inmediatamente y debe incluir monitorización electrocardiográfica continua para detectar posibles arritmias. Si se administra una terapia antiarrítmica, la disopiramida, la procainamida y la quinidina conllevan un riesgo teórico de efectos aditivos de prolongación del intervalo QT que podrían ser aditivos a los de la ziprasidona.
La hipotensión y el colapso circulatorio deben tratarse con medidas apropiadas, como fluidos intravenosos. Si se utilizan agentes simpaticomiméticos para soporte vascular, no se debe utilizar epinefrina ni dopamina, ya que la estimulación beta combinada con el antagonismo α1 asociado con ziprasidona puede empeorar la hipotensión. De manera similar, es razonable esperar que las propiedades de bloqueo alfa-adrenérgico del bretilio se adicionen a las de ziprasidona, lo que resulta en una hipotensión problemática.
En casos de síntomas extrapiramidales severos, se debe administrar medicación anticolinérgica. No existe un antídoto específico para ziprasidona y no es dializable. Debe considerarse la posibilidad de implicación de múltiples fármacos. La supervisión y el control médico estrictos deben continuar hasta que el paciente se recupere.
CONTRAINDICACIONES
Prolongación QT
Debido a la prolongación del intervalo QT relacionada con la dosis de ziprasidona y la asociación conocida de arritmias fatales con la prolongación del intervalo QT por algunos otros fármacos, ziprasidona está contraindicada:
- en pacientes con antecedentes conocidos de prolongación del intervalo QT (incluido el síndrome de QT prolongado congénito)
- en pacientes con infarto agudo de miocardio reciente
- en pacientes con insuficiencia cardiaca no compensada
No se han realizado estudios farmacocinéticos/farmacodinámicos entre ziprasidona y otros fármacos que prolongan el intervalo QT. No se puede excluir un efecto aditivo de ziprasidona y otros medicamentos que prolongan el intervalo QT. Por lo tanto, ziprasidona no debe administrarse con:
- dofetilida, sotalol, quinidina, otros antiarrítmicos de clase Ia y III, mesoridazina, tioridazina, clorpromazina, droperidol, pimozida, esparfloxacino, gatifloxacino, moxifloxacino, halofantrina, mefloquina, pentamidina, trióxido de arsénico, acetato de levometadilo, mesilato de dolasetrón, probucol o tacrolimus.
- otros medicamentos que han demostrado la prolongación del intervalo QT como uno de sus efectos farmacodinámicos y tienen este efecto descrito en la información de prescripción completa como una contraindicación o una advertencia en recuadro o en negrita [ver ADVERTENCIAS Y PRECAUCIONES ].
Hipersensibilidad
La ziprasidona está contraindicada en personas con hipersensibilidad conocida al producto.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
El mecanismo de acción de ziprasidona en el tratamiento de las indicaciones enumeradas podría estar mediado por una combinación de antagonismo de dopamina tipo 2 (D2) y serotonina tipo 2 (5HT2).
Farmacodinámica
La ziprasidona se une con una afinidad relativamente alta a los receptores de dopamina D2 y D3, serotonina 5HT2A, 5HT2C, 5HT1A, 5HT1D y α1-adrenérgicos (Ki s de 4,8, 7,2, 0,4, 1,3, 3,4, 2 y 10 nM, respectivamente). y con moderada afinidad por el receptor de histamina H1 (Ki=47 nM). La ziprasidona es un antagonista de los receptores D2, 5HT2A y 5HT1D y un agonista del receptor 5HT1A. La ziprasidona inhibió la recaptación sináptica de serotonina y norepinefrina. No se mostró una afinidad apreciable por otros sitios de unión/receptor probados, incluido el receptor muscarínico colinérgico (IC50 >1 μM).
Farmacocinética
Farmacocinética oral
La actividad de la ziprasidona se debe principalmente al fármaco original. La farmacocinética de dosis múltiples de ziprasidona es proporcional a la dosis dentro del rango de dosis clínica propuesto, y la acumulación de ziprasidona es predecible con dosis múltiples. La eliminación de ziprasidona se realiza principalmente a través del metabolismo hepático con una vida media terminal media de aproximadamente 7 horas dentro del rango de dosis clínica propuesto. Las concentraciones de estado estacionario se alcanzan dentro de uno a tres días de la dosificación. El aclaramiento sistémico aparente medio es de 7,5 ml/min/kg. Es improbable que ziprasidona interfiera con el metabolismo de fármacos metabolizados por las enzimas del citocromo P450.
Absorción
Ziprasidona se absorbe bien después de la administración oral, alcanzando concentraciones plasmáticas máximas en 6 a 8 horas. La biodisponibilidad absoluta de una dosis de 20 mg en condiciones de alimentación es de aproximadamente el 60 %. La absorción de ziprasidona aumenta hasta dos veces en presencia de alimentos.
Distribución
Ziprasidona tiene un volumen de distribución aparente medio de 1,5 l/kg. Se une en más del 99% a las proteínas plasmáticas, principalmente a la albúmina ya la glucoproteína ácida α1. La unión a proteínas plasmáticas in vitro de ziprasidona no se vio alterada por warfarina o propranolol, dos fármacos altamente unidos a proteínas, ni ziprasidona alteró la unión de estos fármacos en el plasma humano. Por lo tanto, el potencial de interacciones farmacológicas con ziprasidona debido al desplazamiento es mínimo.
Metabolismo y Eliminación
La ziprasidona se metaboliza ampliamente después de la administración oral y solo una pequeña cantidad se excreta en la orina (
Farmacocinética intramuscular
Biodisponibilidad Sistémica
La biodisponibilidad de ziprasidona administrada por vía intramuscular es del 100%. Después de la administración intramuscular de dosis únicas, las concentraciones séricas máximas generalmente ocurren aproximadamente 60 minutos después de la dosis o antes y la vida media promedio (T½) varía de dos a cinco horas. La exposición aumenta de manera relacionada con la dosis y después de tres días de administración intramuscular, se observa poca acumulación.
Metabolismo y Eliminación
Aunque el metabolismo y la eliminación de ziprasidona IM no han sido evaluados sistemáticamente, no se espera que la vía de administración intramuscular altere las rutas metabólicas.
Estudios clínicos
Esquizofrenia
La eficacia de ziprasidona oral en el tratamiento de la esquizofrenia se evaluó en 5 estudios controlados con placebo, 4 ensayos a corto plazo (4 y 6 semanas) y un ensayo de mantenimiento. Todos los ensayos se realizaron en pacientes adultos hospitalizados, la mayoría de los cuales cumplían los criterios del DSM III-R para la esquizofrenia. Cada estudio incluyó de 2 a 3 dosis fijas de ziprasidona además de placebo. Cuatro de los 5 ensayos pudieron distinguir la ziprasidona del placebo; un estudio a corto plazo no lo hizo. Aunque se incluyó un brazo de haloperidol de dosis fija única como tratamiento comparativo en uno de los tres ensayos a corto plazo, este único estudio fue inadecuado para proporcionar una comparación confiable y válida de ziprasidona y haloperidol.
Se utilizaron varios instrumentos para evaluar los signos y síntomas psiquiátricos en estos estudios. La Escala Breve de Calificación Psiquiátrica (BPRS) y la Escala de Síndrome Positivo y Negativo (PANSS) son inventarios de múltiples ítems de psicopatología general que generalmente se usan para evaluar los efectos del tratamiento farmacológico en la esquizofrenia. El grupo de psicosis BPRS (desorganización conceptual, comportamiento alucinatorio, suspicacia y contenido de pensamiento inusual) se considera un subconjunto particularmente útil para evaluar a los pacientes esquizofrénicos activamente psicóticos. Una segunda evaluación ampliamente utilizada, la Impresión Clínica Global (CGI), refleja la impresión de un observador experto, totalmente familiarizado con las manifestaciones de la esquizofrenia, sobre el estado clínico general del paciente. Además, se empleó la Escala para evaluar los síntomas negativos (SANS) para evaluar los síntomas negativos en un ensayo.
Siguen los resultados de los ensayos de ziprasidona oral en la esquizofrenia
- En un ensayo controlado con placebo de 4 semanas (n=139) que comparó 2 dosis fijas de ziprasidona (20 y 60 mg dos veces al día) con placebo, solo la dosis de 60 mg fue superior al placebo en la puntuación total de BPRS y la gravedad de CGI puntaje. Este grupo de dosis más alta no fue superior al placebo en el grupo de psicosis BPRS o en el SANS.
- En un ensayo controlado con placebo de 6 semanas (n=302) que comparó 2 dosis fijas de ziprasidona (40 y 80 mg dos veces al día) con placebo, ambos grupos de dosis fueron superiores al placebo en la puntuación total de la BPRS, el grupo de psicosis de la BPRS, la puntuación de gravedad CGI y las puntuaciones de subescala total y negativa de PANSS. Aunque 80 mg dos veces al día tuvieron un efecto numéricamente mayor que 40 mg dos veces al día, la diferencia no fue estadísticamente significativa.
- En un ensayo controlado con placebo de 6 semanas (n=419) que comparó 3 dosis fijas de ziprasidona (20, 60 y 100 mg dos veces al día) con placebo, los tres grupos de dosis fueron superiores al placebo en la puntuación total de la PANSS, la Puntuación total de la BPRS, el grupo de psicosis de la BPRS y la puntuación de gravedad CGI. Solo el grupo de dosis de 100 mg dos veces al día fue superior al placebo en la puntuación de la subescala negativa de la PANSS. No hubo evidencia clara de una relación dosis-respuesta dentro del rango de dosis de 20 mg dos veces al día a 100 mg dos veces al día.
- En un ensayo controlado con placebo de 4 semanas (n=200) que comparó 3 dosis fijas de ziprasidona (5, 20 y 40 mg dos veces al día), ninguno de los grupos de dosis fue estadísticamente superior al placebo en ningún resultado de interés.
- Se realizó un estudio en pacientes esquizofrénicos estables crónicos o subcrónicos (CGI-S ≤5 al inicio) hospitalizados (n = 294) que habían estado hospitalizados durante no menos de dos meses. Después de un período de preinclusión simple ciego con placebo de 3 días, los sujetos se asignaron al azar a una de las 3 dosis fijas de ziprasidona (20 mg, 40 mg u 80 mg dos veces al día) o placebo y se observaron las recaídas. Los pacientes fueron observados por "recaída psicótica inminente", definida como una puntuación de mejora CGI de ≤6 (mucho peor o mucho peor) y/o puntuaciones ≤6 (moderadamente grave) en los ítems de hostilidad o falta de cooperación de la PANSS en dos días consecutivos . Ziprasidona fue significativamente superior al placebo en el tiempo hasta la recaída, sin diferencias significativas entre los diferentes grupos de dosis. No hubo datos suficientes para examinar los subconjuntos de población en función de la edad y la raza. El examen de los subconjuntos de población en función del género no reveló ninguna capacidad de respuesta diferencial.
Trastorno bipolar I (episodios maníacos o mixtos agudos y tratamiento de mantenimiento como complemento del litio o el valproato)
Episodios mixtos y maníacos agudos asociados con el trastorno bipolar I
La eficacia de ziprasidona se estableció en 2 estudios de monoterapia de 3 semanas, doble ciego, controlados con placebo en pacientes que cumplían los criterios del DSM-IV para el trastorno bipolar I, episodio maníaco o mixto con o sin características psicóticas. Los principales instrumentos de calificación utilizados para evaluar los síntomas maníacos en estos ensayos fueron: (1) la escala de calificación de la manía (MRS), que se deriva del Schedule for Affective Disorders and Schizophrenia-Change Version (SADS-CB) con elementos agrupados como el síndrome maníaco subescala (estado de ánimo elevado, menos necesidad de dormir, energía excesiva, actividad excesiva, grandiosidad), la subescala de Comportamiento e Ideación (irritabilidad, hiperactividad motora, habla acelerada, pensamientos acelerados, juicio pobre) y visión alterada; y (2) la Escala de Impresión Clínica Global-Gravedad de la Enfermedad (CGI-S), que se utilizó para evaluar la importancia clínica de la respuesta al tratamiento.
Los resultados de los ensayos de ziprasidona oral en adultos con trastorno bipolar I, episodio maníaco/mixto son los siguientes: en un ensayo controlado con placebo de 3 semanas (n=210), la dosis de ziprasidona fue de 40 mg dos veces al día el día 1 y de 80 mg dos veces al día. diariamente en el Día 2. Se permitió la titulación dentro del rango de 40-80 mg dos veces al día (en incrementos de 20 mg dos veces al día) durante la duración del estudio. Ziprasidona fue significativamente más eficaz que el placebo en la reducción de la puntuación total MRS y la puntuación CGI-S. La dosis diaria media de ziprasidona en este estudio fue de 132 mg. En un segundo ensayo controlado con placebo de 3 semanas (n=205), la dosis de ziprasidona fue de 40 mg dos veces al día el Día 1. Se permitió la titulación dentro del rango de 40-80 mg dos veces al día (en incrementos de 20 mg dos veces al día). durante la duración del estudio (a partir del día 2). Ziprasidona fue significativamente más eficaz que el placebo en la reducción de la puntuación total MRS y la puntuación CGI-S. La dosis diaria media de ziprasidona en este estudio fue de 112 mg.
Terapia de mantenimiento
La eficacia de ziprasidona como terapia adyuvante al litio o al valproato en el tratamiento de mantenimiento del trastorno bipolar I se estableció en un ensayo controlado con placebo en pacientes que cumplían con los criterios del DSM-IV para el trastorno bipolar I. El ensayo incluyó pacientes cuyo episodio más reciente fue maníaco o mixto, con o sin características psicóticas. En la fase abierta, los pacientes debían estabilizarse con ziprasidona más litio o ácido valproico durante al menos 8 semanas para ser aleatorizados. En la fase aleatorizada doble ciego, los pacientes continuaron el tratamiento con litio o ácido valproico y se aleatorizaron para recibir ziprasidona (administrada dos veces al día con un total de 80 mg a 160 mg por día) o placebo. Generalmente, en la fase de mantenimiento, los pacientes continuaron con la misma dosis con la que se estabilizaron durante la fase de estabilización. El criterio principal de valoración en este estudio fue el tiempo hasta la recurrencia de un episodio del estado de ánimo (episodio maníaco, mixto o depresivo) que requería intervención, que se definió como cualquiera de los siguientes: interrupción debido a un episodio del estado de ánimo, intervención clínica para un episodio del estado de ánimo (p. inicio de medicación u hospitalización), o puntuación de la escala de calificación de manía ≥ 18 o una puntuación MADRS ≥ 18 (en 2 evaluaciones consecutivas con no más de 10 días de diferencia). Un total de 584 sujetos fueron tratados en el período de estabilización de etiqueta abierta. En el período de aleatorización doble ciego, 127 sujetos fueron tratados con ziprasidona y 112 sujetos fueron tratados con placebo. La ziprasidona fue superior al placebo al aumentar el tiempo hasta la recurrencia de un episodio del estado de ánimo. Los tipos de eventos de recaída observados incluyeron episodios depresivos, maníacos y mixtos. Los episodios depresivos, maníacos y mixtos representaron el 53 %, 34 % y 13 %, respectivamente, del número total de eventos de recaída en el estudio.
Tratamiento agudo de la agitación en la esquizofrenia
La eficacia de la ziprasidona intramuscular en el tratamiento de pacientes esquizofrénicos agitados se estableció en dos ensayos doble ciego a corto plazo de sujetos esquizofrénicos que los investigadores consideraron que estaban "agudamente agitados" y que necesitaban medicación antipsicótica IM. Además, los pacientes debían tener una puntuación de 3 o más en al menos 3 de los siguientes ítems de la PANSS: ansiedad, tensión, hostilidad y excitación. La eficacia se evaluó mediante el análisis del área bajo la curva (AUC) de la escala de calificación de actividad conductual (BARS) y la calificación de gravedad de la impresión clínica global (CGI). El BARS es una escala de siete puntos con puntajes que van desde 1 (difícil o incapaz de despertarse) a 7 (violento, requiere moderación). Pacientes' las puntuaciones en la BARS al inicio del estudio fueron en su mayoría 5 (signos de actividad manifiesta [física o verbal], se calma con instrucciones) y, según lo determinado por los investigadores, exhibía un grado de agitación que justificaba la terapia intramuscular. Hubo pocos pacientes con una calificación superior a 5 en la BARS, ya que los pacientes más severamente agitados generalmente no pudieron dar su consentimiento informado para participar en ensayos clínicos previos a la comercialización.
Ambos estudios compararon dosis más altas de ziprasidona intramuscular con una dosis de control de 2 mg. En un estudio, la dosis más alta fue de 20 mg, que podía administrarse hasta 4 veces en las 24 horas del estudio, con intervalos entre dosis de no menos de 4 horas. En el otro estudio, la dosis mayor fue de 10 mg, pudiendo administrarse hasta 4 veces en las 24 horas del estudio, con intervalos entre dosis no inferiores a 2 horas.
Los resultados de los ensayos de ziprasidona intramuscular siguen
INFORMACIÓN DEL PACIENTE
GEODON® Cápsulas (ziprasidona)
Información para pacientes que toman GEODON o sus cuidadores
Este resumen contiene información importante sobre GEODON. No pretende reemplazar las instrucciones de su médico. Lea esta información detenidamente antes de tomar GEODON. Pregúntele a su médico o farmacéutico si no entiende alguna parte de esta información o si desea saber más sobre GEODON.
¿Qué es GEODON 80 mg?
GEODON es un tipo de medicamento recetado llamado psicotrópico, también conocido como antipsicótico atípico. GEODON se puede utilizar para tratar los síntomas de la esquizofrenia y los episodios maníacos o mixtos agudos asociados con el trastorno bipolar. GEODON 80 mg también se puede utilizar como tratamiento de mantenimiento del trastorno bipolar cuando se añade a litio o valproato.
¿Quién debe tomar GEODON 20 mg?
Solo su médico puede saber si GEODON es adecuado para usted. Se le puede recetar GEODON 20 mg si tiene esquizofrenia o trastorno bipolar.
Los síntomas de la esquizofrenia pueden incluir:
- escuchar voces, ver cosas o sentir cosas que no existen (alucinaciones)
- Creencias que no son ciertas (delirios)
- suspicacia inusual (paranoia)
- alejarse de la familia y los amigos
Los síntomas de los episodios maníacos o mixtos del trastorno bipolar pueden incluir:
- estado de ánimo extremadamente alto o irritable
- aumento de la energía, la actividad y la inquietud
- pensamientos acelerados o hablar muy rápido
- distraido facilmente
- poca necesidad de dormir
Si muestra una respuesta a GEODON 40 mg, sus síntomas pueden mejorar. Si continúa tomando GEODON 40 mg, hay menos posibilidades de que sus síntomas regresen. No deje de tomar las cápsulas incluso cuando se sienta mejor sin consultarlo primero con su médico.
También es importante recordar que las cápsulas de GEODON 40 mg deben tomarse con alimentos.
¿Cuál es la información de seguridad más importante que debo saber sobre GEODON 20 mg?
GEODON no está aprobado para el tratamiento de pacientes con psicosis relacionada con la demencia. Los pacientes de edad avanzada con diagnóstico de psicosis relacionada con la demencia tratados con antipsicóticos tienen un mayor riesgo de muerte en comparación con los pacientes tratados con placebo (una pastilla de azúcar).
GEODON es un fármaco eficaz para tratar los síntomas de la esquizofrenia y los episodios maníacos o mixtos del trastorno bipolar. Sin embargo, un posible efecto secundario es que puede cambiar la forma en que funciona la corriente eléctrica en el corazón más que otros medicamentos. El cambio es pequeño y no se sabe si esto será dañino, pero algunos otros medicamentos que causan este tipo de cambio han causado en casos raros anomalías peligrosas del ritmo cardíaco. Debido a esto, GEODON debe usarse solo después de que su médico haya considerado este riesgo de GEODON frente a los riesgos y beneficios de otros medicamentos disponibles para tratar la esquizofrenia o los episodios maníacos y mixtos bipolares.
Su riesgo de cambios peligrosos en el ritmo cardíaco puede aumentar si está tomando ciertos otros medicamentos y si ya tiene ciertas afecciones cardíacas anormales. Por lo tanto, es importante que informe a su médico sobre cualquier otro medicamento que esté tomando, incluidos los medicamentos sin receta, los suplementos y las hierbas medicinales. También debe informar a su médico sobre cualquier problema cardíaco que tenga o haya tenido.
¿Quién NO debe tomar GEODON 40mg?
Pacientes de edad avanzada con diagnóstico de psicosis relacionada con demencia. GEODON no está aprobado para el tratamiento de estos pacientes.
Se debe evitar cualquier cosa que pueda aumentar la posibilidad de una anomalía del ritmo cardíaco. Por lo tanto, no tome GEODON 80 mg si:
- Tiene ciertas enfermedades cardíacas, por ejemplo, síndrome de QT largo, un ataque cardíaco reciente, insuficiencia cardíaca grave o ciertas irregularidades del ritmo cardíaco (discuta los detalles con su médico)
- Actualmente está tomando medicamentos que no deben tomarse en combinación con ziprasidona, por ejemplo, dofetilida, sotalol, quinidina, otros antiarrítmicos de clase Ia y III, mesoridazina, tioridazina, clorpromazina, droperidol, pimozida, esparfloxacina, gatifloxacina, moxifloxacina, halofantrina , mefloquina, pentamidina, trióxido de arsénico, acetato de levometadilo, mesilato de dolasetrón, probucol o tacrolimus.
Qué decirle a su médico antes de comenzar con GEODON
Solo su médico puede decidir si GEODON es adecuado para usted. Antes de comenzar con GEODON, asegúrese de informar a su médico si:
- ha tenido algún problema con la forma en que late su corazón o alguna enfermedad o enfermedad relacionada con el corazón
- cualquier historial familiar de enfermedad cardíaca, incluido un ataque cardíaco reciente
- ha tenido algún problema con desmayos o mareos
- está tomando o ha tomado recientemente algún medicamento recetado
- está tomando cualquier medicamento de venta libre que pueda comprar sin receta, incluidos los remedios naturales o a base de hierbas
- ha tenido algún problema con su hígado
- está embarazada, podría estar embarazada o planea quedar embarazada
- está amamantando o planea amamantar
- es alérgico a algún medicamento
- alguna vez ha tenido una reacción alérgica a la ziprasidona o a cualquiera de los demás componentes de las cápsulas de 20 mg de GEODON. Pídale a su médico o farmacéutico una lista de estos ingredientes
- tiene niveles bajos de potasio o magnesio en la sangre
Es posible que su médico quiera que se haga pruebas de laboratorio adicionales para ver si GEODON 40 mg es un tratamiento adecuado para usted.
GEODON y otros medicamentos
Hay algunos medicamentos que pueden no ser seguros cuando se toma GEODON, y hay algunos medicamentos que pueden afectar el funcionamiento de GEODON 40 mg. Mientras esté tomando GEODON, consulte con su médico antes de comenzar cualquier nuevo medicamento recetado o de venta libre, incluidos los remedios naturales o a base de hierbas.
Cómo tomar GEODON
- Tome GEODON solo según las indicaciones de su médico.
- Trague las cápsulas de GEODON enteras. No mastique, triture ni abra las cápsulas.
- Tome las cápsulas de GEODON 40 mg con alimentos.
- Lo mejor es tomar GEODON 80 mg a la misma hora todos los días.
- GEODON 80 mg puede tardar algunas semanas en hacer efecto. Es importante tener paciencia.
- No cambie su dosis ni deje de tomar su medicamento sin la aprobación de su médico.
- Recuerde seguir tomando sus cápsulas, incluso cuando se sienta mejor.
Posibles efectos secundarios
Debido a que estos problemas podrían significar que tiene una anomalía en el ritmo cardíaco, comuníquese con su médico. INMEDIATAMENTE si tu:
- Desmayo o pérdida del conocimiento
- Siente un cambio en la forma en que late el corazón (palpitaciones)
Los efectos secundarios comunes de GEODON incluyen los siguientes y también deben discutirse con su médico si ocurren:
- Sentirse inusualmente cansado o somnoliento
- Náuseas o malestar estomacal
- Estreñimiento
- Mareo
- Inquietud
- Movimientos musculares anormales, incluidos temblores, arrastrar los pies y movimientos involuntarios descontrolados
- Diarrea
- Sarpullido
- Aumento de tos/secreción nasal
Si desarrolla algún efecto secundario que le preocupe, hable con su médico. Es especialmente importante que le diga a su médico si tiene diarrea, vómitos u otra enfermedad que pueda hacer que pierda líquidos. Es posible que su médico quiera revisar su sangre para asegurarse de que tiene la cantidad correcta de sales importantes después de tales enfermedades.
Para obtener una lista de todos los efectos secundarios que se han informado, solicite a su médico o farmacéutico el prospecto de GEODON Professional.
Qué hacer en caso de sobredosis
En caso de sobredosis, llame a su médico o centro de toxicología de inmediato o vaya a la sala de emergencias más cercana.
Otra información de seguridad importante
Una afección grave llamada síndrome neuroléptico maligno (SNM) puede ocurrir con todos los medicamentos antipsicóticos, incluido GEODON. Los signos de SNM incluyen fiebre muy alta, músculos rígidos, temblores, confusión, sudoración o aumento del ritmo cardíaco y la presión arterial. El NMS es un efecto secundario raro pero grave que podría ser fatal. Por lo tanto, informe a su médico si experimenta alguno de estos signos.
Con ziprasidona puede ocurrir una reacción al fármaco de inicio tardío llamada reacción al fármaco con eosinofilia y síntomas sistémicos (DRESS). Los signos de DRESS pueden incluir sarpullido, fiebre e inflamación de los ganglios linfáticos. Otras reacciones adversas cutáneas graves (SCAR), como el síndrome de Stevens-Johnson, pueden ocurrir con ziprasidona. Los signos del síndrome de Stevens-Johnson pueden incluir sarpullido con ampollas que pueden incluir úlceras en la boca, descamación de la piel, fiebre y manchas en la piel. DRESS y otras SCAR son a veces fatales; por lo tanto, informe a su médico de inmediato si experimenta alguno de estos síntomas.
Se han notificado reacciones adversas relacionadas con niveles elevados de azúcar en sangre (hiperglucemia), en ocasiones graves, en pacientes tratados con antipsicóticos atípicos. Ha habido pocos informes de hiperglucemia o diabetes en pacientes tratados con GEODON y no se sabe si GEODON está asociado con estas reacciones. Los pacientes tratados con un antipsicótico atípico deben ser monitoreados por síntomas de hiperglucemia.
Con GEODON pueden producirse mareos causados por una disminución de la presión arterial, especialmente cuando empieza a tomar este medicamento por primera vez o cuando se aumenta la dosis. Si esto sucede, tenga cuidado de no ponerse de pie demasiado rápido y hable con su médico sobre el problema.
Antes de tomar GEODON, informe a su médico si
- está embarazada o planea quedar embarazada.
- Si queda embarazada mientras recibe GEODON 80 mg, hable con su proveedor de atención médica acerca de registrarse en el Registro Nacional de Embarazo para Antipsicóticos Atípicos. Puede registrarse llamando al 1-866-961-2388 o vaya a http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
- están amamantando o planean amamantar. GEODON 40 mg puede pasar a la leche materna. Hable con su proveedor de atención médica sobre la mejor manera de alimentar a su bebé si recibe GEODON.
Debido a que GEODON 80 mg puede causar somnolencia, tenga cuidado al operar maquinaria o conducir un vehículo motorizado.
Debido a que los medicamentos de la misma clase que GEODON pueden interferir con la capacidad del cuerpo para adaptarse al calor, es mejor evitar situaciones que involucren alta temperatura o humedad.
Es mejor evitar el consumo de bebidas alcohólicas mientras toma GEODON.
Llame a su médico inmediatamente si toma una cantidad de GEODON superior a la prescrita por su médico.
No se ha demostrado que GEODON sea seguro o eficaz en el tratamiento de niños y adolescentes menores de 18 años.
Mantenga GEODON 80 mg y todos los medicamentos fuera del alcance de los niños.
Cómo almacenar GEODON
Guarde las cápsulas de GEODON de 20 mg a temperatura ambiente (59 °F a 86 °F o 15 °C a 30 °C).
Para más información sobre GEODON
Esta hoja es sólo un resumen. GEODON 20 mg es un medicamento recetado y solo su médico puede decidir si es adecuado para usted. Si tiene alguna pregunta o desea obtener más información sobre GEODON, hable con su médico o farmacéutico. También puede visitar www.geodon.com.
Es posible que se haya actualizado el etiquetado de este producto. Para obtener la información de prescripción más reciente, visite www.pfizer.com
