Hydrea 500mg Hydroxyurea Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Hydrea 500 mg y cómo se usa?
Hydrea (hidroxiurea) es un agente antineoplásico (anticancerígeno) que se usa para tratar el melanoma, la leucemia mielocítica crónica resistente y el carcinoma de ovario recurrente, metastásico o inoperable y los carcinomas primarios de células escamosas (epidermoides) de la cabeza y el cuello. Hydrea está disponible en forma genérica.
¿Cuáles son los efectos secundarios de Hydrea?
Los efectos secundarios comunes de Hydrea incluyen:
- náuseas,
- vómitos,
- dolor de barriga,
- Diarrea,
- estreñimiento,
- cambios en la piel como descamación o decoloración,
- síntomas similares a la gripe,
- perdida de cabello,
- sarpullido,
- dolor de cabeza,
- mareo,
- somnolencia, o
- aumento de peso.
Los efectos secundarios graves de Hydrea incluyen:
- anemia,
- mielosupresión y
- leucemia.
DESCRIPCIÓN
HYDREA (cápsulas de hidroxiurea, USP) es un antimetabolito disponible para uso oral en forma de cápsulas que contienen 500 mg de hidroxiurea. Los ingredientes inactivos incluyen ácido cítrico, colorantes (D&C Yellow No. 10, FD&C Blue No. 1, FD&C Red No. 40 y D&C Red No. 28), gelatina, lactosa, estearato de magnesio, fosfato de sodio y dióxido de titanio.
La hidroxiurea es un polvo cristalino de color blanco a blanquecino. Es higroscópico y fácilmente soluble en agua, pero prácticamente insoluble en alcohol. La fórmula empírica es CH4N2O2 y tiene un peso molecular de 76,05. Su fórmula estructural es:
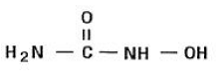
INDICACIONES
HYDREA 500mg está indicado para el tratamiento de:
- Leucemia mieloide crónica resistente.
- Carcinomas de células escamosas localmente avanzados de cabeza y cuello (excluyendo el labio) en combinación con quimiorradiación.
DOSIFICACIÓN Y ADMINISTRACIÓN
Información de dosificación
HYDREA se usa solo o junto con otros agentes antitumorales o radioterapia para tratar enfermedades neoplásicas. Individualice el tratamiento según el tipo de tumor, el estado de la enfermedad, la respuesta al tratamiento, los factores de riesgo del paciente y los estándares de práctica clínica actuales.
Base todas las dosis en el peso real o ideal del paciente, el que sea menor.
HYDREA es un fármaco citotóxico. Siga los procedimientos especiales de manipulación y eliminación aplicables [ver REFERENCIAS ].
Trague las cápsulas de HYDREA enteras. NO abra, rompa ni mastique las cápsulas porque HYDREA es un fármaco citotóxico.
Se recomienda la administración profiláctica de ácido fólico [ver ADVERTENCIAS Y PRECAUCIONES ].
Controle los recuentos sanguíneos al menos una vez a la semana durante la terapia con HYDREA 500 mg. La anemia severa debe corregirse antes de iniciar la terapia con HYDREA.
Modificaciones de dosis por toxicidad
Controle lo siguiente y reduzca la dosis o suspenda HYDREA 500 mg según corresponda:
- Mielosupresión [ver ADVERTENCIAS Y PRECAUCIONES ]
- Vasculitis cutánea [ver ADVERTENCIAS Y PRECAUCIONES ]
Considere modificaciones de dosis para otras toxicidades.
Modificaciones de dosis para insuficiencia renal
Reduzca la dosis de HYDREA en un 50% en pacientes con aclaramiento de creatinina medido de menos de 60 ml/min o con enfermedad renal en etapa terminal (ESRD) [ver Uso en poblaciones específicas y FARMACOLOGÍA CLÍNICA ].
En estos pacientes se recomienda una estrecha vigilancia de los parámetros hematológicos.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Cápsulas
500 mg tapa verde opaca y cuerpo rosa opaco impreso con "HYDREA" y "830".
Almacenamiento y manipulación
HYDREA® (cápsulas de hidroxiurea, USP) se presenta en cápsulas de 500 mg en frascos de HDPE con tapón de rosca de seguridad de plástico. Cada botella contiene 100 cápsulas.
El sombrero es de color verde opaco y el cuerpo es de color rosa opaco. Las cápsulas están impresas en ambas secciones con "HYDREA" y "830" en tinta negra ( CDN 0003-0830-50).
Almacenamiento
Almacenar a 20-25°C (68-77°F); excursiones permitidas a 15°C-30°C (59°F-86°F) [consulte Temperatura ambiente controlada por USP]. Mantener bien cerrado.
Manejo y Eliminación
HYDREA 500 mg es un fármaco citotóxico. Siga los procedimientos especiales de manipulación y eliminación aplicables [ver REFERENCIAS ].
Para disminuir el riesgo de contacto, aconseje a los cuidadores que usen guantes desechables cuando manipulen HYDREA o botellas que contengan HYDREA. Lávese las manos con agua y jabón antes y después del contacto con el frasco o las cápsulas cuando manipule HYDREA. No abra las cápsulas de HYDREA 500 mg. Evite la exposición a las cápsulas trituradas o abiertas. Si las cápsulas trituradas o abiertas entran en contacto con la piel, lave el área afectada de inmediato y completamente con agua y jabón. Si las cápsulas trituradas o abiertas entran en contacto con los ojos, se debe enjuagar bien el área afectada con agua o un colirio isotónico designado para tal fin durante al menos 15 minutos. Si se derrama el polvo de la cápsula, límpielo inmediatamente con una toalla desechable húmeda y deséchelo en un recipiente cerrado, como una bolsa de plástico; al igual que las cápsulas vacías. Luego, las áreas de derrame deben limpiarse tres veces con una solución de detergente y luego con agua limpia. Mantenga el medicamento fuera del alcance de los niños y las mascotas. Comuníquese con su médico para obtener instrucciones sobre cómo desechar las cápsulas vencidas.
REFERENCIAS
OSHA. http://www.osha.gov/SLTC/hazardousdrugs/index.html.
Fabricado para: Bristol-Myers Squibb Company Princeton, Nueva Jersey 08543 EE. UU. Revisado: diciembre de 2020
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas clínicamente significativas se describen en detalle en otras secciones de etiquetado:
- Mielosupresión [ver ADVERTENCIAS Y PRECAUCIONES ]
- Neoplasias malignas [ver ADVERTENCIAS Y PRECAUCIONES ]
- Toxicidades vasculíticas [ver ADVERTENCIAS Y PRECAUCIONES ]
- Riesgos con el uso concomitante de medicamentos antirretrovirales [ver ADVERTENCIAS Y PRECAUCIONES ]
- Recordatorio de radiación [ver ADVERTENCIAS Y PRECAUCIONES ]
- Macrocitosis [ver ADVERTENCIAS Y PRECAUCIONES ]
- Toxicidad pulmonar [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de HYDREA. Debido a que estas reacciones son reportadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia.
- Trastornos del aparato reproductor y de la mama: azoospermia y oligospermia
- Desórdenes gastrointestinales: estomatitis, náuseas, vómitos, diarrea y estreñimiento
- Trastornos del metabolismo y de la nutrición: anorexia, síndrome de lisis tumoral
- Trastornos de la piel y del tejido subcutáneo: erupción maculopapular, ulceración de la piel, lupus eritematoso cutáneo, cambios en la piel similares a la dermatomiositis, eritema periférico y facial, hiperpigmentación, hiperpigmentación de las uñas, atrofia de la piel y las uñas, descamación, pápulas violetas y alopecia
- Trastornos renales y urinarios: disuria, elevaciones del ácido sérico úrico, nitrógeno ureico en sangre (BUN) y niveles de creatinina
- Trastornos del sistema nervioso: dolor de cabeza, mareos, somnolencia, desorientación, alucinaciones y convulsiones
- Trastornos generales: fiebre, escalofríos, malestar general, edema y astenia
- Trastornos hepatobiliares: elevación de las enzimas hepáticas, colestasis y hepatitis
- Desórdenes respiratorios: infiltrados pulmonares difusos, disnea y fibrosis pulmonar, enfermedad pulmonar intersticial, neumonitis, alveolitis, alveolitis alérgica y tos
- Trastornos inmunológicos: lupus eritematoso sistémico
- Hipersensibilidad: Se ha informado fiebre inducida por fármacos (pirexia) (>39°C, >102°F) que requirió hospitalización junto con manifestaciones gastrointestinales, pulmonares, musculoesqueléticas, hepatobiliares, dermatológicas o cardiovasculares. El inicio generalmente ocurrió dentro de las 6 semanas posteriores al inicio y se resolvió al suspender la hidroxiurea. Tras la readministración, la fiebre volvió a ocurrir típicamente dentro de las 24 horas.
Las reacciones adversas observadas con la terapia combinada de hidroxiurea e irradiación son similares a las notificadas con el uso de hidroxiurea o radioterapia solos. Estos efectos incluyen principalmente depresión de la médula ósea (anemia y leucopenia), irritación gástrica y mucositis. Casi todos los pacientes que reciben un curso adecuado de terapia combinada de hidroxiurea e irradiación mostrarán leucopenia concurrente. Se ha producido depresión plaquetaria (
INTERACCIONES CON LA DROGAS
Mayor toxicidad con el uso concomitante de medicamentos antirretrovirales
pancreatitis
En pacientes con infección por VIH durante el tratamiento con hidroxiurea y didanosina, con o sin estavudina, se han producido pancreatitis mortales y no mortales. La hidroxiurea no está indicada para el tratamiento de la infección por VIH; sin embargo, si los pacientes con infección por VIH son tratados con hidroxiurea y, en particular, en combinación con didanosina y/o estavudina, se recomienda una estrecha vigilancia de los signos y síntomas de pancreatitis. Suspender permanentemente la terapia con hidroxiurea en pacientes que desarrollen signos y síntomas de pancreatitis.
hepatotoxicidad
Se ha informado hepatotoxicidad e insuficiencia hepática con resultado de muerte durante la vigilancia posterior a la comercialización en pacientes con infección por VIH tratados con hidroxiurea y otros medicamentos antirretrovirales. Los eventos hepáticos fatales se informaron con mayor frecuencia en pacientes tratados con la combinación de hidroxiurea, didanosina y estavudina. Evita esta combinación.
Neuropatía periférica
Se ha notificado neuropatía periférica, que en algunos casos fue grave, en pacientes con infección por VIH que recibieron hidroxiurea en combinación con medicamentos antirretrovirales, incluida didanosina, con o sin estavudina.
Interferencia de prueba de laboratorio
Interferencia con ensayos de ácido úrico, urea o ácido láctico
Los estudios han demostrado que existe una interferencia analítica de la hidroxiurea con las enzimas (ureasa, uricasa y lactato deshidrogenasa) utilizadas en la determinación de urea, ácido úrico y ácido láctico, lo que arroja resultados falsamente elevados de estos en pacientes tratados con hidroxiurea.
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
mielosupresión
La hidroxiurea causa mielosupresión severa. No se debe iniciar el tratamiento con hidroxiurea si la función de la médula ósea está marcadamente deprimida. Puede ocurrir supresión de la médula ósea, y la leucopenia es generalmente su primera manifestación y la más común. La trombocitopenia y la anemia ocurren con menos frecuencia y rara vez se observan sin una leucopenia previa. La depresión de la médula ósea es más probable en pacientes que han recibido previamente radioterapia o agentes quimioterapéuticos citotóxicos contra el cáncer; utilice la hidroxiurea con precaución en estos pacientes.
Evalúe el estado hematológico antes y durante el tratamiento con HYDREA. Proporcione atención de apoyo y modifique la dosis o suspenda HYDREA según sea necesario. La recuperación de la mielosupresión suele ser rápida cuando se interrumpe el tratamiento.
Neoplasias malignas
La hidroxiurea es un carcinógeno humano. En pacientes que reciben hidroxiurea a largo plazo para trastornos mieloproliferativos, se ha notificado leucemia secundaria. También se ha informado cáncer de piel en pacientes que reciben hidroxiurea a largo plazo. Aconseje protección contra la exposición solar y controle el desarrollo de neoplasias malignas secundarias.
Toxicidad embriofetal
Según el mecanismo de acción y los hallazgos en animales, HYDREA 500 mg puede causar daño fetal cuando se administra a una mujer embarazada. La hidroxiurea fue embriotóxica y teratogénica en ratas y conejos en dosis de 0,8 y 0,3 veces, respectivamente, la dosis diaria máxima recomendada en humanos en mg/m2. Asesorar a las mujeres embarazadas sobre el riesgo potencial para el feto [ver Uso en poblaciones específicas ].
Aconseje a las mujeres con potencial reproductivo que usen métodos anticonceptivos efectivos durante y después del tratamiento con HYDREA 500 mg durante al menos 6 meses después de la terapia. Aconseje a los hombres con potencial reproductivo que usen métodos anticonceptivos efectivos durante y después del tratamiento con HYDREA 500 mg durante al menos 1 año después de la terapia [ver Uso en poblaciones específicas ].
Toxicidades vasculíticas
Se han producido toxicidades vasculíticas cutáneas, incluidas ulceraciones vasculíticas y gangrena, en pacientes con trastornos mieloproliferativos durante el tratamiento con hidroxiurea. Estas toxicidades vasculíticas se informaron con mayor frecuencia en pacientes con antecedentes de tratamiento con interferón o que lo estaban recibiendo actualmente. Si se producen úlceras vasculíticas cutáneas, inicie el tratamiento y suspenda HYDREA.
vacunas vivas
Evite el uso de vacuna viva en pacientes que toman HYDREA. El uso concomitante de HYDREA con una vacuna de virus vivo puede potenciar la replicación del virus y/o puede aumentar la reacción adversa de la vacuna porque HYDREA puede suprimir los mecanismos normales de defensa. La vacunación con vacunas vivas en un paciente que recibe HYDREA 500 mg puede provocar una infección grave. La respuesta de anticuerpos del paciente a las vacunas puede disminuir. Considere la consulta con un especialista.
Riesgos con el uso concomitante de medicamentos antirretrovirales
Se han producido pancreatitis, hepatotoxicidad y neuropatía periférica cuando se administró hidroxiurea concomitantemente con medicamentos antirretrovirales, incluidos didanosina y estavudina [ver INTERACCIONES CON LA DROGAS ].
Recordatorio de radiación
Los pacientes que han recibido radioterapia en el pasado pueden tener una exacerbación del eritema posterior a la irradiación. Vigile el eritema de la piel en pacientes que recibieron radiación previamente y manéjelos sintomáticamente.
macrocitosis
HYDREA 500 mg puede causar macrocitosis, que es autolimitada y, a menudo, se observa temprano en el curso del tratamiento. El cambio morfológico se parece a la anemia perniciosa, pero no está relacionado con la deficiencia de vitamina B12 o ácido fólico. Esto puede enmascarar el diagnóstico de anemia perniciosa. Se recomienda la administración profiláctica de ácido fólico.
Toxicidad pulmonar
Se ha informado enfermedad pulmonar intersticial que incluye fibrosis pulmonar, infiltración pulmonar, neumonitis y alveolitis/alveolitis alérgica (incluidos casos fatales) en pacientes tratados por neoplasia mieloproliferativa. Supervise a los pacientes que desarrollen pirexia, tos, disnea u otros síntomas respiratorios con frecuencia, investigue y trate con prontitud. Suspender HYDREA 500 mg y tratar con corticosteroides [ver REACCIONES ADVERSAS ].
Interferencia de prueba de laboratorio
Es posible la interferencia con los ensayos de ácido úrico, urea o ácido láctico, lo que genera resultados falsos elevados de estos en pacientes tratados con hidroxiurea [ver INTERACCIONES CON LA DROGAS ].
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
No se han realizado estudios convencionales a largo plazo para evaluar el potencial carcinogénico de la hidroxiurea. Sin embargo, la administración intraperitoneal de 125 a 250 mg/kg de hidroxiurea (alrededor de 0,6 a 1,2 veces la dosis diaria oral máxima recomendada en humanos en mg/m2) tres veces por semana durante 6 meses a ratas hembra aumentó la incidencia de tumores mamarios en ratas que sobrevivieron a 18 meses en comparación con el control. La hidroxiurea es mutagénica in vitro para bacterias, hongos, protozoos y células de mamíferos. La hidroxiurea es clastogénica in vitro (células de hámster, linfoblastos humanos) e in vivo (ensayo SCE en roedores, ensayo de micronúcleo de ratón). La hidroxiurea provoca la transformación de células embrionarias de roedores a un fenotipo tumorigénico.
La hidroxiurea administrada a ratas macho en dosis de 60 mg/kg/día (alrededor de 0,3 veces la dosis diaria máxima recomendada en humanos sobre la base de mg/m2) produjo atrofia testicular, disminuyó la espermatogénesis y redujo significativamente su capacidad para fecundar a las hembras.
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
HYDREA puede causar daño fetal según los resultados de los estudios en animales y el mecanismo de acción del fármaco [ver FARMACOLOGÍA CLÍNICA ]. No hay datos con el uso de HYDREA en mujeres embarazadas para informar el riesgo asociado con el fármaco. En estudios de reproducción animal, la administración de hidroxiurea a ratas y conejas preñadas durante la organogénesis produjo efectos embriotóxicos y teratogénicos en dosis de 0,8 veces y 0,3 veces, respectivamente, la dosis diaria máxima recomendada en humanos en mg/m2 (ver Datos ). Aconseje a las mujeres sobre el riesgo potencial para el feto y que eviten quedar embarazadas mientras reciben tratamiento con HYDREA.
En la población general de los EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos reconocidos clínicamente es del 2 % al 4 % y del 15 % al 20 %, respectivamente.
Datos
Datos de animales
Se ha demostrado que la hidroxiurea es un potente teratógeno en una amplia variedad de modelos animales, incluidos ratones, hámsteres, gatos, cerdos en miniatura, perros y monos en dosis de 1 vez la dosis humana administrada en mg/m2. La hidroxiurea es embriotóxica y causa malformaciones fetales (huesos craneales parcialmente osificados, ausencia de cuencas oculares, hidrocefalia, esternebras bipartitas, ausencia de vértebras lumbares) a 180 mg/kg/día (alrededor de 0,8 veces la dosis diaria máxima recomendada en humanos en mg/m2) en ratas y a 30 mg/kg/día (alrededor de 0,3 veces la dosis diaria máxima recomendada en humanos en mg/m2) en conejos. La embriotoxicidad se caracterizó por la disminución de la viabilidad fetal, la reducción del tamaño de las camadas vivas y los retrasos en el desarrollo. La hidroxiurea atraviesa la placenta. Dosis únicas de ≥375 mg/kg (alrededor de 1,7 veces la dosis diaria máxima recomendada en humanos en mg/m2) a ratas causaron retraso en el crecimiento y deterioro de la capacidad de aprendizaje.
Lactancia
Resumen de riesgos
La hidroxiurea se excreta en la leche humana. Debido a la posibilidad de reacciones adversas graves en un bebé amamantado por la hidroxiurea, incluida la carcinogenicidad, interrumpa la lactancia durante el tratamiento con HYDREA.
Hembras y machos con potencial reproductivo
Pruebas de embarazo
Verifique el estado de preñez de las hembras con potencial reproductivo antes de iniciar la terapia con HYDREA.
Anticoncepción
Hembras
HYDREA puede causar daño fetal cuando se administra a una mujer embarazada [ver El embarazo ]. Aconseje a las mujeres con potencial reproductivo que usen métodos anticonceptivos efectivos durante y después del tratamiento con HYDREA durante al menos 6 meses después de la terapia. Aconseje a las hembras que informen inmediatamente sobre el embarazo.
machos
HYDREA 500 mg puede dañar los espermatozoides y el tejido testicular, dando como resultado posibles anomalías genéticas. Los hombres con parejas sexuales femeninas con potencial reproductivo deben usar métodos anticonceptivos efectivos durante y después del tratamiento con HYDREA 500 mg durante al menos 1 año después de la terapia [ver Toxicología no clínica ].
Esterilidad
machos
Según los hallazgos en animales y humanos, la fertilidad masculina puede verse comprometida por el tratamiento con HYDREA. En hombres se ha observado azoospermia u oligospermia, a veces reversible. Informar a los pacientes masculinos sobre la posibilidad de conservación de esperma antes del inicio de la terapia [ver REACCIONES ADVERSAS y Toxicología no clínica ].
Uso pediátrico
No se ha establecido la seguridad y eficacia en pacientes pediátricos.
Uso geriátrico
Los pacientes de edad avanzada pueden ser más sensibles a los efectos de la hidroxiurea y pueden requerir un régimen de dosis más bajo. La hidroxiurea se excreta por vía renal y el riesgo de reacciones adversas a este fármaco puede ser mayor en pacientes con insuficiencia renal. Debido a que es más probable que los pacientes de edad avanzada tengan una función renal disminuida, se debe tener cuidado en la selección de la dosis y puede ser útil monitorear la función renal [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Insuficiencia renal
La exposición a la hidroxiurea es mayor en pacientes con aclaramiento de creatinina de menos de 60 ml/min o en pacientes con enfermedad renal en etapa terminal (ESRD). Reduzca la dosis y controle de cerca los parámetros hematológicos cuando se administre HYDREA 500 mg a estos pacientes [ver DOSIFICACIÓN Y ADMINISTRACIÓN y FARMACOLOGÍA CLÍNICA ].
Deterioro hepático
No hay datos que respalden una guía específica para el ajuste de dosis en pacientes con insuficiencia hepática. En estos pacientes se recomienda una estrecha vigilancia de los parámetros hematológicos.
SOBREDOSIS
Se ha informado toxicidad mucocutánea aguda en pacientes que recibieron hidroxiurea en dosis varias veces superiores a la dosis terapéutica. También se han observado dolor, eritema violeta, edema en palmas y plantas seguido de descamación de manos y pies, hiperpigmentación severa generalizada de la piel y estomatitis.
CONTRAINDICACIONES
HYDREA 500 mg está contraindicado en pacientes que hayan demostrado una hipersensibilidad previa a la hidroxiurea o a cualquier otro componente de la formulación.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
El mecanismo preciso por el cual la hidroxiurea produce sus efectos antineoplásicos no puede, por el momento, describirse. Sin embargo, los informes de varios estudios en cultivo de tejidos en ratas y humanos apoyan la hipótesis de que la hidroxiurea causa una inhibición inmediata de la síntesis de ADN al actuar como un inhibidor de la ribonucleótido reductasa, sin interferir con la síntesis de ácido ribonucleico o de proteína. Esta hipótesis explica por qué, bajo ciertas condiciones, la hidroxiurea puede inducir efectos teratogénicos.
Se han postulado tres mecanismos de acción para la mayor eficacia del uso concomitante de la terapia con hidroxiurea con irradiación en carcinomas de células escamosas (epidermoides) de cabeza y cuello. Los estudios in vitro que utilizan células de hámster chino sugieren que la hidroxiurea (1) es letal para las células en etapa S normalmente radiorresistentes y (2) mantiene otras células del ciclo celular en la etapa G1 o de presíntesis de ADN, donde son más susceptibles a la efectos de la irradiación. El tercer mecanismo de acción se ha teorizado sobre la base de estudios in vitro de células HeLa. Parece que la hidroxiurea, al inhibir la síntesis de ADN, dificulta el proceso de reparación normal de las células dañadas pero no destruidas por la irradiación, lo que reduce su tasa de supervivencia; Las síntesis de ARN y proteínas no han mostrado alteración.
Farmacocinética
Absorción
Luego de la administración oral de HYDREA, la hidroxiurea alcanza concentraciones plasmáticas máximas en 1 a 4 horas. Las concentraciones plasmáticas máximas medias y las AUC aumentan más que proporcionalmente con el aumento de la dosis.
No hay datos sobre el efecto de los alimentos en la absorción de hidroxiurea.
Distribución
La hidroxiurea se distribuye por todo el cuerpo con un volumen de distribución que se aproxima al agua corporal total.
Concentrados de hidroxiurea en leucocitos y eritrocitos.
Metabolismo
Hasta el 60% de una dosis oral sufre conversión a través del metabolismo hepático saturable y una vía menor de degradación por la ureasa que se encuentra en las bacterias intestinales.
Excreción
En pacientes con anemia de células falciformes, la recuperación urinaria acumulada media de hidroxiurea fue de aproximadamente el 40 % de la dosis administrada.
Poblaciones Específicas
Insuficiencia renal
El efecto de la insuficiencia renal sobre la farmacocinética de la hidroxiurea se evaluó en pacientes adultos con enfermedad de células falciformes e insuficiencia renal. Pacientes con función renal normal (depuración de creatinina [CrCl] >80 ml/min), leve (CrCl 50-80 ml/min), moderada (CrCl = 30-60 ml/min). Reduzca la dosis de HYDREA 500 mg cuando se administre a pacientes con depuración de creatinina DOSIFICACIÓN Y ADMINISTRACIÓN y Uso en poblaciones específicas ].
INFORMACIÓN DEL PACIENTE
- Existe riesgo de mielosupresión. Se debe enfatizar el control de los recuentos sanguíneos semanalmente durante la duración de la terapia para los pacientes que toman HYDREA [ver ADVERTENCIAS Y PRECAUCIONES ]. Aconseje a los pacientes que notifiquen inmediatamente los signos y síntomas de infección o sangrado.
- Advierta a los pacientes que existe el riesgo de toxicidades vasculíticas cutáneas y neoplasias malignas secundarias, incluidos leucemia y cánceres de piel [ver ADVERTENCIAS Y PRECAUCIONES ].
- Advierta a las mujeres con potencial reproductivo sobre el riesgo potencial para un feto e informe a su proveedor de atención médica sobre un embarazo conocido o sospechado. Aconseje a las mujeres y los hombres en edad reproductiva que utilicen métodos anticonceptivos durante y después del tratamiento con HYDREA [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
- Aconseje a los pacientes que informen a su proveedor de atención médica si han recibido o planean recibir vacunas mientras toman HYDREA 500 mg, ya que esto puede provocar una infección grave [ver ADVERTENCIAS Y PRECAUCIONES ].
- Aconseje a las mujeres que interrumpan la lactancia durante el tratamiento con HYDREA [ver Uso en poblaciones específicas ].
- Los pacientes con infección por VIH deben comunicarse con su médico en caso de signos y síntomas de pancreatitis, eventos hepáticos y neuropatía periférica [ver ADVERTENCIAS Y PRECAUCIONES ].
- El eritema posterior a la radiación puede ocurrir en pacientes que han recibido terapia de radiación previa [ver ADVERTENCIAS Y PRECAUCIONES ].
- Informe a los pacientes sobre los síntomas de toxicidad pulmonar potencial e indíqueles que busquen atención médica inmediata en caso de pirexia, tos, disnea u otros síntomas respiratorios [ver ADVERTENCIAS Y PRECAUCIONES ].
