Lexapro 10mg, 20mg, 5mg Escitalopram Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Lexapro y cómo se usa?
Lexapro es un medicamento recetado que se usa para tratar los síntomas del trastorno depresivo mayor y el trastorno de ansiedad generalizada. Lexapro se puede usar solo o con otros medicamentos.
- Lexapro pertenece a una clase de medicamentos llamados antidepresivos, ISRS.
- No se sabe si Lexapro 10 mg es seguro y eficaz en niños menores de 12 años.
¿Cuáles son los posibles efectos secundarios de Lexapro?
Lexapro puede causar efectos secundarios graves que incluyen:
- Dolor abdominal,
- Sangrado anormal,
- sueños anormales,
- Alergia,
- visión borrosa,
- visión de túnel,
- Dolor de pecho,
- disminución de la concentración,
- hemostasia,
- dolor o hinchazón de los ojos,
- viendo halos alrededor de las luces,
- pensamientos acelerados,
- comportamiento inusual de toma de riesgos,
- sentimientos de extrema felicidad o tristeza,
- dolor de cabeza,
- acidez,
- Sofocos,
- confusión,
- dificultad para hablar,
- severa debilidad,
- vómitos,
- pérdida de coordinación,
- sintiéndose inestable,
- músculos muy rígidos (rígidos),
- fiebre alta,
- transpiración,
- confusión,
- latidos cardíacos rápidos o irregulares,
- temblores, y
- aturdimiento
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Lexapro incluyen:
- mareo,
- somnolencia,
- debilidad,
- transpiración,
- sentirse tembloroso o ansioso,
- problemas para dormir (insomnio),
- boca seca,
- pérdida de apetito,
- náuseas,
- estreñimiento,
- bostezando,
- cambios de peso,
- disminución del deseo sexual,
- impotencia, y
- dificultad para tener un orgasmo
ADVERTENCIA
SUICIDALIDAD Y MEDICAMENTOS ANTIDEPRESIVOS
Los antidepresivos aumentaron el riesgo de pensamientos y conductas suicidas (tendencia suicida) en comparación con placebo en niños, adolescentes y adultos jóvenes en estudios a corto plazo de trastorno depresivo mayor (TDM) y otros trastornos psiquiátricos. Cualquiera que esté considerando el uso de Lexapro o cualquier otro antidepresivo en un niño, adolescente o adulto joven debe sopesar este riesgo con la necesidad clínica. Los estudios a corto plazo no mostraron un aumento en el riesgo de tendencias suicidas con antidepresivos en comparación con placebo en adultos mayores de 24 años; hubo una reducción del riesgo con los antidepresivos en comparación con el placebo en adultos de 65 años o más. La depresión y ciertos otros trastornos psiquiátricos están asociados con aumentos en el riesgo de suicidio. Los pacientes de todas las edades que comienzan con la terapia antidepresiva deben ser monitoreados apropiadamente y observados de cerca para detectar empeoramiento clínico, tendencias suicidas o cambios inusuales en el comportamiento. Se debe advertir a las familias y cuidadores de la necesidad de una estrecha observación y comunicación con el prescriptor. Lexapro 5 mg no está aprobado para su uso en pacientes pediátricos menores de 12 años. [Ver ADVERTENCIAS Y PRECAUCIONES Empeoramiento Clínico y Riesgo de Suicidio, INFORMACIÓN DEL PACIENTE , y Uso en poblaciones específicas : uso pediátrico].
DESCRIPCIÓN
Lexapro® (oxalato de escitalopram) es un inhibidor selectivo de la recaptación de serotonina (ISRS) administrado por vía oral. Escitalopram es el Senantiómero puro (isómero único) del citalopram derivado de ftalano bicíclico racémico. El oxalato de escitalopram se denomina S-(+)-1-[3(dimetil-amino)propil]-1-(p-fluorofenil)-5-ftalancarbonitrilo oxalato con la siguiente fórmula estructural:
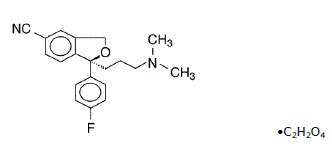
La fórmula molecular es C20H21FN2O • C2H2O4 y el peso molecular es 414,40.
El oxalato de escitalopram se presenta como un polvo fino, de color blanco a ligeramente amarillo y es totalmente soluble en metanol y dimetilsulfóxido (DMSO), soluble en solución salina isotónica, escasamente soluble en agua y etanol, ligeramente soluble en acetato de etilo e insoluble en heptano.
Lexapro (oxalato de escitalopram) está disponible en forma de tabletas o como solución oral.
Los comprimidos de Lexapro son comprimidos redondos recubiertos con película que contienen oxalato de escitalopram en concentraciones equivalentes a 5 mg, 10 mg y 20 mg de base de escitalopram. Los comprimidos de 10 y 20 mg están ranurados. Las tabletas también contienen los siguientes ingredientes inactivos: talco, croscarmelosa sódica, celulosa microcristalina/dióxido de silicio coloidal y estearato de magnesio. El recubrimiento de la película contiene hipromelosa, dióxido de titanio y polietilenglicol.
Lexapro 5 mg solución oral contiene oxalato de escitalopram equivalente a 1 mg/ml de base de escitalopram. También contiene los siguientes ingredientes inactivos: sorbitol, agua purificada, ácido cítrico, citrato de sodio, ácido málico, glicerina, propilenglicol, metilparabeno, propilparabeno y sabor a menta natural.
INDICACIONES
Trastorno depresivo mayor
Lexapro (escitalopram) está indicado para el tratamiento agudo y de mantenimiento del trastorno depresivo mayor en adultos y adolescentes de 12 a 17 años [ver Estudios clínicos ].
Un episodio depresivo mayor (DSM-IV) implica un estado de ánimo deprimido o disfórico prominente y relativamente persistente (casi todos los días durante al menos 2 semanas) que generalmente interfiere con el funcionamiento diario e incluye al menos cinco de los siguientes nueve síntomas: estado de ánimo deprimido, pérdida de interés en las actividades habituales, cambios significativos en el peso y/o el apetito, insomnio o hipersomnia, agitación o retraso psicomotor, aumento de la fatiga, sentimientos de culpa o inutilidad, pensamiento lento o dificultad para concentrarse, intento de suicidio o ideación suicida.
Trastorno de ansiedad generalizada
Lexapro 20 mg está indicado para el tratamiento agudo del trastorno de ansiedad generalizada (TAG) en adultos [ver Estudios clínicos ].
El Trastorno de Ansiedad Generalizada (DSM-IV) se caracteriza por un exceso de ansiedad y preocupación (expectativa aprensiva) que persiste durante al menos 6 meses y que la persona encuentra difícil de controlar. Debe estar asociado con al menos 3 de los siguientes síntomas: inquietud o sensación de nerviosismo o nerviosismo, fatiga fácil, dificultad para concentrarse o la mente se queda en blanco, irritabilidad, tensión muscular y trastornos del sueño.
DOSIFICACIÓN Y ADMINISTRACIÓN
Lexapro 5 mg debe administrarse una vez al día, por la mañana o por la noche, con o sin alimentos.
Trastorno depresivo mayor
Tratamiento inicial
Adolescentes
La dosis recomendada de Lexapro es de 10 mg una vez al día. Un ensayo de dosis flexible de Lexapro (10 a 20 mg/día) demostró la eficacia de Lexapro [ver Estudios clínicos ]. Si la dosis se aumenta a 20 mg, esto debería ocurrir después de un mínimo de tres semanas.
Adultos
La dosis recomendada de Lexapro 10 mg es de 10 mg una vez al día. Un ensayo de dosis fija de Lexapro demostró la eficacia de 10 mg y 20 mg de Lexapro 5 mg, pero no logró demostrar un mayor beneficio de 20 mg sobre 10 mg [ver Estudios clínicos ]. Si la dosis se aumenta a 20 mg, esto debe ocurrir después de un mínimo de una semana.
Tratamiento de mantenimiento
En general, se acepta que los episodios agudos del trastorno depresivo mayor requieren varios meses o más de terapia farmacológica sostenida más allá de la respuesta al episodio agudo. La evaluación sistemática de continuar con Lexapro 10 o 20 mg/día en pacientes adultos con trastorno depresivo mayor que respondieron mientras tomaban Lexapro durante una fase de tratamiento agudo de 8 semanas demostró un beneficio de dicho tratamiento de mantenimiento [ver Estudios clínicos ]. No obstante, el médico que opte por utilizar Lexapro 5 mg durante períodos prolongados debe reevaluar periódicamente la utilidad a largo plazo del fármaco para el paciente individual. Los pacientes deben ser reevaluados periódicamente para determinar la necesidad de un tratamiento de mantenimiento.
Trastorno de ansiedad generalizada
Tratamiento inicial
Adultos
La dosis inicial recomendada de Lexapro es de 10 mg una vez al día. Si la dosis se aumenta a 20 mg, esto debe ocurrir después de un mínimo de una semana.
Tratamiento de mantenimiento
El trastorno de ansiedad generalizada se reconoce como una condición crónica. No se ha estudiado sistemáticamente la eficacia de Lexapro en el tratamiento del TAG más allá de las 8 semanas. El médico que opte por utilizar Lexapro durante períodos prolongados debe reevaluar periódicamente la utilidad a largo plazo del fármaco para el paciente individual.
Detectar el trastorno bipolar antes de iniciar Lexapro
Antes de iniciar el tratamiento con Lexapro u otro antidepresivo, evalúe a los pacientes en busca de antecedentes familiares personales de trastorno bipolar, manía o hipomanía [ver ADVERTENCIAS Y PRECAUCIONES ].
Poblaciones Especiales
10 mg/día es la dosis recomendada para la mayoría de los pacientes de edad avanzada y pacientes con insuficiencia hepática.
No es necesario ajustar la dosis en pacientes con insuficiencia renal leve o moderada. Lexapro debe utilizarse con precaución en pacientes con insuficiencia renal grave.
Interrupción del tratamiento con Lexapro
Se han informado síntomas asociados con la suspensión de Lexapro 5 mg y otros ISRS e IRSN [ver ADVERTENCIAS Y PRECAUCIONES ]. Los pacientes deben ser monitoreados por estos síntomas al suspender el tratamiento. Siempre que sea posible, se recomienda una reducción gradual de la dosis en lugar de una interrupción brusca. Si aparecen síntomas intolerables tras una disminución de la dosis o tras la interrupción del tratamiento, se puede considerar la reanudación de la dosis prescrita anteriormente. Posteriormente, el médico puede continuar disminuyendo la dosis pero a un ritmo más gradual.
Cambio de un paciente a o desde un inhibidor de la monoaminooxidasa (IMAO) destinado a tratar trastornos psiquiátricos
Deben transcurrir al menos 14 días entre la interrupción de un IMAO destinado a tratar trastornos psiquiátricos y el inicio de la terapia con Lexapro. Por el contrario, se deben permitir al menos 14 días después de suspender Lexapro 20 mg antes de comenzar un IMAO destinado a tratar trastornos psiquiátricos [ver CONTRAINDICACIONES ].
Uso de Lexapro con otros IMAO como linezolid o azul de metileno
No inicie Lexapro 5 mg en un paciente que está siendo tratado con linezolid o azul de metileno intravenoso porque existe un mayor riesgo de síndrome serotoninérgico. En un paciente que requiere un tratamiento más urgente de una condición psiquiátrica, se deben considerar otras intervenciones, incluida la hospitalización [ver CONTRAINDICACIONES ].
En algunos casos, un paciente que ya recibe terapia con Lexapro 10 mg puede requerir tratamiento urgente con linezolid o azul de metileno intravenoso. Si no hay disponibles alternativas aceptables al tratamiento con linezolid o azul de metileno intravenoso y se considera que los beneficios potenciales del tratamiento con linezolid o azul de metileno intravenoso superan los riesgos del síndrome serotoninérgico en un paciente en particular, se debe suspender Lexapro de inmediato y linezolid o azul de metileno intravenoso. se puede administrar Se debe monitorear al paciente para detectar síntomas del síndrome serotoninérgico durante 2 semanas o hasta 24 horas después de la última dosis de linezolid o azul de metileno intravenoso, lo que ocurra primero. La terapia con Lexapro puede reanudarse 24 horas después de la última dosis de linezolid o azul de metileno intravenoso [ver ADVERTENCIAS Y PRECAUCIONES ].
No está claro el riesgo de administrar azul de metileno por vías no intravenosas (como comprimidos orales o inyección local) o en dosis intravenosas muy inferiores a 1 mg/kg con Lexapro 10 mg. No obstante, el médico debe ser consciente de la posibilidad de síntomas emergentes del síndrome serotoninérgico con dicho uso [ver ADVERTENCIAS Y PRECAUCIONES ].
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
tabletas
Los comprimidos de Lexapro de 10 mg son comprimidos redondos recubiertos con película que contienen oxalato de escitalopram en concentraciones equivalentes a 5 mg, 10 mg y 20 mg de base de escitalopram. Los comprimidos de 10 y 20 mg están ranurados. Impreso con "FL" en un lado y "5", "10" o "20" en el otro lado según sus respectivas intensidades.
Solucion Oral
Lexapro solución oral contiene oxalato de escitalopram equivalente a 1 mg/mL de base de escitalopram (actualmente no comercializado).
Almacenamiento y manipulación
tabletas
Tabletas de 5mg
Botella de 100 - CDN # 0456-2005-01
Blanco a blanquecino, redondo, sin rayar, recubierto con película. Escriba "FL" en un lado de la tableta y "5" en el otro lado.
Comprimidos de 10mg
Botella de 100 - CDN 0456-2010-01 10 x 10 Dosis Unitaria - CDN # 0456-2010-63
Blanco a blanquecino, redondo, ranurado, recubierto con película. Impresión en el lado ranurado con "F" en el lado izquierdo y "L" en el lado derecho. Imprima en el lado no marcado con "10".
Comprimidos de 20 mg
Botella de 100 - CDN # 0456-2020-01 10 x 10 Dosis Unitaria - CDN # 0456-2020-63
Blanco a blanquecino, redondo, ranurado, recubierto con película. Impresión en el lado ranurado con "F" en el lado izquierdo y "L" en el lado derecho. Imprima en el lado no marcado con "20".
Solucion Oral
5 mg/5 mL, sabor menta (240 mL) - CDN n.º 0456-2101-08. La solución oral no se comercializa actualmente.
Almacenamiento y manipulación
Almacenar a una temperatura de 20 °C a 25 °C (68 °F a 77 °F); excursiones permitidas a 15 a 30°C (59° a 86°F).
Distribuido por: Allergan USA, Inc. Madison, NJ 07940. Revisado: septiembre de 2021
EFECTOS SECUNDARIOS
Experiencia en ensayos clínicos
Debido a que los estudios clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los estudios clínicos de un fármaco no pueden compararse directamente con las tasas de los estudios clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Fuentes de datos de ensayos clínicos
Pediatría (6 -17 años)
Se recopilaron eventos adversos en 576 pacientes pediátricos (286 Lexapro 5 mg, 290 placebo) con trastorno depresivo mayor en estudios doble ciego controlados con placebo. No se ha establecido la seguridad y eficacia de Lexapro 5 mg en pacientes pediátricos menores de 12 años.
Adultos
La información de eventos adversos para Lexapro 5 mg se recopiló de 715 pacientes con trastorno depresivo mayor que estuvieron expuestos a escitalopram y de 592 pacientes que estuvieron expuestos a placebo en ensayos doble ciego controlados por placebo. Otros 284 pacientes con trastorno depresivo mayor fueron expuestos recientemente a escitalopram en ensayos abiertos. La información sobre eventos adversos de Lexapro en pacientes con TAG se recopiló de 429 pacientes expuestos a escitalopram y de 427 pacientes expuestos a placebo en ensayos doble ciego controlados por placebo.
Los eventos adversos durante la exposición se obtuvieron principalmente mediante consultas generales y los investigadores clínicos los registraron utilizando la terminología de su propia elección. En consecuencia, no es posible proporcionar una estimación significativa de la proporción de personas que experimentan eventos adversos sin agrupar primero tipos de eventos similares en un número menor de categorías de eventos estandarizados. En las tablas y tabulaciones que siguen, se ha utilizado la terminología estándar de la Organización Mundial de la Salud (OMS) para clasificar los eventos adversos informados.
Las frecuencias indicadas de reacciones adversas representan la proporción de personas que experimentaron, al menos una vez, un evento adverso emergente del tratamiento del tipo enumerado. Un evento se consideró emergente del tratamiento si ocurrió por primera vez o empeoró mientras recibía la terapia después de la evaluación inicial.
Eventos adversos asociados con la interrupción del tratamiento
Trastorno depresivo mayor
Pediatría (6 -17 años)
Los eventos adversos se asociaron con la interrupción del tratamiento en el 3,5 % de los 286 pacientes que recibieron Lexapro y en el 1 % de los 290 pacientes que recibieron placebo. El evento adverso más común (incidencia de al menos 1 % para Lexapro 10 mg y mayor que el placebo) asociado con la interrupción fue el insomnio (1 % Lexapro, 0 % placebo).
Adultos
Entre los 715 pacientes deprimidos que recibieron Lexapro en ensayos controlados con placebo, el 6 % interrumpió el tratamiento debido a un evento adverso, en comparación con el 2 % de los 592 pacientes que recibieron placebo. En dos estudios de dosis fija, la tasa de discontinuación por eventos adversos en pacientes que recibieron 10 mg/día de Lexapro 20 mg no fue significativamente diferente de la tasa de discontinuación por eventos adversos en pacientes que recibieron placebo. La tasa de interrupción por eventos adversos en pacientes asignados a una dosis fija de 20 mg/día de Lexapro fue del 10 %, que fue significativamente diferente de la tasa de interrupción por eventos adversos en pacientes que recibieron 10 mg/día de Lexapro (4 %) y placebo (3%). Los eventos adversos que se asociaron con la suspensión de al menos el 1 % de los pacientes tratados con Lexapro 5 mg, y cuya tasa fue al menos el doble que la del placebo, fueron náuseas (2 %) y trastornos de la eyaculación (2 % de los pacientes masculinos).
Trastorno de ansiedad generalizada
Adultos
Entre los 429 pacientes con TAG que recibieron Lexapro 10-20 mg/día en ensayos controlados con placebo, el 8 % interrumpió el tratamiento debido a un evento adverso, en comparación con el 4 % de los 427 pacientes que recibieron placebo. Los eventos adversos que se asociaron con la suspensión de al menos el 1 % de los pacientes tratados con Lexapro 20 mg, y para los cuales la tasa fue al menos el doble de la tasa del placebo, fueron náuseas (2 %), insomnio (1 %) y fatiga (1 %).
Incidencia de reacciones adversas en ensayos clínicos controlados con placebo
Trastorno depresivo mayor
Pediatría (6 -17 años)
El perfil general de reacciones adversas en pacientes pediátricos fue generalmente similar al observado en estudios de adultos, como se muestra en la Tabla 2. Sin embargo, las siguientes reacciones adversas (excluyendo las que aparecen en la Tabla 2 y aquellas para las que los términos codificados no son informativos o inducen a error) ) se informaron con una incidencia de al menos el 2% para Lexapro y mayor que el placebo: dolor de espalda, infección del tracto urinario, vómitos y congestión nasal.
Adultos
Las reacciones adversas observadas con mayor frecuencia en pacientes con Lexapro 10 mg (incidencia de aproximadamente el 5 % o más y aproximadamente el doble de la incidencia en pacientes con placebo) fueron insomnio, trastorno de la eyaculación (principalmente retraso en la eyaculación), náuseas, aumento de la sudoración, fatiga y somnolencia.
La Tabla 2 enumera la incidencia, redondeada al porcentaje más cercano, de eventos adversos emergentes del tratamiento que ocurrieron entre 715 pacientes deprimidos que recibieron Lexapro 20 mg en dosis que oscilaron entre 10 y 20 mg/día en ensayos controlados con placebo. Los eventos incluidos son aquellos que ocurren en el 2% o más de los pacientes tratados con Lexapro 20 mg y para los cuales la incidencia en los pacientes tratados con Lexapro 10 mg fue mayor que la incidencia en los pacientes tratados con placebo.
TABLA 2 Reacciones adversas emergentes del tratamiento observadas con una frecuencia de ≥ 2 % y mayor que el placebo para el trastorno depresivo mayor
Trastorno de ansiedad generalizada
Adultos
Las reacciones adversas observadas con mayor frecuencia en pacientes con Lexapro (incidencia de aproximadamente el 5 % o más y aproximadamente el doble de la incidencia en pacientes con placebo) fueron náuseas, trastornos de la eyaculación (principalmente retraso en la eyaculación), insomnio, fatiga, disminución de la libido y anorgasmia.
enumera la incidencia, redondeada al porcentaje más cercano, de eventos adversos emergentes del tratamiento que ocurrieron entre 429 pacientes con TAG que recibieron Lexapro de 10 a 20 mg/día en ensayos controlados con placebo. Los eventos incluidos son aquellos que ocurren en el 2% o más de los pacientes tratados con Lexapro y para los cuales la incidencia en los pacientes tratados con Lexapro fue mayor que la incidencia en los pacientes tratados con placebo.
TABLA 3 Reacciones adversas emergentes del tratamiento observadas con una frecuencia de ≥ 2 % y mayor que el placebo para el trastorno de ansiedad generalizada
Dependencia de la dosis de las reacciones adversas
La posible dependencia de la dosis de reacciones adversas comunes (definida como una tasa de incidencia de ≥5 % en los grupos de Lexapro de 10 mg o 20 mg) se examinó sobre la base de la incidencia combinada de reacciones adversas en dos ensayos de dosis fija. La tasa de incidencia general de eventos adversos en pacientes tratados con 10 mg de Lexapro (66 %) fue similar a la de los pacientes tratados con placebo (61 %), mientras que la tasa de incidencia en pacientes tratados con 20 mg/día de Lexapro fue mayor (86 %). La Tabla 4 muestra las reacciones adversas comunes que ocurrieron en el grupo de 20 mg/día de Lexapro con una incidencia que fue aproximadamente el doble que la del grupo de 10 mg/día de Lexapro 10 mg y aproximadamente el doble que la del grupo de placebo.
TABLA 4 Incidencia de reacciones adversas frecuentes en pacientes con trastorno depresivo mayor
Disfunción sexual masculina y femenina con ISRS
Aunque los cambios en el deseo sexual, el desempeño sexual y la satisfacción sexual a menudo ocurren como manifestaciones de un trastorno psiquiátrico, también pueden ser consecuencia del tratamiento farmacológico. En particular, alguna evidencia sugiere que los ISRS pueden causar tales experiencias sexuales adversas.
Sin embargo, es difícil obtener estimaciones fiables de la incidencia y la gravedad de las experiencias adversas relacionadas con el deseo, el rendimiento y la satisfacción sexuales, en parte porque los pacientes y los médicos pueden ser reacios a hablar de ellas. En consecuencia, es probable que las estimaciones de la incidencia de la experiencia y el rendimiento sexuales adversos citados en la etiqueta del producto subestimen su incidencia real.
TABLA 5 Incidencia de efectos secundarios sexuales en ensayos clínicos controlados con placebo
No existen estudios adecuadamente diseñados que examinen la disfunción sexual con el tratamiento con escitalopram.
Se ha informado priapismo con todos los ISRS.
Si bien es difícil conocer el riesgo preciso de disfunción sexual asociado con el uso de los ISRS, los médicos deben preguntar de forma rutinaria acerca de tales posibles efectos secundarios.
Cambios en los signos vitales
Los grupos de Lexapro 5 mg y placebo se compararon con respecto a (1) el cambio medio desde el inicio en los signos vitales (pulso, presión arterial sistólica y presión arterial diastólica) y (2) la incidencia de pacientes que cumplían los criterios de cambios potencialmente clínicamente significativos desde el inicio en estas variables. Estos análisis no revelaron ningún cambio clínicamente importante en los signos vitales asociados con el tratamiento con Lexapro 20 mg. Además, una comparación de las medidas de los signos vitales en decúbito supino y de pie en sujetos que recibieron Lexapro 20 mg indicó que el tratamiento con Lexapro no está asociado con cambios ortostáticos.
Cambios de peso
Los pacientes tratados con Lexapro en ensayos controlados no se diferenciaron de los pacientes tratados con placebo con respecto al cambio clínicamente importante en el peso corporal.
Cambios de laboratorio
Los grupos de Lexapro 5 mg y placebo se compararon con respecto a (1) el cambio medio desde el inicio en varias variables de química sérica, hematología y análisis de orina, y (2) la incidencia de pacientes que cumplían los criterios de cambios clínicamente significativos desde el inicio en estas variables. Estos análisis no revelaron cambios clínicamente importantes en los parámetros de las pruebas de laboratorio asociados con el tratamiento con Lexapro.
Cambios en el ECG
Los electrocardiogramas de los grupos de Lexapro (N=625) y placebo (N=527) se compararon con respecto a los valores atípicos definidos como sujetos con cambios de QTc de más de 60 ms desde el inicio o valores absolutos de más de 500 ms después de la dosis, y sujetos con aumentos de la frecuencia cardíaca a más de 100 lpm o disminuye a menos de 50 lpm con un cambio del 25 % desde el valor inicial (valores atípicos de taquicardia o bradicardia, respectivamente). Ninguno de los pacientes del grupo de Lexapro 20 mg tuvo un intervalo QTcF >500 mseg o una prolongación >60 mseg en comparación con el 0,2 % de los pacientes del grupo placebo. La incidencia de valores atípicos de taquicardia fue del 0,2 % en el grupo de Lexapro 5 mg y del placebo. La incidencia de valores atípicos de bradicardia fue del 0,5 % en el grupo de Lexapro 10 mg y del 0,2 % en el grupo de placebo.
El intervalo QTcF se evaluó en un estudio aleatorizado, controlado con placebo y activo (moxifloxacino 400 mg), cruzado y de dosis múltiples en aumento en 113 sujetos sanos. La diferencia media máxima (límite de confianza superior del 95 %) con respecto al grupo de placebo fue de 4,5 (6,4) y 10,7 (12,7) mseg para 10 mg y 30 mg de escitalopram supraterapéutico administrados una vez al día, respectivamente. Según la relación exposición-respuesta establecida, el cambio de QTcF previsto del grupo de placebo (intervalo de confianza del 95 %) por debajo de la Cmax para la dosis de 20 mg es de 6,6 (7,9) mseg. Escitalopram 30 mg administrado una vez al día dio como resultado una Cmax media de 1,7 veces mayor que la Cmax media para la dosis terapéutica máxima recomendada en el estado de equilibrio (20 mg). La exposición con una dosis supraterapéutica de 30 mg es similar a las concentraciones en estado estacionario esperadas en los metabolizadores lentos de CYP2C19 después de una dosis terapéutica de 20 mg.
Otras reacciones observadas durante la evaluación previa a la comercialización de Lexapro
La siguiente es una lista de eventos adversos emergentes del tratamiento, como se define en la introducción a la REACCIONES ADVERSAS sección, informado por los 1428 pacientes tratados con Lexapro por períodos de hasta un año en ensayos clínicos doble ciego o abiertos durante su evaluación previa a la comercialización. La lista no incluye los eventos ya enumerados en aquellos eventos para los cuales la causa de un fármaco fue remota y en una tasa inferior al 1% o menor que el placebo, aquellos eventos que fueron tan generales que no dieron información y aquellos eventos informados solo una vez que no tenía una probabilidad sustancial de ser una amenaza aguda para la vida. Los eventos se clasifican por sistema corporal. Los eventos de mayor importancia clínica se describen en el ADVERTENCIAS Y PRECAUCIONES sección.
Cardiovascular -hipertensión, palpitaciones.
Trastornos del sistema nervioso central y periférico - sensación de mareo, migraña.
Desórdenes gastrointestinales -calambres abdominales, acidez estomacal, gastroenteritis.
General - alergia, dolor torácico, fiebre, sofocos, dolor en las extremidades.
Trastornos metabólicos y nutricionales -aumento de peso.
Trastornos del sistema musculoesquelético - artralgia, mialgia rigidez mandibular.
Desórdenes psiquiátricos aumento del apetito, alteración de la concentración, irritabilidad.
Trastornos reproductivos/Femenino - calambres menstruales, trastorno menstrual.
Trastornos del sistema respiratorio - bronquitis, tos, congestión nasal, congestión sinusal, dolor de cabeza sinusal.
Trastornos de la piel y apéndices - sarpullido.
Sentidos especiales - visión borrosa, tinnitus.
Trastornos del sistema urinario -frecuencia urinaria, infección del tracto urinario.
Experiencia posterior a la comercialización
Reacciones adversas notificadas posteriores a la comercialización de escitalopram
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de Lexapro. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Trastornos de la sangre y del sistema linfático: anemia, agranulocitosis, anemia aplásica, anemia hemolítica, púrpura trombocitopénica idiopática, leucopenia, trombocitopenia.
Trastornos cardíacos: fibrilación auricular, bradicardia, insuficiencia cardíaca, infarto de miocardio, taquicardia, torsade de pointes, arritmia ventricular, taquicardia ventricular.
Trastornos del oído y del laberinto: vértigo
Desordenes endocrinos: diabetes mellitus, hiperprolactinemia, SIADH.
Trastornos oculares: glaucoma de ángulo cerrado, diplopía, midriasis, alteración visual.
Trastorno gastrointestinal: disfagia, hemorragia gastrointestinal, reflujo gastroesofágico, pancreatitis, hemorragia rectal.
Desordenes generales y condiciones administrativas del sitio: marcha anormal, astenia, edema, caída, sensación anormal, malestar general.
Trastornos hepatobiliares: hepatitis fulminante, insuficiencia hepática, necrosis hepática, hepatitis.
Trastornos del sistema inmunológico: reacción alérgica, anafilaxia.
Investigaciones: aumento de bilirrubina, disminución de peso, prolongación del intervalo QT en el electrocardiograma, aumento de las enzimas hepáticas, hipercolesterolemia, aumento del INR, disminución de la protrombina.
Trastornos del metabolismo y la nutrición: hiperglucemia, hipoglucemia, hipopotasemia, hiponatremia.
Trastornos musculoesqueléticos y del tejido conjuntivo: calambres musculares, rigidez muscular, debilidad muscular, rabdomiolisis.
Trastornos del sistema nervioso: acatisia, amnesia, ataxia, coreoatetosis, accidente cerebrovascular, disartria, discinesia, distonía, trastornos extrapiramidales, ataques de gran mal (o convulsiones), hipoestesia, mioclonías, nistagmo, parkinsonismo, piernas inquietas, convulsiones, síncope, discinesia tardía, temblor.
Embarazo, Puerperio y Condiciones Perinatales: aborto espontáneo.
Desórdenes psiquiátricos: psicosis aguda, agresión, agitación, ira, ansiedad, apatía, suicidio consumado, confusión, despersonalización, depresión agravada, delirio, engaño, desorientación, sensación de irrealidad, alucinaciones (visuales y auditivas), cambios de humor, nerviosismo, pesadilla, reacción de pánico, paranoia , inquietud, autolesión o pensamientos de autolesión, intento de suicidio, ideación suicida, tendencia suicida.
Trastornos renales y urinarios: insuficiencia renal aguda, disuria, retención urinaria.
Trastornos del sistema reproductivo y de la mama: menorragia, priapismo.
Trastornos respiratorios, torácicos y mediastínicos: disnea, epistaxis, embolismo pulmonar, hipertensión pulmonar del recién nacido. Trastornos de la piel y del tejido subcutáneo: alopecia, angioedema, dermatitis, equimosis, eritema multiforme, reacción de fotosensibilidad, síndrome de Stevens Johnson, necrólisis epidérmica tóxica, urticaria.
Trastornos vasculares: trombosis venosa profunda, sofocos, crisis hipertensiva, hipotensión, hipotensión ortostática, flebitis, trombosis.
INTERACCIONES CON LA DROGAS
Inhibidores de la monoaminooxidasa (IMAO)
[Ver DOSIFICACIÓN Y ADMINISTRACIÓN y , CONTRAINDICACIONES y ADVERTENCIAS Y PRECAUCIONES ].
Fármacos serotoninérgicos
[Ver DOSIFICACIÓN Y ADMINISTRACIÓN y , CONTRAINDICACIONES y ADVERTENCIAS Y PRECAUCIONES ].
triptanos
Ha habido raros informes posteriores a la comercialización del síndrome serotoninérgico con el uso de un ISRS y un triptán. Si el tratamiento concomitante de Lexapro 10 mg con un triptán está clínicamente justificado, se recomienda una cuidadosa observación del paciente, particularmente durante el inicio del tratamiento y los aumentos de dosis [ver ADVERTENCIAS Y PRECAUCIONES ].
Fármacos del SNC
Dados los efectos primarios del escitalopram sobre el SNC, se debe tener precaución cuando se toma en combinación con otros medicamentos de acción central.
Alcohol
Aunque Lexapro no potenció los efectos cognitivos y motores del alcohol en un ensayo clínico, al igual que con otros medicamentos psicotrópicos, no se recomienda el consumo de alcohol por parte de los pacientes que toman Lexapro.
Fármacos que interfieren con la hemostasia (AINE, aspirina, warfarina, etc.)
La liberación de serotonina por las plaquetas juega un papel importante en la hemostasia. Los estudios epidemiológicos de diseño de cohortes y de casos y controles que han demostrado una asociación entre el uso de fármacos psicotrópicos que interfieren con la recaptación de serotonina y la aparición de hemorragia digestiva alta también han demostrado que el uso concomitante de un AINE o aspirina puede potenciar el riesgo de hemorragia. Se han informado efectos anticoagulantes alterados, incluido un aumento del sangrado, cuando se coadministran ISRS e IRSN con warfarina. Los pacientes que reciben terapia con warfarina deben ser monitoreados cuidadosamente cuando se inicia o interrumpe Lexapro.
cimetidina
En sujetos que habían recibido 21 días de 40 mg/día de citalopram racémico, la administración combinada de 400 mg dos veces al día de cimetidina durante 8 días dio como resultado un aumento en el AUC y la Cmax de citalopram del 43 % y el 39 %, respectivamente. Se desconoce el significado clínico de estos hallazgos.
Digoxina
En sujetos que habían recibido 21 días de 40 mg/día de citalopram racémico, la administración combinada de citalopram y digoxina (dosis única de 1 mg) no afectó significativamente la farmacocinética de citalopram o digoxina.
Litio
La coadministración de citalopram racémico (40 mg/día durante 10 días) y litio (30 mmol/día durante 5 días) no tuvo un efecto significativo sobre la farmacocinética de citalopram o litio. No obstante, los niveles de litio en plasma deben controlarse con el ajuste apropiado de la dosis de litio de acuerdo con la práctica clínica estándar. Debido a que el litio puede potenciar los efectos serotoninérgicos del escitalopram, se debe tener precaución cuando se coadministren Lexapro 5 mg y litio.
Pimozida y Celexa
En un estudio controlado, una dosis única de 2 mg de pimozida coadministrada con 40 mg de citalopram racémico una vez al día durante 11 días se asoció con un aumento medio en los valores de QTc de aproximadamente 10 ms en comparación con la pimozida administrada sola. El citalopram racémico no alteró el AUC medio ni la Cmax de la pimozida. Se desconoce el mecanismo de esta interacción farmacodinámica.
sumatriptán
Ha habido informes posteriores a la comercialización raros que describen pacientes con debilidad, hiperreflexia y falta de coordinación después del uso de un ISRS y sumatriptán. Si el tratamiento concomitante con sumatriptán y un ISRS (p. ej., fluoxetina, fluvoxamina, paroxetina, sertralina, citalopram, escitalopram) está clínicamente justificado, se recomienda la observación adecuada del paciente.
teofilina
La administración combinada de citalopram racémico (40 mg/día durante 21 días) y el sustrato CYP1A2 teofilina (dosis única de 300 mg) no afectó la farmacocinética de la teofilina. No se evaluó el efecto de la teofilina sobre la farmacocinética del citalopram.
warfarina
La administración de 40 mg/día de citalopram racémico durante 21 días no afectó la farmacocinética de la warfarina, un sustrato del CYP3A4. El tiempo de protrombina se incrementó en un 5%, cuyo significado clínico se desconoce.
Carbamazepina
La administración combinada de citalopram racémico (40 mg/día durante 14 días) y carbamazepina (titulada a 400 mg/día durante 35 días) no afectó significativamente la farmacocinética de carbamazepina, un sustrato de CYP3A4. Aunque los niveles mínimos de citalopram en plasma no se vieron afectados, dadas las propiedades inductoras de enzimas de la carbamazepina, se debe considerar la posibilidad de que la carbamazepina pueda aumentar el aclaramiento de escitalopram si los dos fármacos se administran conjuntamente.
triazolam
La administración combinada de citalopram racémico (ajustado a 40 mg/día durante 28 días) y el sustrato CYP3A4 triazolam (dosis única de 0,25 mg) no afectó significativamente la farmacocinética de citalopram o triazolam.
ketoconazol
La administración combinada de citalopram racémico (40 mg) y ketoconazol (200 mg), un potente inhibidor de CYP3A4, disminuyó la Cmax y el AUC de ketoconazol en un 21 % y un 10 %, respectivamente, y no afectó significativamente la farmacocinética de citalopram.
ritonavir
La administración combinada de una dosis única de ritonavir (600 mg), un sustrato de CYP3A4 y un potente inhibidor de CYP3A4, y escitalopram (20 mg) no afectó la farmacocinética de ritonavir o escitalopram.
Inhibidores de CYP3A4 y -2C19
Los estudios in vitro indicaron que CYP3A4 y -2C19 son las principales enzimas involucradas en el metabolismo de escitalopram. Sin embargo, la coadministración de escitalopram (20 mg) y ritonavir (600 mg), un potente inhibidor de CYP3A4, no afectó significativamente la farmacocinética de escitalopram. Debido a que el escitalopram es metabolizado por múltiples sistemas enzimáticos, la inhibición de una sola enzima puede no disminuir apreciablemente el aclaramiento de escitalopram.
Fármacos metabolizados por el citocromo P4502D6
Los estudios in vitro no revelaron un efecto inhibitorio de escitalopram sobre CYP2D6. Además, los niveles de estado estacionario de citalopram racémico no fueron significativamente diferentes en los metabolizadores lentos y los metabolizadores rápidos de CYP2D6 después de la administración de dosis múltiples de citalopram, lo que sugiere que es poco probable que la coadministración con escitalopram de un fármaco que inhibe CYP2D6 tenga efectos clínicamente significativos sobre metabolismo del escitalopram. Sin embargo, hay datos in vivo limitados que sugieren un efecto inhibidor modesto de CYP2D6 para escitalopram, es decir, la coadministración de escitalopram (20 mg/día durante 21 días) con el antidepresivo tricíclico desipramina (dosis única de 50 mg), un sustrato para CYP2D6, resultó en un aumento del 40 % en la Cmax y un aumento del 100 % en el AUC de la desipramina. La importancia clínica de este hallazgo es desconocida. No obstante, se recomienda precaución en la coadministración de escitalopram y fármacos metabolizados por CYP2D6.
metoprolol
La administración de 20 mg/día de Lexapro 20 mg durante 21 días en voluntarios sanos resultó en un aumento del 50 % en la Cmax y un aumento del 82 % en el AUC del bloqueador beta-adrenérgico metoprolol (administrado en una dosis única de 100 mg). El aumento de los niveles plasmáticos de metoprolol se ha asociado con una disminución de la cardioselectividad. La coadministración de Lexapro 5 mg y metoprolol no tuvo efectos clínicamente significativos sobre la presión arterial o la frecuencia cardíaca.
Terapia Electroconvulsiva (TEC)
No hay estudios clínicos del uso combinado de TEC y escitalopram.
Abuso y dependencia de drogas
abuso y dependencia
Dependencia Física y Psicológica
Los estudios en animales sugieren que el riesgo de abuso de citalopram racémico es bajo. Lexapro 10 mg no se ha estudiado sistemáticamente en humanos por su potencial de abuso, tolerancia o dependencia física. La experiencia clínica previa a la comercialización con Lexapro no reveló ningún comportamiento de búsqueda del fármaco. Sin embargo, estas observaciones no fueron sistemáticas y, sobre la base de esta experiencia limitada, no es posible predecir hasta qué punto se utilizará indebidamente, se desviará o se abusará de un fármaco activo en el SNC una vez comercializado. En consecuencia, los médicos deben evaluar cuidadosamente a los pacientes con Lexapro en busca de antecedentes de abuso de drogas y seguir de cerca a dichos pacientes, observándolos en busca de signos de uso indebido o abuso (p. ej., desarrollo de tolerancia, incrementos de dosis, comportamiento de búsqueda de drogas).
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Pensamientos y comportamientos suicidas en adolescentes y adultos jóvenes
En análisis combinados de ensayos controlados con placebo de medicamentos antidepresivos (ISRS y otras clases de antidepresivos) que incluyeron aproximadamente 77 000 pacientes adultos y 4500 pacientes pediátricos, la incidencia de pensamientos y conductas suicidas en los pacientes tratados con antidepresivos de 24 años o menos fue mayor que en pacientes tratados con placebo. Hubo una variación considerable en el riesgo de pensamientos y comportamientos suicidas entre los medicamentos, pero se identificó un mayor riesgo en pacientes jóvenes para la mayoría de los medicamentos estudiados. Hubo diferencias en el riesgo absoluto de pensamientos y comportamientos suicidas entre las diferentes indicaciones, con la mayor incidencia en pacientes con TDM. Las diferencias fármaco-placebo en el número de casos de pensamientos y comportamientos suicidas por cada 1000 pacientes tratados se proporcionan en
Se desconoce si el riesgo de pensamientos y comportamientos suicidas en niños, adolescentes y adultos jóvenes se extiende al uso a largo plazo, es decir, más allá de los cuatro meses. Sin embargo, existe evidencia sustancial de ensayos de mantenimiento controlados con placebo en adultos con MDD de que los antidepresivos retrasan la recurrencia de la depresión y que la depresión en sí misma es un factor de riesgo de pensamientos y comportamientos suicidas.
Supervise a todos los pacientes tratados con antidepresivos en busca de cualquier indicación de empeoramiento clínico y aparición de pensamientos y comportamientos suicidas, especialmente durante los primeros meses de la terapia con medicamentos y en momentos de cambios de dosis. Aconseje a los familiares o cuidadores de los pacientes que controlen los cambios en el comportamiento y alerten al proveedor de atención médica. Considere cambiar el régimen terapéutico, incluida la posibilidad de suspender Lexapro, en pacientes cuya depresión empeora persistentemente o que experimentan pensamientos o conductas suicidas emergentes.
Síndrome de serotonina
Se ha notificado el desarrollo de un síndrome serotoninérgico potencialmente mortal con IRSN e ISRS, incluido Lexapro, solo, pero especialmente con el uso concomitante de otros fármacos serotoninérgicos (incluidos triptanos, antidepresivos tricíclicos, fentanilo, litio, tramadol, triptófano, buspirona, anfetaminas, y la hierba de San Juan) y con fármacos que alteran el metabolismo de la serotonina (en particular, los IMAO, tanto los destinados al tratamiento de trastornos psiquiátricos como otros, como linezolid y azul de metileno intravenoso).
Los síntomas del síndrome serotoninérgico pueden incluir cambios en el estado mental (p. ej., agitación, alucinaciones, delirio y coma), inestabilidad autonómica (p. ej., taquicardia, presión arterial lábil, mareos, diaforesis, sofocos, hipertermia), síntomas neuromusculares (p. ej., temblor, rigidez, mioclono, hiperreflexia, falta de coordinación) convulsiones y/o síntomas gastrointestinales (p. ej., náuseas, vómitos, diarrea). Los pacientes deben ser monitoreados por la aparición del síndrome serotoninérgico.
Está contraindicado el uso concomitante de Lexapro 10 mg con IMAO destinados a tratar trastornos psiquiátricos. Lexapro 5 mg tampoco debe iniciarse en un paciente que está siendo tratado con IMAO como linezolid o azul de metileno intravenoso. Todos los informes con azul de metileno que proporcionaron información sobre la vía de administración involucraron la administración intravenosa en el rango de dosis de 1 mg/kg a 8 mg/kg. Ningún informe involucró la administración de azul de metileno por otras vías (como tabletas orales o inyección local en tejido) o en dosis más bajas. Puede haber circunstancias en las que sea necesario iniciar el tratamiento con un IMAO como linezolid o azul de metileno intravenoso en un paciente que toma Lexapro. Lexapro debe interrumpirse antes de iniciar el tratamiento con el IMAO [ver CONTRAINDICACIONES y DOSIFICACIÓN Y ADMINISTRACIÓN ].
Si se justifica clínicamente el uso concomitante de Lexapro 5 mg con otros medicamentos serotoninérgicos, incluidos triptanos, antidepresivos tricíclicos, fentanilo, litio, tramadol, buspirona, triptófano, anfetamina y hierba de San Juan, se debe informar a los pacientes sobre un posible aumento del riesgo de síndrome serotoninérgico. , particularmente durante el inicio del tratamiento y los aumentos de dosis.
El tratamiento con Lexapro y cualquier agente serotoninérgico concomitante debe suspenderse inmediatamente si se presentan los eventos anteriores y debe iniciarse un tratamiento sintomático de apoyo.
Interrupción del tratamiento con Lexapro
Durante la comercialización de Lexapro y otros ISRS e IRSN (inhibidores de la recaptación de serotonina y norepinefrina), ha habido informes espontáneos de eventos adversos que ocurren tras la interrupción de estos medicamentos, en particular cuando es abrupto, incluidos los siguientes: estado de ánimo disfórico, irritabilidad, agitación, mareos, trastornos sensoriales. alteraciones (p. ej., parestesias tales como sensaciones de choque eléctrico), ansiedad, confusión, dolor de cabeza, letargo, labilidad emocional, insomnio e hipomanía. Si bien estos eventos generalmente son autolimitados, ha habido informes de síntomas graves de interrupción.
Se debe controlar a los pacientes para detectar estos síntomas cuando suspendan el tratamiento con Lexapro. Siempre que sea posible, se recomienda una reducción gradual de la dosis en lugar de una interrupción brusca. Si aparecen síntomas intolerables tras una disminución de la dosis o tras la interrupción del tratamiento, se puede considerar la reanudación de la dosis prescrita anteriormente. Posteriormente, el médico puede continuar disminuyendo la dosis pero a un ritmo más gradual [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
convulsiones
Aunque se han observado efectos anticonvulsivos del citalopram racémico en estudios con animales, Lexapro no se ha evaluado sistemáticamente en pacientes con un trastorno convulsivo. Estos pacientes fueron excluidos de los estudios clínicos durante las pruebas previas a la comercialización del producto. En ensayos clínicos de Lexapro 5 mg, se han notificado casos de convulsiones en asociación con el tratamiento con Lexapro. Al igual que otros medicamentos efectivos en el tratamiento del trastorno depresivo mayor, Lexapro 20 mg debe administrarse con precaución en pacientes con antecedentes de trastorno convulsivo.
Activación de manía o hipomanía
En pacientes con trastorno bipolar, el tratamiento de un episodio depresivo con Lexapro u otro antidepresivo puede precipitar un episodio mixto/maníaco. En ensayos controlados con placebo de Lexapro 20 mg en el trastorno depresivo mayor, se notificó activación de manía/hipomanía en uno (0,1 %) de 715 pacientes tratados con Lexapro 20 mg y en ninguno de los 592 pacientes tratados con placebo. Se informó un caso adicional de hipomanía en asociación con el tratamiento con Lexapro 10 mg. También se ha notificado la activación de manía/hipomanía en una pequeña proporción de pacientes con trastornos afectivos mayores tratados con citalopram racémico y otros fármacos comercializados eficaces en el tratamiento del trastorno depresivo mayor. Antes de iniciar el tratamiento con Lexapro, evalúe a los pacientes para detectar antecedentes personales o familiares de trastorno bipolar, manía o hipomanía [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
hiponatremia
La hiponatremia puede ocurrir como resultado del tratamiento con ISRS e IRSN, incluido Lexapro. En muchos casos, esta hiponatremia parece ser el resultado del síndrome de secreción inadecuada de hormona antidiurética (SIADH), y fue reversible cuando se suspendió Lexapro 20 mg. Se han notificado casos con sodio sérico inferior a 110 mmol/L. Los pacientes de edad avanzada pueden tener un mayor riesgo de desarrollar hiponatremia con los ISRS y los IRSN. Además, los pacientes que toman diuréticos o que tienen depleción de volumen pueden tener un mayor riesgo [ver Uso geriátrico ]. Se debe considerar la interrupción de Lexapro en pacientes con hiponatremia sintomática y se debe instituir la intervención médica adecuada.
Los signos y síntomas de la hiponatremia incluyen dolor de cabeza, dificultad para concentrarse, deterioro de la memoria, confusión, debilidad e inestabilidad, lo que puede provocar caídas. Los signos y síntomas asociados con casos más graves y/o agudos incluyen alucinaciones, síncope, convulsiones, coma, paro respiratorio y muerte.
Sangrado anormal
Los ISRS y los IRSN, incluido Lexapro 20 mg, pueden aumentar el riesgo de eventos hemorrágicos. El uso concomitante de aspirina, medicamentos antiinflamatorios no esteroideos, warfarina y otros anticoagulantes puede aumentar el riesgo. Informes de casos y estudios epidemiológicos (casos y controles y diseño de cohortes) han demostrado una asociación entre el uso de fármacos que interfieren con la recaptación de serotonina y la aparición de hemorragia gastrointestinal. Los episodios hemorrágicos relacionados con el uso de ISRS e IRSN van desde equimosis, hematomas, epistaxis y petequias hasta hemorragias potencialmente mortales.
Se debe advertir a los pacientes sobre el riesgo de sangrado asociado con el uso concomitante de Lexapro 20 mg y AINE, aspirina u otros medicamentos que afectan la coagulación.
Interferencia con el rendimiento cognitivo y motor
En un estudio en voluntarios normales, Lexapro 10 mg/día no produjo deterioro de la función intelectual ni del rendimiento psicomotor. Sin embargo, debido a que cualquier droga psicoactiva puede afectar el juicio, el pensamiento o las habilidades motoras, se debe advertir a los pacientes sobre el manejo de maquinaria peligrosa, incluidos los automóviles, hasta que estén razonablemente seguros de que la terapia con Lexapro no afecta su capacidad para participar en tales actividades.
Glaucoma de ángulo cerrado
Glaucoma de ángulo cerrado: la dilatación pupilar que ocurre después del uso de muchos medicamentos antidepresivos, incluido Lexapro 20 mg, puede desencadenar un ataque de ángulo cerrado en un paciente con ángulos anatómicamente estrechos que no tienen una iridectomía permeable.
Uso en pacientes con enfermedades concomitantes
La experiencia clínica con Lexapro en pacientes con ciertas enfermedades sistémicas concomitantes es limitada. Se recomienda precaución al usar Lexapro 5 mg en pacientes con enfermedades o condiciones que produzcan alteraciones del metabolismo o respuestas hemodinámicas.
Lexapro no ha sido evaluado sistemáticamente en pacientes con antecedentes recientes de infarto de miocardio o enfermedad cardíaca inestable. Los pacientes con estos diagnósticos generalmente fueron excluidos de los estudios clínicos durante las pruebas previas a la comercialización del producto.
En sujetos con insuficiencia hepática, el aclaramiento de citalopram racémico disminuyó y las concentraciones plasmáticas aumentaron. La dosis recomendada de Lexapro en pacientes con insuficiencia hepática es de 10 mg/día [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Debido a que el escitalopram se metaboliza extensamente, la excreción del fármaco inalterado en la orina es una vía de eliminación menor. Sin embargo, hasta que se evalúe un número adecuado de pacientes con insuficiencia renal grave durante el tratamiento crónico con Lexapro 20 mg, debe usarse con precaución en dichos pacientes [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Disfunción sexual
El uso de ISRS, incluido Lexapro, puede causar síntomas de disfunción sexual [ver REACCIONES ADVERSAS ]. En pacientes masculinos, el uso de ISRS puede provocar retraso o falla en la eyaculación, disminución de la libido y disfunción eréctil. En pacientes femeninas, el uso de ISRS puede provocar una disminución de la libido y un orgasmo retrasado o ausente.
Es importante que los prescriptores averigüen sobre la función sexual antes de iniciar Lexapro y que averigüen específicamente sobre los cambios en la función sexual durante el tratamiento, ya que es posible que la función sexual no se informe espontáneamente. Cuando se evalúan los cambios en la función sexual, es importante obtener una historia clínica detallada (que incluya el momento del inicio de los síntomas) porque los síntomas sexuales pueden tener otras causas, incluido el trastorno psiquiátrico subyacente. Discutir posibles estrategias de manejo para ayudar a los pacientes a tomar decisiones informadas sobre el tratamiento.
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( Guía de medicamentos ).
Pensamientos y comportamientos suicidas
Aconseje a los pacientes, sus familias y cuidadores que estén atentos a la aparición de ideas y comportamientos suicidas, especialmente durante el tratamiento y cuando la dosis se ajuste hacia arriba o hacia abajo, e indíqueles que informen dichos síntomas a su proveedor de atención médica [ver CUADRO DE ADVERTENCIA y ADVERTENCIAS Y PRECAUCIONES ].
Síndrome de serotonina
Se debe advertir a los pacientes sobre el riesgo de síndrome serotoninérgico con el uso concomitante de Lexapro con otros medicamentos serotoninérgicos, incluidos triptanos, antidepresivos tricíclicos, fentanilo, litio, tramadol, triptófano, buspirona, anfetaminas y hierba de San Juan, y con medicamentos que alteran el metabolismo de serotonina (en particular, los IMAO, tanto los destinados a tratar trastornos psiquiátricos como otros, como la linezolida) [ver ADVERTENCIAS Y PRECAUCIONES ].
Activación de manía o hipomanía
Aconseje a los pacientes y a sus cuidadores que observen signos de activación de manía/hipomanía e indíqueles que informen dichos síntomas al proveedor de atención médica [ver ADVERTENCIAS Y PRECAUCIONES ].
Sangrado anormal
Se debe advertir a los pacientes sobre el uso concomitante de Lexapro 5 mg y AINE, aspirina, warfarina u otros medicamentos que afectan la coagulación, ya que el uso combinado de medicamentos psicotrópicos que interfieren con la recaptación de serotonina y estos agentes se ha asociado con un mayor riesgo de hemorragia [ver ADVERTENCIAS Y PRECAUCIONES ].
Glaucoma de ángulo cerrado
Se debe advertir a los pacientes que tomar Lexapro 5 mg puede causar dilatación pupilar leve, lo que en personas susceptibles puede provocar un episodio de glaucoma de ángulo cerrado. El glaucoma preexistente casi siempre es glaucoma de ángulo abierto porque el glaucoma de ángulo cerrado, cuando se diagnostica, se puede tratar definitivamente con iridectomía. El glaucoma de ángulo abierto no es un factor de riesgo para el glaucoma de ángulo cerrado. Es posible que los pacientes deseen ser examinados para determinar si son susceptibles al cierre angular y someterse a un procedimiento profiláctico (p. ej., iridectomía), si son susceptibles [ver ADVERTENCIAS Y PRECAUCIONES ].
Disfunción sexual
Advierta a los pacientes que el uso de Lexapro puede causar síntomas de disfunción sexual tanto en pacientes masculinos como femeninos. Informe a los pacientes que deben discutir cualquier cambio en la función sexual y las posibles estrategias de manejo con su proveedor de atención médica [ver ADVERTENCIAS Y PRECAUCIONES ].
Medicaciones concomitantes
Dado que el escitalopram es el isómero activo del citalopram racémico (Celexa), los dos agentes no deben administrarse conjuntamente. Se debe recomendar a los pacientes que informen a su médico si están tomando, o planean tomar, cualquier medicamento recetado o de venta libre, ya que existe la posibilidad de interacciones.
Continuación de la terapia prescrita
Si bien los pacientes pueden notar una mejoría con la terapia con Lexapro 10 mg en 1 a 4 semanas, se les debe recomendar que continúen la terapia según las indicaciones.
Interferencia con el rendimiento psicomotor
Debido a que las drogas psicoactivas pueden afectar el juicio, el pensamiento o las habilidades motoras, se debe advertir a los pacientes sobre el manejo de maquinaria peligrosa, incluidos los automóviles, hasta que estén razonablemente seguros de que la terapia con Lexapro no afecta su capacidad para participar en tales actividades.
Alcohol
Se debe informar a los pacientes que, aunque en experimentos con sujetos normales no se ha demostrado que Lexapro 5 mg aumente las deficiencias mentales y motoras causadas por el alcohol, no se recomienda el uso concomitante de Lexapro 20 mg y alcohol en pacientes deprimidos.
El embarazo
Aconseje a las mujeres embarazadas que notifiquen a sus proveedores de atención médica si quedan embarazadas o tienen la intención de quedar embarazadas durante el tratamiento con LEXAPRO. Advierta a los pacientes que el uso de 10 mg de LEXAPRO más adelante en el embarazo puede aumentar el riesgo de complicaciones neonatales que requieran hospitalización prolongada, soporte respiratorio, alimentación por sonda y/o hipertensión pulmonar persistente (HPPRN) del recién nacido [ver Uso en poblaciones específicas ].
Informe a las mujeres que existe un registro de exposición durante el embarazo que monitorea los resultados del embarazo en mujeres expuestas a LEXAPRO durante el embarazo [ver Uso en poblaciones específicas ].
Lactancia
Aconseje a las mujeres que amamantan que usan LEXAPRO que vigilen a los bebés en busca de exceso de sedación, inquietud, agitación, mala alimentación y poco aumento de peso y que busquen atención médica si notan estos signos [ver Uso en poblaciones específicas ].
Necesidad de un programa de tratamiento integral
Lexapro 20 mg está indicado como parte integral de un programa de tratamiento total para MDD que puede incluir otras medidas (psicológicas, educativas, sociales) para pacientes con este síndrome. El tratamiento farmacológico puede no estar indicado para todos los adolescentes con este síndrome. No se ha establecido la seguridad y eficacia de Lexapro 10 mg en MDD en pacientes pediátricos menores de 12 años. Los antidepresivos no están destinados para su uso en adolescentes que presenten síntomas secundarios a factores ambientales y/u otros trastornos psiquiátricos primarios. La ubicación educativa adecuada es esencial y la intervención psicosocial suele ser útil. Cuando las medidas correctivas por sí solas son insuficientes, la decisión de prescribir medicación antidepresiva dependerá de la evaluación del médico sobre la cronicidad y gravedad de los síntomas del paciente.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Carcinogénesis
Se administró citalopram racémico en la dieta a ratones de la cepa NMRI/BOM y ratas de la cepa COBS WI durante 18 y 24 meses, respectivamente. No hubo evidencia de carcinogenicidad del citalopram racémico en ratones que recibieron hasta 240 mg/kg/día. Hubo una mayor incidencia de carcinoma de intestino delgado en ratas que recibieron 8 o 24 mg/kg/día de citalopram racémico. No se estableció una dosis sin efecto para este hallazgo. Se desconoce la relevancia de estos hallazgos para los humanos.
mutagénesis
El citalopram racémico fue mutagénico en el ensayo de mutación inversa bacteriana in vitro (prueba de Ames) en 2 de 5 cepas bacterianas (Salmonella TA98 y TA1537) en ausencia de activación metabólica. Fue clastogénico en el ensayo in vitro de células de pulmón de hámster chino para detectar aberraciones cromosómicas en presencia y ausencia de activación metabólica. El citalopram racémico no fue mutagénico en el ensayo de mutación genética directa de mamíferos (HPRT) in vitro en células de linfoma de ratón o en un ensayo de síntesis de ADN no programada (UDS) in vitro/in vivo acoplado en hígado de rata. No fue clastogénico en el ensayo de aberración cromosómica in vitro en linfocitos humanos o en dos ensayos de micronúcleo de ratón in vivo.
Deterioro de la fertilidad
Cuando se administró citalopram racémico por vía oral a 16 ratas macho y 24 hembras antes y durante el apareamiento y la gestación en dosis de 32, 48 y 72 mg/kg/día, el apareamiento disminuyó en todas las dosis y la fertilidad disminuyó en dosis ≥ 32 mg/kg/día. La duración de la gestación se incrementó a 48 mg/kg/día.
Uso en poblaciones específicas
El embarazo
Registro de exposición durante el embarazo
Existe un registro de exposición durante el embarazo que monitorea los resultados del embarazo en mujeres expuestas a antidepresivos durante el embarazo. Se alienta a los proveedores de atención médica a registrar pacientes llamando al Registro Nacional de Embarazo para Antidepresivos al 1-844-405-6185 o visitando en línea en https://womensmentalhealth.org/clnical-and-research-programs/pregnancyregistry/antidepressants/
Resumen de riesgos
Los datos disponibles de los estudios epidemiológicos publicados y los informes posteriores a la comercialización no han establecido un mayor riesgo de defectos congénitos importantes o abortos espontáneos. Existen riesgos de hipertensión pulmonar persistente del recién nacido (HPPRN) (ver Datos ) y pobre adaptación neonatal (ver Consideraciones clínicas ) con exposición a inhibidores selectivos de la recaptación de serotonina (ISRS), incluido LEXAPRO 5 mg, durante el embarazo. Existen riesgos asociados con la depresión no tratada durante el embarazo (ver Consideraciones clínicas ).
En estudios de reproducción en animales, se ha demostrado que tanto el escitalopram como el citalopram racémico tienen efectos adversos sobre el desarrollo embrionario/fetal y posnatal, incluidas anomalías estructurales fetales, cuando se administran en dosis superiores a las dosis terapéuticas en humanos (ver Datos ).
Se desconoce el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo para la población indicada. Todos los embarazos tienen un riesgo de fondo de defecto congénito, pérdida u otros resultados adversos. En la población general de los EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en los embarazos clínicamente reconocidos es del 2 al 4 % y del 15 al 20 %, respectivamente.
Consideraciones clínicas
Riesgo materno asociado a la enfermedad y/o riesgo embrionario/fetal
Las mujeres que suspenden los antidepresivos tienen más probabilidades de experimentar una recaída de depresión mayor que las mujeres que continúan con los antidepresivos. Este hallazgo proviene de un estudio longitudinal prospectivo de 201 mujeres embarazadas con antecedentes de depresión mayor, que eran eutímicas y tomaban antidepresivos al comienzo del embarazo. Considere el riesgo de depresión no tratada al suspender o cambiar el tratamiento con medicamentos antidepresivos durante el embarazo y el posparto.
Reacciones adversas fetales/neonatales
Los recién nacidos expuestos a ISRS o IRSN, incluido Lexapro 5 mg, al final del tercer trimestre han desarrollado complicaciones que requieren hospitalización prolongada, soporte respiratorio y alimentación por sonda. Tales complicaciones pueden surgir inmediatamente después del parto. Los hallazgos clínicos informados incluyen dificultad respiratoria, cianosis, apnea, convulsiones, inestabilidad de la temperatura, dificultad para alimentarse, vómitos, hipoglucemia, hipotonía, hipertonía, hiperreflexia, temblor, nerviosismo, irritabilidad y llanto constante. Estas características concuerdan con un efecto tóxico directo de los ISRS y los IRSN o, posiblemente, con un síndrome de interrupción del fármaco. Cabe señalar que, en algunos casos, el cuadro clínico es compatible con el síndrome serotoninérgico [ver ADVERTENCIAS Y PRECAUCIONES ].
Datos
Datos humanos
La exposición a los ISRS, particularmente en una etapa posterior del embarazo, puede aumentar el riesgo de HPPRN. La HPPRN ocurre en 1 a 2 de cada 1000 nacidos vivos en la población general y se asocia con una morbilidad y mortalidad neonatal sustancial.
Datos de animales
En un estudio de desarrollo embrionario/fetal en ratas, la administración oral de escitalopram (56, 112 o 150 mg/kg/día) a animales preñados durante el período de organogénesis resultó en una disminución del peso corporal fetal y retrasos asociados en la osificación en las dos dosis más altas. [aproximadamente ≥ 55 veces la dosis humana máxima recomendada (DMRH) de 20 mg/día sobre una base de mg/m2]. La toxicidad materna (signos clínicos y disminución del aumento de peso corporal y del consumo de alimentos), leve a 56 mg/kg/día, estuvo presente en todos los niveles de dosis. La dosis sin efecto de desarrollo de 56 mg/kg/día es aproximadamente 27 veces la MRHD de 20 mg sobre una base de mg/m2. No se observaron malformaciones en ninguna de las dosis probadas (hasta 73 veces la MRHD en base a mg/m2).
Cuando se trató a ratas hembra con escitalopram (6, 12, 24 o 48 mg/kg/día) durante el embarazo y hasta el destete, se observó un ligero aumento de la mortalidad de las crías y retraso del crecimiento con 48 mg/kg/día, que es aproximadamente 23 veces el MRHD de 20 mg sobre una base de mg/m2. Se observó una ligera toxicidad materna (signos clínicos y disminución del aumento de peso corporal y del consumo de alimentos) con esta dosis. También se observó un ligero aumento de la mortalidad de las crías con 24 mg/kg/día. La dosis sin efecto fue de 12 mg/kg/día, que es aproximadamente 6 veces la MRHD de 20 mg sobre una base de mg/m2.
En dos estudios de desarrollo embrionario/fetal en ratas, la administración oral de citalopram racémico (32, 56 o 112 mg/kg/día) a animales preñados durante el período de organogénesis resultó en una disminución del crecimiento y la supervivencia embrionario/fetal y una mayor incidencia de muerte fetal. anormalidades (incluyendo defectos cardiovasculares y esqueléticos) a la dosis alta, que es aproximadamente 18 veces la MRHD de 60 mg/día sobre una base de mg/m2. Esta dosis también se asoció con toxicidad materna (signos clínicos, disminución del aumento de peso corporal). La dosis sin efectos en el desarrollo fue de 56 mg/kg/día, aproximadamente 9 veces la MRHD en base a mg/m2. En un estudio con conejos, no se observaron efectos adversos en el desarrollo embrionario/fetal con dosis de citalopram racémico de hasta 16 mg/kg/día, o aproximadamente 5 veces la MRHD sobre una base de mg/m2. Por lo tanto, los efectos de desarrollo del citalopram racémico se observaron en una dosis tóxica para la madre en la rata y no se observaron en el conejo.
Cuando se trató a ratas hembras con citalopram racémico (4,8, 12,8 o 32 mg/kg/día) desde la gestación tardía hasta el destete, se observó un aumento de la mortalidad de las crías durante los primeros 4 días después del nacimiento y un retraso persistente del crecimiento de las crías con la dosis más alta, lo que es aproximadamente 5 veces la MRHD de 60 mg sobre una base de mg/m2. La dosis sin efecto fue de 12,8 mg/kg/día, que es aproximadamente 2 veces la MRHD en base a mg/m2. Se observaron efectos similares sobre la mortalidad y el crecimiento de las crías cuando las madres fueron tratadas durante la gestación y la lactancia temprana en dosis ≥ 24 mg/kg/día, aproximadamente 4 veces la MRHD en base a mg/m2. En ese estudio no se determinó una dosis sin efecto.
Lactancia
Resumen de riesgos
Los datos de la literatura publicada informan la presencia de escitalopram y desmetilescitalopram en la leche humana (ver Datos ). Hay informes de sedación excesiva, inquietud, agitación, mala alimentación y escaso aumento de peso en lactantes expuestos a escitalopram, a través de la leche materna (ver Consideraciones clínicas ),. No hay datos sobre los efectos de escitalopram o sus metabolitos en la producción de leche. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de la madre de LEXAPRO 5 mg y cualquier posible efecto adverso en el niño amamantado debido a LEXAPRO o a la afección materna subyacente.
Consideraciones clínicas
Los bebés expuestos a LEXAPRO 20 mg deben ser monitoreados por exceso de sedación, inquietud, agitación, mala alimentación y escaso aumento de peso.
Datos
Un estudio de 8 madres lactantes que tomaban escitalopram con dosis diarias de 10-20 mg/día mostró que los lactantes alimentados exclusivamente con leche materna reciben aproximadamente el 3,9 % de la dosis materna de escitalopram ajustada al peso y el 1,7 % de la dosis materna ajustada al peso de desmetilcitalopram .
Uso pediátrico
Se ha establecido la seguridad y eficacia de Lexapro 10 mg en adolescentes (12 a 17 años de edad) para el tratamiento del trastorno depresivo mayor [ver Estudios clínicos ]. Aunque la eficacia de mantenimiento en pacientes adolescentes con trastorno depresivo mayor no ha sido evaluada sistemáticamente, la eficacia de mantenimiento puede extrapolarse a partir de datos de adultos junto con comparaciones de parámetros farmacocinéticos de escitalopram en pacientes adultos y adolescentes.
No se ha establecido la seguridad y eficacia de Lexapro en pacientes pediátricos (menores de 12 años) con trastorno depresivo mayor. En un estudio de seguridad abierto de 24 semanas en 118 niños (de 7 a 11 años de edad) que tenían un trastorno depresivo mayor, los hallazgos de seguridad fueron consistentes con el perfil conocido de seguridad y tolerabilidad de Lexapro.
No se ha establecido la seguridad y eficacia de Lexapro en pacientes pediátricos menores de 18 años con trastorno de ansiedad generalizada.
Se ha observado disminución del apetito y pérdida de peso en asociación con el uso de ISRS. En consecuencia, se debe realizar un control regular del peso y el crecimiento en niños y adolescentes tratados con un ISRS como Lexapro.
Uso geriátrico
Aproximadamente el 6 % de los 1144 pacientes que recibieron escitalopram en ensayos controlados de Lexapro 10 mg en el trastorno depresivo mayor y el TAG tenían 60 años de edad o más; los pacientes de edad avanzada en estos ensayos recibieron dosis diarias de Lexapro entre 10 y 20 mg. El número de pacientes de edad avanzada en estos ensayos fue insuficiente para evaluar adecuadamente las posibles medidas diferenciales de eficacia y seguridad en función de la edad. No obstante, no se puede descartar una mayor sensibilidad de algunos ancianos a los efectos de Lexapro.
Los ISRS y los IRSN, incluido Lexapro 5 mg, se han asociado con casos de hiponatremia clínicamente significativa en pacientes de edad avanzada, que pueden tener un mayor riesgo de sufrir este evento adverso [ver hiponatremia ].
En dos estudios farmacocinéticos, la vida media de escitalopram aumentó aproximadamente un 50 % en sujetos de edad avanzada en comparación con sujetos jóvenes y la Cmax no se modificó [ver FARMACOLOGÍA CLÍNICA ]. 10 mg/día es la dosis recomendada para pacientes de edad avanzada [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
De 4422 pacientes en estudios clínicos de citalopram racémico, 1357 tenían 60 años o más, 1034 tenían 65 años o más y 457 tenían 75 años o más. No se observaron diferencias generales en la seguridad o la eficacia entre estos sujetos y los sujetos más jóvenes, y otra experiencia clínica notificada no ha identificado diferencias en las respuestas entre los pacientes de edad avanzada y los más jóvenes, pero nuevamente, no se puede descartar una mayor sensibilidad de algunas personas de edad avanzada.
SOBREDOSIS
Se ha informado lo siguiente con la sobredosis de tabletas de Lexapro:
- Convulsiones, que pueden ser tardías, y alteración del estado mental, incluido el coma.
- Toxicidad cardiovascular, que puede ser tardía, incluida la prolongación del intervalo QRS y QTc, taquiarritmias de complejo ancho y torsade de pointes. La hipertensión se ve con mayor frecuencia, pero rara vez se puede ver hipotensión sola o con la ingesta concomitante, incluido el alcohol.
- Síndrome serotoninérgico (los pacientes con una sobredosis de múltiples fármacos con otros fármacos proserotoninérgicos pueden tener un mayor riesgo).
Se recomienda un monitoreo cardíaco prolongado en las ingestiones de sobredosis de Lexapro debido al riesgo de arritmia.
Se debe considerar la descontaminación gastrointestinal con carbón activado en pacientes que se presentan poco después de una sobredosis de Lexapro.
Considere comunicarse con un centro de envenenamiento (1-800-221-2222) o un médico toxicólogo para recomendaciones de manejo de sobredosis.
CONTRAINDICACIONES
Inhibidores de la monoaminooxidasa (IMAO)
El uso de IMAO destinados a tratar trastornos psiquiátricos con Lexapro o dentro de los 14 días posteriores a la interrupción del tratamiento con Lexapro 5 mg está contraindicado debido a un mayor riesgo de síndrome serotoninérgico. También está contraindicado el uso de Lexapro 20 mg dentro de los 14 días posteriores a la interrupción de un IMAO destinado a tratar trastornos psiquiátricos [ver DOSIFICACIÓN Y ADMINISTRACIÓN , y ADVERTENCIAS Y PRECAUCIONES ].
También está contraindicado comenzar con Lexapro 20 mg en un paciente que está siendo tratado con IMAO como linezolid o azul de metileno intravenoso debido a un mayor riesgo de síndrome serotoninérgico [ver DOSIFICACIÓN Y ADMINISTRACIÓN , y ADVERTENCIAS Y PRECAUCIONES ].
pimozida
Está contraindicado el uso concomitante en pacientes que toman pimozida [ver INTERACCIONES CON LA DROGAS ].
Hipersensibilidad A Escitalopram O Citalopram
Lexapro 20 mg está contraindicado en pacientes con hipersensibilidad al escitalopram o citalopram o cualquiera de los ingredientes inactivos de Lexapro.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
Se presume que el mecanismo de acción antidepresiva de escitalopram, el enantiómero S del citalopram racémico, está relacionado con la potenciación de la actividad serotoninérgica en el sistema nervioso central (SNC) como resultado de su inhibición de la recaptación neuronal de serotonina (5-HT) en el SNC.
Farmacodinámica
Los estudios in vitro e in vivo en animales sugieren que el escitalopram es un inhibidor de la recaptación de serotonina (ISRS) altamente selectivo con efectos mínimos sobre la recaptación neuronal de norepinefrina y dopamina. El escitalopram es al menos 100 veces más potente que el enantiómero R con respecto a la inhibición de la recaptación de 5-HT y la inhibición de la velocidad de activación neuronal de 5-HT. El tratamiento a largo plazo (hasta 5 semanas) con escitalopram no indujo tolerancia a un modelo de efecto antidepresivo en ratas. El escitalopram no tiene afinidad o tiene muy poca afinidad por los receptores serotoninérgicos (5-HT1-7) u otros, incluidos los alfa y beta-adrenérgicos, la dopamina (D1-5), la histamina (H1-3), los muscarínicos (M1-5) y las benzodiazepinas. receptores Escitalopram tampoco se une o tiene poca afinidad por varios canales iónicos, incluidos los canales de Na+, K+, Cl- y Ca++. Se ha planteado la hipótesis de que el antagonismo de los receptores muscarínicos, histaminérgicos y adrenérgicos está asociado con varios efectos secundarios anticolinérgicos, sedantes y cardiovasculares de otros fármacos psicotrópicos.
Farmacocinética
La farmacocinética de dosis única y múltiple de escitalopram es lineal y proporcional a la dosis en un rango de dosis de 10 a 30 mg/día. La biotransformación de escitalopram es principalmente hepática, con una vida media terminal media de unas 27-32 horas. Con la dosificación una vez al día, las concentraciones plasmáticas en estado estacionario se alcanzan en aproximadamente una semana. En estado estacionario, el grado de acumulación de escitalopram en plasma en sujetos jóvenes sanos fue de 2,2 a 2,5 veces las concentraciones plasmáticas observadas después de una dosis única. Las formas de dosificación de tableta y solución oral de oxalato de escitalopram son bioequivalentes.
Absorción y Distribución
Después de una dosis oral única (tableta o solución de 20 mg) de escitalopram, los niveles sanguíneos máximos se alcanzan aproximadamente a las 5 horas. La absorción de escitalopram no se ve afectada por los alimentos.
La biodisponibilidad absoluta de citalopram es de alrededor del 80% en relación con una dosis intravenosa y el volumen de distribución de citalopram es de alrededor de 12 l/kg. Los datos específicos sobre escitalopram no están disponibles.
La unión de escitalopram a las proteínas plasmáticas humanas es de aproximadamente un 56%.
Metabolismo y eliminación
Luego de la administración oral de escitalopram, la fracción de fármaco recuperada en la orina como escitalopram y S-demetilcitalopram (S-DCT) es de aproximadamente 8% y 10%, respectivamente. El aclaramiento oral de escitalopram es de 600 ml/min, y aproximadamente el 7 % se debe al aclaramiento renal.
El escitalopram se metaboliza a S-DCT y S-didemetilcitalopram (S-DDCT). En humanos, el escitalopram inalterado es el compuesto predominante en el plasma. En el estado estacionario, la concentración del metabolito S-DCT de escitalopram en plasma es aproximadamente un tercio de la del escitalopram. El nivel de S-DDCT no fue detectable en la mayoría de los sujetos. Los estudios in vitro muestran que escitalopram es al menos 7 y 27 veces más potente que S-DCT y S-DDCT, respectivamente, en la inhibición de la recaptación de serotonina, lo que sugiere que los metabolitos de escitalopram no contribuyen significativamente a las acciones antidepresivas de escitalopram. S-DCT y SDDCT también tienen poca o ninguna afinidad por los receptores serotoninérgicos (5-HT1-7) u otros, incluidos los receptores alfa y beta adrenérgicos, la dopamina (D1-5), la histamina (H1-3), los muscarínicos (M1- 5), y receptores de benzodiacepinas. S-DCT y S-DDCT tampoco se unen a varios canales iónicos, incluidos los canales de Na+, K+, Cl- y Ca++.
Los estudios in vitro con microsomas hepáticos humanos indicaron que CYP3A4 y CYP2C19 son las principales isoenzimas involucradas en la N-desmetilación de escitalopram.
Subgrupos de población
Años
Adolescentes
En un estudio de dosis única de 10 mg de escitalopram, el AUC de escitalopram disminuyó un 19 % y la Cmax aumentó un 26 % en sujetos adolescentes sanos (de 12 a 17 años de edad) en comparación con los adultos. Después de dosis múltiples de 40 mg/día de citalopram, la vida media de eliminación del escitalopram, la Cmax en estado estacionario y el AUC fueron similares en pacientes con TDM (de 12 a 17 años de edad) en comparación con pacientes adultos. No es necesario ajustar la dosis en pacientes adolescentes.
Anciano
La farmacocinética de escitalopram en sujetos ≥ 65 años de edad se comparó con la de sujetos más jóvenes en un estudio de dosis única y de dosis múltiples. El AUC y la vida media de escitalopram aumentaron aproximadamente un 50 % en sujetos de edad avanzada, y la Cmax no cambió. 10 mg es la dosis recomendada para pacientes de edad avanzada [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Género
Según los datos de estudios de dosis única y dosis múltiples que miden escitalopram en ancianos, adultos jóvenes y adolescentes, no es necesario ajustar la dosis en función del sexo.
Función hepática reducida
El aclaramiento oral de citalopram se redujo en un 37% y la vida media se duplicó en pacientes con función hepática reducida en comparación con sujetos normales. 10 mg es la dosis recomendada de escitalopram para la mayoría de los pacientes con insuficiencia hepática [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Función renal reducida
En pacientes con insuficiencia renal de leve a moderada, el aclaramiento oral de citalopram se redujo en un 17 % en comparación con sujetos normales. No se recomienda ajustar la dosis para tales pacientes. No hay información disponible sobre la farmacocinética de escitalopram en pacientes con función renal gravemente reducida (aclaramiento de creatinina
Interacciones fármaco-fármaco
Los datos de inhibición enzimática in vitro no revelaron un efecto inhibidor de escitalopram sobre CYP3A4, -1A2, -2C9, -2C19 y -2E1. Según los datos in vitro, se esperaría que el escitalopram tuviera poco efecto inhibidor sobre el metabolismo in vivo mediado por estos citocromos. Si bien los datos in vivo para abordar esta pregunta son limitados, los resultados de los estudios de interacción farmacológica sugieren que el escitalopram, en una dosis de 20 mg, no tiene un efecto inhibidor de 3A4 y tiene un efecto inhibidor modesto de 2D6. Ver INTERACCIONES CON LA DROGAS para obtener información más detallada sobre los datos disponibles sobre interacciones medicamentosas.
Toxicología Animal Y/o Farmacología
Cambios retinales en ratas
Se observaron cambios patológicos (degeneración/atrofia) en las retinas de ratas albinas en el estudio de carcinogenicidad de 2 años con citalopram racémico. Hubo un aumento tanto en la incidencia como en la gravedad de la patología retiniana en ratas macho y hembra que recibieron 80 mg/kg/día. No se observaron hallazgos similares en ratas que recibieron 24 mg/kg/día de citalopram racémico durante dos años, en ratones que recibieron hasta 240 mg/kg/día de citalopram racémico durante 18 meses o en perros que recibieron hasta 20 mg/kg/día. día de citalopram racémico durante un año.
No se han realizado estudios adicionales para investigar el mecanismo de esta patología y no se ha establecido la posible importancia de este efecto en humanos.
Cambios cardiovasculares en perros
En un estudio toxicológico de un año, 5 de 10 perros beagle que recibieron dosis orales de citalopram racémico de 8 mg/kg/día murieron repentinamente entre las semanas 17 y 31 después del inicio del tratamiento. No se observaron muertes súbitas en ratas con dosis de citalopram racémico de hasta 120 mg/kg/día, lo que produjo niveles plasmáticos de citalopram y sus metabolitos demetilcitalopram y didemetilcitalopram (DDCT) similares a los observados en perros con 8 mg/kg/día. Un estudio de dosificación intravenosa posterior demostró que en perros beagle, el DDCT racémico provocó una prolongación del intervalo QT, un factor de riesgo conocido para el resultado observado en perros.
Estudios clínicos
Trastorno depresivo mayor
Adolescentes
La eficacia de Lexapro como tratamiento agudo para el trastorno depresivo mayor en pacientes adolescentes se estableció en un estudio de 8 semanas, de dosis flexible, controlado con placebo que comparó Lexapro 10-20 mg/día con placebo en pacientes ambulatorios de 12 a 17 años de edad. inclusive que cumplían con los criterios del DSM-IV para el trastorno depresivo mayor. El resultado primario fue el cambio desde el inicio hasta el final en la Escala de Calificación de Depresión Infantil - Revisada (CDRS-R). En este estudio, Lexapro 5 mg mostró una mejoría media mayor estadísticamente significativa en comparación con el placebo en la CDRS-R.
La eficacia de Lexapro en el tratamiento agudo del trastorno depresivo mayor en adolescentes se estableció, en parte, sobre la base de la extrapolación del estudio de 8 semanas, de dosis flexible, controlado con placebo con citalopram racémico 20-40 mg/día. En este estudio ambulatorio en niños y adolescentes de 7 a 17 años de edad que cumplieron con los criterios del DSM-IV para el trastorno depresivo mayor, el tratamiento con citalopram mostró una mejoría media estadísticamente significativa desde el inicio, en comparación con el placebo, en la CDRS-R; los resultados positivos de este ensayo provinieron en gran medida del subgrupo de adolescentes.
Dos estudios adicionales de MDD controlados con placebo y de dosis flexible (un estudio de Lexapro en pacientes de 7 a 17 años y un estudio de citalopram en adolescentes) no demostraron eficacia.
Aunque la eficacia de mantenimiento en pacientes adolescentes no ha sido evaluada sistemáticamente, la eficacia de mantenimiento puede extrapolarse a partir de datos de adultos junto con comparaciones de parámetros farmacocinéticos de escitalopram en pacientes adultos y adolescentes.
Adultos
La eficacia de Lexapro 5 mg como tratamiento para el trastorno depresivo mayor se estableció en tres estudios controlados con placebo de 8 semanas de duración realizados en pacientes ambulatorios de entre 18 y 65 años que cumplían con los criterios del DSM-IV para el trastorno depresivo mayor. El resultado primario en los tres estudios fue el cambio desde el inicio hasta el final en la escala de calificación de depresión de Montgomery Asberg (MADRS).
Un estudio de dosis fija comparó 10 mg/día de Lexapro y 20 mg/día de Lexapro con placebo y 40 mg/día de citalopram. Los grupos de tratamiento de 10 mg/día y 20 mg/día de Lexapro 5 mg mostraron una mejoría media mayor estadísticamente significativa en comparación con el placebo en la MADRS. Los grupos de Lexapro de 10 mg y 20 mg fueron similares en esta medida de resultado.
En un segundo estudio de dosis fija de 10 mg/día de Lexapro y placebo, el grupo de tratamiento con 10 mg/día de Lexapro mostró una mejoría media mayor estadísticamente significativa en comparación con el placebo en la MADRS.
En un estudio de dosis flexible, en el que se comparó Lexapro 20 mg, titulado entre 10 y 20 mg/día, con placebo y citalopram, titulado entre 20 y 40 mg/día, el grupo de tratamiento con Lexapro 5 mg mostró una mejoría media mayor estadísticamente significativa en comparación con el placebo en el MADRS.
Los análisis de la relación entre el resultado del tratamiento y la edad, el género y la raza no sugirieron ninguna respuesta diferencial sobre la base de estas características de los pacientes.
En un ensayo a más largo plazo, 274 pacientes que cumplían los criterios (DSM-IV) para el trastorno depresivo mayor, que habían respondido durante una fase inicial de tratamiento abierto de 8 semanas con Lexapro 10 o 20 mg/día, fueron aleatorizados para continuar con Lexapro a la misma dosis, o al placebo, durante un máximo de 36 semanas de observación de la recaída. La respuesta durante la fase abierta se definió como una disminución de la puntuación total de MADRS a ≤ 12. La recaída durante la fase doble ciego se definió como un aumento de la puntuación total de MADRS a ≥ 22, o interrupción debido a una respuesta clínica insuficiente. . Los pacientes que recibieron Lexapro de manera continua experimentaron un tiempo estadísticamente significativo más prolongado hasta la recaída en comparación con los que recibieron placebo.
Trastorno de ansiedad generalizada
La eficacia de Lexapro 5 mg en el tratamiento agudo del trastorno de ansiedad generalizada (TAG) se demostró en tres estudios de 8 semanas, multicéntricos, de dosis flexible, controlados con placebo que compararon Lexapro 10-20 mg/día con placebo en pacientes adultos ambulatorios entre 18 y 80 años de edad que cumplieron con los criterios del DSM-IV para TAG. En los tres estudios, Lexapro mostró una mejoría media mayor estadísticamente significativa en comparación con el placebo en la escala de ansiedad de Hamilton (HAM-A).
Hubo muy pocos pacientes en diferentes grupos étnicos y de edad para evaluar adecuadamente si Lexapro tiene o no efectos diferenciales en estos grupos. No hubo diferencia en la respuesta a Lexapro entre hombres y mujeres.
INFORMACIÓN DEL PACIENTE
Lexapro® (leks-a-pro) (escitalopram) Tabletas/Solución oral
Lea la Guía del medicamento que viene con Lexapro antes de comenzar a tomarlo y cada vez que renueve su receta. Es posible que haya nueva información. Esta Guía del medicamento no reemplaza la conversación con su proveedor de atención médica sobre su condición médica o tratamiento. Hable con su proveedor de atención médica si hay algo que no entiende o sobre lo que desea obtener más información.
¿Cuál es la información más importante que debo saber sobre Lexapro 20mg?
Lexapro 10 mg y otros medicamentos antidepresivos pueden causar efectos secundarios graves, que incluyen:
Mantenga todas las visitas de seguimiento con su proveedor de atención médica y llame entre visitas si le preocupan los síntomas.
Llame a su proveedor de atención médica de inmediato si tiene alguno de los siguientes síntomas, o llame al 911 en caso de emergencia, especialmente si son nuevos, empeoran o le preocupan:
Llame a su proveedor de atención médica de inmediato si tiene alguno de los siguientes síntomas, o llame al 911 si es una emergencia. Lexapro puede estar asociado con estos efectos secundarios graves:
Los síntomas en los hombres pueden incluir:
Los síntomas en las mujeres pueden incluir:
Hable con su proveedor de atención médica si desarrolla algún cambio en su función sexual o si tiene alguna pregunta o inquietud sobre problemas sexuales durante el tratamiento con Lexapro. Puede haber tratamientos que su proveedor de atención médica pueda sugerir.
- Lexapro 5 mg y otros medicamentos antidepresivos pueden aumentar los pensamientos o acciones suicidas en algunos niños, adolescentes o adultos jóvenes dentro del primeros meses de tratamiento o cuando se cambia la dosis.
- La depresión u otras enfermedades mentales graves son las causas más importantes de pensamientos o acciones suicidas.
- Esté atento a estos cambios y llame a su proveedor de atención médica de inmediato si nota:
- Cambios nuevos o repentinos en el estado de ánimo, el comportamiento, las acciones, los pensamientos o los sentimientos, especialmente si son graves.
- Preste especial atención a dichos cambios cuando se inicia Lexapro 5 mg o cuando se cambia la dosis.
- intentos de suicidio
- actuando sobre impulsos peligrosos
- actuando agresivo o violento
- pensamientos sobre el suicidio o la muerte
- depresión nueva o peor
- nuevos o peores ataques de ansiedad o pánico
- sentirse agitado, inquieto, enojado o irritable
- problemas para dormir
- un aumento en la actividad o hablar más de lo normal para usted
- otros cambios inusuales en el comportamiento o el estado de ánimo
- agitación, alucinaciones, coma u otros cambios en el estado mental
- problemas de coordinación o espasmos musculares (reflejos hiperactivos)
- latidos cardíacos acelerados, presión arterial alta o baja
- sudoración o fiebre
- náuseas, vómitos o diarrea
- rigidez muscular
- dificultad para respirar
- hinchazón de la cara, lengua, ojos o boca
- sarpullido, ronchas que pican (urticaria) o ampollas, solo o con fiebre o dolor en las articulaciones
- energía mucho mayor
- problemas severos para dormir
- pensamientos acelerados
- comportamiento temerario
- ideas inusualmente grandiosas
- felicidad excesiva o irritabilidad
- hablando más o más rápido de lo habitual
- dolor de cabeza
- debilidad o sensación de inestabilidad
- confusión, problemas para concentrarse o pensar o problemas de memoria
Solo algunas personas corren el riesgo de tener estos problemas. Es posible que desee someterse a un examen de la vista para ver si está en riesgo y recibir tratamiento preventivo si lo está.
- dolor de ojo
- cambios en la visión
- hinchazón o enrojecimiento en o alrededor del ojo
- Eyaculación retardada o incapacidad para tener una eyaculación
- Disminución del deseo sexual
- Problemas para conseguir o mantener una erección
- Disminución del deseo sexual
- Orgasmo retrasado o incapacidad para tener un orgasmo
No deje de tomar Lexapro sin hablar primero con su proveedor de atención médica. Dejar de tomar Lexapro 5 mg demasiado rápido puede causar síntomas graves que incluyen:
- ansiedad, irritabilidad, estado de ánimo alto o bajo, sensación de inquietud o cambios en los hábitos de sueño
- dolor de cabeza, sudoración, náuseas, mareos
- sensaciones de descarga eléctrica, temblores, confusión
¿Qué es Lexapro?
Lexapro 20 mg es un medicamento recetado que se usa para tratar la depresión. Es importante hablar con su proveedor de atención médica sobre los riesgos de tratar la depresión y también los riesgos de no tratarla. Debe analizar todas las opciones de tratamiento con su proveedor de atención médica. Lexapro también se usa para tratar:
- Trastorno Depresivo Mayor (TDM)
- Trastorno de ansiedad generalizada (TAG)
Hable con su proveedor de atención médica si no cree que su condición esté mejorando con el tratamiento con Lexapro.
¿Quién no debe tomar Lexapro 5mg?
No tome Lexapro 10 mg si usted:
Las personas que toman Lexapro 20 mg casi al mismo tiempo que un IMAO pueden tener efectos secundarios graves o incluso potencialmente mortales. Obtenga ayuda médica de inmediato si tiene alguno de estos síntomas:
- es alérgico al escitalopram o al citalopram o a cualquiera de los ingredientes de Lexapro. Consulte el final de esta Guía del medicamento para obtener una lista completa de los ingredientes de Lexapro.
- Toma un inhibidor de la monoaminooxidasa (IMAO). Pregúntele a su proveedor de atención médica o farmacéutico si no está seguro si está tomando un IMAO, incluido linezolid.
- No tome un IMAO dentro de las 2 semanas posteriores a la suspensión de Lexapro 10 mg a menos que su médico se lo indique.
- No comience a tomar Lexapro 20 mg si dejó de tomar un IMAO en las últimas 2 semanas, a menos que su médico se lo indique.
- fiebre alta
- espasmos musculares incontrolables
- músculos rígidos
- cambios rápidos en la frecuencia cardíaca o la presión arterial
- confusión
- pérdida del conocimiento (desmayo)
- No tome Lexapro con Orap® (pimozida) porque tomar estos dos medicamentos juntos puede causar problemas cardíacos graves.
¿Qué debo decirle a mi proveedor de atención médica antes de tomar Lexapro 20 mg? Pregunte si no está seguro.
Antes de comenzar con Lexapro 20 mg, informe a su proveedor de atención médica si:
- Están tomando ciertos medicamentos como:
- Triptanos utilizados para tratar la migraña
- Medicamentos utilizados para tratar el estado de ánimo, la ansiedad, los trastornos psicóticos o del pensamiento, incluidos los tricíclicos, el litio, los ISRS, los IRSN, las anfetaminas o los antipsicóticos.
- Tramadol
- Suplementos de venta libre como triptófano o hierba de San Juan
- tiene problemas hepáticos
- tiene problemas renales
- tener problemas del corazón
- tiene o ha tenido ataques o convulsiones
- tiene trastorno bipolar o manía
- tiene niveles bajos de sodio en la sangre
- tiene antecedentes de un derrame cerebral
- tiene presión arterial alta
- tiene o ha tenido problemas de sangrado
- está embarazada o planea quedar embarazada. Tomar LEXAPRO al final del embarazo puede aumentar el riesgo de ciertos problemas en su recién nacido. Hable con su proveedor de atención médica sobre los beneficios y riesgos de tratar la depresión durante el embarazo
- Si queda embarazada mientras toma LEXAPRO, hable con su proveedor de atención médica acerca de registrarse en el Registro Nacional de Embarazo para Antidepresivos. Puede registrarse llamando al 1-844-405-6185 o visitando https://womensmentalhealth.org/clinicaland-researchprograms/pregnanceregistry/antidepressants/
- está amamantando o planea amamantar. Lexapro puede pasar a la leche materna. Hable con su proveedor de atención médica sobre la mejor manera de alimentar a su bebé si toma Lexapro.
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos herbales. Lexapro 10mg y algunos medicamentos pueden interactuar entre sí, pueden no funcionar tan bien o pueden causar efectos secundarios graves.
Su proveedor de atención médica o farmacéutico puede decirle si es seguro tomar Lexapro 20 mg con sus otros medicamentos. No comience ni suspenda ningún medicamento mientras toma Lexapro 10 mg sin hablar primero con su proveedor de atención médica.
Si toma Lexapro, no debe tomar ningún otro medicamento que contenga escitalopram o citalopram, incluidos: Celexa.
¿Cómo debo tomar Lexapro?
- Tome Lexapro exactamente según lo prescrito. Es posible que su proveedor de atención médica deba cambiar la dosis de Lexapro hasta que sea la dosis adecuada para usted.
- Lexapro 5 mg se puede tomar con o sin alimentos.
- Si olvida una dosis de Lexapro, tome la dosis olvidada tan pronto como lo recuerde. Si es casi la hora de la próxima dosis, omita la dosis olvidada y tome la siguiente dosis a la hora habitual. No tome dos dosis de Lexapro al mismo tiempo.
- Si toma demasiado Lexapro, llame de inmediato a su proveedor de atención médica o al centro de toxicología, o busque tratamiento de emergencia.
¿Qué debo evitar mientras tomo lexapro?
Lexapro 5mg puede causar somnolencia o puede afectar su capacidad para tomar decisiones, pensar con claridad o reaccionar rápidamente. No debe conducir, operar maquinaria pesada ni realizar otras actividades peligrosas hasta que sepa cómo le afecta Lexapro. No beba alcohol mientras usa Lexapro.
¿Cuáles son los posibles efectos secundarios de Lexapro 20mg?
Lexapro 10 mg puede provocar efectos secundarios graves, incluidos todos de los descritos en la sección titulada “¿Cuál es la información más importante que debo saber sobre Lexapro?”
Los posibles efectos secundarios comunes en personas que toman Lexapro 5 mg incluyen:
- Náuseas
- Somnolencia
- Debilidad
- Mareo
- Sentirse ansioso
- Problemas para dormir
- Problemas sexuales
- Transpiración
- Sacudida
- no sentir hambre
- Boca seca
- Estreñimiento
- Infección
- bostezando
Otros efectos secundarios en niños y adolescentes incluyen:
- aumento de la sed
- aumento anormal en el movimiento muscular o agitación
- hemorragia nasal
- micción difícil
- periodos menstruales abundantes
- posible tasa de crecimiento más lenta y cambio de peso. Se debe controlar la altura y el peso de su hijo durante el tratamiento con Lexapro.
Informe a su proveedor de atención médica si tiene algún efecto secundario que le moleste o que no desaparezca. Estos no son todos los posibles efectos secundarios de Lexapro. Para obtener más información, consulte a su proveedor de atención médica o farmacéutico.
LLAME A SU MÉDICO PARA OBTENER CONSEJOS MÉDICOS SOBRE LOS EFECTOS SECUNDARIOS. PUEDE INFORMAR LOS EFECTOS SECUNDARIOS A LA FDA AL 1-800-FDA-1088.
¿Cómo debo almacenar Lexapro 20mg?
- Almacene Lexapro a una temperatura de 68 °F a 77 °F (20 °C a 25 °C); excursiones permitidas a 59°F a 86°F (15°C a 30°C).
- Mantenga el frasco de Lexapro bien cerrado.
Mantenga Lexapro 10 mg y todos los medicamentos fuera del alcance de los niños.
Información general sobre Lexapro
A veces, los medicamentos se recetan para fines distintos a los enumerados en la Guía del medicamento. No use Lexapro para una condición para la cual no fue recetado. No le dé Lexapro 10 mg a otras personas, incluso si tienen la misma condición. Puede que les haga daño.
Esta Guía del medicamento resume la información más importante sobre Lexapro. Si desea obtener más información, hable con su proveedor de atención médica. Puede pedirle a su proveedor de atención médica o farmacéutico información sobre Lexapro escrita para profesionales de la salud.
Para más información sobre Lexapro 20mg llamar 1-800-678-1605 o vaya a www.Lexapro.com.
¿Cuáles son los ingredientes de Lexapro 20mg?
Ingrediente activo: oxalato de escitalopram Ingredientes inactivos:
- talco, croscarmelosa sódica, celulosa microcristalina/dióxido de silicio coloidal y estearato de magnesio. El recubrimiento de la película contiene hipromelosa, dióxido de titanio y polietilenglicol.
- Solucion Oral: sorbitol, agua purificada, ácido cítrico, citrato de sodio, ácido málico, glicerina, propilenglicol, metilparabeno, propilparabeno y sabor a menta natural (la solución oral no se comercializa actualmente).
Esta Guía del medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de EE. UU.
