Tratamiento del cáncer: Nolvadex 10mg, 20mg Tamoxifen Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Nolvadex y cómo se usa?
Nolvadex 10 mg es un medicamento recetado que se usa para tratar los síntomas del cáncer de mama. Nolvadex se puede usar solo o con otros medicamentos.
Nolvadex 20 mg pertenece a una clase de medicamentos llamados antineoplásicos, antagonistas de los receptores de estrógeno.
No se sabe si Nolvadex 20 mg es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Nolvadex 20mg?
Nolvadex puede causar efectos secundarios graves que incluyen:
- cambios de visión,
- dolor de ojo,
- moretones o sangrado fácil,
- cambios de humor,
- hinchazón de los tobillos o los pies, y
- cansancio inusual
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Nolvadex incluyen:
- Sofocos,
- enrojecimiento,
- cambios en los períodos menstruales,
- náuseas,
- calambres en las piernas,
- calambres abdominales,
- dolor de huesos,
- dolor muscular,
- tos,
- hinchazón,
- fatiga,
- adelgazamiento del cabello,
- dolor de cabeza,
- depresión, y
- pérdida de capacidad/interés sexual (en hombres)
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Nolvadex. Para obtener más información, consulte a su médico o farmacéutico.
ADVERTENCIA
Para mujeres con carcinoma ductal in situ (DCIS) y mujeres con alto riesgo de cáncer de mama: Los eventos graves y potencialmente mortales asociados con NOLVADEX (citrato de tamoxifeno) en el entorno de reducción de riesgos (mujeres con alto riesgo de cáncer y mujeres con CDIS) incluyen neoplasias malignas uterinas, accidente cerebrovascular y embolia pulmonar. Las tasas de incidencia de estos eventos se calcularon a partir del ensayo NSABP P-1 (ver FARMACOLOGÍA CLÍNICA-Estudios clínicos - Reducción de la incidencia de cáncer de mama en mujeres de alto riesgo ). Las neoplasias uterinas consisten en adenocarcinoma endometrial (tasa de incidencia por 1000 mujeres-año de 2,20 para NOLVADEX (citrato de tamoxifeno) frente a 0,71 para placebo) y sarcoma uterino (tasa de incidencia por 1000 mujeres-año de 0,17 para NOLVADEX (citrato de tamoxifeno) frente a 0,4 para placebo)*. Para el accidente cerebrovascular, la tasa de incidencia por 1000 mujeres-año fue de 1,43 para NOLVADEX (citrato de tamoxifeno) frente a 1,00 para el placebo**. Para la embolia pulmonar, la tasa de incidencia por 1000 mujeres-año fue de 0,75 para NOLVADEX (citrato de tamoxifeno) frente a 0,25 para el placebo**.
Algunos de los accidentes cerebrovasculares, embolias pulmonares y tumores malignos uterinos fueron fatales.
Los proveedores de atención médica deben analizar los beneficios potenciales frente a los riesgos potenciales de estos eventos graves con mujeres con alto riesgo de cáncer de mama y mujeres con DCIS que consideren NOLVADEX (citrato de tamoxifeno) para reducir el riesgo de desarrollar cáncer de mama.
Los beneficios de NOLVADEX (citrato de tamoxifeno) superan sus riesgos en mujeres que ya han sido diagnosticadas con cáncer de mama.
REFERENCIAS
*Datos de seguimiento a largo plazo actualizados (la duración media del seguimiento es de 6,9 años) del estudio NSABP P-1. Ver ADVERTENCIAS: Efectos sobre el Útero-Cáncer de Endometrio y Sarcoma Uterino .
**Consulte la Tabla 3 a continuación FARMACOLOGÍA CLÍNICA-Estudios Clínicos .
DESCRIPCIÓN
Las tabletas NOLVADEX® (citrato de tamoxifeno), un antiestrógeno no esteroideo, son para administración oral. Las tabletas de NOLVADEX (citrato de tamoxifeno) están disponibles como:
Comprimidos de 10mg
Cada comprimido contiene 15,2 mg de citrato de tamoxifeno que equivale a 10 mg de tamoxifeno.
Comprimidos de 20 mg
Cada comprimido contiene 30,4 mg de citrato de tamoxifeno que equivale a 20 mg de tamoxifeno.
Ingredientes inactivos: carboximetilcelulosa de calcio, estearato de magnesio, manitol y almidón.
Químicamente, NOLVADEX (citrato de tamoxifeno) es el isómero trans de un derivado de trifeniletileno. El nombre químico es (Z)2-[4-(1,2-difenil-1-butenil) fenoxi]-N,N-dimetiletanamina 2 hidroxi-1,2,3-propanotricarboxilato (1:1). Las fórmulas estructural y empírica son:
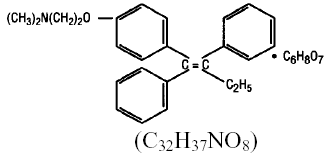
El citrato de tamoxifeno tiene un peso molecular de 563,62, el pKa' es 8.85, la solubilidad de equilibrio en agua a 37°C es 0.5 mg/mL y en HCl 0.02 N a 37°C es 0.2 mg/mL.
INDICACIONES
Cáncer de mama metastásico
NOLVADEX (citrato de tamoxifeno) es eficaz en el tratamiento del cáncer de mama metastásico en mujeres y hombres. En mujeres premenopáusicas con cáncer de mama metastásico, NOLVADEX (citrato de tamoxifeno) es una alternativa a la ooforectomía o la irradiación ovárica. La evidencia disponible indica que los pacientes cuyos tumores son receptores de estrógeno positivos tienen más probabilidades de beneficiarse de la terapia con NOLVADEX (citrato de tamoxifeno).
Tratamiento adyuvante del cáncer de mama
NOLVADEX (citrato de tamoxifeno) está indicado para el tratamiento del cáncer de mama con ganglios positivos en mujeres después de una mastectomía total o segmentaria, disección axilar e irradiación mamaria. En algunos estudios adyuvantes de NOLVADEX (citrato de tamoxifeno), la mayor parte del beneficio hasta la fecha ha sido en el subgrupo con cuatro o más ganglios axilares positivos.
NOLVADEX (citrato de tamoxifeno) está indicado para el tratamiento del cáncer de mama con ganglios axilares negativos en mujeres después de una mastectomía total o segmentaria, disección axilar e irradiación mamaria.
Los valores de los receptores de estrógeno y progesterona pueden ayudar a predecir si es probable que la terapia adyuvante con NOLVADEX (citrato de tamoxifeno) sea beneficiosa.
NOLVADEX (citrato de tamoxifeno) reduce la aparición de cáncer de mama contralateral en pacientes que reciben tratamiento adyuvante con NOLVADEX (citrato de tamoxifeno) para el cáncer de mama.
Carcinoma ductal in situ (CDIS)
En mujeres con DCIS, después de cirugía mamaria y radiación, NOLVADEX (citrato de tamoxifeno) está indicado para reducir el riesgo de cáncer de mama invasivo (ver ADVERTENCIA EN CAJA al principio de la etiqueta). La decisión sobre la terapia con NOLVADEX (citrato de tamoxifeno) para la reducción de la incidencia de cáncer de mama debe basarse en una evaluación individual de los beneficios y riesgos de la terapia con NOLVADEX (citrato de tamoxifeno).
Los datos actuales de los ensayos clínicos respaldan cinco años de terapia adyuvante con NOLVADEX (citrato de tamoxifeno) para pacientes con cáncer de mama.
Reducción de la incidencia de cáncer de mama en mujeres de alto riesgo
NOLVADEX (citrato de tamoxifeno) está indicado para reducir la incidencia de cáncer de mama en mujeres con alto riesgo de cáncer de mama. Este efecto se demostró en un estudio de 5 años de duración planificada con una mediana de seguimiento de 4,2 años. Veinticinco por ciento de los participantes recibieron medicamentos durante 5 años. Los efectos a largo plazo no se conocen. En este estudio, no hubo impacto del tamoxifeno en la mortalidad general o relacionada con el cáncer de mama (ver ADVERTENCIA EN CAJA al principio de la etiqueta).
NOLVADEX (citrato de tamoxifeno) está indicado solo para mujeres de alto riesgo. “Alto riesgo” se define como mujeres de al menos 35 años de edad con un riesgo previsto de cáncer de mama a 5 años ≥ 1,67 %, según lo calculado por el modelo de Gail.
Ejemplos de combinaciones de factores que predicen un riesgo a 5 años ≥ 1,67 % son:
35 años o más y cualquiera de las siguientes combinaciones de factores:
- Un familiar de primer grado con antecedentes de cáncer de mama, 2 o más biopsias benignas y antecedentes de una biopsia de mama que muestre hiperplasia atípica; o
- Al menos 2 familiares de primer grado con antecedentes de cáncer de mama y antecedentes personales de al menos una biopsia de mama; o
- CLIS
40 años o más y cualquiera de las siguientes combinaciones de factores:
- Un familiar de primer grado con antecedentes de cáncer de mama, 2 o más biopsias benignas, edad del primer nacido vivo de 25 años o más y edad de la menarquia de 11 años o menos; o
- Al menos 2 familiares de primer grado con antecedentes de cáncer de mama y edad en el primer nacimiento vivo de 19 años o menos; o
- Un familiar de primer grado con antecedentes de cáncer de mama y antecedentes personales de biopsia mamaria que evidenció hiperplasia atípica.
45 años o más y cualquiera de las siguientes combinaciones de factores:
- Al menos 2 familiares de primer grado con antecedentes de cáncer de mama y edad en el primer nacimiento vivo de 24 años o menos; o
- Un familiar de primer grado con antecedentes de cáncer de mama con antecedentes personales de una biopsia mamaria benigna, edad a la menarquia 11 o menos y edad al primer nacido vivo 20 o más.
50 años o más y cualquiera de las siguientes combinaciones de factores:
- Al menos 2 familiares de primer grado con antecedentes de cáncer de mama; o
- Antecedentes de una biopsia de mama que muestra hiperplasia atípica y edad del primer nacido vivo de 30 años o más y edad de la menarquia de 11 años o menos; o
- Antecedentes de al menos dos biopsias mamarias con antecedentes de hiperplasia atípica y edad del primer nacido vivo de 30 años o más.
55 años o más y cualquiera de las siguientes combinaciones de factores:
- Un familiar de primer grado con antecedentes de cáncer de mama con antecedentes personales de biopsia mamaria benigna y edad de menarquia de 11 años o menos; o
- Antecedentes de al menos 2 biopsias de mama con antecedentes de hiperplasia atípica y edad del primer nacido vivo de 20 años o más.
60 años o más y:
- Riesgo previsto a 5 años de cáncer de mama ≥ 1,67 %, según lo calculado por el modelo de Gail.
Para las mujeres cuyos factores de riesgo no se describen en los ejemplos anteriores, el Modelo de Gail es necesario para estimar el riesgo absoluto de cáncer de mama. Los profesionales de la salud pueden obtener una herramienta de evaluación de riesgos del modelo Gail llamando al 1-800-544-2007.
No hay suficientes datos disponibles sobre el efecto de NOLVADEX (citrato de tamoxifeno) en la incidencia de cáncer de mama en mujeres con mutaciones hereditarias (BRCA1, BRCA2) para poder hacer recomendaciones específicas sobre la eficacia de NOLVADEX (citrato de tamoxifeno) en estas pacientes.
Después de una evaluación del riesgo de desarrollar cáncer de mama, la decisión sobre la terapia con NOLVADEX (citrato de tamoxifeno) para reducir la incidencia de cáncer de mama debe basarse en una evaluación individual de los beneficios y riesgos de la terapia con NOLVADEX (citrato de tamoxifeno). En el ensayo NSABP P-1, el tratamiento con NOLVADEX (citrato de tamoxifeno) redujo el riesgo de desarrollar cáncer de mama durante el período de seguimiento del ensayo, pero no eliminó el riesgo de cáncer de mama (consulte la Tabla 3 en FARMACOLOGÍA CLÍNICA ).
DOSIFICACIÓN Y ADMINISTRACIÓN
Para pacientes con cáncer de mama, la dosis diaria recomendada es de 20-40 mg. Las dosis superiores a 20 mg por día deben administrarse en dosis divididas (mañana y noche).
En tres estudios adyuvantes de agente único en mujeres, se administró una tableta de 10 mg de NOLVADEX (citrato de tamoxifeno) dos (ECOG y NATO) o tres (Toronto) veces al día durante dos años. En el estudio adyuvante NSABP B-14 en mujeres con cáncer de mama con ganglios negativos, se administró una tableta de 10 mg de NOLVADEX (citrato de tamoxifeno) dos veces al día durante al menos 5 años. Los resultados del estudio B-14 sugieren que la continuación de la terapia más allá de los cinco años no proporciona un beneficio adicional (ver FARMACOLOGÍA CLÍNICA ). En el resumen de EBCTCG 1995, la reducción de la recurrencia y la mortalidad fue mayor en los estudios que usaron tamoxifeno durante aproximadamente cinco años que en los que usaron tamoxifeno durante un período de tratamiento más corto. No hubo indicios de que las dosis superiores a 20 mg por día fueran más eficaces. Los datos actuales de los ensayos clínicos respaldan 5 años de terapia adyuvante con NOLVADEX (citrato de tamoxifeno) para pacientes con cáncer de mama.
Carcinoma ductal in situ (CDIS)
La dosis recomendada es NOLVADEX (citrato de tamoxifeno) 20 mg diarios durante 5 años.
Reducción de la incidencia de cáncer de mama en mujeres de alto riesgo
La dosis recomendada es NOLVADEX (citrato de tamoxifeno) 20 mg diarios durante 5 años. No hay datos que respalden el uso de NOLVADEX (citrato de tamoxifeno) más que durante 5 años (Ver FARMACOLOGÍA CLÍNICA-Estudios clínicos - Reducción de la incidencia de cáncer de mama en mujeres de alto riesgo ).
CÓMO SUMINISTRADO
Comprimidos de 10mg que contienen tamoxifeno como citrato en una cantidad equivalente a 10 mg de tamoxifeno (comprimido blanco, redondo, biconvexo, sin recubrimiento, identificado con NOLVADEX (citrato de tamoxifeno) 600 grabado en un lado y un camafeo grabado en el otro lado) se suministran en frascos de 60 tabletas NDC 0310-0600-60.
Comprimidos de 20 mg que contienen tamoxifeno como citrato en una cantidad equivalente a 20 mg de tamoxifeno (comprimido blanco, redondo, biconvexo, sin recubrimiento, identificado con NOLVADEX (citrato de tamoxifeno) 604 grabado en un lado y un camafeo grabado en el otro lado) se suministran en frascos de 30 tabletas NDC 0310-0604-30.
Almacenar a temperatura ambiente controlada, 20-25°C (68-77°F) [ver USP]. Dispensar en un recipiente bien cerrado y resistente a la luz.
*Coumadin® es una marca registrada de Bristol-Myers Squibb Pharmaceuticals. Todas las demás marcas comerciales son propiedad del grupo AstraZeneca, AstraZeneca Pharmaceuticals LP Wilmington, Delaware 19850-5437. Rev. 27-09-05. Fecha de revisión de la FDA: 3/9/2006EFECTOS SECUNDARIOS
Las reacciones adversas a NOLVADEX (citrato de tamoxifeno) son relativamente leves y rara vez lo suficientemente graves como para requerir la interrupción del tratamiento en pacientes con cáncer de mama.
Los estudios clínicos continuos han dado como resultado más información que indica mejor la incidencia de reacciones adversas con NOLVADEX (citrato de tamoxifeno) en comparación con el placebo.
Cáncer de mama metastásico
Se ha producido aumento del dolor óseo y tumoral y, también, brote local de la enfermedad, que en ocasiones se asocian a una buena respuesta tumoral. Los pacientes con aumento del dolor óseo pueden requerir analgésicos adicionales. Los pacientes con enfermedad de tejidos blandos pueden tener aumentos repentinos en el tamaño de las lesiones preexistentes, algunas veces asociado con un eritema marcado dentro y alrededor de las lesiones y/o el desarrollo de nuevas lesiones. Cuando ocurren, el dolor óseo o el brote de la enfermedad se observan poco después de comenzar con NOLVADEX (citrato de tamoxifeno) y generalmente desaparecen rápidamente.
En pacientes tratadas con NOLVADEX (citrato de tamoxifeno) por cáncer de mama metastásico, la reacción adversa más frecuente a NOLVADEX (citrato de tamoxifeno) son los sofocos.
Otras reacciones adversas que se observan con poca frecuencia son hipercalcemia, edema periférico, disgusto por la comida, prurito vulvar, depresión, mareos, aturdimiento, dolor de cabeza, adelgazamiento del cabello y/o pérdida parcial del cabello y sequedad vaginal.
Mujeres premenopáusicas
La siguiente tabla resume la incidencia de reacciones adversas notificadas con una frecuencia del 2 % o más en ensayos clínicos (Ingle, Pritchard, Buchanan) que compararon el tratamiento con NOLVADEX (citrato de tamoxifeno) con la ablación ovárica en pacientes premenopáusicas con cáncer de mama metastásico.
Cáncer de mama masculino
NOLVADEX (citrato de tamoxifeno) es bien tolerado en hombres con cáncer de mama. Los informes de la literatura y los informes de casos sugieren que el perfil de seguridad de NOLVADEX (citrato de tamoxifeno) en los hombres es similar al observado en las mujeres. La pérdida de la libido y la impotencia han dado lugar a la interrupción del tratamiento con tamoxifeno en pacientes masculinos. Además, en varones oligospérmicos tratados con tamoxifeno, los niveles de LH, FSH, testosterona y estrógenos estaban elevados. No se informaron cambios clínicos significativos.
Cáncer de mama adyuvante
En el estudio NSABP B-14, las mujeres con cáncer de mama con ganglios axilares negativos se asignaron al azar a 5 años de NOLVADEX (citrato de tamoxifeno) 20 mg/día o placebo después de la cirugía primaria. Los efectos adversos informados se tabulan a continuación (seguimiento medio de aproximadamente 6,8 años) que muestran eventos adversos más comunes con NOLVADEX (citrato de tamoxifeno) que con placebo. La incidencia de sofocos (64 % frente a 48 %), secreción vaginal (30 % frente a 15 %) y menstruación irregular (25 % frente a 19 %) fue mayor con NOLVADEX (citrato de tamoxifeno) en comparación con el placebo. Todos los demás efectos adversos ocurrieron con una frecuencia similar en los 2 grupos de tratamiento, con la excepción de los eventos trombóticos; se observó una mayor incidencia en pacientes tratados con NOLVADEX (citrato de tamoxifeno) (durante 5 años, 1,7 % frente a 0,4 %). Dos de los pacientes tratados con NOLVADEX (citrato de tamoxifeno) que presentaron eventos trombóticos fallecieron.
En el ensayo adyuvante de cáncer de mama del Eastern Cooperative Oncology Group (ECOG), se administró NOLVADEX (citrato de tamoxifeno) o placebo durante 2 años a mujeres después de una mastectomía. Cuando se comparó con el placebo, NOLVADEX (citrato de tamoxifeno) mostró una incidencia significativamente mayor de sofocos (19 % frente al 8 % del placebo). La incidencia de todas las demás reacciones adversas fue similar en los 2 grupos de tratamiento con la excepción de la trombocitopenia, donde la incidencia de NOLVADEX (citrato de tamoxifeno) fue del 10 % frente al 3 % del placebo, una observación de significación estadística marginal.
En otros estudios adyuvantes, Toronto y NOLVADEX (citrato de tamoxifeno) de la Organización de Ensayos Adyuvantes (NATO), las mujeres recibieron NOLVADEX (citrato de tamoxifeno) o ninguna terapia. En el estudio de Toronto, se observaron sofocos en el 29 % de los pacientes tratados con NOLVADEX (citrato de tamoxifeno) frente al 1 % en el grupo no tratado. En el ensayo de la OTAN, se informaron sofocos y sangrado vaginal en el 2,8 % y el 2,0 % de las mujeres, respectivamente, para NOLVADEX (citrato de tamoxifeno) frente al 0,2 % para cada uno en el grupo no tratado.
Ensayo adyuvante de anastrozol: estudio de anastrozol en comparación con NOLVADEX (citrato de tamoxifeno) para el tratamiento adyuvante del cáncer de mama temprano (ver FARMACOLOGÍA CLÍNICA - Estudios clínicos).
En una mediana de seguimiento de 33 meses, la combinación de anastrozol y NOLVADEX (citrato de tamoxifeno) no demostró ningún beneficio de eficacia en comparación con la terapia con NOLVADEX (citrato de tamoxifeno) administrada sola en todos los pacientes, así como en la subpoblación con receptores hormonales positivos. Este brazo de tratamiento se suspendió del ensayo. La mediana de duración del tratamiento adyuvante para la evaluación de la seguridad fue de 59,8 meses y 59,6 meses para los pacientes que recibieron 1 mg de anastrozol y 20 mg de NOLVADEX (citrato de tamoxifeno), respectivamente.
Los eventos adversos que ocurrieron con una incidencia de al menos el 5% en cualquiera de los grupos de tratamiento durante el tratamiento o dentro de los 14 días posteriores al final del tratamiento se presentan en la siguiente tabla.
Eventos adversos que ocurren con una incidencia de al menos el 5% en cualquiera de los grupos de tratamiento durante el tratamiento o dentro de los 14 días posteriores al final del tratamiento
Ciertos eventos adversos y combinaciones de eventos adversos se especificaron prospectivamente para el análisis, en función de las propiedades farmacológicas conocidas y los perfiles de efectos secundarios de los dos fármacos (consulte la siguiente tabla).
Número (%) de pacientes con eventos adversos preespecificados en el ensayo adyuvante de anastrozol1
Los pacientes que recibieron anastrozol tuvieron un aumento de los trastornos articulares (incluyendo artritis, artrosis y artralgia) en comparación con los pacientes que recibieron NOLVADEX (citrato de tamoxifeno). Los pacientes que recibieron anastrozol tuvieron un aumento en la incidencia de todas las fracturas (específicamente fracturas de columna, cadera y muñeca) [315 (10%)] en comparación con los pacientes que recibieron NOLVADEX (citrato de tamoxifeno) [209 (7%)]. Los pacientes que recibieron anastrozol tuvieron una disminución de los sofocos, el sangrado vaginal, el flujo vaginal, el cáncer de endometrio, los eventos tromboembólicos venosos y los eventos cerebrovasculares isquémicos en comparación con los pacientes que recibieron NOLVADEX (citrato de tamoxifeno).
Los pacientes que recibieron NOLVADEX (citrato de tamoxifeno) tuvieron una disminución de la hipercolesterolemia (108 [3,5 %]) en comparación con los pacientes que recibieron anastrozol (278 [9 %]). Se notificó angina de pecho en 71 [2,3 %] pacientes del brazo de anastrozol y en 51 [1,6 %] pacientes del brazo de NOLVADEX (citrato de tamoxifeno); se notificó infarto de miocardio en 37 [1,2 %] pacientes del grupo de anastrozol y en 34 [1,1 %] pacientes del grupo de NOLVADEX (citrato de tamoxifeno).
Los resultados del subestudio óseo del ensayo adyuvante, a los 12 y 24 meses, demostraron que los pacientes que recibieron anastrozol tuvieron una disminución media tanto en la columna lumbar como en la densidad mineral ósea (DMO) total de la cadera en comparación con el valor inicial. Los pacientes que recibieron NOLVADEX (citrato de tamoxifeno) tuvieron un aumento medio en la DMO de la columna lumbar y de la cadera total en comparación con el valor inicial.
Carcinoma ductal in situ (CDIS)
El tipo y la frecuencia de los eventos adversos en el ensayo NSABP B-24 fueron consistentes con los observados en los otros ensayos adyuvantes realizados con NOLVADEX (citrato de tamoxifeno).
Reducción de la incidencia de cáncer de mama en mujeres de alto riesgo
En el ensayo NSABP P-1, hubo un aumento de cinco efectos adversos graves en el grupo de NOLVADEX (citrato de tamoxifeno): cáncer de endometrio (33 casos en el grupo de NOLVADEX (citrato de tamoxifeno) frente a 14 en el grupo de placebo); embolia pulmonar (18 casos en el grupo de NOLVADEX (citrato de tamoxifeno) frente a 6 en el grupo de placebo); trombosis venosa profunda (30 casos en el grupo NOLVADEX (citrato de tamoxifeno) frente a 19 en el grupo placebo); accidente cerebrovascular (34 casos en el grupo NOLVADEX (citrato de tamoxifeno) frente a 24 en el grupo placebo); formación de cataratas (540 casos en el grupo de NOLVADEX (citrato de tamoxifeno) frente a 483 en el grupo de placebo) y cirugía de cataratas (101 casos en el grupo de NOLVADEX (citrato de tamoxifeno) frente a 63 en el grupo de placebo) (Ver ADVERTENCIAS y la Tabla 3 en FARMACOLOGÍA CLÍNICA ).
La siguiente tabla presenta los eventos adversos observados en NSABP P-1 por brazo de tratamiento. Solo se muestran los eventos adversos más comunes con NOLVADEX (citrato de tamoxifeno) que con el placebo.
En el ensayo NSABP P-1, el 15,0 % y el 9,7 % de los participantes que recibieron tratamiento con NOLVADEX (citrato de tamoxifeno) y placebo, respectivamente, se retiraron del ensayo por motivos médicos. Las siguientes son las razones médicas para retirarse de la terapia con NOLVADEX (citrato de tamoxifeno) y placebo, respectivamente: sofocos (3,1 % frente a 1,5 %) y secreción vaginal (0,5 % frente a 0,1 %).
En el ensayo NSABP P-1, el 8,7 % y el 9,6 % de los participantes que recibieron tratamiento con NOLVADEX (citrato de tamoxifeno) y placebo, respectivamente, se retiraron por razones no médicas.
En el ensayo NSABP P-1, se produjeron bochornos de cualquier gravedad en el 68 % de las mujeres que recibieron placebo y en el 80 % de las mujeres que recibieron NOLVADEX (citrato de tamoxifeno). Se produjeron bochornos intensos en el 28 % de las mujeres que recibieron placebo y en el 45 % de las mujeres que recibieron NOLVADEX (citrato de tamoxifeno). El flujo vaginal ocurrió en el 35 % y el 55 % de las mujeres que recibieron placebo y NOLVADEX (citrato de tamoxifeno), respectivamente; y fue grave en 4,5% y 12,3% respectivamente. No hubo diferencia en la incidencia de sangrado vaginal entre los brazos de tratamiento.
Pacientes pediátricos - Síndrome de McCune-Albright
El volumen uterino medio aumentó después de 6 meses de tratamiento y se duplicó al final del estudio de un año. Una relación casual no ha sido establecida; sin embargo, como se ha observado un aumento en la incidencia de adenocarcinoma endometrial y sarcoma uterino en adultos tratados con NOLVADEX (ver ADVERTENCIA EN CAJA ), se recomienda el seguimiento continuo de los efectos a largo plazo de los pacientes de McCune-Albright tratados con NOLVADEX (citrato de tamoxifeno). La seguridad y eficacia de NOLVADEX (citrato de tamoxifeno) para niñas de dos a 10 años con síndrome de McCune-Albright y pubertad precoz no se han estudiado más allá de un año de tratamiento. No se han establecido los efectos a largo plazo de la terapia con NOLVADEX (citrato de tamoxifeno) en niñas.
Experiencia posterior a la comercialización
Las reacciones adversas notificadas con menos frecuencia son sangrado vaginal, flujo vaginal, irregularidades menstruales, erupción cutánea y dolores de cabeza. Por lo general, estos no han sido lo suficientemente graves como para requerir una reducción de la dosis o la interrupción del tratamiento. Se han informado informes muy raros de eritema multiforme, síndrome de Stevens-Johnson, penfigoide ampolloso, neumonitis intersticial e informes raros de reacciones de hipersensibilidad, incluido angioedema, con la terapia con NOLVADEX (citrato de tamoxifeno). En algunos de estos casos, el tiempo de aparición fue superior a un año. En raras ocasiones, la elevación de los niveles de triglicéridos séricos, en algunos casos con pancreatitis, puede estar asociada con el uso de NOLVADEX (citrato de tamoxifeno) (ver PRECAUCIONES- Interacciones entre medicamentos y pruebas de laboratorio sección).
INTERACCIONES CON LA DROGAS
Cuando se utiliza NOLVADEX (citrato de tamoxifeno) en combinación con anticoagulantes de tipo cumarínico, puede producirse un aumento significativo del efecto anticoagulante. Cuando exista tal coadministración, se recomienda un control cuidadoso del tiempo de protrombina del paciente.
En el ensayo NSABP P-1, las mujeres que requirieron anticoagulantes de tipo cumarínico por cualquier motivo no fueron elegibles para participar en el ensayo (Ver CONTRAINDICACIONES ).
Existe un mayor riesgo de eventos tromboembólicos cuando se usan agentes citotóxicos en combinación con NOLVADEX (citrato de tamoxifeno).
El tamoxifeno redujo las concentraciones plasmáticas de letrozol en un 37 %. Se desconoce el efecto del tamoxifeno sobre el metabolismo y la excreción de otros fármacos antineoplásicos, como la ciclofosfamida y otros fármacos que requieren oxidasas de función mixta para su activación. Se ha demostrado que las concentraciones plasmáticas de tamoxifeno y N-desmetil tamoxifeno se reducen cuando se administran conjuntamente con rifampicina o aminoglutetimida. Se considera que la inducción del metabolismo mediado por CYP3A4 es el mecanismo por el cual ocurren estas reducciones; No se han estudiado otros agentes inductores de CYP3A4 para confirmar este efecto.
Un paciente que recibió NOLVADEX (citrato de tamoxifeno) con fenobarbital concomitante exhibió un nivel sérico de tamoxifeno en el estado estacionario más bajo que el observado en otros pacientes (es decir, 26 ng/ml frente al valor medio de 122 ng/ml). Sin embargo, se desconoce la importancia clínica de este hallazgo. La rifampicina indujo el metabolismo del tamoxifeno y redujo significativamente las concentraciones plasmáticas de tamoxifeno en 10 pacientes. La aminoglutetimida reduce las concentraciones plasmáticas de tamoxifeno y N-desmetil tamoxifeno. La medroxiprogesterona reduce las concentraciones plasmáticas de N-desmetil, pero no las del tamoxifeno.
Se ha demostrado que la terapia concomitante con bromocriptina eleva el tamoxifeno sérico y el N-desmetil tamoxifeno.
Según los resultados clínicos y farmacocinéticos del ensayo adyuvante de anastrozol, NOLVADEX (citrato de tamoxifeno) no debe administrarse con anastrozol (ver FARMACOLOGÍA CLÍNICA - Interacciones Fármaco-Fármaco sección).
Interacciones entre drogas y pruebas de laboratorio
Durante la vigilancia posterior a la comercialización, se informaron elevaciones de T4 en algunas pacientes posmenopáusicas, lo que puede explicarse por aumentos en la globulina transportadora de tiroides. Estas elevaciones no se acompañaron de hipertiroidismo clínico.
Las variaciones en el índice cariopicnótico en los frotis vaginales y los diversos grados de efecto de los estrógenos en los frotis de Papanicolaou se han observado con poca frecuencia en pacientes posmenopáusicas que recibieron NOLVADEX (citrato de tamoxifeno).
En la experiencia posterior a la comercialización con NOLVADEX (citrato de tamoxifeno), se han informado casos poco frecuentes de hiperlipidemias. El control periódico de los triglicéridos y el colesterol plasmáticos puede estar indicado en pacientes con hiperlipidemias preexistentes (Ver REACCIONES ADVERSAS-Experiencia posterior a la comercialización sección).
ADVERTENCIAS
Efectos en pacientes con cáncer de mama metastásico
Al igual que con otras terapias hormonales aditivas (estrógenos y andrógenos), se ha informado hipercalcemia en algunos pacientes con cáncer de mama con metástasis óseas a las pocas semanas de comenzar el tratamiento con NOLVADEX (citrato de tamoxifeno). Si se produce hipercalcemia, se deben tomar las medidas apropiadas y, si es grave, se debe suspender NOLVADEX (citrato de tamoxifeno).
Efectos sobre el útero-cáncer de endometrio y sarcoma uterino
Se ha informado una mayor incidencia de neoplasias uterinas en asociación con el tratamiento con NOLVADEX (citrato de tamoxifeno). Se desconoce el mecanismo subyacente, pero puede estar relacionado con el efecto similar al estrógeno de NOLVADEX (citrato de tamoxifeno). La mayoría de las neoplasias uterinas observadas en asociación con NOLVADEX (citrato de tamoxifeno) se clasifican como adenocarcinoma de endometrio. Sin embargo, también se han notificado sarcomas uterinos raros, incluidos los tumores müllerianos mixtos malignos (MMMT). El sarcoma uterino generalmente se asocia con un estadio FIGO más alto (III/IV) en el momento del diagnóstico, un peor pronóstico y una supervivencia más corta. Se ha informado que el sarcoma uterino ocurre con mayor frecuencia entre las usuarias a largo plazo (≥ 2 años) de NOLVADEX (citrato de tamoxifeno) que entre las no usuarias. Algunas de las neoplasias malignas uterinas (carcinoma endometrial o sarcoma uterino) han sido fatales.
En el ensayo NSABP P-1, entre las participantes aleatorizadas a NOLVADEX (citrato de tamoxifeno) hubo un aumento estadísticamente significativo en la incidencia de cáncer de endometrio (33 casos de cáncer de endometrio invasivo, en comparación con 14 casos entre las participantes aleatorizadas a placebo (RR=2,48 , IC del 95 %: 1,27-4,92). Los 33 casos en participantes que recibieron NOLVADEX (citrato de tamoxifeno) se encontraban en estadio I de FIGO, incluidos 20 adenocarcinomas endometriales IA, 12 IB y 1 IC. En las participantes asignadas al azar a placebo, 13 se encontraban en estadio I de FIGO (8 IA y 5 IB) y 1 estaba en estadio IV de FIGO. Cinco mujeres con NOLVADEX (citrato de tamoxifeno) y 1 con placebo recibieron radioterapia posoperatoria además de la cirugía. Este aumento se observó principalmente entre mujeres de al menos 50 años de edad en el momento de la aleatorización (26 casos de cáncer de endometrio invasivo, en comparación con 6 casos entre las participantes aleatorizadas a placebo (RR=4,50, IC del 95 %: 1,78-13,16). Entre las mujeres ≤ 49 años de edad en el momento de la aleatorización hubo 7 casos de yo cáncer de endometrio invasivo, en comparación con 8 casos entre las participantes asignadas al azar a placebo (RR = 0,94, IC del 95 %: 0,28-2,89). Si se considera la edad en el momento del diagnóstico, hubo 4 casos de cáncer de endometrio entre las participantes ≤ 49 años asignadas al azar a NOLVADEX (citrato de tamoxifeno) en comparación con 2 entre las participantes asignadas al azar al placebo (RR = 2,21, IC del 95 %: 0,4-12,0). Para las mujeres ≥ 50 años en el momento del diagnóstico, hubo 29 casos entre las participantes asignadas al azar a NOLVADEX (citrato de tamoxifeno) en comparación con 12 entre las mujeres que recibieron placebo (RR=2,5, IC del 95 %: 1,3-4,9). Los cocientes de riesgo fueron similares en los dos grupos, aunque ocurrieron menos eventos en mujeres más jóvenes. La mayoría de los cánceres de endometrio (29 de 33 casos en el grupo de NOLVADEX (citrato de tamoxifeno)) se diagnosticaron en mujeres sintomáticas, aunque 5 de 33 casos en el grupo de NOLVADEX (citrato de tamoxifeno) ocurrieron en mujeres asintomáticas. Entre las mujeres que recibieron NOLVADEX (citrato de tamoxifeno), los eventos aparecieron entre 1 y 61 meses (promedio = 32 meses) desde el inicio del tratamiento.
En una revisión actualizada de datos a largo plazo (la mediana de la duración del seguimiento total es de 6,9 años, incluido el seguimiento ciego) de 8306 mujeres con útero intacto en el momento de la aleatorización en el ensayo de reducción de riesgos NSABP P-1, la incidencia de ambos adenocarcinomas y raros sarcomas uterinos aumentó en mujeres que tomaban NOLVADEX (citrato de tamoxifeno). Durante el seguimiento a ciegas, hubo 36 casos de adenocarcinoma endometrial en estadio I de FIGO (22 en estadio IA de FIGO, 13 en IB y 1 IC) en mujeres que recibieron NOLVADEX (citrato de tamoxifeno) y 15 casos en mujeres que recibieron placebo [14 en estadio de FIGO I (9 IA y 5 IB), y 1 caso fue FIGO Estadio IV]. De las pacientes que recibieron NOLVADEX (citrato de tamoxifeno) que desarrollaron cáncer de endometrio, una con cánceres en Etapa IA y 4 con cánceres en Etapa IB recibieron radioterapia. En el grupo de placebo, un paciente con cáncer en estadio 1B de FIGO recibió radioterapia y el paciente con cáncer en estadio IVB de FIGO recibió quimioterapia y terapia hormonal. Durante el seguimiento total, se notificó adenocarcinoma endometrial en 53 mujeres asignadas al azar a NOLVADEX (citrato de tamoxifeno) (30 casos en estadio IA de FIGO, 20 en estadio IB, 1 en estadio IC y 2 en estadio IIIC) y 17 mujeres asignadas al azar a placebo (9 casos en estadio IA de FIGO, 6 en estadio IB, 1 en estadio IIIC y 1 en estadio IVB) (incidencia por 1000 mujeres-año de 2,20 y 0,71, respectivamente). Algunos pacientes recibieron radioterapia posoperatoria además de la cirugía. Se informaron sarcomas uterinos en 4 mujeres aleatorizadas a NOLVADEX (citrato de tamoxifeno) (1 era FIGO IA, 1 era FIGO IB, 1 era FIGO IIA y 1 era FIGO IIIC) y una paciente aleatorizada para recibir placebo (FIGO 1A); incidencia por 1.000 mujeres-año de 0,17 y 0,04, respectivamente. De los pacientes aleatorizados a NOLVADEX (citrato de tamoxifeno), los casos FIGO IA y IB fueron MMMT y sarcoma, respectivamente; el FIGO II era un MMMT; y el FIGO III era un sarcoma; y el único paciente asignado al azar a placebo tenía un MMMT. Se observó un aumento similar en la incidencia de adenocarcinoma endometrial y sarcoma uterino entre las mujeres que recibieron NOLVADEX (citrato de tamoxifeno) en otros cinco ensayos clínicos del NSABP.
Cualquier paciente que reciba o haya recibido previamente NOLVADEX (citrato de tamoxifeno) que informe sangrado vaginal anormal debe ser evaluado de inmediato. Las pacientes que reciben o han recibido previamente NOLVADEX (citrato de tamoxifeno) deben someterse a exámenes ginecológicos anuales y deben informar de inmediato a sus médicos si experimentan algún síntoma ginecológico anormal, por ejemplo, irregularidades menstruales, sangrado vaginal anormal, cambios en el flujo vaginal o dolor pélvico o presión.
En el ensayo P-1, el muestreo endometrial no alteró la tasa de detección de cáncer de endometrio en comparación con las mujeres que no se sometieron a muestreo endometrial (0,6 % con muestreo, 0,5 % sin muestreo) para mujeres con útero intacto. No hay datos que sugieran que el muestreo endometrial de rutina en mujeres asintomáticas que toman NOLVADEX (citrato de tamoxifeno) para reducir la incidencia de cáncer de mama sería beneficioso.
Efectos no malignos en el útero
Se ha informado una mayor incidencia de cambios endometriales que incluyen hiperplasia y pólipos en asociación con el tratamiento con NOLVADEX (citrato de tamoxifeno). La incidencia y el patrón de este aumento sugieren que el mecanismo subyacente está relacionado con las propiedades estrogénicas de NOLVADEX (citrato de tamoxifeno).
Ha habido algunos informes de endometriosis y fibromas uterinos en mujeres que reciben NOLVADEX (citrato de tamoxifeno). El mecanismo subyacente puede deberse al efecto estrogénico parcial de NOLVADEX (citrato de tamoxifeno). También se han observado quistes ováricos en un pequeño número de pacientes premenopáusicas con cáncer de mama avanzado que han sido tratadas con NOLVADEX (citrato de tamoxifeno).
Se ha informado que NOLVADEX (citrato de tamoxifeno) causa irregularidades menstruales o amenorrea.
Efectos tromboembólicos de NOLVADEX (citrato de tamoxifeno)
Existe evidencia de una mayor incidencia de eventos tromboembólicos, incluyendo trombosis venosa profunda y embolia pulmonar, durante la terapia con NOLVADEX (citrato de tamoxifeno). Cuando NOLVADEX (citrato de tamoxifeno) se coadministra con quimioterapia, puede haber un aumento adicional en la incidencia de efectos tromboembólicos. Para el tratamiento del cáncer de mama, se deben considerar cuidadosamente los riesgos y beneficios de NOLVADEX (citrato de tamoxifeno) en mujeres con antecedentes de eventos tromboembólicos. En un pequeño subestudio (N=81) del ensayo NSABP P-1, no pareció haber ningún beneficio en la detección de las mutaciones del factor V Leiden y la protrombina G20210A en las mujeres como medio para identificar a aquellas que pueden no ser candidatas apropiadas para NOLVADEX (tamoxifeno). citrato) terapia.
Los datos del ensayo NSABP P-1 muestran que los participantes que recibieron NOLVADEX (citrato de tamoxifeno) sin antecedentes de embolia pulmonar (EP) tuvieron un aumento estadísticamente significativo de embolia pulmonar (18-NOLVADEX (citrato de tamoxifeno), 6-placebo, RR=3,01 , IC 95%: 1,15-9,27). Tres de los émbolos pulmonares, todos en el brazo de NOLVADEX (citrato de tamoxifeno), fueron fatales. Ochenta y siete por ciento de los casos de embolia pulmonar ocurrieron en mujeres de al menos 50 años de edad en el momento de la aleatorización. Entre las mujeres que recibieron NOLVADEX (citrato de tamoxifeno), los eventos aparecieron entre 2 y 60 meses (promedio = 27 meses) desde el inicio del tratamiento.
En esta misma población, se observó un aumento estadísticamente no significativo de la trombosis venosa profunda (TVP) en el grupo de NOLVADEX (citrato de tamoxifeno) (30-NOLVADEX (citrato de tamoxifeno), 19-placebo; RR=1,59, IC del 95 %: 0,86 -2,98). Se observó el mismo aumento en el riesgo relativo en mujeres ≤ 49 y en mujeres ≥ 50, aunque ocurrieron menos eventos en mujeres más jóvenes. Las mujeres con eventos tromboembólicos tenían riesgo de un segundo evento relacionado (7 de 25 mujeres con placebo, 5 de 48 mujeres con NOLVADEX (citrato de tamoxifeno)) y tenían riesgo de complicaciones del evento y su tratamiento (0/25 con placebo, 4/48 en NOLVADEX (citrato de tamoxifeno)). Entre las mujeres que recibieron NOLVADEX (citrato de tamoxifeno), se produjeron eventos de trombosis venosa profunda entre 2 y 57 meses (promedio = 19 meses) desde el inicio del tratamiento.
Hubo un aumento estadísticamente no significativo de accidentes cerebrovasculares entre los pacientes asignados al azar a NOLVADEX (citrato de tamoxifeno) (24-placebo; 34-NOLVADEX (citrato de tamoxifeno); RR = 1,42; IC del 95 %: 0,82 a 2,51). Seis de los 24 accidentes cerebrovasculares en el grupo de placebo se consideraron de origen hemorrágico y 10 de los 34 accidentes cerebrovasculares en el grupo de NOLVADEX (citrato de tamoxifeno) se clasificaron como hemorrágicos. Diecisiete de los 34 accidentes cerebrovasculares en el grupo de NOLVADEX (citrato de tamoxifeno) se consideraron oclusivos y 7 se consideraron de etiología desconocida. Se informó que 14 de los 24 accidentes cerebrovasculares en el brazo de placebo fueron oclusivos y 4 de etiología desconocida. Entre estos accidentes cerebrovasculares, 3 accidentes cerebrovasculares en el grupo de placebo y 4 accidentes cerebrovasculares en el grupo de NOLVADEX (citrato de tamoxifeno) fueron fatales. Ochenta y ocho por ciento de los accidentes cerebrovasculares ocurrieron en mujeres de al menos 50 años de edad en el momento de la aleatorización. Entre las mujeres que recibieron NOLVADEX (citrato de tamoxifeno), los eventos ocurrieron entre 1 y 63 meses (promedio = 30 meses) desde el inicio del tratamiento.
Efectos sobre el hígado: cáncer de hígado
En el ensayo sueco que usó NOLVADEX (citrato de tamoxifeno) adyuvante 40 mg/día durante 2 a 5 años, se informaron 3 casos de cáncer de hígado en el grupo tratado con NOLVADEX (citrato de tamoxifeno) versus 1 caso en el grupo de observación (Ver PRECAUCIONES- Carcinogénesis ). En otros ensayos clínicos que evalúan NOLVADEX (citrato de tamoxifeno), hasta la fecha no se han notificado casos de cáncer de hígado.
Se informó un caso de cáncer de hígado en NSABP P-1 en un participante asignado al azar a NOLVADEX (citrato de tamoxifeno).
Efectos sobre el hígado: Efectos no malignos
NOLVADEX (citrato de tamoxifeno) se ha asociado con cambios en los niveles de enzimas hepáticas y, en raras ocasiones, con un espectro de anomalías hepáticas más graves, como hígado graso, colestasis, hepatitis y necrosis hepática. Algunos de estos casos graves incluyeron muertes. En la mayoría de los casos informados, la relación con NOLVADEX (citrato de tamoxifeno) es incierta. Sin embargo, se han informado algunos nuevos desafíos y desafíos positivos.
En el ensayo NSABP P-1, se observaron pocos cambios de grado 3-4 en la función hepática (SGOT, SGPT, bilirrubina, fosfatasa alcalina) (10 con placebo y 6 con NOLVADEX (citrato de tamoxifeno)). Los lípidos séricos no se recolectaron sistemáticamente.
Otros tipos de cáncer
Después del tratamiento de cáncer de mama con NOLVADEX (citrato de tamoxifeno) en ensayos clínicos, se han informado varios segundos tumores primarios, que ocurren en sitios distintos del endometrio. Los datos de los estudios NSABP B-14 y P-1 no muestran un aumento en otros cánceres (no uterinos) entre pacientes que reciben NOLVADEX (citrato de tamoxifeno) . Aún no se sabe si un mayor riesgo de otros cánceres (no uterinos) está asociado con NOLVADEX (citrato de tamoxifeno) y continúa evaluándose.
Efectos en el ojo
Se han informado alteraciones oculares, incluidos cambios en la córnea, disminución en la percepción de la visión del color, trombosis de la vena retiniana y retinopatía en pacientes que reciben NOLVADEX (citrato de tamoxifeno). Se ha informado una mayor incidencia de cataratas y la necesidad de cirugía de cataratas en pacientes que reciben NOLVADEX (citrato de tamoxifeno).
En el ensayo NSABP P-1, se observó un mayor riesgo de significación limítrofe de desarrollar cataratas entre aquellas mujeres sin cataratas al inicio (540-NOLVADEX (citrato de tamoxifeno); 483-placebo; RR=1,13, IC del 95 %: 1,00-1,28). observado. Entre estas mismas mujeres, NOLVADEX (citrato de tamoxifeno) se asoció con un mayor riesgo de someterse a una cirugía de cataratas (101-NOLVADEX (citrato de tamoxifeno); 63-placebo; RR = 1,62, IC del 95 %: 1,18-2,22) (consulte la Tabla 3 en FARMACOLOGÍA CLÍNICA ). Entre todas las mujeres en el ensayo (con o sin cataratas al inicio del estudio), NOLVADEX (citrato de tamoxifeno) se asoció con un mayor riesgo de someterse a una cirugía de cataratas (201-NOLVADEX (citrato de tamoxifeno); 129-placebo; RR = 1,58, IC del 95 % 1.26-1.97). No se requirieron exámenes oculares durante el estudio. No se pueden sacar otras conclusiones con respecto a los eventos oftálmicos distintos de las cataratas.
Embarazo Categoría D
NOLVADEX (citrato de tamoxifeno) puede causar daño fetal cuando se administra a una mujer embarazada. Se debe advertir a las mujeres que no queden embarazadas mientras toman NOLVADEX (citrato de tamoxifeno) o dentro de los 2 meses posteriores a la interrupción de NOLVADEX (citrato de tamoxifeno) y deben usar medidas anticonceptivas de barrera o no hormonales si son sexualmente activas. El tamoxifeno no causa infertilidad, incluso en presencia de irregularidades menstruales. Se esperan efectos sobre las funciones reproductivas a partir de las propiedades antiestrogénicas del fármaco. En estudios reproductivos en ratas a niveles de dosis iguales o inferiores a la dosis humana, se observaron cambios en el desarrollo esquelético no teratogénicos y se encontró que eran reversibles. Además, en estudios de fertilidad en ratas y estudios de teratología en conejos utilizando dosis iguales o inferiores a las utilizadas en humanos, se observó una menor incidencia de implantación embrionaria y una mayor incidencia de muerte fetal o retraso en el crecimiento intrauterino, con un comportamiento de aprendizaje más lento en algunas crías de rata en comparación con los controles históricos. Varios titíes preñados recibieron dosis de 10 mg/kg/día (alrededor de 2 veces la dosis máxima diaria recomendada en humanos en base a mg/m²) durante la organogénesis o en la última mitad del embarazo. No se observaron deformaciones y, aunque la dosis fue lo suficientemente alta como para interrumpir el embarazo en algunos animales, los que mantuvieron el embarazo no mostraron evidencia de malformaciones teratogénicas.
En modelos de desarrollo del tracto reproductivo fetal en roedores, el tamoxifeno (en dosis de 0,002 a 2,4 veces la dosis máxima diaria recomendada en humanos en mg/m²) provocó cambios en ambos sexos similares a los causados por el estradiol, el etinilestradiol y el dietilestilbestrol. Aunque se desconoce la relevancia clínica de estos cambios, algunos de estos cambios, especialmente la adenosis vaginal, son similares a los observados en mujeres jóvenes que estuvieron expuestas al dietilestilbestrol en el útero y que tienen un riesgo de 1 en 1000 de desarrollar adenocarcinoma de células claras de la vagina o cuello uterino. Hasta la fecha, no se ha demostrado que la exposición intrauterina al tamoxifeno cause adenosis vaginal o adenocarcinoma de células claras de la vagina o el cuello uterino en mujeres jóvenes. Sin embargo, solo un pequeño número de mujeres jóvenes han estado expuestas al tamoxifeno en el útero, y un número menor ha sido objeto de un seguimiento lo suficientemente largo (hasta los 15-20 años) para determinar si podría producirse una neoplasia vaginal o cervical como resultado de esta exposición.
No existen ensayos adecuados y bien controlados de tamoxifeno en mujeres embarazadas. Ha habido una pequeña cantidad de informes de sangrado vaginal, abortos espontáneos, defectos de nacimiento y muertes fetales en mujeres embarazadas. Si este medicamento se usa durante el embarazo, o la paciente queda embarazada mientras toma este medicamento, o dentro de aproximadamente dos meses después de suspender la terapia, se debe informar a la paciente sobre los riesgos potenciales para el feto, incluido el riesgo potencial a largo plazo de un DES- como síndrome.
Reducción de la incidencia de cáncer de mama en mujeres de alto riesgo - Categoría de embarazo D
Para mujeres sexualmente activas en edad fértil, la terapia con NOLVADEX (citrato de tamoxifeno) debe iniciarse durante la menstruación. En mujeres con irregularidad menstrual, una B-HCG negativa inmediatamente antes del inicio de la terapia es suficiente (Ver PRECAUCIONES-INFORMACIÓN PARA PACIENTES - Reducción de la incidencia de cáncer de mama en mujeres de alto riesgo ).
PRECAUCIONES
General
En pacientes que toman NOLVADEX (citrato de tamoxifeno) para el cáncer de mama, se han informado ocasionalmente disminuciones en los recuentos de plaquetas, por lo general a 50 000-100 000/mm³, con poca frecuencia menores. En pacientes con trombocitopenia significativa, han ocurrido episodios hemorrágicos raros, pero no está claro si estos episodios se deben a la terapia con NOLVADEX (citrato de tamoxifeno). Se ha observado leucopenia, a veces asociada con anemia y/o trombocitopenia. Ha habido informes raros de neutropenia y pancitopenia en pacientes que reciben NOLVADEX (citrato de tamoxifeno); esto a veces puede ser grave.
En el ensayo NSABP P-1, 6 mujeres con NOLVADEX (citrato de tamoxifeno) y 2 con placebo experimentaron descensos de grado 3-4 en el recuento de plaquetas (≤ 50 000/mm³).
Información para pacientes
Se debe instruir a los pacientes para que lean el Guía de medicamentos suministrado según lo exige la ley cuando se dispensa NOLVADEX 10 mg. El texto completo de la Guía de medicamentos se reproduce al final de este documento.
Reducción del cáncer de mama invasivo y CDIS en mujeres con CDIS
Las mujeres con DCIS tratadas con lumpectomía y radioterapia que están considerando NOLVADEX (citrato de tamoxifeno) para reducir la incidencia de un segundo evento de cáncer de mama deben evaluar los riesgos y beneficios de la terapia, ya que el tratamiento con NOLVADEX (citrato de tamoxifeno) disminuyó la incidencia de cáncer de mama invasivo. cáncer, pero no se ha demostrado que afecte la supervivencia (consulte la Tabla 1 en FARMACOLOGÍA CLÍNICA ).
Reducción de la incidencia de cáncer de mama en mujeres de alto riesgo
Las mujeres que tienen un alto riesgo de cáncer de mama pueden considerar la terapia con NOLVADEX (citrato de tamoxifeno) para reducir la incidencia de cáncer de mama. Si se considera que los beneficios del tratamiento superan los riesgos depende del historial de salud personal de la mujer y de cómo sopesa los beneficios y los riesgos. Por lo tanto, la terapia con NOLVADEX (citrato de tamoxifeno) para reducir la incidencia de cáncer de mama puede no ser apropiada para todas las mujeres con alto riesgo de cáncer de mama. Las mujeres que están considerando la terapia con NOLVADEX (citrato de tamoxifeno) deben consultar a su profesional de la salud para una evaluación de los posibles beneficios y riesgos antes de comenzar la terapia para reducir la incidencia de cáncer de mama (consulte la Tabla 3 en FARMACOLOGÍA CLÍNICA ). Las mujeres deben comprender que NOLVADEX (citrato de tamoxifeno) reduce la incidencia de cáncer de mama, pero es posible que no elimine el riesgo. NOLVADEX (citrato de tamoxifeno) disminuyó la incidencia de tumores pequeños con receptores de estrógeno positivos, pero no alteró la incidencia de tumores con receptores de estrógeno negativos o tumores más grandes. En mujeres con cáncer de mama que tienen un alto riesgo de desarrollar un segundo cáncer de mama, el tratamiento con NOLVADEX (citrato de tamoxifeno) durante aproximadamente 5 años redujo la tasa de incidencia anual de un segundo cáncer de mama en aproximadamente un 50 %.
Las mujeres que están embarazadas o que planean quedar embarazadas no deben tomar NOLVADEX (citrato de tamoxifeno) para reducir el riesgo de cáncer de mama. Todas las mujeres premenopáusicas que toman NOLVADEX (citrato de tamoxifeno) deben usar métodos anticonceptivos no hormonales efectivos y durante aproximadamente dos meses después de suspender la terapia si son sexualmente activas. El tamoxifeno no causa infertilidad, incluso en presencia de irregularidades menstruales. Para mujeres sexualmente activas en edad fértil, la terapia con NOLVADEX (citrato de tamoxifeno) debe iniciarse durante la menstruación. En mujeres con irregularidad menstrual, una B-HCG negativa inmediatamente antes del inicio de la terapia es suficiente (Ver ADVERTENCIAS-Embarazo Categoría D ).
Se realizaron dos ensayos europeos de tamoxifeno para reducir el riesgo de cáncer de mama y no mostraron diferencias en el número de casos de cáncer de mama entre los brazos de tamoxifeno y placebo. Estos estudios tenían diseños de ensayos que diferían de los del NSABP P-1, eran más pequeños que los del NSABP P-1 y reclutaron mujeres con un riesgo menor de cáncer de mama que las del P-1.
Monitoreo durante la terapia con NOLVADEX (citrato de tamoxifeno)
Se debe indicar a las mujeres que toman o han tomado NOLVADEX (citrato de tamoxifeno) que busquen atención médica de inmediato en caso de nuevos bultos en los senos, sangrado vaginal, síntomas ginecológicos (irregularidades menstruales, cambios en el flujo vaginal o dolor o presión en la pelvis), síntomas de hinchazón o sensibilidad, dificultad para respirar inexplicable o cambios en la visión. Las mujeres deben informar a todos los proveedores de atención, independientemente del motivo de la evaluación, que toman NOLVADEX (citrato de tamoxifeno) .
Las mujeres que toman NOLVADEX (citrato de tamoxifeno) para reducir la incidencia de cáncer de mama deben someterse a un examen de mama, una mamografía y un examen ginecológico antes de iniciar la terapia. Estos estudios deben repetirse a intervalos regulares durante el tratamiento, de acuerdo con las buenas prácticas médicas. Las mujeres que toman NOLVADEX (citrato de tamoxifeno) como terapia adyuvante contra el cáncer de mama deben seguir los mismos procedimientos de control que las mujeres que toman NOLVADEX (citrato de tamoxifeno) para reducir la incidencia de cáncer de mama. Las mujeres que toman NOLVADEX (citrato de tamoxifeno) como tratamiento para el cáncer de mama metastásico deben revisar este plan de seguimiento con su proveedor de atención y seleccionar las modalidades y el programa de evaluación apropiados.
Pruebas de laboratorio
Deben obtenerse hemogramas completos periódicos, incluidos los recuentos de plaquetas, y pruebas periódicas de la función hepática.
Durante el ensayo ATAC, se informó que más pacientes que recibieron anastrozol tenían un colesterol sérico elevado en comparación con los pacientes que recibieron NOLVADEX (citrato de tamoxifeno) (9 % versus 3,5 %, respectivamente).
Carcinogénesis
Un estudio de carcinogénesis convencional en ratas a dosis de 5, 20 y 35 mg/kg/día (alrededor de una, tres y siete veces la dosis máxima diaria recomendada en humanos sobre una base de mg/m²) administrada por sonda oral durante un máximo de 2 años ) reveló un aumento significativo en el carcinoma hepatocelular en todas las dosis. La incidencia de estos tumores fue significativamente mayor entre las ratas a las que se les administró 20 o 35 mg/kg/día (69 %) en comparación con las que recibieron 5 mg/kg/día (14 %). En un estudio separado, se administró tamoxifeno a ratas en dosis de 45 mg/kg/día (unas nueve veces la dosis diaria máxima recomendada en humanos sobre una base de mg/m²); la neoplasia hepatocelular se exhibió a los 3 a 6 meses.
Se observaron tumores de ovario de células de la granulosa y tumores testiculares de células intersticiales en dos estudios separados con ratones. A los ratones se les administraron las formas trans y racémica de tamoxifeno durante 13 a 15 meses en dosis de 5, 20 y 50 mg/kg/día (alrededor de la mitad, dos y cinco veces la dosis humana diaria recomendada en mg/m²). base).
mutagénesis
No se encontró potencial genotóxico en una batería convencional de pruebas in vivo e in vitro con sistemas de prueba de procariotas y eucariotas con sistemas de metabolización de fármacos. Sin embargo, se observaron mayores niveles de aductos de ADN mediante el marcaje posterior con 32P en ADN de hígado de rata y linfocitos humanos cultivados. También se ha descubierto que el tamoxifeno aumenta los niveles de formación de micronúcleos in vitro en la línea celular linfoblastoide humana (MCL-5). Según estos hallazgos, el tamoxifeno es genotóxico en células MCL-5 de roedores y humanos.
Deterioro de la fertilidad
El tamoxifeno produjo deterioro de la fertilidad y la concepción en ratas hembra en dosis de 0,04 mg/kg/día (alrededor de 0,01 veces la dosis humana máxima diaria recomendada en mg/m²) cuando se administró durante dos semanas antes del apareamiento hasta el día 7 de embarazo . A esta dosis, los índices de fertilidad y reproducción se redujeron notablemente con la mortalidad fetal total. La mortalidad fetal también aumentó con dosis de 0,16 mg/kg/día (alrededor de 0,03 veces la dosis diaria máxima recomendada en humanos en mg/m²) cuando se administró la dosis a ratas hembra entre los días 7 y 17 del embarazo. El tamoxifeno produjo aborto, parto prematuro y muerte fetal en conejos a los que se administró dosis iguales o superiores a 0,125 mg/kg/día (alrededor de 0,05 veces la dosis diaria máxima recomendada en humanos sobre una base de mg/m²). No hubo cambios teratogénicos ni en ratas ni en conejos.
Embarazo Categoría D
Ver ADVERTENCIAS .
Madres lactantes
Se ha informado que el tamoxifeno inhibe la lactancia. Dos estudios controlados con placebo en más de 150 mujeres han demostrado que el tamoxifeno inhibe significativamente la producción de leche posparto temprana. En ambos estudios, el tamoxifeno se administró dentro de las 24 horas posteriores al parto durante 5 a 18 días. Se desconoce el efecto del tamoxifeno sobre la producción de leche establecida.
No hay datos que aborden si el tamoxifeno se excreta en la leche humana. Si se excreta, no hay datos sobre los efectos del tamoxifeno en la leche materna en el lactante o los animales amamantados. Sin embargo, la exposición neonatal directa al tamoxifeno en ratones y ratas (no a través de la leche materna) produjo 1) lesiones del tracto reproductivo en roedores hembras (similares a las observadas en humanos después de la exposición intrauterina al dietilestilbestrol) y 2) defectos funcionales del tracto reproductivo en roedores machos. roedores tales como atrofia testicular y detención de la espermatogénesis.
No se sabe si NOLVADEX (citrato de tamoxifeno) se excreta en la leche humana. Debido al potencial de reacciones adversas graves en lactantes de NOLVADEX (citrato de tamoxifeno), las mujeres que toman NOLVADEX (citrato de tamoxifeno) no deben amamantar.
Reducción de la incidencia de cáncer de mama en mujeres de alto riesgo con CDIS
No se sabe si NOLVADEX (citrato de tamoxifeno) se excreta en la leche humana. Debido al potencial de reacciones adversas graves en lactantes de NOLVADEX (citrato de tamoxifeno), las mujeres que toman NOLVADEX (citrato de tamoxifeno) no deben amamantar.
Uso pediátrico
La seguridad y eficacia de NOLVADEX (citrato de tamoxifeno) para niñas de dos a 10 años con síndrome de McCune-Albright y pubertad precoz no se han estudiado más allá de un año de tratamiento. No se han establecido los efectos a largo plazo de la terapia con NOLVADEX (citrato de tamoxifeno) para niñas. En adultos tratados con NOLVADEX (citrato de tamoxifeno), se ha observado un aumento en la incidencia de neoplasias malignas uterinas, accidente cerebrovascular y embolia pulmonar (ver ADVERTENCIA EN CAJA , y FARMACOLOGÍA CLÍNICA-Estudios clínicos-Síndrome de McCune-Albright subsección).
Uso geriátrico
En el ensayo NSABP P-1, el porcentaje de mujeres de al menos 65 años fue del 16 %. Las mujeres de al menos 70 años de edad representaron el 6% de los participantes. Se observó una reducción en la incidencia de cáncer de mama entre los participantes en cada uno de los subgrupos: se observaron un total de 28 y 10 cánceres de mama invasivos entre los participantes de 65 años o más en los grupos de placebo y NOLVADEX (citrato de tamoxifeno), respectivamente. En todos los demás resultados, los resultados de este subconjunto reflejan los resultados observados en el subconjunto de mujeres de al menos 50 años de edad. No se observaron diferencias generales en la tolerabilidad entre los pacientes mayores y los más jóvenes (Ver FARMACOLOGÍA CLÍNICA - Estudios clínicos - Reducción de la incidencia de cáncer de mama en mujeres de alto riesgo sección).
En el ensayo NSABP B-24, el porcentaje de mujeres de al menos 65 años fue del 23 %. Las mujeres de al menos 70 años de edad representaron el 10% de los participantes. Se observaron un total de 14 y 12 cánceres de mama invasivos entre las participantes de 65 años o más en los grupos de placebo y NOLVADEX (citrato de tamoxifeno), respectivamente. Este subconjunto es demasiado pequeño para llegar a conclusiones sobre la eficacia. En todos los demás criterios de valoración, los resultados en este subconjunto fueron comparables a los de las mujeres más jóvenes inscritas en este ensayo. No se observaron diferencias generales en la tolerabilidad entre los pacientes mayores y los más jóvenes.
SOBREDOSIS
Los signos observados con las dosis más altas después de los estudios para determinar la DL50 en animales fueron dificultades respiratorias y convulsiones.
No se ha informado sobredosis aguda en humanos. En un estudio de pacientes con cáncer metastásico avanzado que determinó específicamente la dosis máxima tolerada de NOLVADEX (citrato de tamoxifeno) al evaluar el uso de dosis muy altas para revertir la resistencia a múltiples fármacos, se observó neurotoxicidad aguda manifestada por temblor, hiperreflexia, marcha inestable y mareos. Estos síntomas ocurrieron dentro de los 3 a 5 días posteriores al inicio de NOLVADEX (citrato de tamoxifeno) y desaparecieron dentro de los 2 a 5 días posteriores a la suspensión del tratamiento. No se observó toxicidad neurológica permanente. Un paciente experimentó una convulsión varios días después de que se suspendió NOLVADEX (citrato de tamoxifeno) y se resolvieron los síntomas neurotóxicos. Se desconoce la relación causal de la convulsión con la terapia con NOLVADEX (citrato de tamoxifeno). Las dosis administradas a estos pacientes fueron todas superiores a la dosis de carga de 400 mg/m², seguidas de dosis de mantenimiento de 150 mg/m² de NOLVADEX (citrato de tamoxifeno) administradas dos veces al día.
En el mismo estudio, se observó una prolongación del intervalo QT en el electrocardiograma cuando los pacientes recibieron dosis superiores a 250 mg/m² de dosis de carga, seguidas de dosis de mantenimiento de 80 mg/m² de NOLVADEX (citrato de tamoxifeno) administradas dos veces al día. Para una mujer con una superficie corporal de 1,5 m², la dosis de carga mínima y las dosis de mantenimiento administradas en las que se produjeron síntomas neurológicos y cambios en el intervalo QT fueron al menos 6 veces superiores con respecto a la dosis máxima recomendada.
No se conoce un tratamiento específico para la sobredosis; el tratamiento debe ser sintomático.
CONTRAINDICACIONES
NOLVADEX (citrato de tamoxifeno) está contraindicado en pacientes con hipersensibilidad conocida al medicamento oa cualquiera de sus ingredientes.
Reducción de la incidencia de cáncer de mama en mujeres de alto riesgo y mujeres con DCIS
NOLVADEX (citrato de tamoxifeno) está contraindicado en mujeres que requieren terapia concomitante con anticoagulantes de tipo cumarínico o en mujeres con antecedentes de trombosis venosa profunda o embolia pulmonar.
FARMACOLOGÍA CLÍNICA
NOLVADEX (citrato de tamoxifeno) es un agente no esteroideo que ha demostrado potentes propiedades antiestrogénicas en sistemas de prueba con animales. Los efectos antiestrogénicos pueden estar relacionados con su capacidad para competir con el estrógeno por los sitios de unión en los tejidos diana, como la mama. El tamoxifeno inhibe la inducción de carcinoma mamario de rata inducido por dimetilbenzantraceno (DMBA) y provoca la regresión de tumores inducidos por DMBA ya establecidos. En este modelo de rata, el tamoxifeno parece ejercer sus efectos antitumorales al unirse a los receptores de estrógeno.
En citosoles derivados de adenocarcinomas de mama humanos, el tamoxifeno compite con el estradiol por la proteína receptora de estrógeno.
Absorción y Distribución
Luego de una dosis oral única de 20 mg de tamoxifeno, se alcanzó una concentración plasmática máxima promedio de 40 ng/mL (rango de 35 a 45 ng/mL) aproximadamente 5 horas después de la administración. La disminución de las concentraciones plasmáticas de tamoxifeno es bifásica con una vida media de eliminación terminal de aproximadamente 5 a 7 días. La concentración plasmática máxima promedio de N-desmetil tamoxifeno es de 15 ng/mL (rango de 10 a 20 ng/mL). La administración crónica de 10 mg de tamoxifeno dos veces al día durante 3 meses a pacientes da como resultado concentraciones plasmáticas promedio en estado estacionario de 120 ng/mL (rango 67-183 ng/mL) para tamoxifeno y 336 ng/mL (rango 148-654 ng/mL). mL) para N-desmetil tamoxifeno. Las concentraciones plasmáticas promedio en estado estacionario de tamoxifeno y N-desmetil tamoxifeno después de la administración de 20 mg de tamoxifeno una vez al día durante 3 meses son 122 ng/mL (rango 71-183 ng/mL) y 353 ng/mL (rango 152-706 ng /mL), respectivamente. Después del inicio de la terapia, las concentraciones de estado estacionario de tamoxifeno se alcanzan en aproximadamente 4 semanas y las concentraciones de estado estacionario de N-desmetil tamoxifeno se alcanzan en aproximadamente 8 semanas, lo que sugiere una vida media de aproximadamente 14 días para este metabolito. En un estudio cruzado de estado estacionario de comprimidos de NOLVADEX (citrato de tamoxifeno) de 10 mg administrados dos veces al día frente a un comprimido de NOLVADEX (citrato de tamoxifeno) de 20 mg administrado una vez al día, el comprimido de NOLVADEX (citrato de tamoxifeno) de 20 mg fue bioequivalente a los 10 mg NOLVADEX (citrato de tamoxifeno) tabletas.
Metabolismo
El tamoxifeno se metaboliza ampliamente después de la administración oral. El N-desmetil tamoxifeno es el principal metabolito que se encuentra en el plasma de los pacientes. La actividad biológica del N-desmetil tamoxifeno parece ser similar a la del tamoxifeno. El 4-hidroxitamoxifeno y un derivado alcohólico primario de la cadena lateral del tamoxifeno se han identificado como metabolitos menores en el plasma. El tamoxifeno es un sustrato del citocromo P-450 3A, 2C9 y 2D6 y un inhibidor de la glicoproteína P.
Excreción
Los estudios en mujeres que recibieron 20 mg de tamoxifeno 14C demostraron que aproximadamente el 65 % de la dosis administrada se eliminó del cuerpo durante un período de 2 semanas, siendo la excreción fecal la principal vía de eliminación. El fármaco se excreta principalmente como conjugados polares; el fármaco inalterado y los metabolitos no conjugados representan menos del 30 % de la radiactividad fecal total.
Poblaciones Especiales
No se han determinado los efectos de la edad, el género y la raza sobre la farmacocinética del tamoxifeno. No se han determinado los efectos de la función hepática reducida sobre el metabolismo y la farmacocinética del tamoxifeno.
Pacientes pediátricos
La farmacocinética de tamoxifeno y N-desmetil tamoxifeno se caracterizó mediante un análisis farmacocinético poblacional con escasas muestras por paciente obtenidas de 27 pacientes pediátricas de sexo femenino de 2 a 10 años inscritas en un estudio diseñado para evaluar la seguridad, eficacia y farmacocinética de NOLVADEX (tamoxifeno citrato) en el tratamiento del síndrome de McCune-Albright. Los datos completos de dos ensayos farmacocinéticos de citrato de tamoxifeno en los que 59 mujeres posmenopáusicas con cáncer de mama completaron los estudios se incluyeron en el análisis para determinar el modelo farmacocinético estructural para el tamoxifeno. Un modelo de un compartimento proporcionó el mejor ajuste a los datos.
En pacientes pediátricos, una concentración plasmática máxima promedio en estado estacionario (Css, max) y AUC fueron de 187 ng/mL y 4110 ng h/mL, respectivamente, y la Css, max ocurrió aproximadamente 8 horas después de la dosificación. El aclaramiento (CL/F) como peso corporal ajustado en pacientes pediátricas fue aproximadamente 2,3 veces mayor que en pacientes con cáncer de mama. En la cohorte más joven de pacientes pediátricas (niñas de 2 a 6 años), CL/F fue 2,6 veces mayor; en la cohorte de mayor edad (7-10,9 años) CL/F fue aproximadamente 1,9 veces mayor. La exposición al N-desmetil tamoxifeno fue comparable entre los pacientes pediátricos y adultos. La seguridad y eficacia de NOLVADEX (citrato de tamoxifeno) para niñas de dos a 10 años con síndrome de McCune-Albright y pubertad precoz no se han estudiado más allá de un año de tratamiento. No se han establecido los efectos a largo plazo de la terapia con NOLVADEX (citrato de tamoxifeno) en niñas. En adultos tratados con NOLVADEX (citrato de tamoxifeno) se ha observado un aumento en la incidencia de neoplasias malignas uterinas, accidente cerebrovascular y embolia pulmonar (ver ADVERTENCIA EN CAJA ).
Interacciones fármaco-fármaco
Los estudios in vitro demostraron que la eritromicina, la ciclosporina, la nifedipina y el diltiazem inhibían de manera competitiva la formación de N-desmetil tamoxifeno con K1 aparente de 20, 1, 45 y 30 µM, respectivamente. Se desconoce la importancia clínica de estos estudios in vitro.
El tamoxifeno redujo la concentración plasmática de letrozol en un 37 % cuando se administraron conjuntamente estos fármacos. La rifampicina, un inductor del citocromo P-450 3A4, redujo el AUC y la Cmax del tamoxifeno en un 86 % y un 55 %, respectivamente. La aminoglutetimida reduce las concentraciones plasmáticas de tamoxifeno y N-desmetil tamoxifeno. La medroxiprogesterona reduce las concentraciones plasmáticas de N-desmetil, pero no las del tamoxifeno.
En el ensayo adyuvante de anastrozol, la coadministración de anastrozol y NOLVADEX (citrato de tamoxifeno) en pacientes con cáncer de mama redujo la concentración plasmática de anastrozol en un 27 % en comparación con las alcanzadas con anastrozol solo; sin embargo, la coadministración no afectó la farmacocinética de tamoxifeno o N-desmetiltamoxifeno (ver PRECAUCIONES - INTERACCIONES MEDICAMENTOSAS ). NOLVADEX (citrato de tamoxifeno) no debe administrarse junto con anastrozol.
Estudios clínicos
Cáncer de mama metastásico
Mujeres premenopáusicas (NOLVADEX (citrato de tamoxifeno) versus ablación)
Tres estudios prospectivos aleatorizados (Ingle, Pritchard, Buchanan) compararon NOLVADEX (citrato de tamoxifeno) con la ablación ovárica (ooforectomía o irradiación ovárica) en mujeres premenopáusicas con cáncer de mama avanzado. Aunque la tasa de respuesta objetiva, el tiempo hasta el fracaso del tratamiento y la supervivencia fueron similares con ambos tratamientos, la acumulación limitada de pacientes impidió una demostración de equivalencia. En un análisis general de los datos de supervivencia de los 3 estudios, el índice de riesgo de muerte (NOLVADEX (citrato de tamoxifeno)/ablación ovárica) fue de 1,00 con intervalos de confianza del 95 % bilaterales de 0,73 a 1,37. Se han observado estrógenos séricos y plasmáticos elevados en mujeres premenopáusicas que reciben NOLVADEX (citrato de tamoxifeno), pero los datos de los estudios aleatorios no sugieren un efecto adverso de este aumento. Un número limitado de pacientes premenopáusicas con progresión de la enfermedad durante la terapia con NOLVADEX (citrato de tamoxifeno) respondieron a la ablación ovárica posterior.
Cáncer de mama masculino
Los resultados publicados de 122 pacientes (119 evaluables) y los informes de casos de 16 pacientes (13 evaluables) tratados con NOLVADEX (citrato de tamoxifeno) han demostrado que NOLVADEX (citrato de tamoxifeno) es eficaz para el tratamiento paliativo del cáncer de mama masculino. Sesenta y seis de estos 132 pacientes evaluables respondieron a NOLVADEX (citrato de tamoxifeno), lo que constituye una tasa de respuesta objetiva del 50%.
Cáncer de mama adyuvante
Visión general
El Early Breast Cancer Trialists' Collaborative Group (EBCTCG) realizó resúmenes mundiales de la terapia adyuvante sistémica para el cáncer de mama temprano en 1985, 1990 y nuevamente en 1995. En 1998, se informaron datos de resultados de 10 años para 36 689 mujeres en 55 ensayos aleatorios de adyuvante NOLVADEX (citrato de tamoxifeno) utilizando dosis de 20-40 mg/día durante 1-5+ años. El veinticinco por ciento de los pacientes recibió 1 año o menos de tratamiento de prueba, el 52 % recibió 2 años y el 23 % recibió alrededor de 5 años. El cuarenta y ocho por ciento de los tumores eran receptores de estrógeno (ER) positivos (> 10 fmol/mg), el 21 % eran pobres en ER (
Entre las mujeres con cáncer de mama ER positivo o desconocido y ganglios positivos que recibieron alrededor de 5 años de tratamiento, la supervivencia general a los 10 años fue del 61,4 % para NOLVADEX (citrato de tamoxifeno) frente al 50,5 % para el control (logrank 2p
El efecto de la duración programada de tamoxifeno puede describirse como sigue. En mujeres con cáncer de mama ER positivo o desconocido que recibieron NOLVADEX (citrato de tamoxifeno) durante 1 año o menos, 2 años o alrededor de 5 años, las reducciones proporcionales en la mortalidad fueron del 12 %, 17 % y 26 %, respectivamente (tendencia significativa a 2p
El beneficio es menos claro para las mujeres con cáncer de mama pobre en RE en quienes la reducción proporcional de la recurrencia fue del 10 % (2p = 0,007) para todas las duraciones en conjunto, o del 9 % (2p = 0,02) si se excluyen los cánceres de mama contralaterales. La correspondiente reducción de la mortalidad fue del 6% (NS). Los efectos de aproximadamente 5 años de NOLVADEX (citrato de tamoxifeno) sobre la recurrencia y la mortalidad fueron similares independientemente de la edad y la quimioterapia concurrente. No hubo indicios de que las dosis superiores a 20 mg por día fueran más eficaces.
Ensayo ATAC de anastrozol adyuvante: estudio de anastrozol en comparación con NOLVADEX (citrato de tamoxifeno) para el tratamiento adyuvante del cáncer de mama temprano - Se realizó un ensayo adyuvante de anastrozol en 9366 mujeres posmenopáusicas con cáncer de mama operable que fueron aleatorizadas para recibir tratamiento adyuvante con anastrozol 1 mg al día, NOLVADEX (citrato de tamoxifeno) 20 mg al día o una combinación de estos dos tratamientos durante cinco años o hasta la recurrencia de la enfermedad En una mediana de seguimiento de 33 meses, la combinación de anastrozol y NOLVADEX (citrato de tamoxifeno) no demostró ningún beneficio de eficacia en comparación con el tratamiento con NOLVADEX (citrato de tamoxifeno) solo en todos los pacientes, así como en la subpoblación con receptores hormonales positivos. Este brazo de tratamiento se suspendió del ensayo. Por favor refiérase a FARMACOLOGÍA CLÍNICA-Poblaciones especiales-Interacciones fármaco-fármaco , PRECAUCIONES-Exámenes de laboratorio , PRECAUCIONES-Interacciones medicamentosas y REACCIONES ADVERSAS secciones para obtener información de seguridad de este ensayo. Consulte la información de prescripción completa de las tabletas de 1 mg de ARIMIDEX® (anastrozol) para obtener información adicional sobre este ensayo.
Los pacientes en los dos brazos de monoterapia del ensayo ATAC fueron tratados durante una mediana de 60 meses (5 años) y seguidos durante una mediana de 68 meses. La supervivencia libre de enfermedad en la población con intención de tratar mejoró de forma estadísticamente significativa [Hazard Ratio (HR) = 0,87, IC del 95 %: 0,78, 0,97, p = 0,0127] en el brazo de anastrozol en comparación con el brazo de NOLVADEX (citrato de tamoxifeno) .
Nodo positivo: estudios individuales
Dos estudios (Hubay y NSABP B-09) demostraron una supervivencia libre de enfermedad mejorada después de una mastectomía radical o radical modificada en mujeres posmenopáusicas o mujeres de 50 años o más con cáncer de mama curable quirúrgicamente con ganglios axilares positivos cuando NOLVADEX (citrato de tamoxifeno) fue añadido a la quimioterapia citotóxica adyuvante. En el estudio de Hubay, se agregó NOLVADEX (citrato de tamoxifeno) a CMF de "dosis baja" (ciclofosfamida, metotrexato y fluorouracilo). En el estudio NSABP B-09, se añadió NOLVADEX (citrato de tamoxifeno) a melfalán [mostaza de L-fenilalanina (P)] y fluorouracilo (F).
En el estudio de Hubay, los pacientes con un receptor de estrógeno positivo (más de 3 fmol) tenían más probabilidades de beneficiarse. En el estudio NSABP B-09 en mujeres de 50 a 59 años de edad, solo las mujeres con niveles de receptores de estrógeno y progesterona de 10 fmol o más se beneficiaron claramente, mientras que hubo una tendencia estadísticamente significativa hacia efectos adversos en mujeres con niveles de receptores de estrógeno y progesterona menos de 10 fmol. En mujeres de 60 a 70 años, hubo una tendencia hacia un efecto beneficioso de NOLVADEX (citrato de tamoxifeno) sin ninguna relación clara con el estado del receptor de estrógeno o progesterona.
Tres estudios prospectivos (ECOG-1178, Toronto, OTAN) que usaron NOLVADEX (citrato de tamoxifeno) adyuvante como agente único demostraron una supervivencia libre de enfermedad mejorada después de una mastectomía total y disección axilar para mujeres posmenopáusicas con ganglios axilares positivos en comparación con controles con placebo/sin tratamiento . El estudio de la OTAN también demostró un beneficio de supervivencia general.
Nodo Negativo - Estudios Individuales
NSABP B-14, un estudio prospectivo, doble ciego, aleatorizado, comparó NOLVADEX (citrato de tamoxifeno) con placebo en mujeres con cáncer de mama con ganglios axilares negativos y receptores de estrógeno positivos (≥ 10 fmol/mg de proteína citosol) (como terapia adyuvante). , tras mastectomía total y disección axilar, o resección segmentaria
INFORMACIÓN DEL PACIENTE
GUÍA DE MEDICAMENTOS
NOLVADEX (citrato de tamoxifeno) ® (NOLE-vah-dex) Tabletas Nombre genérico: tamoxifeno (ta-MOX-I-fen)
Escrito para mujeres que usan NOLVADEX (citrato de tamoxifeno) para reducir su alta probabilidad de contraer cáncer de mama o que tienen carcinoma ductal in situ (DCIS)
Esta Guía del medicamento analiza solo el uso de NOLVADEX (citrato de tamoxifeno) para reducir la posibilidad de contraer cáncer de mama en mujeres de alto riesgo y en mujeres tratadas por CDIS.
Personas que toman NOLVADEX (citrato de tamoxifeno) para tratar cáncer de mama tienen diferentes beneficios y diferentes decisiones que tomar que las mujeres de alto riesgo o las mujeres con carcinoma ductal in situ (DCIS) que toman NOLVADEX (citrato de tamoxifeno) para reducir la probabilidad de contraer cáncer de mama. Si ya tiene cáncer de mama, hable con su médico acerca de cómo se comparan los beneficios de tratar el cáncer de mama con NOLVADEX (citrato de tamoxifeno) con los riesgos que se describen en este documento.
¿Por qué debo leer esta Guía del medicamento?
Esta guía tiene información para ayudarla a decidir si usar NOLVADEX (citrato de tamoxifeno) para reducir su probabilidad de contraer cáncer de mama.
Usted y su médico deben hablar sobre si el posible beneficio de NOLVADEX (citrato de tamoxifeno) para reducir su alta probabilidad de contraer cáncer de mama es mayor que sus posibles riesgos. Su médico tiene un programa de computadora especial o una calculadora de mano para saber si usted está en el grupo de alto riesgo. Si tiene DCIS y ha sido tratada con cirugía y radioterapia, su médico puede recetarle NOLVADEX (citrato de tamoxifeno) para disminuir su probabilidad de contraer cáncer de mama invasivo (propagación).
Lea esta guía detenidamente antes de comenzar con NOLVADEX (citrato de tamoxifeno) . Es importante leer la información que recibe cada vez que recibe más medicamento. Puede haber algo nuevo. Esta guía no le dice todo acerca de NOLVADEX (citrato de tamoxifeno) y no no tomar el lugar de hablar con su médico.
Solo usted y su médico pueden determinar si NOLVADEX (citrato de tamoxifeno) es adecuado para usted.
¿Cuál es la información más importante que debo saber sobre el uso de NOLVADEX (citrato de tamoxifeno) para reducir la probabilidad de contraer cáncer de mama?
NOLVADEX (citrato de tamoxifeno) es un medicamento recetado que es como el estrógeno (hormona femenina) en algunos aspectos y diferente en otros. En el seno, NOLVADEX (citrato de tamoxifeno) puede bloquear los efectos del estrógeno. Debido a que hace esto, NOLVADEX (citrato de tamoxifeno) puede bloquear el crecimiento de los cánceres de seno que necesitan estrógeno para crecer (cánceres que son receptores de estrógeno o progesterona positivos).
NOLVADEX (citrato de tamoxifeno) puede reducir la posibilidad de contraer cáncer de mama en mujeres con una probabilidad más alta de lo normal de contraer cáncer de mama en los próximos cinco años (mujeres de alto riesgo) y mujeres con CDIS.
Debido a que las mujeres de alto riesgo aún no tienen cáncer, es importante pensar detenidamente si el posible beneficio de NOLVADEX (citrato de tamoxifeno) para reducir la probabilidad de contraer cáncer de mama es mayor que sus posibles riesgos.
Esta Guía del medicamento analiza los riesgos y beneficios del uso de NOLVADEX (citrato de tamoxifeno) para reducir la probabilidad de contraer cáncer de mama en mujeres con alto riesgo y mujeres con CDIS. Esta guía hace no discutir los beneficios especiales y las decisiones para las personas que ya tienen cáncer de mama.
¿Por qué las mujeres y los hombres usan NOLVADEX (citrato de tamoxifeno)?
NOLVADEX (citrato de tamoxifeno) tiene más de un uso. NOLVADEX (citrato de tamoxifeno) se utiliza:
para reducir la posibilidad de contraer cáncer de mama en mujeres con una probabilidad superior a la normal de contraer cáncer de mama en los próximos 5 años (mujeres de alto riesgo)
para reducir la posibilidad de contraer cáncer de mama invasivo (propagación) en mujeres que se sometieron a cirugía y radiación por carcinoma ductal in situ (DCIS). CDIS significa que el cáncer está solo dentro de los conductos lácteos.
para tratar cáncer de mama en mujeres después de haber terminado el tratamiento temprano. El tratamiento temprano puede incluir cirugía, radiación y quimioterapia. NOLVADEX (citrato de tamoxifeno) puede evitar que el cáncer se propague a otras partes del cuerpo. También puede reducir la probabilidad de que la mujer desarrolle un nuevo cáncer de mama. en mujeres y hombres,
para tratar cáncer de mama que se ha propagado a otras partes del cuerpo (cáncer de mama metastásico).
Esta guía solo habla sobre el uso de NOLVADEX (citrato de tamoxifeno) para reducir la posibilidad de contraer cáncer de mama (n.º 1 y n.º 2 anteriores).
¿Cuáles son los beneficios de NOLVADEX (citrato de tamoxifeno) para reducir la posibilidad de contraer cáncer de mama en mujeres de alto riesgo y en mujeres tratadas por CDIS?
Un gran estudio de EE. UU. analizó mujeres de alto riesgo comparó a los que tomaron NOLVADEX (citrato de tamoxifeno) durante 5 años con otros que tomaron una pastilla sin NOLVADEX (citrato de tamoxifeno) (placebo). Las mujeres de alto riesgo se definieron como mujeres que tienen una probabilidad del 1,7 % o más de contraer cáncer de mama en los próximos 5 años, según un programa informático especial. En este estudio:
- De cada 1000 mujeres de alto riesgo que tomó un placebo , cada año alrededor de 7 tienen cáncer de mama.
- De cada 1000 mujeres de alto riesgo que tomó NOLVADEX (citrato de tamoxifeno) , cada año alrededor de 4 tienen cáncer de mama.
El estudio mostró que, en promedio, las mujeres de alto riesgo que tomaron NOLVADEX (citrato de tamoxifeno) redujeron sus posibilidades de contraer cáncer de mama en un 44 %, de 7 en 1000 a 4 en 1000.
Otro estudio estadounidense analizó mujeres con CDIS y comparó a los que tomaron NOLVADEX (citrato de tamoxifeno) durante 5 años con otros que tomaron un placebo. En este estudio:
- De cada 1000 mujeres con DCIS que tomó placebo cada año alrededor de 17 tienen cáncer de mama.
- De cada 1000 mujeres con DCIS que tomó NOLVADEX (citrato de tamoxifeno) , cada año alrededor de 10 tienen cáncer de mama.
El estudio mostró que, en promedio, las mujeres con DCIS que tomaron NOLVADEX (citrato de tamoxifeno) redujeron sus posibilidades de contraer cáncer de mama invasivo (propagación) en un 43 %, de 17 en 1000 a 10 en 1000.
Estos estudios no significan que tomar NOLVADEX (citrato de tamoxifeno) reducirá su probabilidad personal de contraer cáncer de mama. No sabemos cuáles serán los beneficios para cualquier mujer que tome NOLVADEX (citrato de tamoxifeno) para reducir su probabilidad de desarrollar cáncer de mama.
¿Cuáles son los riesgos de NOLVADEX (citrato de tamoxifeno)?
En los estudios descritos en "¿Cuáles son los beneficios de NOLVADEX (citrato de tamoxifeno)?", las mujeres de alto riesgo que tomaron NOLVADEX (citrato de tamoxifeno) experimentaron ciertos efectos secundarios en mayor proporción que aquellas que tomaron un placebo.
Algunos de estos efectos secundarios pueden causar la muerte.
En un estudio, en mujeres que todavía tenían el útero
- De cada 1000 mujeres que tomaron un placebo, cada año 1 contrajo cáncer de endometrio (cáncer del revestimiento del útero) y ninguna sarcoma uterino (cáncer del cuerpo del útero).
- De cada 1000 mujeres que tomaron NOLVADEX (citrato de tamoxifeno), cada año 2 contrajeron cáncer de endometrio y menos de 1 sarcoma uterino.
Estos resultados muestran que, en promedio, en mujeres de alto riesgo que aún tenían su útero , NOLVADEX (citrato de tamoxifeno) duplicó la posibilidad de contraer cáncer de endometrio de 1 en 1000 a 2 en 1000, y aumentó la posibilidad de contraer sarcoma uterino. Esto no significa que tomar NOLVADEX (citrato de tamoxifeno) duplicará su probabilidad personal de contraer cáncer de endometrio o aumentará su probabilidad de contraer sarcoma uterino. No sabemos cuál será este riesgo para ninguna mujer. El riesgo es diferente para las mujeres que ya no tienen el útero.
Para todas las mujeres en este estudio, tomar NOLVADEX (citrato de tamoxifeno) aumentó el riesgo de tener un coágulo de sangre en los pulmones o las venas, o de sufrir un derrame cerebral. En algunos casos, las mujeres morían por estos efectos.
NOLVADEX (citrato de tamoxifeno) aumentó el riesgo de tener cataratas (opacidad del cristalino del ojo) o de necesitar cirugía de cataratas. (Consulte "¿Cuáles son los posibles efectos secundarios de NOLVADEX (citrato de tamoxifeno)?" para obtener más detalles sobre los efectos secundarios).
¿Qué no sabemos acerca de tomar NOLVADEX (citrato de tamoxifeno) para reducir la posibilidad de contraer cáncer de mama?
no sabemos
- si NOLVADEX (citrato de tamoxifeno) reduce la posibilidad de contraer cáncer de mama en mujeres que tienen genes anormales de cáncer de mama (BRCA1 y BRCA2)
- si tomar NOLVADEX (citrato de tamoxifeno) durante 5 años reduce la cantidad de cánceres de seno que una mujer tendrá en su vida o si solo retrasa algunos cánceres de seno
- si NOLVADEX (citrato de tamoxifeno) ayuda a una mujer a vivir más tiempo
- los efectos de tomar NOLVADEX (citrato de tamoxifeno) con terapia de reemplazo hormonal (TRH), píldoras anticonceptivas o andrógenos (hormonas masculinas)
- los beneficios de tomar NOLVADEX (citrato de tamoxifeno) si tiene menos de 35 años
Se están realizando estudios para obtener más información sobre los beneficios y riesgos a largo plazo del uso de NOLVADEX (citrato de tamoxifeno) para reducir la posibilidad de contraer cáncer de mama.
¿Cuáles son los posibles efectos secundarios de NOLVADEX (citrato de tamoxifeno)?
El efecto secundario más común de NOLVADEX (citrato de tamoxifeno) son los sofocos. Esto no es un signo de un problema grave.
El siguiente efecto secundario más común es el flujo vaginal. Si la secreción es sanguinolenta, podría ser un signo de un problema grave. [Consulte "Cambios en el revestimiento (endometrio) o el cuerpo del útero" a continuación.]
Los efectos secundarios menos comunes pero graves de NOLVADEX (citrato de tamoxifeno) se enumeran a continuación. Estos pueden ocurrir en cualquier momento. Llame a su médico de inmediato si tiene alguno de los signos de los efectos secundarios que se enumeran a continuación:
- Cambios en el revestimiento (endometrio) o cuerpo de su útero. Estos cambios pueden significar que están comenzando problemas graves, incluido el cáncer de útero. Los signos de cambios en el útero son:
- Sangrado vaginal o secreción sanguinolenta que podría ser de color óxido o marrón. Debe llamar a su médico incluso si solo se produce una pequeña cantidad de sangrado.
- Cambio en su sangrado mensual, como en la cantidad o el momento del sangrado o aumento de la coagulación.
- Dolor o presión en la pelvis (debajo del ombligo).
- Coágulos de sangre en sus venas o pulmones. Estos pueden causar problemas graves, incluida la muerte. Puede tener coágulos hasta 2-3 meses después de dejar de tomar NOLVADEX (citrato de tamoxifeno). Los signos de coágulos de sangre son:
- dolor repentino en el pecho, dificultad para respirar, tos con sangre
- dolor, sensibilidad o hinchazón en una o ambas piernas
- Carrera. El accidente cerebrovascular puede causar problemas médicos graves, incluida la muerte. Los signos de accidente cerebrovascular son:
- debilidad repentina, hormigueo o entumecimiento en la cara, el brazo o la pierna, especialmente en un lado del cuerpo
- confusión repentina, dificultad para hablar o entender
- problemas repentinos para ver en uno o ambos ojos
- problemas repentinos para caminar, mareos, pérdida del equilibrio o la coordinación
- dolor de cabeza repentino e intenso sin causa conocida
- Cataratas o mayor probabilidad de necesitar una cirugía de cataratas. La señal de estos problemas es una visión borrosa lenta.
- Problemas hepáticos, incluida la ictericia. Los signos de problemas hepáticos incluyen falta de apetito y coloración amarillenta de la piel o la parte blanca de los ojos.
Estos no son todos los posibles efectos secundarios de NOLVADEX (citrato de tamoxifeno). Para obtener una lista completa, consulte a su médico o farmacéutico.
¿Quién no debe tomar NOLVADEX (citrato de tamoxifeno)?
No tome NOLVADEX (citrato de tamoxifeno) por ningún motivo si
- Está embarazada o planea quedar embarazada mientras toma NOLVADEX (citrato de tamoxifeno) o durante los 2 meses después de dejar de tomar NOLVADEX (citrato de tamoxifeno). NOLVADEX (citrato de tamoxifeno) puede dañar a su bebé nonato. Toma alrededor de 2 meses eliminar NOLVADEX (citrato de tamoxifeno) de su cuerpo. Para asegurarse de que no está embarazada, puede comenzar a tomar NOLVADEX (citrato de tamoxifeno) mientras tiene su período menstrual. O bien, puede hacerse una prueba de embarazo para asegurarse de que no está embarazada antes de comenzar.
- Están amamantando. No sabemos si NOLVADEX (citrato de tamoxifeno) puede pasar a través de la leche y dañar a su bebé.
- Ha tenido una reacción alérgica a NOLVADEX (citrato de tamoxifeno) o tamoxifeno (el otro nombre de NOLVADEX (citrato de tamoxifeno)), o a cualquiera de sus ingredientes inactivos.
Si queda embarazada mientras toma NOLVADEX (citrato de tamoxifeno), deje de tomarlo de inmediato y comuníquese con su médico. NOLVADEX (citrato de tamoxifeno) puede dañar a su bebé nonato. No tome NOLVADEX (citrato de tamoxifeno) para reducir la probabilidad de contraer cáncer de mama si
- Alguna vez tuvo un coágulo de sangre que requirió tratamiento médico.
- Está tomando medicamentos para diluir la sangre, como warfarina (también llamada Coumadin®*).
- Su capacidad para moverse es limitada durante la mayor parte de sus horas de vigilia.
- Usted está en riesgo de coágulos de sangre. Su médico puede decirle si tiene un alto riesgo de coágulos de sangre.
- No tiene una probabilidad más alta de lo normal de contraer cáncer de mama. Su médico puede decirle si usted es una mujer de alto riesgo.
¿Cómo debo tomar NOLVADEX (citrato de tamoxifeno)?
- Trague las tabletas enteras, con agua u otro líquido sin alcohol. Puede tomar NOLVADEX (citrato de tamoxifeno) con o sin alimentos. Tome su medicamento todos los días. Puede ser más fácil de recordar si lo toma a la misma hora todos los días.
- Si olvida una dosis, tómela cuando lo recuerde, luego tome la siguiente dosis como de costumbre. Si es casi la hora de su próxima dosis o se acuerda de su próxima dosis, no tome tabletas adicionales para compensar la dosis olvidada.
- Tome NOLVADEX (citrato de tamoxifeno) durante 5 años, a menos que su médico le indique lo contrario.
¿Qué debo evitar mientras tomo citrato de tamoxifeno?
- No quede embarazada mientras toma NOLVADEX (citrato de tamoxifeno) o durante 2 meses después de dejar de tomarlo. NOLVADEX (citrato de tamoxifeno) puede hacer que los métodos anticonceptivos hormonales dejen de funcionar. Los métodos hormonales incluyen píldoras anticonceptivas, parches, inyecciones, anillos e implantes. Por lo tanto, mientras toma NOLVADEX (citrato de tamoxifeno), usar métodos anticonceptivos que no usan hormonas, como condones, diafragmas con espermicida o DIU simples. Si queda embarazada, deje de tomar NOLVADEX (citrato de tamoxifeno) de inmediato y llame a su médico.
- No amamante. No sabemos si NOLVADEX (citrato de tamoxifeno) puede pasar a través de la leche y si puede dañar al bebé.
¿Qué debo hacer mientras tomo NOLVADEX (citrato de tamoxifeno)?
- Hágase chequeos ginecológicos regulares (“exámenes femeninos”), exámenes de los senos y mamografías. Su médico le dirá con qué frecuencia. Estos buscarán signos de cáncer de mama y cáncer de endometrio (revestimiento del útero). Debido a que NOLVADEX (citrato de tamoxifeno) no previene todos los cánceres de seno y es posible que usted padezca otros tipos de cáncer, necesita estos exámenes para detectar cualquier cáncer lo antes posible.
- Debido a que NOLVADEX (citrato de tamoxifeno) puede causar efectos secundarios graves, preste mucha atención a su cuerpo. Los signos que debe buscar se enumeran en "¿Cuáles son los posibles efectos secundarios de NOLVADEX (citrato de tamoxifeno)?"
- Dígale a todos los médicos que ve que está tomando NOLVADEX (citrato de tamoxifeno) .
- Informe a su médico de inmediato si tiene nuevos bultos en los senos.
Información general sobre el uso seguro y eficaz de NOLVADEX (citrato de tamoxifeno)
A veces, los medicamentos se recetan para fines distintos a los enumerados en la Guía del medicamento. Su médico le ha recetado NOLVADEX (citrato de tamoxifeno) solo para usted. No se lo dé a otras personas, incluso si tienen una condición similar, porque les puede hacer daño. No lo use para una condición para la cual no fue recetado.
Esta Guía del medicamento es un resumen de información sobre NOLVADEX (citrato de tamoxifeno) para mujeres que usan NOLVADEX (citrato de tamoxifeno) para reducir su alta probabilidad de contraer cáncer de mama o que tienen CDIS. Si desea obtener más información sobre NOLVADEX (citrato de tamoxifeno), pregunte a su médico o farmacéutico. Ellos le pueden dar información sobre NOLVADEX (citrato de tamoxifeno) que está escrito para profesionales de la salud. Para obtener más información sobre NOLVADEX (citrato de tamoxifeno) o el cáncer de mama, visite www.NOLVADEX (citrato de tamoxifeno) .com o llame al 1-800-236-9933.
Ingredientes: citrato de tamoxifeno, carboximetilcelulosa cálcica, estearato de magnesio, manitol y almidón.
Esta Guía del medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de EE. UU.