Paxil 10mg, 20mg, 30mg, 40mg Paroxetine Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Paxil y cómo se usa?
Paxil 20 mg es un medicamento recetado que se usa para tratar los síntomas de la depresión, el trastorno obsesivo-compulsivo (TOC), el trastorno de pánico, la fobia social, el trastorno de ansiedad generalizada, el trastorno de estrés postraumático (TEPT) y los trastornos disóficos premenstruales (TDPM). Paxil se puede usar solo o con otros medicamentos.
- Paxil 40 mg pertenece a una clase de medicamentos llamados antidepresivos, ISRS.
- No se sabe si Paxil es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Paxil 30 mg?
Paxil 10 mg puede causar efectos secundarios graves que incluyen:
- pensamientos acelerados,
- disminución de la necesidad de dormir,
- comportamiento inusual de toma de riesgos,
- sentimientos de extrema felicidad o tristeza,
- siendo más hablador que de costumbre,
- visión borrosa,
- visión de túnel,
- dolor o hinchazón de los ojos,
- viendo halos alrededor de las luces,
- dolor o sensibilidad inusual en los huesos, hinchazón o moretones,
- cambios de peso,
- cambios en el apetito,
- moretones con facilidad,
- sangrado inusual de la nariz, la boca, la vagina o el recto,
- tosiendo sangre,
- músculos muy rígidos o rígidos,
- fiebre alta,
- transpiración,
- confusión,
- latidos cardíacos rápidos o irregulares,
- temblores,
- desmayo,
- dolor de cabeza,
- confusión,
- dificultad para hablar,
- severa debilidad,
- pérdida de coordinación y
- sentirse inestable
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Paxil 30 mg incluyen:
- cambios de visión,
- debilidad,
- somnolencia,
- mareo,
- cansancio,
- transpiración,
- ansiedad,
- sacudida,
- problemas para dormir (insomnio),
- pérdida de apetito,
- náuseas,
- vómitos,
- Diarrea,
- estreñimiento,
- boca seca,
- infección,
- dolor de cabeza,
- disminución del deseo sexual,
- impotencia,
- eyaculación anormal y
- dificultad para tener un orgasmo
Medicamentos suicidas y antidepresivos
Los antidepresivos aumentaron el riesgo de pensamientos y conductas suicidas (tendencia suicida) en comparación con placebo en niños, adolescentes y adultos jóvenes en estudios a corto plazo de trastorno depresivo mayor (TDM) y otros trastornos psiquiátricos. Cualquiera que esté considerando el uso de PAXIL 40 mg o cualquier otro antidepresivo en un niño, adolescente o adulto joven debe sopesar este riesgo con la necesidad clínica. Los estudios a corto plazo no mostraron un aumento en el riesgo de tendencias suicidas con antidepresivos en comparación con placebo en adultos mayores de 24 años; hubo una reducción del riesgo con los antidepresivos en comparación con el placebo en adultos de 65 años o más. La depresión y ciertos otros trastornos psiquiátricos están asociados con aumentos en el riesgo de suicidio. Los pacientes de todas las edades que comienzan con la terapia antidepresiva deben ser monitoreados apropiadamente y observados de cerca para detectar empeoramiento clínico, tendencias suicidas o cambios inusuales en el comportamiento. Se debe advertir a las familias y cuidadores de la necesidad de una estrecha observación y comunicación con el prescriptor. PAXIL 30mg no está aprobado para uso en pacientes pediátricos. (Consulte ADVERTENCIAS: Empeoramiento clínico y riesgo de suicidio, INFORMACIÓN PARA EL PACIENTE y PRECAUCIONES: Uso pediátrico).
DESCRIPCIÓN
PAXIL (clorhidrato de paroxetina) es un fármaco psicotrópico de administración oral. Es la sal clorhidrato de un compuesto de fenilpiperidina identificado químicamente como (-)-trans-4R-(4'fluorofenil)-3S-[(3',4'-metilendioxifenoxi) metil] piperidina hidrocloruro hemihidrato y tiene la fórmula empírica de C19H20FNO3•HCl•½H2O. El peso molecular es 374,8 (329,4 como base libre). La fórmula estructural del clorhidrato de paroxetina es:
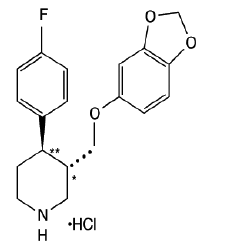
El clorhidrato de paroxetina es un polvo inodoro, blanquecino, con un punto de fusión de 120° a 138°C y una solubilidad de 5,4 mg/mL en agua.
Cada comprimido recubierto con película contiene clorhidrato de paroxetina equivalente a paroxetina de la siguiente manera: 10 mg-amarillo (marcado); 20 mg-rosa (puntuado); 30 mg-azul, 40 mg-verde. Los ingredientes inactivos consisten en fosfato de calcio dibásico dihidrato, hipromelosa, estearato de magnesio, polietilenglicoles, polisorbato 80, glicolato de almidón de sodio, dióxido de titanio y uno o más de los siguientes: D&C Red No. 30 laca de aluminio, D&C Yellow No. 10 laca de aluminio , Laca de aluminio n.º 2 azul FD&C, Laca de aluminio n.º 6 amarillo FD&C.
Suspensión para administración oral
Cada 5 ml de líquido de color naranja con sabor a naranja contiene clorhidrato de paroxetina equivalente a paroxetina, 10 mg. Los ingredientes inactivos consisten en polacrilina potásica, celulosa microcristalina, propilenglicol, glicerina, sorbitol, metilparabeno, propilparabeno, citrato de sodio dihidrato, ácido cítrico anhidro, sacarina de sodio, saborizantes, laca de aluminio FD&C Yellow No. 6 y emulsión de simeticona, USP.
INDICACIONES
PAXIL 20mg está indicado en adultos para el tratamiento de:
- Trastorno depresivo mayor (TDM)
- Trastorno obsesivo compulsivo (TOC)
- Trastorno de pánico (TP)
- Trastorno de ansiedad social (SAD)
- Trastorno de ansiedad generalizada (TAG)
- Trastorno de estrés postraumático (TEPT)
DOSIFICACIÓN Y ADMINISTRACIÓN
Información de administración
Administre PAXIL como dosis única diaria por la mañana, con o sin alimentos.
Agite bien la suspensión oral antes de la administración.
Dosis recomendada para MDD, OCD, PD y PTSD
Las dosis iniciales recomendadas y las dosis máximas de PAXIL 20 mg en pacientes con MDD, OCD, PD y PTSD se presentan en la Tabla 1.
En pacientes con una respuesta inadecuada, aumente la dosis en incrementos de 10 mg por día a intervalos de al menos 1 semana, dependiendo de la tolerabilidad.
Dosis recomendada para SAD y GAD
TRISTE
La dosis inicial y recomendada en pacientes con SAD es de 20 mg al día. En ensayos clínicos, se demostró la eficacia de PAXIL 30 mg en pacientes que recibieron dosis en un rango de 20 mg a 60 mg al día. Si bien se ha evaluado la seguridad de PAXIL en pacientes con SAD en dosis de hasta 60 mg diarios, la información disponible no sugiere ningún beneficio adicional para dosis superiores a 20 mg diarios [ver Estudios clínicos ].
GAD
La dosis inicial y recomendada en pacientes con TAG es de 20 mg diarios. En ensayos clínicos, se demostró la eficacia de PAXIL 10 mg en GAD en pacientes que recibieron dosis en un rango de 20 mg a 50 mg diarios. No hay evidencia suficiente para sugerir un mayor beneficio con dosis superiores a 20 mg diarios [ver Estudios clínicos ].
En pacientes con una respuesta inadecuada, aumente la dosis en incrementos de 10 mg por día a intervalos de al menos 1 semana, dependiendo de la tolerabilidad.
Detectar el trastorno bipolar antes de comenzar PAXIL
Antes de iniciar el tratamiento con PAXIL 10 mg u otro antidepresivo, evalúe a los pacientes para detectar antecedentes personales o familiares de trastorno bipolar, manía o hipomanía [ver ADVERTENCIAS Y PRECAUCIONES ].
Dosis recomendada para pacientes de edad avanzada, pacientes con insuficiencia renal grave y pacientes con insuficiencia hepática grave
La dosis inicial recomendada es de 10 mg por día para pacientes de edad avanzada, pacientes con insuficiencia renal grave y pacientes con insuficiencia hepática grave. La dosis no debe exceder los 40 mg/día.
Cambio de pacientes hacia o desde un inhibidor de la monoaminooxidasa (IMAO)
Deben transcurrir al menos 14 días entre la interrupción de un inhibidor de la monoaminooxidasa (IMAO) y el inicio de PAXIL. Además, deben transcurrir al menos 14 días después de suspender PAXIL antes de comenzar un antidepresivo IMAO [ver CONTRAINDICACIONES , ADVERTENCIAS Y PRECAUCIONES ].
Interrupción del tratamiento con PAXIL
Pueden ocurrir reacciones adversas al suspender PAXIL [ver ADVERTENCIAS Y PRECAUCIONES ]. Reduzca gradualmente la dosis en lugar de suspender PAXIL abruptamente siempre que sea posible.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
PAXIL tabletas están disponibles como:
- Comprimido amarillo ranurado de 10 mg grabado en el frente con "PAXIL" y en el reverso con "10".
- Comprimido rosa ranurado de 20 mg grabado en el frente con "PAXIL" y en el reverso con "20".
- Comprimido azul de 30 mg grabado en el frente con “PAXIL” y en el reverso con “30”.
- Comprimido verde de 40 mg grabado en el frente con “PAXIL” y en el reverso con “40”.
PAXIL 20 mg suspensión oral está disponible como:
- Suspensión de 10 mg/5 mL de color naranja, sabor a naranja en frascos de 250 mL.
Almacenamiento y manipulación
PAXIL (paroxetina) tabletas son comprimidos de forma ovalada que se suministran como:
Guarde las tabletas entre 15° y 30°C (59° y 86°F).
PAXIL (paroxetina) suspensión oral se suministra como:
Guarde la suspensión a una temperatura igual o inferior a 25 °C (77 °F)
Fabricado por: Apotex Inc., Toronto, Ontario, Canadá M9L 1T9. Revisado: febrero de 2021
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas se incluyen con más detalle en otras secciones de la información de prescripción:
- Reacciones de hipersensibilidad a la paroxetina [ver CONTRAINDICACIONES ]
- Pensamientos y comportamientos suicidas [ver ADVERTENCIAS Y PRECAUCIONES ]
- Síndrome serotoninérgico [ver ADVERTENCIAS Y PRECAUCIONES ]
- Toxicidad embriofetal y neonatal [ver ADVERTENCIAS Y PRECAUCIONES ]
- Mayor riesgo de sangrado [ver ADVERTENCIAS Y PRECAUCIONES ]
- Activación de manía/hipomanía [ver ADVERTENCIAS Y PRECAUCIONES ]
- Síndrome de discontinuación [ver ADVERTENCIAS Y PRECAUCIONES ]
- Convulsiones [ver ADVERTENCIAS Y PRECAUCIONES ]
- Glaucoma de ángulo cerrado [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hiponatremia [ver ADVERTENCIAS Y PRECAUCIONES ]
- Fractura ósea [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Los datos de seguridad de PAXIL son de:
- Ensayos clínicos de 6 semanas en pacientes con MDD que recibieron PAXIL de 20 mg a 50 mg una vez al día
- Ensayos clínicos de 12 semanas en pacientes con TOC que recibieron PAXIL de 20 mg a 60 mg una vez al día
- Ensayos clínicos de 10 a 12 semanas en pacientes con EP que recibieron PAXIL de 10 mg a 60 mg una vez al día
- Ensayos clínicos de 12 semanas en pacientes con SAD que recibieron PAXIL de 20 mg a 50 mg una vez al día
- Ensayos clínicos de 8 semanas en pacientes con TAG que recibieron PAXIL de 10 mg a 50 mg una vez al día
- Ensayos clínicos de 12 semanas en pacientes con PTSD que recibieron PAXIL de 20 mg a 50 mg una vez al día
Reacciones adversas que conducen a la suspensión
Veinte por ciento (1.199/6.145) de pacientes tratados con PAXIL en ensayos clínicos en TDM y 16,1% (84/522), 11,8% (64/542), 9,4% (44/469), 10,7% (79/735), y el 11,7 % (79/676) de los pacientes tratados con PAXIL en ensayos clínicos en SAD, OCD, PD, GAD y PTSD, respectivamente, interrumpieron el tratamiento debido a una reacción adversa. Las reacciones adversas más comunes (≥1 %) asociadas con la interrupción (es decir, aquellas reacciones adversas asociadas con el abandono a una tasa de aproximadamente el doble o mayor para PAXIL 10 mg en comparación con el placebo) se presentan en la Tabla 3:
Reacciones adversas más comunes
Las reacciones adversas más comúnmente observadas asociadas con el uso de PAXIL (incidencia del 5 % o más y al menos el doble que para el placebo) fueron:
MDD
Astenia, sudoración, náuseas, disminución del apetito, somnolencia, mareos, insomnio, temblor, nerviosismo, trastornos de la eyaculación y otros trastornos genitales masculinos.
TOC
Náuseas, sequedad de boca, disminución del apetito, estreñimiento, mareos, somnolencia, temblor, sudoración, impotencia y eyaculación anormal.
PD
Astenia, sudoración, disminución del apetito, disminución de la libido, temblor, eyaculación anormal, trastornos genitales femeninos e impotencia.
TRISTE
Sudoración, náuseas, sequedad de boca, estreñimiento, disminución del apetito, somnolencia, temblores, disminución de la libido, bostezos, eyaculación anormal, trastornos genitales femeninos e impotencia.
GAD
Astenia, infección, estreñimiento, disminución del apetito, boca seca, náuseas, disminución de la libido, somnolencia, temblor, sudoración y eyaculación anormal.
TEPT
Astenia, sudoración, náuseas, boca seca, diarrea, disminución del apetito, somnolencia, disminución de la libido, eyaculación anormal, trastornos genitales femeninos e impotencia.
Reacciones adversas en pacientes con MDD
La Tabla 4 presenta las reacciones adversas que ocurrieron con una incidencia del 1% o más y mayor que el placebo en ensayos clínicos de pacientes con MDD tratados con PAXIL.
Reacciones adversas en pacientes con TOC, EP y SAD
La Tabla 5 presenta las reacciones adversas que ocurrieron con una frecuencia del 2 % o más en ensayos clínicos en pacientes con TOC, EP y SAD.
Reacciones adversas en pacientes con GAD y PTSD
La Tabla 6 presenta las reacciones adversas que ocurrieron con una frecuencia del 2 % o más en ensayos clínicos en pacientes con GAD y PTSD.
Reacciones adversas dependientes de la dosis
MDD
Una comparación de las tasas de reacciones adversas en un estudio de dosis fija que comparó PAXIL 10 mg, 20 mg, 30 mg y 40 mg una vez al día con placebo en el tratamiento de MDD reveló reacciones adversas dependientes de la dosis, como se muestra en la Tabla 7:
TOC
En un estudio de dosis fija que comparó el placebo y PAXIL 20 mg, 40 mg y 60 mg en el tratamiento del TOC, no hubo una relación clara entre las reacciones adversas y la dosis de PAXIL 30 mg a la que se asignaron los pacientes.
PD
En un estudio de dosis fija que comparó el placebo y PAXIL 10 mg, 20 mg y 40 mg en el tratamiento de la EP, se demostró que las siguientes reacciones adversas dependen de la dosis: astenia, boca seca, ansiedad, disminución de la libido, temblor y eyaculación anormal.
TRISTE
En un estudio de dosis fija que comparó el placebo y PAXIL 20 mg, 40 mg y 60 mg en el tratamiento de SAD, para la mayoría de las reacciones adversas, no hubo una relación clara entre las reacciones adversas y la dosis de PAXIL 10 mg a la que se asignaron los pacientes. .
GAD
En un estudio de dosis fija que comparó el placebo y PAXIL 20 mg y 40 mg en el tratamiento del TAG, se demostró que las siguientes reacciones adversas dependen de la dosis: astenia, estreñimiento y eyaculación anormal.
TEPT
En un estudio de dosis fija que comparó el placebo y PAXIL 20 mg y 40 mg en el tratamiento del TEPT, se demostró que las siguientes reacciones adversas dependen de la dosis: impotencia y eyaculación anormal.
Disfunción sexual masculina y femenina
Aunque los cambios en el deseo sexual, el desempeño sexual y la satisfacción sexual a menudo ocurren como manifestaciones de un trastorno psiquiátrico, también pueden ser consecuencia del tratamiento con ISRS. Sin embargo, es difícil obtener estimaciones confiables de la incidencia y la gravedad de las experiencias adversas relacionadas con el deseo, el rendimiento y la satisfacción sexuales, en parte porque los pacientes y los proveedores de atención médica pueden mostrarse reacios a discutirlas. En consecuencia, las estimaciones de la incidencia de la experiencia y el desempeño sexuales adversos citados en el etiquetado pueden subestimar su incidencia real.
El porcentaje de pacientes que informan síntomas de disfunción sexual en hombres y mujeres con MDD, OCD, PD, SAD, GAD y PTSD se muestran en la Tabla 8.
El tratamiento con PAXIL 20 mg se ha asociado con varios casos de priapismo. En aquellos casos con evolución conocida, los pacientes se recuperaron sin secuelas.
alucinaciones
En ensayos clínicos combinados de PAXIL, se observaron alucinaciones en el 0,2 % de los pacientes tratados con PAXIL en comparación con el 0,1 % de los pacientes que recibieron placebo.
Reacciones adversas menos comunes
Las siguientes reacciones adversas ocurrieron durante los estudios clínicos de PAXIL y no están incluidas en ninguna otra parte de la etiqueta.
Las reacciones adversas se clasifican por sistema corporal y se enumeran en orden de frecuencia decreciente de acuerdo con las siguientes definiciones: Las reacciones adversas frecuentes son aquellas que ocurren en 1 o más ocasiones en al menos 1/100 pacientes; las reacciones adversas poco frecuentes son aquellas que ocurren en 1/100 a 1/1000 pacientes; Las reacciones adversas raras son aquellas que ocurren en menos de 1/1.000 pacientes.
cuerpo como un todo
Infrecuentes: reacción alérgica, escalofríos, edema facial, malestar general, dolor de cuello; Raros: síndrome adrenérgico, celulitis, moniliasis, rigidez de nuca, dolor pélvico, peritonitis, sepsis, úlcera.
Sistema cardiovascular
Frecuentes: Hipertensión, taquicardia; poco frecuentes: bradicardia, hematoma, hipotensión, migraña, hipotensión postural, síncope; Raros: angina de pecho, arritmia ganglionar, fibrilación auricular, bloqueo de rama, isquemia cerebral, accidente cerebrovascular, insuficiencia cardíaca congestiva, bloqueo cardíaco, gasto cardíaco bajo, infarto de miocardio, isquemia de miocardio, palidez, flebitis, embolia pulmonar, extrasístoles supraventriculares, tromboflebitis, trombosis, varices, cefalea vascular, extrasístoles ventriculares.
Sistema digestivo
Infrecuentes: bruxismo, colitis, disfagia, eructos, gastritis, gastroenteritis, gingivitis, glositis, aumento de la salivación, pruebas de función hepática anormales, hemorragia rectal, estomatitis ulcerosa; Raros: estomatitis aftosa, diarrea sanguinolenta, bulimia, cardioespasmo, colelitiasis, duodenitis, enteritis, esofagitis, impactaciones fecales, incontinencia fecal, hemorragia de las encías, hematemesis, hepatitis, ileítis, íleo, obstrucción intestinal, ictericia, melena, ulceración bucal, úlcera péptica, agrandamiento de las glándulas salivales, sialoadenitis, úlcera de estómago, estomatitis, decoloración de la lengua, edema de la lengua, caries dental.
Sistema endocrino
Raros: diabetes mellitus, bocio, hipertiroidismo, hipotiroidismo, tiroiditis.
Sistemas Hemático y Linfático
Infrecuentes: Anemia, leucopenia, linfadenopatía, púrpura; raros: eritrocitos anormales, basofilia, aumento del tiempo de sangrado, eosinofilia, anemia hipocrómica, anemia por deficiencia de hierro, leucocitosis, linfedema, linfocitos anormales, linfocitosis, anemia microcítica, monocitosis, anemia normocítica, trombocitemia, trombocitopenia.
Metabólico y Nutricional
Frecuentes: aumento de peso; infrecuentes: edema, edema periférico, aumento de SGOT, aumento de SGPT, sed, pérdida de peso; Raros: aumento de la fosfatasa alcalina, bilirrubinemia, aumento del BUN, aumento de la creatinina fosfocinasa, deshidratación, aumento de las gammaglobulinas, gota, hipercalcemia, hipercolesterolemia, hiperglucemia, hiperpotasemia, hiperfosfatemia, hipocalcemia, hipoglucemia, hipopotasemia, hiponatremia, cetosis, aumento de la deshidrogenasa láctica, sin proteínas nitrógeno (NPN) aumentó.
Sistema musculoesquelético
Frecuentes: Artralgia; poco frecuentes: artritis, artrosis; Raros: bursitis, miositis, osteoporosis, espasmo generalizado, tenosinovitis, tetania.
Sistema nervioso
Frecuentes: Labilidad emocional, vértigo; poco frecuentes: pensamiento anormal, abuso de alcohol, ataxia, distonía, discinesia, euforia, hostilidad, hipertonía, hipoestesia, hipocinesia, incoordinación, falta de emoción, aumento de la libido, reacción maníaca, neurosis, parálisis, reacción paranoide; Raros: marcha anormal, acinesia, reacción antisocial, afasia, coreoatetosis, parestesias periorales, convulsiones, delirio, delirios, diplopía, drogodependencia, disartria, síndrome extrapiramidal, fasciculaciones, convulsiones del gran mal, hiperalgesia, histeria, reacción maníaco-depresiva, meningitis, mielitis, neuralgia, neuropatía, nistagmo, neuritis periférica, depresión psicótica, psicosis, reflejos disminuidos, reflejos aumentados, estupor, tortícolis, trismo, síndrome de abstinencia.
Sistema respiratorio
Infrecuentes: asma, bronquitis, disnea, epistaxis, hiperventilación, neumonía, gripe respiratoria; Raros: enfisema, hemoptisis, hipo, fibrosis pulmonar, edema pulmonar, aumento de esputo, estridor, alteración de la voz.
Piel y Apéndices
Frecuentes: Prurito; poco frecuentes: acné, alopecia, dermatitis de contacto, piel seca, equimosis, eccema, herpes simple, fotosensibilidad, urticaria; raros: angioedema, eritema nodoso, eritema multiforme, dermatitis exfoliativa, dermatitis fúngica, forunculosis; herpes zoster, hirsutismo, erupción maculopapular, seborrea, decoloración de la piel, hipertrofia de la piel, úlcera cutánea, disminución de la sudoración, erupción vesiculoampollosa.
Sentidos especiales
Frecuentes: Tinnitus; poco frecuentes: anormalidad de la acomodación, conjuntivitis, dolor de oídos, dolor de ojos, queratoconjuntivitis, midriasis, otitis media; Raros: ambliopía, anisocoria, blefaritis, cataratas, edema conjuntival, úlcera corneal, sordera, exoftalmos, hemorragia ocular, glaucoma, hiperacusia, ceguera nocturna, otitis externa, parosmia, fotofobia, ptosis, hemorragia retiniana, pérdida del gusto, defecto del campo visual.
Sistema urogenital
Infrecuentes: amenorrea, dolor mamario, cistitis, disuria, hematuria, menorragia, nicturia, poliuria, piuria, incontinencia urinaria, retención urinaria, urgencia urinaria, vaginitis; raros: aborto, atrofia mamaria, agrandamiento mamario, trastorno endometrial, epididimitis, lactancia femenina, mama fibroquística, cálculo renal, dolor renal, leucorrea, mastitis, metrorragia, nefritis, oliguria, salpingitis, uretritis, cilindros urinarios, espasmo uterino, urolito vaginal hemorragia, moniliasis vaginal.
Experiencia posterior a la comercialización
Las siguientes reacciones se han identificado durante el uso posterior a la aprobación de PAXIL. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño desconocido, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Pancreatitis aguda, pruebas de función hepática elevadas (los casos más graves fueron muertes por necrosis hepática y transaminasas muy elevadas asociadas con disfunción hepática grave), síndrome de Guillain-Barré, síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, síndrome de secreción inadecuada de ADH, prolactinemia y galactorrea; síntomas extrapiramidales que han incluido acatisia, bradicinesia, rigidez en rueda dentada, crisis oculógira que se ha asociado con el uso concomitante de pimozida; estado epiléptico, insuficiencia renal aguda, hipertensión pulmonar, alveolitis alérgica, anafilaxia, eclampsia, laringismo, neuritis óptica, porfiria, síndrome de piernas inquietas (SPI), fibrilación ventricular, taquicardia ventricular (incluyendo torsade de pointes), anemia hemolítica, eventos relacionados con hematopoyesis (que incluye anemia aplásica, pancitopenia, aplasia de la médula ósea y agranulocitosis), síndromes vasculíticos (como la púrpura de Henoch-Schönlein) y partos prematuros en mujeres embarazadas. Ha habido un informe de caso de hipotensión severa cuando se agregó PAXIL 20 mg al tratamiento crónico con metoprolol.
INTERACCIONES CON LA DROGAS
La Tabla 9 presenta interacciones farmacológicas clínicamente significativas con PAXIL.
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Pensamientos y comportamientos suicidas en adolescentes y adultos jóvenes
En análisis combinados de ensayos controlados con placebo de medicamentos antidepresivos (ISRS y otras clases de antidepresivos) que incluyeron aproximadamente 77 000 pacientes adultos y 4500 pacientes pediátricos, la incidencia de pensamientos y conductas suicidas en pacientes tratados con antidepresivos de 24 años o menos fue mayor que en pacientes tratados con placebo. Hubo una variación considerable en el riesgo de pensamientos y comportamientos suicidas entre los medicamentos, pero se identificó un mayor riesgo en pacientes jóvenes para la mayoría de los medicamentos estudiados. Hubo diferencias en el riesgo absoluto de pensamientos y comportamientos suicidas entre las diferentes indicaciones, con la mayor incidencia en pacientes con TDM. Las diferencias fármaco-placebo en el número de casos de pensamientos y comportamientos suicidas por cada 1000 pacientes tratados se proporcionan en la Tabla 2.
PAXIL 30mg no está aprobado para uso en pacientes pediátricos.
Se desconoce si el riesgo de pensamientos y comportamientos suicidas en niños, adolescentes y adultos jóvenes se extiende al uso a largo plazo, es decir, más allá de los cuatro meses. Sin embargo, existe evidencia sustancial de ensayos de mantenimiento controlados con placebo en adultos con MDD de que los antidepresivos retrasan la recurrencia de la depresión y que la depresión en sí misma es un factor de riesgo de pensamientos y comportamientos suicidas.
Supervise a todos los pacientes tratados con antidepresivos en busca de cualquier indicación de empeoramiento clínico y aparición de pensamientos y comportamientos suicidas, especialmente durante los primeros meses de la terapia con medicamentos y en momentos de cambios de dosis. Aconseje a los familiares o cuidadores de los pacientes que controlen los cambios en el comportamiento y alerten al proveedor de atención médica. Considere cambiar el régimen terapéutico, incluida la posibilidad de descontinuar PAXIL, en pacientes cuya depresión empeora persistentemente o que experimentan pensamientos o comportamientos suicidas emergentes.
Síndrome de serotonina
Los ISRS, incluido PAXIL, pueden precipitar el síndrome serotoninérgico, una afección potencialmente mortal. El riesgo aumenta con el uso concomitante de otros fármacos serotoninérgicos (incluidos triptanos, antidepresivos tricíclicos, fentanilo, litio, tramadol, triptófano, buspirona, anfetaminas y hierba de San Juan) y con fármacos que alteran el metabolismo de la serotonina, es decir, los IMAO [ver CONTRAINDICACIONES , INTERACCIONES CON LA DROGAS ]. El síndrome de serotonina también puede ocurrir cuando estos medicamentos se usan solos.
Los síntomas del síndrome serotoninérgico pueden incluir cambios en el estado mental (p. ej., agitación, alucinaciones, delirio y coma), inestabilidad autonómica (p. ej., taquicardia, presión arterial lábil, mareos, diaforesis, sofocos, hipertermia), síntomas neuromusculares (p. ej., temblor, rigidez, mioclonías, hiperreflexia, falta de coordinación), convulsiones y/o síntomas gastrointestinales (p. ej., náuseas, vómitos, diarrea).
Está contraindicado el uso concomitante de PAXIL con IMAO. Además, no inicie PAXIL 30 mg en un paciente que esté siendo tratado con IMAO como linezolid o azul de metileno intravenoso. Ningún informe involucró la administración de azul de metileno por otras vías (como tabletas orales o inyección local en tejido) o en dosis más bajas. Si es necesario iniciar el tratamiento con un IMAO como linezolid o azul de metileno intravenoso en un paciente que toma PAXIL 10 mg, suspenda PAXIL 40 mg antes de iniciar el tratamiento con el IMAO [ver CONTRAINDICACIONES , INTERACCIONES CON LA DROGAS ].
Supervise a todos los pacientes que toman PAXIL 20 mg para detectar la aparición del síndrome serotoninérgico. Interrumpa el tratamiento con PAXIL 20 mg y cualquier agente serotoninérgico concomitante inmediatamente si se presentan los síntomas anteriores e inicie un tratamiento sintomático de apoyo. Si el uso concomitante de PAXIL con otros medicamentos serotoninérgicos está clínicamente justificado, informe a los pacientes sobre el mayor riesgo de síndrome serotoninérgico y controle los síntomas.
Interacciones farmacológicas que conducen a la prolongación del intervalo QT
Las propiedades inhibidoras de CYP2D6 de la paroxetina pueden elevar los niveles plasmáticos de tioridazina y pimozida. Dado que la tioridazina y la pimozida administradas solas producen una prolongación del intervalo QTc y aumentan el riesgo de arritmias ventriculares graves, el uso de PAXIL 40 mg está contraindicado en combinación con tioridazina y pimozida [ver CONTRAINDICACIONES , INTERACCIONES CON LA DROGAS , FARMACOLOGÍA CLÍNICA ].
Toxicidad embriofetal y neonatal
PAXIL puede causar daño fetal cuando se administra a una mujer embarazada. Los estudios epidemiológicos han demostrado que los bebés expuestos a la paroxetina en el primer trimestre del embarazo tienen un mayor riesgo de malformaciones cardiovasculares. La exposición a la paroxetina al final del embarazo puede aumentar el riesgo de hipertensión pulmonar persistente del recién nacido (PPNH, por sus siglas en inglés) y/o complicaciones neonatales que requieren hospitalización prolongada, asistencia respiratoria y alimentación por sonda.
Si se usa PAXIL 20 mg durante el embarazo, o si la paciente queda embarazada mientras toma PAXIL 30 mg, se debe informar a la paciente sobre el peligro potencial para el feto [ver Uso en poblaciones específicas ].
Mayor riesgo de sangrado
Los medicamentos que interfieren con la inhibición de la recaptación de serotonina, incluido PAXIL 40 mg, aumentan el riesgo de eventos hemorrágicos. El uso concomitante de aspirina, medicamentos antiinflamatorios no esteroideos (AINE), otros medicamentos antiplaquetarios, warfarina y otros anticoagulantes pueden aumentar este riesgo. Informes de casos y estudios epidemiológicos (casos y controles y diseño de cohortes) han demostrado una asociación entre el uso de fármacos que interfieren con la recaptación de serotonina y la aparición de hemorragia gastrointestinal. Los episodios hemorrágicos relacionados con fármacos que interfieren con la recaptación de serotonina van desde equimosis, hematomas, epistaxis y petequias hasta hemorragias potencialmente mortales.
Informar a los pacientes sobre el aumento del riesgo de hemorragia asociado con el uso concomitante de PAXIL 20 mg y agentes antiplaquetarios o anticoagulantes. Para los pacientes que toman warfarina, controle cuidadosamente la relación internacional normalizada.
Activación de manía o hipomanía
En pacientes con trastorno bipolar, el tratamiento de un episodio depresivo con PAXIL 30 mg u otro antidepresivo puede precipitar un episodio mixto/maníaco. Durante los ensayos clínicos controlados de PAXIL, se produjo hipomanía o manía en aproximadamente el 1 % de los pacientes unipolares tratados con PAXIL en comparación con el 1,1 % del control activo y el 0,3 % de los pacientes unipolares tratados con placebo. Antes de iniciar el tratamiento con PAXIL 20 mg, evalúe a los pacientes para detectar antecedentes personales o familiares de trastorno bipolar, manía o hipomanía.
Síndrome de discontinuación
Las reacciones adversas después de la interrupción de los antidepresivos serotoninérgicos, particularmente después de la interrupción abrupta, incluyen: náuseas, sudoración, estado de ánimo disfórico, irritabilidad, agitación, mareos, alteraciones sensoriales (p. ej., parestesia, como sensaciones de descargas eléctricas), temblor, ansiedad, confusión, dolor de cabeza, letargo, labilidad emocional, insomnio, hipomanía, tinnitus y convulsiones. Siempre que sea posible, se recomienda una reducción gradual de la dosis en lugar de un cese abrupto [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Durante los ensayos clínicos de GAD y PTSD, se usaron disminuciones graduales en la dosis diaria de 10 mg/día a intervalos semanales seguidos de 1 semana a 20 mg/día antes de interrumpir el tratamiento. Las siguientes reacciones adversas se informaron con una incidencia del 2 % o mayor para PAXIL 20 mg y fueron al menos el doble de las informadas para el placebo: Sueños anormales, parestesia y mareos Se informaron reacciones adversas al suspender el tratamiento con PAXIL en pacientes pediátricos. No se ha establecido la seguridad y eficacia de PAXIL en pacientes pediátricos [ver ADVERTENCIA EN CAJA , Pensamientos y comportamientos suicidas en adolescentes y adultos jóvenes , Uso en poblaciones específicas ].
convulsiones
Los comprimidos y la suspensión oral de PAXIL de 10 mg no se han evaluado sistemáticamente en pacientes con trastornos convulsivos. Los pacientes con antecedentes de convulsiones fueron excluidos de los estudios clínicos. Durante los estudios clínicos, se produjeron convulsiones en el 0,1 % de los pacientes tratados con PAXIL. PAXIL debe prescribirse con precaución en pacientes con un trastorno convulsivo. Suspenda PAXIL 30 mg en cualquier paciente que desarrolle convulsiones.
Glaucoma de ángulo cerrado
La dilatación pupilar que ocurre después del uso de muchos medicamentos antidepresivos, incluido PAXIL, puede desencadenar un ataque de ángulo cerrado en un paciente con ángulos anatómicamente estrechos que no tienen una iridectomía permeable. Se han informado casos de glaucoma de ángulo cerrado asociados con el uso de PAXIL 40 mg. Evite el uso de antidepresivos, incluido PAXIL, en pacientes con ángulos anatómicamente estrechos no tratados.
hiponatremia
La hiponatremia puede ocurrir como resultado del tratamiento con ISRS, incluido PAXIL. Se han notificado casos con sodio sérico inferior a 110 mmol/L. Los signos y síntomas de la hiponatremia incluyen dolor de cabeza, dificultad para concentrarse, deterioro de la memoria, confusión, debilidad e inestabilidad, lo que puede provocar caídas. Los signos y síntomas asociados con casos más graves y/o agudos incluyen alucinaciones, síncope, convulsiones, coma, paro respiratorio y muerte. En muchos casos, esta hiponatremia parece ser el resultado del síndrome de secreción inadecuada de hormona antidiurética (SIADH).
En pacientes con hiponatremia sintomática, suspenda PAXIL e instituya la intervención médica adecuada. Los pacientes de edad avanzada, los pacientes que toman diuréticos y los que tienen depleción de volumen pueden tener un mayor riesgo de desarrollar hiponatremia con los ISRS [ver Uso en poblaciones específicas ].
Reducción de la eficacia del tamoxifeno
Algunos estudios han demostrado que la eficacia del tamoxifeno, medida por el riesgo de recaída/mortalidad por cáncer de mama, puede reducirse con el uso concomitante de PAXIL como resultado de la inhibición irreversible del CYP2D6 por parte de la paroxetina y los niveles sanguíneos más bajos de tamoxifeno [ver INTERACCIONES CON LA DROGAS ]. Un estudio sugiere que el riesgo puede aumentar con una mayor duración de la coadministración. Sin embargo, otros estudios no han podido demostrar tal riesgo. Cuando se usa tamoxifeno para el tratamiento o la prevención del cáncer de mama, los prescriptores deben considerar el uso de un antidepresivo alternativo con poca o ninguna inhibición de CYP2D6.
Fractura de hueso
Los estudios epidemiológicos sobre el riesgo de fractura ósea durante la exposición a algunos antidepresivos, incluidos los ISRS, han informado una asociación entre el tratamiento antidepresivo y las fracturas. Existen múltiples causas posibles para esta observación y se desconoce hasta qué punto el riesgo de fractura es directamente atribuible al tratamiento con ISRS.
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( Guía de medicamentos ).
Pensamientos y comportamientos suicidas
Aconseje a los pacientes y cuidadores que estén atentos a la aparición de tendencias suicidas, especialmente al principio del tratamiento y cuando la dosis se ajuste hacia arriba o hacia abajo, e indíqueles que informen dichos síntomas al proveedor de atención médica [ver ADVERTENCIA EN CAJA y ADVERTENCIAS Y PRECAUCIONES ].
Síndrome de serotonina
Advierta a los pacientes sobre el riesgo de síndrome serotoninérgico, particularmente con el uso concomitante de PAXIL con otros medicamentos serotoninérgicos, incluidos triptanos, antidepresivos tricíclicos, fentanilo, litio, tramadol, triptófano, buspirona, anfetaminas, hierba de San Juan y con medicamentos que alteran el metabolismo de serotonina (en particular, los IMAO, tanto los destinados al tratamiento de trastornos psiquiátricos como otros, como la linezolida). Indique a los pacientes que se comuniquen con su proveedor de atención médica o informen a la sala de emergencias si experimentan signos o síntomas del síndrome serotoninérgico [ver ADVERTENCIAS Y PRECAUCIONES , INTERACCIONES CON LA DROGAS ].
Medicaciones concomitantes
Aconseje a los pacientes que informen a su médico si están tomando, o planean tomar, cualquier medicamento recetado o de venta libre, ya que existe la posibilidad de interacciones farmacológicas [ver ADVERTENCIAS Y PRECAUCIONES , INTERACCIONES CON LA DROGAS ].
Mayor riesgo de sangrado
Informe a los pacientes sobre el uso concomitante de PAXIL con aspirina, AINE, otros medicamentos antiplaquetarios, warfarina u otros anticoagulantes porque el uso combinado se ha asociado con un mayor riesgo de hemorragia. Aconseje a los pacientes que informen a sus proveedores de atención médica si están tomando o planean tomar algún medicamento recetado o de venta libre que aumente el riesgo de sangrado [ver ADVERTENCIAS Y PRECAUCIONES ].
Activación de manía/hipomanía
Aconseje a los pacientes y a sus cuidadores que observen signos de activación de manía/hipomanía e indíqueles que informen dichos síntomas al proveedor de atención médica [ver ADVERTENCIAS Y PRECAUCIONES ].
Síndrome de discontinuación
Aconseje a los pacientes que no suspendan abruptamente PAXIL 40 mg y que hablen sobre cualquier régimen de disminución con su proveedor de atención médica. Informe a los pacientes que pueden ocurrir reacciones adversas cuando se suspende PAXIL [ver ADVERTENCIAS Y PRECAUCIONES ].
Información de administración para suspensión oral
Indique a los pacientes que agiten bien la suspensión oral antes de la administración [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Reacciones alérgicas
Aconseje a los pacientes que notifiquen a su proveedor de atención médica si desarrollan una reacción alérgica como sarpullido, urticaria, hinchazón o dificultad para respirar [ver REACCIONES ADVERSAS ].
Toxicidad embriofetal
Asesorar a las mujeres sobre el riesgo potencial para el feto [ver ADVERTENCIAS Y PRECAUCIONES , Uso en poblaciones específicas ]. Aconseje a los pacientes que notifiquen a su proveedor de atención médica si quedan embarazadas o tienen la intención de quedar embarazadas durante la terapia debido al riesgo para el feto.
Enfermería
Aconseje a las mujeres que notifiquen a su proveedor de atención médica si están amamantando a un bebé [ver Uso en poblaciones específicas ].
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Carcinogénesis
Se realizaron estudios de carcinogenicidad de dos años en roedores que recibieron paroxetina en la dieta en dosis de 1, 5 y 25 mg/kg/día (ratones) y 1, 5 y 20 mg/kg/día (ratas). Estas dosis son de hasta 2,0 (ratón) y 3,2 (rata) veces la MRHD de 75 mg sobre una base de mg/m2. Hubo un número significativamente mayor de ratas macho en el grupo de dosis alta con sarcomas de células reticulares (1/100, 0/50, 0/50 y 4/50 para los grupos de control, dosis baja, media y alta) , respectivamente) y una tendencia lineal significativamente mayor entre los grupos de dosis para la aparición de tumores linforeticulares en ratas macho. Las ratas hembra no se vieron afectadas. Aunque hubo un aumento relacionado con la dosis en el número de tumores en ratones, no hubo un aumento relacionado con el fármaco en el número de ratones con tumores. Se desconoce la relevancia de estos hallazgos para los humanos.

mutagénesis
La paroxetina no produjo efectos genotóxicos en una batería de 5 ensayos in vitro y 2 in vivo que incluyeron lo siguiente: ensayo de mutación bacteriana, ensayo de mutación de linfoma de ratón, ensayo de síntesis de ADN no programada y pruebas de aberraciones citogenéticas in vivo en médula ósea de ratón e in vitro en linfocitos humanos y en una prueba letal dominante en ratas.
Deterioro de la fertilidad
Algunos estudios clínicos han demostrado que los ISRS (incluida la paroxetina) pueden afectar la calidad del esperma durante el tratamiento con ISRS, lo que puede afectar la fertilidad en algunos hombres.
Se encontró una tasa de embarazo reducida en estudios de reproducción en ratas con una dosis de paroxetina de 15 mg/kg/día, que es 2,4 veces la MRHD de 75 mg sobre una base de mg/m2. Ocurrieron lesiones irreversibles en el tracto reproductivo de ratas macho después de dosificar en estudios de toxicidad durante 2 a 52 semanas. Estas lesiones consistieron en vacuolización del epitelio tubular del epidídimo a 50 mg/kg/día y cambios atróficos en los túbulos seminíferos de los testículos con espermatogénesis detenida a 25 mg/kg/día (8,2 y 4,1 veces la MRHD de 75 mg en una dosis de mg/día). base m2).
Uso en poblaciones específicas
El embarazo
Embarazo Categoría D [Ver ADVERTENCIAS Y PRECAUCIONES ]
Los estudios epidemiológicos han demostrado que los bebés expuestos a la paroxetina en el primer trimestre del embarazo tienen un mayor riesgo de malformaciones congénitas, particularmente malformaciones cardiovasculares. Si se usa paroxetina durante el embarazo, o si la paciente queda embarazada mientras toma paroxetina, informe a la paciente sobre el peligro potencial para el feto.
Consideraciones clínicas
menos que los beneficios de la paroxetina para la madre justifiquen la continuación del tratamiento, se debe considerar suspender el tratamiento con paroxetina o cambiar a otro antidepresivo [ver ADVERTENCIAS Y PRECAUCIONES ]. Para
- Un estudio basado en datos del registro nacional sueco demostró que los bebés expuestos a paroxetina durante el embarazo (n = 815) tenían un mayor riesgo de malformaciones cardiovasculares (2 % de riesgo en bebés expuestos a paroxetina) en comparación con toda la población del registro (1 % de riesgo). para un odds ratio (OR) de 1,8 (intervalo de confianza del 95%: 1,1 a 2,8). No se observó un aumento en el riesgo de malformaciones congénitas generales en los lactantes expuestos a paroxetina. Las malformaciones cardíacas en los bebés expuestos a paroxetina fueron principalmente defectos del tabique ventricular (CIV) y defectos del tabique auricular (CIA). Los defectos septales varían en severidad desde aquellos que se resuelven espontáneamente hasta aquellos que requieren cirugía.
- Un estudio de cohorte retrospectivo separado de los Estados Unidos (datos de United Healthcare) evaluó a 5956 bebés de madres que recibieron antidepresivos durante el primer trimestre (n = 815 para paroxetina). Este estudio mostró una tendencia hacia un aumento del riesgo de malformaciones cardiovasculares para la paroxetina (riesgo del 1,5 %) en comparación con otros antidepresivos (riesgo del 1 %), para un OR de 1,5 (95 % intervalo de confianza de 0,8 a 2,9). De los 12 bebés expuestos a paroxetina con malformaciones cardiovasculares, 9 tenían CIV. Este estudio también sugirió un mayor riesgo de malformaciones congénitas mayores en general, incluidos los defectos cardiovasculares para la paroxetina (riesgo del 4 %) en comparación con otros antidepresivos (riesgo del 2 %) (OR 1,8; intervalo de confianza del 95 %: 1,2 a 2,8).
- Dos grandes estudios de casos y controles que utilizaron bases de datos separadas, cada uno con más de 9000 casos de anomalías congénitas y más de 4000 controles, encontraron que el uso materno de paroxetina durante el primer trimestre del embarazo se asoció con un aumento de 2 a 3 veces del riesgo de flujo de salida del ventrículo derecho obstrucciones del tracto. En un estudio, el OR fue de 2,5 (intervalo de confianza del 95 %, 1,0 a 6,0, 7 lactantes expuestos) y en el otro estudio, el OR fue de 3,3 (intervalo de confianza del 95 %, 1,3 a 8,8, 6 lactantes expuestos).
Otros estudios han encontrado resultados variables en cuanto a si hubo un mayor riesgo de malformaciones congénitas generales, cardiovasculares o específicas. Un metanálisis de datos epidemiológicos durante un período de 16 años (1992 a 2008) sobre el uso de paroxetina en el primer trimestre en el embarazo y malformaciones congénitas incluyó los estudios mencionados anteriormente además de otros (n = 17 estudios que incluyeron malformaciones generales y n = 14 estudios que incluyeron malformaciones cardiovasculares; n = 20 estudios distintos). Aunque sujeto a limitaciones, este metanálisis sugirió una mayor incidencia de malformaciones cardiovasculares (odds ratio de prevalencia [POR] 1,5; intervalo de confianza del 95 %: 1,2 a 1,9) y malformaciones generales (POR 1,2; intervalo de confianza del 95 %: 1,1 a 1,4) con paroxetina utilizar durante el primer trimestre. No fue posible en este metanálisis determinar en qué medida la prevalencia observada de malformaciones cardiovasculares podría haber contribuido a la de las malformaciones generales, ni tampoco fue posible determinar si algún tipo específico de malformaciones cardiovasculares podría haber contribuido a la prevalencia observada. de todas las malformaciones cardiovasculares.
menos que los beneficios de la paroxetina para la madre justifiquen la continuación del tratamiento, se debe considerar suspender el tratamiento con paroxetina o cambiar a otro antidepresivo [ver ADVERTENCIAS Y PRECAUCIONES ]. Para las mujeres que tienen la intención de quedar embarazadas o están en su primer trimestre de embarazo, la paroxetina solo debe iniciarse después de considerar las otras opciones de tratamiento disponibles [ver ADVERTENCIAS Y PRECAUCIONES ].
Tratamiento de mujeres embarazadas durante su tercer trimestre
Los recién nacidos expuestos a ISRS o inhibidores de la recaptación de serotonina y norepinefrina (IRSN), incluido PAXIL 40 mg, al final del tercer trimestre han desarrollado complicaciones que requieren hospitalización prolongada, soporte respiratorio y alimentación por sonda. Tales complicaciones pueden surgir inmediatamente después del parto. Los hallazgos clínicos informados incluyen dificultad respiratoria, cianosis, apnea, convulsiones, inestabilidad de la temperatura, dificultad para alimentarse, vómitos, hipoglucemia, hipotonía, hipertonía, hiperreflexia, temblor, nerviosismo, irritabilidad y llanto constante. Estas características concuerdan con un efecto tóxico directo de los ISRS y los IRSN o, posiblemente, con un síndrome de interrupción del fármaco. Cabe señalar que, en algunos casos, el cuadro clínico es compatible con el síndrome serotoninérgico [ver ADVERTENCIAS Y PRECAUCIONES ].
La exposición a los ISRS al final del embarazo puede tener un mayor riesgo de hipertensión pulmonar persistente del recién nacido (PPHN). La HPPRN ocurre en 1 a 2 de cada 1000 nacidos vivos en la población general y se asocia con una morbilidad y mortalidad neonatal sustancial. En un estudio retrospectivo de casos y controles de 377 mujeres cuyos bebés nacieron con HPPRN y 836 mujeres cuyos bebés nacieron sanos, el riesgo de desarrollar HPPRN fue aproximadamente seis veces mayor para los bebés expuestos a los ISRS después de la semana 20 de gestación en comparación con los bebés que no habían estado expuestas a antidepresivos durante el embarazo.
También ha habido informes posteriores a la comercialización de partos prematuros en mujeres embarazadas expuestas a paroxetina u otros ISRS.
Al tratar a una mujer embarazada con paroxetina durante el tercer trimestre, el médico debe considerar cuidadosamente tanto los posibles riesgos como los beneficios del tratamiento. Estudio longitudinal prospectivo de 201 mujeres con antecedentes de depresión mayor que estaban eutímicas al inicio del embarazo. Las mujeres que suspendieron la medicación antidepresiva durante el embarazo tenían más probabilidades de experimentar una recaída de depresión mayor que las mujeres que continuaron con la medicación antidepresiva.
Hallazgos de animales
Se realizaron estudios de reproducción a dosis de hasta 50 mg/kg/día en ratas y 6 mg/kg/día en conejos administrados durante la organogénesis. Estas dosis son aproximadamente 6 (ratas) y menos de 2 (conejos) veces la dosis humana máxima recomendada (MRHD - 75 mg) en mg/m2. Estos estudios no han revelado evidencia de efectos en el desarrollo. Sin embargo, en ratas, hubo un aumento en las muertes de crías durante los primeros 4 días de lactancia cuando la dosificación ocurrió durante el último trimestre de gestación y continuó durante toda la lactancia. Este efecto ocurrió a una dosis de 1 mg/kg/día que es superior a la MRHD en base a mg/m2. No se determinó la dosis sin efecto para la mortalidad de las crías de rata. Se desconoce la causa de estas muertes.
Madres lactantes
Como muchas otras drogas, la paroxetina se secreta en la leche humana. Debido al potencial de reacciones adversas graves en los lactantes con PAXIL 20 mg, se debe tomar la decisión de suspender a los lactantes o suspender el fármaco, teniendo en cuenta la importancia del fármaco para la madre.
Uso pediátrico
No se ha establecido la seguridad y eficacia de PAXIL en pacientes pediátricos [ver CUADRO DE ADVERTENCIA ]. La eficacia no se demostró en tres ensayos controlados con placebo en 752 pacientes pediátricos con MDD tratados con PAXIL.
Los antidepresivos aumentan el riesgo de pensamientos y conductas suicidas en pacientes pediátricos [ver ADVERTENCIA EN CAJA , ADVERTENCIAS Y PRECAUCIONES ]. Se ha observado disminución del apetito y pérdida de peso en asociación con el uso de ISRS.
En ensayos clínicos controlados con placebo realizados con pacientes pediátricos, se informaron las siguientes reacciones adversas en al menos el 2 % de los pacientes pediátricos tratados con PAXIL y ocurrieron a una tasa de al menos el doble que en los pacientes pediátricos que recibieron placebo: labilidad emocional (incluida la autolesión , pensamientos suicidas, intento de suicidio, llanto y cambios de humor), hostilidad, disminución del apetito, temblores, sudoración, hipercinesia y agitación.
Las reacciones adversas tras la interrupción del tratamiento con PAXIL en los ensayos clínicos pediátricos que incluyeron un régimen de reducción gradual, que ocurrieron en al menos el 2 % de los pacientes y en una tasa de al menos el doble que la del placebo, fueron: labilidad emocional (incluyendo ideación suicida, intento, cambios de humor y llanto), nerviosismo, mareos, náuseas y dolor abdominal.
Uso geriátrico
En ensayos clínicos previos a la comercialización con PAXIL 10 mg, el 17 % de los pacientes tratados con PAXIL (aproximadamente 700) tenían 65 años de edad o más. Los estudios farmacocinéticos revelaron una disminución del aclaramiento en los ancianos y se recomienda una dosis inicial más baja; sin embargo, no se observaron diferencias generales en la seguridad o la eficacia entre los pacientes ancianos y los más jóvenes [ver DOSIFICACIÓN Y ADMINISTRACIÓN , FARMACOLOGÍA CLÍNICA ].
Los ISRS, incluido PAXIL, se han asociado con casos de hiponatremia clínicamente significativa en pacientes de edad avanzada, que pueden tener un mayor riesgo de sufrir esta reacción adversa [ver ADVERTENCIAS Y PRECAUCIONES ].
Insuficiencia renal y hepática
Se producen concentraciones plasmáticas elevadas de paroxetina en pacientes con insuficiencia renal y hepática. La dosis inicial de PAXIL debe reducirse en pacientes con insuficiencia renal grave y en pacientes con insuficiencia hepática grave [ver DOSIFICACIÓN Y ADMINISTRACIÓN , FARMACOLOGÍA CLÍNICA ].
SOBREDOSIS
Experiencia humana
Desde la introducción de PAXIL 30 mg en los Estados Unidos, se han informado en todo el mundo casos espontáneos de sobredosis deliberada o accidental durante el tratamiento con paroxetina. Estos incluyen sobredosis con paroxetina sola y en combinación con otras sustancias. Hay informes de muertes que parecen involucrar paroxetina sola.
Las reacciones adversas comúnmente reportadas asociadas con la sobredosis de paroxetina incluyen somnolencia, coma, náuseas, temblores, taquicardia, confusión, vómitos y mareos. Otros signos y síntomas notables observados con sobredosis de paroxetina (sola o con otras sustancias) incluyen midriasis, convulsiones (incluyendo estado epiléptico), arritmias ventriculares (incluyendo torsade de pointes), hipertensión, reacciones agresivas, síncope, hipotensión, estupor, bradicardia, distonía , rabdomiólisis, síntomas de disfunción hepática (incluyendo insuficiencia hepática, necrosis hepática, ictericia, hepatitis y esteatosis hepática), síndrome serotoninérgico, reacciones maníacas, mioclonía, insuficiencia renal aguda y retención urinaria.
Manejo de sobredosis
No se conocen antídotos específicos para PAXIL. Si ocurre una sobredosis, llame a su centro de control de intoxicaciones al 1-800-222-1222 para obtener las últimas recomendaciones.
CONTRAINDICACIONES
PAXIL está contraindicado en pacientes:
- Tomar IMAO (incluidos los IMAO linezolida y el azul de metileno intravenoso), o dentro de los 14 días posteriores a su suspensión, debido a un mayor riesgo de síndrome serotoninérgico [ver ADVERTENCIAS Y PRECAUCIONES , INTERACCIONES CON LA DROGAS ].
- Tomar tioridazina debido al riesgo de prolongación del intervalo QT [ver ADVERTENCIAS Y PRECAUCIONES y INTERACCIONES CON LA DROGAS ]
- Tomar pimozida debido al riesgo de prolongación del intervalo QT [ver ADVERTENCIAS Y PRECAUCIONES , INTERACCIONES CON LA DROGAS ].
- Con hipersensibilidad conocida (p. ej., anafilaxia, angioedema, síndrome de Stevens-Johnson) a la paroxetina o a cualquiera de los ingredientes inactivos de PAXIL [ver REACCIONES ADVERSAS ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
Se desconoce el mecanismo de acción de PAXIL en el tratamiento de MDD, SAD, OCD\, PD, GAD y PTSD, pero se presume que está relacionado con la potenciación de la actividad serotoninérgica en el sistema nervioso central como resultado de la inhibición de la recaptación neuronal de serotonina. (5-hidroxi-triptamina, 5-HT).
Farmacodinámica
Los estudios a dosis clínicamente relevantes en humanos han demostrado que la paroxetina bloquea la absorción de serotonina en las plaquetas humanas. Los estudios in vitro en animales también sugieren que la paroxetina es un inhibidor potente y altamente selectivo de la recaptación neuronal de serotonina (ISRS) y tiene efectos muy débiles sobre la recaptación neuronal de norepinefrina y dopamina.
Farmacocinética
Se observa una no linealidad en la farmacocinética con dosis crecientes de PAXIL.
En un metanálisis de paroxetina de 4 estudios realizados en voluntarios sanos luego de dosis múltiples de 20 mg/día a 40 mg/día, los hombres no exhibieron una Cmax o AUC significativamente más baja que las mujeres.
Absorción
El clorhidrato de paroxetina se absorbe completamente después de la dosificación oral de una solución de la sal de clorhidrato. En un estudio en el que sujetos varones normales (n = 15) recibieron comprimidos de 30 mg al día durante 30 días, las concentraciones de paroxetina en estado estacionario se alcanzaron en aproximadamente 10 días para la mayoría de los sujetos, aunque puede llevar mucho más tiempo en un paciente ocasional. En estado estacionario, los valores medios de Cmax, Tmax, Cmin y T½ fueron de 61,7 ng/ml (CV 45 %), 5,2 h. (CV 10%), 30,7 ng/mL (CV 67%) y 21,0 horas (CV 32%), respectivamente. Los valores de Cmax y Cmin en estado estacionario fueron aproximadamente 6 y 14 veces mayores de lo que se predeciría a partir de estudios de dosis única. La exposición al fármaco en estado estacionario basada en AUC0-24 fue unas 8 veces mayor de lo que se habría previsto a partir de los datos de dosis única en estos sujetos. La acumulación excesiva es consecuencia del hecho de que una de las enzimas que metaboliza la paroxetina es fácilmente saturable.
La paroxetina es igualmente biodisponible en la suspensión oral y la tableta.
Efecto de la comida
Los efectos de los alimentos sobre la biodisponibilidad de paroxetina se estudiaron en sujetos a los que se administró una dosis única con y sin alimentos. El AUC solo aumentó ligeramente (6 %) cuando el fármaco se administró con alimentos, pero la Cmax fue un 29 % mayor, mientras que el tiempo para alcanzar la concentración plasmática máxima disminuyó de 6,4 horas después de la dosificación a 4,9 horas.
Distribución
La paroxetina se distribuye por todo el cuerpo, incluido el SNC, quedando solo el 1% en el plasma.
Aproximadamente el 95 % y el 93 % de la paroxetina se une a las proteínas plasmáticas a 100 ng/ml y 400 ng/ml, respectivamente. En condiciones clínicas, las concentraciones de paroxetina normalmente serían inferiores a 400 ng/mL. La paroxetina no altera la unión a proteínas in vitro de la fenitoína o la warfarina.
Eliminación
Metabolismo
La semivida de eliminación media es de aproximadamente 21 horas (CV 32 %) después de la administración oral de comprimidos de 30 mg al día durante 30 días de PAXIL.
En estudios de proporcionalidad de dosis en estado estacionario en pacientes ancianos y no ancianos, a dosis de 20 mg a 40 mg diarios para ancianos y de 20 mg a 50 mg diarios para pacientes no ancianos, se observó cierta falta de linealidad en ambas poblaciones, lo que nuevamente refleja una vía metabólica saturable. . En comparación con los valores de Cmin después de 20 mg diarios, los valores después de 40 mg diarios fueron solo de 2 a 3 veces mayores que el doble.
La paroxetina se metaboliza ampliamente después de la administración oral. Los principales metabolitos son productos polares y conjugados de oxidación y metilación, que se eliminan fácilmente. Predominan los conjugados con ácido glucurónico y sulfato, y se han aislado e identificado los principales metabolitos. Los datos indican que los metabolitos no tienen más de 1/50 de la potencia del compuesto original para inhibir la absorción de serotonina. El metabolismo de la paroxetina se lleva a cabo en parte por CYP2D6. La saturación de esta enzima a las dosis clínicas parece explicar la no linealidad de la cinética de la paroxetina con el aumento de la dosis y la duración del tratamiento. El papel de esta enzima en el metabolismo de la paroxetina también sugiere posibles interacciones farmacológicas [ver INTERACCIONES CON LA DROGAS ]. No se ha evaluado el comportamiento farmacocinético de la paroxetina en sujetos con deficiencia de CYP2D6 (metabolizadores lentos).
Excreción
Aproximadamente el 64 % de una dosis de solución oral de 30 mg de paroxetina se excretó en la orina con un 2 % como compuesto original y un 62 % como metabolitos durante un período de 10 días posterior a la dosificación. Alrededor del 36 % se excretó en las heces (probablemente a través de la bilis), principalmente como metabolitos y menos del 1 % como compuesto original durante el período de 10 días posterior a la dosificación.
Estudios de interacción farmacológica
Existen interacciones medicamentosas clínicamente significativas y conocidas entre la paroxetina y otros medicamentos [ver INTERACCIONES CON LA DROGAS ].
Figura 1. Impacto de la paroxetina en la farmacocinética de fármacos coadministrados (escala logarítmica)
Figura 2. Impacto de los fármacos coadministrados en la farmacocinética de la paroxetina
teofilina
Se han informado informes de niveles elevados de teofilina asociados con el tratamiento con PAXIL. Si bien esta interacción no se ha estudiado formalmente, se recomienda monitorear los niveles de teofilina cuando estos medicamentos se administran simultáneamente.
Fármacos metabolizados por el citocromo CYP3A4
Un estudio de interacción in vivo que involucró la coadministración en condiciones de estado estacionario de paroxetina y terfenadina, un sustrato para CYP3A4, no reveló ningún efecto de paroxetina sobre la farmacocinética de terfenadina. Además, los estudios in vitro han demostrado que el ketoconazol, un potente inhibidor de la actividad de CYP3A4, es al menos 100 veces más potente que la paroxetina como inhibidor del metabolismo de varios sustratos de esta enzima, incluidos terfenadina, astemizol, cisaprida, triazolam y ciclosporina. No se espera que el grado de inhibición de la actividad de CYP3A4 de paroxetina tenga importancia clínica.
Poblaciones Específicas
El impacto de poblaciones específicas en la farmacocinética de paroxetina se muestra en la Figura 3.
La dosis inicial recomendada y la dosis máxima de PAXIL se reducen en pacientes de edad avanzada, pacientes con insuficiencia renal grave y pacientes con insuficiencia hepática grave [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Figura 3. Impacto de la población específica en la farmacocinética de la paroxetina (escala logarítmica)
Estudios clínicos
Trastorno depresivo mayor
La eficacia de PAXIL como tratamiento para el trastorno depresivo mayor (MDD) se ha establecido en 6 estudios controlados con placebo de pacientes con MDD (de 18 a 73 años). En estos estudios, se demostró que PAXIL es significativamente más eficaz desde el punto de vista estadístico que el placebo en el tratamiento del MDD en al menos 2 de las siguientes medidas: escala de calificación de depresión de Hamilton (HDRS), el elemento de estado de ánimo deprimido de Hamilton y la impresión clínica global (CGI)- Gravedad de la enfermedad. PAXIL fue significativamente mejor desde el punto de vista estadístico que el placebo en la mejora de las puntuaciones de los subfactores HDRS, incluido el elemento de estado de ánimo deprimido, el factor de alteración del sueño y el factor de ansiedad.
La eficacia a largo plazo de PAXIL 10 mg para el tratamiento de MDD en pacientes ambulatorios se demostró en un estudio de retiro aleatorizado. Los pacientes que respondieron a PAXIL (puntuación total de HDRS
Trastorno obsesivo compulsivo
La eficacia de PAXIL en el tratamiento del trastorno obsesivo compulsivo (TOC) se demostró en dos estudios multicéntricos controlados con placebo de 12 semanas de duración en pacientes adultos ambulatorios (Estudios 1 y 2). Los pacientes tenían TOC de moderado a grave (DSM-IIIR) con puntuaciones iniciales medias en la escala obsesiva compulsiva de Yale Brown (YBOCS) que oscilaban entre 23 y 26. En el estudio 1, un estudio de búsqueda de rango de dosis, los pacientes recibieron dosis diarias fijas de PAXIL 20 mg, 40 mg o 60 mg. El estudio 1 demostró que las dosis diarias de PAXIL de 40 mg y 60 mg son efectivas en el tratamiento del TOC. Los pacientes que recibieron dosis de PAXIL de 40 mg y 60 mg experimentaron una reducción media de aproximadamente 6 y 7 puntos, respectivamente, en la puntuación total de YBOCS, que fue estadísticamente significativamente mayor que la reducción aproximada de 4 puntos con 20 mg y una reducción de 3 puntos en los pacientes tratados con placebo. El estudio 2 fue un estudio de dosis flexible que comparó PAXIL 20 mg a 60 mg diarios con clomipramina 25 mg a 250 mg diarios o placebo). En este estudio, los pacientes que recibieron PAXIL experimentaron una reducción media de aproximadamente 7 puntos en la puntuación total de YBOCS, que fue estadísticamente significativamente mayor que la reducción media de aproximadamente 4 puntos en los pacientes tratados con placebo.
La siguiente tabla proporciona la clasificación de resultados por grupo de tratamiento en los elementos de mejora global de la escala de impresión clínica global (CGI) para el estudio 1.
Los análisis de subgrupos no indicaron que hubiera diferencias en los resultados del tratamiento en función de la edad o el sexo.
La eficacia a largo plazo de PAXIL para el tratamiento del TOC se estableció en una extensión a largo plazo del Estudio 1. Los pacientes que respondieron a PAXIL durante la fase doble ciego de 3 meses y una extensión de 6 meses en PAXIL 20 de etiqueta abierta mg a 60 mg diarios fueron aleatorizados a PAXIL 10 mg o placebo en una fase de prevención de recaídas doble ciego de 6 meses. Los pacientes aleatorizados a PAXIL tuvieron menos probabilidad estadísticamente significativa de recaer que los pacientes tratados con placebo.
Trastorno de pánico
La eficacia de PAXIL 20 mg en el tratamiento del trastorno de pánico (TP) se demostró en tres estudios multicéntricos controlados con placebo de 10 a 12 semanas de duración en pacientes adultos ambulatorios (estudios 1, 2 y 3). Los pacientes tenían EP (DSM-IIIR), con o sin agorafobia. En estos estudios, se demostró que PAXIL es significativamente más eficaz desde el punto de vista estadístico que el placebo en el tratamiento de la EP en al menos 2 de 3 medidas de frecuencia de ataques de pánico y en la puntuación de la gravedad de la enfermedad de la impresión clínica global.
El estudio 1 fue un estudio de búsqueda de rango de dosis de 10 semanas; los pacientes recibieron dosis fijas de PAXIL de 10 mg, 20 mg o 40 mg al día o placebo. Se observó una diferencia estadísticamente significativa con el placebo solo para el grupo de 40 mg diarios de PAXIL. Al final, el 76 % de los pacientes que recibieron PAXIL 40 mg al día no sufrieron ataques de pánico, en comparación con el 44 % de los pacientes tratados con placebo.
El estudio 2 fue un estudio de dosis flexible de 12 semanas que comparó PAXIL 10 mg con 60 mg al día y placebo. Al final, el 51 % de los pacientes tratados con PAXIL estaban libres de ataques de pánico en comparación con el 32 % de los pacientes tratados con placebo.
El estudio 3 fue un estudio de dosis flexible de 12 semanas que comparó PAXIL 10 mg a 60 mg al día con un placebo en pacientes que recibían simultáneamente terapia cognitiva conductual estandarizada. Al final, el 33 % de los pacientes tratados con PAXIL mostró una reducción de 0 o 1 ataque de pánico en comparación con el 14 % de los pacientes tratados con placebo.
En los estudios 2 y 3, la dosis media de PAXIL para quienes completaron el tratamiento al final del estudio fue de aproximadamente 40 mg diarios.
La eficacia a largo plazo de PAXIL 10 mg en la EP se demostró en una extensión del Estudio 1. Los pacientes que respondieron a PAXIL 20 mg durante la fase doble ciego de 10 semanas y durante una fase de extensión doble ciego de 3 meses fueron aleatorizados a PAXIL 10 mg, 20 mg o 40 mg al día o placebo en una fase de prevención de recaídas doble ciego de 3 meses. Los pacientes aleatorizados a PAXIL 20 mg tuvieron una probabilidad significativamente menor de sufrir una recaída que los pacientes tratados con placebo.
Los análisis de subgrupos no indicaron que hubiera diferencias en los resultados del tratamiento en función de la edad o el sexo.
Desorden de ansiedad social
La eficacia de PAXIL en el tratamiento del trastorno de ansiedad social (SAD) se demostró en tres estudios controlados con placebo, multicéntricos y de 12 semanas de duración (Estudios 1, 2 y 3) de pacientes adultos ambulatorios con SAD (DSM-IV). En estos estudios, la eficacia de PAXIL 30 mg en comparación con el placebo se evaluó sobre la base de (1) la proporción de respondedores, definida por una puntuación de mejora de la impresión clínica global (CGI) de 1 (mucha mejoría) o 2 (mucha mejoría). ), y (2) cambio desde el inicio en la Escala de Ansiedad Social de Liebowitz (LSAS).
Los estudios 1 y 2 fueron estudios de dosis flexibles que compararon PAXIL 20 mg con 50 mg al día y placebo. PAXIL demostró una superioridad estadísticamente significativa sobre el placebo tanto en el criterio de respuesta de mejora CGI como en la escala de ansiedad social de Liebowitz (LSAS). En el Estudio 1, para los pacientes que completaron la semana 12, el 69 % de los pacientes tratados con PAXIL en comparación con el 29 % de los pacientes tratados con placebo respondieron a la mejora CGI. En el Estudio 2, los que respondieron a la mejora CGI fueron del 77 % y el 42 % para los pacientes tratados con PAXIL y placebo, respectivamente.
El estudio 3 fue un estudio de 12 semanas que comparó dosis fijas de PAXIL de 20 mg, 40 mg o 60 mg al día con placebo. PAXIL 20 mg fue significativamente superior desde el punto de vista estadístico al placebo tanto en la puntuación total de LSAS como en el criterio de respuesta de mejora CGI; hubo tendencias de superioridad sobre el placebo para los grupos de dosis diaria de 40 mg y 60 mg de PAXIL. No hubo indicios en este estudio de ningún beneficio adicional para dosis superiores a 20 mg diarios.
Los análisis de subgrupos generalmente no indicaron diferencias en los resultados del tratamiento en función de la edad, la raza o el sexo.
Trastorno de ansiedad generalizada
La eficacia de PAXIL en el tratamiento del trastorno de ansiedad generalizada (TAG) se demostró en dos estudios multicéntricos controlados con placebo de 8 semanas de duración (Estudios 1 y 2) de pacientes adultos ambulatorios con TAG (DSM-IV).
El estudio 1 fue un estudio de 8 semanas que comparó dosis fijas de PAXIL de 20 mg o 40 mg al día con placebo. Se demostró que las dosis de PAXIL de 20 mg o 40 mg eran estadísticamente significativamente superiores al placebo en la puntuación total de la escala de calificación de ansiedad de Hamilton (HAM-A).
No hubo suficiente evidencia en este estudio para sugerir un mayor beneficio para la dosis diaria de 40 mg de PAXIL en comparación con la dosis diaria de 20 mg.
El estudio 2 fue un estudio de dosis flexible que comparó PAXIL 20 mg con 50 mg al día y placebo. PAXIL demostró una superioridad estadísticamente significativa sobre el placebo en la puntuación total de la escala de calificación de Hamilton para la ansiedad (HAM-A).
Un tercer estudio, un estudio de dosis flexible que comparó PAXIL 20 mg a 50 mg diarios con un placebo, no demostró una superioridad estadísticamente significativa de PAXIL sobre el placebo en la puntuación total de la escala de calificación de ansiedad de Hamilton (HAM-A), el resultado primario.
Los análisis de subgrupos no indicaron diferencias en los resultados del tratamiento en función de la raza o el género. No hubo suficientes pacientes de edad avanzada para realizar análisis de subgrupos sobre la base de la edad.
En un ensayo a largo plazo, 566 pacientes que cumplían con los criterios del DSM-IV para TAG, que habían respondido durante una fase de tratamiento agudo simple ciego de 8 semanas con 20 mg a 50 mg diarios de PAXIL, fueron aleatorizados para continuar con 30 mg de PAXIL en su misma dosis, o al placebo, durante un máximo de 24 semanas de observación de la recaída. La respuesta durante la fase simple ciego se definió por tener una disminución de ≥2 puntos en comparación con el valor inicial en la escala CGI-Gravedad de la enfermedad, hasta una puntuación de ≤3. La recaída durante la fase doble ciego se definió como un aumento de ≥2 puntos en comparación con el valor inicial en la escala CGI-Severity of Illness hasta una puntuación de ≥4, o retiro debido a la falta de eficacia. Los pacientes que continuaron recibiendo PAXIL 40 mg experimentaron una tasa de recaída significativamente menor desde el punto de vista estadístico durante las siguientes 24 semanas en comparación con los que recibieron placebo.
Trastorno de estrés postraumático
La eficacia de PAXIL 20 mg en el tratamiento del trastorno de estrés postraumático (TEPT) se demostró en dos estudios multicéntricos controlados con placebo de 12 semanas de duración (estudios 1 y 2) de pacientes adultos ambulatorios que cumplieron con los criterios del DSM-IV para el TEPT. La duración media de los síntomas de TEPT para los 2 estudios combinados fue de 13 años (rango de 0,1 año a 57 años). El porcentaje de pacientes con TDM secundario o trastornos de ansiedad distintos al TEPT en los 2 estudios combinados fue del 41 % (356 de 858 pacientes) y del 40 % (345 de 858 pacientes), respectivamente. El resultado del estudio se evaluó mediante (1) la puntuación de la Parte 2 de la Escala de TEPT administrada por el médico (CAPS-2) y (2) la Escala de mejora global de impresión clínica global (CGI-I). El CAPS-2 es un instrumento de múltiples ítems que mide 3 aspectos del PTSD con los siguientes grupos de síntomas: Reexperimentación/intrusión, evitación/adormecimiento e hiperexcitación. Los 2 resultados primarios de cada ensayo fueron (1) el cambio desde el inicio hasta el final en la puntuación total de CAPS-2 (17 ítems) y (2) la proporción de respondedores en el CGI-I, donde los respondedores se definieron como pacientes que tenían una puntuación de 1 (muy mejorado) o 2 (mucho mejorado).
El estudio 1 fue un estudio de 12 semanas que comparó dosis fijas de PAXIL de 20 mg o 40 mg diarios con placebo. Se demostró que las dosis de PAXIL de 20 mg y 40 mg eran significativamente superiores desde el punto de vista estadístico al placebo en el cambio desde el inicio para la puntuación total de CAPS-2 y en la proporción de respondedores en el CGI-I. No hubo evidencia suficiente en este estudio para sugerir un mayor beneficio para la dosis diaria de 40 mg en comparación con la dosis diaria de 20 mg.
El estudio 2 fue un estudio de dosis flexible de 12 semanas que comparó PAXIL 20 mg a 50 mg diarios con un placebo. Se demostró que PAXIL 40 mg es significativamente superior al placebo en el cambio desde el inicio para el puntaje total de CAPS-2 y en la proporción de respondedores en el CGI-I.
Un tercer estudio, un estudio de dosis flexible que comparó PAXIL 20 mg a 50 mg diarios con un placebo, demostró que PAXIL 20 mg es estadísticamente significativamente superior al placebo en el cambio desde el inicio para la puntuación total de CAPS-2, pero no en la proporción de respondedores en el CGI -YO.
La mayoría de los pacientes en estos ensayos eran mujeres (68 % mujeres: 377 de 551 sujetos en el Estudio 1 y 66 % mujeres: 202 de 303 sujetos en el Estudio 2). Los análisis de subgrupos no indicaron diferencias en los resultados del tratamiento en función del género. Hubo un número insuficiente de pacientes de 65 años o más o que no eran caucásicos para realizar análisis de subgrupos en función de la edad o la raza, respectivamente.
INFORMACIÓN DEL PACIENTE
PAXIL® (PAX-il)(paroxetina) comprimidos y suspensión oral
¿Cuál es la información más importante que debo saber sobre PAXIL?
PAXIL puede causar efectos secundarios graves, que incluyen:
- Mayor riesgo de pensamientos o acciones suicidas. PAXIL 10 mg y otros medicamentos antidepresivos pueden aumentar los pensamientos y acciones suicidas en algunas personas de 24 años de edad y menores, especialmente dentro de los primeros meses de tratamiento o cuando se cambia la dosis. PAXIL no es para uso en niños.
- La depresión u otras enfermedades mentales son las causas más importantes de pensamientos y acciones suicidas.
¿Cómo puedo estar alerta y tratar de prevenir pensamientos y acciones suicidas?
- Preste mucha atención a cualquier cambio, especialmente cambios repentinos en el estado de ánimo, comportamiento, pensamientos o sentimientos, o si desarrolla pensamientos o acciones suicidas. Esto es muy importante cuando se inicia un medicamento antidepresivo o cuando se cambia de dosis.
- Llame a su proveedor de atención médica de inmediato para informar cambios nuevos o repentinos en el estado de ánimo, comportamiento, pensamientos o sentimientos, o si desarrolla pensamientos o acciones suicidas.
- Mantenga todas las visitas de seguimiento con su proveedor de atención médica según lo programado. Llame a su proveedor de atención médica entre visitas según sea necesario, especialmente si le preocupan los síntomas.
Llame a su proveedor de atención médica u obtenga ayuda médica de emergencia de inmediato si tiene alguno de los siguientes síntomas, especialmente si son nuevos, empeoran o le preocupan:
- intentos de suicidio
- actuando agresivo o violento
- depresión nueva o peor
- sentirse agitado, inquieto, enojado o irritable
- un aumento en la actividad y hablar más de lo que es normal para usted
- actuando sobre impulsos peligrosos
- pensamientos sobre el suicidio o la muerte
- nuevos o peores ataques de ansiedad o pánico
- problemas para dormir
- otros cambios inusuales en el comportamiento o el estado de ánimo
¿Qué es PAXIL?
PAXIL 30 mg es un medicamento recetado que se usa en adultos para tratar:
- Cierto tipo de depresión llamado trastorno depresivo mayor (MDD, por sus siglas en inglés)
- Trastorno obsesivo compulsivo (TOC)
- Trastorno de pánico (TP)
- Trastorno de Ansiedad Social (SAD)
- Trastorno de ansiedad generalizada (TAG)
- Trastorno de estrés postraumático (TEPT)
No tome PAXIL si usted:
- tomar un inhibidor de la monoaminooxidasa (IMAO)
- han dejado de tomar un IMAO en los últimos 14 días
- están siendo tratados con el antibiótico linezolid o el azul de metileno intravenoso
- están tomando pimozida
- están tomando tioridazina
- es alérgico a la paroxetina o a cualquiera de los ingredientes de PAXIL. Consulte el final de esta Guía del medicamento para obtener una lista completa de los ingredientes de PAXIL.
Pregúntele a su proveedor de atención médica o farmacéutico si no está seguro si está tomando un IMAO o uno de estos medicamentos, incluido el antibiótico linezolid o el azul de metileno por vía intravenosa.
No comience a tomar un IMAO durante al menos 14 días después de suspender el tratamiento con PAXIL.
Antes de tomar PAXIL, infórmele a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si usted:
- tener problemas del corazón
- tiene o ha tenido problemas de sangrado
- tiene o tiene antecedentes familiares de trastorno bipolar, manía o hipomanía
- tiene o ha tenido ataques o convulsiones
- tiene glaucoma (presión alta en el ojo)
- tiene niveles bajos de sodio en la sangre
- tener problemas en los huesos
- tiene problemas renales o hepáticos
- está embarazada o planea quedar embarazada. PAXIL 40 mg puede dañar a su bebé nonato. Hable con su proveedor de atención médica sobre los riesgos para su bebé por nacer si toma PAXIL durante el embarazo. Informe a su proveedor de atención médica de inmediato si queda embarazada o cree que está embarazada durante el tratamiento con PAXIL.
- están amamantando o planean amamantar. PAXIL pasa a la leche materna. Hable con su proveedor de atención médica sobre la mejor manera de alimentar a su bebé durante el tratamiento con PAXIL.
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos a base de hierbas.
PAXIL y algunos otros medicamentos pueden afectarse entre sí y causar posibles efectos secundarios graves. PAXIL 30 mg puede afectar la forma en que funcionan otros medicamentos y otros medicamentos pueden afectar la forma en que funciona PAXIL.
Informe especialmente a su proveedor de atención médica si toma:
- medicamentos utilizados para tratar las migrañas llamados triptanos
- antidepresivos tricíclicos
- fentanilo
- litio
- tramadol
- triptófano
- buspirona
- anfetaminas
- Hierba de San Juan
- medicamentos que pueden afectar la coagulación de la sangre, como aspirina, medicamentos antiinflamatorios no esteroideos (AINE), warfarina
- diuréticos
- tamoxifeno
- medicamentos utilizados para tratar trastornos del estado de ánimo, de ansiedad, psicóticos o del pensamiento, incluidos los inhibidores selectivos de la recaptación de serotonina (ISRS) y los inhibidores de la recaptación de serotonina y norepinefrina (IRSN)
Pregúntele a su proveedor de atención médica si no está seguro si está tomando alguno de estos medicamentos. Su proveedor de atención médica puede decirle si es seguro tomar PAXIL 10 mg con sus otros medicamentos.
No comience ni suspenda ningún otro medicamento durante el tratamiento con PAXIL sin hablar primero con su proveedor de atención médica. Dejar de tomar PAXIL repentinamente puede causarle efectos secundarios graves. Ver, “¿Cuáles son los posibles efectos secundarios de PAXIL 20 mg?”
Conozca los medicamentos que toma. Mantenga una lista de ellos para mostrársela a su proveedor de atención médica y farmacéutico cuando obtenga un nuevo medicamento.
¿Cómo debo tomar PAXIL?
- Tome PAXIL exactamente según lo recetado. Es posible que su proveedor de atención médica deba cambiar la dosis de PAXIL 30 mg hasta que sea la dosis adecuada para usted.
- Tome PAXIL 1 vez al día por la mañana.
- PAXIL 30 mg se puede tomar con o sin alimentos.
- Si está tomando la suspensión oral de PAXIL, agite bien la suspensión antes de tomarla.
- Si toma demasiado PAXIL, llame a su centro de toxicología al 1-800-222-1222 o vaya de inmediato a la sala de emergencias del hospital más cercano.
¿Cuáles son los posibles efectos secundarios de PAXIL 10 mg?
PAXIL 40 mg puede causar efectos secundarios graves, que incluyen:
- Ver, “¿Cuál es la información más importante que debo saber sobre PAXIL?”
- Síndrome serotoninérgico. Un problema potencialmente mortal llamado síndrome serotoninérgico puede ocurrir cuando toma PAXIL 20 mg con otros medicamentos. Ver, "¿Quién no debe tomar PAXIL?" Llame a su proveedor de atención médica o vaya a la sala de emergencias del hospital más cercano de inmediato. si tiene alguno de los siguientes signos y síntomas del síndrome serotoninérgico:
- agitación
- ver u oír cosas que no son reales (alucinaciones)
- confusión
- coma
- latidos cardíacos acelerados
- cambios en la presión arterial
- mareo
- transpiración
- enrojecimiento
- temperatura corporal alta (hipertermia)
- sacudidas (temblores), músculos rígidos o espasmos musculares
- pérdida de coordinación
- convulsiones
- náuseas, vómitos, diarrea
- Problemas oculares (glaucoma de ángulo cerrado). PAXIL 10 mg puede causar un tipo de problema ocular llamado glaucoma de ángulo cerrado en personas con otras afecciones oculares. Es posible que desee someterse a un examen de la vista para ver si está en riesgo y recibir tratamiento preventivo si lo está. Llame a su proveedor de atención médica si tiene dolor en los ojos, cambios en la visión o hinchazón o enrojecimiento en o alrededor del ojo.
- Interacciones de medicamentos. Tomar PAXIL 20 mg con otros medicamentos, como tioridazina y pimozida, puede aumentar el riesgo de desarrollar un problema cardíaco grave llamado prolongación del intervalo QT.
- Convulsiones (convulsiones).
- Episodios maníacos. Los episodios maníacos pueden ocurrir en personas con trastorno bipolar que toman PAXIL. Los síntomas pueden incluir:
- gran aumento de energía
- pensamientos acelerados
- ideas inusualmente grandiosas
- hablando más o más rápido de lo habitual
- problemas severos para dormir
- comportamiento temerario
- felicidad excesiva o irritabilidad
- Síndrome de discontinuación. Dejar de tomar PAXIL 20 mg repentinamente puede causarle efectos secundarios graves. Es posible que su proveedor de atención médica quiera disminuir su dosis lentamente. Los síntomas pueden incluir:
- náuseas
- transpiración
- cambios en tu estado de ánimo
- irritabilidad y agitación
- mareo
- sensación de descarga eléctrica (parestesia)
- temblor
- ansiedad
- confusión
- dolor de cabeza
- cansancio
- problemas para dormir
- hipomanía
- zumbido en los oídos (tinnitus)
- convulsiones
- Niveles bajos de sodio en la sangre (hiponatremia). Los niveles bajos de sodio en la sangre que pueden ser graves y causar la muerte pueden ocurrir durante el tratamiento con PAXIL. Las personas de edad avanzada y las personas que toman ciertos medicamentos pueden correr un mayor riesgo de desarrollar niveles bajos de sodio en la sangre. Los signos y síntomas pueden incluir:
- dolor de cabeza
- dificultad para concentrarse
- cambios de memoria
- confusión
- debilidad e inestabilidad en los pies que pueden provocar caídas
En casos más graves o más repentinos, los signos y síntomas incluyen:
- ver u oír cosas que no son reales (alucinaciones)
- desmayo
- convulsiones
- coma
- dejar de respirar (paro respiratorio)
- Sangrado anormal. Tomar PAXIL con aspirina, AINE o anticoagulantes puede aumentar este riesgo. Informe a su proveedor de atención médica sobre cualquier sangrado o hematoma inusual.
- Fracturas de hueso.
Los efectos secundarios más comunes de PAXIL 10 mg incluyen:
- problemas de función sexual masculina y femenina
- estreñimiento
- Diarrea
- boca seca
- problemas para dormir
- nerviosismo
- transpiración
- bostezando
- debilidad (astenia)
- disminucion del apetito
- mareo
- infección
- náuseas
- somnolencia
- estremecimiento (temblor)
Estos no son todos los posibles efectos secundarios de PAXIL.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar PAXIL?
- Almacene las tabletas de PAXIL entre 59 °F y 86 °F (15 °C y 30 °C).
- Guarde la suspensión oral de 10 mg de PAXIL a una temperatura igual o inferior a 25 °C (77 °F).
Mantenga PAXIL y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de PAXIL.
veces, los medicamentos se recetan para fines distintos a los enumerados en la Guía del medicamento. No tome PAXIL para una condición para la cual no fue recetado. No le dé PAXIL a otras personas, incluso si tienen los mismos síntomas que usted tiene. Puede que les haga daño. Puede pedirle a su proveedor de atención médica o farmacéutico información sobre PAXIL escrita para profesionales de la salud.
¿Cuáles son los ingredientes de PAXIL 30mg?
Ingrediente activo: clorhidrato de paroxetina
Ingredientes inactivos:
fosfato dibásico de calcio dihidratado, hipromelosa, estearato de magnesio, polietilenglicoles, polisorbato 80, glicolato de almidón sódico, dióxido de titanio y uno o más de los siguientes: D&C Red No. 30 laca de aluminio, D&C Yellow No. 10 laca de aluminio, FD&C Blue No .2 laca de aluminio, FD&C Yellow No. 6 laca de aluminio
Suspensión oral: ácido cítrico (anhidro), FD&C amarillo No. 6, saborizantes, glicerina, metilparabeno, celulosa microcristalina y carboximetilcelulosa sódica, polacrilina potásica, propilenglicol, propilparabeno, agua purificada, sacarina sódica, emulsión de simeticona y citrato sódico (dihidrato)
Esta Guía del medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de EE. UU.
