Proscar 5mg Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Proscar 5mg y cómo se usa?
Proscar es un medicamento recetado que se usa para tratar los síntomas de la hiperplasia prostática benigna y la alopecia androgénica. Este medicamento es para uso exclusivo en hombres. Proscar 5 mg se puede usar solo o con otros medicamentos.
Proscar pertenece a una clase de medicamentos llamados inhibidores de la 5-alfa-reductasa.
No se sabe si Proscar 5 mg es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Proscar 5 mg?
Proscar puede causar efectos secundarios graves que incluyen:
- náuseas intensas o continuas,
- respiración dificultosa,
- hinchazón de la cara, los labios, la lengua o la garganta,
- bultos en los senos,
- dolor o sensibilidad en los senos,
- secreción del pezón y
- otros cambios en los senos
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Proscar incluyen:
- pérdida de interés en el sexo,
- impotencia,
- problemas para tener un orgasmo, y
- eyaculación anormal
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Proscar. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
PROSCAR (finasteride), un compuesto sintético de 4-azasteroides, es un inhibidor específico de la 5α-reductasa de esteroides tipo II, una enzima intracelular que convierte el andrógeno testosterona en 5α-dihidrotestosterona (DHT).
La finasterida es 4-azaandrost-1-eno-17-carboxamida, N-(1,1-dimetiletil)-3-oxo-,(5α,17ß)-. La fórmula empírica de la finasterida es C23H36N2O2 y su peso molecular es 372,55. Su fórmula estructural es:
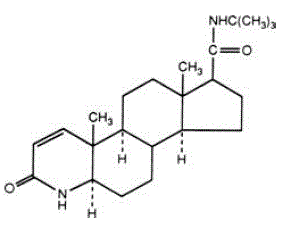
La finasterida es un polvo cristalino blanco con un punto de fusión cercano a los 250°C. Es fácilmente soluble en cloroformo y en disolventes alcohólicos inferiores, pero es prácticamente insoluble en agua.
Los comprimidos de PROSCAR (finasterida) para administración oral son comprimidos recubiertos con película que contienen 5 mg de finasterida y los siguientes ingredientes inactivos: lactosa hidratada, celulosa microcristalina, almidón pregelatinizado, glicolato de almidón sódico, hidroxipropilcelulosa LF, hidroxipropilmetilcelulosa, dióxido de titanio, estearato de magnesio , talco, docusato de sodio, laca de aluminio FD&C Blue 2 y óxido de hierro amarillo.
INDICACIONES
Monoterapia
PROSCAR® está indicado para el tratamiento de la hiperplasia prostática benigna (HPB) sintomática en hombres con agrandamiento de la próstata para:
- Mejorar los síntomas
- Reducir el riesgo de retención urinaria aguda
- Reduzca el riesgo de la necesidad de cirugía, incluida la resección transuretral de la próstata (TURP) y la prostatectomía.
Combinación con Alpha-Blocker
PROSCAR 5 mg administrado en combinación con el bloqueador alfa doxazosina está indicado para reducir el riesgo de progresión sintomática de la HPB (un aumento confirmado de ≥4 puntos en la puntuación de síntomas de la American Urological Association (AUA)).
Limitaciones de uso
PROSCAR no está aprobado para la prevención del cáncer de próstata.
DOSIFICACIÓN Y ADMINISTRACIÓN
PROSCAR puede administrarse con o sin comidas.
Monoterapia
La dosis recomendada de PROSCAR es de un comprimido (5 mg) una vez al día [ver Estudios clínicos ].
Combinación con Alpha-Blocker
La dosis recomendada de PROSCAR es una tableta (5 mg) que se toma una vez al día en combinación con el bloqueador alfa doxazosina [ver Estudios clínicos ].
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Comprimidos recubiertos con película de 5 mg, de color azul, con forma de manzana modificada, con el código MSD 72 en una cara y PROSCAR 5 mg en la otra.
Almacenamiento y manipulación
No. 3094 - PROSCAR tabletas 5 mg son comprimidos recubiertos con película de color azul, con forma de manzana modificada, con el código MSD 72 en una cara y PROSCAR en la otra. Se suministran de la siguiente manera:
CDN 0006-0072-31 unidad de uso botellas de 30 CDN 0006-0072-58 unidad de uso botellas de 100.
Almacenamiento y manipulación
Almacenar a temperatura ambiente por debajo de 30°C (86°F). Proteger de la luz y mantener el envase bien cerrado.
Las mujeres no deben manipular tabletas de PROSCAR trituradas o rotas de 5 mg cuando están embarazadas o pueden estar embarazadas debido a la posibilidad de absorción de finasterida y el riesgo potencial subsiguiente para un feto masculino [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
Distribuido por: Merck Sharp & Dohme Corp., una subsidiaria de MERCK & CO.,INC., Whitehouse Station, NJ 08889, EE. UU. Revisado: junio de 2021
EFECTOS SECUNDARIOS
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica clínica.
Estudio controlado con placebo de 4 años (PLESS)
En PLESS, se evaluó la seguridad de 1524 pacientes tratados con PROSCAR y 1516 pacientes tratados con placebo durante un período de 4 años. Las reacciones adversas notificadas con mayor frecuencia estaban relacionadas con la función sexual. El 3,7 % (57 pacientes) tratados con PROSCAR 5 mg y el 2,1 % (32 pacientes) tratados con placebo interrumpieron el tratamiento como consecuencia de reacciones adversas relacionadas con la función sexual, que son las reacciones adversas notificadas con mayor frecuencia.
La Tabla 1 presenta las únicas reacciones adversas clínicas consideradas posible, probable o definitivamente relacionadas con el fármaco por el investigador, para las cuales la incidencia con PROSCAR 5 mg fue ≥1 % y mayor que con el placebo durante los 4 años del estudio. En los años 2-4 del estudio, no hubo diferencias significativas entre los grupos de tratamiento en las incidencias de impotencia, disminución de la libido y trastorno de la eyaculación.
Estudios de Fase III y Prórroga Abierta de 5 Años
El perfil de experiencias adversas en los estudios de fase III controlados con placebo de 1 año, las extensiones abiertas de 5 años y PLESS fueron similares.
Estudio de terapia médica de síntomas prostáticos (MTOPS)
En el estudio MTOPS, 3047 hombres con HPB sintomática fueron aleatorizados para recibir PROSCAR 5 mg/día (n=768), doxazosina 4 u 8 mg/día (n=756), la combinación de PROSCAR 5 mg/día y doxazosina 4 o 8 mg/día (n=786), o placebo (n=737) durante 4 a 6 años. [Ver un Estudios clínicos .]
Las tasas de incidencia de experiencias adversas relacionadas con el fármaco notificadas por ≥2 % de los pacientes en cualquier grupo de tratamiento en el estudio MTOPS se enumeran en la Tabla 2.
Los efectos adversos individuales que ocurrieron con mayor frecuencia en el grupo de combinación en comparación con cualquiera de los fármacos solos fueron: astenia, hipotensión postural, edema periférico, mareos, disminución de la libido, rinitis, eyaculación anormal, impotencia y función sexual anormal (ver Tabla 2). De estos, la incidencia de eyaculación anormal en pacientes que recibieron terapia combinada fue comparable a la suma de las incidencias de esta experiencia adversa informada para las dos monoterapias.
La terapia de combinación con finasterida y doxazosina no se asoció con nuevas experiencias clínicas adversas.
Cuatro pacientes en MTOPS informaron la experiencia adversa del cáncer de mama. Tres de estos pacientes estaban solo con finasterida y uno con terapia combinada. [Ver un Datos a largo plazo .]
El Estudio MTOPS no fue diseñado específicamente para hacer comparaciones estadísticas entre grupos para las experiencias adversas informadas. Además, las comparaciones directas de los datos de seguridad entre el estudio MTOPS y los estudios previos de los agentes individuales pueden no ser apropiadas debido a las diferencias en la población de pacientes, la dosis o el régimen de dosis y otros elementos del diseño del estudio y del procedimiento.
Datos a largo plazo
Cáncer de próstata de alto grado
El ensayo PCPT fue un ensayo aleatorizado, doble ciego, controlado con placebo de 7 años que inscribió a 18 882 hombres ≥55 años de edad con un tacto rectal normal y un PSA ≤3,0 ng/mL. Los hombres recibieron PROSCAR (finasteride 5 mg) o placebo diariamente. Los pacientes fueron evaluados anualmente con PSA y tacto rectal. Se realizaron biopsias por PSA elevado, un examen rectal digital anormal o el final del estudio. La incidencia de cáncer de próstata con una puntuación de Gleason de 8 a 10 fue mayor en los hombres tratados con finasterida (1,8 %) que en los tratados con placebo (1,1 %) [ver INDICACIONES y ADVERTENCIAS Y PRECAUCIONES ]. En un ensayo clínico controlado con placebo de 4 años con otro inhibidor de la 5α-reductasa (dutasterida, AVODART), se observaron resultados similares para el cáncer de próstata con una puntuación de Gleason de 8 a 10 (1 % de dutasterida frente a 0,5 % de placebo).
No se ha demostrado beneficio clínico en pacientes con cáncer de próstata tratados con PROSCAR.
Cáncer de mama
Durante el estudio MTOPS de 4 a 6 años controlado con placebo y comparador que inscribió a 3047 hombres, hubo 4 casos de cáncer de mama en hombres tratados con finasteride pero ningún caso en hombres no tratados con finasteride. Durante el estudio PLESS controlado con placebo de 4 años que inscribió a 3040 hombres, hubo 2 casos de cáncer de mama en hombres tratados con placebo pero ningún caso en hombres tratados con finasterida. Durante el ensayo de prevención del cáncer de próstata controlado con placebo (PCPT) de 7 años que inscribió a 18 882 hombres, hubo 1 caso de cáncer de mama en hombres tratados con finasterida y 1 caso de cáncer de mama en hombres tratados con placebo. Actualmente se desconoce la relación entre el uso a largo plazo de finasterida y la neoplasia mamaria masculina.
función sexual
No hay evidencia de un aumento de las experiencias sexuales adversas con una mayor duración del tratamiento con PROSCAR. Los nuevos informes de experiencias adversas sexuales relacionadas con los medicamentos disminuyeron con la duración de la terapia.
Experiencia posterior a la comercialización
Los siguientes eventos adversos adicionales se informaron en la experiencia posterior a la comercialización con PROSCAR. Debido a que estos eventos son informados voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco:
- reacciones de hipersensibilidad, como prurito, urticaria y angioedema (incluida la hinchazón de los labios, la lengua, la garganta y la cara)
- dolor testicular
- hematospermia
- disfunción sexual que continuó después de la interrupción del tratamiento, incluida la disfunción eréctil, disminución de la libido y trastornos de la eyaculación (p. ej., reducción del volumen de eyaculación). Estos eventos se informaron en raras ocasiones en hombres que tomaban PROSCAR para el tratamiento de la BPH. La mayoría de los hombres eran mayores y estaban tomando medicamentos concomitantes y/o tenían condiciones comórbidas. Se desconoce el papel independiente de PROSCAR 5 mg en estos eventos.
- Rara vez se informó infertilidad masculina y/o calidad seminal deficiente en hombres que tomaban PROSCAR 5 mg para el tratamiento de la HBP. Se ha informado normalización o mejora de la calidad seminal deficiente después de la interrupción de la finasterida. Se desconoce el papel independiente de PROSCAR en estos eventos.
- depresión
- cáncer de mama masculino.
El siguiente evento adverso adicional relacionado con la disfunción sexual que continuó después de la interrupción del tratamiento se informó en la experiencia posterior a la comercialización con finasterida en dosis más bajas utilizadas para tratar la calvicie de patrón masculino. Debido a que el evento es informado voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco:
- trastornos del orgasmo
INTERACCIONES CON LA DROGAS
Sistema de enzimas metabolizadoras de fármacos ligadas al citocromo P450
No se han identificado interacciones medicamentosas de importancia clínica. Finasteride no parece afectar el sistema enzimático metabolizador de fármacos ligado al citocromo P450. Los compuestos que se han probado en humanos incluyen antipirina, digoxina, propranolol, teofilina y warfarina y no se encontraron interacciones clínicamente significativas.
Otra terapia concomitante
Aunque no se realizaron estudios de interacción específicos, PROSCAR 5 mg se usó concomitantemente en estudios clínicos con paracetamol, ácido acetilsalicílico, bloqueadores alfa, inhibidores de la enzima convertidora de angiotensina (ECA), analgésicos, anticonvulsivos, bloqueadores beta-adrenérgicos, diuréticos, calcio. bloqueadores de canales, nitratos cardíacos, inhibidores de la HMG-CoA reductasa, medicamentos antiinflamatorios no esteroideos (AINE), benzodiazepinas, antagonistas H2 y antiinfecciosos de quinolona sin evidencia de interacciones adversas clínicamente significativas.
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Efectos sobre el antígeno prostático específico (PSA) y el uso de PSA en la detección del cáncer de próstata
En estudios clínicos, PROSCAR redujo la concentración sérica de PSA en aproximadamente un 50 % dentro de los seis meses de tratamiento. Esta disminución es predecible en todo el rango de valores de PSA en pacientes con HPB sintomática, aunque puede variar de un individuo a otro.
Para la interpretación de los PSA en serie en hombres que toman PROSCAR, se debe establecer una nueva línea base de PSA al menos seis meses después de comenzar el tratamiento y monitorear periódicamente el PSA a partir de entonces. Cualquier aumento confirmado desde el valor más bajo de PSA mientras toma PROSCAR 5 mg puede indicar la presencia de cáncer de próstata y debe evaluarse, incluso si los niveles de PSA todavía están dentro del rango normal para los hombres que no toman un inhibidor de la 5α reductasa. El incumplimiento de la terapia con PROSCAR también puede afectar los resultados de la prueba de PSA. Para interpretar un valor de PSA aislado en pacientes tratados con PROSCAR 5 mg durante seis meses o más, los valores de PSA deben duplicarse para compararlos con los rangos normales en hombres no tratados. Estos ajustes preservan la utilidad del PSA para detectar el cáncer de próstata en hombres tratados con PROSCAR.
PROSCAR también puede causar disminuciones en el PSA sérico en presencia de cáncer de próstata.
La proporción de PSA libre a total (porcentaje de PSA libre) permanece constante incluso bajo la influencia de PROSCAR. Si los médicos optan por utilizar el porcentaje de PSA libre como ayuda para la detección del cáncer de próstata en hombres que reciben tratamiento con finasterida, no parece necesario ajustar su valor.
Mayor riesgo de cáncer de próstata de alto grado
Los hombres de 55 años o más con un tacto rectal normal y PSA ≤3,0 ng/mL al inicio del estudio que tomaban finasteride 5 mg/día en el Prostate Cancer Prevention Trial (PCPT) de 7 años tenían un mayor riesgo de cáncer de próstata con una puntuación de Gleason de 8-10 (finasterida 1,8% frente a placebo 1,1%). [Ver un INDICACIONES y REACCIONES ADVERSAS .] Se observaron resultados similares en un ensayo clínico controlado con placebo de 4 años con otro inhibidor de la 5α-reductasa (dutasterida, AVODART) (1 % de dutasterida frente a 0,5 % de placebo). Los inhibidores de la 5α reductasa pueden aumentar el riesgo de desarrollar cáncer de próstata de alto grado. No se ha establecido si el efecto de los inhibidores de la 5α-reductasa para reducir el volumen de la próstata o los factores relacionados con el estudio afectaron los resultados de estos estudios.
exposición de las hembras
Riesgo para el feto masculino
PROSCAR está contraindicado en mujeres embarazadas y en mujeres que pueden estar potencialmente embarazadas y no está indicado para su uso en mujeres. Según los estudios en animales y el mecanismo de acción, PROSCAR 5 mg puede causar un desarrollo anormal de los genitales externos en un feto masculino si se administra a una mujer embarazada. Las mujeres embarazadas o que puedan estar potencialmente embarazadas no deben manipular las tabletas de PROSCAR de 5 mg trituradas o partidas. Los comprimidos de PROSCAR de 5 mg están recubiertos y evitarán el contacto con el ingrediente activo durante la manipulación normal, siempre que los comprimidos no se hayan roto o triturado. Si una mujer embarazada entra en contacto con tabletas de 5 mg de PROSCAR trituradas o rotas, el área de contacto debe lavarse inmediatamente con agua y jabón. [Ver un CONTRAINDICACIONES ,A Uso en poblaciones específicas ,A FARMACOLOGÍA CLÍNICA , y CÓMO SUMINISTRADO .]
Pacientes pediátricos y mujeres
PROSCAR no está indicado para uso en pacientes pediátricos [ver Uso en poblaciones específicas y FARMACOLOGÍA CLÍNICA ] o hembras [ver también ADVERTENCIAS Y PRECAUCIONES ,A Uso en poblaciones específicas ,A FARMACOLOGÍA CLÍNICA , y CÓMO SUMINISTRADO ].
Efecto sobre las características del semen
El tratamiento con PROSCAR durante 24 semanas para evaluar los parámetros del semen en voluntarios masculinos sanos no reveló efectos clínicamente significativos sobre la concentración, la movilidad, la morfología o el pH de los espermatozoides. Se observó una mediana de disminución de 0,6 ml (22,1 %) en el volumen de eyaculado con una reducción concomitante en el total de espermatozoides por eyaculado. Estos parámetros se mantuvieron dentro del rango normal y fueron reversibles al suspender la terapia con un tiempo promedio para volver a la línea de base de 84 semanas.
Consideración de otras condiciones urológicas
Antes de iniciar el tratamiento con PROSCAR 5 mg, se deben considerar otras condiciones urológicas que puedan causar síntomas similares. Además, el cáncer de próstata y la HPB pueden coexistir.
Los pacientes con gran volumen urinario residual y/o flujo urinario severamente disminuido deben ser monitoreados cuidadosamente para detectar uropatía obstructiva. Estos pacientes pueden no ser candidatos para la terapia con finasterida.
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( INFORMACIÓN DEL PACIENTE ).
Mayor riesgo de cáncer de próstata de alto grado
Se debe informar a los pacientes que hubo un aumento en el cáncer de próstata de alto grado en hombres tratados con inhibidores de la 5α-reductasa indicados para el tratamiento de la HBP, incluido PROSCAR 5 mg, en comparación con los tratados con placebo en estudios que analizan el uso de estos medicamentos para prevenir la próstata. cáncer [ver INDICACIONES ,A ADVERTENCIAS Y PRECAUCIONES , y REACCIONES ADVERSAS ].
Exposición de mujeres: riesgo para el feto masculino
Los médicos deben informar a los pacientes que las mujeres embarazadas o que puedan estar embarazadas no deben manipular tabletas de PROSCAR trituradas o rotas debido a la posibilidad de absorción de finasterida y el riesgo potencial subsiguiente para el feto masculino. Las tabletas de PROSCAR están recubiertas y evitarán el contacto con el ingrediente activo durante la manipulación normal, siempre que las tabletas no hayan sido rotas o trituradas. Si una mujer embarazada o potencialmente embarazada entra en contacto con tabletas de PROSCAR trituradas o rotas, el área de contacto debe lavarse inmediatamente con agua y jabón [ver CONTRAINDICACIONES ,A ADVERTENCIAS Y PRECAUCIONES ,A Uso en poblaciones específicas y CÓMO SUMINISTRADO ].
Instrucciones adicionales
Los médicos deben informar a los pacientes que el volumen de eyaculación puede disminuir en algunos pacientes durante el tratamiento con PROSCAR. Esta disminución no parece interferir con la función sexual normal. Sin embargo, la impotencia y la disminución de la libido pueden ocurrir en pacientes tratados con PROSCAR [ver REACCIONES ADVERSAS ].
Los médicos deben instruir a sus pacientes para que informen de inmediato cualquier cambio en sus senos, como bultos, dolor o secreción del pezón. Se han informado cambios en los senos que incluyen agrandamiento de los senos, sensibilidad y neoplasias [ver REACCIONES ADVERSAS ].
Los médicos deben indicar a sus pacientes que lean el prospecto del paciente antes de comenzar la terapia con PROSCAR 5 mg y que lo vuelvan a leer cada vez que renueven la receta para que estén al tanto de la información actual para los pacientes con respecto a PROSCAR.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Carcinogénesis
No se observó evidencia de un efecto tumorigénico en un estudio de 24 meses en ratas Sprague-Dawley que recibieron dosis de finasterida de hasta 160 mg/kg/día en machos y 320 mg/kg/día en hembras. Estas dosis produjeron una exposición sistémica respectiva en ratas de 111 y 274 veces la observada en humanos que recibieron la dosis humana recomendada de 5 mg/día. Todos los cálculos de exposición se basaron en el AUC calculado (0-24 h) para animales y el AUC medio (0-24 h) para el hombre (0,4 μg•h/mL).
En un estudio de carcinogenicidad de 19 meses en ratones CD-1, se observó un aumento estadísticamente significativo (p≤0,05) en la incidencia de adenomas testiculares de células de Leydig a 228 veces la exposición humana (250 mg/kg/día). En ratones a 23 veces la exposición humana, estimada (25 mg/kg/día) y en ratas a 39 veces la exposición humana (40 mg/kg/día) se observó un aumento en la incidencia de hiperplasia de células de Leydig. Se ha demostrado una correlación positiva entre los cambios proliferativos en las células de Leydig y un aumento en los niveles séricos de LH (2 a 3 veces por encima del control) en ambas especies de roedores tratadas con altas dosis de finasteride. No se observaron cambios en las células de Leydig relacionados con el fármaco en ratas o perros tratados con finasteride durante 1 año en 30 y 350 veces (20 mg/kg/día y 45 mg/kg/día, respectivamente) o en ratones tratados durante 19 meses en 2,3 veces la exposición humana, estimada (2,5 mg/kg/día).
mutagénesis
No se observó evidencia de mutagenicidad en un ensayo de mutagénesis bacteriana in vitro, un ensayo de mutagénesis en células de mamíferos o en un ensayo de elución alcalina in vitro. En un ensayo de aberraciones cromosómicas in vitro, usando células de ovario de hámster chino, hubo un ligero aumento en las aberraciones cromosómicas. Estas concentraciones corresponden a 4000-5000 veces los niveles plasmáticos máximos en el hombre al recibir una dosis total de 5 mg. En un ensayo de aberración cromosómica in vivo en ratones, no se observó un aumento de la aberración cromosómica relacionado con el tratamiento con finasteride a la dosis máxima tolerada de 250 mg/kg/día (228 veces la exposición humana) según lo determinado en los estudios de carcinogenicidad.
Deterioro de la fertilidad
En conejos machos sexualmente maduros tratados con finasteride a 543 veces la exposición humana (80 mg/kg/día) durante un máximo de 12 semanas, no se observaron efectos sobre la fertilidad, el recuento de espermatozoides o el volumen de eyaculación. En ratas macho sexualmente maduras tratadas con 61 veces la exposición humana (80 mg/kg/día), no hubo efectos significativos sobre la fertilidad después de 6 o 12 semanas de tratamiento; sin embargo, cuando el tratamiento se continuó hasta por 24 o 30 semanas, hubo una disminución aparente en la fertilidad, la fecundidad y una disminución significativa asociada en los pesos de las vesículas seminales y la próstata. Todos estos efectos fueron reversibles dentro de las 6 semanas posteriores a la interrupción del tratamiento. No se han observado efectos relacionados con el fármaco en los testículos o en el apareamiento en ratas o conejos. Esta disminución de la fertilidad en las ratas tratadas con finasterida es secundaria a su efecto sobre los órganos sexuales accesorios (próstata y vesículas seminales), lo que provoca que no se forme un tapón seminal. El tapón seminal es esencial para la fertilidad normal en ratas y no es relevante en el hombre.
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
PROSCAR está contraindicado en mujeres embarazadas y no indicado para uso en mujeres. Según estudios en animales y el mecanismo de acción, PROSCAR 5 mg puede causar un desarrollo anormal de los genitales externos en un feto masculino si se administra a una mujer embarazada [ver ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ].
En un estudio de desarrollo embriofetal en ratas, hubo un aumento dependiente de la dosis en el hipospadias que ocurrió en 3,6 a 100 % de las crías macho de ratas preñadas a las que se les administró finasterida oral durante el período de mayor organogénesis en dosis de aproximadamente 0,1 a 86 veces la máxima dosis humana recomendada (MRHD) de 5 mg/día (basada en el AUC en dosis para animales de 0,1 a 100 mg/kg/día).
También se observaron pesos prostáticos y vesiculares seminales reducidos, separación prepucial retardada y desarrollo transitorio del pezón en crías masculinas con dosis maternas orales de aproximadamente 0,03 veces la MRHD (basado en el AUC de la dosis animal de 0,03 mg/kg/día), junto con una distancia anogenital reducida en descendientes machos en dosis maternas orales de aproximadamente 0,003 veces la MRHD (basado en el AUC en dosis animal de 0,003 mg/kg/día).
PROSCAR es un inhibidor de la 5α-reductasa tipo II que evita la conversión de testosterona en 5α-dihidrotestosterona (DHT), una hormona necesaria para el desarrollo normal de los genitales masculinos. Si este medicamento se usa durante el embarazo, o si la paciente queda embarazada mientras toma este medicamento, se debe informar a la paciente sobre el peligro potencial para el feto masculino.
El desarrollo genital masculino anormal es una consecuencia esperada cuando los inhibidores de la 5α-reductasa inhiben la conversión de testosterona en 5α-dihidrotestosterona (DHT). Estos resultados son similares a los informados en lactantes varones con deficiencia genética de 5α-reductasa. Las mujeres pueden estar expuestas a la finasterida a través del contacto con tabletas de PROSCAR trituradas o rotas o el semen de una pareja masculina que toma PROSCAR. Con respecto a la exposición a la finasterida a través de la piel, las tabletas de PROSCAR de 5 mg están recubiertas y evitarán el contacto de la piel con la finasterida durante la manipulación normal si las tabletas no han sido trituradas o rotas. Las mujeres embarazadas o que puedan estar embarazadas no deben manipular comprimidos de PROSCAR de 5 mg triturados o partidos debido a la posible exposición de un feto masculino. Con respecto a la posible exposición a la finasterida a través del semen, se realizaron tres estudios que midieron las concentraciones de finasterida en el semen de hombres que recibieron 5 mg/día de PROSCAR. En estos estudios, se estimó que la cantidad más alta de finasterida en el semen era de 50 a 100 veces menor que la dosis de finasterida (5 μg) que no tuvo efecto sobre los niveles circulantes de DHT en los hombres [ver Datos y FARMACOLOGÍA CLÍNICA ].
Datos
Datos humanos
En 2 estudios de sujetos sanos (n=69) que recibieron PROSCAR 5 mg/día durante 6 a 24 semanas, las concentraciones de finasterida en el semen oscilaron entre indetectables ( FARMACOLOGÍA CLÍNICA ].
Datos de animales
En un estudio de desarrollo embriofetal, ratas preñadas recibieron finasterida durante el período de mayor organogénesis (días 6 a 17 de gestación). Con dosis maternas de finasterida oral de aproximadamente 0,1 a 86 veces la dosis humana máxima recomendada (DMRH) de 5 mg/día (basado en el AUC en dosis para animales de 0,1 a 100 mg/kg/día) hubo un aumento de hipospadias dependiente de la dosis eso ocurrió en 3.6 a 100% de la descendencia masculina. Los múltiplos de exposición se estimaron utilizando datos de ratas no preñadas. Los días 16 a 17 de gestación es un período crítico en ratas fetales macho para la diferenciación de los genitales externos. Con dosis maternas orales de aproximadamente 0,03 veces la MRHD (basado en el AUC de la dosis para animales de 0,03 mg/kg/día), la descendencia masculina presentó una disminución del peso prostático y de las vesículas seminales, retraso en la separación del prepucio y desarrollo transitorio del pezón. Se produjo una disminución de la distancia anogenital en las crías macho de ratas preñadas que recibieron aproximadamente 0,003 veces la MRHD (basado en el AUC de la dosis animal de 0,003 mg/kg/día). No se observaron anomalías en la descendencia femenina con ninguna dosis materna de finasterida.
No se observaron anomalías del desarrollo en las crías de hembras no tratadas apareadas con ratas macho tratadas con finasteride que recibieron aproximadamente 61 veces la MRHD (basado en el AUC de la dosis animal de 80 mg/kg/día). Se observó una ligera disminución de la fertilidad en las crías machos después de la administración de aproximadamente 3 veces la MRHD (basado en el AUC de la dosis para animales de 3 mg/kg/día) a ratas hembra durante la última etapa de la gestación y la lactancia. No se observaron efectos sobre la fertilidad en las crías hembras en estas condiciones.
No se observó evidencia de malformaciones genitales externas masculinas u otras anomalías en fetos de conejo expuestos a finasterida durante el período de mayor organogénesis (días 6-18 de gestación) a dosis orales maternas de hasta 100 mg/kg/día (los niveles de exposición a finasterida no fueron medida en conejos). Sin embargo, es posible que este estudio no haya incluido el período crítico para los efectos de la finasterida en el desarrollo de los genitales externos masculinos en el conejo.
Los efectos fetales de la exposición materna a la finasterida durante el período de desarrollo embrionario y fetal se evaluaron en el mono rhesus (días de gestación 20-100), en una especie y un período de desarrollo más predictivo de efectos específicos en humanos que los estudios en ratas y conejos. La administración intravenosa de finasterida a monas preñadas en dosis de hasta 800 ng/día (concentración sanguínea máxima estimada de 1,86 ng/mL o aproximadamente 143 veces la exposición más alta estimada de hembras preñadas a finasterida del semen de hombres que toman 5 mg/día) resultó en ninguna anormalidad en los fetos masculinos. En confirmación de la relevancia del modelo rhesus para el desarrollo fetal humano, la administración oral de una dosis de finasterida (2 mg/kg/día o aproximadamente 18 000 veces los niveles sanguíneos más altos estimados de finasterida en el semen de hombres que toman 5 mg/día) para monos preñados resultó en anormalidades genitales externas en fetos machos. No se observaron otras anomalías en los fetos masculinos y no se observaron anomalías relacionadas con la finasterida en los fetos femeninos en ninguna dosis.
Lactancia
Resumen de riesgos
PROSCAR no está indicado para uso en mujeres.
Hembras y machos con potencial reproductivo
Esterilidad
Hembras
PROSCAR no está indicado para uso en mujeres.
machos
El tratamiento con PROSCAR durante 24 semanas para evaluar los parámetros del semen en voluntarios masculinos sanos no reveló efectos clínicamente significativos sobre la concentración, la movilidad, la morfología o el pH de los espermatozoides. Se observó una mediana de disminución de 0,6 ml (22,1 %) en el volumen de eyaculado con una reducción concomitante en el total de espermatozoides por eyaculado. Estos parámetros se mantuvieron dentro del rango normal y fueron reversibles al suspender la terapia con un tiempo promedio para volver al valor inicial de 84 semanas [ver ADVERTENCIAS Y PRECAUCIONES ].
Ha habido informes posteriores a la comercialización de infertilidad masculina y/o mala calidad seminal; Se informó normalización o mejora de la calidad seminal después de la interrupción de la finasterida [ver REACCIONES ADVERSAS ].
Uso pediátrico
PROSCAR 5 mg no está indicado para uso en pacientes pediátricos.
No se ha establecido la seguridad y eficacia en pacientes pediátricos.
Uso geriátrico
Del total de sujetos incluidos en PLESS, 1480 y 105 sujetos tenían 65 años y más y 75 años y más, respectivamente. No se observaron diferencias generales en la seguridad o la eficacia entre estos sujetos y los sujetos más jóvenes, y otra experiencia clínica notificada no ha identificado diferencias en las respuestas entre los pacientes de edad avanzada y los más jóvenes. No es necesario ajustar la dosis en los ancianos [ver FARMACOLOGÍA CLÍNICA y Estudios clínicos ].
Deterioro hepático
Se debe tener precaución en la administración de PROSCAR en aquellos pacientes con anomalías en la función hepática, ya que la finasterida se metaboliza extensamente en el hígado [ver FARMACOLOGÍA CLÍNICA ].
Insuficiencia renal
No es necesario ajustar la dosis en pacientes con insuficiencia renal [ver FARMACOLOGÍA CLÍNICA ].
SOBREDOSIS
Los pacientes han recibido dosis únicas de PROSCAR de 5 mg hasta 400 mg y dosis múltiples de PROSCAR de 5 mg hasta 80 mg/día durante tres meses sin efectos adversos. Hasta que se obtenga más experiencia, no se puede recomendar un tratamiento específico para una sobredosis de PROSCAR.
Se observó una letalidad significativa en ratones machos y hembras con dosis orales únicas de 1500 mg/m2 (500 mg/kg) y en ratas hembras y machos con dosis orales únicas de 2360 mg/m2 (400 mg/kg) y 5900 mg/m2 (1000 mg/kg), respectivamente.
CONTRAINDICACIONES
PROSCAR está contraindicado en lo siguiente:
- Hipersensibilidad a cualquier componente de este medicamento.
- El embarazo. El uso de finasteride está contraindicado en mujeres cuando están o pueden estar potencialmente embarazadas. Debido a la capacidad de los inhibidores de la 5α-reductasa tipo II para inhibir la conversión de testosterona en 5α-dihidrotestosterona (DHT), la finasterida puede causar anomalías en los genitales externos de un feto masculino de una mujer embarazada que recibe finasterida. Si este medicamento se usa durante el embarazo, o si ocurre un embarazo mientras se toma este medicamento, se debe informar a la mujer embarazada sobre el peligro potencial para el feto masculino. [Ver también ADVERTENCIAS Y PRECAUCIONES ,A Uso en poblaciones específicas , y CÓMO SUMINISTRADO .] En ratas hembras, las dosis bajas de finasterida administradas durante el embarazo han producido anomalías en los genitales externos de las crías macho.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
El desarrollo y agrandamiento de la próstata depende del potente andrógeno 5α-dihidrotestosterona (DHT). La 5α-reductasa tipo II metaboliza la testosterona a DHT en la glándula prostática, el hígado y la piel. DHT induce efectos androgénicos al unirse a los receptores de andrógenos en los núcleos celulares de estos órganos.
La finasterida es un inhibidor competitivo y específico de la 5α-reductasa tipo II con la que forma lentamente un complejo enzimático estable. La rotación de este complejo es extremadamente lenta (t½ ∼ 30 días). Esto se ha demostrado tanto in vivo como in vitro. Finasteride no tiene afinidad por el receptor de andrógenos. En el hombre, los metabolitos de esteroides reducidos en 5α en la sangre y la orina disminuyen después de la administración de finasterida.
Farmacodinámica
En el hombre, una sola dosis oral de 5 mg de PROSCAR produce una rápida reducción de la concentración sérica de DHT, observándose el efecto máximo 8 horas después de la primera dosis. La supresión de DHT se mantiene a lo largo del intervalo de dosificación de 24 horas y con el tratamiento continuado. Se ha demostrado que la dosificación diaria de PROSCAR de 5 mg/día durante un máximo de 4 años reduce la concentración sérica de DHT en aproximadamente un 70 %. La mediana del nivel circulante de testosterona aumentó aproximadamente un 10-20%, pero se mantuvo dentro del rango fisiológico. En un estudio separado en hombres sanos tratados con 1 mg de finasterida por día (n=82) o placebo (n=69), los niveles circulantes medios de testosterona y estradiol aumentaron aproximadamente un 15 % en comparación con el valor inicial, pero se mantuvieron dentro del rango rango fisiológico.
En pacientes que recibieron 5 mg/día de PROSCAR, se observaron aumentos de alrededor del 10 % en la hormona luteinizante (LH) y la hormona estimulante del folículo (FSH), pero los niveles permanecieron dentro del rango normal. En voluntarios sanos, el tratamiento con PROSCAR 5 mg no alteró la respuesta de LH y FSH a la hormona liberadora de gonadotropina, lo que indica que el eje hipotálamo-pituitario-testicular no se vio afectado.
En pacientes con BPH, PROSCAR no tiene efecto sobre los niveles circulantes de cortisol, prolactina, hormona estimulante de la tiroides o tiroxina. No se observó ningún efecto clínicamente significativo en el perfil de lípidos plasmáticos (es decir, colesterol total, lipoproteínas de baja densidad, lipoproteínas de alta densidad y triglicéridos) ni en la densidad mineral ósea.
Los varones adultos con deficiencia de 5α-reductasa tipo II genéticamente heredada también tienen niveles reducidos de DHT. Excepto por los defectos urogenitales asociados presentes al nacer, no se han observado otras anomalías clínicas relacionadas con la deficiencia de 5α-reductasa tipo II en estos individuos. Estos individuos tienen una glándula prostática pequeña durante toda su vida y no desarrollan BPH.
En pacientes con BPH tratados con finasteride (1-100 mg/día) durante 7-10 días antes de la prostatectomía, se midió un contenido de DHT aproximadamente un 80 % más bajo en el tejido prostático extirpado en la cirugía, en comparación con el placebo; la concentración tisular de testosterona aumentó hasta 10 veces por encima de los niveles previos al tratamiento, en relación con el placebo. El contenido intraprostático de PSA también disminuyó.
En voluntarios masculinos sanos tratados con PROSCAR 5 mg durante 14 días, la interrupción de la terapia resultó en un retorno de los niveles de DHT a los niveles previos al tratamiento en aproximadamente 2 semanas. En los pacientes tratados durante tres meses, el volumen de la próstata, que se redujo en aproximadamente un 20 %, volvió a acercarse al valor inicial después de aproximadamente tres meses de interrupción del tratamiento.
Farmacocinética
Absorción
En un estudio de 15 sujetos jóvenes sanos, la biodisponibilidad media de las tabletas de 5 mg de finasterida fue del 63 % (rango 34-108 %), según la relación del área bajo la curva (AUC) en relación con una dosis de referencia intravenosa (IV). . La concentración plasmática máxima de finasterida promedió 37 ng/mL (rango, 27-49 ng/mL) y se alcanzó 1-2 horas después de la dosis. La biodisponibilidad de la finasterida no se vio afectada por los alimentos.
Distribución
El volumen medio de distribución en estado estacionario fue de 76 litros (rango, 44-96 litros). Aproximadamente el 90% de la finasterida circulante se une a las proteínas plasmáticas. Hay una fase de acumulación lenta para la finasterida después de dosis múltiples. Después de la dosificación de 5 mg/día de finasterida durante 17 días, las concentraciones plasmáticas de finasterida fueron un 47 y un 54 % más altas que después de la primera dosis en hombres de 45 a 60 años (n=12) y ≥70 años (n=12) , respectivamente. Las concentraciones mínimas medias después de 17 días de dosificación fueron 6,2 ng/mL (rango, 2,49,8 ng/mL) y 8,1 ng/mL (rango, 1,8-19,7 ng/mL), respectivamente, en los dos grupos de edad. Aunque en este estudio no se alcanzó el estado estacionario, la concentración plasmática mínima media en otro estudio en pacientes con HBP (edad media, 65 años) que recibieron 5 mg/día fue de 9,4 ng/ml (rango, 7,1-13,3 ng/ml; n= 22) después de más de un año de dosificación.
Se ha demostrado que la finasterida atraviesa la barrera hematoencefálica, pero no parece distribuirse preferentemente al LCR.
En 2 estudios de sujetos sanos (n=69) que recibieron PROSCAR 5 mg/día durante 6 a 24 semanas, las concentraciones de finasterida en el semen oscilaron entre indetectables ( Uso en poblaciones específicas ].
Metabolismo
La finasterida se metaboliza ampliamente en el hígado, principalmente a través de la subfamilia de enzimas citocromo P450 3A4. Se han identificado dos metabolitos, los metabolitos monohidroxilados de cadena lateral de t-butilo y ácido monocarboxílico, que no poseen más del 20 % de la actividad inhibidora de la 5α-reductasa de la finasterida.
Excreción
En sujetos jóvenes sanos (n=15), el aclaramiento plasmático medio de finasterida fue de 165 ml/min (rango, 70279 ml/min) y la vida media de eliminación media en plasma fue de 6 horas (rango, 3-16 horas). Después de una dosis oral de 14C-finasteride en humanos (n=6), una media del 39% (rango, 32-46%) de la dosis se excretó en la orina en forma de metabolitos; El 57% (rango, 51-64%) se excretó en las heces.
La vida media terminal promedio de finasteride en sujetos ≥70 años de edad fue de aproximadamente 8 horas (rango, 6-15 horas; n=12), en comparación con 6 horas (rango, 4-12 horas; n=12) en sujetos 45-60 años de edad. Como resultado, el AUC medio (0-24 h) después de 17 días de dosificación fue un 15 % mayor en sujetos ≥70 años que en sujetos de 45-60 años (p=0,02).
Pediátrico
No se ha investigado la farmacocinética de finasterida en pacientes
Finasteride no está indicado para uso en pacientes pediátricos [ver ADVERTENCIAS Y PRECAUCIONES ,A Uso en poblaciones específicas ].
Género
Finasteride no está indicado para uso en mujeres [ver CONTRAINDICACIONES ,A ADVERTENCIAS Y PRECAUCIONES ,A Uso en poblaciones específicas , y CÓMO SUMINISTRADO ].
geriátrico
No es necesario ajustar la dosis en los ancianos. Aunque la tasa de eliminación de finasterida disminuye en los ancianos, estos hallazgos no tienen importancia clínica. [Ver un Farmacocinética y Uso en poblaciones específicas .]
La raza
No se ha estudiado el efecto de la raza sobre la farmacocinética de la finasterida.
Deterioro hepático
No se ha estudiado el efecto de la insuficiencia hepática sobre la farmacocinética de la finasterida. Se debe tener precaución en la administración de PROSCAR 5 mg en aquellos pacientes con anomalías en la función hepática, ya que la finasterida se metaboliza extensamente en el hígado. Insuficiencia renal
No es necesario ajustar la dosis en pacientes con insuficiencia renal. En pacientes con insuficiencia renal crónica, con aclaramientos de creatinina que oscilan entre 9,0 y 55 ml/min, el AUC, la concentración plasmática máxima, la vida media y la unión a proteínas después de una dosis única de 14C-finasterida fueron similares a los valores obtenidos en voluntarios sanos. La excreción urinaria de metabolitos disminuyó en pacientes con insuficiencia renal. Esta disminución se asoció con un aumento en la excreción fecal de metabolitos. Las concentraciones plasmáticas de metabolitos fueron significativamente más altas en pacientes con insuficiencia renal (basado en un aumento del 60 % en el AUC de radiactividad total). Sin embargo, la finasterida ha sido bien tolerada en pacientes con HPB con función renal normal que recibieron hasta 80 mg/día durante 12 semanas, donde la exposición de estos pacientes a los metabolitos sería presumiblemente mucho mayor.
Estudios clínicos
Monoterapia
PROSCAR 5 mg/día se evaluó inicialmente en pacientes con síntomas de HPB y agrandamiento de la próstata mediante examen rectal digital en dos estudios doble ciego, aleatorizados, controlados con placebo de 1 año de duración y sus extensiones abiertas de 5 años.
PROSCAR 5 mg se evaluó más en el Estudio de eficacia y seguridad a largo plazo (PLESS) de PROSCAR, un estudio multicéntrico, doble ciego, aleatorizado, controlado con placebo, de 4 años. 3040 pacientes entre las edades de 45 y 78 años, con síntomas moderados a severos de BPH y una próstata agrandada en el examen rectal digital, fueron aleatorizados en el estudio (1524 a finasteride, 1516 a placebo) y 3016 pacientes fueron evaluables para eficacia. 1883 pacientes completaron el estudio de 4 años (1000 en el grupo de finasteride, 883 en el grupo de placebo).
Efecto sobre la puntuación de los síntomas
Los síntomas se cuantificaron utilizando una puntuación similar a la American Urological Association Symptom Score, que evaluó tanto los síntomas obstructivos (deterioro del tamaño y la fuerza del chorro, sensación de vaciado incompleto de la vejiga, micción retrasada o interrumpida) como los síntomas irritativos (nicturia, polaquiuria, necesidad de orinar). forzar o empujar el flujo de orina) calificando en una escala de 0 a 5 para seis síntomas y una escala de 0 a 4 para un síntoma, para una puntuación total posible de 34.
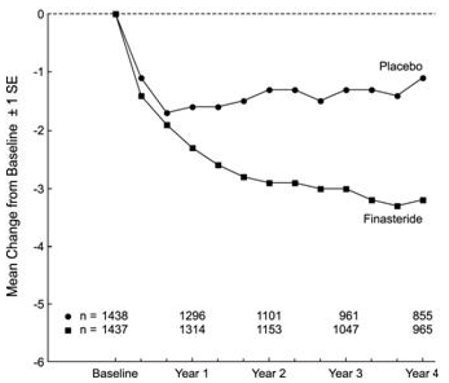
Los pacientes en PLESS tenían síntomas de moderados a graves al inicio del estudio (media de aproximadamente 15 puntos en una escala de 0 a 34 puntos). Los pacientes aleatorizados a PROSCAR que permanecieron en tratamiento durante 4 años tuvieron una disminución media (± 1 SD) en la puntuación de los síntomas de 3,3 (± 5,8) puntos en comparación con 1,3 (± 5,6) puntos en el grupo de placebo. (Consulte la Figura 1). Se evidenció una mejora estadísticamente significativa en la puntuación de los síntomas al año en pacientes tratados con PROSCAR frente a placebo (-2,3 frente a -1,6), y esta mejora continuó hasta el año 4.
Figura 1 Puntuación de síntomas en PLESS
Los resultados observados en estudios anteriores fueron comparables a los observados en PLESS. Aunque en algunos pacientes se observó una mejoría temprana de los síntomas urinarios, en general fue necesario un ensayo terapéutico de al menos 6 meses para evaluar si se había logrado una respuesta beneficiosa en el alivio de los síntomas. La mejoría en los síntomas de HPB se observó durante el primer año y se mantuvo durante 5 años adicionales de estudios abiertos de extensión.
Efecto sobre la retención urinaria aguda y la necesidad de cirugía
En PLESS, la eficacia también se evaluó evaluando los fracasos del tratamiento. El fracaso del tratamiento se definió prospectivamente como eventos urológicos relacionados con la HPB o deterioro clínico, falta de mejoría y/o necesidad de terapia alternativa. Los eventos urológicos relacionados con la HPB se definieron como intervención quirúrgica urológica y retención urinaria aguda que requería cateterismo. La información completa del evento estaba disponible para el 92% de los pacientes. La siguiente tabla (Tabla 5) resume los resultados.
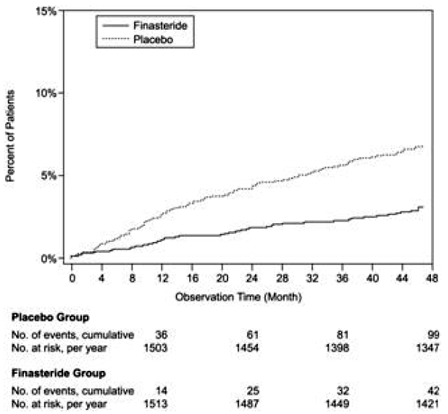
En comparación con el placebo, PROSCAR se asoció con un riesgo significativamente menor de retención urinaria aguda o la necesidad de cirugía relacionada con la HBP [13,2 % para el placebo frente al 6,6 % para PROSCAR; 51% de reducción del riesgo, IC del 95%: (34 a 63%)]. En comparación con el placebo, PROSCAR 5 mg se asoció con un riesgo significativamente menor de cirugía [10,1 % para placebo frente a 4,6 % para PROSCAR; reducción del riesgo del 55 %, IC del 95 %: (37 a 68 %)] y con un riesgo significativamente menor de retención urinaria aguda [6,6 % para placebo frente a 2,8 % para PROSCAR; reducción del riesgo del 57 %, IC del 95 %: (34 a 72 %)]; véanse las Figuras 2 y 3.
Figura 2 Porcentaje de pacientes que se sometieron a cirugía para la HBP, incluida la RTUP
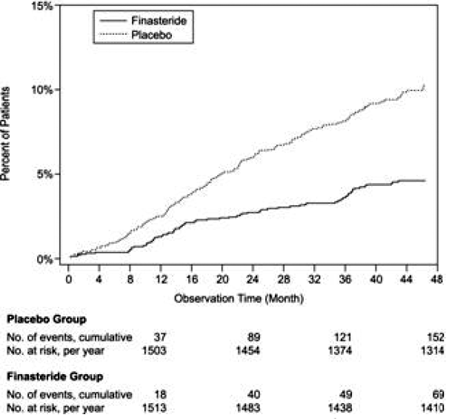
Figura 3 Porcentaje de pacientes que desarrollan retención urinaria aguda (espontánea y precipitada)
Efecto sobre el índice de flujo urinario máximo
En los pacientes en PLESS que permanecieron en terapia durante la duración del estudio y tenían datos de flujo urinario evaluables, PROSCAR 5 mg aumentó el flujo urinario máximo en 1,9 ml/s en comparación con 0,2 ml/s en el grupo de placebo.
Hubo una clara diferencia entre los grupos de tratamiento en el flujo urinario máximo a favor de PROSCAR 5 mg en el mes 4 (1,0 frente a 0,3 ml/seg), que se mantuvo durante todo el estudio. En los estudios anteriores de 1 año, el aumento en la tasa de flujo urinario máximo fue comparable a PLESS y se mantuvo durante el primer año y durante 5 años adicionales de estudios abiertos de extensión.
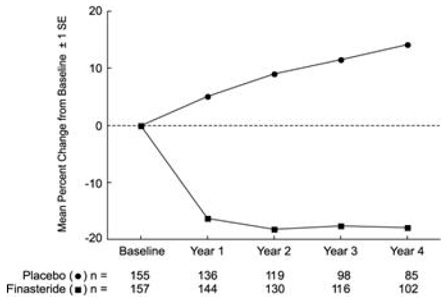
Efecto sobre el volumen de la próstata
En PLESS, el volumen de la próstata se evaluó anualmente mediante resonancia magnética nuclear (RMN) en un subconjunto de pacientes. En los pacientes tratados con PROSCAR 5 mg que continuaron con la terapia, el volumen de la próstata se redujo en comparación con el valor inicial y el placebo durante los 4 años del estudio. PROSCAR redujo el volumen de la próstata en un 17,9 % (de 55,9 cc al inicio a 45,8 cc a los 4 años) en comparación con un aumento del 14,1 % (de 51,3 cc a 58,5 cc) en el grupo de placebo (p
Los resultados observados en estudios anteriores fueron comparables a los observados en PLESS. El volumen prostático medio al inicio osciló entre 40 y 50 cc. La reducción en el volumen de la próstata se observó durante el primer año y se mantuvo a lo largo de cinco años adicionales de estudios abiertos de extensión.
Figura 4 Volumen prostático en PLESS
Volumen prostático como predictor de respuesta terapéutica
Un metanálisis que combinó datos de 1 año de siete estudios doble ciego controlados con placebo de diseño similar, que incluyeron 4491 pacientes con HPB sintomática, demostró que, en pacientes tratados con PROSCAR, la magnitud de la respuesta de los síntomas y el grado de mejora en la máxima la tasa de flujo urinario fue mayor en pacientes con agrandamiento de la próstata al inicio del estudio.
Combinación con terapia alfa-bloqueante
El ensayo de terapia médica de síntomas prostáticos (MTOPS) fue un estudio doble ciego, aleatorizado, controlado con placebo, multicéntrico, de 4 a 6 años (promedio de 5 años) en 3047 hombres con HBP sintomática, que fueron aleatorizados para recibir PROSCAR 5 mg/día (n=768), doxazosina 4 u 8 mg/día (n=756), la combinación de PROSCAR 5 mg/día y doxazosina 4 u 8 mg/día (n=786), o placebo (n=737 ). Todos los participantes se sometieron a una titulación semanal de doxazosina (o su placebo) de 1 a 2 a 4 a 8 mg/día. Solo aquellos que toleraron el nivel de dosis de 4 u 8 mg se mantuvieron con doxazosina (o su placebo) en el estudio. La dosis final tolerada del participante (ya sea 4 mg u 8 mg) se administró a partir del final de la Semana 4. La dosis final de doxazosina se administró una vez al día, a la hora de acostarse.
La edad media de los pacientes en el momento de la aleatorización fue de 62,6 años (±7,3 años). Los pacientes eran caucásicos (82 %), afroamericanos (9 %), hispanos (7 %), asiáticos (1 %) o nativos americanos (
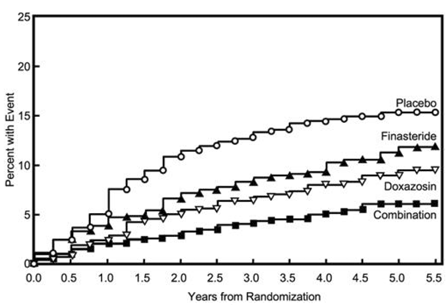
El criterio principal de valoración fue una medida compuesta de la primera aparición de cualquiera de los siguientes cinco resultados: un aumento confirmado de ≥4 puntos desde el inicio en la puntuación de los síntomas, retención urinaria aguda, insuficiencia renal relacionada con la HBP (aumento de la creatinina), infecciones recurrentes del tracto urinario o urosepsis o incontinencia. En comparación con el placebo, el tratamiento con PROSCAR 5 mg, doxazosina o la terapia combinada resultó en una reducción del riesgo de experimentar uno de estos cinco eventos de resultado en un 34 % (p = 0,002), 39 % (p
La mayoría de los eventos (274 de 351; 78 %) fue un aumento confirmado de ≥4 puntos en la puntuación de los síntomas, denominado progresión de la puntuación de los síntomas. El riesgo de progresión de la puntuación de los síntomas se redujo en un 30 % (p=0,016), 46 % (p
Figura 5 Incidencia acumulada de un aumento de 4 puntos en la puntuación de síntomas de la AUA por grupo de tratamiento
El tratamiento con PROSCAR 5 mg, doxazosina o la combinación de PROSCAR con doxazosina redujo la puntuación media de síntomas desde el inicio en el año 4. La Tabla 7 proporciona el cambio medio desde el inicio para la puntuación de síntomas AUA por grupo de tratamiento para pacientes que permanecieron en terapia durante cuatro años.
Los resultados de MTOPS son consistentes con los hallazgos del estudio PLESS de 4 años controlado con placebo [ver Monoterapia ] en que el tratamiento con PROSCAR reduce el riesgo de retención urinaria aguda y la necesidad de cirugía relacionada con la HPB. En MTOPS, el riesgo de desarrollar retención urinaria aguda se redujo en un 67 % en pacientes tratados con PROSCAR en comparación con pacientes tratados con placebo (0,8 % para PROSCAR y 2,4 % para placebo). Además, el riesgo de requerir terapia invasiva relacionada con la HPB se redujo en un 64 % en pacientes tratados con PROSCAR en comparación con pacientes tratados con placebo (2,0 % para PROSCAR 5 mg y 5,4 % para placebo).
Resumen de estudios clínicos
Los datos de estos estudios, que muestran una mejoría en los síntomas relacionados con la HPB, una reducción en el fracaso del tratamiento (eventos urológicos relacionados con la HPB), mayores tasas de flujo urinario máximo y una disminución del volumen de la próstata, sugieren que PROSCAR detiene el proceso de la enfermedad de la HPB en hombres con una agrandamiento de la próstata.
INFORMACIÓN DEL PACIENTE
No se proporcionó información. por favor refiérase a ADVERTENCIAS Y PRECAUCIONES sección.
