Seroquel 25mg, 50mg, 100mg, 200mg, 300mg Quetiapine Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Seroquel 100mg y cómo se usa?
Seroquel 50 mg es un medicamento recetado que se usa para tratar los síntomas de la esquizofrenia, el trastorno bipolar I, la manía; Trastorno Bipolar, Episodios Depresivos; Trastorno Bipolar I, Mantenimiento; y Trastorno Depresivo Mayor. Seroquel 50 mg puede usarse solo o con otros medicamentos.
Seroquel pertenece a una clase de medicamentos llamados Antipsicóticos, 2da Generación; Agentes antimaníacos.
No se sabe si Seroquel 200 mg es seguro y eficaz en niños menores de 12 años.
¿Cuáles son los posibles efectos secundarios de Seroquel 50mg?
Seroquel puede causar efectos secundarios graves que incluyen:
- movimientos musculares incontrolados en la cara (masticar, relamerse los labios, fruncir el ceño, mover la lengua, parpadear o mover los ojos),
- apariencia de la cara como una máscara,
- dificultad al tragar,
- problemas con el habla,
- aturdimiento,
- estreñimiento severo,
- micción dolorosa o difícil,
- visión borrosa,
- visión de túnel,
- dolor de ojo,
- viendo halos alrededor de las luces,
- músculos muy rígidos (rígidos),
- fiebre alta,
- transpiración,
- confusión,
- latidos cardíacos rápidos o irregulares,
- temblores,
- desmayo,
- aumento de la sed,
- aumento de la micción,
- boca seca,
- aliento con olor afrutado,
- fiebre,
- escalofríos,
- úlceras de boca,
- llagas en la piel,
- dolor de garganta,
- tos, y
- dificultad para respirar
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Seroquel incluyen:
- problemas del habla,
- mareo,
- somnolencia,
- cansancio,
- falta de energía,
- latidos rápidos del corazón,
- congestión nasal,
- Apetito incrementado,
- aumento de peso,
- dolor de barriga,
- vómitos,
- estreñimiento,
- boca seca, y
- prueba de función hepática anormal
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Seroquel. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
ADVERTENCIA
AUMENTO DE LA MORTALIDAD EN PACIENTES ANCIANOS CON PSICOSIS RELACIONADA CON DEMENCIA; y PENSAMIENTOS Y COMPORTAMIENTOS SUICIDAS
Aumento de la mortalidad en pacientes ancianos con psicosis relacionada con demencia
Los pacientes de edad avanzada con psicosis relacionada con la demencia tratados con medicamentos antipsicóticos tienen un mayor riesgo de muerte [ver ADVERTENCIAS Y PRECAUCIONES]. SEROQUEL no está aprobado para el tratamiento de pacientes con psicosis relacionada con demencia [ver ADVERTENCIAS Y PRECAUCIONES].
Pensamientos y comportamientos suicidas
Los antidepresivos aumentaron el riesgo de pensamientos y conductas suicidas en niños, adolescentes y adultos jóvenes en estudios a corto plazo. Estos estudios no mostraron un aumento en el riesgo de pensamientos y conductas suicidas con el uso de antidepresivos en pacientes mayores de 24 años; hubo una reducción en el riesgo con el uso de antidepresivos en pacientes de 65 años o más [ver ADVERTENCIAS Y PRECAUCIONES].
En pacientes de todas las edades que comienzan con la terapia antidepresiva, controle de cerca el empeoramiento y la aparición de pensamientos y comportamientos suicidas. Aconseje a las familias y cuidadores sobre la necesidad de una estrecha observación y comunicación con el prescriptor [ver ADVERTENCIAS Y PRECAUCIONES].
SEROQUEL 50 mg no está aprobado para uso en pacientes pediátricos menores de diez años [ver Uso en poblaciones específicas].
DESCRIPCIÓN
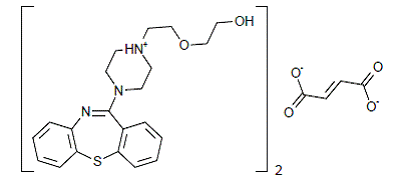
SEROQUEL® (fumarato de quetiapina) es un agente psicotrópico perteneciente a una clase química, los derivados de las dibenzotiazepinas. La designación química es 2-[2-(4-dibenzo [b,f] [1,4]tiazepin-11-il-1-piperazinil)etoxi]-etanol fumarato (2:1) (sal). Está presente en tabletas como la sal de fumarato. Todas las dosis y concentraciones de las tabletas se expresan como miligramos de base, no como sal de fumarato. Su fórmula molecular es C42H50N6O4S2•C4H4O4 y tiene un peso molecular de 883,11 (sal de fumarato). La fórmula estructural es:
El fumarato de quetiapina es un polvo cristalino de color blanco a blanquecino moderadamente soluble en agua.
SEROQUEL se suministra para administración oral en presentaciones de 25 mg (redondo, durazno), 50 mg (redondo, blanco), 100 mg (redondo, amarillo), 200 mg (redondo, blanco), 300 mg (en forma de cápsula, blanco) y Comprimidos de 400 mg (en forma de cápsula, amarillos).
Los ingredientes inactivos son povidona, fosfato dicálcico dibásico dihidrato, celulosa microcristalina, glicolato de almidón de sodio, lactosa monohidrato, estearato de magnesio, hipromelosa, polietilenglicol y dióxido de titanio.
Las tabletas de 25 mg contienen óxido férrico rojo y óxido férrico amarillo y las tabletas de 100 mg y 400 mg contienen solo óxido férrico amarillo.
INDICACIONES
Esquizofrenia
SEROQUEL XR está indicado para el tratamiento de la esquizofrenia. La eficacia de SEROQUEL XR en la esquizofrenia se estableció en un ensayo de 6 semanas y uno de mantenimiento en adultos con esquizofrenia. La eficacia fue respaldada por tres ensayos de 6 semanas en adultos con esquizofrenia y un ensayo de 6 semanas en adolescentes con esquizofrenia (13-17 años) tratados con SEROQUEL [ver Estudios clínicos ].
Trastorno bipolar
SEROQUEL 25mg XR está indicado para el tratamiento agudo de episodios maníacos o mixtos asociados con el trastorno bipolar I, tanto como monoterapia como adyuvante del litio o divalproex. La eficacia de SEROQUEL XR en episodios maníacos o mixtos del trastorno bipolar I se estableció en un ensayo de 3 semanas en adultos con episodios maníacos o mixtos asociados con el trastorno bipolar I. La eficacia fue respaldada por dos ensayos de monoterapia de 12 semanas y un ensayo adyuvante de 3 semanas en adultos con episodios maníacos asociados con el trastorno bipolar I, así como un ensayo de monoterapia de 3 semanas en niños y adolescentes (10 - 17 años) con episodios maníacos asociados. con trastorno bipolar I tratados con SEROQUEL [ver Estudios clínicos ].
SEROQUEL 100mg XR está indicado para el tratamiento agudo de episodios depresivos asociados con el trastorno bipolar. La eficacia de SEROQUEL XR se estableció en un ensayo de 8 semanas en adultos con trastorno bipolar I o II y está respaldada por dos ensayos de 8 semanas en adultos con trastorno bipolar I o II tratados con SEROQUEL [ver Estudios clínicos ].
SEROQUEL 100mg XR está indicado para el tratamiento de mantenimiento del trastorno bipolar I, como complemento del litio o divalproex. La eficacia se extrapoló de dos ensayos de mantenimiento en adultos con trastorno bipolar I tratados con SEROQUEL. La eficacia de la monoterapia para el tratamiento de mantenimiento del trastorno bipolar I no se ha evaluado sistemáticamente en ensayos clínicos controlados [ver Estudios clínicos ].
Tratamiento adyuvante del trastorno depresivo mayor (MDD)
SEROQUEL 100 mg XR está indicado para uso como terapia complementaria a los antidepresivos para el tratamiento de MDD. La eficacia de SEROQUEL XR como terapia complementaria a los antidepresivos en MDD se estableció en dos ensayos de 6 semanas en adultos con MDD que tuvieron una respuesta inadecuada al tratamiento antidepresivo [ver Estudios clínicos ].
Consideraciones especiales en el tratamiento de la esquizofrenia pediátrica y el trastorno bipolar I
La esquizofrenia pediátrica y el trastorno bipolar I son trastornos mentales graves, sin embargo, el diagnóstico puede ser un desafío. Para la esquizofrenia pediátrica, los perfiles de síntomas pueden ser variables, y para el trastorno bipolar I, los pacientes pueden tener patrones variables de periodicidad de síntomas maníacos o mixtos. Se recomienda que la terapia con medicamentos para la esquizofrenia pediátrica y el trastorno bipolar I se inicie solo después de que se haya realizado una evaluación diagnóstica exhaustiva y se hayan considerado detenidamente los riesgos asociados con el tratamiento con medicamentos. El tratamiento con medicamentos tanto para la esquizofrenia pediátrica como para el trastorno bipolar I está indicado como parte de un programa de tratamiento total que a menudo incluye intervenciones psicológicas, educativas y sociales.
DOSIFICACIÓN Y ADMINISTRACIÓN
Instrucciones de administración importantes
Las tabletas de SEROQUEL XR deben tragarse enteras y no partirse, masticarse ni triturarse.
Se recomienda tomar SEROQUEL 50 mg XR sin alimentos o con una comida ligera (aproximadamente 300 calorías) [ver FARMACOLOGÍA CLÍNICA ].
SEROQUEL 25mg XR debe administrarse una vez al día, preferiblemente por la noche.
Dosis recomendada
La dosis inicial recomendada, la titulación, el rango de dosis y la dosis máxima de SEROQUEL 50 mg XR para cada indicación aprobada se muestran en la Tabla 1 a continuación. Después de la dosificación inicial, se pueden hacer ajustes hacia arriba o hacia abajo, si es necesario, dependiendo de la respuesta clínica y la tolerabilidad del paciente [ver Estudios clínicos ].
Tratamiento de mantenimiento para la esquizofrenia y el trastorno bipolar I
Tratamiento de mantenimiento
Los pacientes deben ser reevaluados periódicamente para determinar la necesidad de un tratamiento de mantenimiento y la dosis adecuada para dicho tratamiento [ver Estudios clínicos ].
Modificaciones de dosis en pacientes de edad avanzada
Se debe considerar una tasa más lenta de titulación de la dosis y una dosis objetivo más baja en ancianos y en pacientes que están debilitados o que tienen una predisposición a las reacciones hipotensivas [ver Uso en poblaciones específicas , y FARMACOLOGÍA CLÍNICA ]. Cuando esté indicado, el aumento de la dosis debe realizarse con precaución en estos pacientes.
Los pacientes de edad avanzada deben comenzar con SEROQUEL XR 50 mg/día y la dosis se puede aumentar en incrementos de 50 mg/día según la respuesta clínica y la tolerabilidad del paciente individual.
Modificaciones de dosis en pacientes con insuficiencia hepática
Los pacientes con insuficiencia hepática deben comenzar con SEROQUEL XR 50 mg/día. La dosis se puede aumentar diariamente en incrementos de 50 mg/día hasta una dosis efectiva, dependiendo de la respuesta clínica y la tolerabilidad del paciente.
Modificaciones de dosis cuando se usa con inhibidores de CYP3A4
La dosis de SEROQUEL XR debe reducirse a una sexta parte de la dosis original cuando se co-medica con un inhibidor potente de CYP3A4 (p. ej., ketoconazol, itraconazol, indinavir, ritonavir, nefazodona, etc.). Cuando se suspende el inhibidor de CYP3A4, la dosis de SEROQUEL XR debe aumentarse 6 veces [ver FARMACOLOGÍA CLÍNICA y INTERACCIONES CON LA DROGAS ].
Modificaciones de dosis cuando se usa con inductores de CYP3A4
La dosis de SEROQUEL XR debe aumentarse hasta 5 veces la dosis original cuando se usa en combinación con un tratamiento crónico (p. ej., más de 7 a 14 días) de un inductor potente de CYP3A4 (p. ej., fenitoína, carbamazepina, rifampicina, avasimiba, St. (Hierba de San Juan, etc.). La dosis debe titularse en función de la respuesta clínica y la tolerancia del paciente individual. Cuando se suspende el inductor de CYP3A4, la dosis de SEROQUEL 100 mg XR debe reducirse al nivel original dentro de 7 a 14 días [ver FARMACOLOGÍA CLÍNICA y INTERACCIONES CON LA DROGAS ].
Reinicio del tratamiento en pacientes previamente interrumpidos
Aunque no hay datos para abordar específicamente el reinicio del tratamiento, se recomienda que cuando se reinicie la terapia de pacientes que han estado sin SEROQUEL 50 mg XR durante más de una semana, se debe seguir el programa de dosificación inicial. Cuando se reinicia el tratamiento con pacientes que han estado sin SEROQUEL 300 mg XR durante menos de una semana, es posible que no se requiera un aumento gradual de la dosis y se puede reiniciar la dosis de mantenimiento.
Cambio de pacientes de tabletas de SEROQUEL de 50 mg a tabletas de SEROQUEL de 100 mg XR
Los pacientes que actualmente están siendo tratados con SEROQUEL (formulación de liberación inmediata) pueden cambiar a SEROQUEL XR a la dosis diaria total equivalente tomada una vez al día. Pueden ser necesarios ajustes de dosis individuales.
Cambio de antipsicóticos
No hay datos recopilados sistemáticamente para abordar específicamente el cambio de pacientes de otros antipsicóticos a SEROQUEL 200 mg XR, o sobre la administración concomitante con otros antipsicóticos. Si bien la interrupción inmediata del tratamiento antipsicótico previo puede ser aceptable para algunos pacientes, la interrupción más gradual puede ser más apropiada para otros. En todos los casos, se debe minimizar el período de superposición de la administración de antipsicóticos. Cuando cambie a los pacientes de antipsicóticos de depósito, si es médicamente apropiado, inicie la terapia con SEROQUEL XR en lugar de la próxima inyección programada. La necesidad de continuar con la medicación existente para el síndrome extrapiramidal debe reevaluarse periódicamente.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
- Los comprimidos de liberación prolongada de 50 mg son de color melocotón, recubiertos con película, con forma de cápsula, biconvexos, tallados con “XR 50” en un lado y lisos en el otro lado.
- Los comprimidos de liberación prolongada de 150 mg son comprimidos blancos, recubiertos con película, en forma de cápsula, biconvexos, tallados con “XR 150” en un lado y lisos en el otro lado.
- Los comprimidos de liberación prolongada de 200 mg son comprimidos amarillos, recubiertos con película, en forma de cápsula, biconvexos, tallados con “XR 200” en un lado y lisos en el otro lado.
- Las tabletas de liberación prolongada de 300 mg son de color amarillo pálido, recubiertas con película, en forma de cápsula, biconvexas, talladas con “XR 300” en un lado y lisas en el otro lado.
- Los comprimidos de liberación prolongada de 400 mg son comprimidos blancos, recubiertos con película, en forma de cápsula, biconvexos, tallados con “XR 400” en un lado y lisos en el otro lado.
Almacenamiento y manipulación
Comprimidos de 50 mg ( CDN 0310-0280-60) melocotón, comprimidos recubiertos con película, en forma de cápsula, biconvexos, tallados con “XR 50” en una cara y lisos en la otra se suministran en frascos de 60 comprimidos.
Comprimidos de 150 mg ( CDN 0310-0281-60) comprimidos blancos, recubiertos con película, en forma de cápsula, biconvexos, tallados con “XR 150” en una cara y lisos en la otra, se suministran en frascos de 60 comprimidos.
Comprimidos de 200 mg ( CDN 0310-0282-60) comprimidos amarillos, recubiertos con película, en forma de cápsula, biconvexos, tallados con “XR 200” en una cara y lisos en la otra, se suministran en frascos de 60 comprimidos.
Comprimidos de 300 mg ( CDN 0310-0283-60) comprimidos tallados, biconvexos, recubiertos con película, de color amarillo pálido, con “XR 300” en una cara y lisos en la otra, se suministran en frascos de 60 comprimidos.
Comprimidos de 400 mg ( CDN 0310-0284-60) comprimidos blancos, recubiertos con película, en forma de cápsula, biconvexos, tallados con “XR 400” en una cara y lisos en la otra, se suministran en frascos de 60 comprimidos.
Guarde SEROQUEL XR a 25 °C (77 °F); excursiones permitidas a 15-30°C (59-86°F) [Ver USP ].
Distribuido por: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850. Revisado: marzo de 2020
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas se analizan con más detalle en otras secciones de la etiqueta:
- Aumento de la mortalidad en pacientes de edad avanzada con psicosis relacionada con demencia [ver ADVERTENCIAS Y PRECAUCIONES ]
- Pensamientos y conductas suicidas en adolescentes y adultos jóvenes [ver ADVERTENCIAS Y PRECAUCIONES ]
- Reacciones adversas cerebrovasculares, incluido accidente cerebrovascular en pacientes de edad avanzada con psicosis relacionada con demencia [ver ADVERTENCIAS Y PRECAUCIONES ]
- Síndrome neuroléptico maligno (SNM) [ver ADVERTENCIAS Y PRECAUCIONES ]
- Cambios metabólicos (hiperglucemia, dislipidemia, aumento de peso) [ver ADVERTENCIAS Y PRECAUCIONES ]
- Discinesia tardía [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hipotensión [ver ADVERTENCIAS Y PRECAUCIONES ]
- Caídas [ver ADVERTENCIAS Y PRECAUCIONES ]
- Aumentos de la presión arterial (niños y adolescentes) [ver ADVERTENCIAS Y PRECAUCIONES ]
- Leucopenia, neutropenia y agranulocitosis [ver ADVERTENCIAS Y PRECAUCIONES ]
- Cataratas [ver ADVERTENCIAS Y PRECAUCIONES ]
- Prolongación QT [ver ADVERTENCIAS Y PRECAUCIONES ]
- Convulsiones [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hipotiroidismo [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hiperprolactinemia [ver ADVERTENCIAS Y PRECAUCIONES ]
- Potencial de deterioro cognitivo y motor [ver ADVERTENCIAS Y PRECAUCIONES ]
- Regulación de la temperatura corporal [ver ADVERTENCIAS Y PRECAUCIONES ]
- Disfagia [ver ADVERTENCIAS Y PRECAUCIONES ]
- Síndrome de discontinuación [ver ADVERTENCIAS Y PRECAUCIONES ]
- Efectos anticolinérgicos (antimuscarínicos) [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en estudios clínicos
Debido a que los estudios clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los estudios clínicos de un fármaco no pueden compararse directamente con las tasas de los estudios clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Adultos
La siguiente información se deriva de una base de datos de ensayos clínicos para SEROQUEL 200 mg que consta de más de 4300 pacientes. Esta base de datos incluye 698 pacientes expuestos a SEROQUEL para el tratamiento de la depresión bipolar, 405 pacientes expuestos a SEROQUEL 200 mg para el tratamiento de la manía bipolar aguda (monoterapia y terapia adyuvante), 646 pacientes expuestos a SEROQUEL para el tratamiento de mantenimiento del trastorno bipolar I como adyuvante terapia, y aproximadamente 2600 pacientes y/o sujetos normales expuestos a 1 o más dosis de SEROQUEL 200mg para el tratamiento de la esquizofrenia.
De estos aproximadamente 4300 sujetos, aproximadamente 4000 (2300 en esquizofrenia, 405 en manía bipolar aguda, 698 en depresión bipolar y 646 para el tratamiento de mantenimiento del trastorno bipolar I) eran pacientes que participaron en ensayos de efectividad de dosis múltiples y su experiencia correspondía a aproximadamente 2400 pacientes-año. Las condiciones y la duración del tratamiento con SEROQUEL 200 mg variaron mucho e incluyeron (en categorías superpuestas) fases de estudios abiertos y doble ciego, pacientes hospitalizados y ambulatorios, estudios de dosis fija y de titulación de dosis, y estudios a corto o largo plazo. exposición. Las reacciones adversas se evaluaron mediante la recopilación de reacciones adversas, resultados de exámenes físicos, signos vitales, pesos, análisis de laboratorio, ECG y resultados de exámenes oftalmológicos.
Las frecuencias indicadas de reacciones adversas representan la proporción de personas que experimentaron, al menos una vez, una reacción adversa del tipo indicado.
Reacciones adversas asociadas con la interrupción del tratamiento en ensayos a corto plazo controlados con placebo
Esquizofrenia
En general, hubo poca diferencia en la incidencia de interrupción debido a reacciones adversas (4 % para SEROQUEL frente a 3 % para placebo) en un grupo de ensayos controlados. Sin embargo, las interrupciones debidas a somnolencia (0,8 % SEROQUEL 100 mg frente a 0 % placebo) e hipotensión (0,4 % SEROQUEL 200 mg frente a 0 % placebo) se consideraron relacionadas con el fármaco [ver ADVERTENCIAS Y PRECAUCIONES ].
Trastorno bipolar
Manía
En general, las interrupciones debido a reacciones adversas fueron del 5,7 % para SEROQUEL 25 mg frente al 5,1 % para placebo en monoterapia y del 3,6 % para SEROQUEL frente al 5,9 % para placebo en terapia adjunta.
Depresión
En general, las interrupciones debido a reacciones adversas fueron del 12,3 % para SEROQUEL 300 mg frente al 19,0 % para SEROQUEL 600 mg y el 5,2 % para placebo.
Reacciones adversas comúnmente observadas en ensayos controlados con placebo a corto plazo
En los ensayos de terapia aguda de esquizofrenia (hasta 6 semanas) y manía bipolar (hasta 12 semanas), las reacciones adversas observadas con mayor frecuencia asociadas con el uso de SEROQUEL en monoterapia (incidencia del 5 % o más) y observadas a una tasa de SEROQUEL al menos el doble que el placebo fueron somnolencia (18 %), mareos (11 %), boca seca (9 %), estreñimiento (8 %), aumento de ALT (5 %), aumento de peso (5 %) y dispepsia ( 5%).
Reacciones adversas que ocurren con una incidencia del 2 % o más entre los pacientes tratados con SEROQUEL en ensayos controlados con placebo a corto plazo
El prescriptor debe ser consciente de que las cifras de las tablas y tabulaciones no pueden utilizarse para predecir la incidencia de efectos secundarios en el curso de la práctica médica habitual cuando las características del paciente y otros factores difieren de los que prevalecieron en los ensayos clínicos. Del mismo modo, las frecuencias citadas no pueden compararse con cifras obtenidas de otras investigaciones clínicas que involucran diferentes tratamientos, usos e investigadores. Las cifras citadas, sin embargo, proporcionan al médico prescriptor alguna base para estimar la contribución relativa de los factores farmacológicos y no farmacológicos a la incidencia de efectos secundarios en la población estudiada.
La Tabla 9 enumera la incidencia, redondeada al porcentaje más cercano, de reacciones adversas que ocurrieron durante el tratamiento agudo de la esquizofrenia (hasta 6 semanas) y la manía bipolar (hasta 12 semanas) en el 2 % o más de los pacientes tratados con SEROQUEL (dosis que varían de 75 a 800 mg/día) donde la incidencia en pacientes tratados con SEROQUEL fue mayor que la incidencia en pacientes tratados con placebo.
En los estudios de terapia adyuvante aguda de la manía bipolar (hasta 3 semanas), las reacciones adversas más comúnmente observadas asociadas con el uso de SEROQUEL (incidencia del 5 % o más) y observadas a una tasa de SEROQUEL al menos dos veces mayor que la del placebo fueron somnolencia (34%), boca seca (19%), astenia (10%), estreñimiento (10%), dolor abdominal (7%), hipotensión postural (7%), faringitis (6%) y aumento de peso (6 %).
La Tabla 10 enumera la incidencia, redondeada al porcentaje más cercano, de reacciones adversas que ocurrieron durante el tratamiento (hasta 3 semanas) de manía aguda en el 2 % o más de los pacientes tratados con SEROQUEL (dosis que oscilan entre 100 y 800 mg/día) utilizados como terapia adjunta a litio y divalproex donde la incidencia en pacientes tratados con SEROQUEL fue mayor que la incidencia en pacientes tratados con placebo.
En estudios de depresión bipolar (hasta 8 semanas), las reacciones adversas más comúnmente observadas asociadas con el uso de SEROQUEL (incidencia del 5 % o mayor) y observadas a una tasa de SEROQUEL 200 mg al menos dos veces mayor que la del placebo fueron somnolencia (57 % ), sequedad de boca (44 %), mareos (18 %), estreñimiento (10 %) y letargo (5 %).
La Tabla 11 enumera la incidencia, redondeada al porcentaje más cercano, de las reacciones adversas que ocurrieron durante el tratamiento (hasta 8 semanas) de la depresión bipolar en el 2 % o más de los pacientes tratados con SEROQUEL (dosis de 300 y 600 mg/día) donde el la incidencia en pacientes tratados con SEROQUEL fue mayor que la incidencia en pacientes tratados con placebo.
Las exploraciones de las interacciones en función del sexo, la edad y la raza no revelaron diferencias clínicamente significativas en la aparición de reacciones adversas en función de estos factores demográficos.
Dependencia de la dosis de reacciones adversas en ensayos controlados con placebo a corto plazo
Reacciones adversas relacionadas con la dosis
Se exploraron los datos de reacciones adversas obtenidos espontáneamente de un estudio de esquizofrenia que comparó cinco dosis fijas de SEROQUEL (75 mg, 150 mg, 300 mg, 600 mg y 750 mg/día) con placebo para determinar la relación de las reacciones adversas con la dosis. Los análisis de regresión logística revelaron una dosis-respuesta positiva (p
Reacciones adversas en ensayos clínicos con quetiapina y no enumeradas en otra parte de la etiqueta:
También se han notificado las siguientes reacciones adversas con quetiapina: pesadillas, hipersensibilidad y elevaciones de la creatina fosfoquinasa sérica (no asociada con SNM), galactorrea, bradicardia (que puede ocurrir al inicio del tratamiento o cerca de él y estar asociada con hipotensión y/o síncope). ) plaquetas disminuidas, sonambulismo (y otros eventos relacionados), elevaciones en los niveles de gamma-GT, hipotermia, disnea, eosinofilia, retención urinaria, obstrucción intestinal y priapismo.
Síntomas extrapiramidales (EPS)
distonía
Efecto de clase
Los síntomas de distonía, contracciones anormales prolongadas de grupos musculares, pueden ocurrir en individuos susceptibles durante los primeros días de tratamiento. Los síntomas distónicos incluyen: espasmo de los músculos del cuello, que a veces progresa a opresión en la garganta, dificultad para tragar, dificultad para respirar y/o protrusión de la lengua. Si bien estos síntomas pueden ocurrir en dosis bajas, ocurren con mayor frecuencia y con mayor gravedad con alta potencia y en dosis más altas de fármacos antipsicóticos de primera generación. Se observa un riesgo elevado de distonía aguda en hombres y grupos de edad más jóvenes.
Se usaron cuatro métodos para medir el EPS: (1) puntaje total de Simpson-Angus (cambio medio desde el inicio) que evalúa el parkinsonismo y la acatisia, (2) puntaje de evaluación global de la escala de calificación de acatisia de Barnes (BARS), (3) incidencia de quejas espontáneas de SEP (acatisia, acinesia, rigidez en rueda dentada, síndrome extrapiramidal, hipertonía, hipocinesia, rigidez del cuello y temblor) y (4) uso de medicamentos anticolinérgicos para tratar el SEP.
Adultos
Los datos de un ensayo clínico de esquizofrenia de 6 semanas que comparó cinco dosis fijas de SEROQUEL (75, 150, 300, 600, 750 mg/día) proporcionaron evidencia de la falta de síntomas extrapiramidales (EPS) y la relación con la dosis para los EPS asociados con SEROQUEL Tratamiento de 100 mg. Se utilizaron tres métodos para medir los EPS: (1) puntuación total de Simpson-Angus (cambio medio desde el inicio) que evalúa el parkinsonismo y la acatisia, (2) la incidencia de síntomas espontáneos de EPS (acatisia, acinesia, rigidez en rueda dentada, síndrome extrapiramidal, hipertonía, hipocinesia, rigidez de nuca y temblor), y (3) uso de medicamentos anticolinérgicos para EPS.
En la Tabla 12, el evento distónico incluyó rigidez de nuca, hipertonía, distonía, rigidez muscular, oculogiración; el parkinsonismo incluía rigidez en rueda dentada, temblor, babeo, hipocinesia; la acatisia incluía acatisia, agitación psicomotora; el evento discinético incluyó discinesia tardía, discinesia, coreoatetosis; y otro evento extrapiramidal incluido inquietud, trastorno extrapiramidal, trastorno del movimiento.
Las tasas de incidencia de parkinsonismo medidas por la puntuación total de Simpson-Angus para el placebo y las cinco dosis fijas (75, 150, 300, 600, 750 mg/día) fueron: -0,6; -1,0, -1,2; -1,6; -1,8 y -1,8. La tasa de uso de medicamentos anticolinérgicos para tratar SEP con placebo y las cinco dosis fijas fue: 14 %; 11%; 10%; 8%; 12% y 11%.
En seis ensayos clínicos adicionales controlados con placebo (3 en manía aguda y 3 en esquizofrenia) que usaron dosis variables de SEROQUEL, no hubo diferencias entre los grupos de tratamiento con SEROQUEL y placebo en la incidencia de SEP, según lo evaluado por las puntuaciones totales de Simpson-Angus, quejas espontáneas de EPS y el uso concomitante de medicamentos anticolinérgicos para tratar EPS.
En dos ensayos clínicos controlados con placebo para el tratamiento de la depresión bipolar utilizando 300 mg y 600 mg de SEROQUEL 100 mg, la incidencia de reacciones adversas potencialmente relacionadas con los SEP fue del 12 % en ambos grupos de dosis y del 6 % en el grupo de placebo. En estos estudios, la incidencia de las reacciones adversas individuales (acatisia, trastorno extrapiramidal, temblor, discinesia, distonía, inquietud, contracciones musculares involuntarias, hiperactividad psicomotora y rigidez muscular) fue generalmente baja y no superó el 4 % en ningún grupo de tratamiento.
Los 3 grupos de tratamiento fueron similares en el cambio medio en la puntuación total de SAS y la puntuación de la Evaluación global de BARS al final del tratamiento. El uso concomitante de medicamentos anticolinérgicos fue poco frecuente y similar en los tres grupos de tratamiento.
Niños Y Adolescentes
La siguiente información se deriva de una base de datos de ensayos clínicos para SEROQUEL 200 mg que consta de más de 1000 pacientes pediátricos. Esta base de datos incluye 677 pacientes expuestos a SEROQUEL 200 mg para el tratamiento de la esquizofrenia y 393 niños y adolescentes (10-17 años) expuestos a SEROQUEL para el tratamiento de la manía bipolar aguda.
Reacciones adversas asociadas con la interrupción del tratamiento en ensayos a corto plazo controlados con placebo
Esquizofrenia
La incidencia de interrupción debido a reacciones adversas para los pacientes tratados con quetiapina y con placebo fue del 8,2 % y del 2,7 %, respectivamente. El evento adverso que condujo a la suspensión en el 1 % o más de los pacientes tratados con SEROQUEL y con una incidencia mayor que el placebo fue la somnolencia (2,7 % y 0 % para el placebo).
Bipolar I Manía
La incidencia de discontinuación debido a reacciones adversas para pacientes tratados con quetiapina y placebo fue 11,4% y 4,4%, respectivamente. Las reacciones adversas que dieron lugar a la suspensión en el 2 % o más de los pacientes tratados con SEROQUEL y con una incidencia mayor que el placebo fueron somnolencia (4,1 % frente a 1,1 %) y fatiga (2,1 % frente a 0).
Reacciones adversas comúnmente observadas en ensayos controlados con placebo a corto plazo
En el tratamiento de la esquizofrenia (hasta 6 semanas), las reacciones adversas más comúnmente observadas asociadas con el uso de quetiapina en adolescentes (incidencia del 5 % o mayor e incidencia de quetiapina al menos el doble que para el placebo) fueron somnolencia (34 %), mareos (12%), boca seca (7%), taquicardia (7%).
En la terapia de manía bipolar (hasta 3 semanas), las reacciones adversas más comúnmente observadas asociadas con el uso de quetiapina en niños y adolescentes (incidencia del 5 % o mayor e incidencia de quetiapina al menos el doble que para el placebo) fueron somnolencia (53 %), mareos (18%), fatiga (11%), aumento del apetito (9%), náuseas (8%), vómitos (8%), taquicardia (7%), boca seca (7%) y aumento de peso (6% ).
En un ensayo agudo (8 semanas) de SEROQUEL XR de 100 mg en niños y adolescentes (de 10 a 17 años) con depresión bipolar, en el que no se estableció la eficacia, las reacciones adversas más comúnmente observadas asociadas con el uso de SEROQUEL XR (incidencia del 5 % o más y al menos el doble que para el placebo) fueron mareos 7 %, diarrea 5 %, fatiga 5 % y náuseas 5 %.
Reacciones adversas que ocurrieron con una incidencia de ≥ 2 % entre pacientes tratados con SEROQUEL 300 mg en ensayos a corto plazo controlados con placebo
Esquizofrenia (adolescentes, 13-17 años)
Los siguientes hallazgos se basaron en un ensayo controlado con placebo de 6 semanas en el que se administró quetiapina en dosis de 400 u 800 mg/día.
La Tabla 13 enumera la incidencia, redondeada al porcentaje más cercano, de reacciones adversas que ocurrieron durante el tratamiento (hasta 6 semanas) de la esquizofrenia en el 2 % o más de los pacientes tratados con SEROQUEL (dosis de 400 u 800 mg/día) donde la incidencia en pacientes tratados con SEROQUEL fue al menos el doble de la incidencia en pacientes tratados con placebo.
Las reacciones adversas potencialmente relacionadas con la dosis con mayor frecuencia en el grupo de 800 mg en comparación con el grupo de 400 mg incluyeron mareos (8 % frente a 15 %), sequedad de boca (4 % frente a 10 %) y taquicardia (6 % frente a 10 %). .11%).
Bipolar I Mania (Niños Y Adolescentes 10-17 Años)
Los siguientes hallazgos se basaron en un ensayo controlado con placebo de 3 semanas en el que se administró quetiapina en dosis de 400 o 600 mg/día.
Reacciones adversas comúnmente observadas
En la terapia de manía bipolar (hasta 3 semanas), las reacciones adversas más comúnmente observadas asociadas con el uso de quetiapina en niños y adolescentes (incidencia del 5 % o mayor e incidencia de quetiapina al menos el doble que para el placebo) fueron somnolencia (53 %), mareos (18%), fatiga (11%), aumento del apetito (9%), náuseas (8%), vómitos (8%), taquicardia (7%), boca seca (7%) y aumento de peso (6% ).
La Tabla 14 enumera la incidencia, redondeada al porcentaje más cercano, de reacciones adversas que ocurrieron durante el tratamiento (hasta 3 semanas) de la manía bipolar en el 2 % o más de los pacientes tratados con SEROQUEL (dosis de 400 o 600 mg/día) donde el la incidencia en pacientes tratados con SEROQUEL fue mayor que la incidencia en pacientes tratados con placebo.
Las reacciones adversas que estuvieron potencialmente relacionadas con la dosis con mayor frecuencia en el grupo de 600 mg en comparación con el grupo de 400 mg incluyeron somnolencia (50 % frente a 57 %), náuseas (6 % frente a 10 %) y taquicardia (6 % frente a 10 %). 9%).
Síntomas extrapiramidales
En un ensayo de monoterapia a corto plazo controlado con placebo en pacientes adolescentes con esquizofrenia (duración de 6 semanas), la incidencia agregada de síntomas extrapiramidales fue del 12,9 % (19/147) para SEROQUEL 100 mg y del 5,3 % (4/75) para el placebo. aunque la incidencia de las reacciones adversas individuales (acatisia, temblor, trastorno extrapiramidal, hipocinesia, inquietud, hiperactividad psicomotora, rigidez muscular, discinesia) no superó el 4,1 % en ningún grupo de tratamiento. En un ensayo de monoterapia a corto plazo controlado con placebo en niños y adolescentes con manía bipolar (duración de 3 semanas), la incidencia agregada de síntomas extrapiramidales fue del 3,6 % (7/193) para SEROQUEL y del 1,1 % (1/90) para placebo.
La Tabla 15 presenta una lista de pacientes con reacciones adversas potencialmente asociadas con síntomas extrapiramidales en el ensayo de monoterapia a corto plazo controlado con placebo en pacientes adolescentes con esquizofrenia (duración de 6 semanas).
En los cuadros 15-16, el evento distónico incluyó rigidez de nuca, hipertonía y rigidez muscular; el parkinsonismo incluía rigidez en rueda dentada y temblor; la acatisia incluía solo la acatisia; el evento discinético incluyó discinesia tardía, discinesia y coreoatetosis; y otro evento extrapiramidal incluido inquietud y trastorno extrapiramidal.
La Tabla 16 presenta una lista de pacientes con reacciones adversas asociadas con síntomas extrapiramidales en un ensayo de monoterapia a corto plazo controlado con placebo en pacientes niños y adolescentes con manía bipolar (duración de 3 semanas).
Cambios de laboratorio, ECG y signos vitales observados en estudios clínicos
Cambios de laboratorio
Recuentos de neutrófilos
Adultos
En ensayos clínicos de monoterapia controlados con placebo que involucraron a 3368 pacientes con fumarato de quetiapina y 1515 con placebo, la incidencia de al menos una ocurrencia de recuento de neutrófilos ADVERTENCIAS Y PRECAUCIONES ].
Elevaciones de transaminasas
Adultos
Se han informado elevaciones asintomáticas, transitorias y reversibles de las transaminasas séricas (principalmente ALT). En ensayos de esquizofrenia en adultos, la proporción de pacientes con elevaciones de transaminasas > 3 veces los límites superiores del rango de referencia normal en un grupo de ensayos controlados con placebo de 3 a 6 semanas fue de aproximadamente 6 % (29/483) para SEROQUEL en comparación con el 1% (3/194) para el placebo. En ensayos de manía bipolar aguda en adultos, la proporción de pacientes con elevaciones de transaminasas > 3 veces los límites superiores del rango de referencia normal en un grupo de ensayos controlados con placebo de 3 a 12 semanas fue de aproximadamente 1 % para ambos SEROQUEL (3 /560) y placebo (3/294). Estas elevaciones de enzimas hepáticas por lo general ocurrieron dentro de las primeras 3 semanas de tratamiento farmacológico y regresaron rápidamente a los niveles previos al estudio con el tratamiento continuo con SEROQUEL. En ensayos de depresión bipolar, la proporción de pacientes con elevaciones de transaminasas de >3 veces los límites superiores del rango de referencia normal en dos ensayos controlados con placebo de 8 semanas fue del 1 % (5/698) para SEROQUEL 50 mg y del 2 % (6/ 347) para el placebo.
Disminución de la hemoglobina
Adultos
En ensayos a corto plazo controlados con placebo, se produjeron disminuciones en la hemoglobina a ≤13 g/dL en hombres, ≤12 g/dL en mujeres en al menos una ocasión en el 8,3 % (594/7155) de los pacientes tratados con quetiapina en comparación con el 6,2 % ( 219/3536) de pacientes tratados con placebo. En una base de datos de ensayos clínicos controlados y no controlados, se produjeron disminuciones de la hemoglobina a ≤13 g/dl en hombres y ≤12 g/dl en mujeres en al menos una ocasión en el 11 % (2277/20729) de los pacientes tratados con quetiapina.
Interferencia con las pruebas de detección de drogas en orina
Ha habido informes en la literatura que sugieren resultados falsos positivos en inmunoensayos enzimáticos en orina para metadona y antidepresivos tricíclicos en pacientes que han tomado quetiapina. Se debe tener precaución en la interpretación de resultados positivos de detección de drogas en orina para estos fármacos, y se debe considerar la confirmación mediante una técnica analítica alternativa (p. ej., métodos cromatográficos).
Cambios en el ECG
Adultos
Las comparaciones entre grupos para ensayos combinados controlados con placebo no revelaron diferencias estadísticamente significativas de SEROQUEL/placebo en las proporciones de pacientes que experimentaron cambios potencialmente importantes en los parámetros del ECG, incluidos los intervalos QT, QTc y PR. Sin embargo, las proporciones de pacientes que cumplieron con los criterios de taquicardia se compararon en cuatro ensayos clínicos controlados con placebo de 3 a 6 semanas para el tratamiento de la esquizofrenia que revelaron una incidencia del 1 % (4/399) para SEROQUEL 100 mg en comparación con el 0,6 % (1 /156) incidencia para placebo. En ensayos de manía bipolar aguda (monoterapia), la proporción de pacientes que cumplían los criterios de taquicardia fue del 0,5 % (1/192) para SEROQUEL 200 mg en comparación con la incidencia del 0 % (0/178) para el placebo. En los ensayos de manía bipolar aguda (adyuvante), la proporción de pacientes que cumplieron con los mismos criterios fue del 0,6 % (1/166) para SEROQUEL 100 mg en comparación con la incidencia del 0 % (0/171) para el placebo. En los ensayos de depresión bipolar, ningún paciente tuvo aumentos de la frecuencia cardíaca de más de 120 latidos por minuto. El uso de 50 mg de SEROQUEL se asoció con un aumento medio de la frecuencia cardíaca, evaluado por ECG, de 7 latidos por minuto en comparación con un aumento medio de 1 latido por minuto entre los pacientes que recibieron placebo. Esta ligera tendencia a la taquicardia en adultos puede estar relacionada con el potencial de SEROQUEL para inducir cambios ortostáticos [ver ADVERTENCIAS Y PRECAUCIONES ].
Niños y Adolescentes
En el ensayo de esquizofrenia aguda (6 semanas) en adolescentes, se produjeron aumentos de la frecuencia cardíaca (>110 lpm) en el 5,2 % (3/73) de los pacientes que recibieron SEROQUEL 400 mg y en el 8,5 % (5/74) de los pacientes que recibieron SEROQUEL 800 mg en comparación con el 0 % (0/75) de los pacientes que recibieron placebo. Los aumentos medios en la frecuencia cardíaca fueron de 3,8 lpm y 11,2 lpm para los grupos de 400 mg y 800 mg de SEROQUEL, respectivamente, en comparación con una disminución de 3,3 lpm en el grupo de placebo [ver ADVERTENCIAS Y PRECAUCIONES ].
En el ensayo de manía bipolar aguda (3 semanas) en niños y adolescentes, se produjeron aumentos en la frecuencia cardíaca (>110 lpm) en el 1,1 % (1/89) de los pacientes que recibieron SEROQUEL 400 mg y en el 4,7 % (4/85) de los pacientes recibieron SEROQUEL 600 mg en comparación con el 0 % (0/98) de los pacientes que recibieron placebo. Los aumentos medios en la frecuencia cardíaca fueron de 12,8 lpm y 13,4 lpm para los grupos de 400 mg y 600 mg de SEROQUEL, respectivamente, en comparación con una disminución de 1,7 lpm en el grupo de placebo [ver ADVERTENCIAS Y PRECAUCIONES ].
En un ensayo agudo (8 semanas) de SEROQUEL XR en niños y adolescentes (10-17 años) con depresión bipolar, en el que no se estableció la eficacia, los aumentos de la frecuencia cardíaca (>110 lpm 10-12 años y 13-17 años) ocurrió en el 0 % de los pacientes que recibieron SEROQUEL XR y en el 1,2 % de los pacientes que recibieron placebo. Los aumentos medios en la frecuencia cardíaca fueron de 3,4 lpm para SEROQUEL XR, en comparación con 0,3 lpm en el grupo de placebo [ver ADVERTENCIAS Y PRECAUCIONES ].
Experiencia posterior a la comercialización
Las siguientes reacciones adversas se identificaron durante la aprobación posterior de SEROQUEL. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Las reacciones adversas notificadas desde la introducción en el mercado que se relacionaron temporalmente con el tratamiento con quetiapina incluyen reacción anafiláctica, miocardiopatía, reacción al fármaco con eosinofilia y síntomas sistémicos (DRESS), hiponatremia, miocarditis, enuresis nocturna, pancreatitis, amnesia retrógrada, rabdomiolisis, síndrome de secreción inadecuada de hormona antidiurética (SIADH), síndrome de Stevens-Johnson (SJS), necrólisis epidérmica tóxica (NET), disminución del recuento de plaquetas, reacciones hepáticas graves (incluyendo hepatitis, necrosis hepática e insuficiencia hepática), agranulocitosis, obstrucción intestinal, íleo, isquemia de colon, retención urinaria , apnea del sueño y pustulosis exantemática generalizada aguda (PEAG).
INTERACCIONES CON LA DROGAS
Efecto de otras drogas sobre la quetiapina
Los riesgos de usar SEROQUEL en combinación con otros medicamentos no han sido evaluados extensamente en estudios sistemáticos. Dados los efectos primarios de SEROQUEL sobre el SNC, se debe tener precaución cuando se toma en combinación con otros medicamentos de acción central. SEROQUEL 300 mg potenció los efectos cognitivos y motores del alcohol en un ensayo clínico en sujetos con trastornos psicóticos seleccionados, y las bebidas alcohólicas deben limitarse mientras se toma quetiapina.
La exposición a quetiapina aumenta con los inhibidores prototipo de CYP3A4 (p. ej., ketoconazol, itraconazol, indinavir, ritonavir, nefazodona, etc.) y disminuye con los inductores prototipo de CYP3A4 (p. ej., fenitoína, carbamazepina, rifampicina, avasimiba, hierba de San Juan, etc.) . Será necesario ajustar la dosis de quetiapina si se administra junto con inductores o inhibidores potentes de CYP3A4.
Inhibidores de CYP3A4
La coadministración de ketoconazol, un potente inhibidor del citocromo CYP3A4, resultó en un aumento significativo de la exposición a quetiapina. La dosis de SEROQUEL 200 mg debe reducirse a una sexta parte de la dosis original si se administra junto con un inhibidor potente de CYP3A4 [ver DOSIFICACIÓN Y ADMINISTRACIÓN y FARMACOLOGÍA CLÍNICA ].
Inductores CYP3A4
La coadministración de quetiapina y fenitoína, un inductor de CYP3A4, aumentó 5 veces el aclaramiento oral medio de quetiapina. Puede ser necesario aumentar las dosis de SEROQUEL 50 mg hasta 5 veces para mantener el control de los síntomas de la esquizofrenia en pacientes que reciben quetiapina y fenitoína u otros inductores potentes conocidos de CYP3A4 [ver DOSIFICACIÓN Y ADMINISTRACIÓN y FARMACOLOGÍA CLÍNICA ]. Cuando se suspende el inductor de CYP3A4, la dosis de SEROQUEL 25 mg debe reducirse al nivel original dentro de 7 a 14 días [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Se estudiaron los efectos potenciales de varios medicamentos concomitantes sobre la farmacocinética de quetiapina [ver FARMACOLOGÍA CLÍNICA ].
Efecto de la quetiapina sobre otras drogas
Debido a su potencial para inducir hipotensión, SEROQUEL 50 mg puede potenciar los efectos de ciertos agentes antihipertensivos.
SEROQUEL 25 mg puede antagonizar los efectos de la levodopa y los agonistas de la dopamina.
No hay interacciones farmacocinéticas clínicamente relevantes de Seroquel con otros medicamentos basados en la vía CYP. Seroquel 50 mg y sus metabolitos no son inhibidores de los principales CYP metabolizadores (1A2, 2C9, 2C19, 2D6 y 3A4).
Abuso y dependencia de drogas
Sustancia controlada
SEROQUEL no es una sustancia controlada.
Abuso
SEROQUEL no ha sido estudiado sistemáticamente, en animales o humanos, por su potencial de abuso, tolerancia o dependencia física. Si bien los ensayos clínicos no revelaron ninguna tendencia a ningún comportamiento de búsqueda de fármacos, estas observaciones no fueron sistemáticas y, sobre la base de esta experiencia limitada, no es posible predecir hasta qué punto un fármaco activo sobre el SNC será mal utilizado, desviado, y/o abusado una vez comercializado. En consecuencia, los pacientes deben ser evaluados cuidadosamente en busca de antecedentes de abuso de drogas, y dichos pacientes deben ser observados de cerca en busca de signos de uso indebido o abuso de SEROQUEL, por ejemplo, desarrollo de tolerancia, aumentos en la dosis, comportamiento de búsqueda de drogas.
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Aumento de la mortalidad en pacientes ancianos con psicosis relacionada con demencia
Los pacientes de edad avanzada con psicosis relacionada con la demencia tratados con medicamentos antipsicóticos tienen un mayor riesgo de muerte. El análisis de 17 ensayos controlados con placebo (duración modal de 10 semanas), principalmente en pacientes que tomaban fármacos antipsicóticos atípicos, reveló un riesgo de muerte en pacientes tratados con fármacos de entre 1,6 y 1,7 veces el riesgo de muerte en pacientes tratados con placebo. En el transcurso de un ensayo controlado típico de 10 semanas, la tasa de muerte en los pacientes tratados con medicamentos fue de alrededor del 4,5 %, en comparación con una tasa de alrededor del 2,6 % en el grupo de placebo. Aunque las causas de muerte fueron variadas, la mayoría de las muertes parecían ser de naturaleza cardiovascular (p. ej., insuficiencia cardíaca, muerte súbita) o infecciosa (p. ej., neumonía). Los estudios observacionales sugieren que, al igual que con los fármacos antipsicóticos atípicos, el tratamiento con fármacos antipsicóticos convencionales puede aumentar la mortalidad. No está claro hasta qué punto los hallazgos de aumento de la mortalidad en los estudios observacionales pueden atribuirse al fármaco antipsicótico en contraposición a algunas características de los pacientes. SEROQUEL no está aprobado para el tratamiento de pacientes con psicosis relacionada con demencia [ver ADVERTENCIA EN CAJA ].
Pensamientos y comportamientos suicidas en adolescentes y adultos jóvenes
Los pacientes con trastorno depresivo mayor (MDD), tanto adultos como pediátricos, pueden experimentar un empeoramiento de su depresión y/o la aparición de ideación y comportamiento suicida (suicidalidad) o cambios inusuales en el comportamiento, estén o no tomando medicamentos antidepresivos, y esto el riesgo puede persistir hasta que ocurra una remisión significativa. El suicidio es un riesgo conocido de depresión y ciertos otros trastornos psiquiátricos, y estos trastornos en sí mismos son los predictores más fuertes de suicidio. Sin embargo, desde hace mucho tiempo existe la preocupación de que los antidepresivos puedan tener un papel en la inducción del empeoramiento de la depresión y la aparición de tendencias suicidas en ciertos pacientes durante las primeras fases del tratamiento. Los análisis combinados de ensayos controlados con placebo a corto plazo de medicamentos antidepresivos (ISRS y otros) mostraron que estos medicamentos aumentan el riesgo de pensamientos y conductas suicidas (tendencia suicida) en niños, adolescentes y adultos jóvenes (de 18 a 24 años) con depresión mayor. (TDM) y otros trastornos psiquiátricos. Los estudios a corto plazo no mostraron un aumento en el riesgo de tendencias suicidas con antidepresivos en comparación con placebo en adultos mayores de 24 años; hubo una reducción con los antidepresivos en comparación con el placebo en adultos de 65 años o más.
Los análisis agrupados de ensayos controlados con placebo en niños y adolescentes con TDM, trastorno obsesivo-compulsivo (TOC) u otros trastornos psiquiátricos incluyeron un total de 24 ensayos a corto plazo de 9 fármacos antidepresivos en más de 4400 pacientes. Los análisis agrupados de ensayos controlados con placebo en adultos con MDD u otros trastornos psiquiátricos incluyeron un total de 295 ensayos a corto plazo (duración media de 2 meses) de 11 fármacos antidepresivos en más de 77 000 pacientes. Hubo una variación considerable en el riesgo de suicidio entre los fármacos, pero una tendencia hacia un aumento en los pacientes más jóvenes para casi todos los fármacos estudiados. Hubo diferencias en el riesgo absoluto de suicidio entre las diferentes indicaciones, con la mayor incidencia en MDD. Sin embargo, las diferencias de riesgo (fármaco frente a placebo) fueron relativamente estables dentro de los estratos de edad y entre las indicaciones. Estas diferencias de riesgo (diferencia fármaco-placebo en el número de casos de tendencias suicidas por cada 1000 pacientes tratados) se proporcionan en la Tabla 2.
No se produjeron suicidios en ninguno de los ensayos pediátricos. Hubo suicidios en los ensayos con adultos, pero el número no fue suficiente para llegar a ninguna conclusión sobre el efecto del fármaco sobre el suicidio.
Se desconoce si el riesgo de suicidio se extiende al uso a largo plazo, es decir, más allá de varios meses. Sin embargo, existe evidencia sustancial de ensayos de mantenimiento controlados con placebo en adultos con depresión de que el uso de antidepresivos puede retrasar la recurrencia de la depresión.
Todos los pacientes que reciben tratamiento con antidepresivos por cualquier indicación deben ser monitoreados adecuadamente y observados de cerca por si empeoran clínicamente, tienen tendencias suicidas y cambios inusuales en el comportamiento, especialmente durante los meses iniciales de un ciclo de terapia con medicamentos, o en momentos de cambios de dosis, ya sea aumentos o disminuye.
Los siguientes síntomas, ansiedad, agitación, ataques de pánico, insomnio, irritabilidad, hostilidad, agresividad, impulsividad, acatisia (inquietud psicomotora), hipomanía y manía, se han informado en pacientes adultos y pediátricos que también reciben tratamiento con antidepresivos para el trastorno depresivo mayor como para otras indicaciones, tanto psiquiátricas como no psiquiátricas. Aunque no se ha establecido un vínculo causal entre la aparición de tales síntomas y el empeoramiento de la depresión y/o la aparición de impulsos suicidas, existe la preocupación de que tales síntomas puedan representar precursores de tendencias suicidas emergentes.
Se debe considerar cambiar el régimen terapéutico, incluida la posibilidad de suspender el medicamento, en pacientes cuya depresión empeora persistentemente, o que están experimentando tendencias suicidas emergentes o síntomas que podrían ser precursores de un empeoramiento de la depresión o tendencias suicidas, especialmente si estos síntomas son severos, abruptos. en el inicio, o no formaban parte de los síntomas de presentación del paciente.
Se debe alertar a las familias y cuidadores de pacientes en tratamiento con antidepresivos por trastorno depresivo mayor u otras indicaciones, tanto psiquiátricas como no psiquiátricas, sobre la necesidad de monitorear a los pacientes por la aparición de agitación, irritabilidad, cambios inusuales en el comportamiento y otros síntomas. descrito anteriormente, así como la aparición de tendencias suicidas, e informar dichos síntomas de inmediato a los proveedores de atención médica. Dicho seguimiento debe incluir la observación diaria por parte de las familias y los cuidadores. Las recetas de SEROQUEL deben hacerse para la cantidad más pequeña de comprimidos compatible con un buen manejo del paciente, a fin de reducir el riesgo de sobredosis.
Detección de pacientes para el trastorno bipolar
Un episodio depresivo mayor puede ser la presentación inicial del trastorno bipolar. En general, se cree (aunque no se ha establecido en ensayos controlados) que tratar un episodio de este tipo con un antidepresivo solo puede aumentar la probabilidad de precipitación de un episodio mixto/maníaco en pacientes con riesgo de trastorno bipolar. Se desconoce si alguno de los síntomas descritos anteriormente representa tal conversión. Sin embargo, antes de iniciar el tratamiento con un antidepresivo, incluido SEROQUEL, los pacientes con síntomas depresivos deben someterse a una evaluación adecuada para determinar si tienen riesgo de trastorno bipolar; dicha evaluación debe incluir un historial psiquiátrico detallado, incluidos antecedentes familiares de suicidio, trastorno bipolar y depresión.
Reacciones adversas cerebrovasculares, incluido el accidente cerebrovascular, en pacientes ancianos con psicosis relacionada con demencia
En ensayos controlados con placebo con risperidona, aripiprazol y olanzapina en sujetos de edad avanzada con demencia, hubo una mayor incidencia de reacciones adversas cerebrovasculares (accidentes cerebrovasculares y ataques isquémicos transitorios), incluidas muertes, en comparación con los sujetos tratados con placebo. SEROQUEL no está aprobado para el tratamiento de pacientes con psicosis relacionada con demencia [ver también ADVERTENCIA EN CAJA y Aumento de la mortalidad en pacientes ancianos con psicosis relacionada con demencia ].
Síndrome Neuroléptico Maligno (SNM)
Se ha informado un complejo de síntomas potencialmente fatales, a veces denominado Síndrome Neuroléptico Maligno (SNM), en asociación con la administración de fármacos antipsicóticos, incluido SEROQUEL. Se han informado casos raros de SNM con SEROQUEL. Las manifestaciones clínicas del SNM son hiperpirexia, rigidez muscular, estado mental alterado y evidencia de inestabilidad autonómica (pulso o presión arterial irregulares, taquicardia, diaforesis y arritmia cardíaca). Los signos adicionales pueden incluir creatinina fosfoquinasa elevada, mioglobinuria (rabdomiólisis) e insuficiencia renal aguda.
La evaluación diagnóstica de los pacientes con este síndrome es complicada. Al llegar a un diagnóstico, es importante excluir los casos en los que la presentación clínica incluye tanto una enfermedad médica grave (p. ej., neumonía, infección sistémica, etc.) como signos y síntomas extrapiramidales (EPS) no tratados o tratados inadecuadamente. Otras consideraciones importantes en el diagnóstico diferencial incluyen toxicidad anticolinérgica central, golpe de calor, fiebre por fármacos y patología primaria del sistema nervioso central (SNC).
El manejo del SNM debe incluir: 1) suspensión inmediata de los medicamentos antipsicóticos y otros medicamentos que no sean esenciales para la terapia concurrente; 2) tratamiento sintomático intensivo y seguimiento médico; y 3) tratamiento de cualquier problema médico grave concomitante para el cual haya tratamientos específicos disponibles. No existe un acuerdo general sobre los regímenes de tratamiento farmacológico específicos para el SNM.
Si un paciente requiere tratamiento con medicamentos antipsicóticos después de la recuperación del SNM, se debe considerar cuidadosamente la posible reintroducción de la terapia con medicamentos. El paciente debe ser monitoreado cuidadosamente ya que se han reportado recurrencias de SNM.
Cambios metabólicos
Los fármacos antipsicóticos atípicos se han asociado con cambios metabólicos que incluyen hiperglucemia/diabetes mellitus, dislipidemia y aumento de peso corporal. Si bien se ha demostrado que todos los medicamentos de la clase producen algunos cambios metabólicos, cada medicamento tiene su propio perfil de riesgo específico. En algunos pacientes, se observó en estudios clínicos un empeoramiento de más de uno de los parámetros metabólicos de peso, glucosa en sangre y lípidos. Los cambios en estos perfiles metabólicos deben manejarse según corresponda desde el punto de vista clínico.
Hiperglucemia y Diabetes Mellitus
Se ha notificado hiperglucemia, en algunos casos extrema y asociada con cetoacidosis o coma hiperosmolar o muerte, en pacientes tratados con antipsicóticos atípicos, incluida la quetiapina. La evaluación de la relación entre el uso de antipsicóticos atípicos y las anomalías de la glucosa se complica por la posibilidad de un mayor riesgo de diabetes mellitus en pacientes con esquizofrenia y la creciente incidencia de diabetes mellitus en la población general. Dados estos factores de confusión, la relación entre el uso de antipsicóticos atípicos y las reacciones adversas relacionadas con la hiperglucemia no se comprende por completo. Sin embargo, los estudios epidemiológicos sugieren un mayor riesgo de reacciones adversas relacionadas con la hiperglucemia en pacientes tratados con antipsicóticos atípicos. No se dispone de estimaciones precisas del riesgo de reacciones adversas relacionadas con la hiperglucemia en pacientes tratados con antipsicóticos atípicos.
Los pacientes con un diagnóstico establecido de diabetes mellitus que comienzan con antipsicóticos atípicos deben ser monitoreados regularmente para detectar un empeoramiento del control de la glucosa. Los pacientes con factores de riesgo de diabetes mellitus (p. ej., obesidad, antecedentes familiares de diabetes) que inician un tratamiento con antipsicóticos atípicos deben someterse a pruebas de glucosa en sangre en ayunas al comienzo del tratamiento y periódicamente durante el tratamiento. Cualquier paciente tratado con antipsicóticos atípicos debe ser monitoreado por síntomas de hiperglucemia que incluyen polidipsia, poliuria, polifagia y debilidad. Los pacientes que desarrollan síntomas de hiperglucemia durante el tratamiento con antipsicóticos atípicos deben someterse a pruebas de glucosa en sangre en ayunas. En algunos casos, la hiperglucemia se resolvió cuando se suspendió el antipsicótico atípico; sin embargo, algunos pacientes requirieron la continuación del tratamiento antidiabético a pesar de la interrupción del fármaco sospechoso.
Adultos
En un ensayo de 24 semanas (con control activo, 115 pacientes tratados con SEROQUEL) diseñado para evaluar el estado glucémico con pruebas de tolerancia oral a la glucosa de todos los pacientes, en la semana 24 la incidencia de un nivel de glucosa posterior a la provocación con glucosa ≥200 mg/dL fue 1,7% y la incidencia de un nivel de glucosa en sangre en ayunas ≥126 mg/dl fue de 2,6%. El cambio medio en la glucosa en ayunas desde el inicio fue de 3,2 mg/dL y el cambio medio en la glucosa a las 2 horas desde el inicio fue de -1,8 mg/dL para la quetiapina.
En 2 ensayos clínicos de abstinencia aleatorizados controlados con placebo a largo plazo para el mantenimiento del trastorno bipolar I, la exposición media de 213 días para SEROQUEL (646 pacientes) y 152 días para el placebo (680 pacientes), el cambio medio en la glucosa desde el inicio fue de +5,0 mg /dL para SEROQUEL 100 mg y –0.05 mg/dL para placebo. La tasa ajustada por exposición de cualquier aumento del nivel de glucosa en sangre (≥126 mg/dL) para los pacientes más de 8 horas después de una comida (sin embargo, es posible que a algunos pacientes no se les haya impedido la ingesta de calorías de los líquidos durante el período de ayuno) fue de 18,0 por 100 años-paciente para SEROQUEL (10,7% de los pacientes; n=556) y 9,5 para el placebo por 100 años-paciente (4,6% de los pacientes; n=581).
Niños y Adolescentes
En un estudio de monoterapia de 25 mg de SEROQUEL controlado con placebo de pacientes adolescentes (13-17 años de edad) con esquizofrenia (6 semanas de duración), el cambio medio en los niveles de glucosa en ayunas para SEROQUEL (n=138) en comparación con el placebo (n=67) fue de –0,75 mg/dl frente a –1,70 mg/dl. En un estudio de monoterapia de 300 mg de SEROQUEL controlado con placebo de pacientes niños y adolescentes (10-17 años de edad) con manía bipolar (3 semanas de duración), el cambio medio en el nivel de glucosa en ayunas para SEROQUEL (n=170) en comparación con el placebo (n =81) fue de 3,62 mg/dl frente a –1,17 mg/dl. Ningún paciente en ninguno de los estudios con un nivel inicial de glucosa en ayunas normal (
En un estudio de monoterapia con SEROQUEL XR controlado con placebo (8 semanas de duración) de pacientes niños y adolescentes (1017 años de edad) con depresión bipolar, en el que no se estableció la eficacia, el cambio medio en los niveles de glucosa en ayunas para SEROQUEL 300 mg XR (n= 60) en comparación con el placebo (n=62) fue de 1,8 mg/dl frente a 1,6 mg/dl. En este estudio, no hubo pacientes en los grupos tratados con SEROQUEL XR o con placebo con un nivel de glucosa en ayunas normal inicial (126 mg/dL. Hubo un paciente en el grupo de SEROQUEL 25 mg XR con un nivel de glucosa en ayunas en el límite inicial (>100 mg/dl y 126 mg/dl en comparación con cero pacientes en el grupo. grupo placebo.
dislipidemia
Adultos
La Tabla 4 muestra el porcentaje de pacientes adultos con cambios en el colesterol total, los triglicéridos, el colesterol LDL y el colesterol HDL desde el inicio por indicación en ensayos clínicos con SEROQUEL.
Niños y Adolescentes
La Tabla 5 muestra el porcentaje de niños y adolescentes con cambios en el colesterol total, los triglicéridos, el colesterol LDL y el colesterol HDL desde el inicio en los ensayos clínicos con SEROQUEL.
En un estudio de monoterapia de SEROQUEL XR controlado con placebo (8 semanas de duración) de niños y adolescentes (1017 años de edad) con depresión bipolar, en el que no se estableció la eficacia, el porcentaje de niños y adolescentes con cambios en el colesterol total (≥200 mg/dL), triglicéridos (≥150 mg/dL), colesterol LDL (≥ 130 mg/dL) y colesterol HDL (≤40 mg/dL) desde el inicio hasta los niveles clínicamente significativos fueron: colesterol total 8% (7 /83) para SEROQUEL 50mg XR vs. 6% (5/84) para placebo; triglicéridos 28 % (22/80) para SEROQUEL 100 mg XR frente a 9 % (7/82) para placebo; Colesterol LDL 2 % (2/86) para SEROQUEL XR frente a 4 % (3/85) para placebo y colesterol HDL 20 % (13/65) para SEROQUEL XR frente a 15 % (11/74) para placebo.
Aumento de peso
Se han observado aumentos de peso en ensayos clínicos. Los pacientes que reciben quetiapina deben someterse a un control regular del peso.
Adultos
En ensayos clínicos con SEROQUEL 50mg se han reportado los siguientes aumentos de peso.
Niños y Adolescentes
En dos ensayos clínicos con SEROQUEL 25 mg, uno en manía bipolar y otro en esquizofrenia, los aumentos de peso informados se incluyen en la Tabla 7.
El cambio medio en el peso corporal en el ensayo de esquizofrenia fue de 2,0 kg en el grupo de SEROQUEL de 25 mg y de -0,4 kg en el grupo de placebo y en el ensayo de manía bipolar, fue de 1,7 kg en el grupo de SEROQUEL de 200 mg y de 0,4 kg en el grupo de placebo.
En un estudio abierto que inscribió a pacientes de los dos ensayos pediátricos anteriores, el 63 % de los pacientes (241/380) completaron 26 semanas de tratamiento con SEROQUEL. Después de 26 semanas de tratamiento, el aumento medio del peso corporal fue de 4,4 kg. Cuarenta y cinco por ciento de los pacientes ganaron ≥7% de su peso corporal, sin ajustar por crecimiento normal. Para ajustar el crecimiento normal durante 26 semanas, se utilizó un aumento de al menos 0,5 desviaciones estándar del valor inicial en el IMC como medida de un cambio clínicamente significativo; El 18,3% de los pacientes con SEROQUEL cumplieron con este criterio después de 26 semanas de tratamiento.
En un ensayo clínico de SEROQUEL XR en niños y adolescentes (10-17 años) con depresión bipolar, en el que no se estableció la eficacia, el porcentaje de pacientes con aumento de peso ≥7% del peso corporal en algún momento fue del 15% ( 14/92) para SEROQUEL 25 mg XR vs. 10 % (10/100) para placebo. El cambio medio en el peso corporal fue de 1,4 kg en el grupo de SEROQUEL 50 mg XR frente a 0,6 kg en el grupo de placebo.
Cuando se trate a pacientes pediátricos con SEROQUEL 50 mg por cualquier indicación, se debe evaluar el aumento de peso frente al esperado para un crecimiento normal.
Discinesia tardía
Se puede desarrollar un síndrome de movimientos discinéticos involuntarios, potencialmente irreversibles, en pacientes tratados con fármacos antipsicóticos, incluida la quetiapina. Aunque la prevalencia del síndrome parece ser mayor entre los ancianos, especialmente en las mujeres de edad avanzada, es imposible confiar en las estimaciones de prevalencia para predecir, al inicio del tratamiento antipsicótico, qué pacientes tienen probabilidades de desarrollar el síndrome. Se desconoce si los medicamentos antipsicóticos difieren en su potencial para causar discinesia tardía.
Se cree que el riesgo de desarrollar discinesia tardía y la probabilidad de que se vuelva irreversible aumentan a medida que aumenta la duración del tratamiento y la dosis total acumulada de fármacos antipsicóticos administrados al paciente. Sin embargo, el síndrome puede desarrollarse, aunque con mucha menos frecuencia, después de períodos de tratamiento relativamente breves a dosis bajas o incluso puede surgir después de la interrupción del tratamiento.
La discinesia tardía puede remitir, parcial o completamente, si se suspende el tratamiento antipsicótico. Sin embargo, el tratamiento antipsicótico en sí mismo puede suprimir (o suprimir parcialmente) los signos y síntomas del síndrome y, por lo tanto, es posible que enmascare el proceso subyacente. Se desconoce el efecto que tiene la supresión sintomática sobre el curso a largo plazo del síndrome.
Teniendo en cuenta estas consideraciones, SEROQUEL 50 mg debe recetarse de la manera que sea más probable que minimice la aparición de discinesia tardía. El tratamiento antipsicótico crónico generalmente debe reservarse para pacientes que parecen sufrir una enfermedad crónica que (1) se sabe que responde a los medicamentos antipsicóticos y (2) para quienes tratamientos alternativos, igualmente efectivos, pero potencialmente menos dañinos no están disponibles o no son apropiados . En pacientes que sí requieren tratamiento crónico, se debe buscar la menor dosis y la menor duración del tratamiento que produzca una respuesta clínica satisfactoria. La necesidad de continuar el tratamiento debe reevaluarse periódicamente.

Si aparecen signos y síntomas de discinesia tardía en un paciente que recibe SEROQUEL 200 mg, se debe considerar la suspensión del fármaco. Sin embargo, algunos pacientes pueden requerir tratamiento con SEROQUEL 200 mg a pesar de la presencia del síndrome.
Hipotensión
La quetiapina puede inducir hipotensión ortostática asociada con mareos, taquicardia y, en algunos pacientes, síncope, especialmente durante el período inicial de titulación de la dosis, lo que probablemente refleja sus propiedades antagonistas adrenérgicas α1. Se notificó síncope en el 1 % (28/3265) de los pacientes tratados con SEROQUEL, en comparación con el 0,2 % (2/954) con placebo y aproximadamente el 0,4 % (2/527) con fármacos de control activo. La hipotensión ortostática, los mareos y el síncope pueden provocar caídas.
SEROQUEL 25 mg debe usarse con especial precaución en pacientes con enfermedad cardiovascular conocida (antecedentes de infarto de miocardio o cardiopatía isquémica, insuficiencia cardíaca o anomalías de la conducción), enfermedad cerebrovascular o condiciones que puedan predisponer a los pacientes a la hipotensión (deshidratación, hipovolemia y tratamiento con medicamentos antihipertensivos). El riesgo de hipotensión ortostática y síncope puede minimizarse limitando la dosis inicial a 25 mg dos veces al día [ver DOSIFICACIÓN Y ADMINISTRACIÓN ]. Si ocurre hipotensión durante la titulación a la dosis objetivo, es apropiado volver a la dosis anterior en el programa de titulación.
Caídas
Los fármacos antipsicóticos atípicos, incluido SEROQUEL, pueden causar somnolencia, hipotensión postural, inestabilidad motora y sensorial, lo que puede provocar caídas y, en consecuencia, fracturas u otras lesiones. Para los pacientes con enfermedades, afecciones o medicamentos que podrían exacerbar estos efectos, complete las evaluaciones de riesgo de caídas al iniciar el tratamiento antipsicótico y de manera recurrente para los pacientes que reciben terapia antipsicótica a largo plazo.
Aumentos De La Presión Arterial (Niños Y Adolescentes)
En ensayos controlados con placebo en niños y adolescentes con esquizofrenia (6 semanas de duración) o manía bipolar (3 semanas de duración), la incidencia de aumentos en cualquier momento de la presión arterial sistólica (≥20 mmHg) fue del 15,2 % (51/335 ) para SEROQUEL 50mg y 5,5% (9/163) para placebo; la incidencia de aumentos en cualquier momento de la presión arterial diastólica (≥10 mmHg) fue del 40,6 % (136/335) para SEROQUEL y del 24,5 % (40/163) para el placebo. En el ensayo clínico abierto de 26 semanas, un niño con antecedentes informados de hipertensión experimentó una crisis hipertensiva. Se debe medir la presión arterial en niños y adolescentes al comienzo y periódicamente durante el tratamiento.
En un ensayo clínico de SEROQUEL XR controlado con placebo (8 semanas de duración) en niños y adolescentes (10-17 años) con depresión bipolar, en el que no se estableció la eficacia, la incidencia de aumentos en cualquier momento de la presión arterial sistólica (≥ 20 mmHg) fue del 6,5 % (6/92) para SEROQUEL XR y del 6,0 % (6/100) para el placebo; la incidencia de aumentos en cualquier momento de la presión arterial diastólica (≥10 mmHg) fue del 46,7 % (43/92) para SEROQUEL 25 mg XR y del 36,0 % (36/100) para el placebo.
Leucopenia, neutropenia y agranulocitosis
En ensayos clínicos y experiencia posterior a la comercialización, se informaron eventos de leucopenia/neutropenia temporalmente relacionados con agentes antipsicóticos atípicos, incluido SEROQUEL. Se ha informado agranulocitosis.
Se ha notificado agranulocitosis (definida como un recuento absoluto de neutrófilos
Los posibles factores de riesgo de leucopenia/neutropenia incluyen un recuento bajo de glóbulos blancos (WBC) preexistente y antecedentes de leucopenia/neutropenia inducida por fármacos. Los pacientes con un WBC bajo preexistente o un historial de leucopenia/neutropenia inducida por medicamentos deben controlar su conteo sanguíneo completo (CBC) con frecuencia durante los primeros meses de terapia y deben suspender SEROQUEL 50 mg al primer signo de una disminución en WBC en ausencia de otros factores causales.
Los pacientes con neutropenia deben ser monitoreados cuidadosamente en busca de fiebre u otros síntomas o signos de infección y tratados de inmediato si se presentan tales síntomas o signos. Los pacientes con neutropenia grave (recuento absoluto de neutrófilos
cataratas
Se observó el desarrollo de cataratas en asociación con el tratamiento con quetiapina en estudios crónicos con perros [ver Toxicología no clínica ]. También se han observado cambios en el cristalino en adultos, niños y adolescentes durante el tratamiento a largo plazo con SEROQUEL 100 mg, pero no se ha establecido una relación causal con el uso de SEROQUEL 200 mg. Sin embargo, la posibilidad de cambios lenticulares no se puede excluir en este momento. Por lo tanto, se recomienda el examen del cristalino mediante métodos adecuados para detectar la formación de cataratas, como el examen con lámpara de hendidura u otros métodos adecuadamente sensibles, al inicio del tratamiento o poco después, y a intervalos de 6 meses durante el tratamiento crónico.
Prolongación QT
En los ensayos clínicos, la quetiapina no se asoció con un aumento persistente de los intervalos QT. Sin embargo, el efecto QT no se evaluó sistemáticamente en un estudio exhaustivo de QT. En la experiencia posterior a la comercialización, se informaron casos de prolongación del intervalo QT en pacientes que tomaron una sobredosis de quetiapina [ver SOBREDOSIS ], en pacientes con enfermedades concomitantes y en pacientes que toman medicamentos que se sabe que causan desequilibrio electrolítico o aumentan el intervalo QT [ver INTERACCIONES CON LA DROGAS ].
Debe evitarse el uso de quetiapina en combinación con otros fármacos que prolongan el intervalo QTc, incluidos los antiarrítmicos de clase 1A (p. ej., quinidina, procainamida) o antiarrítmicos de clase III (p. ej., amiodarona, sotalol), medicamentos antipsicóticos (p. ej., ziprasidona, clorpromazina, tioridazina), antibióticos (p. ej., gatifloxacina, moxifloxacina) o cualquier otra clase de medicamentos que prolonguen el intervalo QTc (p. ej., pentamidina, acetato de levometadilo, metadona).
La quetiapina también debe evitarse en circunstancias que puedan aumentar el riesgo de aparición de torsade de pointes y/o muerte súbita, incluidos (1) antecedentes de arritmias cardíacas como bradicardia; (2) hipopotasemia o hipomagnesemia; (3) uso concomitante de otros fármacos que prolonguen el intervalo QTc; y (4) presencia de prolongación congénita del intervalo QT.
También se debe tener precaución cuando se prescribe quetiapina a pacientes con mayor riesgo de prolongación del intervalo QT (p. ej., enfermedad cardiovascular, antecedentes familiares de prolongación del intervalo QT, ancianos, insuficiencia cardíaca congestiva e hipertrofia cardíaca).
convulsiones
Durante los ensayos clínicos, se produjeron convulsiones en el 0,5 % (20/3490) de los pacientes tratados con SEROQUEL en comparación con el 0,2 % (2/954) con placebo y el 0,7 % (4/527) con fármacos de control activo. Al igual que con otros antipsicóticos, SEROQUEL 25 mg debe usarse con precaución en pacientes con antecedentes de convulsiones o con afecciones que potencialmente reduzcan el umbral convulsivo, por ejemplo, demencia de Alzheimer. Las condiciones que reducen el umbral de convulsiones pueden ser más frecuentes en una población de 65 años o más.
hipotiroidismo
Adultos
Los ensayos clínicos con quetiapina demostraron disminuciones relacionadas con la dosis en los niveles de hormona tiroidea. La reducción de la tiroxina total y libre (T4) de aproximadamente un 20 % en el extremo superior del rango de dosis terapéuticas fue máxima en las primeras seis semanas de tratamiento y se mantuvo sin adaptación ni progresión durante la terapia más crónica. En casi todos los casos, la interrupción del tratamiento con quetiapina se asoció con una reversión de los efectos sobre la T4 total y libre, independientemente de la duración del tratamiento. El mecanismo por el cual la quetiapina afecta el eje tiroideo no está claro. Si hay un efecto sobre el eje hipotálamo-pituitario, la medición de TSH por sí sola puede no reflejar con precisión el estado de la tiroides de un paciente. Por lo tanto, tanto la TSH como la T4 libre, además de la evaluación clínica, deben medirse al inicio y en el seguimiento.
En los estudios complementarios de manía, donde SEROQUEL 50 mg se agregó a litio o divalproato, el 12 % (24/196) de los pacientes tratados con SEROQUEL 200 mg en comparación con el 7 % (15/203) de los pacientes tratados con placebo tenían niveles elevados de TSH. De los pacientes tratados con SEROQUEL 300 mg con niveles elevados de TSH, 3 tenían simultáneamente niveles bajos de T4 libre (T4 libre
Aproximadamente el 0,7% (26/3489) de los pacientes con SEROQUEL experimentaron aumentos de TSH en los estudios de monoterapia. Algunos pacientes con aumentos de TSH necesitaron tratamiento de reemplazo de tiroides.
En todos los ensayos de quetiapina, la incidencia de cambios en las hormonas tiroideas y TSH fue1: disminución de T4 libre (5mIU/L), 4,9% (956/19412). En ocho pacientes, en los que se midió TBG, los niveles de TBG no cambiaron.
La Tabla 8 muestra la incidencia de estos cambios en ensayos clínicos controlados con placebo a corto plazo.
En ensayos de monoterapia a corto plazo controlados con placebo, la incidencia de cambios recíprocos en T3 y TSH fue del 0,0 % tanto para quetiapina (1/4800) como para placebo (0/2190) y para T4 y TSH los cambios fueron del 0,1 % (7 /6154) para quetiapina versus 0,0% (1/3007) para placebo.
Niños Y Adolescentes
En ensayos agudos controlados con placebo en pacientes niños y adolescentes con esquizofrenia (duración de 6 semanas) o manía bipolar (duración de 3 semanas), la incidencia de cambios en los valores de la función tiroidea en cualquier momento para pacientes tratados con SEROQUEL 100 mg y pacientes tratados con placebo la TSH elevada fue del 2,9 % (8/280) frente al 0,7 % (1/138), respectivamente, y la tiroxina total disminuida fue del 2,8 % (8/289) frente al 0 % (0/145), respectivamente. De los pacientes tratados con SEROQUEL con niveles elevados de TSH, 1 tenía simultáneamente un nivel bajo de T4 libre al final del tratamiento.
Hiperprolactinemia
Adultos
Durante los ensayos clínicos con quetiapina, la incidencia de cambios en los niveles de prolactina a un valor clínicamente significativo se produjo en el 3,6 % (158/4416) de los pacientes tratados con quetiapina en comparación con el 2,6 % (51/1968) con placebo.
Niños Y Adolescentes
En ensayos agudos controlados con placebo en niños y adolescentes con manía bipolar (duración de 3 semanas) o esquizofrenia (duración de 6 semanas), la incidencia de cambios en los niveles de prolactina a un valor (>20 μg/L hombres; >26 μg /L mujeres en cualquier momento) fue 13,4 % (18/134) para SEROQUEL en comparación con 4 % (3/75) para placebo en hombres y 8,7 % (9/104) para SEROQUEL 25 mg en comparación con 0 % (0/39) para placebo en mujeres.
Al igual que otros medicamentos que antagonizan los receptores de dopamina D2, SEROQUEL 300 mg eleva los niveles de prolactina en algunos pacientes y la elevación puede persistir durante la administración crónica. La hiperprolactinemia, independientemente de la etiología, puede suprimir la GnRH hipotalámica, lo que reduce la secreción hipofisaria de gonadotropina. Esto, a su vez, puede inhibir la función reproductiva al alterar la esteroidogénesis gonadal tanto en pacientes femeninos como masculinos. Se han informado casos de galactorrea, amenorrea, ginecomastia e impotencia en pacientes que reciben compuestos que elevan la prolactina. La hiperprolactinemia prolongada, cuando se asocia con hipogonadismo, puede conducir a una disminución de la densidad ósea tanto en mujeres como en hombres.
Los experimentos de cultivo de tejidos indican que aproximadamente un tercio de los cánceres de mama humanos son dependientes de la prolactina in vitro, un factor de importancia potencial si se considera la prescripción de estos fármacos en un paciente con cáncer de mama detectado previamente. Como es común con los compuestos que aumentan la liberación de prolactina, se observó neoplasia de las células de los islotes pancreáticos y de las glándulas mamarias (adenocarcinomas mamarios, pituitarios y adenomas pancreáticos) en estudios de carcinogenicidad realizados en ratones y ratas. Ni los estudios clínicos ni los estudios epidemiológicos realizados hasta la fecha han demostrado una asociación entre la administración crónica de esta clase de fármacos y la tumorigénesis en humanos, pero la evidencia disponible es demasiado limitada para ser concluyente [ver Toxicología no clínica ].
Potencial de deterioro cognitivo y motor
La somnolencia fue un evento adverso informado con frecuencia en pacientes tratados con SEROQUEL, especialmente durante el período de 3 a 5 días del ajuste inicial de la dosis. En los ensayos de esquizofrenia, se notificó somnolencia en el 18 % (89/510) de los pacientes que recibieron SEROQUEL 200 mg en comparación con el 11 % (22/206) de los pacientes que recibieron placebo. En ensayos de manía bipolar aguda que usaron SEROQUEL 200 mg como monoterapia, se informó somnolencia en el 16 % (34/209) de los pacientes que recibieron SEROQUEL 300 mg en comparación con el 4 % de los pacientes que recibieron placebo. En los ensayos de manía bipolar aguda que utilizaron SEROQUEL como terapia adjunta, se informó somnolencia en el 34 % (66/196) de los pacientes que recibieron SEROQUEL en comparación con el 9 % (19/203) de los pacientes que recibieron placebo. En los ensayos de depresión bipolar, se notificó somnolencia en el 57 % (398/698) de los pacientes que recibieron SEROQUEL 50 mg en comparación con el 15 % (51/347) de los pacientes que recibieron placebo. Dado que SEROQUEL 25 mg tiene el potencial de afectar el juicio, el pensamiento o las habilidades motoras, se debe advertir a los pacientes sobre la realización de actividades que requieran alerta mental, como operar un vehículo motorizado (incluidos los automóviles) o manejar maquinaria peligrosa hasta que estén razonablemente seguros de que la terapia con SEROQUEL funciona. no afectarlos negativamente. La somnolencia puede provocar caídas.
Regulación de la temperatura corporal
Aunque no se informó con SEROQUEL 100 mg, la interrupción de la capacidad del cuerpo para reducir la temperatura corporal central se ha atribuido a los agentes antipsicóticos. Se recomienda el cuidado adecuado cuando se prescriba SEROQUEL 300 mg a pacientes que experimentarán condiciones que pueden contribuir a una elevación de la temperatura corporal central, por ejemplo, ejercicio intenso, exposición a calor extremo, recibir medicación concomitante con actividad anticolinérgica o estar sujetos a deshidratación.
disfagia
La dismotilidad esofágica y la aspiración se han asociado con el uso de fármacos antipsicóticos. La neumonía por aspiración es una causa común de morbilidad y mortalidad en pacientes de edad avanzada, en particular aquellos con demencia de Alzheimer avanzada. SEROQUEL 100 mg y otros medicamentos antipsicóticos deben usarse con precaución en pacientes con riesgo de neumonía por aspiración.
Síndrome de discontinuación
Se han descrito síntomas agudos de abstinencia, como insomnio, náuseas y vómitos, después de la suspensión abrupta de fármacos antipsicóticos atípicos, incluido SEROQUEL. En ensayos clínicos de monoterapia a corto plazo, controlados con placebo, con SEROQUEL 25 mg XR que incluyeron una fase de interrupción que evaluó los síntomas de interrupción, la incidencia agregada de pacientes que experimentaron uno o más síntomas de interrupción después de la interrupción abrupta fue del 12,1 % (241/1993) para SEROQUEL XR y 6,7% (71/1065) para placebo. La incidencia de las reacciones adversas individuales (es decir, insomnio, náuseas, dolor de cabeza, diarrea, vómitos, mareos e irritabilidad) no superó el 5,3 % en ningún grupo de tratamiento y, por lo general, se resolvió después de 1 semana después de la interrupción. Se recomienda la retirada gradual. [ver Uso en poblaciones específicas ]
Efectos anticolinérgicos (antimuscarínicos)
La norquetiapina, un metabolito activo de la quetiapina, tiene una afinidad de moderada a fuerte por varios subtipos de receptores muscarínicos. Esto contribuye a las reacciones adversas anticolinérgicas cuando SEROQUEL 25 mg se usa en dosis terapéuticas, se toma concomitantemente con otros medicamentos anticolinérgicos o se toma en sobredosis. SEROQUEL debe usarse con precaución en pacientes que reciben medicamentos con efectos anticolinérgicos (antimuscarínicos) [ver SOBREDOSIS y FARMACOLOGÍA CLÍNICA ].
El estreñimiento fue un evento adverso informado con frecuencia en pacientes tratados con quetiapina y representa un factor de riesgo de obstrucción intestinal. Se ha informado obstrucción intestinal con quetiapina, incluidos informes fatales en pacientes que estaban recibiendo múltiples medicamentos concomitantes que disminuyen la motilidad intestinal.
SEROQUEL 300 mg debe usarse con precaución en pacientes con un diagnóstico actual o antecedentes de retención urinaria, hipertrofia prostática clínicamente significativa, estreñimiento o aumento de la presión intraocular.
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA (Guía del medicamento).
Se debe informar a los pacientes sobre los siguientes problemas y pedirles que alerten a su prescriptor si ocurren mientras toman SEROQUEL.
Aumento de la mortalidad en pacientes de edad avanzada con psicosis relacionada con la demencia Se debe advertir a los pacientes y cuidadores que los pacientes de edad avanzada con psicosis relacionada con la demencia tratados con fármacos antipsicóticos atípicos tienen un mayor riesgo de muerte en comparación con el placebo. La quetiapina no está aprobada para pacientes de edad avanzada con psicosis relacionada con demencia [ver ADVERTENCIAS Y PRECAUCIONES ].
Pensamientos y comportamientos suicidas
Se debe alentar a los pacientes, sus familias y sus cuidadores a estar alerta ante la aparición de ansiedad, agitación, ataques de pánico, insomnio, irritabilidad, hostilidad, agresividad, impulsividad, acatisia (inquietud psicomotora), hipomanía, manía, otros cambios inusuales en el comportamiento. , empeoramiento de la depresión e ideación suicida, especialmente al principio del tratamiento con antidepresivos y cuando la dosis se ajusta hacia arriba o hacia abajo. Se debe recomendar a las familias y cuidadores de los pacientes que estén atentos a la aparición de dichos síntomas en el día a día, ya que los cambios pueden ser abruptos. Dichos síntomas deben informarse al médico o al profesional de la salud del paciente, especialmente si son graves, de aparición repentina o si no formaban parte de los síntomas de presentación del paciente. Síntomas como estos pueden estar asociados con un mayor riesgo de pensamientos y conductas suicidas e indican la necesidad de un control muy estricto y posiblemente cambios en la medicación [ver ADVERTENCIAS Y PRECAUCIONES ].
Síndrome Neuroléptico Maligno (SNM)
Se debe recomendar a los pacientes que informen a su médico sobre cualquier signo o síntoma que pueda estar relacionado con el SNM. Estos pueden incluir rigidez muscular y fiebre alta [ver ADVERTENCIAS Y PRECAUCIONES ].
Hiperglucemia y Diabetes Mellitus
Los pacientes deben ser conscientes de los síntomas de hiperglucemia (nivel alto de azúcar en la sangre) y diabetes mellitus. Los pacientes a los que se les diagnostica diabetes, aquellos con factores de riesgo de diabetes o aquellos que desarrollan estos síntomas durante el tratamiento deben controlar su glucosa en sangre al comienzo y periódicamente durante el tratamiento [ver ADVERTENCIAS Y PRECAUCIONES ].
Hiperlipidemia
Se debe advertir a los pacientes que pueden ocurrir elevaciones en el colesterol total, colesterol LDL y triglicéridos y disminuciones en el colesterol HDL. Se debe controlar el perfil de lípidos de los pacientes al comienzo y periódicamente durante el tratamiento [ver ADVERTENCIAS Y PRECAUCIONES ].
Aumento de peso
Se debe advertir a los pacientes que pueden experimentar un aumento de peso. Se debe controlar el peso de los pacientes con regularidad [ver ADVERTENCIAS Y PRECAUCIONES ].
Hipotensión ortostática
Se debe advertir a los pacientes sobre el riesgo de hipotensión ortostática (los síntomas incluyen sentirse mareado o aturdido al ponerse de pie, lo que puede provocar caídas), especialmente durante el período de titulación inicial de la dosis, y también en los momentos de reinicio del tratamiento o aumentos en la dosis [ ver ADVERTENCIAS Y PRECAUCIONES ].
Aumento de la presión arterial en niños y adolescentes
A los pacientes niños y adolescentes se les debe medir la presión arterial al comienzo del tratamiento y periódicamente durante el mismo [ver ADVERTENCIAS Y PRECAUCIONES ].
Leucopenia/Neutropenia
Se debe advertir a los pacientes con un recuento bajo de glóbulos blancos preexistente o antecedentes de leucopenia/neutropenia inducida por fármacos que deben controlar su recuento sanguíneo completo mientras toman SEROQUEL. Se debe recomendar a los pacientes que hablen con su médico lo antes posible si tienen fiebre, síntomas parecidos a los de la gripe, dolor de garganta o cualquier otra infección, ya que esto podría ser el resultado de un WBC muy bajo, que puede requerir SEROQUEL 100 mg. detenido y/o tratamiento a administrar [ver ADVERTENCIAS Y PRECAUCIONES ].
Interferencia con el rendimiento cognitivo y motor
Se debe advertir a los pacientes sobre el riesgo de somnolencia o sedación (que puede provocar caídas), especialmente durante el período de titulación inicial de la dosis. Se debe advertir a los pacientes sobre la realización de cualquier actividad que requiera agudeza mental, como conducir un vehículo motorizado (incluidos los automóviles) o manejar maquinaria, hasta que estén razonablemente seguros de que el tratamiento con quetiapina no les afecta negativamente [ver ADVERTENCIAS Y PRECAUCIONES ].
Exposición al calor y deshidratación
Se debe advertir a los pacientes sobre el cuidado apropiado para evitar el sobrecalentamiento y la deshidratación [ver ADVERTENCIAS Y PRECAUCIONES ].
Medicación concomitante
Al igual que con otros medicamentos, se debe recomendar a los pacientes que notifiquen a sus médicos si están tomando, o planean tomar, cualquier medicamento recetado o de venta libre [ver INTERACCIONES CON LA DROGAS ].
El embarazo
Aconseje a las mujeres embarazadas que notifiquen a su proveedor de atención médica si quedan embarazadas o tienen la intención de quedar embarazadas durante el tratamiento con SEROQUEL. Advierta a los pacientes que SEROQUEL puede causar síntomas extrapiramidales y/o de abstinencia (agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria y trastorno de la alimentación) en un recién nacido. Informe a los pacientes que existe un registro de embarazos que monitorea los resultados del embarazo en mujeres expuestas a SEROQUEL 25 mg durante el embarazo [ver Uso en poblaciones específicas ].
Esterilidad
Aconseje a las hembras con potencial reproductivo que SEROQUEL puede afectar la fertilidad debido a un aumento en los niveles de prolactina sérica. Los efectos sobre la fertilidad son reversibles [ver Uso en poblaciones específicas ].
Necesidad de un programa de tratamiento integral
SEROQUEL está indicado como parte integral de un programa de tratamiento total para adolescentes con esquizofrenia y trastorno bipolar pediátrico que puede incluir otras medidas (psicológicas, educativas y sociales). No se ha establecido la eficacia y seguridad de SEROQUEL 100 mg en pacientes pediátricos menores de 13 años para esquizofrenia o menores de 10 años para manía bipolar. La ubicación educativa adecuada es esencial y la intervención psicosocial suele ser útil. La decisión de prescribir antipsicóticos atípicos dependerá de la evaluación del médico sobre la cronicidad y la gravedad de los síntomas del paciente [ver INDICACIONES ].
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Carcinogénesis
Se realizaron estudios de carcinogenicidad en ratones C57BL y ratas Wistar. Se administró quetiapina en la dieta a ratones en dosis de 20, 75, 250 y 750 mg/kg ya ratas por sonda en dosis de 25, 75 y 250 mg/kg durante dos años. Estas dosis son equivalentes a 0.1, 0.5, 1.5 y 4.5 veces la MRHD de 800 mg/día en base a mg/m2 de área de superficie corporal (ratones) o 0.3, 1 y 3 veces la MRHD en base a mg/m2 de área de superficie corporal (ratas). Hubo aumentos estadísticamente significativos en los adenomas foliculares de la glándula tiroides en ratones macho con dosis de 1,5 y 4,5 veces la MRHD en base a mg/m2 de área de superficie corporal y en ratas macho con una dosis de 3 veces la MRHD en mg/m2 de área de superficie corporal. Los adenocarcinomas de las glándulas mamarias aumentaron significativamente desde el punto de vista estadístico en ratas hembra en todas las dosis probadas (0,3, 1 y 3 veces la MRHD según el área de superficie corporal en mg/m2).
Los adenomas de células foliculares tiroideas pueden ser el resultado de la estimulación crónica de la glándula tiroides por la hormona estimulante de la tiroides (TSH) como resultado del aumento del metabolismo y la eliminación de tiroxina por el hígado de roedores. Se observaron cambios en TSH, tiroxina y eliminación de tiroxina compatibles con este mecanismo en estudios de toxicidad subcrónica en ratas y ratones y en un estudio de toxicidad de 1 año en ratas; sin embargo, los resultados de estos estudios no fueron definitivos. Se desconoce la relevancia de los aumentos en los adenomas de células foliculares tiroideas para el riesgo humano, a través de cualquier mecanismo.
Se ha demostrado que los fármacos antipsicóticos elevan de forma crónica los niveles de prolactina en roedores. Las mediciones séricas en un estudio de toxicidad de 1 año mostraron que la quetiapina aumentó los niveles medios de prolactina sérica un máximo de 32 y 13 veces en ratas macho y hembra, respectivamente. Se han encontrado aumentos en las neoplasias mamarias en roedores después de la administración crónica de otros fármacos antipsicóticos y se considera que están mediados por la prolactina. Se desconoce la relevancia de este aumento de la incidencia de tumores de glándulas mamarias mediados por prolactina en ratas para el riesgo humano [ver ADVERTENCIAS Y PRECAUCIONES ].
mutagénesis
La quetiapina no fue mutagénica ni clastogénica en las pruebas estándar de genotoxicidad. El potencial mutagénico de la quetiapina se probó en el ensayo de mutación del gen bacteriano Ames in vitro y en el ensayo de mutación del gen de mamíferos in vitro en células de ovario de hámster chino. El potencial clastogénico de la quetiapina se probó en el ensayo de aberración cromosómica in vitro en linfocitos humanos cultivados y en el ensayo de micronúcleos de médula ósea in vivo en ratas hasta 500 mg/kg, que es 6 veces la dosis máxima recomendada en humanos basada en mg/m2. área superficial del cuerpo.
Deterioro de la fertilidad
La quetiapina disminuyó el apareamiento y la fertilidad en ratas macho Sprague-Dawley en dosis orales de 50 y 150 mg/kg o aproximadamente 1 y 3 veces la MRHD de 800 mg/día en base a mg/m2 de área de superficie corporal. Los efectos relacionados con las drogas incluyeron aumentos en el intervalo para aparearse y en el número de apareamientos requeridos para una impregnación exitosa. Estos efectos continuaron observándose a 3 veces la MRHD incluso después de un período de dos semanas sin tratamiento. La dosis sin efecto para problemas de apareamiento y fertilidad en ratas macho fue de 25 mg/kg, o 0,3 veces la dosis MRHD basada en mg/m2 de área de superficie corporal. La quetiapina afectó negativamente el apareamiento y la fertilidad en ratas hembra Sprague-Dawley en una dosis oral de aproximadamente 1 vez la MRHD de 800 mg/día en base a mg/m2 de área de superficie corporal. Los efectos relacionados con las drogas incluyeron disminuciones en los apareamientos y en los apareamientos que resultaron en preñez, y un aumento en el intervalo hasta el apareamiento. Se observó un aumento en los ciclos estrales irregulares con dosis de 10 y 50 mg/kg, o aproximadamente 0,1 y 1 veces la MRHD de 800 mg/día en base a mg/m2 de superficie corporal. La dosis sin efecto en ratas hembra fue de 1 mg/kg, o 0,01 veces la MRHD de 800 mg/día en base a mg/m2 de área de superficie corporal.
Uso en poblaciones específicas
El embarazo
Registro de exposición durante el embarazo
Existe un registro de exposición durante el embarazo que monitorea los resultados del embarazo en mujeres expuestas a antipsicóticos atípicos, incluido SEROQUEL 50 mg, durante el embarazo. Se alienta a los proveedores de atención médica a registrar pacientes comunicándose con el Registro Nacional de Embarazo para Antipsicóticos Atípicos al 1-866-961-2388 o en línea en http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
Resumen de riesgos
Los recién nacidos expuestos a fármacos antipsicóticos (incluido SEROQUEL) durante el tercer trimestre corren el riesgo de presentar síntomas extrapiramidales y/o de abstinencia después del parto (ver Consideraciones clínicas ). Los datos generales disponibles de los estudios epidemiológicos publicados de mujeres embarazadas expuestas a quetiapina no han establecido un riesgo asociado al fármaco de anomalías congénitas graves, aborto espontáneo o resultados maternos o fetales adversos (ver Datos ). Existen riesgos para la madre asociados con la esquizofrenia no tratada, bipolar I o trastorno depresivo mayor, y con la exposición a antipsicóticos, incluido SEROQUEL 200 mg, durante el embarazo (ver Consideraciones clínicas ).
En estudios con animales, se produjo toxicidad embriofetal, incluidos retrasos en la osificación esquelética a aproximadamente 1 y 2 veces la dosis máxima recomendada en humanos (DMRH) de 800 mg/día tanto en ratas como en conejos, y una mayor incidencia de flexión del carpo/tarso (menor anomalía del tejido blando) en fetos de conejo a aproximadamente 2 veces la MRHD. Además, los pesos fetales se redujeron en ambas especies. La toxicidad materna (observada como disminución del peso corporal y/o muerte) ocurrió con 2 veces la MRHD en ratas y aproximadamente 1-2 veces la MRHD en conejos.
Se desconoce el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo para las poblaciones indicadas. Todos los embarazos tienen un riesgo de fondo de defecto congénito, pérdida u otros resultados adversos. En la población general de los EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 al 4 % y del 15 al 20 %, respectivamente.
Consideraciones clínicas
Riesgo materno y/o fetal asociado a la enfermedad
Existe un riesgo para la madre de esquizofrenia no tratada o trastorno bipolar I, incluido un mayor riesgo de recaída, hospitalización y suicidio. La esquizofrenia y el trastorno bipolar I se asocian con mayores resultados perinatales adversos, incluido el parto prematuro. No se sabe si esto es un resultado directo de la enfermedad o de otros factores comórbidos.
Un estudio longitudinal prospectivo siguió a 201 mujeres embarazadas con antecedentes de trastorno depresivo mayor que eran eutímicas y tomaban antidepresivos al comienzo del embarazo. Las mujeres que suspendieron los antidepresivos durante el embarazo tenían más probabilidades de experimentar una recaída de depresión mayor que las mujeres que continuaron con los antidepresivos. Considere el riesgo de depresión no tratada al suspender o cambiar el tratamiento con medicamentos antidepresivos durante el embarazo y el posparto.
Reacciones adversas fetales/neonatales
Se han informado síntomas extrapiramidales y/o de abstinencia, que incluyen agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria y trastornos de la alimentación en recién nacidos que estuvieron expuestos a medicamentos antipsicóticos, incluido SEROQUEL 50 mg, durante el tercer trimestre del embarazo. Estos síntomas variaron en severidad. Supervise a los recién nacidos para detectar síntomas extrapiramidales y/o de abstinencia y maneje los síntomas adecuadamente. Algunos neonatos se recuperaron en horas o días sin tratamiento específico; otros requirieron hospitalización prolongada.
Datos
Datos humanos
Los datos publicados de estudios observacionales, registros de nacimiento e informes de casos sobre el uso de antipsicóticos atípicos durante el embarazo no informan una asociación clara con los antipsicóticos y defectos congénitos importantes. Un estudio de cohorte retrospectivo de una base de datos de Medicaid de 9258 mujeres expuestas a antipsicóticos durante el embarazo no indicó un mayor riesgo general de defectos congénitos importantes.
Datos de animales
Cuando ratas y conejas preñadas fueron expuestas a quetiapina durante la organogénesis, no hubo efecto teratogénico en los fetos. Las dosis fueron 25, 50 y 200 mg/kg en ratas y 25, 50 y 100 mg/kg en conejos, que son aproximadamente 0,3, 0,6 y 2 veces (ratas) y 0,6, 1 y 2 veces (conejos) la MRHD para esquizofrenia de 800 mg/día en base a mg/m2 de superficie corporal. Sin embargo, hubo evidencia de toxicidad embriofetal que incluye retrasos en la osificación esquelética a aproximadamente 1 y 2 veces la MRHD de 800 mg/día tanto en ratas como en conejos, y una mayor incidencia de flexura carpiana/tarsiana (anomalía menor de los tejidos blandos) en fetos de conejo a aproximadamente 2 veces la MRHD. Además, los pesos fetales se redujeron en ambas especies. La toxicidad materna (observada como disminución del peso corporal y/o muerte) ocurrió con 2 veces la MRHD en ratas y aproximadamente 1-2 veces la MRHD (todas las dosis probadas) en conejos.
En un estudio reproductivo peri/postnatal en ratas, no se observaron efectos relacionados con el fármaco cuando las madres embarazadas fueron tratadas con quetiapina en dosis de 0,01, 0,1 y 0,2 veces la MRHD de 800 mg/día en base a mg/m2 de superficie corporal. Sin embargo, en un estudio peri/postnatal preliminar, hubo aumentos en la muerte de fetos y crías, y disminuciones en el peso medio de la camada a 3 veces la MRHD.
Lactancia
Resumen de riesgos
Los datos limitados de la literatura publicada informan la presencia de quetiapina en la leche materna humana a una dosis infantil relativa de
Hembras y machos con potencial reproductivo
Esterilidad
Hembras
Con base en la acción farmacológica de la quetiapina (antagonismo D2), el tratamiento con SEROQUEL puede provocar un aumento en los niveles de prolactina sérica, lo que puede conducir a una reducción reversible de la fertilidad en mujeres con potencial reproductivo [ver ADVERTENCIAS Y PRECAUCIONES ].
Uso pediátrico
En general, las reacciones adversas observadas en niños y adolescentes durante los ensayos clínicos fueron similares a las de la población adulta con pocas excepciones. Se produjeron aumentos en la presión arterial sistólica y diastólica en niños y adolescentes y no en adultos. La hipotensión ortostática ocurrió con mayor frecuencia en adultos (4-7 %) en comparación con niños y adolescentes ( ADVERTENCIAS Y PRECAUCIONES y REACCIONES ADVERSAS ].
Esquizofrenia
La eficacia y seguridad de SEROQUEL 50 mg en el tratamiento de la esquizofrenia en adolescentes de 13 a 17 años se demostraron en un ensayo doble ciego controlado con placebo de 6 semanas [ver INDICACIONES , DOSIFICACIÓN Y ADMINISTRACIÓN , REACCIONES ADVERSAS , y Estudios clínicos ].
No se ha establecido la seguridad y eficacia de SEROQUEL 300 mg en pacientes pediátricos menores de 13 años con esquizofrenia.
Mantenimiento
No se ha establecido la seguridad y eficacia de SEROQUEL en el tratamiento de mantenimiento del trastorno bipolar en pacientes pediátricos menores de 18 años. No se ha establecido la seguridad y eficacia de SEROQUEL en el tratamiento de mantenimiento de la esquizofrenia en ninguna población de pacientes, incluidos los pacientes pediátricos.
Manía bipolar
La eficacia y seguridad de SEROQUEL en el tratamiento de la manía en niños y adolescentes de 10 a 17 años con trastorno bipolar I se demostró en un ensayo multicéntrico de 3 semanas, doble ciego, controlado con placebo [ver INDICACIONES , DOSIFICACIÓN Y ADMINISTRACIÓN , REACCIONES ADVERSAS , y Estudios clínicos ]. No se ha establecido la seguridad y eficacia de SEROQUEL en pacientes pediátricos menores de 10 años con manía bipolar.
depresión bipolar
No se ha establecido la seguridad y eficacia de SEROQUEL 300 mg en pacientes pediátricos menores de 18 años con depresión bipolar. Se realizó un ensayo clínico con SEROQUEL XR en niños y adolescentes (10-17 años de edad) con depresión bipolar, no se estableció la eficacia.
Se observaron algunas diferencias en la farmacocinética de quetiapina entre niños/adolescentes (10-17 años) y adultos. Cuando se ajustó por peso, el AUC y la Cmax de quetiapina fueron un 41 % y un 39 % inferiores, respectivamente, en niños y adolescentes en comparación con los adultos. La farmacocinética del metabolito activo, norquetiapina, fue similar entre niños/adolescentes y adultos después de ajustar por peso [ver FARMACOLOGÍA CLÍNICA ].
Uso geriátrico
De los aproximadamente 3700 pacientes en estudios clínicos con SEROQUEL 300 mg, el 7% (232) tenían 65 años o más. En general, no hubo indicios de una tolerabilidad diferente de SEROQUEL en los ancianos en comparación con los adultos más jóvenes. Sin embargo, la presencia de factores que podrían disminuir el aclaramiento farmacocinético, aumentar la respuesta farmacodinámica a SEROQUEL 200 mg o causar una peor tolerancia u ortostasis, debe llevar a considerar una dosis inicial más baja, una titulación más lenta y un control cuidadoso durante el período de dosificación inicial en el anciano. El aclaramiento plasmático medio de SEROQUEL 25 mg se redujo entre un 30 % y un 50 % en pacientes de edad avanzada en comparación con pacientes más jóvenes [ver FARMACOLOGÍA CLÍNICA y DOSIFICACIÓN Y ADMINISTRACIÓN ].
Insuficiencia renal
La experiencia clínica con SEROQUEL en pacientes con insuficiencia renal es limitada [ver FARMACOLOGÍA CLÍNICA ].
Deterioro hepático
Dado que la quetiapina se metaboliza ampliamente en el hígado, se esperan niveles plasmáticos más altos en pacientes con insuficiencia hepática. En esta población, se recomienda una dosis inicial baja de 25 mg/día y la dosis puede aumentarse en incrementos de 25 mg/día a 50 mg/día [ver DOSIFICACIÓN Y ADMINISTRACIÓN y FARMACOLOGÍA CLÍNICA ].
SOBREDOSIS
Experiencia humana
En ensayos clínicos, se ha informado supervivencia en sobredosis agudas de hasta 30 gramos de quetiapina. La mayoría de los pacientes que sufrieron una sobredosis no experimentaron reacciones adversas o se recuperaron por completo de los eventos notificados. Se ha notificado la muerte en un ensayo clínico tras una sobredosis de 13,6 gramos de quetiapina sola. En general, los signos y síntomas notificados fueron los resultantes de una exageración de los efectos farmacológicos conocidos del fármaco, es decir, somnolencia, sedación, taquicardia, hipotensión y toxicidad anticolinérgica, incluidos coma y delirio. Los pacientes con enfermedad cardiovascular grave preexistente pueden tener un mayor riesgo de sufrir los efectos de una sobredosis [ver ADVERTENCIAS Y PRECAUCIONES ]. Un caso, con una sobredosis estimada de 9600 mg, se asoció con hipopotasemia y bloqueo cardíaco de primer grado. En la experiencia posterior a la comercialización, se informaron casos de prolongación del intervalo QT con sobredosis.
Manejo de sobredosis
Establezca y mantenga una vía aérea y asegure una oxigenación y ventilación adecuadas. La monitorización cardiovascular debe iniciarse inmediatamente y debe incluir monitorización electrocardiográfica continua para detectar posibles arritmias.
Las medidas de apoyo adecuadas son el pilar de la gestión. Para obtener la información más actualizada sobre el manejo de la sobredosis de Seroquel XR, comuníquese con un Centro Regional de Control de Intoxicaciones certificado (1-800-222-1222).
CONTRAINDICACIONES
Hipersensibilidad a la quetiapina o a alguno de los excipientes de la formulación de SEROQUEL XR. Se han informado reacciones anafilácticas en pacientes tratados con SEROQUEL XR.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
El mecanismo de acción de la quetiapina en las indicaciones enumeradas no está claro. Sin embargo, la eficacia de quetiapina en estas indicaciones podría estar mediada por una combinación de antagonismo de dopamina tipo 2 (D2) y serotonina tipo 2 (5HT2). El metabolito activo, N-desalquil quetiapina (norquetiapina), tiene una actividad similar en D2, pero mayor actividad en los receptores 5HT2A que el fármaco original (quetiapina).
Farmacodinámica
La quetiapina y su metabolito, la norquetiapina, tienen afinidad por múltiples receptores de neurotransmisores que se unen a la norquetiapina con mayor afinidad que la quetiapina en general. Los valores de Ki para quetiapina y norquetiapina en dopamina D1 son 428/99,8 nM, en D2 626/489 nM, en serotonina 5HT1A 1040/191 nM en 5HT2A 38/2,9 nM, en histamina H1 4,4/1,1 nM, en muscarínico M1 1086/ 38,3 nM, y en α1b adrenérgico 14,6/46,4 nM y en receptores α2 617/1290 nM, respectivamente. La quetiapina y la norquetiapina carecen de una afinidad apreciable por los receptores de las benzodiazepinas.
Efecto sobre el intervalo QT
En los ensayos clínicos, la quetiapina no se asoció con un aumento persistente de los intervalos QT. Sin embargo, el efecto QT no se evaluó sistemáticamente en un estudio exhaustivo de QT. En la experiencia posterior a la comercialización, se informaron casos de prolongación del intervalo QT en pacientes que tomaron una sobredosis de quetiapina [ver SOBREDOSIS ], en pacientes con enfermedades concomitantes y en pacientes que toman medicamentos que se sabe que causan desequilibrio electrolítico o aumentan el intervalo QT.
Farmacocinética
Adultos
La actividad del fumarato de quetiapina se debe principalmente al fármaco original. La farmacocinética de dosis múltiples de quetiapina es proporcional a la dosis dentro del rango de dosis clínica propuesto, y la acumulación de quetiapina es predecible con dosis múltiples. La eliminación de quetiapina se realiza principalmente a través del metabolismo hepático con una vida media terminal media de aproximadamente 6 horas dentro del rango de dosis clínica propuesto. Se espera que las concentraciones de estado estacionario se alcancen dentro de los dos días posteriores a la dosificación. Es improbable que la quetiapina interfiera con el metabolismo de los fármacos metabolizados por las enzimas del citocromo P450.
Niños Y Adolescentes
En el estado estacionario, la farmacocinética del compuesto original, en niños y adolescentes (10-17 años de edad), fue similar a la de los adultos. Sin embargo, cuando se ajustó por dosis y peso, el AUC y la Cmax del compuesto original fueron un 41 % y un 39 % inferiores, respectivamente, en niños y adolescentes que en adultos. Para el metabolito activo, norquetiapina, el AUC y la Cmax fueron un 45 % y un 31 % más altos, respectivamente, en niños y adolescentes que en adultos. Cuando se ajustó por dosis y peso, la farmacocinética del metabolito, norquetiapina, fue similar entre niños y adolescentes y adultos [ver Uso en poblaciones específicas ].
Absorción
El fumarato de quetiapina se absorbe rápidamente después de la administración oral, alcanzando concentraciones plasmáticas máximas en 1,5 horas. La formulación de la tableta es 100 % biodisponible en relación con la solución. La biodisponibilidad de quetiapina se ve afectada marginalmente por la administración con alimentos, con valores de Cmax y AUC aumentados en un 25 % y un 15 %, respectivamente.
Distribución
La quetiapina se distribuye ampliamente por todo el cuerpo con un volumen aparente de distribución de 10±4 l/kg. Se une en un 83% a las proteínas plasmáticas en concentraciones terapéuticas. In vitro, la quetiapina no afectó la unión de warfarina o diazepam a la albúmina sérica humana. A su vez, ni la warfarina ni el diazepam alteraron la unión de la quetiapina.
Metabolismo y Eliminación
Después de una dosis oral única de 14C-quetiapina, menos del 1 % de la dosis administrada se excretó como fármaco inalterado, lo que indica que la quetiapina se metaboliza en gran medida. Aproximadamente el 73 % y el 20 % de la dosis se recuperó en la orina y las heces, respectivamente.
La quetiapina se metaboliza ampliamente en el hígado. Las principales vías metabólicas son la sulfoxidación al metabolito sulfóxido y la oxidación al metabolito ácido original; ambos metabolitos son farmacológicamente inactivos. Los estudios in vitro con microsomas hepáticos humanos revelaron que la isoenzima 3A4 del citocromo P450 está involucrada en el metabolismo de la quetiapina a su metabolito sulfóxido principal, pero inactivo, y en el metabolismo de su metabolito activo N-desalquil quetiapina.
Años
El aclaramiento oral de quetiapina se redujo en un 40 % en pacientes de edad avanzada (≥ 65 años, n=9) en comparación con pacientes jóvenes (n=12), y puede ser necesario ajustar la dosis [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Género
No hay efecto de género en la farmacocinética de quetiapina.
La raza
No hay efecto de raza sobre la farmacocinética de quetiapina.
De fumar
Fumar no tiene efecto sobre el aclaramiento oral de quetiapina.
Insuficiencia renal
Los pacientes con insuficiencia renal grave (Clcr=10-30 ml/min/1,73 m2, n=8) tuvieron un aclaramiento oral medio un 25 % más bajo que los sujetos normales (Clcr > 80 ml/min/1,73 m2, n=8), pero las concentraciones plasmáticas de quetiapina en sujetos con insuficiencia renal estuvieron dentro del rango de concentraciones observadas en sujetos normales que recibieron la misma dosis. Por lo tanto, no es necesario ajustar la dosis en estos pacientes [ver Uso en poblaciones específicas ].
insuficiencia hepática
Los pacientes con insuficiencia hepática (n=8) tuvieron un aclaramiento oral medio de quetiapina un 30 % más bajo que los sujetos normales. En dos de los 8 pacientes con insuficiencia hepática, el AUC y la Cmax fueron 3 veces más altos que los observados típicamente en sujetos sanos. Dado que la quetiapina se metaboliza extensamente en el hígado, se esperan niveles plasmáticos más altos en la población con insuficiencia hepática y es posible que sea necesario ajustar la dosis [ver DOSIFICACIÓN Y ADMINISTRACIÓN y USO EN POBLACIONES ESPECÍFICAS ].
Estudios de interacción fármaco-fármaco
Las evaluaciones in vivo del efecto de otros fármacos sobre la farmacocinética de quetiapina se resumen en la Tabla 17 [ver DOSIFICACIÓN Y ADMINISTRACIÓN y INTERACCIONES CON LA DROGAS ].
Los datos de inhibición enzimática in vitro sugieren que la quetiapina y 9 de sus metabolitos tendrían poco efecto inhibidor sobre el metabolismo in vivo mediado por los citocromos CYP 1A2, 2C9, 2C19, 2D6 y 3A4. Quetiapina en dosis de 750 mg/día no afectó la farmacocinética de dosis única de antipirina, litio o lorazepam (Tabla 18) [ver INTERACCIONES CON LA DROGAS ].
Toxicología Animal Y/o Farmacología
La quetiapina provocó un aumento relacionado con la dosis en la deposición de pigmento en la glándula tiroides en estudios de toxicidad en ratas que duraron 4 semanas o más y en un estudio de carcinogenicidad en ratones de 2 años. Las dosis fueron de 10, 25, 50, 75, 150 y 250 mg/kg en estudios con ratas, que son aproximadamente 0,1, 0,3, 0,6, 1, 2 y 3 veces la MRHD de 800 mg/día en base a mg/m2 de superficie corporal , respectivamente. Las dosis en el estudio de carcinogenicidad en ratones fueron de 20, 75, 250 y 750 mg/kg, que son aproximadamente 0,1, 0,5, 1,5 y 4,5 veces la MRHD de 800 mg/día en base a mg/m2 de superficie corporal. Se demostró que la deposición de pigmento es irreversible en ratas. No se pudo determinar la identidad del pigmento, pero se encontró que estaba co-localizado con quetiapina en las células epiteliales foliculares de la glándula tiroides. Se desconocen los efectos funcionales y la relevancia de este hallazgo para el riesgo humano.
En perros que recibieron quetiapina durante 6 o 12 meses, pero no durante 1 mes, se produjeron cataratas triangulares focales en la unión de las suturas posteriores en la corteza exterior del cristalino a una dosis de 100 mg/kg, o 4 veces la MRHD de 800 mg/día en base a mg/m2 de superficie corporal. Este hallazgo puede deberse a la inhibición de la biosíntesis de colesterol por parte de la quetiapina. La quetiapina provocó una reducción relacionada con la dosis en los niveles de colesterol plasmático en estudios de dosis repetidas en perros y monos; sin embargo, no hubo correlación entre el colesterol plasmático y la presencia de cataratas en perros individuales. La aparición de delta-8colestanol en plasma es consistente con la inhibición de una etapa tardía en la biosíntesis de colesterol en estas especies. También se observó una reducción del 25 % en el contenido de colesterol de la corteza exterior del cristalino en un estudio especial en perras tratadas con quetiapina. Las cataratas relacionadas con las drogas no se han visto en ninguna otra especie; sin embargo, en un estudio de 1 año en monos, se detectó una apariencia estriada en la superficie anterior del cristalino en 2/7 hembras con una dosis de 225 mg/kg o 5,5 veces la MRHD de 800 mg/día en base a mg/m2 corporal área de superficie.
Estudios clínicos
Esquizofrenia
Ensayos a corto plazo-Adultos
La eficacia de SEROQUEL 50 mg en el tratamiento de la esquizofrenia se estableció en 3 ensayos controlados a corto plazo (6 semanas) de pacientes hospitalizados con esquizofrenia que cumplieron con los criterios del DSM III-R para la esquizofrenia. Aunque se incluyó un brazo de haloperidol de dosis única fija como tratamiento comparativo en uno de los tres ensayos, este grupo de dosis única de haloperidol fue inadecuado para proporcionar una comparación confiable y válida de SEROQUEL 200 mg y haloperidol.
En estos estudios se utilizaron varios instrumentos para evaluar los signos y síntomas psiquiátricos, entre ellos la Escala Breve de Calificación Psiquiátrica (BPRS), un inventario de múltiples ítems de psicopatología general tradicionalmente utilizado para evaluar los efectos del tratamiento farmacológico en la esquizofrenia. El grupo de psicosis BPRS (desorganización conceptual, comportamiento alucinatorio, suspicacia y contenido de pensamiento inusual) se considera un subconjunto particularmente útil para evaluar a los pacientes esquizofrénicos activamente psicóticos. Una segunda evaluación tradicional, la Impresión Clínica Global (CGI), refleja la impresión de un observador experto, totalmente familiarizado con las manifestaciones de la esquizofrenia, sobre el estado clínico general del paciente.
Los resultados de los ensayos son los siguientes:
Los principales resultados de eficacia de estos tres estudios en el tratamiento de la esquizofrenia en adultos se presentan en la Tabla 19.
El examen de los subconjuntos de población (raza, género y edad) no reveló ninguna respuesta diferencial en función de la raza o el género, con un efecto aparentemente mayor en pacientes menores de 40 años en comparación con los mayores de 40 años. La importancia clínica de este hallazgo es desconocido.
Adolescentes (Edades 13-17)
La eficacia de SEROQUEL 300 mg en el tratamiento de la esquizofrenia en adolescentes (13-17 años de edad) se demostró en un ensayo doble ciego controlado con placebo de 6 semanas (estudio 4). Los pacientes que cumplieron con los criterios de diagnóstico de esquizofrenia del DSM-IV se asignaron al azar a uno de tres grupos de tratamiento: SEROQUEL 400 mg/día (n=73), SEROQUEL 800 mg/día (n=74) o placebo (n=75). La medicación del estudio se inició a 50 mg/día y el día 2 se aumentó a 100 mg/día (dividida y administrada dos o tres veces al día). Posteriormente, la dosis se ajustó a la dosis objetivo de 400 mg/día u 800 mg/día con incrementos de 100 mg/día, dividida y administrada dos o tres veces al día. La variable principal de eficacia fue el cambio medio desde el inicio en la Escala de Síndrome Positivo y Negativo total (PANSS).
SEROQUEL en dosis de 400 mg/día y 800 mg/día fue superior al placebo en la reducción de la puntuación total de la PANSS. Los principales resultados de eficacia de este estudio en el tratamiento de la esquizofrenia en adolescentes se presentan en la Tabla 19.
Trastorno bipolar
Trastorno bipolar I, episodios maníacos o mixtos
Adultos
La eficacia de SEROQUEL en el tratamiento agudo de los episodios maníacos se estableció en 3 ensayos controlados con placebo en pacientes que cumplían con los criterios del DSM-IV para el trastorno bipolar I con episodios maníacos. Estos ensayos incluyeron pacientes con o sin características psicóticas y excluyeron pacientes con ciclos rápidos y episodios mixtos. De estos ensayos, 2 fueron monoterapia (12 semanas) y 1 fue terapia adjunta (3 semanas) a litio o divalproato. Los resultados clave en estos ensayos fueron el cambio desde el inicio en la puntuación de la Escala de calificación de manía joven (YMRS) a las 3 y 12 semanas para la monoterapia y a las 3 semanas para la terapia adjunta. La terapia adjunta se define como el inicio simultáneo o la administración posterior de SEROQUEL 100 mg con litio o divalproato.
El principal instrumento de calificación utilizado para evaluar los síntomas maníacos en estos ensayos fue YMRS, una escala de 11 ítems calificada por médicos que tradicionalmente se usa para evaluar el grado de sintomatología maníaca (irritabilidad, comportamiento perturbador/agresivo, sueño, estado de ánimo elevado, habla, aumento de la actividad, interés sexual, trastorno del lenguaje/pensamiento, contenido del pensamiento, apariencia e introspección) en un rango de 0 (sin rasgos maníacos) a 60 (puntuación máxima).
Los resultados de los ensayos son los siguientes:
Monoterapia
La eficacia de SEROQUEL en el tratamiento agudo de la manía bipolar se estableció en 2 ensayos controlados con placebo. En dos ensayos de 12 semanas (n=300, n=299) que compararon SEROQUEL con placebo, SEROQUEL 300 mg fue superior al placebo en la reducción de la puntuación total de YMRS en las semanas 3 y 12. La mayoría de los pacientes en estos ensayos que tomaron SEROQUEL 100 mg se dosificaron en un rango entre 400 mg/día y 800 mg por día (estudios 1 y 2 en la Tabla 20).
Terapia adjunta
En este ensayo controlado con placebo de 3 semanas, 170 pacientes con manía bipolar (YMRS ≥20) fueron aleatorizados para recibir SEROQUEL 100 mg o placebo como tratamiento adjunto a litio o divalproex. Los pacientes pueden o no haber recibido un tratamiento adecuado con litio o divalproato antes de la aleatorización. SEROQUEL 50 mg fue superior al placebo cuando se agregó a litio o divalproato solo en la reducción de la puntuación total de la YMRS (estudio 3 en la Tabla 20).
La mayoría de los pacientes en este ensayo que tomaban SEROQUEL 25 mg recibieron dosis en un rango entre 400 mg/día y 800 mg por día. En un ensayo de diseño similar (n=200), SEROQUEL se asoció con una mejora en las puntuaciones de la YMRS, pero no demostró superioridad frente al placebo, posiblemente debido a un mayor efecto del placebo.
Los principales resultados de eficacia de estos estudios en el tratamiento de la manía en adultos se presentan en la Tabla 20.
Niños y Adolescentes (10-17 años)
La eficacia de SEROQUEL en el tratamiento agudo de episodios maníacos asociados con el trastorno bipolar I en niños y adolescentes (10-17 años de edad) se demostró en un ensayo multicéntrico, doble ciego, controlado con placebo, de 3 semanas (estudio 4 en Tabla 20). Los pacientes que cumplieron con los criterios de diagnóstico del DSM-IV para un episodio maníaco fueron aleatorizados en uno de tres grupos de tratamiento: SEROQUEL 400 mg/día (n=95), SEROQUEL 600 mg/día (n=98) o placebo (n=91) . La medicación del estudio se inició a 50 mg/día y el día 2 se aumentó a 100 mg/día (dosis divididas administradas dos o tres veces al día). Posteriormente, la dosis se ajustó a una dosis objetivo de 400 mg/día o 600 mg/día con incrementos de 100 mg/día, administrados en dosis divididas dos o tres veces al día. La variable principal de eficacia fue el cambio medio desde el inicio en la puntuación total de la YMRS.
SEROQUEL 400 mg/día y 600 mg/día fueron superiores al placebo en la reducción de la puntuación total de la YMRS (Tabla 20).
Trastorno Bipolar, Episodios Depresivos
Adultos
La eficacia de SEROQUEL 25 mg para el tratamiento agudo de los episodios depresivos asociados con el trastorno bipolar se estableció en 2 estudios de diseño idéntico, de 8 semanas, aleatorizados, doble ciego, controlados con placebo (N=1045) (estudios 5 y 6 en la Tabla 21) . Estos estudios incluyeron pacientes con trastorno bipolar I o II y aquellos con o sin ciclo rápido. A los pacientes asignados al azar a SEROQUEL 200 mg se les administraron dosis fijas de 300 mg o 600 mg una vez al día.
El instrumento de calificación principal utilizado para evaluar los síntomas depresivos en estos estudios fue la Escala de calificación de depresión de Montgomery-Asberg (MADRS), una escala calificada por médicos de 10 ítems con puntajes que van de 0 a 60. El criterio principal de valoración en ambos estudios fue el cambio de línea de base en la puntuación MADRS en la semana 8. En ambos estudios, SEROQUEL 50 mg fue superior al placebo en la reducción de la puntuación MADRS. La mejora de los síntomas, medida por el cambio en la puntuación MADRS en relación con el placebo, se observó en ambos estudios en el día 8 (semana 1) y en adelante. En estos estudios, no se observaron beneficios adicionales con la dosis de 600 mg. Para el grupo de dosis de 300 mg, se observaron mejoras estadísticamente significativas sobre el placebo en la calidad de vida general y la satisfacción relacionada con varias áreas de funcionamiento, según lo medido con el Q-LES-Q(SF).
Los principales resultados de eficacia de estos estudios en el tratamiento agudo de episodios depresivos asociados con el trastorno bipolar en adultos se presentan en la Tabla 21.
Tratamiento de mantenimiento como complemento de litio o divalproex
La eficacia de SEROQUEL 100 mg en el tratamiento de mantenimiento del trastorno bipolar I se estableció en 2 ensayos controlados con placebo en pacientes (n=1326) que cumplían con los criterios del DSM-IV para el trastorno bipolar I (estudios 7 y 8 en las Figuras 1 y 2). Los ensayos incluyeron pacientes cuyo episodio más reciente fue maníaco, depresivo o mixto, con o sin características psicóticas. En la fase abierta, los pacientes debían permanecer estables con SEROQUEL más litio o divalproato durante al menos 12 semanas para ser aleatorizados. En promedio, los pacientes se estabilizaron durante 15 semanas. En la fase de aleatorización, los pacientes continuaron el tratamiento con litio o divalproato y se aleatorizaron para recibir SEROQUEL (administrado dos veces al día con un total de 400 mg/día a 800 mg/día) o placebo. Aproximadamente el 50 % de los pacientes habían interrumpido el tratamiento con SEROQUEL el día 280 y el 50 % del grupo del placebo habían interrumpido el tratamiento doble ciego el día 117. El criterio principal de valoración en estos estudios fue el tiempo hasta la recurrencia de un evento del estado de ánimo (episodio maníaco, mixto o depresivo). Un evento del estado de ánimo se definió como el inicio de la medicación o la hospitalización por un episodio del estado de ánimo; Puntuación YMRS≥20 o puntuación MADRS≥20 en 2 evaluaciones consecutivas; o abandono del estudio por un evento anímico (Figura 1 y Figura 2).
En ambos estudios, SEROQUEL fue superior al placebo al aumentar el tiempo hasta la recurrencia de cualquier evento del estado de ánimo. El efecto del tratamiento estuvo presente para aumentar el tiempo hasta la recurrencia de los episodios maníacos y depresivos. El efecto de SEROQUEL fue independiente de cualquier subgrupo específico (estabilizador del estado de ánimo asignado, sexo, edad, raza, episodio bipolar más reciente o ciclo rápido).
Figura 1: Curvas de Kaplan-Meier de tiempo hasta la recurrencia de un evento de estado de ánimo (Estudio 7)
Figura 2: Curvas de Kaplan-Meier de tiempo hasta la recurrencia de un evento de estado de ánimo (Estudio 8)
INFORMACIÓN DEL PACIENTE
SEROQUEL (SER-oh-kwell)(fumarato de quetiapina) Tabletas
Lea esta Guía del medicamento antes de comenzar a tomar SEROQUEL y cada vez que renueve su receta. Es posible que haya nueva información. Esta información no reemplaza la conversación con su proveedor de atención médica sobre su condición médica o su tratamiento.
¿Cuál es la información más importante que debo saber sobre SEROQUEL?
SEROQUEL 100 mg puede causar efectos secundarios graves, que incluyen:
- Hable con su proveedor de atención médica o el de su familiar sobre:
- todos los riesgos y beneficios del tratamiento con medicamentos antidepresivos.
- todas las opciones de tratamiento para la depresión u otra enfermedad mental grave
- Los medicamentos antidepresivos pueden aumentar los pensamientos o acciones suicidas en algunos niños, adolescentes y adultos jóvenes durante los primeros meses de tratamiento.
- La depresión y otras enfermedades mentales graves son las causas más importantes de pensamientos y acciones suicidas. Algunas personas pueden tener un riesgo particularmente alto de tener pensamientos o acciones suicidas. Estos incluyen personas que tienen (o tienen antecedentes familiares de) depresión, enfermedad bipolar (también llamada enfermedad maníaco-depresiva) o pensamientos o acciones suicidas.
- ¿Cómo puedo vigilar y tratar de prevenir pensamientos y acciones suicidas en mí mismo o en un miembro de la familia?
- Preste mucha atención a cualquier cambio, especialmente a los repentinos, en el estado de ánimo, el comportamiento, los pensamientos o los sentimientos. Esto es muy importante cuando se inicia un medicamento antidepresivo o cuando se cambia la dosis.
- Llame al proveedor de atención médica de inmediato para informar cambios nuevos o repentinos en el estado de ánimo, el comportamiento, los pensamientos o los sentimientos.
- Mantenga todas las visitas de seguimiento con el proveedor de atención médica según lo programado. Llame al proveedor de atención médica entre visitas según sea necesario, especialmente si le preocupan los síntomas.
Llame a un proveedor de atención médica de inmediato si usted o un miembro de su familia tienen alguno de los siguientes síntomas, especialmente si son nuevos, empeoran o le preocupan:
- pensamientos sobre el suicidio o la muerte
- intentos de suicidio
- depresión nueva o peor
- ansiedad nueva o peor
- sentirse muy agitado o inquieto
- ataques de pánico
- dificultad para dormir (insomnio)
- irritabilidad nueva o peor
- Actuar agresivo, estar enojado o violento.
- actuando sobre impulsos peligrosos
- un aumento extremo en la actividad y el habla (manía)
- otros cambios inusuales en el comportamiento o el estado de ánimo
¿Qué más necesito saber sobre los medicamentos antidepresivos?
- Nunca suspenda un medicamento antidepresivo sin hablar primero con su proveedor de atención médica. Detener un medicamento antidepresivo repentinamente puede causar otros síntomas.
- Los antidepresivos son medicamentos que se usan para tratar la depresión y otras enfermedades. Es importante discutir todos los riesgos de tratar la depresión y también los riesgos de no tratarla. Los pacientes y sus familias u otros cuidadores deben analizar todas las opciones de tratamiento con el proveedor de atención médica, no solo el uso de antidepresivos.
- Las medicinas antidepresivas tienen otros efectos secundarios. Hable con el proveedor de atención médica sobre los efectos secundarios del medicamento recetado para usted o su familiar.
- Los medicamentos antidepresivos pueden interactuar con otros medicamentos. Conozca todos los medicamentos que usted o su familiar toman. Mantenga una lista de todos los medicamentos para mostrársela al proveedor de atención médica. No empiece a tomar nuevos medicamentos sin antes consultar con su proveedor de atención médica.
- No todos los medicamentos antidepresivos recetados para niños están aprobados por la FDA para su uso en niños. Hable con el proveedor de atención médica de su hijo para obtener más información.
¿Qué es SEROQUEL 300mg?
SEROQUEL 100 mg es un medicamento recetado que se usa para tratar:
- esquizofrenia en personas de 13 años o más
- trastorno bipolar en adultos, incluyendo:
- episodios depresivos asociados al trastorno bipolar
- episodios maníacos asociados con el trastorno bipolar I solo o con litio o divalproato
- tratamiento a largo plazo del trastorno bipolar I con litio o divalproato
- episodios maníacos asociados con el trastorno bipolar I en niños de 10 a 17 años
No se sabe si SEROQUEL 100 mg es seguro y eficaz en niños menores de 10 años.
¿Qué debo decirle a mi proveedor de atención médica antes de tomar SEROQUEL 100 mg?
Antes de tomar SEROQUEL 200 mg, informe a su proveedor de atención médica si tiene o ha tenido:
- diabetes o nivel alto de azúcar en la sangre en usted o su familia. Su proveedor de atención médica debe controlar su nivel de azúcar en la sangre antes de comenzar con SEROQUEL 300 mg y también durante la terapia.
- niveles altos de colesterol total, triglicéridos o colesterol LDL, o niveles bajos de colesterol HDL
- presión arterial baja o alta
- recuento bajo de glóbulos blancos
- cataratas
- convulsiones
- pruebas de tiroides anormales
- altos niveles de prolactina
- problemas del corazón
- problemas hepáticos
- cualquier otra condición médica
- embarazo o planes de quedar embarazada. No se sabe si SEROQUEL 100mg dañará a su bebé por nacer.
- Si queda embarazada mientras recibe SEROQUEL, hable con su proveedor de atención médica acerca de registrarse en el Registro Nacional de Embarazo para Antipsicóticos Atípicos. Puede registrarse llamando al 1-866-961-2388 o vaya a http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
- lactancia o planes para amamantar. SEROQUEL puede pasar a la leche materna. Hable con su proveedor de atención médica sobre la mejor manera de alimentar a su bebé si recibe SEROQUEL.
- si tiene o ha tenido una afección en la que no puede vaciar completamente la vejiga (retención urinaria), agrandamiento de la próstata, estreñimiento o aumento de la presión dentro de los ojos.
Informe al proveedor de atención médica sobre todos los medicamentos que toma o ha tomado recientemente. incluyendo medicamentos recetados, medicamentos de venta libre, suplementos herbales y vitaminas.
SEROQUEL 300mg y otros medicamentos pueden afectarse entre sí y causar efectos secundarios graves. SEROQUEL 200 mg puede afectar la forma en que funcionan otros medicamentos, y otros medicamentos pueden afectar la forma en que funciona SEROQUEL 200 mg.
Informe a su proveedor de atención médica si se someterá a una prueba de detección de drogas en la orina porque SEROQUEL puede afectar los resultados de la prueba. Dígales a quienes le hagan la prueba que está tomando SEROQUEL.
¿Cómo debo tomar SEROQUEL?
- Tome SEROQUEL exactamente como se lo indique su proveedor de atención médica. No cambie la dosis usted mismo.
- Tome SEROQUEL 25 mg por vía oral, con o sin alimentos.
- Si cree que debe dejar de tomar SEROQUEL 25 mg, hable primero con su proveedor de atención médica. Si deja de tomar SEROQUEL repentinamente, es posible que tenga efectos secundarios como dificultad para dormir o dificultad para permanecer dormido (insomnio), náuseas y vómitos.
- Si olvida una dosis de SEROQUEL 25 mg, tómela tan pronto como lo recuerde. Si está cerca de su próxima dosis, omita la dosis olvidada. Sólo toma la siguiente dosis a tu hora regular. No tome 2 dosis al mismo tiempo a menos que su proveedor de atención médica se lo indique. Si no está seguro acerca de su dosis, llame a su proveedor de atención médica.
¿Qué debo evitar mientras tomo SEROQUEL 100mg?
- No conduzca, opere maquinaria ni realice otras actividades peligrosas hasta que sepa cómo le afecta SEROQUEL. SEROQUEL puede provocarle somnolencia.
- Evite sobrecalentarse o deshidratarse.
- No haga demasiado ejercicio.
- Si hace calor, quédese adentro en un lugar fresco si es posible.
- Mantente alejado de el sol. No use demasiada ropa ni pesada.
- Beber abundante agua.
- No beba alcohol mientras toma SEROQUEL. Puede empeorar algunos efectos secundarios de SEROQUEL.
¿Cuáles son los posibles efectos secundarios de SEROQUEL 300mg?
SEROQUEL 200 mg puede causar efectos secundarios graves, que incluyen:
- Ver “¿Cuál es la información más importante que debo saber sobre SEROQUEL 200mg?”
- accidente cerebrovascular que puede llevar a la muerte puede ocurrir en personas mayores con demencia que toman medicamentos como SEROQUEL
- síndrome neuroléptico maligno (SNM). El SNM es una afección rara pero muy grave que puede ocurrir en personas que toman medicamentos antipsicóticos, incluido SEROQUEL. El SNM puede causar la muerte y debe tratarse en un hospital. Llame a su proveedor de atención médica de inmediato si se enferma gravemente y tiene algunos o todos estos síntomas:
- fiebre alta
- sudoración excesiva
- músculos rígidos
- confusión
- cambios en la respiración, los latidos del corazón y la presión arterial
- caídas puede ocurrir en algunas personas que toman SEROQUEL. Estas caídas pueden causar lesiones graves.
- nivel alto de azúcar en la sangre (hiperglucemia). El nivel alto de azúcar en la sangre puede ocurrir si ya tiene diabetes o si nunca ha tenido diabetes. Un nivel alto de azúcar en la sangre podría conducir a:
- acumulación de ácido en la sangre debido a las cetonas (cetoacidosis)
- coma
- muerte
En algunas personas que toman SEROQUEL pueden ocurrir aumentos en el nivel de azúcar en la sangre. Los niveles extremadamente altos de azúcar en la sangre pueden provocar coma o la muerte. Si tiene diabetes o factores de riesgo para la diabetes (como sobrepeso o antecedentes familiares de diabetes), su proveedor de atención médica debe controlar su nivel de azúcar en la sangre antes de comenzar con SEROQUEL 50 mg y durante la terapia. Llame a su proveedor de atención médica si tiene alguno de estos síntomas de nivel alto de azúcar en la sangre (hiperglucemia) mientras toma SEROQUEL:
- sentir mucha sed
- necesidad de orinar más de lo normal
- sentir mucha hambre
- sentirse débil o cansado
- sentirse mal del estómago
- se siente confundido, o su aliento huele afrutado
- niveles elevados de grasa en la sangre (aumento del colesterol y los triglicéridos). Los niveles altos de grasa pueden ocurrir en personas tratadas con SEROQUEL. Es posible que no tenga ningún síntoma, por lo que su proveedor de atención médica puede decidir controlar su colesterol y triglicéridos durante su tratamiento con SEROQUEL.
- aumento de peso (aumento de peso). El aumento de peso es común en las personas que toman SEROQUEL, por lo que usted y su proveedor de atención médica deben controlar su peso con regularidad. Hable con su proveedor de atención médica sobre las formas de controlar el aumento de peso, como seguir una dieta sana y equilibrada y hacer ejercicio.
- movimientos que no puede controlar en su cara, lengua u otras partes del cuerpo (discinesia tardía). Estos pueden ser signos de una afección grave. Es posible que la discinesia tardía no desaparezca, incluso si deja de tomar SEROQUEL. La discinesia tardía también puede comenzar después de dejar de tomar SEROQUEL.
- disminución de la presión arterial (hipotensión ortostática), incluyendo mareos o desmayos causados por un cambio repentino en la frecuencia cardíaca y la presión arterial al levantarse demasiado rápido de una posición sentada o acostada.
- Aumento de la presión arterial en niños y adolescentes. Su proveedor de atención médica debe controlar la presión arterial en niños y adolescentes antes de comenzar con SEROQUEL y durante la terapia.
- recuento bajo de glóbulos blancos. Informe a su proveedor de atención médica lo antes posible si tiene fiebre, síntomas similares a los de la gripe o cualquier otra infección, ya que esto podría ser el resultado de un recuento muy bajo de glóbulos blancos. Su proveedor de atención médica puede verificar su nivel de glóbulos blancos para determinar si se necesita más tratamiento u otra acción.
- cataratas
- convulsiones
- pruebas tiroideas anormales. Su proveedor de atención médica puede realizar análisis de sangre para verificar su nivel de hormona tiroidea.
- aumentos en los niveles de prolactina
- somnolencia, somnolencia, sensación de cansancio, dificultad para pensar y realizar actividades normales
- aumento de la temperatura corporal
- dificultad para tragar
- dificultad para dormir o dificultad para permanecer dormido (insomnio), náuseas o vómitos si deja de tomar SEROQUEL repentinamente. Estos síntomas generalmente mejoran 1 semana después de comenzar a tenerlos.
Los efectos secundarios más comunes de SEROQUEL 50mg incluyen:
En adultos:
- somnolencia
- caída repentina de la presión arterial al ponerse de pie
- aumento de peso
- lentitud
- pruebas hepáticas anormales
- dolor de barriga
- boca seca
- mareo
- debilidad
- dolor abdominal
- estreñimiento
- dolor de garganta
En Niños y Adolescentes:
- somnolencia
- mareo
- fatiga
- náuseas
- boca seca
- aumento de peso
- Apetito incrementado
- vómitos
- latidos rápidos
Estos no son todos los posibles efectos secundarios de SEROQUEL. Para obtener más información, consulte a su proveedor de atención médica o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo conservar SEROQUEL 100mg?
- Guarde SEROQUEL 100 mg a temperatura ambiente, entre 20 °C y 25 °C (68 °F y 77 °F).
- Mantenga SEROQUEL y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de SEROQUEL
A veces, los medicamentos se recetan para fines distintos a los enumerados en la Guía del medicamento. No use SEROQUEL para una condición para la cual no fue recetado. No le dé SEROQUEL a otras personas, incluso si tienen los mismos síntomas que usted tiene. Puede que les haga daño.
Esta Guía del medicamento resume la información más importante sobre SEROQUEL. Si desea obtener más información, hable con su proveedor de atención médica. Puede pedirle a su farmacéutico o proveedor de atención médica información sobre SEROQUEL 100 mg que está escrita para profesionales de la salud.
Para obtener más información, vaya a www.SEROQUEL.com o llame al 1-800-236-9933.
¿Cuáles son los ingredientes de SEROQUEL 200mg?
Ingrediente activo: fumarato de quetiapina
Ingredientes inactivos: povidona, fosfato dicálcico dibásico dihidrato, celulosa microcristalina, glicolato de almidón sódico, lactosa monohidrato, estearato de magnesio, hipromelosa, polietilenglicol y dióxido de titanio. Los comprimidos de 25 mg contienen óxido férrico rojo y amarillo. Los comprimidos de 100 mg y 400 mg contienen únicamente óxido férrico amarillo.
Esta Guía del medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de EE. UU.
