Suprax 100mg, 200mg Cefixime Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Suprax 200mg y cómo se usa?
Suprax (cefixima) para suspensión oral es un antibiótico de cefalosporina que se usa para tratar muchos tipos diferentes de infecciones causadas por bacterias.
¿Cuáles son los efectos secundarios de Suprax?
Los efectos secundarios comunes de Suprax 100 mg incluyen:
- malestar/dolor estomacal,
- Diarrea,
- náuseas,
- estreñimiento,
- pérdida de apetito,
- gas,
- dolor de cabeza,
- mareo,
- ansiedad,
- somnolencia,
- aumento de la micción nocturna,
- nariz que moquea,
- dolor de garganta,
- tos, o
- picazón o secreción vaginal.
Informe a su médico si experimenta efectos secundarios raros pero muy graves de Suprax 200 mg, incluidos:
- dolor estomacal o abdominal intenso,
- náuseas o vómitos persistentes,
- ojos o piel amarillentos,
- orina oscura,
- cansancio inusual,
- nuevos signos de infección (p. ej., dolor de garganta persistente, fiebre),
- moretones o sangrado fácil,
- cambio en la cantidad de orina, o
- cambios mentales/anímicos (por ejemplo, confusión).
DESCRIPCIÓN
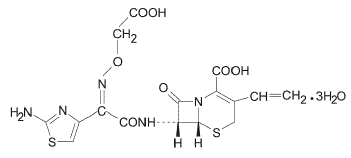
La cefixima es un antibacteriano cefalosporínico semisintético para administración oral. Químicamente, es (6R,7R)-7-[2-(2-Amino-4-tiazolil)glioxilamido]-8-oxo-3-vinil-5-tia-1-azabiciclo [4.2.0] oct-2 ácido -eno-2-carboxílico, 72-(Z)-[O-(carboximetil)oxima] trihidrato.
Peso molecular = 507,50 como trihidrato. La fórmula química es C16H15N5O7S2.3H2O
La fórmula estructural de la cefixima es:
- Los ingredientes inactivos contenidos en las tabletas USP de 400 mg de SUPRAX® (cefixima) son: fosfato de calcio dibásico, hipromelosa, monohidrato de lactosa, estearato de magnesio, celulosa microcristalina, polietilenglicol, almidón pregelatinizado, dióxido de titanio y triacetina.
- Los ingredientes inactivos contenidos en las cápsulas de SUPRAX® (cefixima) de 400 mg son: dióxido de silicio coloidal, crospovidona, hidroxipropilcelulosa de baja sustitución, estearato de magnesio y manitol. La cubierta de la cápsula contiene los siguientes ingredientes inactivos: óxido férrico negro, óxido férrico rojo, gelatina, hidróxido de potasio, propilenglicol, goma laca, laurilsulfato de sodio y dióxido de titanio.
- Los ingredientes inactivos contenidos en las tabletas masticables de SUPRAX® (cefixima) de 100 mg o 150 mg o 200 mg son: aspartame, dióxido de silicio coloidal, crospovidona, laca de aluminio FD&C Red # 40, hidroxipropilcelulosa de baja sustitución, estearato de magnesio, manitol, permaseal sabor fantasía, y sabor tutti frutti.
- Los ingredientes inactivos contenidos en SUPRAX® (cefixima) polvo para suspensión oral USP son: dióxido de silicio coloidal, benzoato de sodio, sabor a fresa, sucralosa (solo en concentración de 500 mg/5 mL), sacarosa y goma xantana.
INDICACIONES
Infecciones del tracto urinario no complicadas
SUPRAX está indicado en el tratamiento de pacientes adultos y pediátricos de seis meses de edad o más con infecciones del tracto urinario no complicadas causadas por aislados susceptibles de Escherichia coli y Proteus mirabilis.
Otitis media
SUPRAX está indicado en el tratamiento de pacientes adultos y pediátricos de seis meses de edad o más con otitis media causada por aislamientos susceptibles de Haemophilus influenzae, Moraxella catarrhalis y Streptococcus pyogenes. (La eficacia de Streptococcus pyogenes en este sistema de órganos se estudió en menos de 10 infecciones).
Nota
Para los pacientes con otitis media causada por Streptococcus pneumoniae, la respuesta general fue aproximadamente un 10 % menor para la cefixima que para el comparador [ver Estudios clínicos ].
faringitis y amigdalitis
SUPRAX está indicado en el tratamiento de adultos y pacientes pediátricos de seis meses de edad o mayores.con faringitis y amigdalitis causadas por aislamientos susceptibles de Streptococcus pyogenes. (Nota: la penicilina es el fármaco de elección habitual en el tratamiento de las infecciones por Streptococcus pyogenes. SUPRAX es generalmente eficaz en la erradicación de Streptococcus pyogenes de la nasofaringe; sin embargo, no se dispone de datos que establezcan la eficacia de SUPRAX 100 mg en la prevención posterior de la fiebre reumática). disponible.)
Exacerbaciones agudas de bronquitis crónica
SUPRAX 200 mg está indicado en el tratamiento de pacientes adultos y pediátricos de seis meses de edad o mayores con exacerbaciones agudas de bronquitis crónica causadas por aislamientos susceptibles de Streptococcus pneumoniae y Haemophilus influenzae.
Gonorrea no complicada (cervical/uretral)
SUPRAX 100 mg está indicado en el tratamiento de pacientes adultos y pediátricos de seis meses de edad o mayores con gonorrea no complicada (cervical/uretral) causada por aislados susceptibles de Neisseria gonorrhoeae (aislados productores de penicilinasa y no productores de penicilinasa).
Uso
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de SUPRAX 100 mg y otros medicamentos antibacterianos, SUPRAX 100 mg debe usarse solo para tratar infecciones que se haya comprobado o que se sospeche firmemente que son causadas por bacterias susceptibles. Cuando la información de cultivo y susceptibilidad esté disponible, se debe considerar al seleccionar o modificar la terapia antimicrobiana. En ausencia de tales datos, la epidemiología local y los patrones de susceptibilidad pueden contribuir a la selección empírica de la terapia.
DOSIFICACIÓN Y ADMINISTRACIÓN
Adultos
La dosis recomendada de cefixima es de 400 mg al día. Esto puede administrarse como una tableta o cápsula de 400 mg al día o la tableta de 400 mg puede dividirse y administrarse como media tableta cada 12 horas. Para el tratamiento de infecciones gonocócicas cervicales/uretrales no complicadas, se recomienda una dosis oral única de 400 mg. La cápsula y la tableta se pueden administrar sin importar la comida.
En el tratamiento de infecciones por Streptococcus pyogenes se debe administrar una dosis terapéutica de cefixima durante al menos 10 días.
Pacientes pediátricos (6 meses o más)
La dosis recomendada es de 8 mg/kg/día de suspensión. Esto puede administrarse como una sola dosis diaria o puede administrarse en dos dosis divididas, como 4 mg/kg cada 12 horas.
Nota
Se ha determinado una dosis sugerida para cada rango de peso pediátrico. Consulte la Tabla 1. Asegúrese de que todos los pedidos que especifican una dosis en mililitros incluyan una concentración, porque SUPRAX para suspensión oral está disponible en tres concentraciones diferentes (100 mg/5 ml, 200 mg/5 ml y 500 mg/5 ml).
Los niños que pesen más de 45 kg o mayores de 12 años deben ser tratados con la dosis recomendada para adultos. Las tabletas masticables de SUPRAX (cefixima) deben masticarse o triturarse antes de tragarlas.
La otitis media debe tratarse con las tabletas masticables o la suspensión. Los ensayos clínicos de otitis media se realizaron con las tabletas masticables o la suspensión, y las tabletas masticables o la suspensión dieron como resultado niveles máximos en sangre más altos que la tableta cuando se administraron en la misma dosis.
Por lo tanto, el comprimido o la cápsula no deben sustituirse por los comprimidos masticables o la suspensión en el tratamiento de la otitis media [ver FARMACOLOGÍA CLÍNICA ].
En el tratamiento de infecciones por Streptococcus pyogenes se debe administrar una dosis terapéutica de cefixima durante al menos 10 días.
Insuficiencia renal
SUPRAX 200 mg puede administrarse en presencia de insuficiencia renal. Se puede emplear una dosis y un programa normales en pacientes con depuración de creatinina de 60 ml/min o más. Consulte la Tabla 2 para conocer los ajustes de dosis para adultos con insuficiencia renal. Ni la hemodiálisis ni la diálisis peritoneal eliminan cantidades significativas de fármaco del organismo.
Instrucciones de reconstitución para suspensión oral
Después de la reconstitución, la suspensión puede conservarse durante 14 días a temperatura ambiente o en refrigeración, sin pérdida significativa de potencia. Mantener bien cerrado. Agitar bien antes de usar. Deseche la porción no utilizada después de 14 días.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
SUPRAX está disponible para administración oral en las siguientes formas de dosificación y concentraciones:
- Los comprimidos recubiertos con película proporcionan 400 mg de cefixima como trihidrato. Estos son comprimidos recubiertos con película, de color blanco a blanquecino, con forma de cápsula, con bordes biselados y una ranura dividida en cada lado. La tableta tiene grabado "SUPRAX" en un lado y "LUPIN" en el otro lado.
- Las cápsulas aportan 400 mg de cefixima como trihidrato. Estas son cápsulas de tamaño “00EL” con tapa rosa opaca y cuerpo rosa opaco con “LU” en la tapa y “U43” en el cuerpo en tinta negra. Las cápsulas contienen polvo granular blanco a blanco amarillento.
- Las tabletas masticables proporcionan 100 mg o 150 mg o 200 mg de cefixima como trihidrato. La tableta de 100 mg es una tableta rosa, redonda, grabada con "SUPRAX 100" en un lado y "LUPIN" en el otro lado. La tableta de 150 mg es una tableta rosa, redonda, grabada con "SUPRAX 150" en un lado y "LUPIN" en el otro lado. La tableta de 200 mg es una tableta rosa, redonda, grabada con "SUPRAX 200" en un lado y "LUPIN" en el otro lado.
- El polvo para suspensión oral, cuando se reconstituye, proporciona 100 mg/5 ml o 200 mg/5 ml o 500 mg/5 ml de cefixima como trihidrato. Para 100 mg/5 mL y 200 mg/5 mL, el polvo tiene un color blanquecino a amarillo pálido y tiene sabor a fresa. Para 500 mg/5 mL, el polvo tiene un color entre blanquecino y crema y tiene sabor a fresa.
Almacenamiento y manipulación
SUPRAX® está disponible para administración oral en las siguientes formas de dosificación, concentraciones y paquetes que se enumeran en la siguiente tabla:
Fabricado por: Lupin Limited Mandideep 462 046 India. Revisado: marzo de 2018.
EFECTOS SECUNDARIOS
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Las reacciones adversas observadas con más frecuencia en los ensayos de EE. UU. de la formulación en tabletas fueron eventos gastrointestinales, que se informaron en el 30 % de los pacientes adultos con el régimen de dos o una vez al día. El cinco por ciento (5%) de los pacientes en los ensayos clínicos de EE. UU. interrumpieron la terapia debido a reacciones adversas relacionadas con el medicamento. Las reacciones adversas individuales incluyeron diarrea 16 %, heces blandas o frecuentes 6 %, dolor abdominal 3 %, náuseas 7 %, dispepsia 3 % y flatulencia 4 %. La incidencia de reacciones adversas gastrointestinales, incluidas diarrea y heces blandas, en pacientes pediátricos que recibieron la suspensión fue comparable a la incidencia observada en pacientes adultos que recibieron tabletas.
Experiencia posterior a la comercialización
Se informaron las siguientes reacciones adversas después del uso posterior a la aprobación de cefixima. Las tasas de incidencia fueron menos de 1 en 50 (menos del 2%).
Gastrointestinal
En los ensayos clínicos se identificaron varios casos de colitis pseudomembranosa documentada. La aparición de los síntomas de la colitis pseudomembranosa puede ocurrir durante o después del tratamiento.
Reacciones hipersensibles
Reacciones anafilácticas/anafilactoides (incluidos shock y muertes), erupciones cutáneas, urticaria, fiebre medicamentosa, prurito, angioedema y edema facial. Se han informado eritema multiforme, síndrome de Stevens-Johnson y reacciones similares a la enfermedad del suero.
Hepático
elevaciones transitorias de SGPT, SGOT, fosfatasa alcalina, hepatitis, ictericia.
Renal
Elevaciones transitorias de BUN o creatinina, insuficiencia renal aguda.
Sistema nervioso central
Dolores de cabeza, mareos, convulsiones.
Sistema hemico y linfatico
Trombocitopenia transitoria, leucopenia, neutropenia, prolongación del tiempo de protrombina, LDH elevada, pancitopenia, agranulocitosis y eosinofilia.
Pruebas de laboratorio anormales
Hiperbilirrubinemia.
Otras reacciones adversas
Prurito genital, vaginitis, candidiasis, necrólisis epidérmica tóxica.
Reacciones adversas notificadas para medicamentos de la clase de las cefalosporinas
Reacciones alérgicas, superinfección, disfunción renal, nefropatía tóxica, disfunción hepática incluyendo colestasis, anemia aplásica, anemia hemolítica, hemorragia y colitis.
Se ha implicado a varias cefalosporinas en el desencadenamiento de convulsiones, particularmente en pacientes con insuficiencia renal cuando no se redujo la dosis [ver DOSIFICACIÓN Y ADMINISTRACIÓN ver SOBREDOSIS ]. Si se presentan convulsiones asociadas con la terapia con medicamentos, se debe suspender el medicamento. La terapia anticonvulsiva puede ser dada si está clínicamente indicada.
INTERACCIONES CON LA DROGAS
Carbamazepina
Se han informado niveles elevados de carbamazepina en la experiencia posterior a la comercialización cuando se administra cefixima de manera concomitante. La monitorización del fármaco puede ser de ayuda para detectar alteraciones en las concentraciones plasmáticas de carbamazepina.
warfarina y anticoagulantes
Se ha notificado aumento del tiempo de protrombina, con o sin hemorragia clínica, cuando se administra cefixima de forma concomitante.
Interacciones entre medicamentos y pruebas de laboratorio
Una reacción falsa positiva para cetonas en la orina puede ocurrir con pruebas que usan nitroprusiato pero no con aquellas que usan nitroferricianuro.
La administración de cefixima puede dar como resultado una reacción falsa positiva de glucosa en la orina usando Clinitest®, solución de Benedict o solución de Fehling. Se recomienda utilizar pruebas de glucosa basadas en reacciones enzimáticas de glucosa oxidasa (como Clinistix® o TesTape®). Se ha informado una prueba de Coombs directa positiva falsa durante el tratamiento con otras cefalosporinas; por lo tanto, debe reconocerse que una prueba de Coombs positiva puede deberse a la droga.
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Reacciones hipersensibles
Se han informado reacciones anafilácticas/anafilactoides (incluyendo shock y muertes) con el uso de cefixima.
Antes de iniciar la terapia con SUPRAX, se debe realizar una investigación cuidadosa para determinar si el paciente ha tenido reacciones previas de hipersensibilidad a las cefalosporinas, penicilinas u otras drogas. Si se va a administrar este producto a pacientes sensibles a la penicilina, se debe tener precaución porque la hipersensibilidad cruzada entre los fármacos antibacterianos betalactámicos se ha documentado claramente y puede ocurrir hasta en un 10 % de los pacientes con antecedentes de alergia a la penicilina. Si ocurre una reacción alérgica a SUPRAX 100 mg, suspenda el medicamento.
Diarrea asociada a Clostridium difficile
Se ha informado diarrea asociada a Clostridium difficile (CDAD) con el uso de casi todos los agentes antibacterianos, incluido SUPRAX 200 mg, y puede variar en gravedad desde diarrea leve hasta colitis fatal. El tratamiento con agentes antibacterianos altera la flora normal del colon y conduce al crecimiento excesivo de C. difficile.
C. difficile produce toxinas A y B que contribuyen al desarrollo de CDAD. Los aislamientos de C. difficile que producen hipertoxina causan una mayor morbilidad y mortalidad, ya que estas infecciones pueden ser refractarias a la terapia antimicrobiana y pueden requerir colectomía. Se debe considerar CDAD en todos los pacientes que presentan diarrea después del uso de medicamentos antibacterianos. Es necesaria una cuidadosa historia clínica ya que se ha informado que la CDAD ocurre más de dos meses después de la administración de agentes antibacterianos.
Si se sospecha o se confirma CDAD, es posible que se deba suspender el uso continuo de medicamentos antibacterianos no dirigidos contra C. difficile. Se debe instituir el manejo adecuado de líquidos y electrolitos, la suplementación con proteínas, el tratamiento farmacológico antibacteriano de C. difficile y la evaluación quirúrgica según esté clínicamente indicado.
Ajuste de dosis en insuficiencia renal
La dosis de SUPRAX 100 mg debe ajustarse en pacientes con insuficiencia renal, así como en aquellos sometidos a diálisis peritoneal ambulatoria continua (CAPD) y hemodiálisis (HD). Los pacientes en diálisis deben ser monitoreados cuidadosamente [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Efectos de coagulación
Las cefalosporinas, incluido SUPRAX 200 mg, pueden estar asociadas con una caída en la actividad de la protrombina. Los que están en riesgo incluyen pacientes con insuficiencia renal o hepática, o estado nutricional deficiente, así como pacientes que reciben un ciclo prolongado de terapia antimicrobiana y pacientes previamente estabilizados con terapia anticoagulante. Se debe controlar el tiempo de protrombina en pacientes de riesgo y se debe administrar vitamina K exógena según lo indicado.
Desarrollo de bacterias resistentes a los medicamentos
Prescribir SUPRAX (cefixima) en ausencia de una infección bacteriana comprobada o fuertemente sospechada es poco probable que brinde beneficios al paciente y aumenta el riesgo de desarrollo de bacterias resistentes a los medicamentos.
Riesgo en pacientes con fenilcetonuria
La fenilalanina puede ser dañina para los pacientes con fenilcetonuria (PKU). Las tabletas masticables SUPRAX de 200 mg contienen aspartamo, una fuente de fenilalanina. Cada concentración de 100 mg, 150 mg y 200 mg contiene 3,3 mg, 5 mg y 6,7 mg de fenilalanina, respectivamente. Antes de recetar tabletas masticables SUPRAX a un paciente con PKU, considere la cantidad diaria combinada de fenilalanina de todas las fuentes, incluidas las tabletas masticables SUPRAX de 200 mg.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
No se han realizado estudios de por vida en animales para evaluar el potencial carcinogénico. La cefixima no causó mutaciones puntuales en bacterias o células de mamíferos, daño en el ADN o daño en los cromosomas in vitro y no mostró potencial clastogénico in vivo en la prueba de micronúcleos de ratón. En ratas, la fertilidad y el rendimiento reproductivo no se vieron afectados por la cefixima en dosis de hasta 25 veces la dosis terapéutica para adultos.
Uso en poblaciones específicas
El embarazo
Embarazo Categoría B
Se han realizado estudios de reproducción en ratones y ratas a dosis de hasta 40 veces la dosis humana y no han revelado evidencia de daño al feto debido a la cefixima. No existen estudios adecuados y bien controlados en mujeres embarazadas. Debido a que los estudios de reproducción en animales no siempre predicen la respuesta humana, este medicamento debe usarse durante el embarazo solo si es claramente necesario.
Trabajo y entrega
No se ha estudiado la cefixima para su uso durante el trabajo de parto y el parto. El tratamiento solo debe administrarse si es claramente necesario.
Madres lactantes
No se sabe si la cefixima se excreta en la leche humana. Se debe considerar la interrupción temporal de la lactancia durante el tratamiento con este medicamento.
Uso pediátrico
No se ha establecido la seguridad y eficacia de la cefixima en niños menores de seis meses. La incidencia de reacciones adversas gastrointestinales, incluidas diarrea y heces blandas, en los pacientes pediátricos que recibieron la suspensión, fue comparable a la incidencia observada en pacientes adultos que recibieron comprimidos.
Uso geriátrico
Los estudios clínicos no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes. Otra experiencia clínica informada no ha identificado diferencias en las respuestas entre los ancianos y los pacientes más jóvenes. Un estudio farmacocinético en ancianos detectó diferencias en los parámetros farmacocinéticos [ver FARMACOLOGÍA CLÍNICA ]. Estas diferencias fueron pequeñas y no indican la necesidad de ajustar la dosis del fármaco en los ancianos.
Insuficiencia renal
La dosis de cefixima debe ajustarse en pacientes con insuficiencia renal, así como en aquellos sometidos a diálisis peritoneal ambulatoria continua (CAPD) y hemodiálisis (HD). Los pacientes en diálisis deben ser monitoreados cuidadosamente [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
SOBREDOSIS
Puede estar indicado el lavado gástrico; de lo contrario, no existe un antídoto específico. La cefixima no se elimina en cantidades significativas de la circulación mediante hemodiálisis o diálisis peritoneal. Las reacciones adversas en un pequeño número de voluntarios adultos sanos que recibieron dosis únicas de hasta 2 g de cefixima no difirieron del perfil observado en pacientes tratados con las dosis recomendadas.
CONTRAINDICACIONES
Suprax (cefixima) está contraindicado en pacientes con alergia conocida a la cefixima u otras cefalosporinas.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
La cefixima es un fármaco antibacteriano de cefalosporina semisintético [ver Microbiología ].
Farmacocinética
Los comprimidos masticables de SUPRAX 200 mg son bioequivalentes a la suspensión oral.
Los comprimidos y la suspensión de SUPRAX de 200 mg, administrados por vía oral, se absorben en un 40 % a 50 %, ya sea que se administren con o sin alimentos; sin embargo, el tiempo hasta la absorción máxima aumenta aproximadamente 0,8 horas cuando se administra con alimentos. Una sola tableta de cefixima de 200 mg produce una concentración sérica máxima promedio de aproximadamente 2 mcg/mL (rango de 1 a 4 mcg/mL); una sola tableta de 400 mg produce una concentración máxima promedio de aproximadamente 3,7 mcg/mL (rango de 1,3 a 7,7 mcg/mL). La suspensión oral produce concentraciones máximas promedio de aproximadamente un 25 % a un 50 % más altas que las tabletas, cuando se prueba en voluntarios adultos normales. Dosis de 200 mg de suspensión oral producen concentraciones máximas promedio de 3 mcg/mL (rango de 1 a 4,5 mcg/mL) y 4,6 mcg/mL (rango de 1,9 a 7,7 mcg/mL), respectivamente, cuando se prueban en voluntarios adultos normales . El área bajo la curva de tiempo versus concentración (AUC) es mayor en aproximadamente un 10 % a un 25 % con la suspensión oral que con la tableta después de dosis de 100 a 400 mg, cuando se prueba en voluntarios adultos normales. Este aumento de la absorción debe tenerse en cuenta si la suspensión oral se sustituye por la tableta. Debido a la falta de bioequivalencia, las tabletas no deben sustituirse por suspensión oral en el tratamiento de la otitis media [ver DOSIFICACIÓN Y ADMINISTRACIÓN ]. No se han realizado estudios cruzados de tableta versus suspensión en niños.
La cápsula de 400 mg es bioequivalente a la tableta de 400 mg en ayunas. Sin embargo, los alimentos reducen la absorción después de la administración de la cápsula en aproximadamente un 15 % según el AUC y un 25 % según la Cmax.
Las concentraciones séricas máximas ocurren entre 2 y 6 horas después de la administración oral de una sola tableta de 200 mg, una sola tableta de 400 mg o 400 mg de suspensión de cefixima. Las concentraciones séricas máximas ocurren entre 2 y 5 horas después de una sola administración de 200 mg de suspensión. Las concentraciones séricas máximas ocurren entre 3 y 8 horas después de la administración oral de una sola cápsula de 400 mg.
Distribución
La unión a proteínas séricas es independiente de la concentración con una fracción unida de aproximadamente el 65%. En un estudio de dosis múltiples realizado con una formulación de investigación que es menos biodisponible que la tableta o la suspensión, hubo poca acumulación de fármaco en suero u orina después de la dosificación durante 14 días. No se dispone de datos adecuados sobre los niveles de cefixima en LCR.
Metabolismo y excreción
No hay evidencia de metabolismo de cefixima in vivo. Aproximadamente el 50% de la dosis absorbida se excreta sin cambios en la orina en 24 horas. En estudios con animales, se observó que la cefixima también se excreta en la bilis en más del 10 % de la dosis administrada. La vida media sérica de la cefixima en sujetos sanos es independiente de la forma de dosificación y tiene un promedio de 3 a 4 horas, pero puede variar hasta 9 horas en algunos voluntarios normales.
Poblaciones Especiales
Geriatría
Las AUC promedio en estado estacionario en pacientes de edad avanzada son aproximadamente un 40 % más altas que las AUC promedio en otros adultos sanos. Las diferencias en los parámetros farmacocinéticos entre 12 sujetos jóvenes y 12 ancianos que recibieron 400 mg de cefixima una vez al día durante 5 días se resumen a continuación:
Sin embargo, estos aumentos no fueron clínicamente significativos [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Insuficiencia renal
En sujetos con deterioro moderado de la función renal (aclaramiento de creatinina de 20 a 40 ml/min), la vida media sérica promedio de cefixima se prolonga a 6,4 horas. En caso de insuficiencia renal grave (aclaramiento de creatinina de 5 a 20 ml/min), la vida media aumentó a un promedio de 11,5 horas. El fármaco no se elimina significativamente de la sangre mediante hemodiálisis o diálisis peritoneal. Sin embargo, un estudio indicó que con dosis de 400 mg, los pacientes sometidos a hemodiálisis tienen perfiles sanguíneos similares a los sujetos con aclaramientos de creatinina de 21 a 60 ml/min.
Microbiología
Mecanismo de acción
Al igual que con otras cefalosporinas, la acción bactericida de la cefixima resulta de la inhibición de la síntesis de la pared celular. La cefixima es estable en presencia de ciertas enzimas beta-lactamasas. Como resultado, ciertos organismos resistentes a las penicilinas y algunas cefalosporinas debido a la presencia de betalactamasas pueden ser sensibles a la cefixima.
Resistencia
La resistencia a la cefixima en aislamientos de Haemophilus influenzae y Neisseria gonorrhoeae se asocia con mayor frecuencia con alteraciones en las proteínas de unión a penicilina (PBP). La cefixima puede tener una actividad limitada contra Enterobacteriaceae productoras de betalactamasas de espectro extendido (BLEE). Las especies de Pseudomonas, las especies de Enterococcus, las cepas de estreptococos del grupo D, Listeria monocytogenes, la mayoría de las cepas de estafilococos (incluidas las cepas resistentes a la meticilina), la mayoría de las cepas de las especies de Enterobacter, la mayoría de las cepas de Bacteroides fragilis y la mayoría de las cepas de las especies de Clostridium son resistentes a la cefixima.
Actividad antimicrobiana
Se ha demostrado que la cefixima es activa contra la mayoría de los aislados de los siguientes microorganismos, tanto in vitro como en infecciones clínicas [ver INDICACIONES ].
bacterias grampositivas
Streptococcus pneumoniae Streptococcus pyogenes
Bacterias Gram-negativo
Escherichia coli Haemophilus influenzae Moraxella catarrhalis Neisseria gonorrhoeae Proteus mirabilis
Los siguientes datos in vitro están disponibles, pero se desconoce su importancia clínica. Al menos el 90 por ciento de las siguientes bacterias exhiben una concentración inhibitoria mínima (MIC) in vitro menor o igual al punto de corte susceptible para cefixima contra aislados de género o grupo de organismos similares. Sin embargo, la eficacia de la cefixima en el tratamiento de infecciones clínicas causadas por estas bacterias no se ha establecido en ensayos clínicos adecuados y bien controlados.
bacterias grampositivas
Streptococcus agalactiae
Bacterias Gram-negativo
Citrobacter amalonaticus Citrobacter diversus Haemophilus parainfluenzae Klebsiella oxytoca Klebsiella pneumoniae Pasteurella multocida Proteus vulgaris Especies de Providencia Especies de Salmonella Serratia marcescens Especies de Shigella
Pruebas de susceptibilidad
Para obtener información específica sobre los criterios interpretativos de las pruebas de susceptibilidad y los métodos de prueba asociados y los estándares de control de calidad reconocidos por la FDA para este medicamento, consulte: https://www.fda.gov/STIC.
Estudios clínicos
Se realizaron ensayos clínicos comparativos de otitis media en casi 400 niños entre las edades de 6 meses a 10 años. Se aisló Streptococcus pneumoniae en el 47% de los pacientes, Haemophilus influenzae en el 34%, Moraxella catarrhalis en el 15% y S. pyogenes en el 4%.
La tasa de respuesta general de Streptococcus pneumoniae a la cefixima fue aproximadamente un 10 % más baja y la de Haemophilus influenzae o Moraxella catarrhalis aproximadamente un 7 % más alta (12 % cuando se incluyen cepas aisladas de H. influenzae positivas para betalactamasa) que las tasas de respuesta de estos organismos a los fármacos de control activo.
En estos estudios, los pacientes fueron aleatorizados y tratados con cefixima en regímenes de dosis de 4 mg/kg dos veces al día u 8 mg/kg una vez al día, o con un comparador. Sesenta y nueve a 70% de los pacientes en cada grupo tuvieron resolución de signos y síntomas de otitis media cuando se evaluaron de 2 a 4 semanas después del tratamiento, pero se encontró derrame persistente en 15% de los pacientes. Cuando se evaluó al finalizar la terapia, se consideró que el 17 % de los pacientes que recibieron cefixima y el 14 % de los pacientes que recibieron fármacos comparativos eficaces (18 % incluidos los pacientes que tenían Haemophilus influenzae resistente al fármaco de control y que recibieron el fármaco antibacteriano de control) fracasos del tratamiento. Para el seguimiento de 2 a 4 semanas, un total de 30% a 31% de los pacientes tenían evidencia de fracaso del tratamiento o enfermedad recurrente.
Resultado bacteriológico de la otitis media de dos a cuatro semanas después de la terapia basado en la repetición del oído medio
INFORMACIÓN DEL PACIENTE
Aconseje a los pacientes que los medicamentos antibacterianos, incluida la cefixima, solo deben usarse para tratar infecciones bacterianas. No tratan infecciones virales (p. ej., el resfriado común). Cuando se receta cefixima para tratar una infección bacteriana, se debe informar a los pacientes que, aunque es común sentirse mejor al comienzo de la terapia, el medicamento debe tomarse exactamente como se indica. Omitir dosis o no completar el curso completo de la terapia puede: (1) disminuir la eficacia del tratamiento inmediato y (2) aumentar la probabilidad de que las bacterias desarrollen resistencia y no sean tratables con cefixima para suspensión oral o tabletas masticables de cefixima u otros medicamentos antibacterianos en el futuro.
Aconseje a los pacientes con fenilcetonuria que las tabletas masticables SUPRAX de 200 mg contienen aspartamo, una fuente de fenilalanina, de la siguiente manera: Cada tableta masticable SUPRAX contiene 3.3 mg, 5 mg y 6.7 mg de fenilalanina por cada 100 mg, 150 mg y 200 mg de concentración, respectivamente.
Advierta a los pacientes que la diarrea es un problema común causado por los medicamentos antibacterianos que generalmente desaparece cuando se suspende el medicamento antibacteriano. A veces, después de comenzar el tratamiento con medicamentos antibacterianos, los pacientes pueden desarrollar heces acuosas y sanguinolentas (con o sin calambres estomacales y fiebre) incluso dos o más meses después de haber tomado la última dosis del medicamento antibacteriano. Si esto ocurre, los pacientes deben comunicarse con su médico lo antes posible.
