Sustiva 200mg, 600mg Efavirenz Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Sustiva 600mg y cómo se usa?
Sustiva es un medicamento recetado que se usa para tratar los síntomas de la infección por VIH. Sustiva se puede usar solo o con otros medicamentos.
Sustiva pertenece a una clase de medicamentos llamados INNTR contra el VIH.
No se sabe si Sustiva es seguro y efectivo en niños menores de 3 meses de edad.
¿Cuáles son los posibles efectos secundarios de Sustiva?
Sustiva puede causar efectos secundarios graves que incluyen:
- urticaria,
- respiración dificultosa,
- hinchazón de la cara, los labios, la lengua o la garganta,
- fiebre,
- dolor de garganta,
- ojos irritados,
- dolor de piel,
- erupción cutánea roja o morada con ampollas y descamación,
- embargo,
- alucinaciones,
- problemas para concentrarse,
- dificultad para hablar o moverse (puede ocurrir meses o años después de comenzar a tomar el medicamento),
- mareo,
- somnolencia,
- confusión,
- problemas para concentrarse,
- sueños extraños,
- insomnio,
- problemas con el habla,
- dificultades con su equilibrio o movimiento muscular,
- ansiedad,
- paranoia,
- comportamiento inusual,
- sentirse triste o sin esperanza,
- pensamientos suicidas,
- náuseas,
- dolor de estómago,
- pérdida de apetito,
- orina oscura,
- heces de color arcilla,
- coloración amarillenta de la piel o los ojos (ictericia),
- sudores nocturnos,
- glándulas inflamadas,
- herpes labial,
- tos,
- sibilancias,
- Diarrea,
- pérdida de peso,
- dificultad para tragar,
- problemas con el equilibrio o el movimiento de los ojos,
- debilidad,
- sensación de picazón,
- hinchazón en el cuello o la garganta (agrandamiento de la tiroides),
- cambios menstruales y
- impotencia
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Sustiva incluyen:
- náuseas,
- vómitos,
- mareo,
- somnolencia,
- problemas para concentrarse,
- sarpullido,
- dolor de cabeza,
- cansancio,
- problemas para dormir (insomnio),
- sueños extraños y
- cambios en la forma o ubicación de la grasa corporal (especialmente en los brazos, las piernas, la cara, el cuello, los senos y la cintura)
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Sustiva. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
SUSTIVA® (efavirenz) es un inhibidor de la transcriptasa inversa (NNRTI) no nucleósido específico del VIH-1. El efavirenz se describe químicamente como (S)-6-cloro-4-(ciclopropiletinil)-1,4-dihidro4-(trifluorometil)-2H-3,1-benzoxazin-2-ona. Su fórmula empírica es C14H9ClF3NO2 y su fórmula estructural es:
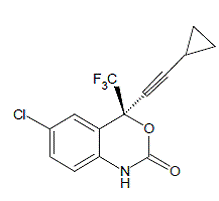
Efavirenz es un polvo cristalino de color blanco a ligeramente rosado con una masa molecular de 315,68. Es prácticamente insoluble en agua (
Cápsulas
SUSTIVA está disponible en cápsulas para administración oral que contienen 50 mg o 200 mg de efavirenz y los siguientes ingredientes inactivos: lactosa monohidrato, estearato de magnesio, lauril sulfato de sodio y glicolato de almidón de sodio. La cubierta de la cápsula contiene los siguientes ingredientes inactivos y colorantes: gelatina, laurilsulfato de sodio, dióxido de titanio y/u óxido de hierro amarillo. Las cubiertas de las cápsulas también pueden contener dióxido de silicio. Las cápsulas están impresas con tinta que contiene carmín 40 azul, FD&C Blue No. 2 y dióxido de titanio.
tabletas
SUSTIVA 600 mg está disponible en comprimidos recubiertos con película para administración oral que contienen 600 mg de efavirenz y los siguientes ingredientes inactivos: croscarmelosa sódica, hidroxipropilcelulosa, lactosa monohidrato, estearato de magnesio, celulosa microcristalina y laurilsulfato de sodio. El revestimiento de la película contiene Opadry Yellow y Opadry Clear. Los comprimidos están pulidos con cera de carnauba e impresos con tinta violeta, Opacode WB.
INDICACIONES
SUSTIVA® (efavirenz) en combinación con otros agentes antirretrovirales está indicado para el tratamiento de la infección por el virus de la inmunodeficiencia humana tipo 1 (VIH-1) en adultos y en pacientes pediátricos de al menos 3 meses de edad y con un peso mínimo de 3,5 kg.
DOSIFICACIÓN Y ADMINISTRACIÓN
función hepática
Controle la función hepática antes y durante el tratamiento con SUSTIVA [ver ADVERTENCIAS Y PRECAUCIONES ]. SUSTIVA 600 mg no se recomienda en pacientes con insuficiencia hepática moderada o grave (Child Pugh B o C) [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
Adultos
La dosis recomendada de SUSTIVA (efavirenz) es de 600 mg por vía oral, una vez al día, en combinación con un inhibidor de la proteasa y/o inhibidores de la transcriptasa inversa análogos de los nucleósidos (INTI). Se recomienda tomar SUSTIVA con el estómago vacío, preferiblemente a la hora de acostarse. El aumento de las concentraciones de efavirenz observado después de la administración de SUSTIVA 600 mg con alimentos puede conducir a un aumento en la frecuencia de reacciones adversas [ver FARMACOLOGÍA CLÍNICA ]. La dosificación a la hora de acostarse puede mejorar la tolerabilidad de los síntomas del sistema nervioso [ver ADVERTENCIAS Y PRECAUCIONES , REACCIONES ADVERSAS , y INFORMACIÓN DEL PACIENTE ]. Las cápsulas o tabletas de SUSTIVA deben tragarse intactas con líquido. Para los pacientes que no pueden tragar cápsulas o tabletas, se recomienda el método de administración de cápsulas rociadas [ver Método de administración por aspersión de cápsulas ].
Terapia antirretroviral concomitante
SUSTIVA debe administrarse en combinación con otros medicamentos antirretrovirales [ver INDICACIONES , ADVERTENCIAS Y PRECAUCIONES , INTERACCIONES CON LA DROGAS , y FARMACOLOGÍA CLÍNICA ].
Ajuste de dosis
Si SUSTIVA 200 mg se coadministra con voriconazol, la dosis de mantenimiento de voriconazol debe aumentarse a 400 mg cada 12 horas y la dosis de SUSTIVA 200 mg debe reducirse a 300 mg una vez al día utilizando la formulación en cápsulas (una cápsula de 200 mg y dos de 50 mg o seis cápsulas de 50 mg). mg cápsulas). Los comprimidos de SUSTIVA 600 mg no deben romperse. [ver INTERACCIONES CON LA DROGAS y FARMACOLOGÍA CLÍNICA .]
Si SUSTIVA se coadministra con rifampicina a pacientes que pesan 50 kg o más, se recomienda aumentar la dosis de SUSTIVA de 200 mg a 800 mg una vez al día [ver INTERACCIONES CON LA DROGAS y FARMACOLOGÍA CLÍNICA ].
Pacientes pediátricos
Se recomienda tomar SUSTIVA 600 mg con el estómago vacío, preferiblemente a la hora de acostarse. La Tabla 1 describe la dosis recomendada de SUSTIVA para pacientes pediátricos de 3 meses de edad o más y que pesan entre 3,5 kg y 40 kg [ver FARMACOLOGÍA CLÍNICA ]. La dosis recomendada de SUSTIVA para pacientes pediátricos que pesen 40 kg o más es de 600 mg una vez al día. Para los pacientes pediátricos que no pueden tragar las cápsulas, el contenido de la cápsula se puede administrar con una pequeña cantidad de comida o fórmula infantil usando el método de administración de cápsulas rociadas [ver Método de administración por aspersión de cápsulas ].
Método de administración por aspersión de cápsulas
Para pacientes pediátricos de al menos 3 meses y que pesen al menos 3,5 kg y adultos que no puedan tragar cápsulas o comprimidos, el contenido de la cápsula se puede administrar con una pequeña cantidad (1 a 2 cucharaditas) de comida. El uso de fórmula infantil para mezclar solo debe considerarse para aquellos bebés pequeños que no pueden consumir alimentos sólidos de manera confiable. Se debe indicar a los pacientes y cuidadores que abran la cápsula con cuidado para evitar el derrame o la dispersión del contenido de la cápsula en el aire. La cápsula debe sostenerse horizontalmente sobre un recipiente pequeño y girarse con cuidado para abrirla. Para los pacientes que pueden tolerar los alimentos sólidos, todo el contenido de la cápsula debe mezclarse suavemente con un alimento blando apropiado para su edad, como compota de manzana, mermelada de uva o yogur, en el recipiente pequeño. En el caso de los bebés pequeños que reciben la mezcla de fórmula infantil en cápsulas, se debe mezclar todo el contenido de la cápsula con 2 cucharaditas de fórmula infantil reconstituida a temperatura ambiente en un recipiente pequeño, revolviendo con cuidado con una cuchara pequeña y luego extrayendo la mezcla en un vaso de 10 mL jeringa dosificadora oral para administración. Después de la administración de la mezcla de alimento o fórmula de SUSTIVA, se debe agregar una pequeña cantidad adicional (aproximadamente 2 cucharaditas) de alimento o fórmula al recipiente de mezcla vacío, agitar para dispersar cualquier residuo de SUSTIVA restante y administrar al paciente. La mezcla de alimento o fórmula SUSTIVA debe administrarse dentro de los 30 minutos posteriores a la mezcla. No se deben consumir alimentos adicionales durante las 2 horas posteriores a la administración de SUSTIVA.
En el prospecto aprobado por la FDA para el paciente se proporcionan más instrucciones para el paciente sobre el método de administración de cápsulas rociadas (ver INFORMACIÓN DEL PACIENTE y INSTRUCCIONES DE USO ).
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Cápsulas
Las cápsulas de 200 mg son de color dorado, tienen impreso "SUSTIVA" en el reverso en el cuerpo y "200 mg" impreso en la tapa.
Las cápsulas de 50 mg son de color dorado y blanco, tienen impreso "SUSTIVA" en la tapa de color dorado y "50 mg" impreso al revés en el cuerpo blanco.
tabletas
Los comprimidos de 600 mg son comprimidos recubiertos con película, de forma capsular, de color amarillo, con “SUSTIVA” impreso en ambos lados.
Almacenamiento y manipulación
Cápsulas
Las cápsulas de SUSTIVA® (efavirenz) están disponibles de la siguiente manera:
Las cápsulas de 200 mg son de color dorado, tienen impreso “SUSTIVA” en el reverso en el cuerpo y “200 mg” impreso en la tapa.
Botellas de 90 - CDN 0056-0474-92
Las cápsulas de 50 mg son de color dorado y blanco, tienen impreso "SUSTIVA" en la tapa de color dorado y "50 mg" impreso al revés en el cuerpo blanco.
Botellas de 30 - CDN 0056-0470-30
tabletas
Las tabletas SUSTIVA® (efavirenz) están disponibles de la siguiente manera:
Los comprimidos de 600 mg son comprimidos recubiertos con película, de forma capsular, amarillos, con “SUSTIVA” impreso en ambos lados.
Botellas de 30 - CDN 0056-0510-30
Almacenamiento
Las cápsulas de SUSTIVA de 600 mg y las tabletas de SUSTIVA deben almacenarse a 25 °C (77 °F); excursiones permitidas a 15°C-30°C (59°F-86°F) [consulte Temperatura ambiente controlada por USP].
Distribuido por: Bristol-Myers Squibb Company Princeton, NJ 08543 EE. UU. Revisado: oct 2020
EFECTOS SECUNDARIOS
Las reacciones adversas más significativas observadas en pacientes tratados con SUSTIVA son:
- síntomas psiquiátricos [ver ADVERTENCIAS Y PRECAUCIONES ],
- síntomas del sistema nervioso [ver ADVERTENCIAS Y PRECAUCIONES ],
- sarpullido [ver ADVERTENCIAS Y PRECAUCIONES ].
- hepatotoxicidad [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en ensayos clínicos
Debido a que los estudios clínicos se realizan en condiciones muy variables, las tasas de reacciones adversas notificadas no pueden compararse directamente con las tasas de otros estudios clínicos y es posible que no reflejen las tasas observadas en la práctica clínica.
Reacciones adversas en adultos
Las reacciones adversas más comunes (>5 % en cualquiera de los grupos de tratamiento con efavirenz) de gravedad al menos moderada entre los pacientes del Estudio 006 tratados con SUSTIVA 200 mg en combinación con zidovudina/lamivudina o indinavir fueron erupción cutánea, mareos, náuseas, dolor de cabeza, fatiga, insomnio, y vómitos
Las reacciones adversas clínicas seleccionadas de intensidad moderada o grave observadas en ≥2 % de los pacientes tratados con SUSTIVA en dos ensayos clínicos controlados se presentan en la Tabla 2.
Se ha informado pancreatitis, aunque no se ha establecido una relación causal con efavirenz. Se observaron aumentos asintomáticos en los niveles de amilasa sérica en un número significativamente mayor de pacientes tratados con efavirenz 600 mg que en los pacientes control (ver Anomalías de laboratorio ).
Síntomas del sistema nervioso
Para 1008 pacientes tratados con regímenes que contenían SUSTIVA y 635 pacientes tratados con un régimen de control en ensayos controlados, la Tabla 3 enumera la frecuencia de los síntomas de diferentes grados de gravedad y brinda las tasas de interrupción para uno o más de los siguientes síntomas del sistema nervioso: mareos, insomnio, problemas de concentración, somnolencia, sueños anormales, euforia, confusión, agitación, amnesia, alucinaciones, estupor, pensamientos anormales y despersonalización [ver ADVERTENCIAS Y PRECAUCIONES ]. Las frecuencias de los síntomas específicos del sistema nervioso central y periférico se proporcionan en la Tabla 2.
Síntomas psiquiátricos
Se han informado experiencias adversas psiquiátricas graves en pacientes tratados con SUSTIVA. En ensayos controlados, los síntomas psiquiátricos observados con una frecuencia superior al 2 % entre los pacientes tratados con SUSTIVA 600 mg o regímenes de control, respectivamente, fueron depresión (19 %, 16 %), ansiedad (13 %, 9 %) y nerviosismo (7 %). , 2%).
Sarpullido
En ensayos clínicos controlados, la frecuencia de erupción cutánea (todos los grados, independientemente de la causalidad) fue del 26 % para 1008 adultos tratados con regímenes que contenían SUSTIVA 200 mg y del 17 % para 635 adultos tratados con un régimen de control. La mayoría de los informes de erupción cutánea fueron de gravedad leve o moderada. La frecuencia de erupción cutánea de Grado 3 fue del 0,8 % para los pacientes tratados con SUSTIVA y del 0,3 % para los grupos de control, y la frecuencia de erupción cutánea de Grado 4 fue del 0,1 % para SUSTIVA y 0 para los grupos de control. Las tasas de interrupción como resultado de la erupción fueron del 1,7 % para los pacientes tratados con SUSTIVA y del 0,3 % para los grupos de control [ver ADVERTENCIAS Y PRECAUCIONES ].
La experiencia con SUSTIVA en pacientes que descontinuaron otros agentes antirretrovirales de la clase NNRTI es limitada. Diecinueve pacientes que suspendieron la nevirapina debido a una erupción han sido tratados con SUSTIVA. Nueve de estos pacientes desarrollaron un sarpullido de leve a moderado mientras recibían el tratamiento con SUSTIVA, y dos de estos pacientes lo suspendieron debido al sarpullido.
Anomalías de laboratorio
En la Tabla 4 se presentan anomalías de laboratorio de Grado 3-4 seleccionadas informadas en ≥2 % de los pacientes tratados con SUSTIVA en dos ensayos clínicos.
Pacientes Coinfectados con Hepatitis B o C
Las pruebas de función hepática deben controlarse en pacientes con antecedentes de hepatitis B y/o C. En el conjunto de datos a largo plazo del Estudio 006, 137 pacientes tratados con regímenes que contenían SUSTIVA (duración media de la terapia, 68 semanas) y 84 tratados con un régimen de control (mediana de duración, 56 semanas) fueron seropositivos en la detección de hepatitis B (positivo para antígeno de superficie) y/o C (anticuerpo positivo para hepatitis C). Entre estos pacientes coinfectados, se desarrollaron elevaciones de AST a más de cinco veces el LSN en el 13 % de los pacientes en los brazos de SUSTIVA y en el 7 % de los del brazo de control, y se desarrollaron elevaciones de ALT a más de cinco veces el LSN en el 20 % de los pacientes en los brazos SUSTIVA y 7% de los pacientes en el brazo control. Entre los pacientes coinfectados, el 3 % de los tratados con regímenes que contenían SUSTIVA y el 2 % en el grupo de control interrumpieron el estudio debido a trastornos hepáticos o del sistema biliar [ver ADVERTENCIAS Y PRECAUCIONES ].
lípidos
Se han observado aumentos desde el inicio en el colesterol total del 10 al 20 % en algunos voluntarios no infectados que recibieron SUSTIVA. En pacientes tratados con SUSTIVA + zidovudina + lamivudina, se observaron aumentos desde el inicio en el colesterol total y HDL sin ayuno de aproximadamente 20% y 25%, respectivamente. En pacientes tratados con SUSTIVA + indinavir, se observaron aumentos desde el inicio en el colesterol y HDL sin ayunar de aproximadamente 40% y 35%, respectivamente. Se informaron niveles de colesterol total sin ayuno ≥240 mg/dl y ≥300 mg/dl en el 34 % y el 9 %, respectivamente, de los pacientes tratados con SUSTIVA + zidovudina + lamivudina; 54% y 20%, respectivamente, de pacientes tratados con SUSTIVA + indinavir; y 28% y 4%, respectivamente, de pacientes tratados con indinavir + zidovudina + lamivudina. Los efectos de SUSTIVA 600 mg sobre los triglicéridos y LDL en este estudio no se caracterizaron bien ya que las muestras se tomaron de pacientes que no estaban en ayunas. Se desconoce el significado clínico de estos hallazgos [ver ADVERTENCIAS Y PRECAUCIONES ].
Reacciones adversas en pacientes pediátricos
Debido a que los estudios clínicos se realizan en condiciones muy variables, las tasas de reacciones adversas notificadas no pueden compararse directamente con las tasas de otros estudios clínicos y es posible que no reflejen las tasas observadas en la práctica clínica.
La evaluación de las reacciones adversas se basa en tres ensayos clínicos en 182 pacientes pediátricos infectados por el VIH-1 (de 3 meses a 21 años de edad) que recibieron SUSTIVA 200 mg en combinación con otros agentes antirretrovirales durante una mediana de 123 semanas. Las reacciones adversas observadas en los tres ensayos fueron similares a las observadas en ensayos clínicos en adultos, excepto que la erupción fue más común en pacientes pediátricos (32 % para todos los grados, independientemente de la causalidad) y más a menudo de mayor grado (es decir, más grave). Dos (1,1 %) pacientes pediátricos experimentaron erupción de Grado 3 (erupción confluente con fiebre, erupción generalizada) y cuatro (2,2 %) pacientes pediátricos experimentaron erupción de Grado 4 (todos eritema multiforme). Cinco pacientes pediátricos (2,7 %) abandonaron el estudio debido a una erupción cutánea [ver ADVERTENCIAS Y PRECAUCIONES ].
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de SUSTIVA. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño desconocido, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Cuerpo como un todo: reacciones alérgicas, astenia, redistribución/acumulación de grasa corporal [ver ADVERTENCIAS Y PRECAUCIONES ]
Sistema Nervioso Central y Periférico: coordinación anormal, ataxia, encefalopatía, coordinación cerebelosa y alteraciones del equilibrio, convulsiones, hipoestesia, parestesia, neuropatía, temblor, vértigo
Endocrino: ginecomastia
Gastrointestinal: estreñimiento, malabsorción
Cardiovascular: enrojecimiento, palpitaciones
Hígado y Sistema Biliar: aumento de las enzimas hepáticas, insuficiencia hepática, hepatitis.
Metabólicas y Nutricionales: hipercolesterolemia, hipertrigliceridemia
Musculoesquelético: artralgia, mialgia, miopatía
Psiquiátrico: reacciones agresivas, agitación, delirios, labilidad emocional, manía, neurosis, paranoia, psicosis, suicidio, catatonia
Respiratorio: disnea
Piel y apéndices: eritema multiforme, dermatitis fotoalérgica, síndrome de Stevens-Johnson
Sentidos especiales: visión anormal, tinnitus
INTERACCIONES CON LA DROGAS
Potencial de SUSTIVA para afectar a otras drogas
Se ha demostrado que efavirenz in vivo induce CYP3A y CYP2B6. Otros compuestos que son sustratos de CYP3A o CYP2B6 pueden tener concentraciones plasmáticas reducidas cuando se coadministran con SUSTIVA.
Posibilidad de que otras drogas afecten a SUSTIVA
Se esperaría que los fármacos que inducen la actividad de CYP3A (p. ej., fenobarbital, rifampicina, rifabutina) aumenten el aclaramiento de efavirenz, lo que da como resultado concentraciones plasmáticas más bajas [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Fármacos que prolongan el intervalo QT
Hay información limitada disponible sobre la posibilidad de una interacción farmacodinámica entre SUSTIVA 600 mg y medicamentos que prolongan el intervalo QTc. Se ha observado una prolongación del intervalo QTc con el uso de efavirenz [ver FARMACOLOGÍA CLÍNICA ]. Considere alternativas a SUSTIVA 600 mg cuando se coadministre con un medicamento con un riesgo conocido de Torsade de Pointes.
Interacciones farmacológicas establecidas y otras potencialmente significativas
Las interacciones farmacológicas con SUSTIVA se resumen en la Tabla 5. Para obtener datos farmacocinéticos, [ver FARMACOLOGÍA CLÍNICA ] Tablas 7 y 8. Esta tabla incluye interacciones potencialmente significativas, pero no es exhaustiva.
Medicamentos sin interacciones clínicamente significativas con SUSTIVA
No se recomienda ajustar la dosis cuando SUSTIVA 600 mg se administra con los siguientes: antiácidos de hidróxido de aluminio/magnesio, azitromicina, cetirizina, famotidina, fluconazol, lorazepam, nelfinavir, inhibidores nucleósidos de la transcriptasa inversa (abacavir, emtricitabina, lamivudina, estavudina, tenofovir disoproxil fumarato, zidovudina ), paroxetina y raltegravir.
Interacción de prueba de cannabinoides
Efavirenz no se une a los receptores de cannabinoides. Se han informado resultados falsos positivos de las pruebas de cannabinoides en orina con algunos ensayos de detección en sujetos no infectados e infectados por el VIH que recibieron efavirenz. Se recomienda la confirmación de pruebas de detección positivas para cannabinoides mediante un método más específico.
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Interacciones con la drogas
Las concentraciones plasmáticas de efavirenz pueden verse alteradas por sustratos, inhibidores o inductores de CYP3A. Asimismo, efavirenz puede alterar las concentraciones plasmáticas de fármacos metabolizados por CYP3A o CYP2B6. El efecto más destacado de efavirenz en estado estacionario es la inducción de CYP3A y CYP2B6 [ver DOSIFICACIÓN Y ADMINISTRACIÓN y INTERACCIONES CON LA DROGAS ].
Prolongación QTc
Se ha observado una prolongación del intervalo QTc con el uso de efavirenz [ver INTERACCIONES CON LA DROGAS y FARMACOLOGÍA CLÍNICA ]. Considere alternativas a SUSTIVA 600 mg cuando se coadministre con un fármaco con un riesgo conocido de Torsade de Pointes o cuando se administre a pacientes con mayor riesgo de Torsade de Pointes.
Resistencia
SUSTIVA 200 mg no debe usarse como agente único para tratar la infección por VIH-1 ni agregarse como agente único a un régimen fallido. El virus resistente emerge rápidamente cuando se administra efavirenz como monoterapia. La elección de nuevos agentes antirretrovirales para usar en combinación con efavirenz debe tener en cuenta el potencial de resistencia cruzada viral.
Coadministración con productos relacionados
No se recomienda la coadministración de SUSTIVA con ATRIPLA (efavirenz 600 mg/emtricitabina 200 mg/tenofovir disoproxil fumarate 300 mg) a menos que sea necesario ajustar la dosis (p. ej., con rifampicina), ya que efavirenz es uno de sus ingredientes activos.
Síntomas psiquiátricos
Se han informado experiencias adversas psiquiátricas graves en pacientes tratados con SUSTIVA. En ensayos controlados de 1008 pacientes tratados con regímenes que contenían SUSTIVA 600 mg durante una media de 2,1 años y 635 pacientes tratados con regímenes de control durante una media de 1,5 años, la frecuencia (independientemente de la causalidad) de eventos psiquiátricos graves específicos entre los pacientes que recibieron SUSTIVA o los regímenes de control, respectivamente, fueron depresión severa (2,4%, 0,9%), ideación suicida (0,7%, 0,3%), intentos de suicidio no fatales (0,5%, 0), comportamiento agresivo (0,4%, 0,5%), reacciones paranoides (0,4 %, 0,3 %) y reacciones maníacas (0,2 %, 0,3 %). Cuando los síntomas psiquiátricos similares a los mencionados anteriormente se combinaron y evaluaron como grupo en un análisis multifactorial de datos del Estudio 006, el tratamiento con efavirenz se asoció con un aumento en la aparición de estos síntomas psiquiátricos seleccionados. Otros factores asociados con un aumento en la aparición de estos síntomas psiquiátricos fueron antecedentes de uso de drogas inyectables, antecedentes psiquiátricos y recepción de medicación psiquiátrica al ingresar al estudio; Se observaron asociaciones similares en los grupos de tratamiento SUSTIVA y de control. En el Estudio 006, se produjo la aparición de nuevos síntomas psiquiátricos graves a lo largo del estudio tanto en los pacientes tratados con SUSTIVA como en los tratados con el control. El uno por ciento de los pacientes tratados con SUSTIVA descontinuaron o interrumpieron el tratamiento debido a uno o más de estos síntomas psiquiátricos seleccionados. También ha habido informes ocasionales posteriores a la comercialización de muerte por suicidio, delirios y comportamiento similar a la psicosis, aunque no se puede determinar una relación causal con el uso de SUSTIVA a partir de estos informes. También se han informado casos de catatonia posteriores a la comercialización y pueden estar asociados con una mayor exposición a efavirenz. Los pacientes con experiencias adversas psiquiátricas graves deben buscar una evaluación médica inmediata para evaluar la posibilidad de que los síntomas puedan estar relacionados con el uso de SUSTIVA y, de ser así, determinar si los riesgos de continuar con la terapia superan los beneficios. [ver REACCIONES ADVERSAS .]
Síntomas del sistema nervioso
El cincuenta y tres por ciento (531/1008) de los pacientes que recibieron SUSTIVA 600 mg en ensayos controlados informaron síntomas del sistema nervioso central (cualquier grado, independientemente de la causalidad) en comparación con el 25 % (156/635) de los pacientes que recibieron regímenes de control [ver REACCIONES ADVERSAS ]. Estos síntomas incluyeron, entre otros, mareos (28,1 % de los 1008 pacientes), insomnio (16,3 %), problemas de concentración (8,3 %), somnolencia (7,0 %), sueños anormales (6,2 %) y alucinaciones (1,2 %). %). Estos síntomas fueron graves en el 2,0 % de los pacientes; y el 2,1 % de los pacientes interrumpieron el tratamiento como resultado. Estos síntomas generalmente comienzan durante el primer o segundo día de terapia y generalmente se resuelven después de las primeras 2 a 4 semanas de terapia. Después de 4 semanas de tratamiento, la prevalencia de síntomas del sistema nervioso de gravedad al menos moderada osciló entre el 5 % y el 9 % en pacientes tratados con regímenes que contenían SUSTIVA y entre el 3 % y el 5 % en pacientes tratados con un régimen de control. Se debe informar a los pacientes que es probable que estos síntomas comunes mejoren con la terapia continua y que no predijeron la aparición posterior de los síntomas psiquiátricos menos frecuentes [ver Síntomas psiquiátricos ]. La dosificación a la hora de acostarse puede mejorar la tolerabilidad de estos síntomas del sistema nervioso [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
El análisis de datos a largo plazo del Estudio 006 (mediana de seguimiento de 180 semanas, 102 semanas y 76 semanas para pacientes tratados con SUSTIVA + zidovudina + lamivudina, SUSTIVA + indinavir e indinavir + zidovudina + lamivudina, respectivamente) mostró que, más allá de Después de 24 semanas de tratamiento, la incidencia de síntomas del sistema nervioso de nueva aparición entre los pacientes tratados con SUSTIVA fue generalmente similar a la del brazo de control que contenía indinavir.
La neurotoxicidad de inicio tardío, que incluye ataxia y encefalopatía (alteración de la conciencia, confusión, enlentecimiento psicomotor, psicosis, delirio), puede ocurrir meses o años después de comenzar la terapia con efavirenz. Se han producido algunos eventos de neurotoxicidad de inicio tardío en pacientes con polimorfismos genéticos de CYP2B6 que están asociados con niveles elevados de efavirenz a pesar de la dosificación estándar de SUSTIVA. Los pacientes que presenten signos y síntomas de experiencias adversas neurológicas graves deben ser evaluados de inmediato para evaluar la posibilidad de que estos eventos puedan estar relacionados con el uso de efavirenz y si se justifica la interrupción de SUSTIVA 600 mg.
Se debe alertar a los pacientes que reciben SUSTIVA 600 mg sobre el potencial de efectos aditivos en el sistema nervioso central cuando SUSTIVA 200 mg se usa concomitantemente con alcohol o drogas psicoactivas.
Los pacientes que experimentan síntomas del sistema nervioso central, como mareos, problemas de concentración y/o somnolencia, deben evitar tareas potencialmente peligrosas, como conducir u operar maquinaria.
Toxicidad embriofetal
Efavirenz puede causar daño fetal cuando se administra durante el primer trimestre a una mujer embarazada. Aconseje a las mujeres con potencial reproductivo que estén recibiendo SUSTIVA 600 mg para evitar el embarazo. [ver Uso en poblaciones específicas .]
Sarpullido
En ensayos clínicos controlados, el 26 % (266/1008) de los pacientes adultos tratados con 600 mg de SUSTIVA experimentaron erupción cutánea de nueva aparición en comparación con el 17 % (111/635) de los tratados en los grupos de control [ver REACCIONES ADVERSAS ]. Se produjo erupción cutánea asociada con ampollas, descamación húmeda o ulceración en el 0,9 % (9/1008) de los pacientes tratados con SUSTIVA. La incidencia de erupción cutánea de grado 4 (p. ej., eritema multiforme, síndrome de Stevens-Johnson) en pacientes adultos tratados con SUSTIVA en todos los estudios y acceso ampliado fue del 0,1 %. Las erupciones suelen ser erupciones cutáneas maculopapulares de leves a moderadas que ocurren dentro de las primeras 2 semanas de iniciar el tratamiento con efavirenz (la mediana de tiempo hasta la aparición de la erupción en adultos fue de 11 días) y, en la mayoría de los pacientes que continúan la terapia con efavirenz, la erupción se resuelve dentro de 1 mes (duración media, 16 días). La tasa de interrupción por erupción en los ensayos clínicos en adultos fue del 1,7 % (17/1008).
Se informó erupción en 59 de 182 pacientes pediátricos (32 %) tratados con SUSTIVA [ver REACCIONES ADVERSAS ]. Dos pacientes pediátricos experimentaron erupción de grado 3 (erupción confluente con fiebre, erupción generalizada) y cuatro pacientes tuvieron erupción de grado 4 (eritema multiforme). La mediana de tiempo hasta la aparición de la erupción en pacientes pediátricos fue de 28 días (rango 3-1642 días). Se debe considerar la profilaxis con antihistamínicos apropiados antes de iniciar la terapia con SUSTIVA en pacientes pediátricos.
SUSTIVA 600 mg generalmente se puede reiniciar en pacientes que interrumpieron la terapia debido a una erupción. SUSTIVA 200 mg debe interrumpirse en pacientes que desarrollen erupción cutánea grave asociada con ampollas, descamación, afectación de las mucosas o fiebre. Los antihistamínicos y/o corticosteroides apropiados pueden mejorar la tolerabilidad y acelerar la resolución de la erupción. Para los pacientes que han tenido una reacción cutánea potencialmente mortal (p. ej., síndrome de Stevens-Johnson), se debe considerar una terapia alternativa [ver CONTRAINDICACIONES ].
hepatotoxicidad
Se han informado casos de hepatitis posteriores a la comercialización, incluida la hepatitis fulminante que progresa a insuficiencia hepática que requiere trasplante o provoca la muerte, en pacientes tratados con SUSTIVA. Los informes han incluido pacientes con enfermedad hepática subyacente, incluida la coinfección con hepatitis B o C, y pacientes sin enfermedad hepática preexistente u otros factores de riesgo identificables.
SUSTIVA 600 mg no se recomienda para pacientes con insuficiencia hepática moderada o grave. Se recomienda un control cuidadoso de los pacientes con insuficiencia hepática leve que reciben SUSTIVA. [ver REACCIONES ADVERSAS y Uso en poblaciones específicas ].
Se recomienda el control de las enzimas hepáticas antes y durante el tratamiento para todos los pacientes [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Considere suspender SUSTIVA 600 mg en pacientes con elevaciones persistentes de las transaminasas séricas a más de cinco veces el límite superior del rango normal.Suspender SUSTIVA 200 mg si la elevación de las transaminasas séricas se acompaña de signos o síntomas clínicos de hepatitis o descompensación hepática.
convulsiones
Se han observado convulsiones en pacientes adultos y pediátricos que reciben efavirenz, generalmente en presencia de antecedentes médicos conocidos de convulsiones [ver Toxicología no clínica ]. Se debe tener precaución en cualquier paciente con antecedentes de convulsiones. Los pacientes que reciben medicamentos anticonvulsivos concomitantes principalmente metabolizados por el hígado, como fenitoína y fenobarbital, pueden requerir un control periódico de los niveles plasmáticos [ver INTERACCIONES CON LA DROGAS ].
Elevaciones de lípidos
El tratamiento con SUSTIVA ha resultado en aumentos en la concentración de colesterol total y triglicéridos [ver REACCIONES ADVERSAS ]. Se deben realizar pruebas de colesterol y triglicéridos antes de iniciar la terapia con SUSTIVA 200 mg y en intervalos periódicos durante la terapia.
Síndrome de Reconstitución Inmune
Se ha notificado síndrome de reconstitución inmunitaria en pacientes tratados con terapia antirretroviral combinada, incluido SUSTIVA. Durante la fase inicial del tratamiento antirretroviral combinado, los pacientes cuyo sistema inmunitario responde pueden desarrollar una respuesta inflamatoria a infecciones oportunistas indolentes o residuales (como infección por Mycobacterium avium, citomegalovirus, neumonía por Pneumocystis jiroveci [PCP] o tuberculosis), lo que puede requerir una evaluación adicional y tratamiento
También se ha informado que ocurren trastornos autoinmunes (como la enfermedad de Graves, la polimiositis, el síndrome de Guillain-Barré y la hepatitis autoinmune) en el marco de la reconstitución inmunitaria; sin embargo, el tiempo de aparición es más variable y puede ocurrir muchos meses después del inicio del tratamiento.
Redistribución de grasa
En pacientes que reciben terapia antirretroviral se ha observado redistribución/acumulación de grasa corporal que incluye obesidad central, agrandamiento de la grasa dorsocervical (joroba de búfalo), emaciación periférica, emaciación facial, agrandamiento de las mamas y “aspecto cushingoide”. El mecanismo y las consecuencias a largo plazo de estos eventos son actualmente desconocidos. Una relación casual no ha sido establecida.
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( INFORMACIÓN DEL PACIENTE y Instrucciones de uso ).
Interacciones con la drogas
En las etiquetas de los frascos del producto se incluye una declaración para pacientes y proveedores de atención médica: ALERTA: Infórmese sobre los medicamentos que NO deben tomarse con SUSTIVA.
SUSTIVA puede interactuar con algunos medicamentos; por lo tanto, aconseje a los pacientes que informen a su médico sobre el uso de cualquier otro medicamento recetado o sin receta.
Información general para pacientes
Informe a los pacientes que SUSTIVA 200 mg no es una cura para la infección por VIH-1 y que los pacientes pueden continuar experimentando enfermedades asociadas con la infección por VIH-1, incluidas las infecciones oportunistas. Los pacientes deben permanecer bajo el cuidado de un médico mientras toman SUSTIVA.
Aconseje a los pacientes que eviten hacer cosas que puedan transmitir la infección por VIH-1 a otras personas.
- No comparta ni reutilice agujas u otros equipos de inyección.
- No comparta artículos personales que puedan tener sangre o fluidos corporales, como cepillos de dientes y hojas de afeitar.
- No tengas ningún tipo de sexo sin protección. Practique siempre sexo más seguro usando un condón de látex o poliuretano para reducir la posibilidad de contacto sexual con semen, secreciones vaginales o sangre.
- No amamante. Las madres con VIH-1 no deben amamantar porque el VIH-1 puede transmitirse al bebé a través de la leche materna.
Instrucciones de dosificación
Aconseje a los pacientes que tomen SUSTIVA todos los días según lo prescrito. Si un paciente olvida tomar SUSTIVA, dígale que tome la dosis olvidada de inmediato, a menos que sea casi la hora de la próxima dosis. Aconseje al paciente que no tome 2 dosis a la vez y que tome la siguiente dosis a la hora programada regularmente. Aconseje al paciente que pregunte a un proveedor de atención médica si necesita ayuda para planificar los mejores momentos para tomar su medicamento.
SUSTIVA 200 mg siempre debe usarse en combinación con otros medicamentos antirretrovirales. Aconseje a los pacientes que tomen SUSTIVA 600 mg con el estómago vacío, preferiblemente a la hora de acostarse. Tomar SUSTIVA con alimentos aumenta las concentraciones de efavirenz y puede aumentar la frecuencia de reacciones adversas. La dosificación a la hora de acostarse puede mejorar la tolerabilidad de los síntomas del sistema nervioso [ver DOSIFICACIÓN Y ADMINISTRACIÓN y REACCIONES ADVERSAS ]. Los proveedores de atención médica deben ayudar a los padres o cuidadores a determinar el mejor programa de dosificación de SUSTIVA para bebés y niños pequeños.
Para pacientes adultos y pediátricos que no pueden tragar cápsulas o tabletas, se debe recomendar a los pacientes o a sus cuidadores que lean y sigan cuidadosamente las instrucciones para administrar el contenido de la cápsula en una pequeña cantidad de comida o fórmula infantil [ver DOSIFICACIÓN Y ADMINISTRACIÓN y etiquetado para pacientes aprobado por la FDA ( INFORMACIÓN DEL PACIENTE y INSTRUCCIONES DE USO )]. Los pacientes deben llamar a su proveedor de atención médica o farmacéutico si tienen alguna pregunta.
Síntomas del sistema nervioso
Informe a los pacientes que los síntomas del sistema nervioso central (NSS), incluidos mareos, insomnio, problemas de concentración, somnolencia y sueños anormales, se informan comúnmente durante las primeras semanas de terapia con SUSTIVA [ver ADVERTENCIAS Y PRECAUCIONES ]. La dosificación a la hora de acostarse puede mejorar la tolerabilidad de estos síntomas, que es probable que mejoren con la terapia continua. Alerte a los pacientes sobre el potencial de efectos aditivos cuando SUSTIVA se usa concomitantemente con alcohol o drogas psicoactivas. Indique a los pacientes que si experimentan NSS deben evitar tareas potencialmente peligrosas, como conducir u operar maquinaria.
Informe a los pacientes que existe el riesgo de desarrollar neurotoxicidad de inicio tardío, incluidas ataxia y encefalopatía, que pueden ocurrir meses o años después de comenzar la terapia con SUSTIVA [ver ADVERTENCIAS Y PRECAUCIONES ].
Síntomas psiquiátricos
Informe a los pacientes que se han informado síntomas psiquiátricos graves que incluyen depresión severa, intentos de suicidio, comportamiento agresivo, delirios, paranoia, síntomas similares a la psicosis y catatonia en pacientes que reciben SUSTIVA [ver ADVERTENCIAS Y PRECAUCIONES ]. Si experimentan experiencias adversas psiquiátricas graves, deben buscar una evaluación médica inmediata. Aconseje a los pacientes que informen a su médico sobre cualquier historial de enfermedad mental o abuso de sustancias.
Sarpullido
Informe a los pacientes que un efecto secundario frecuente es el sarpullido [ver ADVERTENCIAS Y PRECAUCIONES ]. Las erupciones generalmente desaparecen sin ningún cambio en el tratamiento. Sin embargo, dado que la erupción puede ser grave, aconseje a los pacientes que se comuniquen con su médico de inmediato si se produce una erupción.
hepatotoxicidad
Indique a los pacientes que estén atentos a los primeros signos de advertencia de inflamación o insuficiencia hepática, como fatiga, debilidad, falta de apetito, náuseas y vómitos, así como a signos posteriores como ictericia, confusión, hinchazón abdominal y heces descoloridas, y que consulten a su profesional de la salud sin demora si se presentan tales síntomas [ver ADVERTENCIAS Y PRECAUCIONES y REACCIONES ADVERSAS ].
Hembras De Potencial Reproductivo
Aconseje a las mujeres con potencial reproductivo que utilicen un método anticonceptivo eficaz, así como un método de barrera durante el tratamiento con SUSTIVA 600 mg y durante 12 semanas después de suspender SUSTIVA. Aconseje a las pacientes que se comuniquen con su proveedor de atención médica si planean quedar embarazadas, quedar embarazadas o si se sospecha un embarazo durante el tratamiento con SUSTIVA [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
Registro de exposición durante el embarazo
Informe a los pacientes que existe un registro de exposición durante el embarazo que monitorea los resultados del embarazo en mujeres expuestas a SUSTIVA durante el embarazo [ver Uso en poblaciones específicas ].
Redistribución de grasa
Informe a los pacientes que la redistribución o acumulación de grasa corporal puede ocurrir en pacientes que reciben terapia antirretroviral y que se desconocen la causa y los efectos a largo plazo en la salud de estas afecciones [ver ADVERTENCIAS Y PRECAUCIONES ].
SUSTIVA es una marca registrada de Bristol-Myers Squibb Pharma Company. ATRIPLA es una marca registrada de Bristol-Myers Squibb & Gilead Sciences, LLC.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Carcinogénesis
Se llevaron a cabo estudios de carcinogenicidad a largo plazo en ratones y ratas con efavirenz. Los ratones recibieron dosis de 0, 25, 75, 150 o 300 mg/kg/día durante 2 años. Las incidencias de adenomas y carcinomas hepatocelulares y adenomas alveolares/bronquiolares pulmonares aumentaron por encima de los antecedentes en las mujeres. No se observaron aumentos en la incidencia de tumores por encima del fondo en los hombres. No se estableció un NOAEL en mujeres para este estudio porque se produjeron hallazgos tumorales en todas las dosis. El AUC en el NOAEL (150 mg/kg) en los machos fue aproximadamente 0,9 veces mayor que en humanos a la dosis clínica recomendada. En el estudio con ratas, no se observaron aumentos en la incidencia de tumores con dosis de hasta 100 mg/kg/día, para las cuales las AUC fueron 0,1 (machos) o 0,2 (hembras) veces mayores que en humanos con la dosis clínica recomendada.
mutagénesis
Efavirenz dio negativo en una batería de ensayos de genotoxicidad in vitro e in vivo. Estos incluyeron ensayos de mutación bacteriana en S. typhimurium y E. coli, ensayos de mutación de mamíferos en células de ovario de hámster chino, ensayos de aberración cromosómica en linfocitos de sangre periférica humana o células de ovario de hámster chino, y un ensayo de micronúcleo de médula ósea de ratón in vivo.
Deterioro de la fertilidad
Efavirenz no perjudicó el apareamiento ni la fertilidad de ratas macho o hembra, y no afectó el esperma de las ratas macho tratadas. El rendimiento reproductivo de las crías de ratas hembra que recibieron efavirenz no se vio afectado. Las AUC en los valores NOAEL en ratas macho (200 mg/kg) y hembra (100 mg/kg) fueron aproximadamente ≤0,15 veces mayores que en humanos con la dosis clínica recomendada.
Uso en poblaciones específicas
El embarazo
Registro de exposición durante el embarazo
Existe un registro de exposición durante el embarazo que monitorea los resultados del embarazo en mujeres expuestas a SUSTIVA 600 mg durante el embarazo. Se recomienda a los médicos que registren a los pacientes llamando al Registro de embarazos con antirretrovirales al 1-800-258-4263.
Resumen de riesgos
Hay informes de casos retrospectivos de defectos del tubo neural en bebés cuyas madres estuvieron expuestas a regímenes que contenían efavirenz en el primer trimestre del embarazo. Los datos de embarazos prospectivos del Registro de embarazos con antirretrovirales no son suficientes para evaluar adecuadamente este riesgo. Los datos disponibles del Registro de Embarazo Antirretroviral no muestran ninguna diferencia en el riesgo de defectos congénitos mayores en general en comparación con la tasa de antecedentes de defectos congénitos mayores del 2,7 % en la población de referencia de EE. UU. del Programa de Defectos Congénitos del Área Metropolitana de Atlanta (MACDP). Aunque no se ha establecido una relación causal entre la exposición a efavirenz en el primer trimestre y los defectos del tubo neural, se han observado malformaciones similares en estudios realizados en monos a dosis similares a la humana. Además, se produjeron toxicidades fetales y embrionarias en ratas, a una dosis diez veces menor que la exposición humana a la dosis clínica recomendada. Debido al riesgo potencial de defectos del tubo neural, no se debe usar efavirenz en el primer trimestre del embarazo. Informar a las mujeres embarazadas sobre el riesgo potencial para el feto.
Datos
Datos humanos
Hay informes retrospectivos posteriores a la comercialización de hallazgos consistentes con defectos del tubo neural, incluido meningomielocele, todos en bebés de madres expuestas a regímenes que contienen efavirenz en el primer trimestre.
Según los informes prospectivos del Registro de embarazos antirretrovirales (APR) de aproximadamente 1000 nacidos vivos después de la exposición a regímenes que contienen efavirenz (incluidos más de 800 nacidos vivos expuestos en el primer trimestre), no hubo diferencia entre efavirenz y defectos congénitos generales en comparación con el tasa de antecedentes de defectos congénitos del 2,7 % en la población de referencia de EE. UU. del Programa de defectos congénitos del área metropolitana de Atlanta. A partir del informe APR provisional emitido en diciembre de 2014, la prevalencia de defectos congénitos después de la exposición en el primer trimestre fue del 2,3 % (IC del 95 %: 1,4 %-3,6 %). Uno de estos defectos informados prospectivamente con la exposición en el primer trimestre fue un defecto del tubo neural. También se informó prospectivamente un caso único de anoftalmía con exposición a efavirenz en el primer trimestre. Este caso también incluyó hendiduras faciales oblicuas severas y bandas amnióticas, que tienen una asociación conocida con anoftalmía.
Datos de animales
Los efectos de efavirenz sobre el desarrollo embriofetal se han estudiado en tres especies no clínicas (monos cangrejeros, ratas y conejos). En monos, se administró efavirenz 60 mg/kg/día a hembras preñadas durante todo el embarazo (días 20 a 150 de gestación). Las exposiciones sistémicas maternas al fármaco (AUC) fueron 1,3 veces la exposición en humanos a la dosis clínica recomendada (600 mg/día), con concentraciones de fármaco en la vena umbilical fetal de aproximadamente 0,7 veces los valores maternos. Tres de 20 fetos/bebés tenían una o más malformaciones; no hubo fetos malformados o bebés de madres tratadas con placebo. Las malformaciones que ocurrieron en estos tres fetos de mono incluyeron anencefalia y anoftalmía unilateral en un feto, microftalmía en el segundo y paladar hendido en el tercero. No se estableció un NOAEL (nivel sin efecto adverso observable) para este estudio porque solo se evaluó una dosis. En ratas, se administró efavirenz durante la organogénesis (días 7 a 18 de gestación) o desde el día 7 de gestación hasta el día 21 de lactancia a 50, 100 o 200 mg/kg/día. La administración de 200 mg/kg/día en ratas se asoció con un aumento en la incidencia de reabsorciones tempranas; y las dosis de 100 mg/kg/día y mayores se asociaron con mortalidad neonatal temprana. El AUC en el NOAEL (50 mg/kg/día) en este estudio con ratas fue 0,1 veces mayor que en humanos con la dosis clínica recomendada. Las concentraciones de fármaco en la leche en el día 10 de lactancia fueron aproximadamente 8 veces más altas que las del plasma materno. En conejas preñadas, efavirenz no fue letal para los embriones ni teratogénico cuando se administró en dosis de 25, 50 y 75 mg/kg/día durante el período de organogénesis (días 6 a 18 de gestación). El AUC en el NOAEL (75 mg/kg/día) en conejos fue 0,4 veces mayor que en humanos a la dosis clínica recomendada.
Lactancia
Resumen de riesgos
Los Centros para el Control y la Prevención de Enfermedades recomiendan que las madres infectadas por el VIH no amamanten a sus bebés para evitar el riesgo de transmisión posnatal del VIH. Debido al potencial de transmisión del VIH en bebés amamantados, aconseje a las mujeres que no amamanten.
Hembras y machos con potencial reproductivo
Debido a los posibles efectos teratogénicos, se debe evitar el embarazo en mujeres que reciben SUSTIVA. [ver El embarazo .]
Pruebas de embarazo
Las mujeres con potencial reproductivo deben someterse a pruebas de embarazo antes de iniciar SUSTIVA.
Anticoncepción
Las mujeres en edad reproductiva deben usar métodos anticonceptivos efectivos durante el tratamiento con SUSTIVA 200 mg y durante 12 semanas después de suspender SUSTIVA 200 mg debido a la larga vida media de efavirenz. La anticoncepción de barrera siempre debe usarse en combinación con otros métodos anticonceptivos. Los métodos hormonales que contienen progesterona pueden tener una eficacia reducida [ver INTERACCIONES CON LA DROGAS ].
Uso pediátrico
La seguridad, el perfil farmacocinético y las respuestas virológica e inmunológica de SUSTIVA 600 mg se evaluaron en pacientes pediátricos infectados por el VIH-1 de 3 meses a 21 años de edad que no habían recibido tratamiento antirretroviral previo y que tenían experiencia en tres ensayos clínicos abiertos [ver REACCIONES ADVERSAS , FARMACOLOGÍA CLÍNICA , y Estudios clínicos ]. El tipo y la frecuencia de las reacciones adversas en estos ensayos fueron generalmente similares a los de los pacientes adultos, con la excepción de una frecuencia más alta de erupción cutánea, incluida una frecuencia más alta de erupción cutánea de grado 3 o 4, en pacientes pediátricos en comparación con los adultos [ver ADVERTENCIAS Y PRECAUCIONES y REACCIONES ADVERSAS ].
No se recomienda el uso de SUSTIVA en pacientes menores de 3 meses de edad O con menos de 3,5 kg de peso corporal porque la seguridad, la farmacocinética y la actividad antiviral de SUSTIVA 600 mg no se han evaluado en este grupo de edad y existe el riesgo de desarrollar resistencia al VIH. si SUSTIVA está infradosificado. ver DOSIFICACIÓN Y ADMINISTRACIÓN para recomendaciones de dosificación para pacientes pediátricos.
Uso geriátrico
Los estudios clínicos de SUSTIVA 200 mg no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes. En general, la selección de la dosis para un paciente de edad avanzada debe ser cautelosa, reflejando la mayor frecuencia de disminución de la función hepática, renal o cardíaca y de enfermedades concomitantes u otra terapia.
Deterioro hepático
SUSTIVA no se recomienda para pacientes con insuficiencia hepática moderada o grave porque no hay datos suficientes para determinar si es necesario ajustar la dosis. Los pacientes con insuficiencia hepática leve pueden ser tratados con efavirenz sin ningún ajuste de dosis. Debido al amplio metabolismo de efavirenz mediado por el citocromo P450 y a la experiencia clínica limitada en pacientes con insuficiencia hepática, se debe tener precaución al administrar SUSTIVA a estos pacientes [ver ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ].
SOBREDOSIS
Algunos pacientes que tomaron accidentalmente 600 mg dos veces al día informaron un aumento de los síntomas del sistema nervioso. Un paciente experimentó contracciones musculares involuntarias.
El tratamiento de la sobredosis de SUSTIVA 200 mg debe consistir en medidas generales de apoyo, incluida la monitorización de los signos vitales y la observación del estado clínico del paciente. Se puede usar la administración de carbón activado para ayudar a eliminar el fármaco no absorbido. No existe un antídoto específico para la sobredosis de SUSTIVA. Dado que el efavirenz se une en gran medida a las proteínas, es poco probable que la diálisis elimine significativamente el fármaco de la sangre.
CONTRAINDICACIONES
- SUSTIVA está contraindicado en pacientes con hipersensibilidad clínicamente significativa previamente demostrada (p. ej., síndrome de Stevens-Johnson, eritema multiforme o erupciones cutáneas tóxicas) a cualquiera de los componentes de este producto.
- Está contraindicada la coadministración de efavirenz con elbasvir y grazoprevir [ver ADVERTENCIAS Y PRECAUCIONES y INTERACCIONES CON LA DROGAS ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
Efavirenz es un fármaco antiviral [ver Microbiología ].
Farmacodinámica
Electrofisiología cardíaca
El efecto de SUSTIVA 600 mg en el intervalo QTc se evaluó en un estudio abierto, positivo y controlado con placebo, de secuencia única fija, de 3 períodos, cruzado de 3 tratamientos en 58 sujetos sanos enriquecidos para los polimorfismos CYP2B6. La Cmáx media de efavirenz en sujetos con genotipo CYP2B6 *6/*6 tras la administración de una dosis diaria de 600 mg durante 14 días fue 2,25 veces mayor que la Cmáx media observada en sujetos con genotipo CYP2B6 *1/*1. Se observó una relación positiva entre la concentración de efavirenz y la prolongación del intervalo QTc. En función de la relación concentración-QTc, la prolongación media del QTc y su límite superior del intervalo de confianza del 90 % son 8,7 ms y 11,3 ms en sujetos con genotipo CYP2B6*6/*6 tras la administración de una dosis diaria de 600 mg durante 14 días [ver ADVERTENCIAS Y PRECAUCIONES ].
Farmacocinética
Absorción
Las concentraciones plasmáticas máximas de efavirenz de 1,6-9,1 μM se alcanzaron 5 horas después de la administración de dosis orales únicas de 100 mg a 1600 mg a voluntarios no infectados. Se observaron aumentos relacionados con la dosis en Cmax y AUC para dosis de hasta 1600 mg; los aumentos fueron menos que proporcionales, lo que sugiere una absorción disminuida en dosis más altas.
En pacientes infectados por VIH-1 en estado estacionario, la Cmax media, la Cmin media y el AUC medio fueron proporcionales a la dosis después de dosis diarias de 200 mg, 400 mg y 600 mg. El tiempo hasta las concentraciones plasmáticas máximas fue de aproximadamente 3 a 5 horas y las concentraciones plasmáticas en estado estacionario se alcanzaron en 6 a 10 días. En 35 pacientes que recibieron SUSTIVA 600 mg una vez al día, la Cmax en estado estacionario fue de 12,9 ± 3,7 μM (media ± DE), la Cmin en estado estacionario fue de 5,6 ± 3,2 μM y el AUC fue de 184 ± 73 μM•h.
Efecto de los alimentos sobre la absorción oral:
Cápsulas
La administración de una dosis única de 600 mg de cápsulas de efavirenz con una comida rica en grasas/alta en calorías (894 kcal, 54 g de grasa, 54 % de calorías de grasa) o una comida reducida en grasas/normalmente calórica (440 kcal, 2 g grasa, 4 % calorías de la grasa) se asoció con un aumento medio del 22 % y el 17 % en el AUC∞ de efavirenz y un aumento medio del 39 % y el 51 % en la Cmax de efavirenz, respectivamente, en relación con las exposiciones alcanzadas cuando se administra en ayunas . [ver DOSIFICACIÓN Y ADMINISTRACIÓN y INFORMACIÓN DEL PACIENTE .]
tabletas
La administración de un solo comprimido de 600 mg de efavirenz con una comida rica en grasas/calórica (aproximadamente 1000 kcal, 500-600 kcal de grasas) se asoció con un aumento del 28 % en el AUC∞ medio de efavirenz y un aumento del 79 % en el AUC∞ medio de efavirenz. Cmax de efavirenz en relación con las exposiciones logradas en ayunas. [ver DOSIFICACIÓN Y ADMINISTRACIÓN y INFORMACIÓN DEL PACIENTE .]
Biodisponibilidad del contenido de las cápsulas mezclado con vehículos alimentarios
En sujetos adultos sanos, el AUC de efavirenz cuando se administró como el contenido de tres cápsulas de 200 mg mezcladas con 2 cucharaditas de ciertos vehículos alimentarios (puré de manzana, mermelada de uva o yogur o fórmula infantil) cumplió con los criterios de bioequivalencia para el AUC de la formulación de cápsula intacta administrada. en condiciones de ayuno.
Distribución
Efavirenz se une en gran medida (aproximadamente 99,5-99,75%) a las proteínas plasmáticas humanas, predominantemente a la albúmina. En pacientes infectados por el VIH-1 (n=9) que recibieron SUSTIVA de 200 a 600 mg una vez al día durante al menos un mes, las concentraciones en líquido cefalorraquídeo oscilaron entre 0,26 y 1,19 % (media 0,69 %) de la concentración plasmática correspondiente. Esta proporción es aproximadamente 3 veces mayor que la fracción no unida a proteínas (libre) de efavirenz en plasma.
Metabolismo
Los estudios en humanos y los estudios in vitro utilizando microsomas hepáticos humanos han demostrado que efavirenz se metaboliza principalmente por el sistema del citocromo P450 a metabolitos hidroxilados con la subsiguiente glucuronidación de estos metabolitos hidroxilados. Estos metabolitos son esencialmente inactivos contra el VIH-1. Los estudios in vitro sugieren que CYP3A y CYP2B6 son las principales isoenzimas responsables del metabolismo de efavirenz.
Se ha demostrado que efavirenz induce las enzimas CYP, lo que provoca la inducción de su propio metabolismo. Las dosis múltiples de 200 a 400 mg por día durante 10 días dieron como resultado un grado de acumulación inferior al previsto (22 a 42 % más bajo) y una vida media terminal más corta de 40 a 55 horas (vida media de dosis única de 52 a 76 horas). ).
Eliminación
Efavirenz tiene una vida media terminal de 52 a 76 horas después de dosis únicas y de 40 a 55 horas después de dosis múltiples. Se realizó un estudio de excreción/balance de masas de un mes usando 400 mg por día con una dosis marcada con C administrada el día 8. Aproximadamente el 14-34 % del radiomarcado se recuperó en la orina y el 16-61 % se recuperó en las heces. . Casi toda la excreción urinaria del fármaco radiomarcado fue en forma de metabolitos. Efavirenz representó la mayor parte de la radiactividad total medida en las heces.
Poblaciones Especiales
Pediátrico
Los parámetros farmacocinéticos de efavirenz en estado estacionario en pacientes pediátricos se predijeron mediante un modelo farmacocinético poblacional y se resumen en la Tabla 6 por rangos de peso que corresponden a las dosis recomendadas.
género y raza
La farmacocinética de efavirenz en pacientes parece ser similar entre hombres y mujeres y entre los grupos raciales estudiados.
Insuficiencia renal
No se ha estudiado la farmacocinética de efavirenz en pacientes con insuficiencia renal; sin embargo, menos del 1 % de efavirenz se excreta sin cambios en la orina, por lo que el impacto de la insuficiencia renal en la eliminación de efavirenz debe ser mínimo.
Deterioro hepático
Un estudio de dosis múltiples no mostró ningún efecto significativo sobre la farmacocinética de efavirenz en pacientes con insuficiencia hepática leve (Child-Pugh Clase A) en comparación con los controles. No hubo datos suficientes para determinar si la insuficiencia hepática moderada o grave (Child-Pugh Clase B o C) afecta la farmacocinética de efavirenz.
Estudios de interacción farmacológica
Se ha demostrado in vivo que efavirenz provoca la inducción de enzimas hepáticas, lo que aumenta la biotransformación de algunos fármacos metabolizados por CYP3A y CYP2B6. Los estudios in vitro han demostrado que efavirenz inhibe las isoenzimas CYP 2C9 y 2C19 con valores de Ki (8,5-17 μM) en el rango de concentraciones plasmáticas de efavirenz observadas. En estudios in vitro, efavirenz no inhibió CYP2E1 e inhibió CYP2D6 y CYP1A2 (valores Ki 82-160 μM) solo en concentraciones muy por encima de las alcanzadas clínicamente. La coadministración de efavirenz con fármacos metabolizados principalmente por las isoenzimas CYP2C9, CYP2C19, CYP3A o CYP2B6 puede producir concentraciones plasmáticas alteradas del fármaco coadministrado. Se esperaría que los fármacos que inducen la actividad de CYP3A y CYP2B6 aumenten el aclaramiento de efavirenz, lo que da como resultado concentraciones plasmáticas más bajas.
Los estudios de interacción farmacológica se realizaron con efavirenz y otros fármacos que probablemente se coadministren o fármacos comúnmente utilizados como sondeos para la interacción farmacocinética. Los efectos de la coadministración de efavirenz sobre la Cmax, AUC y Cmin se resumen en la Tabla 7 (efecto de efavirenz sobre otros fármacos) y la Tabla 8 (efecto de otros fármacos sobre efavirenz). Para obtener información sobre las recomendaciones clínicas, consulte INTERACCIONES CON LA DROGAS .
Microbiología
Mecanismo de acción
Efavirenz es un NNRTI del VIH-1. La actividad de efavirenz está mediada predominantemente por la inhibición no competitiva de la transcriptasa inversa del VIH-1. Efavirenz no inhibe la transcriptasa inversa del VIH-2 y las polimerasas α, β, γ y δ del ADN celular humano.
Actividad antiviral en cultivo celular
La concentración de efavirenz que inhibe la replicación de cepas silvestres adaptadas en laboratorio y aislados clínicos en cultivo celular en un 90-95 % (EC90-95) osciló entre 1,7 y 25 nM en líneas celulares linfoblastoides, células mononucleares de sangre periférica (PBMC) y macrófagos. /cultivos de monocitos. Efavirenz demostró actividad antiviral contra el clado B y la mayoría de los aislados que no son del clado B (subtipos A, AE, AG, C, D, F, G, J, N), pero tuvo una actividad antiviral reducida contra los virus del grupo O. Efavirenz demostró actividad antiviral aditiva sin citotoxicidad contra el VIH-1 en cultivo celular cuando se combinó con los NNRTI delavirdina y nevirapina, NRTI (abacavir, didanosina, emtricitabina, lamivudina, estavudina, tenofovir, zalcitabina, zidovudina), IP (amprenavir, indinavir, lopinavir, nelfinavir, ritonavir, saquinavir) y el inhibidor de fusión enfuvirtide. Efavirenz demostró actividad antiviral aditiva a antagonista en cultivo celular con atazanavir. Efavirenz no fue antagonista con adefovir, utilizado para el tratamiento de la infección por el virus de la hepatitis B, o ribavirina, utilizada en combinación con interferón para el tratamiento de la infección por el virus de la hepatitis C.
Resistencia
En cultivo celular
En cultivo celular, los aislados de VIH-1 con susceptibilidad reducida a efavirenz (aumento de >380 veces en el valor EC90) surgieron rápidamente en presencia del fármaco. La caracterización genotípica de estos virus identificó sustituciones de un solo aminoácido L100I o V179D, sustituciones dobles L100I/V108I y sustituciones triples L100I/V179D/Y181C en la transcriptasa inversa.
Estudios clínicos
Se han obtenido aislados clínicos con susceptibilidad reducida en cultivo celular a efavirenz. Se observaron una o más sustituciones en las posiciones de aminoácidos 98, 100, 101, 103, 106, 108, 188, 190, 225 y 227 en la transcriptasa inversa en pacientes que fracasaron en el tratamiento con efavirenz en combinación con indinavir o con zidovudina más lamivudina. La sustitución K103N fue la más frecuentemente observada. La vigilancia de la resistencia a largo plazo (promedio de 52 semanas, rango de 4 a 106 semanas) analizó 28 aislamientos de falla virológica y de línea de base coincidentes. Sesenta y uno por ciento (17/28) de estos aislados fallidos habían disminuido la susceptibilidad a efavirenz en cultivo celular con un cambio medio de 88 veces en la susceptibilidad a efavirenz (valor EC50) con respecto a la referencia. La sustitución de NNRTI que se desarrolló con mayor frecuencia en estos aislamientos de pacientes fue K103N (54 %). Otras sustituciones de NNRTI que se desarrollaron incluyeron L100I (7 %), K101E/Q/R (14 %), V108I (11 %), G190S/T/A (7 %), P225H (18 %) y M230I/L (11 %).
Resistencia cruzada
Se ha observado resistencia cruzada entre los NNRTI. Los aislamientos clínicos previamente caracterizados como resistentes a efavirenz también fueron fenotípicamente resistentes en cultivo celular a delavirdina y nevirapina en comparación con el valor inicial. Los aislamientos virales clínicos resistentes a delavirdina y/o nevirapina con sustituciones asociadas a resistencia a NNRTI (A98G, L100I, K101E/P, K103N/S, V106A, Y181X, Y188X, G190X, P225H, F227L o M230L) mostraron una susceptibilidad reducida a efavirenz en cultivo celular. Más del 90 % de los aislamientos clínicos resistentes a los NRTI analizados en cultivo celular retuvieron la susceptibilidad al efavirenz.
Toxicología Animal
Se observaron convulsiones no sostenidas en 6 de 20 monos que recibieron efavirenz en dosis que produjeron valores de AUC en plasma de 4 a 13 veces mayores que los de los humanos que recibieron la dosis recomendada [ver ADVERTENCIAS Y PRECAUCIONES ].
Estudios clínicos
Adultos
estudio 006 un ensayo aleatorizado y abierto, comparó SUSTIVA (600 mg una vez al día) + zidovudina (ZDV, 300 mg cada 12 horas) + lamivudina (LAM, 150 mg cada 12 horas) o SUSTIVA (600 mg una vez al día) + indinavir (IDV, 1000 mg q8h) con indinavir (800 mg q8h) + zidovudina (300 mg q12h) + lamivudina (150 mg q12h). Se inscribieron 1.266 pacientes (edad media 36,5 años [rango 18-81], 60 % caucásicos, 83 % hombres). Todos los pacientes no habían recibido tratamiento previo con efavirenz, lamivudina, NNRTI ni IP al ingresar al estudio. La mediana del recuento inicial de células CD4+ fue de 320 células/mm3 y la mediana del nivel inicial de ARN del VIH-1 fue de 4,8 log copias/mL. Los resultados del tratamiento con ensayo estándar (límite de ensayo 400 copias/mL) durante 48 y 168 semanas se muestran en la Tabla 9. Los niveles de ARN del VIH en plasma se cuantificaron con ensayo estándar (límite de ensayo 400 copias/mL) y ultrasensible (límite de ensayo 50 copias/mL) versiones del ensayo AMPLICOR HIV-1 MONITOR. Durante el estudio, se introdujo en Europa la versión 1.5 del ensayo para mejorar la detección de virus que no pertenecen al clado B.
Para los pacientes tratados con SUSTIVA + zidovudina + lamivudina, SUSTIVA + indinavir o indinavir + zidovudina + lamivudina, el porcentaje de respondedores con ARN del VIH-1
ACTG 364 es un estudio aleatorizado, doble ciego, controlado con placebo, de 48 semanas en pacientes con experiencia en NRTI que habían completado dos estudios previos de ACTG. Ciento noventa y seis pacientes (edad media 41 años [rango 18-76], 74 % caucásicos, 88 % hombres) recibieron NRTI en combinación con SUSTIVA (600 mg una vez al día) o nelfinavir (NFV, 750 mg tres veces al día ), o SUSTIVA (600 mg una vez al día) + nelfinavir de forma aleatorizada y doble ciego. El recuento inicial medio de células CD4+ fue de 389 células/mm3 y el nivel inicial medio de ARN del VIH-1 fue de 8130 copias/ml. Al ingresar al estudio, a todos los pacientes se les asignó un nuevo régimen de NRTI de etiqueta abierta, que dependía de su experiencia previa con el tratamiento con NRTI. No hubo diferencias significativas en el recuento medio de células CD4+ entre los grupos de tratamiento; el aumento medio general fue de aproximadamente 100 células a las 48 semanas entre los pacientes que continuaron con los regímenes del estudio. Los resultados del tratamiento se muestran en la Tabla 10. Los niveles de ARN del VIH en plasma se cuantificaron con el ensayo AMPLICOR HIV-1 MONITOR utilizando un límite inferior de cuantificación de 500 copias/mL.
Un análisis de Kaplan-Meier del tiempo hasta el fracaso del tratamiento a lo largo de 72 semanas demuestra una mayor duración de la supresión virológica (ARN del VIH
Pacientes pediátricos
El estudio AI266922 es un estudio abierto para evaluar la farmacocinética, la seguridad, la tolerabilidad y la actividad antiviral de SUSTIVA 200 mg en combinación con didanosina y emtricitabina en pacientes pediátricos sin tratamiento antirretroviral previo y con experiencia. Treinta y siete pacientes de 3 meses a 6 años de edad (mediana de 0,7 años) fueron tratados con SUSTIVA. Al inicio del estudio, la mediana del ARN del VIH-1 en plasma fue de 5,88 log copias/ml, la mediana del recuento de células CD4+ fue de 1144 células/mm3 y la mediana del porcentaje de CD4+ fue del 25 %. La mediana de tiempo en la terapia del estudio fue de 60 semanas; El 27 % de los pacientes interrumpieron el tratamiento antes de la semana 48. Usando un análisis ITT, las proporciones generales de pacientes con ARN del VIH
El estudio PACTG 1021 fue un estudio abierto para evaluar la farmacocinética, la seguridad, la tolerabilidad y la actividad antiviral de SUSTIVA 200 mg en combinación con didanosina y emtricitabina en pacientes pediátricos que nunca habían recibido tratamiento antirretroviral. Cuarenta y tres pacientes de 3 meses a 21 años de edad (mediana de 9,6 años) recibieron dosis de SUSTIVA. Al inicio del estudio, la mediana del ARN del VIH-1 en plasma fue de 4,8 log copias/mL, la mediana del recuento de células CD4+ fue de 367 células/mm3 y la mediana del porcentaje de CD4+ fue del 18 %. La mediana del tiempo de tratamiento del estudio fue de 181 semanas; El 16 % de los pacientes interrumpieron el tratamiento antes de la semana 48. Usando un análisis ITT, las proporciones generales de pacientes con ARN del VIH
El estudio PACTG 382 fue un estudio abierto para evaluar la farmacocinética, la seguridad, la tolerabilidad y la actividad antiviral de SUSTIVA en combinación con nelfinavir y un NRTI en pacientes pediátricos sin experiencia previa con NRTI y sin tratamiento previo con antirretrovirales. Ciento dos pacientes de 3 meses a 16 años de edad (mediana de 5,7 años) fueron tratados con SUSTIVA. Ochenta y siete por ciento de los pacientes habían recibido terapia antirretroviral previa. Al inicio del estudio, la mediana del ARN del VIH-1 en plasma fue de 4,57 log copias/mL, la mediana del recuento de células CD4+ fue de 755 células/mm3 y la mediana del porcentaje de CD4+ fue del 30 %. La mediana del tiempo de tratamiento del estudio fue de 118 semanas; El 25 % de los pacientes interrumpieron el tratamiento antes de la semana 48. Usando un análisis ITT, la proporción general de pacientes con ARN del VIH
INFORMACIÓN DEL PACIENTE
SUSTIVA® (sus-TEE-vah) (efavirenz) cápsulas
SUSTIVA® (sus-TEE-vah) (efavirenz) tabletas
Importante: Consulte a su médico o farmacéutico acerca de los medicamentos que no debe tomar con SUSTIVA. Para obtener más información, consulte la sección "¿Qué debo decirle a mi médico antes de tomar SUSTIVA?"
Lea esta Información para el paciente antes de comenzar a tomar SUSTIVA y cada vez que renueve su receta. Es posible que haya nueva información. Esta información no reemplaza la conversación con su médico acerca de su condición médica o tratamiento.
¿Qué es SUSTIVA?
SUSTIVA 600 mg es un medicamento recetado para el VIH-1 (virus de la inmunodeficiencia humana tipo 1) que se usa con otros medicamentos antirretrovirales para tratar la infección por el VIH-1 en adultos y niños que tienen al menos 3 meses de edad y pesan al menos 7 libras 12 onzas (3.5 kg). El VIH es el virus que causa el SIDA (Síndrome de Inmunodeficiencia Adquirida).
No se sabe si SUSTIVA es seguro y eficaz en niños menores de 3 meses de edad o que pesan menos de 7 libras 12 onzas (3,5 kg).
Cuando se usa con otros medicamentos antirretrovirales para tratar la infección por VIH-1, SUSTIVA 600 mg puede ayudar a:
- reducir la cantidad de VIH-1 en su sangre. Esto se llama carga viral.
- aumentar la cantidad de células CD4+ (T) en la sangre que ayudan a combatir otras infecciones.
Reducir la cantidad de VIH-1 y aumentar las células CD4+ (T) en su sangre puede ayudar a mejorar su sistema inmunológico. Esto puede reducir su riesgo de muerte o de contraer infecciones que pueden ocurrir cuando su sistema inmunitario está débil (infecciones oportunistas).
SUSTIVA 600mg no cura la infección por VIH-1 ni el SIDA. Debe seguir tomando medicamentos contra el VIH-1 para controlar la infección por VIH-1 y disminuir las enfermedades relacionadas con el VIH.
Evite hacer cosas que puedan propagar la infección por el VIH-1 a otras personas:
- No comparta ni reutilice agujas u otros equipos de inyección.
- No comparta artículos personales que puedan tener sangre o fluidos corporales, como cepillos de dientes y hojas de afeitar.
- No tengas ningún tipo de sexo sin protección. Practique siempre sexo más seguro usando un condón de látex o poliuretano para reducir la posibilidad de contacto sexual con cualquier fluido corporal como semen, secreciones vaginales o sangre.
Pregúntele a su médico si tiene alguna pregunta sobre cómo prevenir la transmisión del VIH a otras personas.
¿Quién no debe tomar SUSTIVA 600mg?
No tome SUSTIVA si es alérgico al efavirenz oa alguno de los ingredientes de SUSTIVA. Consulte el final de este folleto para obtener una lista completa de los ingredientes de SUSTIVA.
No tome SUSTIVA si actualmente está tomando elbasvir y grazoprevir (ZEPATIER®).
¿Qué debo decirle a mi médico antes de tomar SUSTIVA 200 mg?
Antes de tomar SUSTIVA, informe a su médico si tiene alguna condición médica y, en particular, si:
- tener una condición del corazón
- ha tenido alguna vez un problema de salud mental
- alguna vez ha usado drogas callejeras o grandes cantidades de alcohol
- tiene problemas hepáticos, incluida la infección por el virus de la hepatitis B o C
- tiene antecedentes de convulsiones
- está embarazada o planea quedar embarazada. SUSTIVA 600 mg puede dañar a su bebé por nacer. Si puede quedar embarazada, su proveedor de atención médica debe realizar una prueba de embarazo antes de comenzar con SUSTIVA. No debe quedar embarazada mientras toma SUSTIVA y durante 12 semanas después de suspender el tratamiento con SUSTIVA. Las mujeres que pueden quedar embarazadas deben usar 2 formas efectivas de control de la natalidad durante el tratamiento y durante 12 semanas después de suspender el tratamiento con SUSTIVA. Una forma de control de la natalidad de barrera siempre debe usarse junto con otro tipo de control de la natalidad.
- Las formas de control de la natalidad de barrera pueden incluir condones de látex o poliuretano, esponja anticonceptiva, diafragma con espermicida y capuchón cervical.
- Es posible que las formas hormonales de control de la natalidad, como las píldoras anticonceptivas, las inyecciones, los anillos vaginales o los implantes, no funcionen durante el tratamiento con SUSTIVA.
- Hable con su médico acerca de los métodos anticonceptivos que se pueden usar durante el tratamiento con SUSTIVA.
- Registro de Embarazo. Hay un registro de embarazo para mujeres que toman medicamentos antirretrovirales durante el embarazo. El propósito de este registro es recopilar información sobre su salud y la de su bebé. Hable con su médico acerca de cómo puede participar en este registro.
- No amamante si toma SUSTIVA.
- No debe amamantar si tiene VIH debido al riesgo de transmitir el VIH a su bebé.
Informe a su médico y farmacéutico sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos a base de hierbas.
SUSTIVA 600 mg puede afectar la forma en que funcionan otros medicamentos, y otros medicamentos pueden afectar la forma en que funciona SUSTIVA 600 mg, y puede causar efectos secundarios graves. Si toma ciertos medicamentos con SUSTIVA, la cantidad de SUSTIVA 600 mg en su cuerpo puede ser demasiado baja y es posible que no funcione para ayudar a controlar su infección por VIH. El virus del VIH en su cuerpo puede volverse resistente a SUSTIVA oa otros medicamentos contra el VIH similares.
No debe tomar SUSTIVA 600mg si toma ATRIPLA (efavirenz, emtricitabina, tenofovir disoproxil fumarate) a menos que su médico se lo indique.
Informe a su médico y farmacéutico sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos a base de hierbas. Algunos medicamentos interactúan con SUSTIVA.
Mantenga una lista de sus medicamentos para mostrársela a su médico y farmacéutico.
- Puede pedirle a su médico o farmacéutico una lista de medicamentos que interactúan con SUSTIVA.
- No empiece a tomar un nuevo medicamento sin consultar a su médico. Su médico puede decirle si es seguro tomar SUSTIVA con otros medicamentos.
¿Cómo debo tomar SUSTIVA?
- Tome SUSTIVA 600 mg exactamente como se lo indique su médico.
- No cambie su dosis ni deje de tomar SUSTIVA a menos que su médico se lo indique.
- Permanezca bajo el cuidado de su médico durante el tratamiento con SUSTIVA.
- SUSTIVA debe utilizarse con otros medicamentos antirretrovirales.
- Tome SUSTIVA 1 vez al día.
- SUSTIVA viene en tabletas o cápsulas.
- Los comprimidos de SUSTIVA no deben romperse.
- Trague las tabletas o cápsulas de SUSTIVA enteras con líquido.
Cómo y cuándo tomar SUSTIVA.
- Debe tomar SUSTIVA 600 mg con el estómago vacío antes de acostarse. Tomar SUSTIVA 200 mg con alimentos aumenta la cantidad de medicamento en su cuerpo. Algunos efectos secundarios pueden molestarle menos si toma SUSTIVA 600 mg con el estómago vacío y antes de acostarse.
- El médico de su hijo le recetará la dosis adecuada de SUSTIVA 200 mg en función del peso de su hijo.
- Si tiene dificultad para tragar tabletas o cápsulas, informe a su médico. Su médico puede recomendar abrir la cápsula SUSTIVA y mezclar el contenido con comida o fórmula infantil. Consulte las "Instrucciones de uso" detalladas al final de esta Información para el paciente para conocer la forma correcta de tomar SUSTIVA 600 mg usando el método de rociado de cápsulas.
- Los adultos y los niños que toman SUSTIVA 600 mg utilizando el método de rociado de cápsulas no deben comer durante 2 horas después de tomar una dosis de SUSTIVA.
- Los bebés no deben recibir fórmula infantil durante 2 horas después de tomar una dosis de SUSTIVA utilizando el método de rociado de cápsulas.
- No se pierda una dosis de SUSTIVA. Si olvida tomar SUSTIVA, tome la dosis olvidada de inmediato, a menos que sea casi la hora de su próxima dosis. No tome 2 dosis a la vez. Simplemente tome su próxima dosis a la hora programada regularmente. Si necesita ayuda para planificar los mejores momentos para tomar su medicamento, consulte a su médico o farmacéutico.
- Si toma demasiado SUSTIVA, llame a su médico o acuda de inmediato a la sala de emergencias del hospital más cercano.
- Cuando su suministro de SUSTIVA 600 mg comience a agotarse, obtenga más de su médico o farmacia. Es importante no quedarse sin SUSTIVA. La cantidad de VIH-1 en la sangre puede aumentar si se suspende el medicamento, aunque sea por poco tiempo. El virus puede volverse resistente a SUSTIVA 600 mg y más difícil de tratar.
¿Cuáles son los posibles efectos secundarios de SUSTIVA?
SUSTIVA 600 mg puede causar efectos secundarios graves, que incluyen:
Si tiene mareos, dificultad para concentrarse o somnolencia, no conduzca un automóvil, no use maquinaria ni haga nada que requiera que esté alerta.
Algunos síntomas del sistema nervioso (p. ej., confusión, pensamientos y movimientos físicos lentos, y delirios [falsas creencias] o alucinaciones [ver u oír cosas que otros no ven ni oyen]) pueden ocurrir meses o años después de comenzar la terapia con SUSTIVA 600 mg. Comuníquese de inmediato con su proveedor de atención médica si presenta cualquiera de estos síntomas.
Informe a su médico de inmediato si presenta alguno de los siguientes síntomas:
- Problemas graves de salud mental puede ocurrir en personas que toman SUSTIVA. Informe a su médico de inmediato si tiene alguno de los siguientes síntomas:
- sentirse triste o desesperanzado no confiar en otras personas
- sentirse ansioso o inquieto escuchar o ver cosas que no son reales
- tiene pensamientos de lastimarse a sí mismo (suicidio) o ha tratado de lastimarse a sí mismo o a otros
- no son capaces de moverse o hablar normalmente
- no son capaces de diferenciar entre lo que es verdadero o real y lo que es falso o irreal
- Síntomas del sistema nervioso son comunes en personas que toman SUSTIVA 200 mg y pueden ser graves. Estos síntomas suelen comenzar durante el primer o segundo día de tratamiento con SUSTIVA 200mg y suelen desaparecer después de 2 a 4 semanas de tratamiento. Algunos síntomas pueden ocurrir meses o años después de comenzar la terapia con SUSTIVA. Estos síntomas pueden empeorar si bebe alcohol, toma un medicamento para problemas de salud mental o usa ciertas drogas ilícitas durante el tratamiento con SUSTIVA. Los síntomas pueden incluir:
- mareo
- problemas para concentrarse
- problemas para dormir
- somnolencia
- sueños inusuales
- falta de coordinación o dificultad con el equilibrio
- Erupción cutanea es común con SUSTIVA 600 mg pero a veces puede ser grave. La erupción cutánea generalmente desaparece sin ningún cambio en el tratamiento. Si desarrolla una erupción con cualquiera de los siguientes síntomas, informe a su médico de inmediato:
- erupción cutánea, con o sin picazón
- descamación de la piel
- fiebre
- úlceras de boca
- hinchazón de tu cara
- ojos rojos o inflamados, como "ojo rosado" (conjuntivitis)
- ampollas o lesiones en la piel
- Problemas hepáticos, incluyendo insuficiencia hepática y muerte. puede ocurrir en personas que toman SUSTIVA. Los problemas hepáticos pueden ocurrir en personas sin antecedentes de problemas hepáticos. Su médico le hará análisis de sangre para controlar su hígado antes de que comience con SUSTIVA 200 mg y durante el tratamiento.
- su piel o la parte blanca de sus ojos se vuelve amarilla (ictericia)
- no tiene ganas de comer durante varios días o más
- tu orina se vuelve oscura
- se siente mal del estómago (náuseas)
- sus evacuaciones intestinales (heces) se vuelven de color claro
- tiene dolor en la parte inferior del estómago (abdominal)
- convulsiones puede ocurrir en personas que toman SUSTIVA. Es más probable que ocurran convulsiones si ha tenido convulsiones en el pasado. Informe a su médico si ha tenido una convulsión o si toma un medicamento para ayudar a prevenir las convulsiones.
- Cambios en su sistema inmunológico (Síndrome de Reconstitución Inmune) puede ocurrir cuando comienza a tomar medicamentos contra el VIH-1. Su sistema inmunológico puede fortalecerse y comenzar a combatir infecciones que han estado ocultas en su cuerpo durante mucho tiempo. Informe a su médico si comienza a tener nuevos síntomas después de comenzar a tomar su medicamento contra el VIH-1.
- Cambios en la grasa corporal puede ocurrir en personas que toman medicamentos para el VIH-1. Estos cambios pueden incluir una mayor cantidad de grasa en la parte superior de la espalda y el cuello ("joroba de búfalo"), los senos y alrededor de la parte principal del cuerpo (tronco). También puede ocurrir pérdida de grasa de las piernas, los brazos y la cara. Se desconocen la causa y los efectos a largo plazo en la salud de estas afecciones.
Los efectos secundarios más comunes de SUSTIVA 600mg incluyen:
- sarpullido
- sueños anormales
- mareo
- cansancio
- náuseas
- problemas para dormir
- dolor de cabeza
- vómitos
- dificultad para concentrarse
Algunos pacientes que toman SUSTIVA han experimentado niveles elevados de lípidos (colesterol y triglicéridos) en la sangre. Informe a su médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de SUSTIVA. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar SUSTIVA?
- Guarde las cápsulas y tabletas de SUSTIVA a temperatura ambiente, entre 20 °C y 25 °C (68 °F y 77 °F).
Mantenga SUSTIVA y todos los medicamentos fuera del alcance de los niños.
Información general sobre SUSTIVA
A veces, los medicamentos se recetan para fines distintos a los enumerados en el folleto de información para el paciente. No use SUSTIVA 600 mg para una condición para la cual no fue recetado. No le dé SUSTIVA 600 mg a otras personas, incluso si tienen los mismos síntomas que usted tiene. Puede que les haga daño.
Si desea obtener más información, hable con su médico. Puede solicitar a su farmacéutico o médico información sobre SUSTIVA escrita para profesionales de la salud. Para obtener más información, visite www.sustiva.com o llame al 1-800-321-1335.
¿Cuáles son los ingredientes de SUSTIVA?
Ingrediente activo: efavirenz
Ingredientes inactivos:
Cápsulas SUSTIVA 600mg: lactosa monohidrato, estearato de magnesio, lauril sulfato de sodio y glicolato de almidón de sodio. La cubierta de la cápsula contiene gelatina, laurilsulfato de sodio, dióxido de titanio y/u óxido de hierro amarillo. La cubierta de la cápsula también puede contener dióxido de silicio. Las cápsulas están impresas con tinta que contiene carmín 40 azul, FD&C Blue No. 2 y dióxido de titanio.
SUSTIVA tabletas: croscarmelosa de sodio, hidroxipropilcelulosa, lactosa monohidrato, estearato de magnesio, celulosa microcristalina y laurilsulfato de sodio. El recubrimiento de la tableta contiene Opadry Yellow y Opadry Clear. Los comprimidos están pulidos con cera de carnauba e impresos con tinta violeta, Opacode WB.
Esta información para el paciente ha sido aprobada por la Administración de Drogas y Alimentos de los Estados Unidos.
Instrucciones de uso
SUSTIVA® (sus-TEE-vah) (efavirenz) cápsulas
Preparación de una dosis de SUSTIVA 600 mg utilizando el método de rociado de cápsulas
Lea estas Instrucciones de uso antes de preparar su primera dosis de SUSTIVA mezclada con alimentos o fórmula infantil usando el método de rociado de cápsulas, cada vez que renueve su receta y según sea necesario. Es posible que haya nueva información. Esta información no reemplaza la conversación con su médico acerca de su condición médica o tratamiento. Pregúntele a su médico o farmacéutico si tiene alguna duda sobre cómo mezclar o administrar una dosis de SUSTIVA 200 mg utilizando el método de rociado de cápsulas.
Información importante:
- Para obtener más información sobre las cápsulas de SUSTIVA 600 mg, consulte el prospecto de información para el paciente.
- El método de rociado de cápsulas para mezclar el contenido de las cápsulas de SUSTIVA con alimentos blandos o fórmula infantil puede usarse para adultos o niños que no pueden tragar cápsulas o tabletas.
- Debe tomar SUSTIVA 600 mg con el estómago vacío antes de acostarse.
- No debe comer durante 2 horas después de tomar SUSTIVA mezclado con alimentos.
- Los bebés que tienen la edad suficiente para tragar alimentos deben recibir SUSTIVA utilizando el método de rociado de cápsulas mezclado con alimentos en lugar de fórmula infantil.
- Hable con su médico para que lo ayude a decidir el mejor horario para darle a su bebé SUSTIVA mezclado con fórmula infantil utilizando el método de rociado de cápsulas.
Preparación de una dosis de SUSTIVA 600mg mezclada con alimentos mediante el método de rociado de cápsulas.
Antes de preparar una dosis de SUSTIVA 200 mg mezclada con alimentos usando el método de rociado de cápsulas, reúna los siguientes suministros:
- toallas de papel
- cucharadita para medir
- cuchara pequeña para revolver y alimentar
- pequeña recipiente limpio (como un pequeña taza o tazón)
- alimentos blandos como puré de manzana, mermelada de uva o yogur
Paso 1. Elija una superficie de trabajo limpia y plana. Coloque una toalla de papel limpia sobre la superficie de trabajo. Luego coloque los demás suministros sobre la toalla de papel.
Paso 2. Lávese y séquese bien las manos.
Paso 3. Coloque de 1 a 2 cucharaditas de alimentos blandos como puré de manzana, mermelada de uva o yogur en el recipiente pequeño (ver Figura A ). El color y la consistencia del alimento pueden cambiar cuando se mezclan con el medicamento.
Figura A
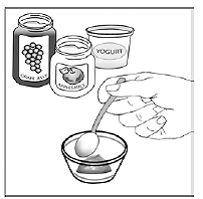
Paso 4. Hay 2 partes de la cápsula SUSTIVA 200mg. Mire la cápsula SUSTIVA para ver qué parte de la cápsula se superpone a la otra parte (ver Figura B ).
Figura B
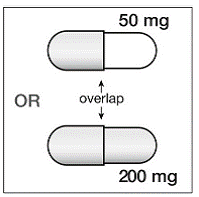
Paso 5. Sostenga la cápsula SUSTIVA en una posición lateral (horizontal) directamente sobre el recipiente de comida. Sostenga cada extremo de la cápsula SUSTIVA entre sus dedos pulgar e índice (ver Figura C ).
Figura C
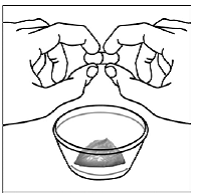
Paso 6. Use su dedo pulgar e índice para pellizcar cerca del final de la parte superpuesta de la cápsula de SUSTIVA 600 mg (ver Figura D ).
Figura D
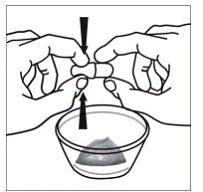
Luego, gire con cuidado ambos extremos de la cápsula de SUSTIVA 600 mg en direcciones opuestas para abrirla (ver Figura E ). Tenga cuidado de no derramar el contenido de la cápsula ni esparcirlo por el aire.
Figura E

Paso 7. Espolvorear el contenido de la cápsula SUSTIVA sobre los alimentos (ver Figura F ).
- Revise las cubiertas de las cápsulas para asegurarse de que estén vacías.
- Deseche las cubiertas de las cápsulas vacías.
Figura F

Si la dosis total recetada es más de 1 cápsula, siga los pasos 4 a 7 para cada cápsula. No agregue más alimentos.
Los pasos 8 a 11 deben completarse dentro de 30 minutos de mezclar el medicamento (ver Figura G ).
Figura G

Paso 8. Use la cuchara pequeña para mezclar suavemente el contenido de la cápsula y la comida (ver Figura H ). Las chispas no se disolverán. La mezcla se verá granulosa pero no debe tener grumos.
Figura H
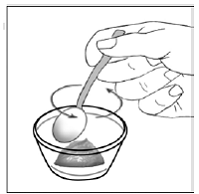
Paso 9. Use la cuchara pequeña para dar o tomar la comida y la mezcla del contenido de la cápsula. Asegúrate de tragar toda la mezcla.
Paso 10. Agregue aproximadamente 2 cucharaditas más de comida al recipiente vacío y revuelva suavemente con la cuchara pequeña para mezclar con el contenido de la cápsula que aún pueda estar en el recipiente.
Paso 11. Use la cuchara pequeña para dar o tomar la comida y la mezcla del contenido de la cápsula. Asegúrate de tragar toda la mezcla.
Paso 12. Lava el recipiente y las cucharas. Deseche la toalla de papel y limpie la superficie de trabajo. Lava tus manos.
Preparación de una dosis de SUSTIVA 600 mg mezclada con fórmula infantil utilizando el método de rociado de cápsulas
Para asegurarse de que su bebé reciba todo el medicamento, no le dé el contenido de las cápsulas de SUSTIVA en un biberón.
Antes de preparar una dosis de SUSTIVA mezclada con fórmula infantil usando el método de rociado de cápsulas, reúna los siguientes suministros:
- toallas de papel
- cucharadita para revolver y medir
- pequeña recipiente limpio (como un pequeña taza o tazón) (ver figura yo ).
- Jeringa de dosificación oral de 10 ml (pregúntele a su farmacéutico) (ver figura yo ).
- fórmula infantil a temperatura ambiente.
figura yo
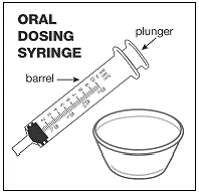
Paso 1. Prepare la fórmula infantil de acuerdo con las instrucciones del paquete de fórmula infantil. Usará aproximadamente 1 onza de la fórmula para administrar el medicamento. Cualquier resto de fórmula no se debe dar al niño durante 2 horas.
Paso 2. Elija una superficie de trabajo limpia y plana. Coloque una toalla de papel limpia sobre la superficie de trabajo. Coloque los suministros que necesitará en la toalla de papel.
Paso 3. Lávese y séquese bien las manos.
Paso 4. Vierta 2 cucharaditas de fórmula infantil a temperatura ambiente en el recipiente (ver Figura J ).
Figura J
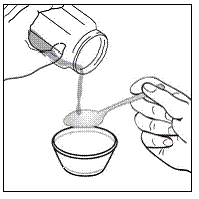
Paso 5. Hay 2 partes de la cápsula SUSTIVA. Mire la cápsula SUSTIVA para ver qué parte de la cápsula se superpone a la otra parte (ver Figura K ).
Figura K
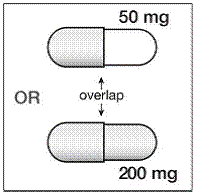
Paso 6. Sostenga la cápsula de SUSTIVA en una posición lateral (horizontal) directamente sobre el recipiente con la fórmula infantil. Sostenga cada extremo de la cápsula SUSTIVA de 600 mg entre sus dedos pulgar e índice (ver Figura L ).
Figura L
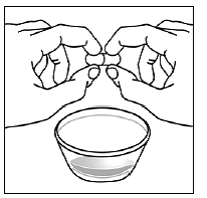
Paso 7. Utilice los dedos pulgar e índice para pellizcar cerca del extremo de la parte superpuesta de la cápsula SUSTIVA (ver Figura M ).
Figura M
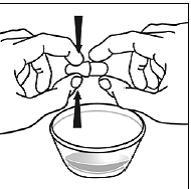
Luego, gire con cuidado ambos extremos de la cápsula SUSTIVA en direcciones opuestas para abrirla (ver Figura N ). Tenga cuidado de no derramar el contenido de la cápsula ni esparcirlo por el aire.
Figura N
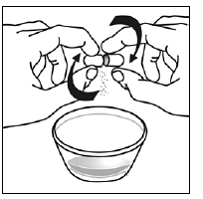
Paso 8. Espolvorear el contenido de la cápsula SUSTIVA 600 mg sobre la fórmula infantil (ver Figura O ).
- Revise las cubiertas de las cápsulas para asegurarse de que estén vacías.
- Deseche las cubiertas de las cápsulas vacías.
Figura O
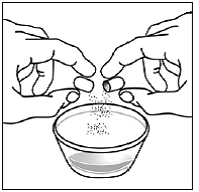
Si la dosis total recetada es más de 1 cápsula, siga los pasos 5 a 8 para cada cápsula. No agregue más fórmula infantil.
Los pasos 9 a 12 deben completarse dentro de 30 minutos de mezclar el medicamento (ver Figura P ).
Figura P

Paso 9. Sostenga el recipiente con una mano. Con la otra mano, use la cucharilla para mezclar suavemente el contenido de la cápsula y la fórmula infantil (ver Figura Q ). Las chispas no se disolverán. La mezcla se verá granulosa pero no debe tener grumos.
Figura Q
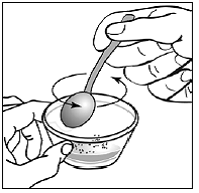
Paso 10. Para extraer toda la mezcla en la jeringa de dosificación oral:
Figura R
Cifras
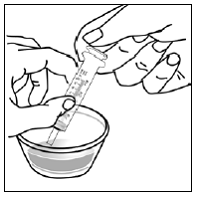
Figura T
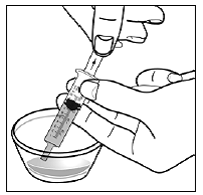
- Verifique que el émbolo esté completamente empujado dentro del cilindro de la jeringa (ver Figura R ).
- Coloque la punta de la jeringa en la mezcla del recipiente (ver Cifras ).
- Lentamente tire hacia atrás del émbolo y extraiga toda la mezcla (ver Figura T ).
Paso 11. Coloque la punta de la jeringa en la boca de su bebé a lo largo de la parte interna de la mejilla (ver Figura U ). Empuje lentamente el émbolo para darle a su bebé toda la mezcla.
Figura U
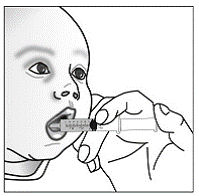
Paso 12. Para asegurarse de que se administre todo el medicamento a su bebé:
- Repita el paso 4 anterior.
- Revuelva con una cucharadita.
- Luego, repite Pasos 10 y 11 anteriores (ver Figura V ).
Figura V
Paso 13. Retire el émbolo de la jeringa de dosificación oral. Lave el recipiente, la cucharilla y la jeringa de dosificación oral. Permita que el émbolo y el cilindro de la jeringa se sequen antes de volver a armarlos.
Paso 14. Deseche la toalla de papel y limpie la superficie de trabajo. Lava tus manos.
¿Cómo debo conservar SUSTIVA 600mg cápsulas?
- Guarde las cápsulas de SUSTIVA a temperatura ambiente, entre 68 °F y 77 °F (20 °C y 25 °C).
Mantenga las cápsulas de SUSTIVA 600 mg y todos los medicamentos fuera del alcance de los niños.
Estas Instrucciones de uso han sido aprobadas por la Administración de Drogas y Alimentos de EE. UU.
