Ventolin Inhaler 100mcg Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Ventolin y cómo se usa?
Ventolin HFA es un medicamento recetado que se usa para tratar los síntomas del asma aguda o grave o inducida por el ejercicio (broncoespasmo). Ventolin HFA se puede usar solo o con otros medicamentos.
Ventolin HFA pertenece a una clase de medicamentos llamados agonistas beta2.
No se sabe si Ventolin HFA es seguro y eficaz en niños menores de 4 años.
¿Cuáles son los posibles efectos secundarios de Ventolin?
Ventolin puede causar efectos secundarios graves que incluyen:
- sibilancias,
- asfixia,
- problemas respiratorios,
- Dolor de pecho,
- frecuencia cardíaca rápida,
- latidos del corazón palpitantes,
- revoloteando en tu pecho,
- dolor de cabeza intenso,
- latidos en el cuello o las orejas,
- dolor o ardor al orinar,
- aumento de la sed,
- aumento de la micción,
- boca seca,
- aliento con olor afrutado,
- calambres en las piernas,
- estreñimiento
- latidos irregulares del corazón,
- entumecimiento u hormigueo,
- debilidad muscular y
- sensación de cojera
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Ventolin incluyen:
- Dolor de pecho,
- latidos del corazón rápidos o fuertes,
- mareo,
- sentirse tembloroso,
- nerviosismo,
- dolor de cabeza,
- dolor de espalda,
- dolor de cuerpo,
- dolor de barriga,
- dolor de garganta,
- dolor en los senos paranasales y
- nariz mocosa o congestionada
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Ventolin. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
El componente activo de VENTOLIN HFA es el sulfato de albuterol, USP, la forma racémica del albuterol y un broncodilatador beta-adrenérgico relativamente selectivo. El sulfato de albuterol tiene el nombre químico α1 - [(terc-butilamino)metil]-4-hidroxi-m-xileno-α, α'-diol sulfato (2:1)(sal) y la siguiente estructura química:
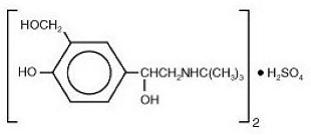
El sulfato de albuterol es un polvo cristalino blanco con un peso molecular de 576,7 y la fórmula empírica es (C13H21NO3)2•H2SO4. Es soluble en agua y ligeramente soluble en etanol.
El nombre recomendado por la Organización Mundial de la Salud para la base de albuterol es salbutamol.
VENTOLIN HFA es un inhalador de plástico azul con una correa azul que contiene un bote de aerosol de dosis medida presurizado equipado con un contador. Cada bote contiene una suspensión microcristalina de sulfato de albuterol en propelente HFA-134a (1,1,1,2-tetrafluoroetano). No contiene otros excipientes.
Después del cebado, cada activación del inhalador libera 120 mcg de sulfato de albuterol, USP en 75 mg de suspensión de la válvula y 108 mcg de sulfato de albuterol, USP de la boquilla (equivalente a 90 mcg de base de albuterol de la boquilla).
Cebe VENTOLIN HFA antes de usarlo por primera vez, cuando el inhalador no se haya usado durante más de 2 semanas o cuando el inhalador se haya caído. Para preparar VENTOLIN HFA, libere 4 rocíos en el aire lejos de la cara, agitando bien antes de cada rocío.
INDICACIONES
broncoespasmo
El aerosol para inhalación VENTOLIN® HFA está indicado para el tratamiento o la prevención del broncoespasmo en pacientes a partir de los 4 años con enfermedad obstructiva reversible de las vías respiratorias.
Broncoespasmo inducido por el ejercicio
VENTOLIN HFA está indicado para la prevención del broncoespasmo inducido por el ejercicio en pacientes a partir de los 4 años.
DOSIFICACIÓN Y ADMINISTRACIÓN
broncoespasmo
Para el tratamiento de episodios agudos de broncoespasmo o prevención de los síntomas asociados al broncoespasmo, la posología habitual para adultos y niños es de 2 inhalaciones repetidas cada 4 a 6 horas; en algunos pacientes, 1 inhalación cada 4 horas puede ser suficiente. No se recomienda una administración más frecuente ni un mayor número de inhalaciones.
Broncoespasmo inducido por el ejercicio
Para la prevención del broncoespasmo inducido por el ejercicio, la dosis habitual para adultos y niños mayores de 4 años es de 2 inhalaciones 15 a 30 minutos antes del ejercicio.
Información de administración
VENTOLIN HFA debe administrarse únicamente por vía oral inhalada.
Cebado
El cebado de VENTOLIN HFA es fundamental para garantizar un contenido adecuado de albuterol en cada actuación. Cebe VENTOLIN HFA antes de usarlo por primera vez, cuando el inhalador no se haya usado durante más de 2 semanas o cuando el inhalador se haya caído. Para preparar VENTOLIN HFA, libere 4 rocíos en el aire lejos de la cara, agitando bien antes de cada rocío.
Limpieza
Para garantizar una dosificación adecuada y evitar la obstrucción del orificio del actuador, lave el actuador con agua tibia y déjelo secar al aire por completo al menos una vez a la semana.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Aerosoles de inhalación. Inhalador de plástico azul con una correa azul que contiene un bote de aerosol de dosis medida presurizado que contiene 60 o 200 inhalaciones medidas y equipado con un contador. Cada actuación libera 108 mcg de sulfato de albuterol (90 mcg de base de albuterol) de la boquilla.
Almacenamiento y manipulación
Aerosol de inhalación VENTOLIN HFA se suministra en las siguientes cajas de 1 como un bote de aluminio presurizado equipado con un contador y provisto de un actuador de plástico azul con una tapa de correa azul:
CDN 0173-0682-20 Bote de 18 g con 200 pulsaciones CDN 0173-0682-21 Bote de 8 g con 60 pulsaciones CDN 0173-0682-24 Bote de paquete institucional de 8 g que contiene 60 aplicaciones
Cada inhalador está sellado en una bolsa de aluminio protectora contra la humedad con un desecante que debe desecharse cuando se abre la bolsa. Cada inhalador está empaquetado con un folleto de información para el paciente.
El actuador azul suministrado con VENTOLIN HFA no debe usarse con ningún otro recipiente de producto, y los actuadores de otros productos no deben usarse con un recipiente de VENTOLIN HFA.
VENTOLIN HFA tiene un contador adjunto al recipiente. El contador comienza en 204 o 64 y cuenta regresivamente cada vez que se libera un rocío. No se puede asegurar la cantidad correcta de medicamento en cada actuación después de que el contador marque 000, aunque el recipiente no esté completamente vacío y seguirá funcionando. El inhalador debe desecharse cuando el contador marque 000 o 12 meses después de sacarlo de la bolsa de aluminio protectora contra la humedad, lo que ocurra primero.
Mantener fuera del alcance de los niños. Evite rociar en los ojos.
Contenido bajo presión: No perforar. No use ni guarde cerca del calor o llama abierta. La exposición a temperaturas superiores a los 120 °F puede causar una explosión. Nunca arroje el recipiente al fuego o al incinerador.
Guárdelo a temperatura ambiente entre 68 °F y 77 °F (20 °C y 25 °C); excursiones permitidas de 59°F a 86°F (15°C a 30°C) [Ver Temperatura ambiente controlada por USP ]. Guarde el inhalador con la boquilla hacia abajo. Para obtener los mejores resultados, el inhalador debe estar a temperatura ambiente antes de su uso. AGITE BIEN ANTES DE CADA PULVERIZACIÓN.
GlaxoSmithKline, Research Triangle Park, NC 27709. Revisado: diciembre de 2014
EFECTOS SECUNDARIOS
El uso de VENTOLIN HFA puede estar asociado con lo siguiente:
- Broncoespasmo paradójico [ver ADVERTENCIAS Y PRECAUCIONES ]
- Efectos cardiovasculares [ver ADVERTENCIAS Y PRECAUCIONES ]
- Reacciones de hipersensibilidad inmediata [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hipopotasemia [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Los datos de seguridad que se describen a continuación reflejan la exposición a VENTOLIN HFA en 248 sujetos tratados con VENTOLIN HFA en 3 ensayos clínicos controlados con placebo de 2 a 12 semanas de duración. Los datos de adultos y adolescentes se basan en 2 ensayos clínicos en los que 202 sujetos con asma mayores de 12 años fueron tratados con inhalaciones de VENTOLIN HFA 2 4 veces al día durante 12 semanas. La población adulta/adolescente fue de 92 mujeres, 110 hombres y 163 blancos, 19 negros, 18 hispanos, 2 otros. Los datos de sujetos pediátricos se basan en 1 ensayo clínico en el que 46 sujetos con asma de 4 a 11 años de edad fueron tratados con inhalaciones de VENTOLIN HFA 2 4 veces al día durante 2 semanas. La población era de 21 mujeres, 25 hombres y 25 blancos, 17 negros, 3 hispanos, 1 otro.
Sujetos adultos y adolescentes de 12 años o más: Los dos ensayos doble ciego, aleatorizados y de 12 semanas de duración en 610 sujetos adultos y adolescentes con asma que compararon VENTOLIN HFA, un inhalador de albuterol propulsado por CFC 11/12 y un inhalador de placebo HFA-134a. En general, la incidencia y la naturaleza de las reacciones adversas informadas para VENTOLIN HFA y un inhalador de albuterol propulsado por CFC 11/12 fueron comparables. La Tabla 1 enumera la incidencia de todas las reacciones adversas (ya sea que el investigador las considere relacionadas o no con el fármaco) de estos ensayos que ocurrieron a una tasa del 3 % o más en el grupo tratado con VENTOLIN HFA y con mayor frecuencia en el grupo tratado con VENTOLIN HFA que en el grupo del inhalador de placebo HFA-134a.
Las reacciones adversas informadas por menos del 3 % de los sujetos adultos y adolescentes que recibieron VENTOLIN HFA y por una mayor proporción de sujetos que recibieron VENTOLIN HFA que los que recibieron HFA-134a como inhalador de placebo y que tienen el potencial de estar relacionadas con VENTOLIN HFA incluyen diarrea, laringitis, edema orofaríngeo, tos, trastornos pulmonares, taquicardia y extrasístoles. También se han observado palpitaciones y mareos con VENTOLIN HFA.
Sujetos pediátricos de 4 a 11 años: Los resultados del ensayo clínico de 2 semanas en sujetos pediátricos con asma de 4 a 11 años mostraron que esta población pediátrica tenía un perfil de reacciones adversas similar al de las poblaciones de adultos y adolescentes.
Se han realizado tres ensayos para evaluar la seguridad y eficacia de VENTOLIN HFA en sujetos entre el nacimiento y los 4 años de edad. Los resultados de estos ensayos no establecieron la eficacia de VENTOLIN HFA en este grupo de edad [ver Uso en poblaciones específicas ]. Dado que no se ha demostrado la eficacia de VENTOLIN HFA en niños entre el nacimiento y los 48 meses de edad, no se puede establecer la seguridad de VENTOLIN HFA en este grupo de edad. Sin embargo, el perfil de seguridad observado en la población pediátrica menor de 4 años fue comparable al observado en los sujetos pediátricos de mayor edad y en adultos y adolescentes. Donde las tasas de incidencia de reacciones adversas fueron mayores en sujetos menores de 4 años en comparación con sujetos mayores, las tasas de incidencia más altas se observaron en todos los brazos de tratamiento, incluido el placebo. Estas reacciones adversas incluyeron infección del tracto respiratorio superior, nasofaringitis, pirexia y taquicardia.
Experiencia posterior a la comercialización
Además de las reacciones adversas informadas en los ensayos clínicos, se identificaron las siguientes reacciones adversas durante el uso posterior a la aprobación del sulfato de albuterol. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco. Estos eventos se eligieron para su inclusión debido a su gravedad, frecuencia de notificación o conexión causal con el albuterol o una combinación de estos factores.
Se han notificado casos de broncoespasmo paradójico, ronquera, arritmias (incluyendo fibrilación auricular, taquicardia supraventricular) y reacciones de hipersensibilidad (incluyendo urticaria, angioedema, exantema) después del uso de VENTOLIN HFA.
Además, el albuterol, al igual que otros agentes simpaticomiméticos, puede causar reacciones adversas como hipopotasemia, hipertensión, vasodilatación periférica, angina de pecho, temblor, estimulación del sistema nervioso central, hiperactividad, insomnio, dolor de cabeza, calambres musculares, sequedad o irritación de la orofaringe y alteraciones metabólicas. acidosis.
INTERACCIONES CON LA DROGAS
Otros broncodilatadores en aerosol simpaticomiméticos de acción corta no deben usarse concomitantemente con albuterol. Si se van a administrar fármacos adrenérgicos adicionales por cualquier vía, deben usarse con precaución para evitar efectos cardiovasculares nocivos.
Agentes bloqueadores de los receptores beta-adrenérgicos
Los bloqueadores beta no solo bloquean el efecto pulmonar de los agonistas beta, como VENTOLIN HFA, sino que también pueden producir broncoespasmo grave en pacientes con asma. Por lo tanto, los pacientes con asma normalmente no deben ser tratados con betabloqueantes. Sin embargo, bajo ciertas circunstancias, puede que no existan alternativas aceptables al uso de agentes bloqueadores beta-adrenérgicos para estos pacientes; Podrían considerarse los betabloqueantes cardioselectivos, aunque deben administrarse con precaución.
Diuréticos no ahorradores de potasio
Los cambios en el ECG y/o la hipopotasemia que pueden resultar de la administración de diuréticos no ahorradores de potasio (como los diuréticos de asa o tiazídicos) pueden empeorar de forma aguda con los beta-agonistas, especialmente cuando se excede la dosis recomendada del beta-agonista. Aunque se desconoce la importancia clínica de estos efectos, se recomienda precaución en la coadministración de VENTOLIN HFA con diuréticos no ahorradores de potasio.
Digoxina
Se demostraron disminuciones medias del 16 % al 22 % en los niveles séricos de digoxina después de la administración de dosis única intravenosa y oral de albuterol, respectivamente, a voluntarios normales que habían recibido digoxina durante 10 días. No está clara la relevancia clínica de estos hallazgos para los pacientes con enfermedad obstructiva de las vías respiratorias que reciben albuterol y digoxina inhalados de forma crónica. Sin embargo, sería prudente evaluar cuidadosamente los niveles séricos de digoxina en pacientes que actualmente reciben digoxina y albuterol.
Inhibidores de la monoaminooxidasa y antidepresivos tricíclicos
VENTOLIN HFA debe administrarse con extrema precaución a los pacientes que reciben tratamiento con inhibidores de la monoaminooxidasa o antidepresivos tricíclicos, o dentro de las 2 semanas posteriores a la suspensión de dichos agentes, ya que la acción del albuterol en el sistema vascular puede verse potenciada.
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Broncoespasmo paradójico
VENTOLIN HFA puede producir broncoespasmo paradójico, que puede poner en peligro la vida. Si se produce un broncoespasmo paradójico después de la administración de VENTOLIN HFA, se debe suspender inmediatamente y se debe instituir una terapia alternativa. Debe reconocerse que el broncoespasmo paradójico, cuando se asocia con formulaciones inhaladas, ocurre con frecuencia con el primer uso de un recipiente nuevo.
Deterioro del asma
El asma puede empeorar de forma aguda durante un período de horas o de forma crónica durante varios días o más. Si el paciente necesita más dosis de VENTOLIN HFA de lo habitual, esto puede ser un marcador de desestabilización del asma y requiere una reevaluación del paciente y del régimen de tratamiento, prestando especial atención a la posible necesidad de tratamiento antiinflamatorio, por ejemplo, corticosteroides.
Uso de agentes antiinflamatorios
El uso de broncodilatadores agonistas beta-adrenérgicos solos puede no ser adecuado para controlar el asma en muchos pacientes. Se debe considerar desde el principio la adición de agentes antiinflamatorios, por ejemplo, corticosteroides, al régimen terapéutico.
Efectos cardiovasculares
VENTOLIN HFA, como todos los demás agonistas beta2-adrenérgicos, puede producir efectos cardiovasculares clínicamente significativos en algunos pacientes, como cambios en la frecuencia del pulso o la presión arterial. Si ocurren tales efectos, es posible que sea necesario suspender VENTOLIN HFA. Además, se ha informado que los beta-agonistas producen cambios en el electrocardiograma (ECG), como aplanamiento de la onda T, prolongación del intervalo QTc y depresión del segmento ST. Se desconoce la relevancia clínica de estos hallazgos. Por lo tanto, VENTOLIN HFA, como todas las demás aminas simpaticomiméticas, debe usarse con precaución en pacientes con trastornos cardiovasculares subyacentes, especialmente insuficiencia coronaria, arritmias cardíacas e hipertensión.
No exceda la dosis recomendada
Se han informado muertes en asociación con el uso excesivo de fármacos simpaticomiméticos inhalados en pacientes con asma. Se desconoce la causa exacta de la muerte, pero se sospecha un paro cardíaco después de un desarrollo inesperado de una crisis asmática aguda grave y la hipoxia subsiguiente.
Reacciones de hipersensibilidad inmediata
Pueden ocurrir reacciones de hipersensibilidad inmediata (p. ej., urticaria, angioedema, erupción cutánea, broncoespasmo, hipotensión), incluida la anafilaxia, después de la administración de VENTOLIN HFA [ver CONTRAINDICACIONES ].
Condiciones coexistentes
VENTOLIN HFA, al igual que otras aminas simpaticomiméticas, debe usarse con precaución en pacientes con trastornos convulsivos, hipertiroidismo o diabetes mellitus y en pacientes que responden de manera inusual a las aminas simpaticomiméticas. Se ha informado que grandes dosis de albuterol intravenoso agravan la diabetes mellitus y la cetoacidosis preexistentes.
Hipopotasemia
Los medicamentos agonistas beta-adrenérgicos pueden producir una hipopotasemia significativa en algunos pacientes, posiblemente a través de una derivación intracelular, que tiene el potencial de producir efectos cardiovasculares adversos [ver FARMACOLOGÍA CLÍNICA ]. La disminución del potasio sérico suele ser transitoria, no requiriendo suplementación.
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( INFORMACIÓN DEL PACIENTE e Instrucciones de uso ).
Frecuencia de uso
Informe a los pacientes que la acción de VENTOLIN HFA debe durar hasta 4 a 6 horas. No use VENTOLIN HFA con más frecuencia de lo recomendado. Indique a los pacientes que no aumenten la dosis o la frecuencia de las dosis de VENTOLIN HFA sin consultar al médico. Indique a los pacientes que busquen atención médica de inmediato si el tratamiento con VENTOLIN HFA se vuelve menos efectivo para el alivio sintomático, los síntomas empeoran y/o necesitan usar el producto con más frecuencia de lo habitual.
Cebado
Indique a los pacientes que preparen VENTOLIN HFA antes de usarlo por primera vez, cuando el inhalador no se haya usado durante más de 2 semanas o cuando el inhalador se haya caído. Para preparar VENTOLIN HFA, libere 4 rocíos en el aire lejos de la cara, agitando bien antes de cada rocío.
Limpieza
Para garantizar una dosificación adecuada y evitar el bloqueo del orificio del actuador, indique a los pacientes que laven el actuador con agua tibia y que lo dejen secar al aire por completo al menos una vez a la semana. Informe a los pacientes que se incluyen instrucciones detalladas de limpieza en el folleto de información para el paciente.
Broncoespasmo paradójico
Informe a los pacientes que VENTOLIN HFA puede producir broncoespasmo paradójico. Indíqueles que descontinúen VENTOLIN HFA si ocurre broncoespasmo paradójico.
Uso concomitante de drogas
Aconseje a los pacientes que mientras estén usando VENTOLIN HFA, otros medicamentos inhalados y medicamentos para el asma deben tomarse solo según las indicaciones del médico.
Efectos adversos comunes
Los efectos adversos comunes del tratamiento con albuterol inhalado incluyen palpitaciones, dolor de pecho, frecuencia cardíaca rápida, temblor y nerviosismo.
El embarazo
Aconseje a las pacientes embarazadas o lactantes que se comuniquen con sus médicos sobre el uso de VENTOLIN HFA.
VENTOLIN es una marca registrada del grupo de empresas GSK. Las demás marcas enumeradas son marcas comerciales de sus respectivos propietarios y no son marcas comerciales del grupo de empresas GSK. Los fabricantes de estas marcas no están afiliados ni respaldan al grupo de empresas GSK ni a sus productos.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
En un estudio de 2 años en ratas Sprague-Dawley, el sulfato de albuterol provocó un aumento relacionado con la dosis en la incidencia de leiomiomas benignos del mesovario a dosis dietéticas y superiores de 2,0 mg/kg (aproximadamente 14 y 6 veces la MRHDID para adultos y niños, respectivamente, sobre una base de mg/m). En otro estudio, este efecto fue bloqueado por la coadministración de propranolol, un antagonista betaadrenérgico no selectivo. En un estudio de 18 meses en ratones CD-1, el sulfato de albuterol no mostró evidencia de tumorigenicidad en dosis dietéticas de hasta 500 mg/kg (aproximadamente 1700 y 800 veces la MRHDID para adultos y niños, respectivamente, sobre una base de mg/m² ). En un estudio de 22 meses en hámsteres dorados, el sulfato de albuterol no mostró evidencia de tumorigenicidad en dosis dietéticas de hasta 50 mg/kg (aproximadamente 225 y 110 veces la MRHDID para adultos y niños, respectivamente, sobre una base de mg/m²).
El sulfato de albuterol no fue mutagénico en la prueba de Ames ni en una prueba de mutación en levadura. El sulfato de albuterol no fue clastogénico en un ensayo de linfocitos periféricos humanos o en un ensayo de micronúcleo de ratón de la cepa AH1.
Los estudios de reproducción en ratas no demostraron evidencia de alteración de la fertilidad con dosis orales de sulfato de albuterol de hasta 50 mg/kg (aproximadamente 340 veces la MRHDID para adultos sobre una base de mg/m).
Uso en poblaciones específicas
El embarazo
Efectos teratogénicos
Embarazo Categoría C. No existen ensayos adecuados y bien controlados con VENTOLIN HFA o sulfato de albuterol en mujeres embarazadas. Durante la experiencia de comercialización a nivel mundial, se han informado diversas anomalías congénitas, que incluyen paladar hendido y defectos en las extremidades, en los hijos de pacientes tratados con albuterol. Algunas de las madres estaban tomando múltiples medicamentos durante sus embarazos. No se puede discernir un patrón consistente de defectos, y no se ha establecido una relación entre el uso de albuterol y las anomalías congénitas. Los estudios de reproducción animal en ratones y conejos revelaron evidencia de teratogenicidad. VENTOLIN HFA debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto. Se debe recomendar a las mujeres que se comuniquen con sus médicos si quedan embarazadas mientras toman VENTOLIN HFA.
En un estudio de reproducción en ratones, el sulfato de albuterol administrado por vía subcutánea produjo la formación de paladar hendido en 5 de 111 (4,5 %) fetos con exposiciones inferiores a la dosis inhalatoria diaria máxima recomendada en humanos (MRHDID) para adultos sobre una base de mg/m² y en 10 de 108 (9,3 %) fetos con aproximadamente 8 veces la MRHDID. No se observaron efectos similares con aproximadamente una undécima parte de la MRHDID. El paladar hendido también ocurrió en 22 de 72 (30,5%) fetos de mujeres tratadas por vía subcutánea con isoproterenol (control positivo).
En un estudio de reproducción en conejos, el sulfato de albuterol administrado por vía oral produjo craneosquisis en 7 de 19 fetos (37 %) a aproximadamente 680 veces la MRHDID.
En otro estudio con conejos, una formulación de sulfato de albuterol/HFA-134a administrada por inhalación produjo agrandamiento de la porción frontal de las fontanelas fetales en aproximadamente un tercio de la MRHDID.
Efectos no teratogénicos
Un estudio en el que se administró sulfato de albuterol radiomarcado a ratas preñadas demostró que el material relacionado con el fármaco se transfiere de la circulación materna al feto.
Trabajo y entrega
No existen ensayos bien controlados en humanos que hayan investigado los efectos de VENTOLIN HFA en el trabajo de parto prematuro o a término. Debido al potencial de interferencia de los betaagonistas con la contractilidad uterina, el uso de VENTOLIN HFA durante el trabajo de parto debe restringirse a aquellas pacientes en las que los beneficios claramente superan los riesgos.
Madres lactantes
Los niveles plasmáticos de sulfato de albuterol y HFA-134a después de dosis terapéuticas inhaladas son muy bajos en humanos, pero no se sabe si los componentes de VENTOLIN HFA se excretan en la leche humana. Debido al potencial de tumorigenicidad demostrado para el albuterol en estudios con animales y la falta de experiencia con el uso de VENTOLIN HFA por parte de madres lactantes, se debe tomar la decisión de suspender la lactancia o suspender el fármaco, teniendo en cuenta la importancia del fármaco para La madre. Se debe tener precaución cuando se administra VENTOLIN HFA a mujeres lactantes.
Uso pediátrico
La seguridad y la eficacia de VENTOLIN HFA en niños de 4 años o más se establecieron en base a dos ensayos clínicos de 12 semanas en sujetos de 12 años o más con asma y un ensayo clínico de 2 semanas en sujetos de 4 a 11 años con asma. [ver REACCIONES ADVERSAS , Estudios clínicos ]. No se ha establecido la seguridad y eficacia de VENTOLIN HFA en niños menores de 4 años. Se realizaron tres ensayos para evaluar la seguridad y eficacia de VENTOLIN HFA en sujetos menores de 4 años y los resultados se describen a continuación.
Se realizaron dos ensayos aleatorizados, doble ciego, controlados con placebo de 4 semanas de duración en 163 sujetos pediátricos desde el nacimiento hasta los 48 meses con síntomas de broncoespasmo asociado con la enfermedad obstructiva de las vías respiratorias (los síntomas de presentación incluyeron: sibilancias, tos, disnea u opresión en el pecho) . VENTOLIN HFA o placebo HFA se administró con una cámara de retención con válvula AeroChamber Plus® o una cámara de retención con válvula Optichamber® con máscara 3 veces al día. En un ensayo, se administraron 90 mcg de VENTOLIN HFA (n = 26), 180 mcg de VENTOLIN HFA (n = 25) y HFA de placebo (n = 26) a niños de 24 a 48 meses de edad. En el segundo ensayo, se administraron VENTOLIN HFA 90 mcg (n = 29), VENTOLIN HFA 180 mcg (n = 29) y placebo HFA (n = 28) a niños con edades comprendidas entre el nacimiento y los 24 meses. Durante el período de tratamiento de 4 semanas, no hubo diferencias de tratamiento en las puntuaciones de síntomas de asma entre los grupos que recibieron VENTOLIN HFA 90 mcg, VENTOLIN HFA 180 mcg y placebo en cualquiera de los ensayos.
En un tercer ensayo, VENTOLIN HFA se evaluó en 87 sujetos pediátricos menores de 24 meses para el tratamiento de sibilancias agudas. VENTOLIN HFA se entregó con una cámara de retención con válvula AeroChamber Plus en esta prueba. No hubo diferencias significativas en las puntuaciones de los síntomas del asma y el cambio medio desde el inicio en una puntuación de los síntomas del asma entre VENTOLIN HFA 180 mcg y VENTOLIN HFA 360 mcg.
Se realizaron estudios de caracterización de dosis in vitro para evaluar la administración de VENTOLIN HFA a través de cámaras de retención con máscaras adheridas. Los estudios se realizaron con 2 cámaras de retención diferentes con máscaras (tamaño pequeño y mediano). Los datos del estudio in vitro al simular la respiración del paciente sugieren que la dosis de VENTOLIN HFA presentada para inhalación a través de una cámara de retención con válvula y mascarilla será comparable a la dosis administrada en adultos sin espaciador ni mascarilla por kilogramo de peso corporal (Tabla 2). Sin embargo, los ensayos clínicos en niños menores de 4 años descritos anteriormente sugieren que no se ha definido la dosis óptima de VENTOLIN HFA en este grupo de edad o que VENTOLIN HFA no es efectivo en este grupo de edad. No se ha demostrado la seguridad y eficacia de VENTOLIN HFA administrado con o sin un dispositivo espaciador en niños menores de 4 años.
Uso geriátrico
Los ensayos clínicos de VENTOLIN HFA no incluyeron un número suficiente de sujetos de 65 años o más para determinar si los sujetos mayores responden de manera diferente a los sujetos más jóvenes. Otra experiencia clínica informada no ha identificado diferencias en las respuestas entre los ancianos y los pacientes más jóvenes. En general, la selección de la dosis para un paciente de edad avanzada debe ser cautelosa, generalmente comenzando en el extremo inferior del rango de dosificación, lo que refleja la mayor frecuencia de disminución de la función hepática, renal o cardíaca, y de enfermedades concomitantes u otra terapia con medicamentos.
SOBREDOSIS
Los signos y síntomas esperados con una sobredosis de albuterol son los de una estimulación beta-adrenérgica excesiva y/o la aparición o exageración de cualquiera de los signos y síntomas de la estimulación beta-adrenérgica (p. ej., convulsiones, angina, hipertensión o hipotensión, taquicardia con tasas de hasta a 200 latidos/min, arritmias, nerviosismo, dolor de cabeza, temblor, calambres musculares, sequedad de boca, palpitaciones, náuseas, mareos, fatiga, malestar general, insomnio, hiperglucemia, hipopotasemia, acidosis metabólica).
Al igual que con todos los medicamentos simpaticomiméticos inhalados, una sobredosis de VENTOLIN HFA en aerosol para inhalación puede asociar un paro cardíaco e incluso la muerte.
El tratamiento consiste en la interrupción de VENTOLIN HFA junto con la terapia sintomática adecuada. Se puede considerar el uso juicioso de un bloqueador beta-receptor cardioselectivo, teniendo en cuenta que dicha medicación puede producir broncoespasmo. No hay evidencia suficiente para determinar si la diálisis es beneficiosa para la sobredosis de VENTOLIN HFA.
CONTRAINDICACIONES
VENTOLIN HFA está contraindicado en pacientes con antecedentes de hipersensibilidad a cualquiera de los ingredientes [ver ADVERTENCIAS Y PRECAUCIONES , DESCRIPCIÓN ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
Los estudios in vitro y los estudios farmacológicos in vivo han demostrado que el albuterol tiene un efecto preferencial sobre los receptores beta2-adrenérgicos en comparación con el isoproterenol. Aunque los receptores adrenérgicos beta2 son los receptores adrenérgicos predominantes en el músculo liso bronquial y los receptores adrenérgicos beta1 son los receptores predominantes en el corazón, también hay receptores adrenérgicos beta2 en el corazón humano que comprenden del 10% al 50% de los receptores adrenérgicos beta totales. No se ha establecido la función precisa de estos receptores, pero su presencia plantea la posibilidad de que incluso los agonistas beta2 selectivos puedan tener efectos cardíacos.
La activación de los receptores beta2-adrenérgicos en el músculo liso de las vías respiratorias conduce a la activación de la adenilciclasa ya un aumento de la concentración intracelular de monofosfato de adenosina cíclico-3',5' (AMP cíclico). Este aumento de AMP cíclico conduce a la activación de la proteína cinasa A, que inhibe la fosforilación de la miosina y reduce las concentraciones de calcio iónico intracelular, lo que produce relajación. El albuterol relaja los músculos lisos de todas las vías respiratorias, desde la tráquea hasta los bronquiolos terminales. El albuterol actúa como un antagonista funcional para relajar las vías respiratorias independientemente del espasmógeno involucrado, protegiendo así contra todos los desafíos broncoconstrictores. Las concentraciones aumentadas de AMP cíclico también están asociadas con la inhibición de la liberación de mediadores de los mastocitos en las vías respiratorias.
Se ha demostrado que el albuterol en la mayoría de los ensayos clínicos controlados tiene más efecto sobre el tracto respiratorio, en forma de relajación del músculo liso bronquial, que el isoproterenol en dosis comparables y produce menos efectos cardiovasculares. Los estudios clínicos controlados y otra experiencia clínica han demostrado que el albuterol inhalado, al igual que otros fármacos agonistas beta-adrenérgicos, puede producir un efecto cardiovascular significativo en algunos pacientes, medido por la frecuencia del pulso, la presión arterial, los síntomas y/o los cambios electrocardiográficos [ver ADVERTENCIAS Y PRECAUCIONES ].
Farmacocinética
Los niveles sistémicos de albuterol son bajos después de la inhalación de las dosis recomendadas. Un ensayo realizado en 12 sujetos masculinos y femeninos sanos usando una dosis más alta (1080 mcg de base de albuterol) mostró que se produjeron concentraciones plasmáticas máximas medias de aproximadamente 3 ng/mL después de la dosificación cuando se administró albuterol usando el propulsor HFA-134a. El tiempo medio hasta las concentraciones máximas (Tmax) se retrasó después de la administración de VENTOLIN HFA (Tmax= 0,42 horas) en comparación con el inhalador de albuterol propulsado por CFC (Tmax= 0,17 horas). La semivida plasmática terminal aparente del albuterol es de aproximadamente 4,6 horas. No se realizaron más ensayos farmacocinéticos para VENTOLIN HFA en recién nacidos, niños o ancianos.
Toxicología Animal Y/o Farmacología
preclínico
Los estudios intravenosos en ratas con sulfato de albuterol han demostrado que el albuterol cruza la barrera hematoencefálica y alcanza concentraciones cerebrales de aproximadamente el 5,0% de las concentraciones plasmáticas. En estructuras fuera de la barrera hematoencefálica (glándulas pineal y pituitaria), se encontró que las concentraciones de albuterol eran 100 veces mayores que en todo el cerebro.
Los estudios en animales de laboratorio (minicerdos, roedores y perros) han demostrado la aparición de arritmias cardíacas y muerte súbita (con evidencia histológica de necrosis miocárdica) cuando se administran simultáneamente beta-agonistas y metilxantinas. Se desconoce la relevancia clínica de estos hallazgos.
Propelente HFA-134a
En animales y humanos, se encontró que el propulsor HFA-134a se absorbía y eliminaba rápidamente, con una vida media de eliminación de 3 a 27 minutos en animales y de 5 a 7 minutos en humanos. El tiempo hasta la concentración plasmática máxima (Tmax) y el tiempo medio de residencia son extremadamente cortos, lo que da lugar a una aparición transitoria de HFA-134a en la sangre sin evidencia de acumulación.
El propulsor HFA-134a carece de actividad farmacológica excepto en dosis muy altas en animales (es decir, de 380 a 1300 veces la exposición humana máxima según las comparaciones del área bajo los valores de la curva de concentración plasmática versus tiempo [AUC]), lo que produce principalmente ataxia, temblores , disnea o salivación. Estos eventos son similares a los efectos producidos por los CFC estructuralmente relacionados, que se han utilizado ampliamente en inhaladores de dosis medidas.
Estudios clínicos
Broncoespasmo asociado con el asma
Sujetos adultos y adolescentes de 12 años de edad y mayores
La eficacia de VENTOLIN HFA se evaluó en dos ensayos controlados con placebo, doble ciego, aleatorizados, de 12 semanas de duración en sujetos de 12 años o más con asma leve a moderada. Estos ensayos incluyeron un total de 610 sujetos (323 hombres, 287 mujeres). En cada ensayo, los sujetos recibieron 2 inhalaciones de VENTOLIN HFA, albuterol propulsado por CFC 11/12 o placebo HFA-134a 4 veces al día durante 12 semanas. Los sujetos que tomaron el inhalador de placebo HFA-134a también tomaron VENTOLIN HFA para el alivio de los síntomas del asma según fuera necesario. Algunos sujetos que participaron en estos ensayos clínicos estaban usando terapia concomitante con esteroides inhalados. La eficacia se evaluó mediante el volumen espiratorio forzado en serie en 1 segundo (FEV ). En cada uno de estos ensayos, 2 inhalaciones de VENTOLIN HFA produjeron una mejora significativamente mayor en FEV1 sobre el valor previo al tratamiento que el placebo. Los resultados de los 2 ensayos clínicos se describen a continuación.
En un ensayo doble ciego, aleatorizado, de 12 semanas, se comparó VENTOLIN HFA (101 sujetos) con albuterol propulsado con CFC 11/12 (99 sujetos) y un inhalador de placebo HFA-134a (97 sujetos) en sujetos adolescentes y adultos de 12 a 76 años con asma leve a moderada. Las mediciones seriadas de FEV1 [que se muestran a continuación como cambio porcentual desde el valor inicial del día de la prueba en el día 1 (n = 297) y en la semana 12 (n = 249)] demostraron que 2 inhalaciones de VENTOLIN HFA produjeron una mejora significativamente mayor en FEV1 sobre el valor previo al tratamiento que placebo.
FEV1 como cambio porcentual de la predosis en un ensayo clínico grande de 12 semanas el día 1 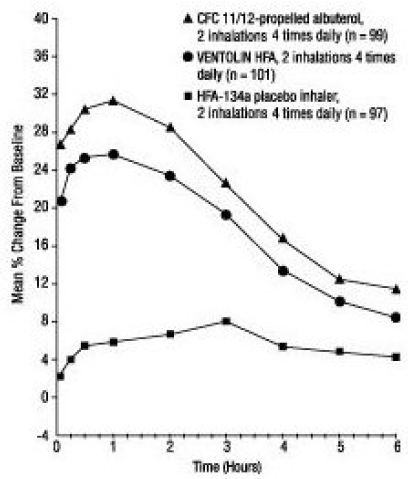
semana 12 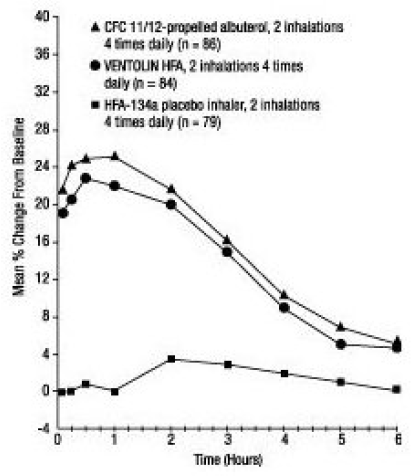
En la población respondedora (mayor o igual al 15 % de aumento en el FEV1 dentro de los 30 minutos posteriores a la dosis) tratada con VENTOLIN HFA, el tiempo medio hasta el inicio de un aumento del 15 % en el FEV1 sobre el valor previo al tratamiento fue de 5,4 minutos, y el tiempo medio para el efecto máximo fue de 56 minutos. La duración media del efecto medida por un aumento del 15 % en FEV1 sobre el valor previo al tratamiento fue de aproximadamente 4 horas. En algunos sujetos, la duración del efecto fue de hasta 6 horas.
El segundo ensayo aleatorizado doble ciego de 12 semanas se llevó a cabo para evaluar la eficacia y la seguridad de cambiar a los sujetos de albuterol propulsado con CFC 11/12 a VENTOLIN HFA. Durante la fase preliminar de 3 semanas del ensayo, todos los sujetos recibieron albuterol propulsado con CFC 11/12. Durante la fase de tratamiento doble ciego, VENTOLIN HFA (91 sujetos) se comparó con albuterol propulsado por CFC 11/12 (100 sujetos) y un inhalador de placebo HFA-134a (95 sujetos) en sujetos adultos y adolescentes con asma leve a moderada. Las mediciones seriales de FEV1 demostraron que 2 inhalaciones de VENTOLIN HFA produjeron una mejoría significativamente mayor en la función pulmonar que el placebo. El cambio del inhalador de albuterol propulsado por CFC 11/12 a VENTOLIN HFA no reveló cambios clínicamente significativos en el perfil de eficacia.
En los 2 ensayos en adultos, los resultados de eficacia de VENTOLIN HFA fueron significativamente mayores que los del placebo y fueron clínicamente comparables a los logrados con el albuterol propulsado con CFC 11/12, aunque se observaron pequeñas diferencias numéricas en la respuesta media del FEV1 y otras medidas. Los médicos deben reconocer que las respuestas individuales a los agonistas beta-adrenérgicos administrados a través de diferentes propulsores pueden variar y que no se deben asumir respuestas equivalentes en pacientes individuales.
Sujetos pediátricos de 4 a 11 años de edad
La eficacia de VENTOLIN HFA se evaluó en un ensayo de 2 semanas, aleatorizado, doble ciego, controlado con placebo en 135 sujetos pediátricos de 4 a 11 años con asma leve a moderada. En este ensayo, los sujetos recibieron VENTOLIN HFA, albuterol propulsado por CFC 11/12 o placebo HFA-134a. Las mediciones seriadas de la función pulmonar demostraron que 2 inhalaciones de VENTOLIN HFA produjeron una mejoría significativamente mayor en la función pulmonar que el placebo y que no hubo diferencias significativas entre los grupos tratados con VENTOLIN HFA y albuterol propulsado por CFC 11/12. En la población respondedora tratada con VENTOLIN HFA, el tiempo medio hasta el inicio de un aumento del 15 % en la tasa de flujo espiratorio máximo (PEFR) sobre el valor previo al tratamiento fue de 7,8 minutos, y el tiempo medio hasta el efecto máximo fue de aproximadamente 90 minutos. La duración media del efecto medida por un aumento del 15 % en el PEFR sobre el valor previo al tratamiento fue superior a 3 horas. En algunos sujetos, la duración del efecto fue de hasta 6 horas.
Broncoespasmo inducido por el ejercicio
Un ensayo clínico controlado en sujetos adultos con asma (N = 24) demostró que 2 inhalaciones de VENTOLIN HFA tomadas aproximadamente 30 minutos antes del ejercicio previnieron significativamente el broncoespasmo inducido por el ejercicio (medido por el porcentaje máximo de caída en FEV1 después del ejercicio) en comparación con un HFA-134a inhalador de placebo Además, se demostró que VENTOLIN HFA es clínicamente comparable a un inhalador de albuterol propulsado por CFC 11/12 para esta indicación.
INFORMACIÓN DEL PACIENTE
VENTOLIN® [vent' o-lin] HFA (sulfato de albuterol) Aerosol para inhalación
Lea la información para el paciente que viene con el aerosol para inhalación VENTOLIN HFA antes de comenzar a usarlo y cada vez que renueve su receta. Es posible que haya nueva información. Esta información del paciente no reemplaza la conversación con su proveedor de atención médica sobre su condición médica o tratamiento.
¿Qué es VENTOLIN HFA?
VENTOLIN HFA es un medicamento inhalado recetado que se usa en personas de 4 años o más para:
- tratar o prevenir el broncoespasmo en personas con enfermedad obstructiva reversible de las vías respiratorias
- prevenir el broncoespasmo inducido por el ejercicio
No se sabe si VENTOLIN HFA es seguro y efectivo en niños menores de 4 años.
¿Quién no debe usar VENTOLIN HFA?
No use VENTOLIN HFA si es alérgico al sulfato de albuterol o a cualquiera de los ingredientes de VENTOLIN HFA. Consulte "¿Cuáles son los ingredientes de VENTOLIN HFA?" a continuación para obtener una lista completa de ingredientes.
¿Qué debo decirle a mi proveedor de atención médica antes de usar VENTOLIN HFA?
Informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si usted:
- tener problemas del corazón.
- tiene presión arterial alta.
- tener convulsiones.
- tiene problemas de tiroides.
- tener diabetes
- tiene niveles bajos de potasio en la sangre.
- es alérgico a alguno de los ingredientes de VENTOLIN HFA o a cualquier otro medicamento. Consulte "¿Cuáles son los ingredientes de VENTOLIN HFA?" a continuación para obtener una lista completa de ingredientes.
- tiene otras condiciones médicas.
- está embarazada o planea quedar embarazada. No se sabe si VENTOLIN HFA puede dañar a su bebé por nacer.
- están amamantando. No se sabe si el medicamento en VENTOLIN HFA pasa a la leche y si puede dañar a su bebé.
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos a base de hierbas. VENTOLIN HFA y ciertos otros medicamentos pueden interactuar entre sí. Esto puede causar efectos secundarios graves.
Informe especialmente a su proveedor de atención médica si toma:
- otros medicamentos inhalados o medicamentos para el asma
- medicamentos betabloqueantes
- diuréticos
- digoxina
- inhibidores de la monoaminooxidasa
- antidepresivos tricíclicos
Pídale a su proveedor de atención médica o farmacéutico una lista de estos medicamentos si no está seguro.
Conozca los medicamentos que toma. Mantenga una lista de ellos para mostrársela a su proveedor de atención médica y farmacéutico cuando obtenga un nuevo medicamento.
¿Cómo debo usar VENTOLIN HFA?
Lea las instrucciones paso a paso para usar VENTOLIN HFA al final de esta Información para el paciente.
- No haga use VENTOLIN HFA a menos que su proveedor de atención médica le haya enseñado cómo usar el inhalador y usted sepa cómo usarlo correctamente.
- Los niños deben usar VENTOLIN HFA con la ayuda de un adulto, según las instrucciones del proveedor de atención médica del niño.
- Use VENTOLIN HFA exactamente como se lo indique su proveedor de atención médica. No use VENTOLIN HFA con más frecuencia de lo recetado.
- No haga aumente su dosis o tome dosis adicionales de VENTOLIN HFA sin hablar primero con su proveedor de atención médica.
- Cada dosis de VENTOLIN HFA debe durar de 4 a 6 horas.
- Obtenga ayuda médica de inmediato si VENTOLIN HFA ya no ayuda con sus síntomas.
- Obtenga ayuda médica de inmediato si sus síntomas empeoran o si necesita usar su inhalador con más frecuencia.
- Mientras esté usando VENTOLIN HFA, use otros medicamentos inhalados y medicamentos para el asma solo según las indicaciones de su proveedor de atención médica.
- Llame a su proveedor de atención médica si sus síntomas de asma, como sibilancias y dificultad para respirar, empeoran en unas pocas horas o días. Es posible que su proveedor de atención médica necesite darle otro medicamento para tratar sus síntomas.
¿Cuáles son los posibles efectos secundarios de VENTOLIN HFA?
VENTOLIN HFA puede causar efectos secundarios graves, que incluyen:
- empeoramiento de la dificultad para respirar, tos y sibilancias (broncoespasmo paradójico). Si esto sucede, deje de usar VENTOLIN HFA y llame a su proveedor de atención médica o busque ayuda de emergencia de inmediato. Es más probable que ocurra un broncoespasmo paradójico con el primer uso de un nuevo envase de medicamento.
- problemas cardíacos, que incluyen frecuencia cardíaca más rápida y presión arterial más alta
- posible muerte en personas con asma que usan demasiado VENTOLIN HFA
- reacciones alérgicas graves. Llame a su proveedor de atención médica o busque atención médica de emergencia si presenta alguno de los siguientes síntomas de una reacción alérgica grave:
- sarpullido
- urticaria
- hinchazón de la cara, la boca y la lengua
- problemas respiratorios
- cambios en los niveles sanguíneos de laboratorio (azúcar, potasio)
Los efectos secundarios comunes de VENTOLIN HFA incluyen:
- dolor de garganta
- infección del tracto respiratorio superior, incluida la infección viral
- tos
- dolor muscular
- su corazón se siente como si estuviera latiendo con fuerza o acelerándose (palpitaciones)
- Dolor de pecho
- frecuencia cardíaca rápida
- inestabilidad
- nerviosismo
- mareo
Informe a su proveedor de atención médica sobre cualquier efecto secundario que le moleste o que no desaparezca.
Estos no son todos los efectos secundarios de VENTOLIN HFA. Consulte a su proveedor de atención médica o farmacéutico para obtener más información.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar VENTOLIN HFA?
- Guarde VENTOLIN HFA a temperatura ambiente entre 68 °F y 77 °F (20 °C y 25 °C) con la boquilla hacia abajo.
- El contenido de su VENTOLIN HFA está bajo presión: No perforar. No use ni guarde cerca del calor o llama abierta. Las temperaturas superiores a 120 °F pueden hacer que el recipiente explote.
- No arrojar al fuego oa un incinerador.
- Guarde VENTOLIN HFA en la bolsa de aluminio sin abrir y ábralo solo cuando esté listo para usar.
- Mantenga VENTOLIN HFA y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de VENTOLIN HFA
A veces, los medicamentos se recetan para fines no mencionados en el folleto de información para el paciente. No use VENTOLIN HFA para una condición para la cual no fue recetado. No le dé su VENTOLIN HFA a otras personas, incluso si tienen la misma condición que usted tiene. Puede que les haga daño.
Este folleto de información para el paciente resume la información más importante sobre VENTOLIN HFA. Si desea obtener más información, hable con su proveedor de atención médica o farmacéutico. Puede pedirle a su proveedor de atención médica o farmacéutico información sobre VENTOLIN HFA escrita para profesionales de atención médica.
Para obtener más información sobre VENTOLIN HFA, llame al 1-888-825-5249 o visite nuestro sitio web en www.ventolin.com.
¿Cuáles son los ingredientes de VENTOLIN HFA?
Ingrediente activo: sulfato de albuterol
Ingrediente inactivo: propelente HFA-134a
Instrucciones de uso
Solo para inhalación oral
Su inhalador VENTOLIN HFA
- El bote de metal contiene el medicamento. Ver Figura A.
Figura A 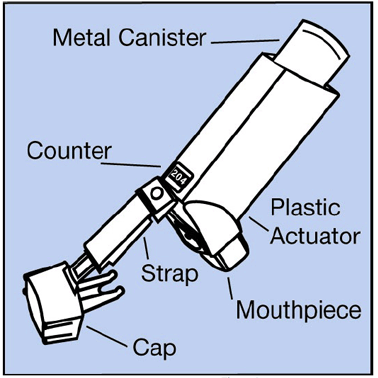
- El recipiente tiene un contador para mostrar cuántas aplicaciones de medicamento le quedan. El número se muestra a través de una ventana en la parte posterior del actuador. Consulte la figura B.
Figura B 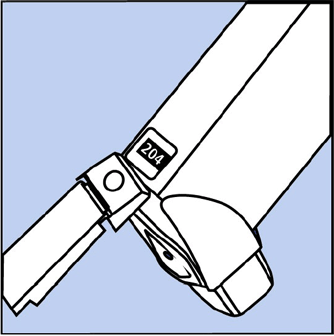
- El contador comienza en cualquiera 204 o 064 según el tamaño de inhalador que tenga. El número contará de 1 en 1 cada vez que rocíe el inhalador. El contador dejará de contar en 000.
- No intente cambiar los números o quitar el contador del recipiente de metal. El contador no se puede reiniciar y está conectado permanentemente al recipiente.
- El actuador de plástico azul rocía el medicamento del recipiente. El actuador tiene una tapa protectora que cubre la boquilla. Ver Figura A . Mantenga la tapa protectora en la boquilla cuando el recipiente no esté en uso. La correa mantiene la tapa unida al actuador.
- No haga utilice el actuador con un bote de medicamento de cualquier otro inhalador.
- No haga use un cartucho de VENTOLIN HFA con un actuador de cualquier otro inhalador.
Antes de usar su inhalador VENTOLIN HFA
- Saque VENTOLIN HFA de la bolsa de aluminio justo antes de usarlo por primera vez. Deseche de forma segura la bolsa y el paquete de secado que viene dentro de la bolsa.
- El inhalador debe estar a temperatura ambiente antes de usarlo.
- Si su hijo necesita usar VENTOLIN HFA, obsérvelo de cerca para asegurarse de que use el inhalador correctamente. Su proveedor de atención médica le mostrará cómo su hijo debe usar VENTOLIN HFA.
Cómo preparar su inhalador VENTOLIN HFA
- Antes de usar VENTOLIN HFA por primera vez, debe preparar el inhalador para que obtenga la cantidad correcta de medicamento cuando lo use.
- Para preparar el inhalador, retire la tapa de la boquilla y agite bien el inhalador. Luego rocíe el inhalador 1 vez en el aire lejos de su cara. Ver Figura C. Evite rociar en los ojos.
Figura C 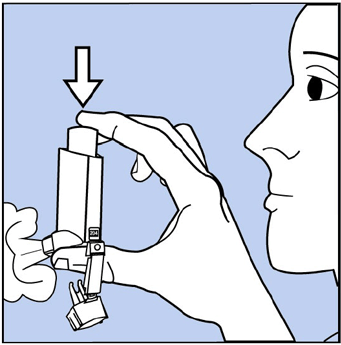
- Agite y rocíe el inhalador así 3 veces más para terminar de cebarlo. El contador ahora debería leer 200 o 60 , según el tamaño de inhalador que tenga. Consulte la figura D.
Figura D 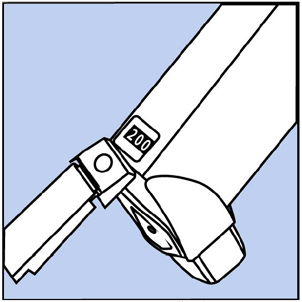
- Debe volver a preparar su inhalador si no lo ha usado en más de 14 días o si se le cae. Quite la tapa de la boquilla y agite y rocíe el inhalador 4 veces en el aire lejos de su cara.
Cómo usar su inhalador VENTOLIN HFA
Siga estos pasos cada vez que use VENTOLIN HFA.
Paso 1. Asegúrese de que el recipiente encaje firmemente en el actuador. El contador debe mostrarse a través de la ventana del actuador.
Agite bien el inhalador antes de cada pulverización.
Retire la tapa de la boquilla del actuador. Mire dentro de la boquilla en busca de objetos extraños y saque los que vea.
Paso 2. Sostenga el inhalador con la boquilla hacia abajo. Ver Figura E .
Figura E 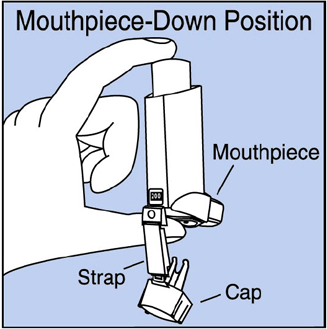
Paso 3. Exhale por la boca y expulse tanto aire de los pulmones como pueda. Colóquese la boquilla en la boca y cierre los labios alrededor de ella. Ver figura F .
Figura F 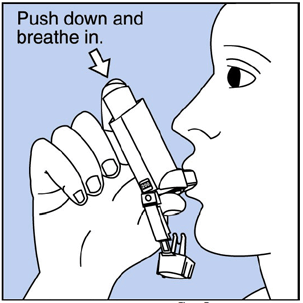
Paso 4. Empuje la parte superior del recipiente hasta el fondo mientras respira profunda y lentamente por la boca. Ver Figura F .
Paso 5. Después de que salga el spray, retire el dedo del recipiente. Después de haber inhalado por completo, quítese el inhalador de la boca y ciérrela.
Paso 6. Contenga la respiración durante unos 10 segundos, o durante el tiempo que le resulte cómodo. Exhala despacio todo el tiempo que puedas.
Si su proveedor de atención médica le ha dicho que use más, espere 1 minuto y agite el inhalador nuevamente. Repita los pasos 2 a 6.
Paso 7. Vuelva a colocar la tapa en la boquilla cada vez que use el inhalador. Asegúrese de que encaje firmemente en su lugar.
Limpieza de su inhalador VENTOLIN HFA
Limpie su inhalador al menos 1 vez por semana. Es posible que no vea ninguna acumulación de medicamento en el inhalador, pero es importante mantenerlo limpio para que la acumulación de medicamento no bloquee el rociado. Consulte la figura G.
Figura G 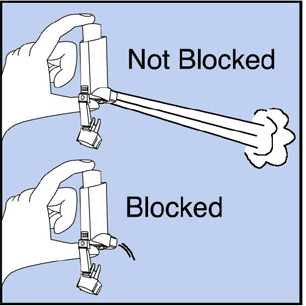
Paso 8. Saque el recipiente del actuador y retire la tapa de la boquilla. La correa de la tapa permanecerá unida al actuador.
Paso 9. Sostenga el actuador debajo del grifo y deje correr agua tibia durante unos 30 segundos. Ver figura h
Figura H 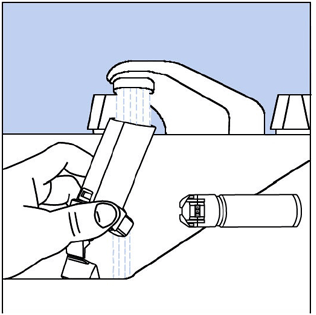
Paso 10. Voltee el actuador y deje correr agua tibia a través de la boquilla durante unos 30 segundos. Ver figura yo .
figura yo 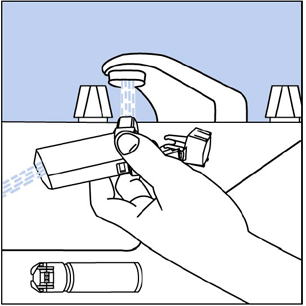
Paso 11. Sacuda toda el agua que pueda del actuador. Mire dentro de la boquilla para asegurarse de que se haya eliminado por completo cualquier acumulación de medicamento. Si hay alguna acumulación, repita los pasos 9 y 10.
Paso 12. Deje que el actuador se seque al aire durante la noche. Ver figura J.
Figura J 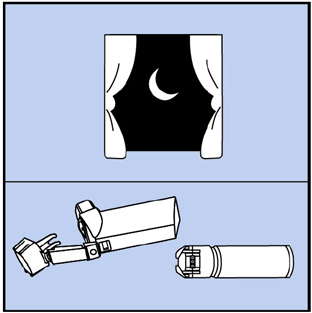
Paso 13. Cuando el actuador esté seco, coloque la tapa protectora en la boquilla y luego coloque el recipiente en el actuador y asegúrese de que encaje firmemente. Agite bien el inhalador, quite la tapa y rocíe el inhalador una vez en el aire lejos de su cara. (El contador hará una cuenta regresiva de 1 número). Vuelva a colocar la tapa en la boquilla.
Si necesita usar su inhalador antes de que el actuador esté completamente seco:
- Sacude tanta agua del actuador como puedas.
- Coloque la tapa en la boquilla y luego coloque el recipiente en el actuador y asegúrese de que encaje firmemente.
- Agite bien el inhalador y rocíelo 1 vez en el aire lejos de su cara.
- Tome su dosis de VENTOLIN HFA según lo prescrito.
- Siga los pasos de limpieza 8 a 13 anteriores.
Reemplazo de su inhalador VENTOLIN HFA:
- Cuando el contador marca 020, debe volver a surtir su receta o preguntarle a su proveedor de atención médica si necesita otra receta para VENTOLIN HFA.
- Deseche el inhalador cuando el contador lee 0 o 12 meses después de abrir la bolsa de aluminio, lo que ocurra primero. No debe seguir usando el inhalador cuando el contador marque 000 porque no recibirá la cantidad correcta de medicamento.
- No use el inhalador después de la fecha de caducidad, que está en el embalaje en el que viene.
Para el uso correcto de su inhalador VENTOLIN HFA, recuerde:
- El recipiente siempre debe encajar firmemente en el actuador.
- Inhale profunda y lentamente para asegurarse de obtener todo el medicamento.
- Contenga la respiración durante unos 10 segundos después de inhalar el medicamento. Luego exhale completamente.
- Siempre mantenga la tapa protectora en la boquilla cuando su inhalador no esté en uso.
- Guarde siempre su inhalador con la boquilla apuntando hacia abajo.
- Limpie su inhalador al menos 1 vez por semana.
Si tiene preguntas sobre VENTOLIN HFA o sobre cómo usar su inhalador, llame a GlaxoSmithKline (GSK) al 1-888-825-5249 o visite www.ventolin.com.
Esta Información para el paciente y las Instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de EE. UU.
