Wellbutrin 150mg, 300mg Bupropion Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Wellbutrin 150 mg y cómo se usa?
Wellbutrin 150 mg es un medicamento recetado que se usa para tratar los síntomas de la depresión mayor y el trastorno afectivo estacional. Wellbutrin 150 mg se puede usar solo o con otros medicamentos.
Wellbutrin 150 mg pertenece a una clase de medicamentos llamados antidepresivos, inhibidores de la recaptación de dopamina, antidepresivos, otros, ayudas para dejar de fumar.
¿Cuáles son los posibles efectos secundarios de Wellbutrin 150 mg?
Wellbutrin puede causar efectos secundarios graves que incluyen:
- convulsiones (convulsiones),
- confusión,
- cambios inusuales en el estado de ánimo o el comportamiento,
- visión borrosa,
- visión de túnel,
- dolor o hinchazón de los ojos,
- viendo halos alrededor de las luces,
- latidos cardíacos rápidos o irregulares,
- pensamientos acelerados,
- mayor energía,
- comportamiento temerario,
- sentirse extremadamente feliz o irritable,
- hablando más de lo habitual, y
- problemas severos con el sueño
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Wellbutrin incluyen:
- boca seca,
- congestión nasal,
- problemas de la vista,
- escuchando problemas,
- náuseas,
- vómitos,
- estreñimiento,
- problemas para dormir (insomnio),
- temblores,
- transpiración,
- sentirse ansioso o nervioso,
- latidos rápidos del corazón,
- confusión,
- agitación,
- hostilidad,
- sarpullido,
- dolor de cabeza,
- mareos, y
- dolor en las articulaciones
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Wellbutrin. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088
ADVERTENCIA
PENSAMIENTOS Y CONDUCTAS SUICIDAS
SUICIDALIDAD Y MEDICAMENTOS ANTIDEPRESIVOS
Los antidepresivos aumentaron el riesgo de pensamientos y conductas suicidas en niños, adolescentes y adultos jóvenes en ensayos a corto plazo. Estos ensayos no mostraron un aumento en el riesgo de pensamientos y conductas suicidas con el uso de antidepresivos en sujetos mayores de 24 años; hubo una reducción en el riesgo con el uso de antidepresivos en sujetos mayores de 65 años [ver ADVERTENCIAS Y PRECAUCIONES].
En pacientes de todas las edades que comienzan con la terapia antidepresiva, controle de cerca el empeoramiento y la aparición de pensamientos y comportamientos suicidas. Aconseje a las familias y cuidadores sobre la necesidad de una estrecha observación y comunicación con el prescriptor [ver ADVERTENCIAS Y PRECAUCIONES].
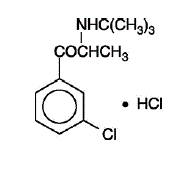
DESCRIPCIÓN
WELLBUTRIN (clorhidrato de bupropión), un antidepresivo de la clase de las aminocetonas, no tiene relación química con los inhibidores selectivos de la recaptación de serotonina tricíclicos, tetracíclicos ni con otros agentes antidepresivos conocidos. Su estructura se parece mucho a la del dietilpropión; está relacionado con las feniletilaminas. Se designa como clorhidrato de (±)-1-(3-clorofenil)-2-[(1,1-dimetiletil)amino]-1-propanona. El peso molecular es 276,2. La fórmula molecular es C13H18ClNO•HCl. El polvo de clorhidrato de bupropión es blanco, cristalino y altamente soluble en agua. Tiene un sabor amargo y produce la sensación de anestesia local en la mucosa oral. La fórmula estructural es:
WELLBUTRIN se suministra para administración oral en comprimidos recubiertos con película de 75 mg (amarillo dorado) y 100 mg (rojo). Cada tableta contiene la cantidad etiquetada de clorhidrato de bupropión y los ingredientes inactivos: tableta de 75 mg: D&C Yellow No. 10 Lake, FD&C Yellow No. 6 Lake, hidroxipropilcelulosa, hipromelosa, celulosa microcristalina, polietilenglicol, talco y dióxido de titanio; Tableta de 100 mg: FD&C Red No. 40 Lake, FD&C Yellow No. 6 Lake, hidroxipropilcelulosa, hipromelosa, celulosa microcristalina, polietilenglicol, talco y dióxido de titanio.
INDICACIONES
WELLBUTRIN (clorhidrato de bupropión) está indicado para el tratamiento del trastorno depresivo mayor (MDD), tal como se define en el Manual diagnóstico y estadístico (DSM).
La eficacia de WELLBUTRIN 300 mg en el tratamiento de un episodio depresivo mayor se estableció en dos ensayos controlados con pacientes hospitalizados de 4 semanas y un ensayo controlado con pacientes ambulatorios de 6 semanas en sujetos adultos con TDM [ver Estudios clínicos ].
DOSIFICACIÓN Y ADMINISTRACIÓN
Instrucciones generales de uso
Para minimizar el riesgo de convulsiones, aumente la dosis gradualmente [ver ADVERTENCIAS Y PRECAUCIONES ]. Los aumentos de dosis no deben exceder los 100 mg/día en un período de 3 días. Las tabletas de WELLBUTRIN deben tragarse enteras y no deben triturarse, dividirse ni masticarse. WELLBUTRIN 300 mg se puede tomar con o sin alimentos.
La dosis inicial recomendada es de 200 mg/día, administrados como 100 mg dos veces al día. Después de 3 días de dosificación, la dosis puede aumentarse a 300 mg/día, administrados como 100 mg 3 veces al día, con al menos 6 horas entre dosis sucesivas. La dosificación superior a 300 mg/día se puede lograr usando las tabletas de 75 o 100 mg.
Se puede considerar un máximo de 450 mg/día, administrado en dosis divididas de no más de 150 mg cada una, para pacientes que no muestran mejoría clínica después de varias semanas de tratamiento con 300 mg/día. Administrar la tableta de 100 mg 4 veces al día para no exceder el límite de 150 mg en una sola dosis.
En general, se acepta que los episodios agudos de depresión requieren varios meses o más de tratamiento con fármacos antidepresivos más allá de la respuesta en el episodio agudo. Se desconoce si la dosis de WELLBUTRIN necesaria para el tratamiento de mantenimiento es idéntica a la dosis que proporcionó una respuesta inicial. Reevaluar periódicamente la necesidad de un tratamiento de mantenimiento y la dosis adecuada para dicho tratamiento.
Ajuste de dosis en pacientes con insuficiencia hepática
En pacientes con insuficiencia hepática de moderada a grave (puntuación de Child-Pugh: 7 a 15), la dosis máxima de WELLBUTRIN 150 mg es de 75 mg/día. En pacientes con insuficiencia hepática leve (puntuación de Child-Pugh: 5 a 6), considere reducir la dosis y/o la frecuencia de la dosificación [ver Uso en poblaciones específicas , FARMACOLOGÍA CLÍNICA ].
Ajuste de dosis en pacientes con insuficiencia renal
Considere reducir la dosis y/o la frecuencia de WELLBUTRIN 150 mg en pacientes con insuficiencia renal (tasa de filtración glomerular inferior a 90 ml/min) [ver Uso en poblaciones específicas , FARMACOLOGÍA CLÍNICA ].
Cambio de un paciente a o desde un antidepresivo inhibidor de la monoaminooxidasa (IMAO)
Deben transcurrir al menos 14 días entre la interrupción de un IMAO destinado a tratar la depresión y el inicio de la terapia con WELLBUTRIN. Por el contrario, se deben permitir al menos 14 días después de suspender WELLBUTRIN antes de comenzar un antidepresivo IMAO [ver CONTRAINDICACIONES , INTERACCIONES CON LA DROGAS ].
Uso de WELLBUTRIN con IMAO reversibles como linezolid o azul de metileno
No comience con WELLBUTRIN 300 mg en un paciente que está siendo tratado con un IMAO reversible como linezolid o azul de metileno intravenoso. Las interacciones medicamentosas pueden aumentar el riesgo de reacciones hipertensivas. En un paciente que requiere un tratamiento más urgente de una condición psiquiátrica, se deben considerar intervenciones no farmacológicas, incluida la hospitalización [ver CONTRAINDICACIONES , INTERACCIONES CON LA DROGAS ].
En algunos casos, un paciente que ya recibe terapia con WELLBUTRIN puede requerir tratamiento urgente con linezolid o azul de metileno intravenoso. Si no se encuentran disponibles alternativas aceptables al tratamiento con linezolid o azul de metileno intravenoso y se considera que los beneficios potenciales del tratamiento con linezolid o azul de metileno intravenoso superan los riesgos de reacciones hipertensivas en un paciente en particular, WELLBUTRIN 300 mg debe suspenderse de inmediato y linezolid o metileno intravenoso. Se puede administrar azul. El paciente debe ser monitoreado durante 2 semanas o hasta 24 horas después de la última dosis de linezolid o azul de metileno intravenoso, lo que ocurra primero. La terapia con WELLBUTRIN 300 mg puede reanudarse 24 horas después de la última dosis de linezolid o azul de metileno intravenoso.
No está claro el riesgo de administrar azul de metileno por vías no intravenosas (como comprimidos orales o inyección local) o en dosis intravenosas muy inferiores a 1 mg/kg con WELLBUTRIN 300 mg. No obstante, el médico debe ser consciente de la posibilidad de una interacción farmacológica con dicho uso [ver CONTRAINDICACIONES , INTERACCIONES CON LA DROGAS ].
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
- 75 mg: tabletas biconvexas, redondas, de color amarillo dorado, impresas con "WELLBUTRIN 75".
- 100 mg: tabletas rojas, redondas y biconvexas impresas con "WELLBUTRIN 100".
Almacenamiento y manipulación
Las tabletas WELLBUTRIN de 150 mg, 75 mg de clorhidrato de bupropión, son tabletas biconvexas, redondas, de color amarillo dorado, impresas con "WELLBUTRIN 75" en frascos de 100 ( CDN 0173-0177-55).
Los comprimidos de WELLBUTRIN, 100 mg de clorhidrato de bupropión, son comprimidos rojos, redondos y biconvexos con la inscripción “WELLBUTRIN 100” en frascos de 100 ( CDN 0173-0178-55).
Almacenar a temperatura ambiente, 20° a 25°C (68° a 77°F); excursiones permitidas entre 15°C y 30°C (59°F y 86°F) [Ver Temperatura ambiente controlada por USP ]. Proteger de la luz y la humedad.
Fabricado para: GlaxoSmithKline, Research Triangle Park,. Revisado: noviembre de 2019
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas se analizan con mayor detalle en otras secciones de la etiqueta:
- Pensamientos y conductas suicidas en adolescentes y adultos jóvenes [ver ADVERTENCIA EN CAJA , ADVERTENCIAS Y PRECAUCIONES ]
- Síntomas neuropsiquiátricos y riesgo de suicidio en el tratamiento para dejar de fumar [ver ADVERTENCIAS Y PRECAUCIONES ]
- Convulsión [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hipertensión [ver ADVERTENCIAS Y PRECAUCIONES ]
- Activación de manía o hipomanía [ver ADVERTENCIAS Y PRECAUCIONES ]
- Psicosis y otras reacciones neuropsiquiátricas [ver ADVERTENCIAS Y PRECAUCIONES ]
- Glaucoma de ángulo cerrado [ver ADVERTENCIAS Y PRECAUCIONES ]
- Reacciones de hipersensibilidad [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica clínica.
Reacciones adversas que conducen a la interrupción del tratamiento
Las reacciones adversas fueron lo suficientemente molestas como para provocar la suspensión del tratamiento con WELLBUTRIN en aproximadamente el 10 % de los 2400 sujetos y voluntarios sanos que participaron en los ensayos clínicos durante el desarrollo inicial del producto. Los eventos más comunes que causan la interrupción incluyen trastornos neuropsiquiátricos (3,0%), principalmente agitación y anomalías en el estado mental; trastornos gastrointestinales (2,1%), principalmente náuseas y vómitos; trastornos neurológicos (1,7%), principalmente convulsiones, dolores de cabeza y trastornos del sueño; y problemas dermatológicos (1,4%), principalmente erupciones. Sin embargo, es importante señalar que muchos de estos eventos ocurrieron con dosis que excedieron la dosis diaria recomendada.
Reacciones adversas comúnmente observadas
Las reacciones adversas comúnmente encontradas en sujetos tratados con WELLBUTRIN son agitación, sequedad de boca, insomnio, dolor de cabeza/migraña, náuseas/vómitos, estreñimiento, temblores, mareos, sudoración excesiva, visión borrosa, taquicardia, confusión, sarpullido, hostilidad, arritmia cardíaca y trastornos auditivos. disturbio.
La Tabla 2 resume las reacciones adversas que ocurrieron en los ensayos controlados con placebo con una incidencia de al menos el 1 % de los sujetos que recibieron WELLBUTRIN 150 mg y con mayor frecuencia en estos sujetos que en el grupo de placebo.
Otras reacciones adversas observadas durante el desarrollo clínico de WELLBUTRIN
Las condiciones y la duración de la exposición a WELLBUTRIN variaron mucho y una proporción sustancial de la experiencia se obtuvo en entornos clínicos abiertos y no controlados. Durante esta experiencia, se informaron numerosos eventos adversos; sin embargo, sin los controles adecuados, es imposible determinar con certeza qué eventos fueron o no causados por WELLBUTRIN. La siguiente enumeración está organizada por sistema de órganos y describe eventos en términos de su frecuencia relativa de notificación en la base de datos.
Se utilizan las siguientes definiciones de frecuencia: Las reacciones adversas frecuentes se definen como aquellas que ocurren en al menos 1/100 sujetos. Las reacciones adversas poco frecuentes son aquellas que ocurren en 1/100 a 1/1,000 sujetos, mientras que los eventos raros son aquellos que ocurren en menos de 1/1,000 sujetos.
Cardiovascular Frecuente fue edema; infrecuentes fueron dolor torácico, anomalías en el electrocardiograma (ECG) (latidos prematuros y cambios inespecíficos de ST-T) y dificultad para respirar/disnea; raros fueron enrojecimiento e infarto de miocardio.
Dermatológico: Infrecuente fue la alopecia.
Endocrino: Infrecuente fue la ginecomastia; rara fue la glucosuria.
Gastrointestinal: Poco frecuentes fueron disfagia, trastornos de la sed y daño hepático/ictericia; rara fue la perforación intestinal.
Genitourinario: Frecuente era la nicturia; infrecuentes fueron irritación vaginal, hinchazón testicular, infección del tracto urinario, erección dolorosa y eyaculación retardada; raros fueron la enuresis y la incontinencia urinaria.
Neurológico: Los más frecuentes fueron ataxia/falta de coordinación, convulsiones, mioclonías, discinesia y distonía; infrecuentes fueron midriasis, vértigo y disartria; raros fueron anomalías en el electroencefalograma (EEG) y problemas de atención.
Neurosiquiátrico: Frecuentes fueron manía/hipomanía, aumento de la libido, alucinaciones, disminución de la función sexual y depresión; infrecuentes fueron el deterioro de la memoria, la despersonalización, la psicosis, la disforia, la inestabilidad del estado de ánimo, la paranoia y el trastorno del pensamiento formal; rara fue la ideación suicida.
Quejas orales: Frecuente fue la estomatitis; infrecuentes fueron dolor de muelas, bruxismo, irritación de las encías y edema oral.
Respiratorio: Infrecuentes fueron bronquitis y dificultad para respirar/disnea; rara fue la embolia pulmonar.
Sentidos especiales: Poco frecuente fue la alteración visual; rara fue la diplopía.
Inespecífico: Frecuentes eran síntomas parecidos a la gripe; infrecuente fue el dolor inespecífico; rara fue la sobredosis.
Apetito y peso alterados
Una pérdida de peso de más de 5 libras. ocurrió en el 28% de los sujetos que recibieron WELLBUTRIN. Esta incidencia es aproximadamente el doble de la observada en sujetos comparables tratados con tricíclicos o placebo. Además, mientras que el 35 % de los sujetos que recibieron antidepresivos tricíclicos aumentaron de peso, solo el 9,4 % de los sujetos tratados con WELLBUTRIN lo hicieron. En consecuencia, si la pérdida de peso es un signo de presentación importante de la enfermedad depresiva de un paciente, se debe considerar el potencial anoréxico y/o reductor de peso de WELLBUTRIN.
Experiencia posterior a la comercialización
Las siguientes reacciones adversas se identificaron durante el uso posterior a la aprobación de WELLBUTRIN y no se describen en ninguna otra parte de la etiqueta. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Cuerpo (general)
Artralgia, mialgia y fiebre con exantema y otros síntomas sugestivos de hipersensibilidad retardada. Estos síntomas pueden parecerse a la enfermedad del suero [ver ADVERTENCIAS Y PRECAUCIONES ].
Cardiovascular
Hipertensión (en algunos casos severa), hipotensión ortostática, bloqueo cardíaco de tercer grado.
Endocrino
Hiponatremia, síndrome de secreción inadecuada de hormona antidiurética, hiperglucemia, hipoglucemia.
Gastrointestinal
Esofagitis, hepatitis.
hemico y linfatico
Equimosis, leucocitosis, leucopenia, trombocitopenia. Cuando se coadministró bupropión con warfarina, se observaron alteraciones del PT y/o del INR, asociados con poca frecuencia a complicaciones hemorrágicas o trombóticas.
musculoesquelético
Rigidez muscular/fiebre/rabdomiolisis, debilidad muscular.
Sistema nervioso
Agresión, coma, suicidio consumado, delirio, alteraciones del sueño, ideación paranoide, parestesia, parkinsonismo, inquietud, intento de suicidio, desenmascaramiento de discinesia tardía.
Piel y apéndices
Síndrome de Stevens-Johnson, angioedema, dermatitis exfoliativa, urticaria.
Sentidos especiales
Tinnitus, aumento de la presión intraocular.
INTERACCIONES CON LA DROGAS
Posibilidad de que otros medicamentos afecten a WELLBUTRIN
El bupropión se metaboliza principalmente a hidroxibupropión por CYP2B6. Por lo tanto, existe la posibilidad de interacciones farmacológicas entre WELLBUTRIN y fármacos que son inhibidores o inductores de CYP2B6.
Inhibidores de CYP2B6
ticlopidina y clopidogrel
El tratamiento concomitante con estos medicamentos puede aumentar la exposición al bupropión pero disminuir la exposición al hidroxibupropión. Según la respuesta clínica, puede ser necesario ajustar la dosis de WELLBUTRIN cuando se coadministra con inhibidores de CYP2B6 (p. ej., ticlopidina o clopidogrel) [ver FARMACOLOGÍA CLÍNICA ].
Inductores de CYP2B6
Ritonavir, lopinavir y efavirenz
El tratamiento concomitante con estos medicamentos puede disminuir la exposición a bupropión e hidroxibupropión. Puede ser necesario aumentar la dosis de WELLBUTRIN cuando se coadministra con ritonavir, lopinavir o efavirenz [ver FARMACOLOGÍA CLÍNICA ] pero no debe exceder la dosis máxima recomendada.
Carbamazepina, fenobarbital, fenitoína
Si bien no se han estudiado sistemáticamente, estos medicamentos pueden inducir el metabolismo del bupropión y pueden disminuir la exposición al bupropión [ver FARMACOLOGÍA CLÍNICA ]. Si se usa bupropión de forma concomitante con un inductor de CYP, puede ser necesario aumentar la dosis de bupropión, pero no se debe exceder la dosis máxima recomendada.
Potencial de WELLBUTRIN 300 mg para afectar a otras drogas
Fármacos metabolizados por CYP2D6
El bupropión y sus metabolitos (eritrohidrobupropión, treohidrobupropión, hidroxibupropión) son inhibidores de CYP2D6. Por lo tanto, la coadministración de WELLBUTRIN con medicamentos que son metabolizados por CYP2D6 puede aumentar la exposición de medicamentos que son sustratos de CYP2D6. Dichos medicamentos incluyen ciertos antidepresivos (p. ej., venlafaxina, nortriptilina, imipramina, desipramina, paroxetina, fluoxetina y sertralina), antipsicóticos (p. ej., haloperidol, risperidona, tioridazina), bloqueadores beta (p. ej., metoprolol) y antiarrítmicos de tipo 1C (p. ej., , propafenona y flecainida). Cuando se usa concomitantemente con WELLBUTRIN, puede ser necesario disminuir la dosis de estos sustratos de CYP2D6, particularmente para medicamentos con un índice terapéutico estrecho.
Los fármacos que requieren activación metabólica por CYP2D6 para ser efectivos (p. ej., tamoxifeno) teóricamente podrían tener una eficacia reducida cuando se administran concomitantemente con inhibidores de CYP2D6 como el bupropión. Los pacientes tratados concomitantemente con WELLBUTRIN y tales medicamentos pueden requerir dosis más altas del medicamento [ver FARMACOLOGÍA CLÍNICA ].
Digoxina
La coadministración de WELLBUTRIN con digoxina puede disminuir los niveles de digoxina en plasma. Monitoree los niveles de digoxina en plasma en pacientes tratados concomitantemente con WELLBUTRIN y digoxina [ver FARMACOLOGÍA CLÍNICA ].
Fármacos que reducen el umbral de convulsiones
Tenga mucho cuidado cuando coadministre WELLBUTRIN con otros medicamentos que reduzcan el umbral convulsivo (p. ej., otros productos de bupropión, antipsicóticos, antidepresivos, teofilina o corticosteroides sistémicos). Use dosis iniciales bajas y aumente la dosis gradualmente [ver CONTRAINDICACIONES , ADVERTENCIAS Y PRECAUCIONES ].
Medicamentos Dopaminérgicos (Levodopa Y Amantadina)
El bupropión, la levodopa y la amantadina tienen efectos agonistas de la dopamina. Se ha informado toxicidad del SNC cuando se coadministró bupropión con levodopa o amantadina. Las reacciones adversas han incluido inquietud, agitación, temblor, ataxia, alteración de la marcha, vértigo y mareos. Se presume que la toxicidad resulta de los efectos acumulativos de los agonistas de la dopamina. Tenga cuidado cuando administre WELLBUTRIN 150 mg concomitantemente con estos medicamentos.
Uso con alcohol
En la experiencia posterior a la comercialización, ha habido informes raros de eventos neuropsiquiátricos adversos o reducción de la tolerancia al alcohol en pacientes que bebían alcohol durante el tratamiento con WELLBUTRIN. Se debe minimizar o evitar el consumo de alcohol durante el tratamiento con WELLBUTRIN.
Inhibidores de la MAO
El bupropión inhibe la recaptación de dopamina y norepinefrina. El uso concomitante de IMAO y bupropión está contraindicado porque existe un mayor riesgo de reacciones hipertensivas si se usa bupropión junto con IMAO. Los estudios en animales demuestran que la toxicidad aguda del bupropión aumenta con el inhibidor de la MAO fenelzina. Deben transcurrir al menos 14 días entre la suspensión de un IMAO destinado a tratar la depresión y el inicio del tratamiento con WELLBUTRIN. Por el contrario, se deben permitir al menos 14 días después de suspender WELLBUTRIN 150 mg antes de comenzar un antidepresivo IMAO [ver DOSIFICACIÓN Y ADMINISTRACIÓN , CONTRAINDICACIONES ].
Interacciones entre fármacos y pruebas de laboratorio
Se han notificado falsos positivos en las pruebas de detección de anfetaminas mediante inmunoensayo en orina en pacientes que toman bupropión. Esto se debe a la falta de especificidad de algunas pruebas de detección. Pueden producirse resultados falsos positivos incluso después de interrumpir el tratamiento con bupropión. Las pruebas de confirmación, como la cromatografía de gases/espectrometría de masas, distinguirán el bupropión de las anfetaminas.
Abuso y dependencia de drogas
Sustancia controlada
El bupropión no es una sustancia controlada.
Abuso
humanos
Los ensayos clínicos controlados realizados en voluntarios normales, en sujetos con antecedentes de abuso de múltiples drogas y en sujetos deprimidos mostraron cierto aumento en la actividad motora y agitación/excitación, a menudo típica de la actividad estimulante central.
En una población de personas experimentadas con drogas de abuso, una dosis oral única de 400 mg de bupropion produjo una actividad leve similar a la de las anfetaminas en comparación con el placebo en la subescala de morfina-benzedrina de los inventarios del centro de investigación de adicciones (ARCI) y una puntuación superior a placebo pero menos de 15 mg del estimulante de la Lista II dextroanfetamina en la escala de agrado del ARCI. Estas escalas miden sentimientos generales de euforia y gusto por las drogas, que a menudo se asocian con el potencial de abuso.
Sin embargo, no se sabe que los resultados de los ensayos clínicos predigan de forma fiable el potencial de abuso de las drogas. No obstante, la evidencia de los ensayos de dosis única sugiere que la dosis diaria recomendada de bupropión cuando se administra por vía oral en dosis divididas probablemente no sea un refuerzo significativo para las personas que abusan de anfetaminas o estimulantes del SNC. Sin embargo, las dosis más altas (que no pudieron probarse debido al riesgo de convulsiones) podrían ser modestamente atractivas para quienes abusan de las drogas estimulantes del SNC.
WELLBUTRIN está destinado únicamente para uso oral. Se ha notificado la inhalación de comprimidos triturados o la inyección de bupropión disuelto. Se han notificado convulsiones y/o casos de muerte cuando se administró bupropión por vía intranasal o por inyección parenteral.
animales
Los estudios en roedores y primates demostraron que el bupropión exhibe algunas acciones farmacológicas comunes a los psicoestimulantes. En roedores, se ha demostrado que aumenta la actividad locomotora, provoca una respuesta de comportamiento estereotipada leve y aumenta las tasas de respuesta en varios paradigmas de comportamiento controlado por horario. En modelos de primates que evaluaron los efectos de refuerzo positivo de las drogas psicoactivas, el bupropión se autoadministró por vía intravenosa. En ratas, el bupropión produjo efectos de estímulo discriminatorio similares a las anfetaminas y la cocaína en los paradigmas de discriminación de drogas utilizados para caracterizar los efectos subjetivos de las drogas psicoactivas.
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Pensamientos y conductas suicidas en niños, adolescentes y adultos jóvenes
Los pacientes con TDM, tanto adultos como pediátricos, pueden experimentar un empeoramiento de su depresión y/o la aparición de ideas y comportamientos suicidas (tendencia al suicidio) o cambios inusuales en el comportamiento, estén o no tomando medicamentos antidepresivos, y este riesgo puede persistir hasta que sea significativo. se produce la remisión. El suicidio es un riesgo conocido de depresión y ciertos otros trastornos psiquiátricos, y estos trastornos en sí mismos son los predictores más fuertes de suicidio. Ha habido una preocupación de larga data de que los antidepresivos puedan tener un papel en la inducción del empeoramiento de la depresión y la aparición de tendencias suicidas en ciertos pacientes durante las primeras fases del tratamiento.
Los análisis combinados de ensayos controlados con placebo a corto plazo de medicamentos antidepresivos (inhibidores selectivos de la recaptación de serotonina [ISRS] y otros) muestran que estos medicamentos aumentan el riesgo de pensamientos y conductas suicidas (tendencia suicida) en niños, adolescentes y adultos jóvenes (edades 18 a 24) con TDM y otros trastornos psiquiátricos. Los ensayos clínicos a corto plazo no mostraron un aumento en el riesgo de tendencias suicidas con antidepresivos en comparación con placebo en adultos mayores de 24 años; hubo una reducción con los antidepresivos en comparación con el placebo en adultos de 65 años o más.
Los análisis agrupados de ensayos controlados con placebo en niños y adolescentes con TDM, trastorno obsesivo compulsivo (TOC) u otros trastornos psiquiátricos incluyeron un total de 24 ensayos a corto plazo de 9 fármacos antidepresivos en más de 4400 sujetos. Los análisis agrupados de ensayos controlados con placebo en adultos con MDD u otros trastornos psiquiátricos incluyeron un total de 295 ensayos a corto plazo (duración media de 2 meses) de 11 fármacos antidepresivos en más de 77 000 sujetos. Hubo una variación considerable en el riesgo de suicidio entre las drogas, pero una tendencia hacia un aumento en los sujetos más jóvenes para casi todas las drogas estudiadas. Hubo diferencias en el riesgo absoluto de suicidio entre las diferentes indicaciones, con la mayor incidencia en MDD. Sin embargo, las diferencias de riesgo (fármaco frente a placebo) fueron relativamente estables dentro de los estratos de edad y entre las indicaciones. Estas diferencias de riesgo (diferencia fármaco-placebo en el número de casos de tendencias suicidas por cada 1000 sujetos tratados) se proporcionan en la Tabla 1.
No se produjeron suicidios en ninguno de los ensayos pediátricos. Hubo suicidios en los ensayos con adultos, pero el número no fue suficiente para llegar a ninguna conclusión sobre el efecto del fármaco sobre el suicidio.
Se desconoce si el riesgo de suicidio se extiende al uso a largo plazo, es decir, más allá de varios meses. Sin embargo, existe evidencia sustancial de ensayos de mantenimiento controlados con placebo en adultos con depresión de que el uso de antidepresivos puede retrasar la recurrencia de la depresión.
Todos los pacientes que reciben tratamiento con antidepresivos por cualquier indicación deben ser monitoreados adecuadamente y observados de cerca por si empeoran clínicamente, tienen tendencias suicidas y cambios inusuales en el comportamiento, especialmente durante los meses iniciales de un ciclo de terapia con medicamentos, o en momentos de cambios de dosis, ya sea aumentos o disminuye [vea el RECUADRO DE ADVERTENCIA].
Los siguientes síntomas, ansiedad, agitación, ataques de pánico, insomnio, irritabilidad, hostilidad, agresividad, impulsividad, acatisia (inquietud psicomotora), hipomanía y manía, se han informado en pacientes adultos y pediátricos que también reciben tratamiento con antidepresivos para el trastorno depresivo mayor como para otras indicaciones, tanto psiquiátricas como no psiquiátricas. Aunque no se ha establecido un vínculo causal entre la aparición de tales síntomas y el empeoramiento de la depresión y/o la aparición de impulsos suicidas, existe la preocupación de que tales síntomas puedan representar precursores de tendencias suicidas emergentes.
Se debe considerar cambiar el régimen terapéutico, incluida la posibilidad de suspender el medicamento, en pacientes cuya depresión empeora persistentemente, o que están experimentando tendencias suicidas emergentes o síntomas que podrían ser precursores de un empeoramiento de la depresión o tendencias suicidas, especialmente si estos síntomas son severos, abruptos. en el inicio, o no formaban parte de los síntomas de presentación del paciente.
Se debe alertar a las familias y cuidadores de pacientes que reciben tratamiento con antidepresivos por MDD u otras indicaciones, tanto psiquiátricas como no psiquiátricas, sobre la necesidad de monitorear a los pacientes para detectar la aparición de agitación, irritabilidad, cambios inusuales en el comportamiento y los otros síntomas descritos anteriormente, como así como el surgimiento de tendencias suicidas, e informar dichos síntomas de inmediato a los proveedores de atención médica. Dicho seguimiento debe incluir la observación diaria por parte de las familias y los cuidadores. Las recetas de WELLBUTRIN 150 mg deben hacerse para la cantidad más pequeña de comprimidos compatible con un buen manejo del paciente, a fin de reducir el riesgo de sobredosis.
Eventos adversos neuropsiquiátricos y riesgo de suicidio en el tratamiento para dejar de fumar
WELLBUTRIN no está aprobado para el tratamiento para dejar de fumar; sin embargo, contiene el mismo ingrediente activo que el medicamento para dejar de fumar ZYBAN. Se han informado eventos adversos neuropsiquiátricos graves en pacientes que toman bupropión para dejar de fumar. Estos informes posteriores a la comercialización han incluido cambios en el estado de ánimo (incluyendo depresión y manía), psicosis, alucinaciones, paranoia, delirios, ideación homicida, agresión, hostilidad, agitación, ansiedad y pánico, así como ideación suicida, intento de suicidio y suicidio consumado. ver REACCIONES ADVERSAS ]. Algunos pacientes que dejaron de fumar pueden haber experimentado síntomas de abstinencia de la nicotina, incluido un estado de ánimo deprimido. Se ha informado depresión, que rara vez incluye ideación suicida, en fumadores que intentan dejar de fumar sin medicación. Sin embargo, algunos de estos eventos adversos ocurrieron en pacientes que tomaban bupropión y seguían fumando.
Los eventos adversos neuropsiquiátricos ocurrieron en pacientes sin y con enfermedad psiquiátrica preexistente; algunos pacientes experimentaron un empeoramiento de sus enfermedades psiquiátricas. Observe a los pacientes para detectar la aparición de eventos adversos neuropsiquiátricos. Aconseje a los pacientes y cuidadores que el paciente debe dejar de tomar WELLBUTRIN 300 mg y ponerse en contacto con un proveedor de atención médica de inmediato si se observa agitación, estado de ánimo deprimido o cambios en el comportamiento o pensamiento que no son típicos del paciente, o si el paciente desarrolla ideación o comportamiento suicida. . En muchos casos posteriores a la comercialización, se informó la resolución de los síntomas después de la interrupción del bupropión. Sin embargo, los síntomas persistieron en algunos casos; por lo tanto, se debe proporcionar un control continuo y atención de apoyo hasta que se resuelvan los síntomas.
Embargo
WELLBUTRIN 300 mg puede causar convulsiones. El riesgo de convulsiones está relacionado con la dosis. La dosis no debe exceder los 450 mg/día. Aumente la dosis gradualmente. Suspenda WELLBUTRIN 150 mg y no reinicie el tratamiento si el paciente experimenta una convulsión.
El riesgo de convulsiones también está relacionado con factores del paciente, situaciones clínicas y medicamentos concomitantes que reducen el umbral convulsivo. Considere estos riesgos antes de iniciar el tratamiento con WELLBUTRIN. WELLBUTRIN 300 mg está contraindicado en pacientes con un trastorno convulsivo, diagnóstico actual o previo de anorexia nerviosa o bulimia, o que hayan interrumpido abruptamente el alcohol, las benzodiazepinas, los barbitúricos y los medicamentos antiepilépticos [ver CONTRAINDICACIONES , INTERACCIONES CON LA DROGAS ]. Las siguientes condiciones también pueden aumentar el riesgo de convulsiones: lesión grave en la cabeza; malformación arteriovenosa; tumor del SNC o infección del SNC; accidente cerebrovascular severo; uso concomitante de otros medicamentos que reducen el umbral convulsivo (p. ej., otros productos de bupropión, antipsicóticos, antidepresivos tricíclicos, teofilina y corticosteroides sistémicos); trastornos metabólicos (p. ej., hipoglucemia, hiponatremia, insuficiencia hepática grave e hipoxia); uso de drogas ilícitas (p. ej., cocaína); o abuso o uso indebido de medicamentos recetados como los estimulantes del sistema nervioso central. Condiciones predisponentes adicionales incluyen diabetes mellitus tratada con hipoglucemiantes orales o insulina; uso de drogas anoréxicas; y uso excesivo de alcohol, benzodiazepinas, sedantes/hipnóticos u opiáceos.
Incidencia de convulsiones con el uso de bupropión
El bupropión se asocia con convulsiones en aproximadamente el 0,4 % (4/1000) de los pacientes tratados con dosis de hasta 450 mg/día. La incidencia estimada de convulsiones para WELLBUTRIN aumenta casi 10 veces entre 450 y 600 mg/día.
El riesgo de convulsiones puede reducirse si la dosis de WELLBUTRIN 300 mg no excede los 450 mg/día, administrados en 150 mg 3 veces al día, y la tasa de titulación es gradual.
Hipertensión
El tratamiento con WELLBUTRIN puede resultar en presión arterial elevada e hipertensión. Evalúe la presión arterial antes de iniciar el tratamiento con WELLBUTRIN 150 mg y controle periódicamente durante el tratamiento. El riesgo de hipertensión aumenta si WELLBUTRIN 150 mg se usa concomitantemente con IMAO u otros medicamentos que aumentan la actividad dopaminérgica o noradrenérgica [ver CONTRAINDICACIONES ].
Los datos de un ensayo comparativo de la formulación de liberación sostenida de bupropion HCl, el sistema transdérmico de nicotina (NTS), la combinación de bupropion de liberación sostenida más NTS y el placebo como ayuda para dejar de fumar sugieren una mayor incidencia de hipertensión emergente del tratamiento en pacientes tratados con la combinación de bupropión de liberación sostenida y NTS. En este ensayo, el 6,1 % de los sujetos tratados con la combinación de bupropión de liberación sostenida y NTS tuvo hipertensión emergente del tratamiento en comparación con el 2,5 %, 1,6 % y 3,1 % de los sujetos tratados con bupropión de liberación sostenida, NTS y placebo, respectivamente. . La mayoría de estos sujetos tenían evidencia de hipertensión preexistente. Tres sujetos (1,2 %) tratados con la combinación de bupropión de liberación sostenida y NTS y 1 sujeto (0,4 %) tratado con NTS interrumpieron la medicación del estudio debido a hipertensión en comparación con ninguno de los sujetos tratados con bupropión de liberación sostenida o placebo. Se recomienda monitorear la presión arterial en pacientes que reciben la combinación de bupropión y reemplazo de nicotina.
En un ensayo clínico de bupropión de liberación inmediata en sujetos con MDD e insuficiencia cardíaca congestiva estable (N = 36), el bupropión se asoció con una exacerbación de la hipertensión preexistente en 2 sujetos, lo que llevó a la interrupción del tratamiento con bupropión. No existen ensayos controlados que evalúen la seguridad de bupropión en pacientes con antecedentes recientes de infarto de miocardio o enfermedad cardíaca inestable.
Activación de manía/hipomanía
El tratamiento antidepresivo puede precipitar un episodio maníaco, mixto o hipomaníaco. El riesgo parece aumentar en pacientes con trastorno bipolar o que tienen factores de riesgo para el trastorno bipolar. Antes de iniciar WELLBUTRIN, evalúe a los pacientes para detectar antecedentes de trastorno bipolar y la presencia de factores de riesgo para el trastorno bipolar (p. ej., antecedentes familiares de trastorno bipolar, suicidio o depresión). WELLBUTRIN 150 mg no está aprobado para su uso en el tratamiento de la depresión bipolar.
Psicosis y otras reacciones neuropsiquiátricas
Los pacientes deprimidos tratados con WELLBUTRIN han tenido una variedad de signos y síntomas neuropsiquiátricos, que incluyen delirios, alucinaciones, psicosis, trastornos de la concentración, paranoia y confusión. Algunos de estos pacientes tenían un diagnóstico de trastorno bipolar. En algunos casos, estos síntomas disminuyeron con la reducción de la dosis y/o la suspensión del tratamiento. Indique a los pacientes que se pongan en contacto con un profesional sanitario si se producen dichas reacciones.
Glaucoma de ángulo cerrado
La dilatación pupilar que ocurre después del uso de muchos medicamentos antidepresivos, incluido WELLBUTRIN 300 mg, puede desencadenar un ataque de ángulo cerrado en un paciente con ángulos anatómicamente estrechos que no tienen una iridectomía permeable.
Reacciones hipersensibles
Se han producido reacciones anafilactoides/anafilácticas durante los ensayos clínicos con bupropión. Las reacciones se han caracterizado por prurito, urticaria, angioedema y disnea que requieren tratamiento médico. Además, ha habido informes raros y espontáneos posteriores a la comercialización de eritema multiforme, síndrome de Stevens-Johnson y shock anafiláctico asociado con bupropión. Indique a los pacientes que descontinúen WELLBUTRIN 150 mg y consulten a un proveedor de atención médica si desarrollan una reacción alérgica o anafilactoide/anafiláctica (p. ej., erupción cutánea, prurito, urticaria, dolor torácico, edema y dificultad para respirar) durante el tratamiento.
Hay informes de artralgia, mialgia, fiebre con erupción cutánea y otros síntomas similares a la enfermedad del suero que sugieren hipersensibilidad retardada.
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( Guía de medicamentos ).
Pensamientos y comportamientos suicidas
Instruir a los pacientes, sus familias y/o sus cuidadores para que estén alerta ante la aparición de ansiedad, agitación, ataques de pánico, insomnio, irritabilidad, hostilidad, agresividad, impulsividad, acatisia (inquietud psicomotora), hipomanía, manía, otros cambios inusuales en el comportamiento , empeoramiento de la depresión e ideación suicida, especialmente al principio del tratamiento con antidepresivos y cuando la dosis se ajusta hacia arriba o hacia abajo. Aconseje a las familias y cuidadores de los pacientes que observen la aparición de tales síntomas día a día, ya que los cambios pueden ser abruptos. Dichos síntomas deben informarse al médico o al profesional de la salud del paciente, especialmente si son graves, de inicio repentino o no formaban parte de los síntomas que presentaba el paciente. Síntomas como estos pueden estar asociados con un mayor riesgo de pensamientos y conductas suicidas e indican la necesidad de un control muy estricto y posiblemente cambios en la medicación.
Eventos adversos neuropsiquiátricos y riesgo de suicidio en el tratamiento para dejar de fumar
Aunque WELLBUTRIN 150 mg no está indicado para el tratamiento para dejar de fumar, contiene el mismo ingrediente activo que ZYBAN, que está aprobado para este uso. Informar a los pacientes que algunos pacientes han experimentado cambios en el estado de ánimo (incluyendo depresión y manía), psicosis, alucinaciones, paranoia, delirios, ideación homicida, agresión, hostilidad, agitación, ansiedad y pánico, así como ideación suicida y suicidio al intentar dejar de fumar. fumar mientras toma bupropión. Indique a los pacientes que descontinúen el bupropión y que se comuniquen con un profesional de la salud si experimentan tales síntomas [ver ADVERTENCIAS Y PRECAUCIONES , REACCIONES ADVERSAS ].
Reacciones alérgicas severas
Instruya a los pacientes sobre los síntomas de hipersensibilidad y descontinúe WELLBUTRIN 300 mg si tienen una reacción alérgica grave.
Embargo
Indique a los pacientes que descontinúen y no reinicien WELLBUTRIN si experimentan una convulsión durante el tratamiento. Advierta a los pacientes que el uso excesivo o la interrupción abrupta del alcohol, las benzodiazepinas, los medicamentos antiepilépticos o los sedantes/hipnóticos pueden aumentar el riesgo de convulsiones. Aconseje a los pacientes que minimicen o eviten el consumo de alcohol.
Glaucoma de ángulo cerrado
Se debe advertir a los pacientes que tomar WELLBUTRIN 150 mg puede causar una dilatación pupilar leve, que en personas susceptibles puede provocar un episodio de glaucoma de ángulo cerrado. El glaucoma preexistente casi siempre es un glaucoma de ángulo abierto porque el glaucoma de ángulo cerrado, cuando se diagnostica, se puede tratar definitivamente con iridectomía. El glaucoma de ángulo abierto no es un factor de riesgo para el glaucoma de ángulo cerrado. Es posible que los pacientes deseen ser examinados para determinar si son susceptibles al cierre angular y someterse a un procedimiento profiláctico (p. ej., iridectomía), si son susceptibles [ver ADVERTENCIAS Y PRECAUCIONES ].
Productos que contienen bupropión
Indique a los pacientes que WELLBUTRIN 150 mg contiene el mismo ingrediente activo (clorhidrato de bupropión) que se encuentra en ZYBAN, que se usa como ayuda para el tratamiento para dejar de fumar, y que WELLBUTRIN 150 mg no debe usarse en combinación con ZYBAN ni con ningún otro medicamento que contenga bupropión (como como WELLBUTRIN 150 mg SR, la formulación de liberación sostenida y WELLBUTRIN XL o FORFIVO XL, las formulaciones de liberación prolongada, y APLENZIN, la formulación de liberación prolongada de bromhidrato de bupropión). Además, hay una serie de productos genéricos de bupropión HCl para formulaciones de liberación inmediata, sostenida y prolongada.
Potencial de deterioro cognitivo y motor
Advierta a los pacientes que cualquier fármaco activo en el SNC como WELLBUTRIN puede afectar su capacidad para realizar tareas que requieren juicio o habilidades motoras y cognitivas. Aconseje a los pacientes que hasta que estén razonablemente seguros de que WELLBUTRIN 300 mg no afecta negativamente su rendimiento, deben abstenerse de conducir un automóvil o de operar maquinaria compleja y peligrosa. WELLBUTRIN 150 mg puede conducir a una disminución de la tolerancia al alcohol.
Medicaciones concomitantes
Aconseje a los pacientes que notifiquen a su proveedor de atención médica si están tomando o planean tomar algún medicamento recetado o de venta libre porque WELLBUTRIN 150 mg y otros medicamentos pueden afectar el metabolismo de los demás.
El embarazo
Aconseje a las pacientes que notifiquen a su proveedor de atención médica si quedan embarazadas o tienen la intención de quedar embarazadas durante la terapia con WELLBUTRIN. Informe a los pacientes que existe un registro de exposición durante el embarazo que monitorea los resultados del embarazo en mujeres expuestas a WELLBUTRIN 150 mg durante el embarazo [ver Uso en poblaciones específicas ].
Información de almacenamiento
Indique a los pacientes que almacenen WELLBUTRIN a temperatura ambiente, entre 20 °C y 25 °C (68 °F y 77 °F) y que mantengan las tabletas secas y protegidas de la luz.
Información de administración
Indique a los pacientes que tomen WELLBUTRIN en dosis divididas en partes iguales 3 o 4 veces al día, con dosis separadas por al menos 6 horas para minimizar el riesgo de convulsiones. Indique a los pacientes si olvidan una dosis, que no tomen una tableta adicional para compensar la dosis olvidada y que tomen la siguiente tableta a la hora habitual debido al riesgo de convulsiones relacionado con la dosis. Indique a los pacientes que las tabletas de WELLBUTRIN deben tragarse enteras y no trituradas, partidas ni masticadas. WELLBUTRIN se puede tomar con o sin alimentos.
WELLBUTRIN, WELLBUTRIN SR, WELLBUTRIN 150 mg XL y ZYBAN son marcas comerciales propiedad del grupo de empresas GSK o con licencia para este. Las otras marcas enumeradas son marcas comerciales propiedad de sus respectivos propietarios o con licencia para ellos y no son propiedad ni tienen licencia del grupo de empresas GSK. Los fabricantes de estas marcas no están afiliados ni respaldan al grupo de empresas GSK ni a sus productos.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Se realizaron estudios de carcinogenicidad de por vida en ratas y ratones con dosis de bupropión de hasta 300 y 150 mg/kg/día, respectivamente. Estas dosis son aproximadamente 6 y 2 veces la MRHD, respectivamente, sobre una base de mg/m2. En el estudio con ratas hubo un aumento en las lesiones proliferativas nodulares del hígado en dosis de 100 a 300 mg/kg/día (aproximadamente 2 a 6 veces la MRHD en base a mg/m2); no se probaron dosis más bajas. La cuestión de si tales lesiones pueden o no ser precursoras de neoplasias del hígado está actualmente sin resolver. No se observaron lesiones hepáticas similares en el estudio con ratones, y no se observó un aumento en los tumores malignos del hígado y otros órganos en ninguno de los estudios.
El bupropión produjo una respuesta positiva (2 a 3 veces la tasa de mutación del control) en 2 de 5 cepas en el ensayo de mutagenicidad bacteriana de Ames. El bupropión produjo un aumento de las aberraciones cromosómicas en 1 de 3 estudios citogenéticos de médula ósea de rata in vivo.
No hubo efectos en la fertilidad de machos y hembras cuando a las ratas se les administraron dosis orales de bupropión de hasta 300 mg/kg/día (aproximadamente 6 veces la MRHD en mg/m2) a las hembras antes del apareamiento y hasta el día 13 de gestación. o durante la lactancia, y a los machos durante 60 días antes y durante el apareamiento. Sin embargo, dosis de 200 mg/kg/día (aproximadamente 4 veces la MRHD en base a mg/m2) o más, causaron ataxia transitoria o cambios de comportamiento en ratas hembra adultas. Tampoco hubo efectos adversos sobre la fertilidad, la reproducción o el crecimiento y desarrollo de la descendencia masculina o femenina.
Uso en poblaciones específicas
El embarazo
Registro de exposición durante el embarazo
Existe un registro independiente de exposición durante el embarazo que monitorea los resultados del embarazo en mujeres expuestas a cualquier antidepresivo durante el embarazo. Se alienta a los proveedores de atención médica a registrar a los pacientes llamando al Registro Nacional de Embarazo para Antidepresivos al 1-844-4056185 o visitando en línea https://womensmentalhealth.org/clinical-and-researchprograms/pregnancyregistry/antidepressants.
Resumen de riesgos
Los datos de estudios epidemiológicos de mujeres embarazadas expuestas a bupropión en el primer trimestre no han identificado un mayor riesgo de malformaciones congénitas en general (ver Datos ). Existen riesgos para la madre asociados con la depresión no tratada durante el embarazo (ver Consideraciones clínicas ). Cuando se administró bupropión a ratas preñadas durante la organogénesis, no hubo evidencia de malformaciones fetales en dosis de hasta aproximadamente 10 veces la dosis máxima recomendada en humanos (DMRH) de 450 mg/día. Cuando se administró a conejas preñadas durante la organogénesis, se observaron aumentos no relacionados con la dosis en la incidencia de malformaciones fetales y variaciones esqueléticas en dosis aproximadamente iguales a la MRHD y mayores. Se observaron pesos fetales reducidos con dosis dos veces superiores a la MRHD y mayores (ver Datos de animales ).
Se desconoce el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo para la población indicada. Todos los embarazos tienen un riesgo de fondo de defecto congénito, pérdida u otros resultados adversos. En la población general de los EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y de aborto espontáneo en embarazos reconocidos clínicamente es del 2 % al 4 % y del 15 % al 20 %, respectivamente.
Consideraciones clínicas
Riesgo materno y/o embrionario/fetal asociado a la enfermedad
Un estudio longitudinal prospectivo siguió a 201 mujeres embarazadas con antecedentes de trastorno depresivo mayor que eran eutímicas y tomaban antidepresivos durante el embarazo al comienzo del embarazo. Las mujeres que suspendieron los antidepresivos durante el embarazo tenían más probabilidades de experimentar una recaída de depresión mayor que las mujeres que continuaron con los antidepresivos. Considere los riesgos para la madre de la depresión no tratada y los posibles efectos en el feto al suspender o cambiar el tratamiento con medicamentos antidepresivos durante el embarazo y el posparto.
Datos
Datos humanos
Los datos del Registro internacional de embarazos con bupropión (675 exposiciones en el primer trimestre) y un estudio de cohorte retrospectivo que utilizó la base de datos de United Healthcare (1213 exposiciones en el primer trimestre) no mostraron un aumento del riesgo de malformaciones en general. El Registro no fue diseñado ni potenciado para evaluar defectos específicos, pero sugirió un posible aumento de las malformaciones cardíacas.
No se ha observado un aumento del riesgo de malformaciones cardiovasculares en general después de la exposición a bupropión durante el primer trimestre. La tasa de malformaciones cardiovasculares observada prospectivamente en embarazos con exposición a bupropión en el primer trimestre del Registro internacional de embarazos fue del 1,3 % (9 malformaciones cardiovasculares/675 exposiciones maternas a bupropión en el primer trimestre), que es similar a la tasa de fondo de malformaciones cardiovasculares (aproximadamente 1%). Datos de la base de datos de United Healthcare, que tenía un número limitado de casos expuestos con malformaciones cardiovasculares, y un estudio de casos y controles (6853 bebés con malformaciones cardiovasculares y 5763 con malformaciones no cardiovasculares) del uso autoinformado de bupropión del National Birth Defects El estudio de prevención (NBDPS) no mostró un aumento del riesgo de malformaciones cardiovasculares en general después de la exposición a bupropión durante el primer trimestre.
Los hallazgos del estudio sobre la exposición al bupropión durante el primer trimestre y el riesgo de obstrucción del tracto de salida del ventrículo izquierdo (LVOTO) son inconsistentes y no permiten sacar conclusiones con respecto a una posible asociación. La base de datos de United Healthcare carecía de poder suficiente para evaluar esta asociación; el NBDPS encontró un mayor riesgo de LVOTO (n = 10; OR ajustado = 2,6; IC del 95 %: 1,2, 5,7), y el estudio de control de casos de Slone Epidemiology no encontró un mayor riesgo de LVOTO.
Los hallazgos del estudio sobre la exposición al bupropión durante el primer trimestre y el riesgo de defecto del tabique ventricular (CIV) son inconsistentes y no permiten sacar conclusiones con respecto a una posible asociación. El Estudio de Epidemiología de Slone encontró un mayor riesgo de CIV después de la exposición materna a bupropión en el primer trimestre (n = 17; OR ajustado = 2,5; IC del 95 %: 1,3, 5,0), pero no encontró un mayor riesgo de ninguna otra malformación cardiovascular estudiada (incluyendo LVOTO como arriba). El estudio de la base de datos del NBDPS y United Healthcare no encontró una asociación entre la exposición materna al bupropión en el primer trimestre y la CIV.
Para los hallazgos de LVOTO y VSD, los estudios estuvieron limitados por la pequeña cantidad de casos expuestos, los hallazgos inconsistentes entre los estudios y el potencial de hallazgos fortuitos de comparaciones múltiples en estudios de casos y controles.
Datos de animales
En estudios realizados en ratas y conejas preñadas, se administró bupropión por vía oral durante el período de organogénesis en dosis de hasta 450 y 150 mg/kg/día, respectivamente (aproximadamente 10 y 6 veces la MRHD, respectivamente, en mg/m2). ). No hubo evidencia de malformaciones fetales en ratas. Cuando se administró a conejas preñadas durante la organogénesis, se observaron aumentos no relacionados con la dosis en la incidencia de malformaciones fetales y variaciones esqueléticas en la dosis más baja probada (25 mg/kg/día, aproximadamente igual a la MRHD en mg/m2) y mayor Se observaron pesos fetales reducidos con dosis de 50 mg/kg/día (aproximadamente 2 veces la MRHD sobre una base de mg/m2) y mayores. No se evidenció toxicidad materna a dosis de 50 mg/kg/día o menos.
En un estudio de desarrollo pre y posnatal, el bupropión administrado por vía oral a ratas preñadas en dosis de hasta 150 mg/kg/día (aproximadamente 3 veces la MRHD en mg/m2) desde la implantación embrionaria hasta la lactancia no tuvo ningún efecto sobre el crecimiento de las crías. o desarrollo.
Lactancia
Resumen de riesgos
Los datos de la literatura publicada informan la presencia de bupropión y sus metabolitos en la leche humana (ver Datos ). No hay datos sobre los efectos del bupropión o sus metabolitos en la producción de leche. Los datos limitados de los informes posteriores a la comercialización no han identificado una asociación clara de reacciones adversas en el lactante. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de WELLBUTRIN de la madre y cualquier efecto adverso potencial sobre el niño amamantado debido a WELLBUTRIN oa la afección materna subyacente.
Datos
En un estudio de lactancia de 10 mujeres, se midieron los niveles de bupropión dosificado por vía oral y sus metabolitos activos en la leche extraída. La exposición infantil diaria promedio (suponiendo un consumo diario de 150 ml/kg) al bupropión y sus metabolitos activos fue del 2 % de la dosis materna ajustada según el peso. Los informes posteriores a la comercialización han descrito convulsiones en bebés amamantados. La relación entre la exposición al bupropión y estas convulsiones no está clara.
Uso pediátrico
No se ha establecido la seguridad y eficacia en la población pediátrica [ver ADVERTENCIA EN CAJA , ADVERTENCIAS Y PRECAUCIONES ].
Uso geriátrico
De los aproximadamente 6,000 sujetos que participaron en ensayos clínicos con tabletas de liberación sostenida de bupropión (ensayos para dejar de fumar y depresión), 275 tenían ≥65 años y 47 tenían ≥75 años. Además, varios cientos de sujetos de ≥65 años participaron en ensayos clínicos utilizando la formulación de liberación inmediata de bupropión (ensayos de depresión). No se observaron diferencias generales en seguridad o eficacia entre estos sujetos y sujetos más jóvenes. La experiencia clínica notificada no ha identificado diferencias en las respuestas entre los ancianos y los pacientes más jóvenes, pero no se puede descartar una mayor sensibilidad de algunas personas mayores.
El bupropión se metaboliza ampliamente en el hígado a metabolitos activos, que luego se metabolizan y excretan por los riñones. El riesgo de reacciones adversas puede ser mayor en pacientes con insuficiencia renal. Debido a que es más probable que los pacientes de edad avanzada tengan una función renal disminuida, puede ser necesario considerar este factor en la selección de la dosis; puede ser útil para monitorear la función renal [ver DOSIFICACIÓN Y ADMINISTRACIÓN , Uso en poblaciones específicas , FARMACOLOGÍA CLÍNICA ].
Insuficiencia renal
Considere una dosis reducida y/o frecuencia de dosificación de WELLBUTRIN en pacientes con insuficiencia renal (tasa de filtración glomerular: menos de 90 ml/min). El bupropión y sus metabolitos se eliminan por vía renal y pueden acumularse en estos pacientes en mayor medida de lo habitual. Vigile de cerca las reacciones adversas que podrían indicar exposiciones altas a bupropión o metabolitos [ver DOSIFICACIÓN Y ADMINISTRACIÓN , FARMACOLOGÍA CLÍNICA ].
Deterioro hepático
En pacientes con insuficiencia hepática de moderada a grave (puntuación de Child-Pugh: 7 a 15), la dosis máxima de WELLBUTRIN 150 mg es de 75 mg al día. En pacientes con insuficiencia hepática leve (puntuación de Child-Pugh: 5 a 6), considere reducir la dosis y/o la frecuencia de la dosificación [ver DOSIFICACIÓN Y ADMINISTRACIÓN , FARMACOLOGÍA CLÍNICA ].
SOBREDOSIS
Experiencia de sobredosis humana
Se han informado sobredosis de hasta 30 gramos o más de bupropión. Se informaron convulsiones en aproximadamente un tercio de todos los casos. Otras reacciones graves notificadas con sobredosis de bupropión solo incluyeron alucinaciones, pérdida del conocimiento, taquicardia sinusal y cambios en el ECG, como trastornos de la conducción (incluida la prolongación del QRS) o arritmias. Se han notificado fiebre, rigidez muscular, rabdomiólisis, hipotensión, estupor, coma e insuficiencia respiratoria principalmente cuando el bupropión formaba parte de sobredosis de múltiples fármacos.
Aunque la mayoría de los pacientes se recuperaron sin secuelas, se han informado muertes asociadas con sobredosis de bupropión solo en pacientes que ingirieron grandes dosis del fármaco. En estos pacientes se informaron múltiples convulsiones no controladas, bradicardia, insuficiencia cardíaca y paro cardíaco antes de la muerte.
Manejo de sobredosis
Consulte a un centro de control de intoxicaciones certificado para obtener orientación y asesoramiento actualizados. Los números de teléfono de los centros de control de envenenamiento certificados se encuentran en la Referencia del escritorio del médico (PDR). Llame al 1-800-222-1222 o consulte www.poison.org.
No se conocen antídotos para el bupropión. En caso de sobredosis, brinde atención de apoyo, incluida una estrecha supervisión y control médico. Considere la posibilidad de una sobredosis de múltiples drogas. Asegurar una adecuada vía aérea, oxigenación y ventilación. Controlar el ritmo cardíaco y los signos vitales. No se recomienda la inducción de emesis.
CONTRAINDICACIONES
- WELLBUTRIN 150 mg está contraindicado en pacientes con un trastorno convulsivo.
- WELLBUTRIN está contraindicado en pacientes con un diagnóstico actual o anterior de bulimia o anorexia nerviosa, ya que se observó una mayor incidencia de convulsiones en dichos pacientes tratados con WELLBUTRIN [ver ADVERTENCIAS Y PRECAUCIONES ].
- WELLBUTRIN 300 mg está contraindicado en pacientes que suspendieron abruptamente el alcohol, las benzodiazepinas, los barbitúricos y los medicamentos antiepilépticos [ver ADVERTENCIAS Y PRECAUCIONES , INTERACCIONES CON LA DROGAS ].
- Está contraindicado el uso de IMAO (destinados a tratar trastornos psiquiátricos) concomitantemente con WELLBUTRIN 300 mg o dentro de los 14 días posteriores a la interrupción del tratamiento con WELLBUTRIN 150 mg. Existe un mayor riesgo de reacciones hipertensivas cuando WELLBUTRIN se usa concomitantemente con IMAO. También está contraindicado el uso de WELLBUTRIN dentro de los 14 días posteriores a la interrupción del tratamiento con un IMAO. Está contraindicado iniciar WELLBUTRIN 150 mg en un paciente tratado con IMAO reversibles como linezolid o azul de metileno intravenoso [ver DOSIFICACIÓN Y ADMINISTRACIÓN , ADVERTENCIAS Y PRECAUCIONES , INTERACCIONES CON LA DROGAS ].
- WELLBUTRIN está contraindicado en pacientes con hipersensibilidad conocida al bupropión u otros componentes de WELLBUTRIN. Se han informado reacciones anafilactoides/anafilácticas y síndrome de Stevens-Johnson [ver ADVERTENCIAS Y PRECAUCIONES ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
Se desconoce el mecanismo exacto de la acción antidepresiva del bupropión, pero se presume que está relacionado con mecanismos noradrenérgicos y/o dopaminérgicos. El bupropión es un inhibidor relativamente débil de la recaptación neuronal de norepinefrina y dopamina y no inhibe la recaptación de serotonina. El bupropión no inhibe la monoamino oxidasa.
Farmacocinética
El bupropión es una mezcla racémica. No se ha estudiado la actividad farmacológica y la farmacocinética de los enantiómeros individuales. La vida media de eliminación media (±DE) de bupropión después de la dosificación crónica es de 21 (±9) horas, y las concentraciones plasmáticas de bupropión en estado estacionario se alcanzan en 8 días.
Absorción
No se ha determinado la biodisponibilidad absoluta de WELLBUTRIN en humanos porque no se encuentra disponible una formulación intravenosa para uso humano. Sin embargo, parece probable que solo una pequeña proporción de cualquier dosis administrada por vía oral llegue intacta a la circulación sistémica. En estudios con ratas y perros, la biodisponibilidad de bupropion osciló entre el 5 % y el 20 %.
En humanos, luego de la administración oral de WELLBUTRIN 300 mg, las concentraciones plasmáticas máximas de bupropión generalmente se alcanzan dentro de las 2 horas. Las concentraciones plasmáticas de bupropión son proporcionales a la dosis después de dosis únicas de 100 a 250 mg; sin embargo, se desconoce si la proporcionalidad entre dosis y nivel plasmático se mantiene en el uso crónico.
Distribución
Las pruebas in vitro muestran que el bupropión se une en un 84 % a las proteínas plasmáticas humanas en concentraciones de hasta 200 mcg/mL. La extensión de la unión a proteínas del metabolito hidroxibupropión es similar a la del bupropión, mientras que la extensión de la unión a proteínas del metabolito treohidrobupropión es aproximadamente la mitad de la observada con bupropión.
Metabolismo
El bupropión se metaboliza extensamente en humanos. Hay tres metabolitos activos: hidroxibupropión, que se forma mediante la hidroxilación del grupo terc-butilo del bupropión, y los isómeros de amino-alcohol treohidrobupropión y eritrohidrobupropión, que se forman mediante la reducción del grupo carbonilo. Los hallazgos in vitro sugieren que CYP2B6 es la principal isoenzima involucrada en la formación de hidroxibupropión, mientras que las enzimas del citocromo P450 no están involucradas en la formación de treohidrobupropión. La oxidación de la cadena lateral de bupropión da como resultado la formación de un conjugado de glicina de ácido metaclorobenzoico, que luego se excreta como el principal metabolito urinario. La potencia y la toxicidad de los metabolitos en relación con el bupropión no se han caracterizado por completo. Sin embargo, se ha demostrado en una prueba de detección de antidepresivos en ratones que el hidroxibupropión es la mitad de potente que el bupropión, mientras que el treohidrobupropión y el eritrohidrobupropión son 5 veces menos potentes que el bupropión. Esto puede tener importancia clínica porque las concentraciones plasmáticas de los metabolitos son tan altas o más altas que las del bupropión.
Luego de una dosis única en humanos, las concentraciones plasmáticas máximas de hidroxibupropión ocurren aproximadamente 3 horas después de la administración de WELLBUTRIN y son aproximadamente 10 veces el nivel máximo del fármaco original en estado estacionario. La vida media de eliminación del hidroxibupropión es de aproximadamente 20 (±5) horas, y su AUC en estado estacionario es aproximadamente 17 veces mayor que la del bupropión. Los tiempos para alcanzar las concentraciones máximas de los metabolitos eritrohidrobupropión y treohidrobupropión son similares a los del metabolito hidroxibupropión. Sin embargo, sus semividas de eliminación son más prolongadas, 33 (±10) y 37 (±13) horas, respectivamente, y las AUC en estado estacionario son 1,5 y 7 veces mayores que las del bupropión, respectivamente.
El bupropión y sus metabolitos exhiben una cinética lineal luego de la administración crónica de 300 a 450 mg/día.
Eliminación
Luego de la administración oral de 200 mg de 14C-bupropión en humanos, el 87 % y el 10 % de la dosis radiactiva se recuperó en la orina y las heces, respectivamente. Solo el 0,5 % de la dosis oral se excretó como bupropión inalterado.
Poblaciones Específicas
Se puede esperar que los factores o condiciones que alteran la capacidad metabólica (p. ej., enfermedad hepática, insuficiencia cardíaca congestiva [CHF], edad, medicamentos concomitantes, etc.) o la eliminación influyan en el grado y la extensión de la acumulación de los metabolitos activos de bupropión. La eliminación de los principales metabolitos de bupropión puede verse afectada por la reducción de la función renal o hepática porque son compuestos moderadamente polares y es probable que experimenten un mayor metabolismo o conjugación en el hígado antes de la excreción urinaria.
Pacientes con insuficiencia renal
Existe información limitada sobre la farmacocinética de bupropión en pacientes con insuficiencia renal. Una comparación entre ensayos entre sujetos normales y sujetos con insuficiencia renal terminal demostró que los valores de Cmax y AUC del fármaco original eran comparables en los 2 grupos, mientras que los metabolitos de hidroxibupropión y treohidrobupropión tenían un aumento de 2,3 y 2,8 veces, respectivamente. en AUC para sujetos con insuficiencia renal terminal. Un segundo ensayo, que comparó sujetos normales y sujetos con insuficiencia renal de moderada a grave (TFG 30,9 ± 10,8 ml/min) mostró que después de una dosis única de 150 mg de bupropión de liberación sostenida, la exposición al bupropión fue aproximadamente 2 veces mayor en sujetos con insuficiencia renal, mientras que los niveles de los metabolitos hidroxibupropión y treo/eritrohidrobupropión (combinados) fueron similares en los 2 grupos. El bupropión se metaboliza ampliamente en el hígado a metabolitos activos, que se metabolizan aún más y posteriormente se excretan por los riñones. La eliminación de los principales metabolitos de bupropión puede verse reducida por una función renal alterada. WELLBUTRIN se debe usar con precaución en pacientes con insuficiencia renal y se debe considerar una frecuencia y/o dosis reducidas [ver Uso en poblaciones específicas ].
Pacientes con insuficiencia hepática
El efecto de la insuficiencia hepática sobre la farmacocinética de bupropión se caracterizó en 2 ensayos de dosis única, uno en sujetos con enfermedad hepática alcohólica y otro en sujetos con cirrosis de leve a grave. El primer ensayo demostró que la vida media del hidroxibupropión fue significativamente más larga en 8 sujetos con enfermedad hepática alcohólica que en 8 voluntarios sanos (32 ± 14 horas versus 21 ± 5 horas, respectivamente). Aunque no fue estadísticamente significativo, las AUC de bupropión e hidroxibupropión fueron más variables y tendieron a ser mayores (entre un 53 % y un 57 %) en voluntarios con enfermedad hepática alcohólica. Las diferencias en la vida media de bupropion y los otros metabolitos en los 2 grupos fueron mínimas.
El segundo ensayo no demostró diferencias estadísticamente significativas en la farmacocinética del bupropión y sus metabolitos activos en 9 sujetos con cirrosis hepática de leve a moderada en comparación con 8 voluntarios sanos. Sin embargo, se observó más variabilidad en algunos de los parámetros farmacocinéticos de bupropión (AUC, Cmax y Tmax) y sus metabolitos activos (t½) en sujetos con cirrosis hepática de leve a moderada. En sujetos con cirrosis hepática severa, se observaron alteraciones significativas en la farmacocinética de bupropion y sus metabolitos (Tabla 3).
Pacientes con disfunción ventricular izquierda
Durante un ensayo de dosificación crónica con bupropion en 14 sujetos deprimidos con disfunción ventricular izquierda (antecedentes de CHF o agrandamiento del corazón en la radiografía), no hubo un efecto aparente sobre la farmacocinética de bupropion o sus metabolitos, en comparación con voluntarios sanos.
Años
Los efectos de la edad sobre la farmacocinética del bupropión y sus metabolitos no se han caracterizado por completo, pero una exploración de las concentraciones de bupropión en estado estacionario de varios ensayos de eficacia de la depresión en sujetos que recibieron dosis en un rango de 300 a 750 mg/día, en un 3- horario diario, no reveló relación entre la edad (18 a 83 años) y la concentración plasmática de bupropión. Un ensayo farmacocinético de dosis única demostró que la disposición de bupropión y sus metabolitos en sujetos de edad avanzada fue similar a la de sujetos más jóvenes. Estos datos sugieren que no existe un efecto destacado de la edad sobre la concentración de bupropión; sin embargo, otro ensayo farmacocinético de dosis única y múltiple sugirió que los ancianos tienen un mayor riesgo de acumulación de bupropión y sus metabolitos [ver Uso en poblaciones específicas ].
Pacientes masculinos y femeninos
El análisis combinado de los datos farmacocinéticos de bupropión de 90 voluntarios sanos de sexo masculino y 90 voluntarios sanos de sexo femenino no reveló diferencias relacionadas con el sexo en las concentraciones plasmáticas máximas de bupropión. La exposición sistémica media (AUC) fue aproximadamente un 13 % mayor en los voluntarios masculinos en comparación con las voluntarias femeninas. La importancia clínica de este hallazgo es desconocida.
fumadores
Los efectos del tabaquismo sobre la farmacocinética del bupropión se estudiaron en 34 voluntarios sanos, hombres y mujeres; 17 eran fumadores crónicos de cigarrillos y 17 no fumadores. Después de la administración oral de una dosis única de 150 mg de bupropión, no hubo diferencias estadísticamente significativas en la Cmax, la vida media, el Tmax, el AUC o el aclaramiento de bupropion o sus metabolitos activos entre fumadores y no fumadores.
Estudios de interacción farmacológica
Posibilidad de que otros medicamentos afecten a WELLBUTRIN
Los estudios in vitro indican que el bupropión se metaboliza principalmente a hidroxibupropión por CYP2B6. Por lo tanto, existe la posibilidad de interacciones farmacológicas entre WELLBUTRIN y fármacos que son inhibidores o inductores de CYP2B6. Además, los estudios in vitro sugieren que la paroxetina, la sertralina, la norfluoxetina, la fluvoxamina y el nelfinavir inhiben la hidroxilación del bupropión.
Inhibidores de CYP2B6
Ticlopidina, clopidogrel: en un ensayo en voluntarios varones sanos, 75 mg de clopidogrel una vez al día o 250 mg de ticlopidina dos veces al día aumentaron las exposiciones (Cmax y AUC) de bupropión en un 40 % y un 60 % para el clopidogrel, y en un 38 % y un 85 % para la ticlopidina , respectivamente. Las exposiciones (Cmáx y AUC) de hidroxibupropión se redujeron en un 50 % y un 52 %, respectivamente, con clopidogrel, y en un 78 % y 84 %, respectivamente, con ticlopidina. Se cree que este efecto se debe a la inhibición de la hidroxilación de bupropión catalizada por CYP2B6.
Prasugrel: prasugrel es un inhibidor débil de CYP2B6. En sujetos sanos, prasugrel aumentó los valores de Cmáx y AUC de bupropión en un 14 % y 18 %, respectivamente, y disminuyó los valores de Cmáx y AUC de hidroxibupropión, un metabolito activo de bupropión, en un 32 % y un 24 %, respectivamente.
Cimetidina: el metabolito treohidrobupropión del bupropión no parece ser producido por las enzimas del citocromo P450. Los efectos de la administración concomitante de cimetidina sobre la farmacocinética de bupropión y sus metabolitos activos se estudiaron en 24 voluntarios masculinos jóvenes sanos. Después de la administración oral de 300 mg de bupropión con y sin 800 mg de cimetidina, la farmacocinética de bupropión e hidroxibupropión no se vio afectada. Sin embargo, hubo aumentos del 16 % y el 32 % en el AUC y la Cmax, respectivamente, de las fracciones combinadas de treohidrobupropión y eritrohidrobupropión.
Citalopram: Citalopram no afectó la farmacocinética de bupropión y sus tres metabolitos.
Inductores de CYP2B6
Ritonavir y lopinavir: en un ensayo con voluntarios sanos, ritonavir 100 mg dos veces al día redujo el AUC y la Cmax de bupropion en un 22 % y un 21 %, respectivamente. La exposición del metabolito de hidroxibupropión disminuyó en un 23 %, la del treohidrobupropión disminuyó en un 38 % y la del eritrohidrobupropión disminuyó en un 48 %.
En un segundo ensayo con voluntarios sanos, ritonavir en una dosis de 600 mg dos veces al día disminuyó el AUC y la Cmax de bupropión en un 66 % y un 62 %, respectivamente. La exposición del metabolito de hidroxibupropión disminuyó en un 78 %, la del treohidrobupropión disminuyó en un 50 % y la del eritrohidrobupropión disminuyó en un 68 %.
En otro ensayo con voluntarios sanos, 400 mg de lopinavir/100 mg de ritonavir dos veces al día redujeron el AUC y la Cmax de bupropión en un 57 %. El AUC y la Cmax de hidroxibupropión se redujeron en un 50 % y un 31 %, respectivamente.
Efavirenz: En un ensayo en voluntarios sanos, efavirenz 600 mg una vez al día durante 2 semanas redujo el AUC y la Cmax de bupropión en aproximadamente un 55 % y un 34 %, respectivamente. El AUC de hidroxibupropión no cambió, mientras que la Cmax de hidroxibupropión aumentó en un 50 %.
Carbamazepina, fenobarbital, fenitoína: aunque no se han estudiado sistemáticamente, estos fármacos pueden inducir el metabolismo del bupropión.
Potencial de WELLBUTRIN para afectar a otras drogas
Los datos en animales indicaron que el bupropión puede ser un inductor de enzimas metabolizadoras de fármacos en humanos. En un ensayo, luego de la administración crónica de 100 mg de bupropión tres veces al día a 8 voluntarios masculinos sanos durante 14 días, no hubo evidencia de inducción de su propio metabolismo. No obstante, puede haber potencial para alteraciones clínicamente importantes de los niveles en sangre de los fármacos coadministrados.
Fármacos metabolizados por CYP2D6
In vitro, el bupropión y sus metabolitos (eritrohidrobupropión, treohidrobupropión, hidroxibupropión) son inhibidores de CYP2D6. En un ensayo clínico de 15 sujetos masculinos (de 19 a 35 años de edad) que eran metabolizadores rápidos de CYP2D6, 300 mg/día de bupropión seguidos de una dosis única de 50 mg de desipramina aumentó la Cmax, el AUC y la t½ de desipramina en un promedio de aproximadamente 2, 5 y 2 veces, respectivamente. El efecto estuvo presente durante al menos 7 días después de la última dosis de bupropión. No se ha estudiado formalmente el uso concomitante de bupropión con otros fármacos metabolizados por CYP2D6.
Citalopram: aunque citalopram no se metaboliza principalmente por CYP2D6, en un ensayo el bupropión aumentó la Cmax y el AUC de citalopram en un 30 % y un 40 %, respectivamente.
Lamotrigina: Dosis orales múltiples de bupropión no tuvieron efectos estadísticamente significativos sobre la farmacocinética de dosis única de lamotrigina en 12 voluntarios sanos.
Digoxina: Los datos de la literatura mostraron que la exposición a la digoxina disminuyó cuando se administró una dosis oral única de 0,5 mg de digoxina 24 horas después de una dosis oral única de 150 mg de bupropión de liberación prolongada en voluntarios sanos.
Estudios clínicos
La eficacia de WELLBUTRIN 150 mg en el tratamiento del trastorno depresivo mayor se estableció en dos ensayos controlados con placebo de 4 semanas en pacientes adultos hospitalizados con TDM (ensayos 1 y 2 en la Tabla 4) y en un ensayo controlado con placebo de 6 semanas en pacientes ambulatorios adultos con TDM (Ensayo 3 en la Tabla 4). En el primer ensayo, el rango de dosis de WELLBUTRIN 300 mg fue de 300 mg a 600 mg/día administrados en 3 dosis divididas; El 78% de los sujetos fueron tratados con dosis de 300 mg a 450 mg/día. El ensayo demostró la eficacia de WELLBUTRIN 300 mg según lo medido por la puntuación total de la escala de calificación de depresión de Hamilton (HDRS), el elemento de estado de ánimo deprimido de HDRS (ítem 1) y la puntuación de gravedad de impresiones clínicas globales (CGI-S). El segundo ensayo incluyó 2 dosis de WELLBUTRIN (300 y 450 mg/día) y placebo. Este ensayo demostró la eficacia de WELLBUTRIN 150 mg solo para la dosis de 450 mg/día. Los resultados de eficacia fueron estadísticamente significativos para la puntuación total de HDRS y la puntuación de CGI-S, pero no para el ítem 1 de HDRS. En el tercer ensayo, los pacientes ambulatorios fueron tratados con 300 mg/día de WELLBUTRIN. Este ensayo demostró la eficacia de WELLBUTRIN 150 mg medida por la puntuación total de HDRS, el ítem 1 de HDRS, la escala de calificación de depresión de Montgomery-Asberg (MADRS), la puntuación CGI-S y la puntuación de la escala de mejora CGI (CGI-I). . La eficacia de WELLBUTRIN 300 mg en uso a largo plazo, es decir, durante más de 6 semanas, no ha sido evaluada sistemáticamente en ensayos controlados.
INFORMACIÓN DEL PACIENTE
WELLBUTRIN (WELL byu-trin) (clorhidrato de bupropión) Comprimidos
IMPORTANTE: Asegúrese de leer las tres secciones de esta Guía del medicamento. La primera sección trata sobre el riesgo de pensamientos y acciones suicidas con medicamentos antidepresivos; la segunda sección trata sobre el riesgo de cambios en el pensamiento y el comportamiento, depresión y pensamientos o acciones suicidas con medicamentos utilizados para dejar de fumar; y la tercera sección se titula "¿Qué otra información importante debo saber sobre WELLBUTRIN 150mg?"
Medicamentos antidepresivos, depresión y otras enfermedades mentales graves, y pensamientos o acciones suicidas
Esta sección de la Guía del medicamento solo trata sobre el riesgo de pensamientos y acciones suicidas con medicamentos antidepresivos.
¿Cuál es la información más importante que debo saber sobre los medicamentos antidepresivos, la depresión y otras enfermedades mentales graves y los pensamientos o acciones suicidas?
1. Los medicamentos antidepresivos pueden aumentar el riesgo de pensamientos o acciones suicidas en algunos niños, adolescentes o adultos jóvenes durante los primeros meses de tratamiento.
2. La depresión u otras enfermedades mentales graves son las causas más importantes de pensamientos y acciones suicidas. Algunas personas pueden tener un riesgo particularmente alto de tener pensamientos o acciones suicidas. Estos incluyen personas que tienen (o tienen antecedentes familiares de) enfermedad bipolar (también llamada enfermedad maníaco-depresiva) o pensamientos o acciones suicidas.
3. ¿Cómo puedo vigilar y tratar de prevenir pensamientos y acciones suicidas en mí mismo o en un miembro de la familia?
- Preste mucha atención a cualquier cambio, especialmente a los repentinos, en el estado de ánimo, el comportamiento, los pensamientos o los sentimientos. Esto es muy importante cuando se inicia un medicamento antidepresivo o cuando se cambia la dosis.
- Llame a su proveedor de atención médica de inmediato para informar cambios nuevos o repentinos en el estado de ánimo, el comportamiento, los pensamientos o los sentimientos.
- Mantenga todas las visitas de seguimiento con su proveedor de atención médica según lo programado. Llame al proveedor de atención médica entre visitas según sea necesario, especialmente si le preocupan los síntomas.
Llame a su proveedor de atención médica de inmediato si usted o un miembro de su familia tienen alguno de los siguientes síntomas, especialmente si son nuevos, empeoran o le preocupan:
- pensamientos sobre el suicidio o la muerte
- intentos de suicidio
- depresión nueva o peor
- ansiedad nueva o peor
- sentirse muy agitado o inquieto
- ataques de pánico
- dificultad para dormir (insomnio)
- irritabilidad nueva o peor
- Actuar agresivo, estar enojado o violento.
- actuando sobre impulsos peligrosos
- un aumento extremo en la actividad y el habla (manía)
- otros cambios inusuales en el comportamiento o el estado de ánimo
¿Qué más necesito saber sobre los medicamentos antidepresivos?
- Nunca deje de tomar un medicamento antidepresivo sin hablar primero con un proveedor de atención médica. Detener un medicamento antidepresivo repentinamente puede causar otros síntomas.
- Los antidepresivos son medicamentos que se usan para tratar la depresión y otras enfermedades. Es importante discutir todos los riesgos de tratar la depresión y también los riesgos de no tratarla. Los pacientes y sus familias u otros cuidadores deben analizar todas las opciones de tratamiento con el proveedor de atención médica, no solo el uso de antidepresivos.
- Las medicinas antidepresivas tienen otros efectos secundarios. Hable con el proveedor de atención médica sobre los efectos secundarios del medicamento recetado para usted o su familiar.
- Los medicamentos antidepresivos pueden interactuar con otros medicamentos. Conozca todos los medicamentos que toma usted o su familiar. Mantenga una lista de todos los medicamentos para mostrársela al proveedor de atención médica. No empiece a tomar nuevos medicamentos sin antes consultar con su proveedor de atención médica.
No se sabe si WELLBUTRIN es seguro y efectivo en niños menores de 18 años.
Dejar de fumar, medicamentos para dejar de fumar, cambios en el pensamiento y el comportamiento, depresión y pensamientos o acciones suicidas
Esta sección de la Guía del medicamento trata únicamente sobre el riesgo de cambios en el pensamiento y el comportamiento, depresión y pensamientos o acciones suicidas con los medicamentos utilizados para dejar de fumar. Aunque WELLBUTRIN no es un tratamiento para dejar de fumar, contiene el mismo ingrediente activo (clorhidrato de bupropión) que ZYBAN, que se usa para ayudar a los pacientes a dejar de fumar.
Hable con su proveedor de atención médica o con el proveedor de atención médica de su familiar sobre:
- todos los riesgos y beneficios de los medicamentos para dejar de fumar.
- todas las opciones de tratamiento para dejar de fumar.
Cuando intenta dejar de fumar, con o sin bupropión, puede tener síntomas que pueden deberse a la abstinencia de la nicotina, que incluyen:
- ganas de fumar
- frustración
- inquietud
- estado de ánimo deprimido
- enfado
- disminución del ritmo cardíaco
- problemas para dormir
- sentirse ansioso
- Apetito incrementado
- irritabilidad
- dificultad para concentrarse
- aumento de peso
Algunas personas incluso han experimentado pensamientos suicidas al tratar de dejar de fumar sin medicamentos.
A veces, dejar de fumar puede empeorar los problemas de salud mental que ya tiene, como la depresión.
Algunas personas han tenido efectos secundarios graves mientras tomaban bupropión para dejar de fumar, entre ellos: Problemas de salud mental nuevos o peores, como cambios en el comportamiento o el pensamiento, agresión, hostilidad, agitación, depresión o pensamientos o acciones suicidas. Algunas personas tenían estos síntomas cuando comenzaron a tomar bupropión y otras los desarrollaron después de varias semanas de tratamiento o después de suspender el bupropión. Estos síntomas ocurrieron con mayor frecuencia en personas que tenían antecedentes de problemas de salud mental antes de tomar bupropión que en personas sin antecedentes de problemas de salud mental.
Deje de tomar WELLBUTRIN y llame a su proveedor de atención médica de inmediato si usted, su familia o el cuidador notan alguno de estos síntomas. Trabaje con su proveedor de atención médica para decidir si debe continuar tomando WELLBUTRIN. En muchas personas, estos síntomas desaparecieron después de dejar de tomar WELLBUTRIN 300 mg, pero en algunas personas los síntomas continuaron después de dejar de tomar WELLBUTRIN. Es importante que haga un seguimiento con su proveedor de atención médica hasta que desaparezcan los síntomas. Antes de tomar WELLBUTRIN 150 mg, informe a su proveedor de atención médica si alguna vez ha tenido depresión u otros problemas de salud mental. También debe informar a su proveedor de atención médica sobre cualquier síntoma que haya tenido durante otras ocasiones en las que intentó dejar de fumar, con o sin bupropión.
¿Qué otra información importante debo saber sobre WELLBUTRIN?
- Convulsiones: existe la posibilidad de sufrir una convulsión (convulsiones, ataques) con WELLBUTRIN 150 mg, especialmente en personas:
- con ciertos problemas médicos.
- que toman ciertos medicamentos. La posibilidad de tener convulsiones aumenta con dosis más altas de WELLBUTRIN. Para obtener más información, consulte las secciones “¿Quién no debe tomar WELLBUTRIN?” y "¿Qué debo decirle a mi proveedor de atención médica antes de tomar WELLBUTRIN 300 mg?" Informe a su proveedor de atención médica sobre todas sus afecciones médicas y todos los medicamentos que toma. No tome ningún otro medicamento mientras esté tomando WELLBUTRIN 150 mg a menos que su proveedor de atención médica le haya dicho que puede tomarlos. Si tiene una convulsión mientras toma WELLBUTRIN, deje de tomar las tabletas y llame a su proveedor de atención médica de inmediato. No tome WELLBUTRIN 150 mg nuevamente si tiene una convulsión.
- Presión arterial alta (hipertensión). Algunas personas tienen presión arterial alta que puede ser grave mientras toman WELLBUTRIN. La posibilidad de presión arterial alta puede ser mayor si también usa una terapia de reemplazo de nicotina (como un parche de nicotina) para ayudarlo a dejar de fumar (consulte la sección de esta Guía del medicamento llamada "¿Cómo debo tomar WELLBUTRIN 150 mg?").
- Episodios maníacos. Algunas personas pueden tener períodos de manía mientras toman WELLBUTRIN 300 mg, que incluyen:
- Mucho aumento de energía
- Problemas severos para dormir
- Pensamientos acelerados
- Comportamiento temerario
- Ideas inusualmente grandiosas
- Excesiva felicidad o irritabilidad.
- Hablar más o más rápido de lo habitual Si tiene alguno de los síntomas de manía mencionados anteriormente, llame a su proveedor de atención médica.
- Pensamientos o comportamientos inusuales. Algunos pacientes tienen pensamientos o comportamientos inusuales mientras toman WELLBUTRIN, incluidos delirios (creer que es otra persona), alucinaciones (ver u oír cosas que no existen), paranoia (sentimientos de que las personas están en su contra) o sentirse confundidos. Si esto le sucede a usted, llame a su proveedor de atención médica.
- Problemas visuales.
- dolor de ojo
- cambios en la visión
- hinchazón o enrojecimiento en o alrededor del ojo Solo algunas personas corren el riesgo de tener estos problemas. Es posible que desee someterse a un examen de la vista para ver si está en riesgo y recibir tratamiento preventivo si lo está.
- Reacciones alérgicas graves. Algunas personas pueden tener reacciones alérgicas graves a WELLBUTRIN. Deje de tomar WELLBUTRIN 300 mg y llame a su proveedor de atención médica de inmediato. si tiene sarpullido, picor, urticaria, fiebre, glándulas linfáticas inflamadas, llagas dolorosas en la boca o alrededor de los ojos, hinchazón de los labios o la lengua, dolor en el pecho o dificultad para respirar. Estos podrían ser signos de una reacción alérgica grave.
¿Qué es WELLBUTRIN®?
WELLBUTRIN es un medicamento recetado que se usa para tratar a adultos con cierto tipo de depresión llamado trastorno depresivo mayor.
¿Quién no debe tomar WELLBUTRIN 150mg?
No tome WELLBUTRIN si usted
- tiene o ha tenido un trastorno convulsivo o epilepsia.
- tiene o ha tenido un trastorno alimentario como anorexia nerviosa o bulimia.
- está tomando cualquier otro medicamento que contenga bupropión, incluidos ZYBAN (usado para ayudar a las personas a dejar de fumar), WELLBUTRIN 300 mg SR, WELLBUTRIN 150 mg XL, APLENZIN o FORFIVO XL. El bupropión es el mismo ingrediente activo que se encuentra en WELLBUTRIN.
- bebe mucho alcohol y deja de beber abruptamente, o usa medicamentos llamados sedantes (que le dan sueño), benzodiazepinas o medicamentos anticonvulsivos, y deja de usarlos repentinamente.
- tomar un inhibidor de la monoaminooxidasa (IMAO). Pregúntele a su proveedor de atención médica o farmacéutico si no está seguro si está tomando un IMAO, incluido el antibiótico linezolid.
- no tome un IMAO dentro de las 2 semanas posteriores a la suspensión de WELLBUTRIN a menos que se lo indique su proveedor de atención médica.
- no comience a tomar WELLBUTRIN 150 mg si dejó de tomar un IMAO en las últimas 2 semanas, a menos que su proveedor de atención médica se lo indique.
- es alérgico al ingrediente activo de WELLBUTRIN 300 mg, bupropión, o a cualquiera de los ingredientes inactivos. Consulte el final de esta Guía del medicamento para obtener una lista completa de los ingredientes de WELLBUTRIN.
¿Qué debo decirle a mi proveedor de atención médica antes de tomar WELLBUTRIN?
Informe a su proveedor de atención médica si alguna vez ha tenido depresión, pensamientos o acciones suicidas u otros problemas de salud mental. Consulte “Medicamentos antidepresivos, depresión y otras enfermedades mentales graves y pensamientos o acciones suicidas”.
- Informe a su proveedor de atención médica sobre sus otras afecciones médicas, incluso si usted:
- Tiene problemas hepáticos, especialmente cirrosis hepática.
- tiene problemas renales.
- tiene o ha tenido un trastorno alimentario, como anorexia nerviosa o bulimia.
- haber tenido una lesión en la cabeza.
- ha tenido una convulsión (convulsión, ataque).
- tiene un tumor en su sistema nervioso (cerebro o columna vertebral).
- ha tenido un ataque al corazón, problemas cardíacos o presión arterial alta.
- es diabético y está tomando insulina u otros medicamentos para controlar su nivel de azúcar en la sangre.
- beber alcohol.
- abusar de medicamentos recetados o drogas callejeras.
- está embarazada o planea quedar embarazada. Hable con su proveedor de atención médica sobre el riesgo para su bebé por nacer si toma WELLBUTRIN 300 mg durante el embarazo.
- Informe a su proveedor de atención médica si queda embarazada o cree que está embarazada durante el tratamiento con WELLBUTRIN.
- Si queda embarazada durante el tratamiento con WELLBUTRIN, hable con su proveedor de atención médica acerca de registrarse en el Registro Nacional de Embarazo para Antidepresivos. Puede registrarse llamando al 1-844-405-6185.
- está amamantando o planea amamantar durante el tratamiento con WELLBUTRIN. WELLBUTRIN pasa a su leche. Hable con su proveedor de atención médica sobre la mejor manera de alimentar a su bebé durante el tratamiento con WELLBUTRIN.
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos recetados y de venta libre, las vitaminas y los suplementos a base de hierbas. Muchos medicamentos aumentan sus posibilidades de sufrir convulsiones u otros efectos secundarios graves si los toma mientras toma WELLBUTRIN.
¿Cómo debo tomar WELLBUTRIN 300mg?
- Tome WELLBUTRIN 300 mg exactamente como se lo recetó su proveedor de atención médica. No cambie su dosis ni deje de tomar WELLBUTRIN sin hablar primero con su proveedor de atención médica.
- Trague las tabletas de WELLBUTRIN enteras. No mastique, corte ni triture las tabletas de WELLBUTRIN de 300 mg.
- Tome WELLBUTRIN 300 mg a la misma hora todos los días.
- Tome sus dosis de WELLBUTRIN 300 mg con al menos 6 horas de diferencia.
- Puede tomar WELLBUTRIN con o sin alimentos.
- Si olvida una dosis, no tome una dosis adicional para compensar la dosis olvidada. Espere y tome su siguiente dosis a la hora habitual. Esto es muy importante. Demasiado WELLBUTRIN puede aumentar su probabilidad de sufrir una convulsión.
- Si toma demasiado WELLBUTRIN o una sobredosis, llame de inmediato a la sala de emergencias local o al centro de control de envenenamiento.
- No tome ningún otro medicamento mientras toma WELLBUTRIN 300 mg a menos que su proveedor de atención médica le haya dicho que está bien.
- Si está tomando WELLBUTRIN 150 mg para el tratamiento del trastorno depresivo mayor, es posible que le tome varias semanas sentir que WELLBUTRIN 150 mg está funcionando. Una vez que se sienta mejor, es importante seguir tomando WELLBUTRIN exactamente como lo indique su proveedor de atención médica. Llame a su proveedor de atención médica si cree que WELLBUTRIN no está funcionando para usted.
¿Qué debo evitar mientras tomo WELLBUTRIN 300mg?
- Limite o evite el consumo de alcohol durante el tratamiento con WELLBUTRIN. Si suele beber mucho alcohol, hable con su proveedor de atención médica antes de dejar de hacerlo repentinamente. Si deja de beber alcohol repentinamente, puede aumentar su riesgo de tener convulsiones.
- No conduzca un automóvil ni use maquinaria pesada hasta que sepa cómo le afecta WELLBUTRIN 150 mg. WELLBUTRIN puede afectar su capacidad para hacer estas cosas de manera segura.
¿Cuáles son los posibles efectos secundarios de WELLBUTRIN 300 mg?
WELLBUTRIN puede causar efectos secundarios graves. Consulte las secciones al comienzo de esta Guía del medicamento para obtener información sobre los efectos secundarios graves de WELLBUTRIN.
Los efectos secundarios más comunes de WELLBUTRIN incluyen:
- nerviosismo
- sudoración intensa
- boca seca
- temblor (temblor)
- estreñimiento
- problemas para dormir
- dolor de cabeza
- visión borrosa
- náuseas o vómitos
- latidos cardíacos acelerados
- mareo
Si tiene náuseas, tome su medicamento con alimentos. Si tiene problemas para dormir, no tome su medicamento demasiado cerca de la hora de acostarse.
Informe a su proveedor de atención médica de inmediato sobre cualquier efecto secundario que le moleste.
Estos no son todos los posibles efectos secundarios de WELLBUTRIN. Para obtener más información, consulte a su proveedor de atención médica o farmacéutico.
Llame a su proveedor de atención médica para recibir asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
También puede informar los efectos secundarios a GlaxoSmithKline al 1-888-825-5249.
¿Cómo debo almacenar WELLBUTRIN 300mg?
- Guarde WELLBUTRIN a temperatura ambiente, entre 20 °C y 25 °C (68 °F y 77 °F).
- Mantenga las tabletas de WELLBUTRIN secas y fuera de la luz.
Mantenga WELLBUTRIN y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de WELLBUTRIN.
A veces, los medicamentos se recetan para fines distintos a los enumerados en la Guía del medicamento. No use WELLBUTRIN 300mg para una condición para la cual no fue recetado. No le dé WELLBUTRIN a otras personas, incluso si tienen los mismos síntomas que usted. Puede que les haga daño.
Si realiza una prueba de detección de drogas en orina, WELLBUTRIN puede hacer que el resultado de la prueba sea positivo para anfetaminas. Si le dice a la persona que le está haciendo la prueba de detección de drogas que está tomando WELLBUTRIN 300 mg, puede hacer una prueba de detección de drogas más específica que no debería tener este problema.
Esta Guía del medicamento resume información importante sobre WELLBUTRIN. Si desea obtener más información, hable con su proveedor de atención médica. Puede pedirle a su proveedor de atención médica o farmacéutico información sobre WELLBUTRIN escrita para profesionales de la salud.
Para obtener más información sobre WELLBUTRIN, llame al 1-888-825-5249.
¿Cuáles son los ingredientes de WELLBUTRIN 300mg?
Principio activo: clorhidrato de bupropión.
Ingredientes inactivos: tableta de 75 mg: D&C Yellow No. 10 Lake, FD&C Yellow No. 6 Lake, hidroxipropilcelulosa, hipromelosa, celulosa microcristalina, polietilenglicol, talco y dióxido de titanio; Tableta de 100 mg: FD&C Red No. 40 Lake, FD&C Yellow No. 6 Lake, hidroxipropilcelulosa, hipromelosa, celulosa microcristalina, polietilenglicol, talco y dióxido de titanio.
Esta Guía del medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de EE. UU.
