Zyprexa 2.5mg, 5mg, 7.5mg, 10mg, 15mg, 20mg Olanzapine Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Zyprexa 10 mg y cómo se usa?
Zyprexa es un medicamento recetado que se usa para tratar los síntomas de la esquizofrenia y el trastorno bipolar (maníaco depresivo). Zyprexa se puede usar solo o con otros medicamentos.
- Zyprexa pertenece a una clase de medicamentos llamados antipsicóticos, agentes antimaníacos de segunda generación.
- No se sabe si Zyprexa es seguro y efectivo en niños menores de 13 años.
¿Cuáles son los posibles efectos secundarios de Zyprexa 15 mg?
Zyprexa puede causar efectos secundarios graves que incluyen:
- movimientos musculares incontrolados en la cara (masticar, relamerse los labios, fruncir el ceño, mover la lengua, parpadear o mover los ojos),
- dificultad para hablar o tragar,
- hinchazón en las manos o los pies,
- confusión,
- pensamientos o comportamientos inusuales,
- alucinaciones,
- pensamientos sobre hacerte daño a ti mismo,
- debilidad repentina o sensación de malestar,
- fiebre,
- escalofríos,
- dolor de garganta,
- encías hinchadas,
- llagas dolorosas en la boca,
- dolor al tragar,
- llagas en la piel,
- síntomas de resfriado o gripe,
- tos,
- sentir mucha sed o calor,
- incapacidad para orinar,
- sudoración intensa,
- piel caliente o seca,
- dolor de estómago superior,
- Comezón,
- pérdida de apetito,
- orina oscura,
- heces de color arcilla,
- coloración amarillenta de la piel o los ojos (ictericia),
- aumento de la sed,
- aumento de la micción,
- hambre,
- boca seca,
- aliento con olor afrutado,
- somnolencia,
- visión borrosa,
- pérdida de peso,
- músculos muy rígidos,
- fiebre alta,
- confusión,
- latidos cardíacos rápidos o irregulares,
- temblores, y
- aturdimiento
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Zyprexa incluyen:
- aumento de peso (más común en adolescentes),
- Apetito incrementado,
- dolores de cabeza,
- mareo,
- somnolencia,
- sentirse cansado o inquieto,
- problemas con el habla o la memoria,
- temblores o temblores,
- entumecimiento o sensación de hormigueo,
- cambios de personalidad,
- boca seca,
- aumento de la salivación,
- dolor de estómago,
- estreñimiento, y
- dolor en los brazos o las piernas
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Zyprexa. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
ADVERTENCIA
AUMENTO DE LA MORTALIDAD EN PACIENTES ANCIANOS CON PSICOSIS RELACIONADA CON DEMENCIA
Los pacientes de edad avanzada con psicosis relacionada con la demencia tratados con medicamentos antipsicóticos tienen un mayor riesgo de muerte. Los análisis de diecisiete ensayos controlados con placebo (duración modal de 10 semanas), principalmente en pacientes que tomaban fármacos antipsicóticos atípicos, revelaron un riesgo de muerte en pacientes tratados con fármacos de entre 1,6 y 1,7 veces el riesgo de muerte en pacientes tratados con placebo. En el transcurso de un ensayo controlado típico de 10 semanas, la tasa de muerte en los pacientes tratados con medicamentos fue de alrededor del 4,5 %, en comparación con una tasa de alrededor del 2,6 % en el grupo de placebo. Aunque las causas de muerte fueron variadas, la mayoría de las muertes parecían ser de naturaleza cardiovascular (p. ej., insuficiencia cardíaca, muerte súbita) o infecciosa (p. ej., neumonía). Los estudios observacionales sugieren que, al igual que los fármacos antipsicóticos atípicos, el tratamiento con fármacos antipsicóticos convencionales puede aumentar la mortalidad. No está claro hasta qué punto los hallazgos de aumento de la mortalidad en los estudios observacionales pueden atribuirse al fármaco antipsicótico en contraposición a algunas características de los pacientes. ZYPREXA (olanzapina) no está aprobado para el tratamiento de pacientes con psicosis relacionada con la demencia [ver ADVERTENCIAS Y PRECAUCIONES y INFORMACIÓN DEL PACIENTE ].
Cuando use ZYPREXA 15 mg y fluoxetina en combinación, consulte también la sección de advertencia del recuadro del prospecto de Symbyax.
DESCRIPCIÓN
ZYPREXA (olanzapina) es un antipsicótico atípico que pertenece a la clase de las tienobenzodiazepinas. La designación química es 2-metil-4-(4-metil-1-piperazinil)-10H-tieno[2,3-b][1,5]benzodiazepina. La fórmula molecular es C17H20N4S, que corresponde a un peso molecular de 312,44. La estructura química es:
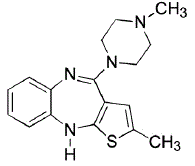
La olanzapina es un sólido cristalino amarillo, prácticamente insoluble en agua.
Los comprimidos de ZYPREXA de 7,5 mg están destinados únicamente a la administración oral.
Cada comprimido contiene olanzapina equivalente a 2,5 mg (8 μmol), 5 mg (16 μmol), 7,5 mg (24 μmol), 10 mg (32 μmol), 15 mg (48 μmol) o 20 mg (64 μmol). Los ingredientes inactivos son cera de carnauba, crospovidona, hidroxipropilcelulosa, hipromelosa, lactosa, estearato de magnesio, celulosa microcristalina y otros ingredientes inactivos. El revestimiento de color contiene dióxido de titanio (todas las concentraciones), laca de aluminio n.° 2 azul FD&C (15 mg) u óxido de hierro rojo sintético (20 mg). Las tabletas de 2.5, 5, 7.5 y 10 mg están impresas con tinta comestible que contiene FD&C Blue No. 2 Aluminium Lake.
ZYPREXA 2,5 mg de ZYDIS (comprimidos de disolución oral de olanzapina) está destinado únicamente a la administración oral.
Cada comprimido de desintegración oral contiene olanzapina equivalente a 5 mg (16 μmol), 10 mg (32 μmol), 15 mg (48 μmol) o 20 mg (64 μmol). Comienza a desintegrarse en la boca en cuestión de segundos, lo que permite que su contenido se trague posteriormente con o sin líquido. ZYPREXA 15 mg ZYDIS (tabletas de desintegración oral de olanzapina) también contiene los siguientes ingredientes inactivos: gelatina, manitol, aspartamo, metilparabeno de sodio y propilparabeno de sodio.
ZYPREXA 2.5mg IntraMuscular (olanzapina para inyección) está destinado únicamente para uso intramuscular.
Cada vial prevé la administración de 10 mg (32 μmol) de olanzapina con los ingredientes inactivos 50 mg de lactosa monohidrato y 3,5 mg de ácido tartárico. Es posible que se haya agregado ácido clorhídrico y/o hidróxido de sodio durante la fabricación para ajustar el pH.
INDICACIONES
Esquizofrenia
ZYPREXA oral está indicado para el tratamiento de la esquizofrenia. La eficacia se estableció en tres ensayos clínicos en pacientes adultos con esquizofrenia: dos ensayos de 6 semanas y un ensayo de mantenimiento. En pacientes adolescentes con esquizofrenia (de 13 a 17 años), la eficacia se estableció en un ensayo de 6 semanas [ver Estudios clínicos ].
Al decidir entre los tratamientos alternativos disponibles para adolescentes, los médicos deben considerar el mayor potencial (en adolescentes en comparación con adultos) de aumento de peso y dislipidemia. Los médicos deben considerar los riesgos potenciales a largo plazo al prescribir a los adolescentes y, en muchos casos, esto puede llevarlos a considerar la prescripción de otros medicamentos primero en los adolescentes [ver ADVERTENCIAS Y PRECAUCIONES ].
Trastorno bipolar I (episodios maníacos o mixtos)
Monoterapia
ZYPREXA oral está indicado para el tratamiento agudo de episodios maníacos o mixtos asociados con el trastorno bipolar I y el tratamiento de mantenimiento del trastorno bipolar I. La eficacia se estableció en tres ensayos clínicos en pacientes adultos con episodios maníacos o mixtos del trastorno bipolar I: dos ensayos de 3 a 4 semanas y un ensayo de mantenimiento con monoterapia. En pacientes adolescentes con episodios maníacos o mixtos asociados con el trastorno bipolar I (de 13 a 17 años), la eficacia se estableció en un ensayo de 3 semanas [ver Estudios clínicos ].
Al decidir entre los tratamientos alternativos disponibles para adolescentes, los médicos deben considerar el mayor potencial (en adolescentes en comparación con adultos) de aumento de peso y dislipidemia. Los médicos deben considerar los riesgos potenciales a largo plazo al prescribir a los adolescentes y, en muchos casos, esto puede llevarlos a considerar la prescripción de otros medicamentos primero en los adolescentes [ver ADVERTENCIAS Y PRECAUCIONES ].
Terapia adyuvante al litio o al valproato
ZYPREXA oral de 5 mg está indicado para el tratamiento de episodios maníacos o mixtos asociados con el trastorno bipolar I como complemento del litio o el valproato. La eficacia se estableció en dos ensayos clínicos de 6 semanas en adultos. La efectividad de la terapia adyuvante para el uso a largo plazo no ha sido evaluada sistemáticamente en ensayos controlados [ver Estudios clínicos ].
Consideraciones especiales en el tratamiento de la esquizofrenia pediátrica y el trastorno bipolar I
La esquizofrenia pediátrica y el trastorno bipolar I son trastornos mentales graves; sin embargo, el diagnóstico puede ser un desafío. Para la esquizofrenia pediátrica, los perfiles de síntomas pueden ser variables, y para el trastorno bipolar I, los pacientes pediátricos pueden tener patrones variables de periodicidad de síntomas maníacos o mixtos. Se recomienda que la terapia con medicamentos para la esquizofrenia pediátrica y el trastorno bipolar I se inicie solo después de que se haya realizado una evaluación diagnóstica exhaustiva y se hayan considerado detenidamente los riesgos asociados con el tratamiento con medicamentos. El tratamiento con medicamentos tanto para la esquizofrenia pediátrica como para el trastorno bipolar I debe ser parte de un programa de tratamiento total que a menudo incluye intervenciones psicológicas, educativas y sociales.
ZYPREXA 15 mg intramuscular: agitación asociada con esquizofrenia y manía bipolar I
ZYPREXA 15 mg intramuscular está indicado para el tratamiento de la agitación aguda asociada con la esquizofrenia y la manía bipolar I.
La eficacia se demostró en 3 ensayos controlados con placebo a corto plazo (24 horas de tratamiento IM) en pacientes adultos hospitalizados agitados con: esquizofrenia o trastorno bipolar I (episodios maníacos o mixtos) [ver Estudios clínicos ].
La “agitación psicomotora” se define en el DSM-IV como “actividad motora excesiva asociada con una sensación de tensión interna”. Los pacientes que experimentan agitación a menudo manifiestan conductas que interfieren con su diagnóstico y atención, por ejemplo, conductas amenazantes, conductas angustiantes cada vez mayores o urgentes, o conductas de autoagotamiento, lo que lleva a los médicos al uso de medicamentos antipsicóticos intramusculares para lograr el control inmediato de la agitación.
ZYPREXA y fluoxetina en combinación: episodios depresivos asociados con el trastorno bipolar I
La combinación de ZYPREXA oral y fluoxetina está indicada para el tratamiento de episodios depresivos asociados con el trastorno bipolar I, según estudios clínicos. Cuando use ZYPREXA 10 mg y fluoxetina en combinación, consulte la sección Estudios clínicos del prospecto de Symbyax.
La monoterapia con ZYPREXA no está indicada para el tratamiento de episodios depresivos asociados con el trastorno bipolar I.
ZYPREXA y fluoxetina en combinación: depresión resistente al tratamiento
La combinación de ZYPREXA oral y fluoxetina está indicada para el tratamiento de la depresión resistente al tratamiento (trastorno depresivo mayor en pacientes que no responden a 2 ensayos separados de diferentes antidepresivos de dosis y duración adecuadas en el episodio actual), según estudios clínicos en pacientes adultos. . Cuando use ZYPREXA y fluoxetina en combinación, consulte la sección Estudios clínicos del prospecto de Symbyax.
La monoterapia de 5 mg de ZYPREXA no está indicada para el tratamiento de la depresión resistente al tratamiento.
DOSIFICACIÓN Y ADMINISTRACIÓN
Esquizofrenia
Adultos
Selección de dosis
La olanzapina oral debe administrarse en un horario de una vez al día, independientemente de las comidas, generalmente comenzando con 5 a 10 mg inicialmente, con una dosis objetivo de 10 mg/día dentro de varios días. Los ajustes de dosis adicionales, si están indicados, generalmente deben realizarse a intervalos de no menos de 1 semana, ya que el estado estacionario de la olanzapina no se alcanzaría hasta aproximadamente 1 semana en el paciente típico. Cuando son necesarios ajustes de dosis, se recomiendan incrementos/disminuciones de dosis de 5 mg una vez al día.
La eficacia en la esquizofrenia se demostró en un rango de dosis de 10 a 15 mg/día en ensayos clínicos. Sin embargo, no se demostró que las dosis superiores a 10 mg/día fueran más eficaces que la dosis de 10 mg/día. Se recomienda un aumento a una dosis mayor que la dosis objetivo de 10 mg/día (es decir, a una dosis de 15 mg/día o mayor) solo después de la evaluación clínica. La olanzapina no está indicada para uso en dosis superiores a 20 mg/día.
Dosificación en poblaciones especiales
La dosis inicial recomendada es de 5 mg en pacientes que están debilitados, que tienen una predisposición a las reacciones hipotensivas, que de otro modo muestran una combinación de factores que pueden resultar en un metabolismo más lento de la olanzapina (p. ej., pacientes mujeres no fumadoras ≥65 años de edad), o que pueden ser más sensibles farmacodinámicamente a la olanzapina [ver ADVERTENCIAS Y PRECAUCIONES , INTERACCIONES CON LA DROGAS , y FARMACOLOGÍA CLÍNICA ]. Cuando esté indicado, el aumento de la dosis debe realizarse con precaución en estos pacientes.
Tratamiento de mantenimiento
La eficacia de la olanzapina oral, de 10 mg/día a 20 mg/día, para mantener la respuesta al tratamiento en pacientes esquizofrénicos que habían permanecido estables con ZYPREXA durante aproximadamente 8 semanas y luego fueron seguidos por recaída se demostró en un ensayo controlado con placebo [ver Estudios clínicos ]. El proveedor de atención médica que elija usar ZYPREXA durante períodos prolongados debe reevaluar periódicamente la utilidad a largo plazo del medicamento para el paciente individual.
Adolescentes
Selección de dosis
La olanzapina oral debe administrarse una vez al día, independientemente de las comidas, con una dosis inicial recomendada de 2,5 o 5 mg, con una dosis objetivo de 10 mg/día. La eficacia en adolescentes con esquizofrenia se demostró en base a un rango de dosis flexible de 2,5 a 20 mg/día en ensayos clínicos, con una dosis modal media de 12,5 mg/día (dosis media de 11,1 mg/día). Cuando sea necesario ajustar la dosis, se recomiendan incrementos/disminuciones de la dosis de 2,5 o 5 mg.
La seguridad y eficacia de dosis superiores a 20 mg/día no se han evaluado en ensayos clínicos [ver Estudios clínicos ].
Tratamiento de mantenimiento
No se ha evaluado sistemáticamente la eficacia de ZYPREXA para el tratamiento de mantenimiento de la esquizofrenia en la población adolescente; sin embargo, la eficacia de mantenimiento se puede extrapolar a partir de datos de adultos junto con comparaciones de parámetros farmacocinéticos de olanzapina en pacientes adultos y adolescentes. Por lo tanto, generalmente se recomienda que los pacientes que responden continúen más allá de la respuesta aguda, pero con la dosis más baja necesaria para mantener la remisión. Los pacientes deben ser reevaluados periódicamente para determinar la necesidad de un tratamiento de mantenimiento.
Trastorno bipolar I (episodios maníacos o mixtos)
Adultos
Selección de dosis para monoterapia
La olanzapina oral debe administrarse en un horario de una vez al día, independientemente de las comidas, generalmente comenzando con 10 o 15 mg. Los ajustes de dosis, si están indicados, deben ocurrir generalmente a intervalos de no menos de 24 horas, reflejando los procedimientos en los ensayos controlados con placebo. Cuando son necesarios ajustes de dosis, se recomiendan incrementos/disminuciones de dosis de 5 mg una vez al día.
La eficacia antimaníaca a corto plazo (3-4 semanas) se demostró en un rango de dosis de 5 mg a 20 mg/día en ensayos clínicos. La seguridad de dosis superiores a 20 mg/día no ha sido evaluada en ensayos clínicos [ver Estudios clínicos ].
Monoterapia de mantenimiento
El beneficio de mantener a los pacientes con trastorno bipolar I en monoterapia con ZYPREXA oral de 10 mg a una dosis de 5 a 20 mg/día, después de lograr un estado de respuesta durante una duración promedio de 2 semanas, se demostró en un ensayo controlado [ver Estudios clínicos ]. El proveedor de atención médica que elija usar ZYPREXA durante períodos prolongados debe reevaluar periódicamente la utilidad a largo plazo del medicamento para el paciente individual.
Selección de dosis para tratamiento adyuvante
Cuando se administra como tratamiento complementario al litio o al valproato, la dosificación oral de olanzapina generalmente debe comenzar con 10 mg una vez al día, independientemente de las comidas.
La eficacia antimaníaca se demostró en un rango de dosis de 5 mg a 20 mg/día en ensayos clínicos [ver Estudios clínicos ]. La seguridad de dosis superiores a 20 mg/día no ha sido evaluada en ensayos clínicos.
Adolescentes
Selección de dosis
La olanzapina oral debe administrarse una vez al día, independientemente de las comidas, con una dosis inicial recomendada de 2,5 o 5 mg, con una dosis objetivo de 10 mg/día. La eficacia en adolescentes con trastorno bipolar I (episodios maníacos o mixtos) se demostró en base a un rango de dosis flexible de 2,5 a 20 mg/día en ensayos clínicos, con una dosis modal media de 10,7 mg/día (dosis media de 8,9 mg/día ). Cuando sea necesario ajustar la dosis, se recomiendan incrementos/disminuciones de la dosis de 2,5 o 5 mg.
La seguridad y eficacia de dosis superiores a 20 mg/día no se han evaluado en ensayos clínicos [ver Estudios clínicos ].
Tratamiento de mantenimiento
No se ha evaluado la eficacia de ZYPREXA 7,5 mg para el tratamiento de mantenimiento del trastorno bipolar I en la población adolescente; sin embargo, la eficacia de mantenimiento se puede extrapolar a partir de datos de adultos junto con comparaciones de parámetros farmacocinéticos de olanzapina en pacientes adultos y adolescentes. Por lo tanto, generalmente se recomienda que los pacientes que responden continúen más allá de la respuesta aguda, pero con la dosis más baja necesaria para mantener la remisión. Los pacientes deben ser reevaluados periódicamente para determinar la necesidad de un tratamiento de mantenimiento.
Administración de ZYPREXA ZYDIS (olanzapina en comprimidos de desintegración oral)
Después de abrir el sobre, retire el papel de aluminio del blister. No empuje la tableta a través del papel de aluminio. Inmediatamente después de abrir el blíster, con las manos secas, retire la tableta y colóquese todo ZYPREXA 15 mg ZYDIS en la boca. La desintegración de la tableta ocurre rápidamente en la saliva, por lo que puede tragarse fácilmente con o sin líquido.
ZYPREXA intramuscular: agitación asociada con la esquizofrenia y la manía bipolar I
Selección de dosis para pacientes adultos agitados con esquizofrenia y manía bipolar I
La eficacia de la olanzapina inyectable intramuscular para controlar la agitación en estos trastornos se demostró en un rango de dosis de 2,5 mg a 10 mg. La dosis recomendada en estos pacientes es de 10 mg. Se puede considerar una dosis más baja de 5 o 7,5 mg cuando los factores clínicos lo justifiquen [ver Estudios clínicos ]. Si persiste la agitación que justifica dosis intramusculares adicionales después de la dosis inicial, se pueden administrar dosis posteriores de hasta 10 mg. Sin embargo, la eficacia de dosis repetidas de olanzapina intramuscular para inyección en pacientes agitados no se ha evaluado sistemáticamente en ensayos clínicos controlados. Además, no se ha evaluado en ensayos clínicos la seguridad de dosis diarias totales superiores a 30 mg o inyecciones de 10 mg administradas con más frecuencia de 2 horas después de la dosis inicial y 4 horas después de la segunda dosis. La dosis máxima de olanzapina intramuscular (p. ej., 3 dosis de 10 mg administradas con 2 a 4 horas de diferencia) puede estar asociada con una ocurrencia sustancial de hipotensión ortostática significativa [ver ADVERTENCIAS Y PRECAUCIONES ]. Por lo tanto, se recomienda que los pacientes que requieran inyecciones intramusculares subsiguientes sean evaluados por hipotensión ortostática antes de la administración de cualquier dosis subsiguiente de olanzapina inyectable intramuscular. No se recomienda la administración de una dosis adicional a un paciente con un cambio postural clínicamente significativo en la presión arterial sistólica.
Si la terapia continua con olanzapina está clínicamente indicada, la olanzapina oral puede iniciarse en un rango de 5-20 mg/día tan pronto como sea clínicamente apropiado [ver Esquizofrenia y Trastorno bipolar I (episodios maníacos o mixtos) ].
Dosificación intramuscular en poblaciones especiales
Se debe considerar una dosis de 5 mg/inyección para pacientes geriátricos o cuando otros factores clínicos lo justifiquen. Se debe considerar una dosis más baja de 2,5 mg/inyección para los pacientes que, de lo contrario, podrían estar debilitados, predispuestos a reacciones hipotensivas o más sensibles farmacodinámicamente a la olanzapina [ver ADVERTENCIAS Y PRECAUCIONES , INTERACCIONES CON LA DROGAS , y FARMACOLOGÍA CLÍNICA ].
Administración de ZYPREXA intramuscular
ZYPREXA Intra Muscular está destinado únicamente para uso intramuscular. No administrar por vía intravenosa o subcutánea. Inyecte lentamente, profundamente en la masa muscular. Los productos farmacéuticos parenterales deben inspeccionarse visualmente en busca de partículas y decoloración antes de la administración, siempre que la solución y el envase lo permitan.
Instrucciones para la preparación de ZYPREXA 2,5 mg intramuscular con agua estéril para inyección
Disuelva el contenido del vial con 2,1 ml de agua estéril para inyección para obtener una solución que contenga aproximadamente 5 mg/ml de olanzapina. La solución resultante debe aparecer clara y amarilla. ZYPREXA 7.5 mg intramuscular reconstituido con agua esterilizada para inyección debe usarse inmediatamente (dentro de 1 hora) después de la reconstitución. Deseche cualquier porción no utilizada.
La siguiente tabla proporciona los volúmenes de inyección para administrar varias dosis de olanzapina intramuscular para inyección reconstituida con agua estéril para inyección.
Información de incompatibilidad física
ZYPREXA 15 mg intramuscular debe reconstituirse solo con agua estéril para inyección. ZYPREXA 20 mg intramuscular no debe combinarse en una jeringa con la inyección de diazepam porque se produce precipitación cuando se mezclan estos productos. La inyección de lorazepam no debe usarse para reconstituir ZYPREXA IntraMuscular ya que esta combinación provoca un retraso en el tiempo de reconstitución. ZYPREXA IntraMuscular no debe combinarse en una jeringa con la inyección de haloperidol porque se ha demostrado que el bajo pH resultante degrada la olanzapina con el tiempo.
ZYPREXA 20 mg y fluoxetina en combinación: episodios depresivos asociados con el trastorno bipolar I
Cuando use ZYPREXA 7.5 mg y fluoxetina en combinación, consulte también la sección Estudios clínicos del prospecto de Symbyax.
Adultos
La olanzapina oral debe administrarse en combinación con fluoxetina una vez al día por la noche, independientemente de las comidas, generalmente comenzando con 5 mg de olanzapina oral y 20 mg de fluoxetina. Los ajustes de dosis, si están indicados, se pueden hacer de acuerdo con la eficacia y la tolerabilidad dentro de los rangos de dosis de olanzapina oral de 5 a 12,5 mg y fluoxetina de 20 a 50 mg. La eficacia antidepresiva se demostró con ZYPREXA 10 mg y fluoxetina en combinación en pacientes adultos con un rango de dosis de olanzapina de 6 a 12 mg y fluoxetina de 25 a 50 mg. La seguridad de la coadministración de dosis superiores a 18 mg de olanzapina con 75 mg de fluoxetina no ha sido evaluada en estudios clínicos.
Niños Y Adolescentes (10-17 años)
La olanzapina oral debe administrarse en combinación con fluoxetina una vez al día por la noche, independientemente de las comidas, comenzando generalmente con 2,5 mg de olanzapina oral y 20 mg de fluoxetina. Los ajustes de dosis, si están indicados, se pueden hacer de acuerdo con la eficacia y la tolerabilidad. No se ha evaluado la seguridad de la coadministración de dosis superiores a 12 mg de olanzapina con 50 mg de fluoxetina en estudios clínicos pediátricos.
La seguridad y la eficacia de ZYPREXA y fluoxetina en combinación se determinaron en ensayos clínicos que respaldan la aprobación de Symbyax (combinación de dosis fija de ZYPREXA y fluoxetina). Symbyax se dosifica entre 3 mg/25 mg (olanzapina/fluoxetina) al día y 12 mg/50 mg (olanzapina/fluoxetina) al día. La siguiente tabla muestra las dosis adecuadas de los componentes individuales de ZYPREXA 10 mg y fluoxetina frente a Symbyax. Los ajustes de dosis, si están indicados, deben hacerse con los componentes individuales de acuerdo con la eficacia y la tolerabilidad.
Si bien no existe evidencia para responder a la pregunta de cuánto tiempo debe permanecer un paciente tratado con ZYPREXA y fluoxetina en combinación, en general se acepta que el trastorno bipolar I, incluidos los episodios depresivos asociados con el trastorno bipolar I, es una enfermedad crónica. enfermedad que requiere tratamiento crónico. El proveedor de atención médica debe reevaluar periódicamente la necesidad de continuar con la farmacoterapia.
La monoterapia de 5 mg de ZYPREXA no está indicada para el tratamiento de episodios depresivos asociados con el trastorno bipolar I.
ZYPREXA 7,5 mg y fluoxetina en combinación: depresión resistente al tratamiento
Cuando use ZYPREXA y fluoxetina en combinación, consulte también la sección Estudios clínicos del prospecto de Symbyax.
La olanzapina oral debe administrarse en combinación con fluoxetina una vez al día por la noche, independientemente de las comidas, generalmente comenzando con 5 mg de olanzapina oral y 20 mg de fluoxetina. Los ajustes de dosis, si están indicados, se pueden hacer de acuerdo con la eficacia y la tolerabilidad dentro de los rangos de dosis de olanzapina oral de 5 a 20 mg y fluoxetina de 20 a 50 mg. La eficacia antidepresiva se demostró con la combinación de olanzapina y fluoxetina en pacientes adultos con un rango de dosis de olanzapina de 6 a 18 mg y fluoxetina de 25 a 50 mg.
La seguridad y la eficacia de la olanzapina en combinación con fluoxetina se determinaron en ensayos clínicos que respaldaron la aprobación de Symbyax (combinación de dosis fija de olanzapina y fluoxetina). Symbyax se dosifica entre 3 mg/25 mg (olanzapina/fluoxetina) al día y 12 mg/50 mg (olanzapina/fluoxetina) al día. La Tabla 1 anterior muestra las dosis adecuadas de los componentes individuales de ZYPREXA y fluoxetina frente a Symbyax. Los ajustes de dosis, si están indicados, deben hacerse con los componentes individuales de acuerdo con la eficacia y la tolerabilidad.
Si bien no existe un cuerpo de evidencia para responder a la pregunta de cuánto tiempo debe permanecer un paciente tratado con ZYPREXA y fluoxetina en combinación, generalmente se acepta que la depresión resistente al tratamiento (trastorno depresivo mayor en pacientes adultos que no responden a 2 ensayos de diferentes antidepresivos de dosis y duración adecuadas en el episodio actual) es una enfermedad crónica que requiere tratamiento crónico. El proveedor de atención médica debe reevaluar periódicamente la necesidad de continuar con la farmacoterapia.
La seguridad de la coadministración de dosis superiores a 18 mg de olanzapina con 75 mg de fluoxetina no ha sido evaluada en estudios clínicos.
La monoterapia de ZYPREXA 7,5 mg no está indicada para el tratamiento de la depresión resistente al tratamiento (trastorno depresivo mayor en pacientes que no responden a 2 antidepresivos de dosis y duración adecuadas en el episodio actual).
ZYPREXA 10 mg y fluoxetina en combinación: dosificación en poblaciones especiales
La dosis inicial de 2,5-5 mg de olanzapina oral con 20 mg de fluoxetina se debe utilizar en pacientes con predisposición a reacciones hipotensivas, pacientes con insuficiencia hepática o pacientes que presentan una combinación de factores que pueden ralentizar el metabolismo de la olanzapina o la fluoxetina en combinación. (sexo femenino, edad geriátrica, condición de no fumador), o aquellos pacientes que pueden ser farmacodinámicamente sensibles a la olanzapina. Puede ser necesario modificar la dosis en pacientes que presenten una combinación de factores que pueden ralentizar el metabolismo. Cuando esté indicado, el aumento de la dosis debe realizarse con precaución en estos pacientes. ZYPREXA y fluoxetina en combinación no se han estudiado sistemáticamente en pacientes mayores de 65 años o en pacientes menores de 10 años [ver ADVERTENCIAS Y PRECAUCIONES , INTERACCIONES CON LA DROGAS , y FARMACOLOGÍA CLÍNICA ].
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Las tabletas de ZYPREXA de 2.5 mg, 5 mg, 7.5 mg y 10 mg son blancas, redondas y están impresas en tinta azul con LILLY y el número de tableta. Las tabletas de 15 mg son elípticas, azules y están grabadas con LILLY y el número de tableta. Las tabletas de 20 mg son elípticas, rosadas y están grabadas con LILLY y el número de tableta. Las tabletas no se marcan. Las tabletas están disponibles de la siguiente manera:
ZYPREXA 10 mg ZYDIS (las tabletas de desintegración oral de olanzapina) son amarillas, redondas y están grabadas con la concentración de la tableta. Las tabletas no se marcan. Las tabletas están disponibles de la siguiente manera:
ZYPREXA 15 mg intramuscular está disponible en vial de 10 mg (1s).
Las tabletas de ZYPREXA de 2.5 mg, 5 mg, 7.5 mg y 10 mg son blancas, redondas y están impresas en tinta azul con LILLY y el número de tableta. Las tabletas de 15 mg son elípticas, azules y están grabadas con LILLY y el número de tableta. Las tabletas de 20 mg son elípticas, rosadas y están grabadas con LILLY y el número de tableta. Las tabletas están disponibles de la siguiente manera:
ZYPREXA 2,5 mg ZYDIS (las tabletas de desintegración oral de olanzapina) son amarillas, redondas y están grabadas con la concentración de la tableta. Las tabletas están disponibles de la siguiente manera:
ZYPREXA intramuscular está disponible en:
CDN 0002-7597-01 (No. VL7597) – vial de 10 mg (1 s)
Almacenamiento y manipulación
Guarde las tabletas de ZYPREXA, ZYPREXA ZYDIS y las ampollas intramusculares de ZYPREXA (antes de la reconstitución) a temperatura ambiente controlada, de 20° a 25°C (68° a 77°F) [consulte USP ]. ZYPREXA 20 mg intramuscular reconstituido se puede almacenar a temperatura ambiente controlada, de 20° a 25°C (68° a 77°F) [ver USP durante un máximo de 1 hora si es necesario. Deseche cualquier porción no utilizada de ZYPREXA IntraMuscular reconstituido. La USP define la temperatura ambiente controlada como una temperatura mantenida termostáticamente que abarca el entorno de trabajo habitual y habitual de 20° a 25°C (68° a 77°F); que dé como resultado una temperatura cinética media calculada en no más de 25 °C; y que permite excursiones entre 15° y 30°C (59° y 86°F) que se experimentan en farmacias, hospitales y almacenes.
Proteja los comprimidos de ZYPREXA y ZYPREXA ZYDIS de la luz y la humedad. Proteger ZYPREXA IntraMuscular de la luz, no congelar.
Comercializado por: Lilly USA, LLC, Indianápolis, IN 46285, EE. UU. Revisado: octubre de 2019
EFECTOS SECUNDARIOS
Cuando use ZYPREXA 2.5 mg y fluoxetina en combinación, consulte también la sección Reacciones adversas del prospecto de Symbyax.
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen ni predigan las tasas observadas en la práctica.
Ensayos clínicos en adultos
La siguiente información para la olanzapina se deriva de una base de datos de ensayos clínicos para la olanzapina que consta de 10 504 pacientes adultos con aproximadamente 4765 años-paciente de exposición a la olanzapina más 722 pacientes con exposición a la olanzapina inyectable intramuscular. Esta base de datos incluye: (1) 2500 pacientes que participaron en ensayos previos a la comercialización de olanzapina oral de dosis múltiples en esquizofrenia y enfermedad de Alzheimer, lo que representa aproximadamente 1122 años-paciente de exposición al 14 de febrero de 1995; (2) 182 pacientes que participaron en ensayos previos a la comercialización del trastorno bipolar I (episodios maníacos o mixtos) de olanzapina oral que representan aproximadamente 66 años-paciente de exposición; (3) 191 pacientes que participaron en un ensayo de olanzapina oral de pacientes que presentaban diversos síntomas psiquiátricos asociados con la enfermedad de Alzheimer, lo que representa aproximadamente 29 años-paciente de exposición; (4) 5788 pacientes adicionales de 88 ensayos clínicos de olanzapina oral hasta el 31 de diciembre de 2001; (5) 1843 pacientes adicionales de 41 ensayos clínicos de olanzapina al 31 de octubre de 2011; y (6) 722 pacientes que participaron en ensayos previos a la comercialización de olanzapina intramuscular para inyección en pacientes agitados con esquizofrenia, trastorno bipolar I (episodios maníacos o mixtos) o demencia. A continuación también se incluye información de la base de datos de estudios clínicos previos a la comercialización de 6 semanas de olanzapina en combinación con litio o valproato, que consta de 224 pacientes que participaron en ensayos de trastorno bipolar I (episodios maníacos o mixtos) con aproximadamente 22 años-paciente de exposición.
Las condiciones y la duración del tratamiento con olanzapina variaron mucho e incluyeron (en categorías superpuestas) fases de estudios abiertos y doble ciego, pacientes hospitalizados y ambulatorios, estudios de dosis fija y de titulación de dosis, y exposición a corto o largo plazo. . Las reacciones adversas se evaluaron mediante la recopilación de reacciones adversas, resultados de exámenes físicos, signos vitales, pesos, analitos de laboratorio, ECG, radiografías de tórax y resultados de exámenes oftalmológicos.
Ciertas partes de la discusión a continuación relacionadas con parámetros de seguridad objetivos o numéricos, a saber, reacciones adversas dependientes de la dosis, cambios en los signos vitales, aumento de peso, cambios de laboratorio y cambios en el ECG se derivan de estudios en pacientes con esquizofrenia y no se han duplicado para el trastorno bipolar I. (episodios maníacos o mixtos) o agitación. Sin embargo, esta información también es generalmente aplicable al trastorno bipolar I (episodios maníacos o mixtos) y agitación.
Las reacciones adversas durante la exposición se obtuvieron mediante informe espontáneo y los investigadores clínicos las registraron utilizando la terminología de su propia elección. En consecuencia, no es posible proporcionar una estimación significativa de la proporción de personas que experimentan reacciones adversas sin agrupar primero tipos de reacciones similares en un número menor de categorías de reacciones estandarizadas. En las tablas y tabulaciones que siguen, se ha utilizado la terminología del diccionario MedDRA y COSTART para clasificar las reacciones adversas notificadas.
Las frecuencias indicadas de reacciones adversas representan la proporción de personas que experimentaron, al menos una vez, una reacción adversa emergente del tratamiento del tipo enumerado. Una reacción se consideró emergente del tratamiento si ocurría por primera vez o empeoraba mientras recibía la terapia después de la evaluación inicial. Las reacciones notificadas no incluyen aquellos términos de reacción que eran tan generales como para no ser informativos. Es posible que las reacciones enumeradas en otras partes del etiquetado no se repitan a continuación. Es importante recalcar que, aunque las reacciones ocurrieron durante el tratamiento con olanzapina, no necesariamente fueron provocadas por éste. Se debe leer la etiqueta completa para obtener una comprensión completa del perfil de seguridad de la olanzapina.
El prescriptor debe ser consciente de que las cifras de las tablas y tabulaciones no pueden utilizarse para predecir la incidencia de efectos secundarios en el curso de la práctica médica habitual cuando las características del paciente y otros factores difieren de los que prevalecieron en los ensayos clínicos. Del mismo modo, las frecuencias citadas no pueden compararse con cifras obtenidas de otras investigaciones clínicas que involucran diferentes tratamientos, usos e investigadores. Sin embargo, las cifras citadas proporcionan al proveedor de atención médica que prescribe alguna base para estimar la contribución relativa de los factores farmacológicos y no farmacológicos a la incidencia de reacciones adversas en la población estudiada.
Incidencia de reacciones adversas en ensayos a corto plazo, controlados con placebo y combinados
Los siguientes hallazgos se basan en ensayos previos a la comercialización de (1) olanzapina oral para la esquizofrenia, el trastorno bipolar I (episodios maníacos o mixtos), un ensayo posterior de pacientes con diversos síntomas psiquiátricos asociados con la enfermedad de Alzheimer y ensayos combinados previos a la comercialización, y (2 ) olanzapina intramuscular para inyección en pacientes agitados con esquizofrenia o manía bipolar I.
Reacciones adversas asociadas con la interrupción del tratamiento en ensayos a corto plazo controlados con placebo
Esquizofrenia
En general, no hubo diferencia en la incidencia de interrupción debido a reacciones adversas (5 % para olanzapina oral frente a 6 % para placebo). Sin embargo, las interrupciones debidas a aumentos en la ALT se consideraron relacionadas con el fármaco (2 % para olanzapina oral frente a 0 % para placebo).
Trastorno Bipolar I (Episodios Maníacos O Mixtos) Monoterapia
En general, no hubo diferencia en la incidencia de interrupción debido a reacciones adversas (2 % para olanzapina oral frente a 2 % para placebo).
Agitación
En general, no hubo diferencia en la incidencia de interrupción debido a reacciones adversas (0,4 % para la inyección de olanzapina intramuscular frente a 0 % para el placebo).
Reacciones adversas asociadas con la interrupción del tratamiento en ensayos combinados a corto plazo
Trastorno bipolar I (episodios maníacos o mixtos), olanzapina como complemento del litio o el valproato
En un estudio de pacientes que ya toleraban litio o valproato como monoterapia, las tasas de interrupción debido a reacciones adversas fueron del 11 % para la combinación de olanzapina oral con litio o valproato en comparación con el 2 % para los pacientes que continuaron con la monoterapia con litio o valproato. Las discontinuaciones con la combinación de olanzapina oral y litio o valproato que ocurrieron en más de 1 paciente fueron: somnolencia (3%), aumento de peso (1%) y edema periférico (1%).
Reacciones adversas comúnmente observadas en ensayos controlados con placebo a corto plazo
Las reacciones adversas observadas con mayor frecuencia asociadas con el uso de olanzapina oral (incidencia del 5 % o más) y que no se observaron con una incidencia equivalente entre los pacientes tratados con placebo (incidencia de olanzapina al menos dos veces mayor que la del placebo) fueron:
Olanzapina intramuscular
Se observó 1 reacción adversa (somnolencia) con una incidencia del 5% o más entre la olanzapina intramuscular para pacientes tratados con inyección y no observada con una incidencia equivalente entre los pacientes tratados con placebo (incidencia de olanzapina al menos el doble que para el placebo) durante el tratamiento con placebo. -Estudios previos a la comercialización controlados. La incidencia de somnolencia durante el período de tratamiento IM de 24 horas en ensayos clínicos en pacientes agitados con esquizofrenia o manía bipolar I fue del 6 % para la inyección de olanzapina intramuscular y del 3 % para el placebo.
Reacciones adversas que ocurren con una incidencia del 2 % o más entre pacientes tratados con olanzapina oral en ensayos controlados con placebo a corto plazo
La Tabla 11 enumera la incidencia, redondeada al porcentaje más cercano, de reacciones adversas emergentes del tratamiento que ocurrieron en el 2 % o más de los pacientes tratados con olanzapina oral (dosis ≥2,5 mg/día) y con una incidencia mayor que el placebo que participaron en el tratamiento agudo. fase de ensayos controlados con placebo.
Dependencia de la dosis de las reacciones adversas
Se ha observado una diferencia en el grupo de dosis para la fatiga, los mareos, el aumento de peso y la elevación de la prolactina. En un único estudio aleatorizado, doble ciego, de dosis fija, de 8 semanas que comparó 10 (N=199), 20 (N=200) y 40 (N=200) mg/día de olanzapina oral en pacientes adultos con esquizofrenia o esquizoafectivo trastorno, se observó incidencia de fatiga (10 mg/día: 1,5 %; 20 mg/día: 2,1 %; 40 mg/día: 6,6 %) con diferencias significativas entre 10 vs 40 y 20 vs 40 mg/día. La incidencia de mareos (10 mg/día: 2,6%; 20 mg/día: 1,6%; 40 mg/día: 6,6%) se observó con diferencias significativas entre 20 vs 40 mg. También se observaron diferencias entre los grupos de dosis para el aumento de peso y la elevación de la prolactina [ver ADVERTENCIAS Y PRECAUCIONES ].
La siguiente tabla aborda la relación de dosis para otras reacciones adversas utilizando datos de un ensayo de esquizofrenia que involucra rangos de dosis fijos de olanzapina oral. Enumera el porcentaje de pacientes con reacciones adversas emergentes del tratamiento para los 3 grupos de rango de dosis fija y placebo. Los datos se analizaron mediante la prueba de Cochran-Armitage, excluyendo el grupo de placebo, y la tabla incluye solo aquellas reacciones adversas para las que hubo una tendencia.
Reacciones adversas comúnmente observadas en ensayos a corto plazo de olanzapina oral como complemento del litio o el valproato
En los ensayos complementarios controlados con placebo del trastorno bipolar I (episodios maníacos o mixtos), las reacciones adversas observadas con mayor frecuencia asociadas con la combinación de olanzapina y litio o valproato (incidencia de ≥5 % y al menos el doble del placebo) fueron:
Reacciones adversas que ocurren con una incidencia del 2 % o más entre los pacientes tratados con olanzapina oral en ensayos a corto plazo de olanzapina como complemento del litio o el valproato
La Tabla 14 enumera la incidencia, redondeada al porcentaje más cercano, de reacciones adversas emergentes del tratamiento que ocurrieron en el 2 % o más de los pacientes tratados con la combinación de olanzapina (dosis ≥5 mg/día) y litio o valproato y con una incidencia superior a litio o valproato solo que participaron en la fase aguda de los ensayos combinados controlados con placebo.
Para obtener información específica sobre las reacciones adversas observadas con litio o valproato, consulte la sección Reacciones adversas de los prospectos de estos otros productos.
Reacciones adversas que ocurren con una incidencia del 1 % o más entre la olanzapina intramuscular para pacientes tratados con inyecciones en ensayos controlados con placebo a corto plazo
La Tabla 15 enumera la incidencia, redondeada al porcentaje más cercano, de reacciones adversas emergentes del tratamiento que ocurrieron en el 1 % o más de los pacientes tratados con olanzapina intramuscular inyectable (rango de dosis de 2,5 a 10 mg/inyección) y con una incidencia mayor que el placebo que participaron en ensayos controlados con placebo a corto plazo en pacientes agitados con esquizofrenia o manía bipolar I.
Síntomas extrapiramidales
La siguiente tabla enumera el porcentaje de pacientes con síntomas extrapiramidales emergentes del tratamiento evaluados mediante análisis categóricos de escalas de calificación formales durante la terapia aguda en un ensayo clínico controlado que comparó la olanzapina oral en 3 dosis fijas con placebo en el tratamiento de la esquizofrenia en un estudio de 6 semanas. prueba.
La siguiente tabla enumera el porcentaje de pacientes con síntomas extrapiramidales emergentes del tratamiento evaluados por reacciones adversas notificadas espontáneamente durante la terapia aguda en el mismo ensayo clínico controlado que comparó olanzapina en 3 dosis fijas con placebo en el tratamiento de la esquizofrenia en un ensayo de 6 semanas.
La siguiente tabla enumera el porcentaje de pacientes adolescentes con síntomas extrapiramidales emergentes del tratamiento evaluados por reacciones adversas notificadas espontáneamente durante la terapia aguda (rango de dosis: 2,5 a 20 mg/día).
La siguiente tabla enumera el porcentaje de pacientes con síntomas extrapiramidales emergentes del tratamiento evaluados mediante análisis categóricos de escalas de calificación formales durante ensayos clínicos controlados que compararon dosis fijas de olanzapina intramuscular para inyección con placebo en agitación. Los pacientes de cada grupo de dosis podían recibir hasta 3 inyecciones durante los ensayos [ver Estudios clínicos ]. Las evaluaciones de los pacientes se realizaron durante las 24 horas posteriores a la dosis inicial de olanzapina inyectable intramuscular.
La siguiente tabla enumera el porcentaje de pacientes con síntomas extrapiramidales emergentes del tratamiento evaluados por reacciones adversas notificadas espontáneamente en el mismo ensayo clínico controlado que compara dosis fijas de olanzapina intramuscular para inyección con placebo en pacientes agitados con esquizofrenia.
Distonía, efecto de clase
Los síntomas de distonía, contracciones anormales prolongadas de grupos musculares, pueden ocurrir en individuos susceptibles durante los primeros días de tratamiento. Los síntomas distónicos incluyen: espasmo de los músculos del cuello, que a veces progresa a opresión en la garganta, dificultad para tragar, dificultad para respirar y/o protrusión de la lengua. Si bien estos síntomas pueden ocurrir con dosis bajas, la frecuencia y la gravedad son mayores con una potencia alta y con dosis más altas de fármacos antipsicóticos de primera generación. En general, se puede observar un riesgo elevado de distonía aguda en hombres y grupos de edad más jóvenes que reciben antipsicóticos; sin embargo, los eventos de distonía se informaron con poca frecuencia (
Otras reacciones adversas
Otras reacciones adversas observadas durante la evaluación del ensayo clínico de olanzapina oral
La siguiente es una lista de reacciones adversas emergentes del tratamiento informadas por pacientes tratados con olanzapina oral (en dosis múltiples ≥1 mg/día) en ensayos clínicos. Esta lista no pretende incluir reacciones (1) ya enumeradas en tablas anteriores o en otra parte del etiquetado, (2) para las cuales la causa de un fármaco era remota, (3) que eran tan generales como para no ser informativas, (4) que no eran considerado que tiene implicaciones clínicas significativas, o (5) que ocurrió a una tasa igual o menor que el placebo. Las reacciones se clasifican por sistema corporal usando las siguientes definiciones: reacciones adversas frecuentes son aquellas que ocurren en al menos 1/100 pacientes; las reacciones adversas poco frecuentes son las que ocurren en 1/100 a 1/1000 pacientes; reacciones raras son aquellas que ocurren en menos de 1/1000 pacientes.
Cuerpo como un Todo - Infrecuentes: escalofríos, edema facial, reacción de fotosensibilidad, intento de suicidio1; Raros: escalofríos y fiebre, efecto de resaca, muerte súbita1.
Sistema cardiovascular - Infrecuentes: accidente cerebrovascular, vasodilatación.
Sistema digestivo - Infrecuentes: distensión abdominal, náuseas y vómitos, edema de la lengua; Raros: íleo, obstrucción intestinal, depósito graso hepático.
Sistema Hemático y Linfático - Infrecuentes: trombocitopenia.
Trastornos Metabólicos y Nutricionales - Frecuentes: aumento de la fosfatasa alcalina; Infrecuentes: bilirrubinemia, hipoproteinemia.
Sistema musculoesquelético - Raros: osteoporosis.
Sistema nervioso - Infrecuentes: ataxia, disartria, disminución de la libido, estupor; Raros: coma.
Sistema respiratorio - Infrecuentes: epistaxis; Raros: edema pulmonar.
Piel y Anexos - Poco frecuentes: alopecia.
Sentidos especiales - Infrecuentes: anormalidad de la acomodación, ojos secos; Raros: midriasis.
Sistema Urogenital - Infrecuentes: amenorrea2, dolor mamario, disminución de la menstruación, impotencia2, aumento de la menstruación2, menorragia2, metrorragia2, poliuria2, polaquiuria, retención urinaria, urgencia urinaria, dificultad para orinar.
1 Estos términos representan eventos adversos graves pero no cumplen con la definición de reacciones adversas a medicamentos. Se incluyen aquí por su gravedad. 2 Ajustado por género.
Otras reacciones adversas observadas durante la evaluación del ensayo clínico de la inyección intramuscular de olanzapina
La siguiente es una lista de reacciones adversas emergentes del tratamiento informadas por pacientes tratados con olanzapina intramuscular para inyección (en 1 o más dosis ≥2.5 mg/inyección) en ensayos clínicos. Esta lista no pretende incluir reacciones (1) ya enumeradas en tablas anteriores o en otra parte del etiquetado, (2) para las cuales la causa de un fármaco era remota, (3) que eran tan generales como para no ser informativas, (4) que no eran considerado que tiene implicaciones clínicas significativas, o (5) que ocurrió a una tasa igual o menor que el placebo. Las reacciones se clasifican por sistema corporal usando las siguientes definiciones: reacciones adversas frecuentes son aquellas que ocurren en al menos 1/100 pacientes; Las reacciones adversas poco frecuentes son aquellas que ocurren en 1/100 a 1/1000 pacientes.
Cuerpo como un Todo - Frecuente: dolor en el lugar de la inyección.
Sistema cardiovascular - Infrecuentes: síncope.
Sistema digestivo - Infrecuentes: náuseas.
Trastornos Metabólicos y Nutricionales - Infrecuentes: aumento de la creatina fosfoquinasa.
Ensayos clínicos en pacientes adolescentes (de 13 a 17 años)
Reacciones adversas comúnmente observadas en ensayos controlados con placebo a corto plazo de olanzapina oral
Las reacciones adversas en pacientes adolescentes tratados con olanzapina oral (dosis ≥2,5 mg) notificadas con una incidencia del 5 % o más y notificadas con al menos el doble de frecuencia que los pacientes tratados con placebo se enumeran en la Tabla 21.
Reacciones adversas que ocurren con una incidencia del 2 % o más entre los pacientes tratados con olanzapina oral en ensayos controlados con placebo a corto plazo (3 a 6 semanas)
Las reacciones adversas en pacientes adolescentes tratados con olanzapina oral (dosis ≥2,5 mg) notificadas con una incidencia del 2 % o más y mayor que el placebo se enumeran en la Tabla 22.
Signos Vitales Y Estudios De Laboratorio
Cambios en los signos vitales
La olanzapina oral se asoció con hipotensión ortostática y taquicardia en ensayos clínicos. La olanzapina intramuscular inyectable se asoció con bradicardia, hipotensión y taquicardia en ensayos clínicos [ver ADVERTENCIAS Y PRECAUCIONES ].
Cambios de laboratorio
Monoterapia con olanzapina en adultos
Una evaluación de la experiencia previa a la comercialización de la olanzapina reveló una asociación con aumentos asintomáticos de ALT, AST y GGT. Dentro de la base de datos previa a la comercialización original de aproximadamente 2400 pacientes adultos con ALT inicial ≤90 UI/L, la incidencia de elevaciones de ALT a >200 UI/L fue del 2 % (50/2381). Ninguno de estos pacientes experimentó ictericia u otros síntomas atribuibles a insuficiencia hepática y la mayoría tuvo cambios transitorios que tendieron a normalizarse mientras continuaba el tratamiento con olanzapina.
En estudios de monoterapia con olanzapina controlados con placebo en adultos, se observaron elevaciones de ALT clínicamente significativas (cambio de
A partir de un análisis de los datos de laboratorio en una base de datos integrada de 41 estudios clínicos completos en pacientes adultos tratados con olanzapina oral, se registraron niveles altos de GGT en ≥1 % (88/5245) de los pacientes.
Se debe tener precaución en pacientes con signos y síntomas de insuficiencia hepática, en pacientes con condiciones preexistentes asociadas con una reserva funcional hepática limitada y en pacientes que están siendo tratados con fármacos potencialmente hepatotóxicos.
La administración de olanzapina también se asoció con aumentos en la prolactina sérica [ver ADVERTENCIAS Y PRECAUCIONES ], con una elevación asintomática del recuento de eosinófilos en el 0,3% de los pacientes, y con un aumento de la CPK.
A partir de un análisis de los datos de laboratorio en una base de datos integrada de 41 estudios clínicos completos en pacientes adultos tratados con olanzapina oral, se registró ácido úrico elevado en ≥3 % (171/4641) de los pacientes.
Monoterapia con olanzapina en adolescentes
En ensayos clínicos controlados con placebo de pacientes adolescentes con esquizofrenia o trastorno bipolar I (episodios maníacos o mixtos), se observaron mayores frecuencias de los siguientes hallazgos emergentes del tratamiento, en cualquier momento, en analitos de laboratorio en comparación con placebo: ALT elevada (≥3X ULN en pacientes con ALT al inicio del estudio
En estudios de monoterapia con olanzapina controlados con placebo en adolescentes, se observaron elevaciones de ALT clínicamente significativas (cambio de
Cambios en el ECG
En estudios combinados de adultos y estudios combinados de adolescentes, no hubo diferencias significativas entre la olanzapina y el placebo en las proporciones de pacientes que experimentaron cambios potencialmente importantes en los parámetros del ECG, incluidos los intervalos QT, QTc (corregido por Fridericia) y PR. El uso de olanzapina se asoció con un aumento medio de la frecuencia cardíaca en comparación con el placebo (adultos: +2,4 latidos por minuto frente a ningún cambio con placebo; adolescentes: +6,3 latidos por minuto frente a -5,1 latidos por minuto con placebo). Este aumento en la frecuencia cardíaca puede estar relacionado con el potencial de la olanzapina para inducir cambios ortostáticos [ver ADVERTENCIAS Y PRECAUCIONES ].
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de ZYPREXA. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, es difícil estimar de manera confiable su frecuencia o evaluar una relación causal con la exposición al fármaco.
Las reacciones adversas informadas desde la introducción en el mercado que se relacionaron temporalmente (pero no necesariamente causalmente) con la terapia con ZYPREXA incluyen las siguientes: reacción alérgica (p. ej., reacción anafilactoide, angioedema, prurito o urticaria), lesión hepática colestásica o mixta, coma diabético, cetoacidosis diabética, reacción de discontinuación (diaforesis, náuseas o vómitos), reacción a fármacos con eosinofilia y síntomas sistémicos (DRESS), hepatitis, ictericia, neutropenia, pancreatitis, priapismo, erupción cutánea, síndrome de piernas inquietas, rabdomiolisis, tartamudeo1 y eventos tromboembólicos venosos (incluyendo embolia pulmonar y trombosis venosa profunda). Se han informado niveles aleatorios de colesterol de ≥240 mg/dL y niveles aleatorios de triglicéridos de ≥1000 mg/dL.
1 La tartamudez solo se estudió en formulaciones orales y de inyección de acción prolongada (LAI).
INTERACCIONES CON LA DROGAS
Los riesgos del uso de olanzapina en combinación con otros medicamentos no se han evaluado de forma exhaustiva en estudios sistemáticos.
Potencial de que otras drogas afecten a la olanzapina
diazepam
La coadministración de diazepam con olanzapina potenció la hipotensión ortostática observada con olanzapina.
Cimetidina y antiácidos
Dosis únicas de cimetidina (800 mg) o antiácidos que contienen aluminio y magnesio no afectaron la biodisponibilidad oral de la olanzapina.
Inductores de CYP1A2
La terapia con carbamazepina (200 mg dos veces al día) provoca un aumento de aproximadamente el 50 % en la depuración de la olanzapina. Es probable que este aumento se deba al hecho de que la carbamazepina es un potente inductor de la actividad de CYP1A2. Dosis diarias más altas de carbamazepina pueden causar un aumento aún mayor en el aclaramiento de olanzapina.
Alcohol
El etanol (dosis única de 45 mg/70 kg) no tuvo efecto sobre la farmacocinética de la olanzapina. La coadministración de alcohol (es decir, etanol) con olanzapina potenció la hipotensión ortostática observada con olanzapina [ver INTERACCIONES CON LA DROGAS ].
Inhibidores de CYP1A2
fluvoxamina
La fluvoxamina, un inhibidor de CYP1A2, disminuye el aclaramiento de olanzapina. Esto da como resultado un aumento medio en la Cmax de olanzapina después de fluvoxamina del 54 % en mujeres no fumadoras y del 77 % en hombres fumadores. El aumento medio del AUC de la olanzapina es del 52 % y del 108 %, respectivamente. Se deben considerar dosis más bajas de olanzapina en pacientes que reciben tratamiento concomitante con fluvoxamina.
Inhibidores de CYP2D6
fluoxetina
La fluoxetina (dosis única de 60 mg o dosis diaria de 60 mg durante 8 días) provoca un pequeño aumento (media del 16 %) en la concentración máxima de olanzapina y una pequeña disminución (media del 16 %) del aclaramiento de la olanzapina. La magnitud del impacto de este factor es pequeña en comparación con la variabilidad general entre individuos y, por lo tanto, no se recomienda modificar la dosis de forma rutinaria. Cuando use ZYPREXA y fluoxetina en combinación, consulte también la sección Interacciones medicamentosas del prospecto de Symbyax.
warfarina
La warfarina (dosis única de 20 mg) no afectó la farmacocinética de la olanzapina.
Inductores de CYP1A2 o glucuronil transferasa
El omeprazol y la rifampicina pueden provocar un aumento del aclaramiento de la olanzapina.
Carbón
La administración de carbón activado (1 g) redujo la Cmax y el AUC de la olanzapina oral en aproximadamente un 60 %. Dado que los niveles máximos de olanzapina normalmente no se obtienen hasta aproximadamente 6 horas después de la administración, el carbón vegetal puede ser un tratamiento útil para la sobredosis de olanzapina.
Potencial de la olanzapina para afectar a otras drogas
Fármacos que actúan sobre el SNC
Dados los efectos primarios de la olanzapina sobre el SNC, se debe tener precaución cuando se toma en combinación con otros fármacos de acción central y alcohol.
Agentes antihipertensivos
La olanzapina, debido a su potencial para inducir hipotensión, puede potenciar los efectos de ciertos agentes antihipertensivos.
Agonistas de levodopa y dopamina
La olanzapina puede antagonizar los efectos de la levodopa y los agonistas de la dopamina.
Lorazepam (IM)
La administración de lorazepam intramuscular (2 mg) 1 hora después de la inyección de olanzapina intramuscular (5 mg) no afectó significativamente la farmacocinética de la olanzapina, el lorazepam no conjugado o el lorazepam total. Sin embargo, esta coadministración de lorazepam intramuscular y olanzapina intramuscular para inyección se sumó a la somnolencia observada con cualquiera de los fármacos solos [ver ADVERTENCIAS Y PRECAUCIONES ].
Litio
Las dosis múltiples de olanzapina (10 mg durante 8 días) no influyeron en la cinética del litio. Por lo tanto, la administración concomitante de olanzapina no requiere ajuste de dosis de litio [ver ADVERTENCIAS Y PRECAUCIONES ].
Valproato
La olanzapina (10 mg diarios durante 2 semanas) no afectó las concentraciones plasmáticas de valproato en estado estacionario. Por lo tanto, la administración concomitante de olanzapina no requiere un ajuste de dosis de valproato [ver ADVERTENCIAS Y PRECAUCIONES ].
Efecto de la olanzapina sobre las enzimas metabolizadoras de fármacos
Los estudios in vitro que utilizan microsomas hepáticos humanos sugieren que la olanzapina tiene poco potencial para inhibir CYP1A2, CYP2C9, CYP2C19, CYP2D6 y CYP3A. Por lo tanto, es poco probable que la olanzapina provoque interacciones farmacológicas clínicamente importantes mediadas por estas enzimas.
imipramina
Las dosis únicas de olanzapina no afectaron la farmacocinética de la imipramina ni de su metabolito activo, la desipramina.
warfarina
Las dosis únicas de olanzapina no afectaron la farmacocinética de la warfarina.
diazepam
La olanzapina no influyó en la farmacocinética de diazepam o su metabolito activo Ndesmetildiazepam. Sin embargo, el diazepam coadministrado con olanzapina aumentó la hipotensión ortostática observada con cualquiera de los fármacos administrados solos.
Alcohol
Las dosis múltiples de olanzapina no influyeron en la cinética del etanol.
Biperideno
Las dosis múltiples de olanzapina no influyeron en la cinética del biperideno.
teofilina
Las dosis múltiples de olanzapina no afectaron la farmacocinética de la teofilina o sus metabolitos.
Abuso y dependencia de drogas
Dependencia
En estudios diseñados prospectivamente para evaluar el potencial de abuso y dependencia, se demostró que la olanzapina tiene efectos depresivos agudos en el SNC pero poco o ningún potencial de abuso o dependencia física en ratas a las que se les administró dosis orales de hasta 15 veces la MRHD oral diaria (20 mg) y monos rhesus dosis orales administradas hasta 8 veces la MRHD oral diaria en base a mg/m² de área de superficie corporal.
La olanzapina no se ha estudiado sistemáticamente en humanos por su potencial de abuso, tolerancia o dependencia física. Si bien los ensayos clínicos no revelaron ninguna tendencia a ningún comportamiento de búsqueda de fármacos, estas observaciones no fueron sistemáticas y, sobre la base de esta experiencia limitada, no es posible predecir hasta qué punto un fármaco activo sobre el SNC se usará indebidamente, se desviará , y/o abusado una vez comercializado. En consecuencia, los pacientes deben ser evaluados cuidadosamente en busca de antecedentes de abuso de drogas, y dichos pacientes deben ser observados de cerca en busca de signos de uso indebido o abuso de olanzapina (p. ej., desarrollo de tolerancia, aumentos en la dosis, comportamiento de búsqueda de drogas).
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Cuando use ZYPREXA 7.5 mg y fluoxetina en combinación, consulte también la sección Advertencias y precauciones del prospecto de Symbyax.
Pacientes de edad avanzada con psicosis relacionada con demencia
Mortalidad aumentada
Los pacientes de edad avanzada con psicosis relacionada con la demencia tratados con medicamentos antipsicóticos tienen un mayor riesgo de muerte. ZYPREXA 20 mg no está aprobado para el tratamiento de pacientes con psicosis relacionada con la demencia [consulte el RECUADRO DE ADVERTENCIA, Uso en pacientes con enfermedades concomitantes e INFORMACIÓN PARA EL PACIENTE].
En ensayos clínicos controlados con placebo de pacientes de edad avanzada con psicosis relacionada con la demencia, la incidencia de muerte en los pacientes tratados con olanzapina fue significativamente mayor que en los pacientes tratados con placebo (3,5 % frente a 1,5 %, respectivamente).
Eventos adversos cerebrovasculares (CVAE), incluido el accidente cerebrovascular
Se informaron eventos adversos cerebrovasculares (p. ej., accidente cerebrovascular, ataque isquémico transitorio), incluidas muertes, en pacientes en ensayos de olanzapina en pacientes de edad avanzada con psicosis relacionada con demencia. En ensayos controlados con placebo, hubo una incidencia significativamente mayor de eventos adversos cerebrovasculares en pacientes tratados con olanzapina en comparación con pacientes tratados con placebo. La olanzapina no está aprobada para el tratamiento de pacientes con psicosis relacionada con demencia [ver ADVERTENCIA EN CAJA y INFORMACIÓN DEL PACIENTE ].
Suicidio
La posibilidad de un intento de suicidio es inherente a la esquizofrenia y al trastorno bipolar I, y la terapia farmacológica debe acompañarse de una estrecha supervisión de los pacientes de alto riesgo. Las recetas de olanzapina deben hacerse para la cantidad más pequeña de comprimidos compatible con un buen manejo del paciente, con el fin de reducir el riesgo de sobredosis.
Síndrome Neuroléptico Maligno (SNM)
Se ha notificado un complejo de síntomas potencialmente mortales, a veces denominado síndrome neuroléptico maligno (SNM), en asociación con la administración de fármacos antipsicóticos, incluida la olanzapina. Las manifestaciones clínicas del SNM son hiperpirexia, rigidez muscular, estado mental alterado y evidencia de inestabilidad autonómica (pulso o presión arterial irregular, taquicardia, diaforesis y arritmia cardíaca). Los signos adicionales pueden incluir creatinina fosfocinasa elevada, mioglobinuria (rabdomiólisis) e insuficiencia renal aguda.
La evaluación diagnóstica de los pacientes con este síndrome es complicada. Al llegar a un diagnóstico, es importante excluir los casos en los que la presentación clínica incluye tanto una enfermedad médica grave (p. ej., neumonía, infección sistémica, etc.) como signos y síntomas extrapiramidales (EPS) no tratados o tratados inadecuadamente. Otras consideraciones importantes en el diagnóstico diferencial incluyen toxicidad anticolinérgica central, golpe de calor, fiebre por fármacos y patología primaria del sistema nervioso central.
El manejo del SNM debe incluir: 1) suspensión inmediata de los medicamentos antipsicóticos y otros medicamentos que no sean esenciales para la terapia concurrente; 2) tratamiento sintomático intensivo y seguimiento médico; y 3) tratamiento de cualquier problema médico grave concomitante para el cual haya tratamientos específicos disponibles. No existe un acuerdo general sobre los regímenes de tratamiento farmacológico específicos para el SNM.
Si un paciente requiere tratamiento con medicamentos antipsicóticos después de la recuperación del SNM, se debe considerar cuidadosamente la posible reintroducción de la terapia con medicamentos. El paciente debe ser monitoreado cuidadosamente, ya que se han informado recurrencias de SNM [ver INFORMACIÓN DEL PACIENTE ].
Reacción a medicamentos con eosinofilia y síntomas sistémicos (DRESS)
Se ha notificado una reacción al fármaco con eosinofilia y síntomas sistémicos (DRESS) con la exposición a la olanzapina. DRESS puede presentarse con una reacción cutánea (como erupción cutánea o dermatitis exfoliativa), eosinofilia, fiebre y/o linfadenopatía con complicaciones sistémicas como hepatitis, nefritis, neumonitis, miocarditis y/o pericarditis. VESTIR es a veces fatal. Suspender la olanzapina si se sospecha de DRESS [ver INFORMACIÓN DEL PACIENTE ].
Cambios metabólicos
Los fármacos antipsicóticos atípicos se han asociado con cambios metabólicos que incluyen hiperglucemia, dislipidemia y aumento de peso. Los cambios metabólicos pueden estar asociados con un mayor riesgo cardiovascular/cerebrovascular. El perfil metabólico específico de la olanzapina se presenta a continuación.
Hiperglucemia y Diabetes Mellitus
Los proveedores de atención médica deben considerar los riesgos y beneficios al recetar olanzapina a pacientes con un diagnóstico establecido de diabetes mellitus o que tienen un nivel de glucosa en sangre elevado (en ayunas 100-126 mg/dL, sin ayuno 140-200 mg/dL). Los pacientes que toman olanzapina deben ser monitoreados regularmente para detectar un empeoramiento del control de la glucosa. Los pacientes que comienzan el tratamiento con olanzapina deben someterse a pruebas de glucosa en sangre en ayunas al comienzo del tratamiento y periódicamente durante el tratamiento. Cualquier paciente tratado con antipsicóticos atípicos debe ser monitoreado por síntomas de hiperglucemia que incluyen polidipsia, poliuria, polifagia y debilidad. Los pacientes que desarrollan síntomas de hiperglucemia durante el tratamiento con antipsicóticos atípicos deben someterse a pruebas de glucosa en sangre en ayunas. En algunos casos, la hiperglucemia se resolvió cuando se suspendió el antipsicótico atípico; sin embargo, algunos pacientes requirieron la continuación del tratamiento antidiabético a pesar de la interrupción del fármaco sospechoso [ver INFORMACIÓN DEL PACIENTE ].
Se ha notificado hiperglucemia, en algunos casos extrema y asociada con cetoacidosis o coma hiperosmolar o muerte, en pacientes tratados con antipsicóticos atípicos, incluida la olanzapina. La evaluación de la relación entre el uso de antipsicóticos atípicos y las anomalías de la glucosa se complica por la posibilidad de un mayor riesgo de diabetes mellitus en pacientes con esquizofrenia y la creciente incidencia de diabetes mellitus en la población general. Los estudios epidemiológicos sugieren un mayor riesgo de reacciones adversas relacionadas con la hiperglucemia emergente del tratamiento en pacientes tratados con antipsicóticos atípicos. Si bien las estimaciones del riesgo relativo son inconsistentes, la asociación entre los antipsicóticos atípicos y los aumentos en los niveles de glucosa parece caer en un continuo y la olanzapina parece tener una asociación mayor que algunos otros antipsicóticos atípicos.
Se han observado aumentos medios de la glucosa en sangre en pacientes tratados (exposición media de 9,2 meses) con olanzapina en la fase 1 de los Ensayos Clínicos de Eficacia de Intervención con Antipsicóticos (CATIE). El aumento medio de la glucosa sérica (muestras en ayunas y no en ayunas) desde el inicio hasta el promedio de las 2 concentraciones séricas más altas fue de 15,0 mg/dL.
En un estudio de voluntarios sanos, los sujetos que recibieron olanzapina (N = 22) durante 3 semanas tuvieron un aumento medio en comparación con el valor inicial en la glucosa en sangre en ayunas de 2,3 mg/dL. Los sujetos tratados con placebo (N=19) tuvieron un aumento medio de la glucosa en sangre en ayunas en comparación con el valor inicial de 0,34 mg/dl.
Monoterapia con olanzapina en adultos
En un análisis de 5 estudios de monoterapia con olanzapina en adultos controlados con placebo con una mediana de duración del tratamiento de aproximadamente 3 semanas, la olanzapina se asoció con un mayor cambio medio en los niveles de glucosa en ayunas en comparación con el placebo (2,76 mg/dl frente a 0,17 mg/dl). La diferencia en los cambios medios entre la olanzapina y el placebo fue mayor en pacientes con evidencia de desregulación de la glucosa al inicio del estudio (pacientes diagnosticados con diabetes mellitus o reacciones adversas relacionadas, pacientes tratados con agentes antidiabéticos, pacientes con un nivel de glucosa inicial al azar ≥200 mg/ dL y/o un nivel basal de glucosa en ayunas ≥126 mg/dL). Los pacientes tratados con olanzapina tuvieron un mayor aumento medio de HbA1c desde el inicio de 0,04 % (exposición media de 21 días), en comparación con una disminución media de HbA1c de 0,06 % en los sujetos tratados con placebo (exposición media de 17 días).
En un análisis de 8 estudios controlados con placebo (exposición mediana al tratamiento de 4 a 5 semanas), el 6,1 % de los sujetos tratados con olanzapina (N=855) presentó glucosuria emergente del tratamiento en comparación con el 2,8 % de los sujetos tratados con placebo (N=599) . La Tabla 2 muestra los cambios a corto y largo plazo en los niveles de glucosa en ayunas de los estudios de monoterapia con olanzapina en adultos.
El cambio medio en la glucosa en ayunas para los pacientes expuestos al menos durante 48 semanas fue de 4,2 mg/dl (N=487). En análisis de pacientes que completaron 9-12 meses de terapia con olanzapina, el cambio medio en los niveles de glucosa en ayunas y sin ayunar continuó aumentando con el tiempo.
Monoterapia con olanzapina en adolescentes
No se ha establecido la seguridad y eficacia de la olanzapina en pacientes menores de 13 años. En un análisis de 3 estudios de monoterapia con olanzapina controlados con placebo de pacientes adolescentes, incluidos aquellos con esquizofrenia (6 semanas) o trastorno bipolar I (episodios maníacos o mixtos) (3 semanas), la olanzapina se asoció con un mayor cambio medio desde el inicio en ayunas niveles de glucosa en comparación con el placebo (2,68 mg/dl frente a -2,59 mg/dl). El cambio medio en la glucosa en ayunas para los adolescentes expuestos al menos durante 24 semanas fue de 3,1 mg/dl (N=121). La Tabla 3 muestra los cambios a corto y largo plazo en la glucemia en ayunas de los estudios de monoterapia con olanzapina en adolescentes.
dislipidemia
Se han observado alteraciones indeseables en los lípidos con el uso de olanzapina. Se recomienda el monitoreo clínico, incluidas las evaluaciones de lípidos de seguimiento periódicas y de referencia en pacientes que usan olanzapina [ver INFORMACIÓN DEL PACIENTE ].
Se han observado elevaciones clínicamente significativas y, a veces, muy altas (>500 mg/dL) en los niveles de triglicéridos con el uso de olanzapina. También se han observado aumentos medios modestos en el colesterol total con el uso de olanzapina.
Monoterapia con olanzapina en adultos
En un análisis de 5 estudios de monoterapia con olanzapina controlados con placebo con una duración del tratamiento de hasta 12 semanas, los pacientes tratados con olanzapina tuvieron aumentos desde el inicio en la media de colesterol total en ayunas, colesterol LDL y triglicéridos de 5,3 mg/dl, 3,0 mg/dl y 20,8 mg/dl, respectivamente, en comparación con disminuciones desde el inicio en el colesterol total medio en ayunas, el colesterol LDL y los triglicéridos de 6,1 mg/dl, 4,3 mg/dl y 10,7 mg/dl para los pacientes tratados con placebo. Para el colesterol HDL en ayunas, no se observaron diferencias clínicamente significativas entre los pacientes tratados con olanzapina y los pacientes tratados con placebo. Los aumentos medios en los valores de lípidos en ayunas (colesterol total, colesterol LDL y triglicéridos) fueron mayores en pacientes sin evidencia de desregulación de lípidos al inicio del estudio, donde la desregulación de lípidos se definió como pacientes diagnosticados con dislipidemia o reacciones adversas relacionadas, pacientes tratados con agentes hipolipemiantes, o pacientes con niveles basales de lípidos elevados.
En estudios a largo plazo (al menos 48 semanas), los pacientes tuvieron aumentos desde el inicio en la media de colesterol total en ayunas, colesterol LDL y triglicéridos de 5,6 mg/dL, 2,5 mg/dL y 18,7 mg/dL, respectivamente, y una media de disminución del colesterol HDL en ayunas de 0,16 mg/dL. En un análisis de pacientes que completaron 12 meses de tratamiento, el colesterol total medio sin ayunar no aumentó más después de aproximadamente 4 a 6 meses.
La proporción de pacientes que tuvieron cambios (al menos una vez) en el colesterol total, el colesterol LDL o los triglicéridos de normal o en el límite a alto, o cambios en el colesterol HDL de normal o en el límite a bajo, fue mayor en los estudios a largo plazo (al menos 48 semanas) en comparación con los estudios a corto plazo. La Tabla 4 muestra los cambios categóricos en los valores de lípidos en ayunas.
En la fase 1 de los Ensayos Clínicos de Eficacia de Intervención con Antipsicóticos (CATIE), durante una mediana de exposición de 9,2 meses, el aumento medio de triglicéridos en pacientes que tomaban olanzapina fue de 40,5 mg/dl. En la fase 1 del CATIE, el aumento medio del colesterol total fue de 9,4 mg/dL.
Monoterapia con olanzapina en adolescentes
No se ha establecido la seguridad y eficacia de la olanzapina en pacientes menores de 13 años. En un análisis de 3 estudios de monoterapia con olanzapina controlados con placebo de adolescentes, incluidos aquellos con esquizofrenia (6 semanas) o trastorno bipolar I (episodios maníacos o mixtos) (3 semanas), los adolescentes tratados con olanzapina tuvieron aumentos desde el inicio en la media de colesterol total en ayunas, LDL colesterol y triglicéridos de 12,9 mg/dL, 6,5 mg/dL y 28,4 mg/dL, respectivamente, en comparación con aumentos desde el inicio en el colesterol total medio en ayunas y colesterol LDL de 1,3 mg/dL y 1,0 mg/dL, y una disminución en triglicéridos de 1,1 mg/dL para adolescentes tratados con placebo. Para el colesterol HDL en ayunas, no se observaron diferencias clínicamente significativas entre los adolescentes tratados con olanzapina y los adolescentes tratados con placebo.
En estudios a largo plazo (al menos 24 semanas), los adolescentes tuvieron aumentos desde el inicio en el promedio de colesterol total en ayunas, colesterol LDL y triglicéridos de 5,5 mg/dL, 5,4 mg/dL y 20,5 mg/dL, respectivamente, y un promedio de disminución del colesterol HDL en ayunas de 4,5 mg/dL. La Tabla 5 muestra los cambios categóricos en los valores de lípidos en ayunas en adolescentes.
Aumento de peso
Se deben considerar las posibles consecuencias del aumento de peso antes de comenzar con la olanzapina. Los pacientes que reciben olanzapina deben someterse a un control regular del peso [ver Información de asesoramiento para pacientes ].
Monoterapia con olanzapina en adultos
En un análisis de 13 estudios de monoterapia con olanzapina controlados con placebo, los pacientes tratados con olanzapina aumentaron un promedio de 2,6 kg (5,7 lb) en comparación con una pérdida de peso promedio de 0,3 kg (0,6 lb) en los pacientes tratados con placebo con una mediana de exposición de 6 semanas. ; El 22,2 % de los pacientes tratados con olanzapina aumentaron al menos el 7 % de su peso inicial, en comparación con el 3 % de los pacientes tratados con placebo, con una mediana de exposición al evento de 8 semanas; El 4,2 % de los pacientes tratados con olanzapina aumentaron al menos el 15 % de su peso inicial, en comparación con el 0,3 % de los pacientes tratados con placebo, con una mediana de exposición al evento de 12 semanas. Se observó un aumento de peso clínicamente significativo en todas las categorías del índice de masa corporal (IMC) inicial. La suspensión debido al aumento de peso se produjo en el 0,2 % de los pacientes tratados con olanzapina y en el 0 % de los pacientes tratados con placebo.
En estudios a largo plazo (al menos 48 semanas), el aumento de peso medio fue de 5,6 kg (12,3 lb) (exposición media de 573 días, N=2021). Los porcentajes de pacientes que aumentaron al menos el 7 %, el 15 % o el 25 % de su peso corporal inicial con la exposición a largo plazo fueron del 64 %, 32 % y 12 %, respectivamente. La interrupción debido al aumento de peso se produjo en el 0,4 % de los pacientes tratados con olanzapina después de al menos 48 semanas de exposición.
La Tabla 6 incluye datos sobre el aumento de peso en adultos con olanzapina combinados de 86 ensayos clínicos. Los datos de cada columna representan los datos de aquellos pacientes que completaron períodos de tratamiento de las duraciones especificadas.
Se han observado diferencias entre los grupos de dosis con respecto al aumento de peso. En un único estudio aleatorizado, doble ciego, de dosis fija, de 8 semanas de duración que comparó 10 (N=199), 20 (N=200) y 40 (N=200) mg/día de olanzapina oral en pacientes adultos con esquizofrenia o trastorno esquizoafectivo, Se observó un aumento de peso medio desde el inicio hasta el punto final (10 mg/día: 1,9 kg; 20 mg/día: 2,3 kg; 40 mg/día: 3 kg) con diferencias significativas entre 10 y 40 mg/día.
Monoterapia con olanzapina en adolescentes
No se ha establecido la seguridad y eficacia de la olanzapina en pacientes menores de 13 años. El aumento medio de peso en los adolescentes fue mayor que en los adultos. En 4 ensayos controlados con placebo, la interrupción debido al aumento de peso se produjo en el 1 % de los pacientes tratados con olanzapina, en comparación con el 0 % de los pacientes tratados con placebo.
En estudios a largo plazo (al menos 24 semanas), el aumento de peso medio fue de 11,2 kg (24,6 libras); (exposición media de 201 días, N=179). Los porcentajes de adolescentes que aumentaron al menos el 7 %, el 15 % o el 25 % de su peso corporal inicial con la exposición a largo plazo fueron del 89 %, 55 % y 29 %, respectivamente. Entre los pacientes adolescentes, el aumento de peso medio por categoría de IMC inicial fue de 11,5 kg (25,3 lb), 12,1 kg (26,6 lb) y 12,7 kg (27,9 lb), respectivamente, para normal (N=106), sobrepeso (N=26) y obesos (N=17). La suspensión debido al aumento de peso se produjo en el 2,2 % de los pacientes tratados con olanzapina después de al menos 24 semanas de exposición.
La Tabla 8 muestra datos sobre el aumento de peso en adolescentes con olanzapina combinados de 6 ensayos clínicos. Los datos de cada columna representan los datos de aquellos pacientes que completaron períodos de tratamiento de las duraciones especificadas. Hay pocos datos de ensayos clínicos disponibles sobre el aumento de peso en adolescentes con olanzapina más allá de los 6 meses de tratamiento.
Discinesia tardía
Se puede desarrollar un síndrome de movimientos discinéticos involuntarios, potencialmente irreversibles, en pacientes tratados con fármacos antipsicóticos. Aunque la prevalencia del síndrome parece ser mayor entre los ancianos, especialmente en las mujeres de edad avanzada, es imposible confiar en las estimaciones de prevalencia para predecir, al inicio del tratamiento antipsicótico, qué pacientes tienen probabilidades de desarrollar el síndrome. Se desconoce si los medicamentos antipsicóticos difieren en su potencial para causar discinesia tardía.
Se cree que el riesgo de desarrollar discinesia tardía y la probabilidad de que se vuelva irreversible aumentan a medida que aumenta la duración del tratamiento y la dosis total acumulada de fármacos antipsicóticos administrados al paciente. Sin embargo, el síndrome puede desarrollarse, aunque con mucha menos frecuencia, después de períodos de tratamiento relativamente breves a dosis bajas o incluso puede surgir después de la interrupción del tratamiento.
La discinesia tardía puede remitir, parcial o completamente, si se suspende el tratamiento antipsicótico. Sin embargo, el tratamiento antipsicótico en sí mismo puede suprimir (o suprimir parcialmente) los signos y síntomas del síndrome y, por lo tanto, es posible que enmascare el proceso subyacente. Se desconoce el efecto que tiene la supresión sintomática sobre el curso a largo plazo del síndrome.
Teniendo en cuenta estas consideraciones, la olanzapina se debe prescribir de la manera que sea más probable que minimice la aparición de discinesia tardía. El tratamiento antipsicótico crónico generalmente debe reservarse para pacientes (1) que padecen una enfermedad crónica que se sabe que responde a los medicamentos antipsicóticos y (2) para quienes tratamientos alternativos, igualmente efectivos, pero potencialmente menos dañinos no están disponibles o no son apropiados. En pacientes que sí requieren tratamiento crónico, se debe buscar la menor dosis y la menor duración del tratamiento que produzca una respuesta clínica satisfactoria. La necesidad de continuar el tratamiento debe reevaluarse periódicamente.
Si aparecen signos y síntomas de discinesia tardía en un paciente que toma olanzapina, se debe considerar la interrupción del fármaco. Sin embargo, algunos pacientes pueden requerir tratamiento con olanzapina a pesar de la presencia del síndrome.
Para obtener información específica sobre las advertencias de litio o valproato, consulte la sección Advertencias de los prospectos de estos otros productos.
Hipotensión ortostática
La olanzapina puede inducir hipotensión ortostática asociada con mareos, taquicardia, bradicardia y, en algunos pacientes, síncope, especialmente durante el período inicial de titulación de la dosis, lo que probablemente refleja sus propiedades antagonistas adrenérgicas α1 [ver Información de asesoramiento para pacientes ].
A partir de un análisis de los datos de signos vitales en una base de datos integrada de 41 estudios clínicos completos en pacientes adultos tratados con olanzapina oral, se registró hipotensión ortostática en ≥20 % (1277/6030) de los pacientes.
Para el tratamiento con olanzapina oral, el riesgo de hipotensión ortostática y síncope puede minimizarse iniciando el tratamiento con 5 mg una vez al día [ver DOSIFICACIÓN Y ADMINISTRACIÓN ]. Se debe considerar una titulación más gradual a la dosis objetivo si ocurre hipotensión.
Hipotensión, bradicardia con o sin hipotensión, taquicardia y síncope también se informaron durante los ensayos clínicos con olanzapina intramuscular para inyección. En un estudio de farmacología clínica de etiqueta abierta en pacientes con esquizofrenia no agitados en el que se evaluó la seguridad y la tolerabilidad de la olanzapina intramuscular bajo un régimen de dosificación máximo (tres dosis de 10 mg administradas con 4 horas de diferencia), aproximadamente un tercio de estos pacientes experimentó una significativa disminución ortostática de la presión arterial sistólica (es decir, disminución ≥30 mmHg) [ver DOSIFICACIÓN Y ADMINISTRACIÓN ]. Se notificó síncope en el 0,6 % (15/2500) de los pacientes tratados con olanzapina en los estudios de fase 2-3 de olanzapina oral y en el 0,3 % (2/722) de los pacientes tratados con olanzapina con agitación en los estudios de olanzapina intramuscular para inyección. Tres voluntarios normales en estudios de fase 1 con olanzapina intramuscular experimentaron hipotensión, bradicardia y pausas sinusales de hasta 6 segundos que se resolvieron espontáneamente (en 2 casos las reacciones ocurrieron con olanzapina intramuscular y en 1 caso con olanzapina oral). El riesgo de esta secuencia de hipotensión, bradicardia y pausa sinusal puede ser mayor en pacientes no psiquiátricos en comparación con pacientes psiquiátricos que posiblemente estén más adaptados a ciertos efectos de los fármacos psicotrópicos. Para la olanzapina intramuscular para terapia de inyección, los pacientes deben permanecer recostados si están somnolientos o mareados después de la inyección hasta que el examen indique que no están experimentando hipotensión postural, bradicardia y/o hipoventilación.
La olanzapina debe usarse con especial precaución en pacientes con enfermedad cardiovascular conocida (antecedentes de infarto de miocardio o isquemia, insuficiencia cardíaca o anomalías de la conducción), enfermedad cerebrovascular y condiciones que predispondrían a los pacientes a la hipotensión (deshidratación, hipovolemia y tratamiento con medicamentos antihipertensivos). ) donde la ocurrencia de síncope, o hipotensión y/o bradicardia podría poner al paciente en mayor riesgo médico.
Es necesario tener precaución en pacientes que reciben tratamiento con otros medicamentos que tienen efectos que pueden inducir hipotensión, bradicardia, depresión respiratoria o del sistema nervioso central [ver INTERACCIONES CON LA DROGAS ]. No se recomienda la administración concomitante de olanzapina intramuscular y benzodiazepina parenteral debido al potencial de sedación excesiva y depresión cardiorrespiratoria.
Caídas
ZYPREXA puede causar somnolencia, hipotensión postural, inestabilidad motora y sensorial, lo que puede provocar caídas y, en consecuencia, fracturas u otras lesiones. Para los pacientes con enfermedades, afecciones o medicamentos que podrían exacerbar estos efectos, complete las evaluaciones de riesgo de caídas al iniciar el tratamiento antipsicótico y de manera recurrente para los pacientes que reciben terapia antipsicótica a largo plazo.
Leucopenia, neutropenia y agranulocitosis
Efecto de clase
En ensayos clínicos y/o experiencia posterior a la comercialización, se informaron eventos de leucopenia/neutropenia temporalmente relacionados con agentes antipsicóticos, incluido ZYPREXA. También se ha informado agranulocitosis.
Los posibles factores de riesgo de leucopenia/neutropenia incluyen un recuento bajo de glóbulos blancos (WBC) preexistente y antecedentes de leucopenia/neutropenia inducida por fármacos. Los pacientes con antecedentes de leucocitos bajos clínicamente significativos o leucopenia/neutropenia inducida por fármacos deben someterse a un hemograma completo (CBC) controlado con frecuencia durante los primeros meses de tratamiento y se debe considerar la interrupción de ZYPREXA ante el primer signo de una disminución clínicamente significativa. en WBC en ausencia de otros factores causales.
Los pacientes con neutropenia clínicamente significativa deben ser monitoreados cuidadosamente en busca de fiebre u otros síntomas o signos de infección y tratados de inmediato si se presentan tales síntomas o signos. Los pacientes con neutropenia grave (recuento absoluto de neutrófilos
disfagia
La dismotilidad esofágica y la aspiración se han asociado con el uso de fármacos antipsicóticos. La neumonía por aspiración es una causa común de morbilidad y mortalidad en pacientes con enfermedad de Alzheimer avanzada. La olanzapina no está aprobada para el tratamiento de pacientes con enfermedad de Alzheimer.
convulsiones
Durante las pruebas previas a la comercialización, se produjeron convulsiones en el 0,9% (22/2500) de los pacientes tratados con olanzapina. Hubo factores de confusión que pueden haber contribuido a la aparición de convulsiones en muchos de estos casos. La olanzapina se debe usar con precaución en pacientes con antecedentes de convulsiones o con afecciones que potencialmente reduzcan el umbral convulsivo, por ejemplo, demencia de Alzheimer. La olanzapina no está aprobada para el tratamiento de pacientes con enfermedad de Alzheimer. Las condiciones que reducen el umbral de convulsiones pueden ser más frecuentes en una población de 65 años o más.
Potencial de deterioro cognitivo y motor
La somnolencia fue una reacción adversa notificada con frecuencia asociada con el tratamiento con olanzapina, con una incidencia del 26 % en pacientes con olanzapina en comparación con el 15 % en pacientes con placebo. Esta reacción adversa también estuvo relacionada con la dosis. La somnolencia llevó a la discontinuación en el 0,4 % (9/2500) de los pacientes en la base de datos previa a la comercialización.
Dado que la olanzapina tiene el potencial de afectar el juicio, el pensamiento o las habilidades motoras, se debe advertir a los pacientes sobre el manejo de maquinaria peligrosa, incluidos los automóviles, hasta que estén razonablemente seguros de que la terapia con olanzapina no los afecta de manera adversa [ver Información de asesoramiento para pacientes ].
Regulación de la temperatura corporal
La interrupción de la capacidad del cuerpo para reducir la temperatura corporal central se ha atribuido a los agentes antipsicóticos. Se recomienda el cuidado adecuado cuando se prescribe olanzapina a pacientes que experimentarán condiciones que pueden contribuir a una elevación de la temperatura corporal central, por ejemplo, ejercicio intenso, exposición a calor extremo, recibir medicación concomitante con actividad anticolinérgica o estar sujetos a deshidratación [ver INFORMACIÓN DEL PACIENTE ].
Uso en pacientes con enfermedades concomitantes
La experiencia clínica con olanzapina en pacientes con ciertas enfermedades sistémicas concomitantes es limitada [ver FARMACOLOGÍA CLÍNICA ].
La olanzapina muestra afinidad por el receptor muscarínico in vitro. En ensayos clínicos previos a la comercialización con olanzapina, la olanzapina se asoció con estreñimiento, boca seca y taquicardia, todas las reacciones adversas posiblemente relacionadas con el antagonismo colinérgico. Estas reacciones adversas a menudo no fueron la base para la interrupción de la olanzapina, pero la olanzapina debe usarse con precaución en pacientes con hipertrofia prostática clínicamente significativa, glaucoma de ángulo estrecho o antecedentes de íleo paralítico o afecciones relacionadas.
En 5 estudios controlados con placebo de olanzapina en pacientes de edad avanzada con psicosis relacionada con la demencia (n = 1184), se informaron las siguientes reacciones adversas emergentes del tratamiento en pacientes tratados con olanzapina con una incidencia de al menos el 2 % y significativamente mayor que con placebo. pacientes tratados: caídas, somnolencia, edema periférico, alteraciones de la marcha, incontinencia urinaria, letargo, aumento de peso, astenia, pirexia, neumonía, sequedad de boca y alucinaciones visuales. La tasa de discontinuación debido a reacciones adversas fue mayor con olanzapina que con placebo (13 % frente a 7 %). Los pacientes de edad avanzada con psicosis relacionada con la demencia tratados con olanzapina tienen un mayor riesgo de muerte en comparación con el placebo. La olanzapina no está aprobada para el tratamiento de pacientes con psicosis relacionada con demencia [ver ADVERTENCIA EN CAJA , Pacientes de edad avanzada con psicosis relacionada con demencia , y INFORMACIÓN DEL PACIENTE ].
La olanzapina no ha sido evaluada ni utilizada de manera apreciable en pacientes con antecedentes recientes de infarto de miocardio o cardiopatía inestable. Los pacientes con estos diagnósticos fueron excluidos de los estudios clínicos previos a la comercialización. Debido al riesgo de hipotensión ortostática con olanzapina, se debe tener precaución en pacientes cardíacos [ver Hipotensión ortostática ].
Hiperprolactinemia
Al igual que con otros fármacos que antagonizan los receptores de dopamina D2, la olanzapina eleva los niveles de prolactina y la elevación persiste durante la administración crónica. La hiperprolactinemia puede suprimir la GnRH hipotalámica, lo que reduce la secreción de gonadotropinas hipofisarias. Esto, a su vez, puede inhibir la función reproductiva al alterar la esteroidogénesis gonadal tanto en pacientes femeninos como masculinos. Se han informado casos de galactorrea, amenorrea, ginecomastia e impotencia en pacientes que reciben compuestos que elevan la prolactina. La hiperprolactinemia prolongada, cuando se asocia con hipogonadismo, puede conducir a una disminución de la densidad ósea tanto en mujeres como en hombres.
Los experimentos de cultivo de tejidos indican que aproximadamente un tercio de los cánceres de mama humanos son dependientes de la prolactina in vitro, un factor de importancia potencial si se contempla la prescripción de estos fármacos en un paciente con cáncer de mama detectado previamente. Como es común con los compuestos que aumentan la liberación de prolactina, se observó un aumento en la neoplasia de la glándula mamaria en los estudios de carcinogenicidad de la olanzapina realizados en ratones y ratas [ver Toxicología no clínica ]. Ni los estudios clínicos ni los estudios epidemiológicos realizados hasta la fecha han demostrado una asociación entre la administración crónica de esta clase de fármacos y la tumorigénesis en humanos; la evidencia disponible se considera demasiado limitada para ser concluyente en este momento.
En estudios clínicos de olanzapina controlados con placebo (hasta 12 semanas), se observaron cambios de normales a altas en las concentraciones de prolactina en el 30 % de los adultos tratados con olanzapina en comparación con el 10,5 % de los adultos tratados con placebo. En un análisis combinado de estudios clínicos que incluyeron 8136 adultos tratados con olanzapina, las manifestaciones clínicas potencialmente asociadas incluyeron eventos relacionados con la menstruación1 (2 % [49/3240] de mujeres), eventos relacionados con la función sexual2 (2 % [150/8136] de mujeres y hombres) y eventos relacionados con la mama3 (0,7 % [23/3240] de mujeres, 0,2 % [9/4896] de hombres).
En estudios de monoterapia con olanzapina controlados con placebo en pacientes adolescentes (hasta 6 semanas) con esquizofrenia o trastorno bipolar I (episodios maníacos o mixtos), se observaron cambios de normales a altas en las concentraciones de prolactina en el 47 % de los pacientes tratados con olanzapina en comparación con 7 % de pacientes tratados con placebo. En un análisis combinado de ensayos clínicos que incluyeron a 454 adolescentes tratados con olanzapina, las manifestaciones clínicas potencialmente asociadas incluyeron eventos relacionados con la menstruación1 (1 % [2/168] de mujeres), eventos relacionados con la función sexual2 (0,7 % [3/454] de mujeres y hombres ) y eventos relacionados con la mama3 (2 % [3/168] de mujeres, 2 % [7/286] de hombres) [ver Uso en poblaciones específicas ].
1 Basado en una búsqueda de los siguientes términos: amenorrea, hipomenorrea, retraso en la menstruación y oligomenorrea.
2 Basado en una búsqueda de los siguientes términos: anorgasmia, eyaculación retardada, disfunción eréctil, disminución de la libido, pérdida de la libido, orgasmo anormal y disfunción sexual.
Basado en una búsqueda de los siguientes términos: secreción mamaria, agrandamiento o hinchazón, galactorrea, ginecomastia y trastorno de la lactancia.
Se han observado diferencias entre los grupos de dosis con respecto a la elevación de prolactina. En un único estudio aleatorizado, doble ciego, de dosis fija, de 8 semanas que comparó 10 (N=199), 20 (N=200) y 40 (N=200) mg/día de olanzapina oral en pacientes adultos con esquizofrenia o esquizoafectivo trastorno, incidencia de aumento de prolactina >24,2 ng/mL (mujeres) o >18,77 ng/mL (hombres) en cualquier momento durante el ensayo (10 mg/día: 31,2 %; 20 mg/día: 42,7 %; 40 mg/día : 61,1%) indicó diferencias significativas entre 10 vs 40 mg/día y 20 vs 40 mg/día.
Usar en combinación con fluoxetina, litio o valproato
Cuando use ZYPREXA y fluoxetina en combinación, el prescriptor también debe consultar la sección de Advertencias y precauciones del prospecto de Symbyax. Cuando se usa ZYPREXA en combinación con litio o valproato, el prescriptor debe consultar las secciones de Advertencias y Precauciones de los prospectos para litio o valproato [ver INTERACCIONES CON LA DROGAS ].
Pruebas de laboratorio
Se recomiendan análisis de glucosa en sangre en ayunas y perfil de lípidos al comienzo del tratamiento y periódicamente durante el mismo [ver Cambios metabólicos y INFORMACIÓN DEL PACIENTE ].
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( Guía de medicamentos ) para las formulaciones orales.
Se debe informar a los pacientes sobre los siguientes problemas y pedirles que alerten a su médico si ocurren mientras toman ZYPREXA 15 mg como monoterapia o en combinación con fluoxetina. Si cree que no está mejorando o tiene alguna inquietud acerca de su condición mientras toma ZYPREXA 2.5 mg, llame a su médico. Cuando use ZYPREXA y fluoxetina en combinación, consulte también la sección Información de asesoramiento para el paciente del prospecto de Symbyax.
Pacientes de edad avanzada con psicosis relacionada con demencia: aumento de la mortalidad y eventos adversos cerebrovasculares (CVAE), incluido el accidente cerebrovascular
Se debe advertir a los pacientes y cuidadores que los pacientes de edad avanzada con psicosis relacionada con la demencia tratados con medicamentos antipsicóticos tienen un mayor riesgo de muerte. Se debe informar a los pacientes y cuidadores que los pacientes de edad avanzada con psicosis relacionada con la demencia tratados con ZYPREXA tuvieron una incidencia significativamente mayor de eventos adversos cerebrovasculares (p. ej., accidente cerebrovascular, ataque isquémico transitorio) en comparación con el placebo.
ZYPREXA no está aprobado para pacientes de edad avanzada con psicosis relacionada con la demencia [ver ADVERTENCIA EN CAJA y ADVERTENCIAS Y PRECAUCIONES ].
Síndrome Neuroléptico Maligno (SNM)
Se debe advertir a los pacientes y cuidadores que se ha informado un complejo de síntomas potencialmente fatales, a veces denominado SNM, en asociación con la administración de medicamentos antipsicóticos, incluido ZYPREXA. Los signos y síntomas del SNM incluyen hiperpirexia, rigidez muscular, estado mental alterado y evidencia de inestabilidad autonómica (pulso o presión arterial irregulares, taquicardia, diaforesis y arritmia cardíaca) [ver ADVERTENCIAS Y PRECAUCIONES ].
Reacción a medicamentos con eosinofilia y síntomas sistémicos (DRESS)
Se debe recomendar a los pacientes que informen a su proveedor de atención médica lo antes posible sobre cualquier signo y síntoma que pueda estar asociado con la reacción a medicamentos con eosinofilia y síntomas sistémicos (DRESS) [ver ADVERTENCIAS Y PRECAUCIONES ].
Hiperglucemia y Diabetes Mellitus
Se debe advertir a los pacientes sobre el riesgo potencial de reacciones adversas relacionadas con la hiperglucemia. Los pacientes deben ser monitoreados regularmente para detectar un empeoramiento del control de la glucosa. Los pacientes que tienen diabetes deben seguir las instrucciones de su médico acerca de la frecuencia con la que deben controlar su nivel de azúcar en la sangre mientras toman ZYPREXA [ver ADVERTENCIAS Y PRECAUCIONES ].
dislipidemia
Se debe advertir a los pacientes que se ha producido dislipidemia durante el tratamiento con ZYPREXA. Los pacientes deben controlar periódicamente su perfil lipídico [ver ADVERTENCIAS Y PRECAUCIONES ].
Aumento de peso
Se debe advertir a los pacientes que se ha producido un aumento de peso durante el tratamiento con ZYPREXA. Se debe controlar el peso de los pacientes con regularidad [ver ADVERTENCIAS Y PRECAUCIONES ].
Hipotensión ortostática
Se debe advertir a los pacientes sobre el riesgo de hipotensión ortostática, especialmente durante el período de titulación inicial de la dosis y en asociación con el uso concomitante de medicamentos que pueden potenciar el efecto ortostático de ZYPREXA, por ejemplo, diazepam o alcohol [ver ADVERTENCIAS Y PRECAUCIONES y INTERACCIONES CON LA DROGAS ]. Se debe recomendar a los pacientes que cambien de posición con cuidado para ayudar a prevenir la hipotensión ortostática y que se acuesten si se sienten mareados o desmayados, hasta que se sientan mejor. Se debe recomendar a los pacientes que llamen a su médico si experimentan cualquiera de los siguientes signos y síntomas asociados con la hipotensión ortostática: mareos, latidos cardíacos rápidos o lentos o desmayos.
Potencial de deterioro cognitivo y motor
Debido a que ZYPREXA tiene el potencial de afectar el juicio, el pensamiento o las habilidades motoras, se debe advertir a los pacientes sobre el manejo de maquinaria peligrosa, incluidos los automóviles, hasta que estén razonablemente seguros de que la terapia con ZYPREXA no los afecta de manera adversa [ver ADVERTENCIAS Y PRECAUCIONES ].
Regulación de la temperatura corporal
Se debe advertir a los pacientes sobre el cuidado adecuado para evitar el sobrecalentamiento y la deshidratación. Se debe recomendar a los pacientes que llamen a su médico de inmediato si se enferman gravemente y tienen algunos o todos estos síntomas de deshidratación: sudoración excesiva o nula, sequedad de boca, sensación de mucho calor, sensación de sed, incapacidad para producir orina [ ver ADVERTENCIAS Y PRECAUCIONES ].
Medicación concomitante
Se debe recomendar a los pacientes que informen a sus proveedores de atención médica si están tomando o planean tomar Symbyax. También se debe recomendar a los pacientes que informen a sus proveedores de atención médica si están tomando, planean tomar o han dejado de tomar cualquier medicamento recetado o de venta libre, incluidos los suplementos herbales, ya que existe la posibilidad de interacciones [ver INTERACCIONES CON LA DROGAS ].
Alcohol
Se debe advertir a los pacientes que eviten el alcohol mientras toman ZYPREXA [ver INTERACCIONES CON LA DROGAS ].
fenilcetonúricos
ZYPREXA 10 mg ZYDIS (tabletas de desintegración oral de olanzapina) contiene fenilalanina (0.34, 0.45, 0.67 o 0.90 mg por tableta de 5, 10, 15 o 20 mg, respectivamente) [ver DESCRIPCIÓN ].
Uso en poblaciones específicas
El embarazo
Aconseje a las mujeres que notifiquen a su proveedor de atención médica si quedan embarazadas o tienen la intención de quedar embarazadas durante el tratamiento con ZYPREXA. Indique a los pacientes que ZYPREXA puede causar síntomas extrapiramidales y/o de abstinencia (agitación, hipertonía, hipotonía, temblores, somnolencia, dificultad respiratoria y trastornos de la alimentación) en un recién nacido. Informe a los pacientes que existe un registro de exposición durante el embarazo que monitorea los resultados del embarazo en mujeres expuestas a ZYPREXA 7.5 mg durante el embarazo [ver Uso en poblaciones específicas ].
Lactancia
Aconseje a las mujeres que amamantan que usan ZYPREXA 20 mg que vigilen a los bebés por exceso de sedación, irritabilidad, mala alimentación y síntomas extrapiramidales (temblores y movimientos musculares anormales) y que busquen atención médica si notan estos signos. [ver Uso en poblaciones específicas ].
Esterilidad
Aconseje a las mujeres con potencial reproductivo que ZYPREXA puede afectar la fertilidad debido a un aumento en los niveles de prolactina sérica. Los efectos sobre la fertilidad son reversibles [ver Uso en poblaciones específicas ].
Uso pediátrico
ZYPREXA 15 mg está indicado para el tratamiento de la esquizofrenia y los episodios maníacos o mixtos asociados con el trastorno bipolar I en adolescentes de 13 a 17 años. En comparación con los pacientes de ensayos clínicos en adultos, era probable que los adolescentes aumentaran más de peso, experimentaran una mayor sedación y tuvieran mayores aumentos en los niveles de colesterol total, triglicéridos, colesterol LDL, prolactina y aminotransferasa hepática. Se debe asesorar a los pacientes sobre los posibles riesgos a largo plazo asociados con ZYPREXA y advertirles que estos riesgos pueden llevarlos a considerar otros medicamentos primero [ver INDICACIONES Y USO ]. No se ha establecido la seguridad y eficacia de ZYPREXA 5 mg en pacientes menores de 13 años. Se ha establecido la seguridad y eficacia de ZYPREXA 15 mg y fluoxetina en combinación en pacientes de 10 a 17 años de edad para el tratamiento agudo de episodios depresivos asociados con el trastorno bipolar I. No se ha establecido la seguridad y eficacia de ZYPREXA y fluoxetina en combinación en pacientes ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
Necesidad de un programa de tratamiento integral en pacientes pediátricos
ZYPREXA 20 mg está indicado como parte integral de un programa de tratamiento total para pacientes pediátricos con esquizofrenia y trastorno bipolar que puede incluir otras medidas (psicológicas, educativas, sociales) para pacientes con el trastorno. No se ha establecido la eficacia y seguridad de ZYPREXA 7.5 mg en pacientes pediátricos menores de 13 años. Los antipsicóticos atípicos no están destinados para su uso en pacientes pediátricos que presenten síntomas secundarios a factores ambientales y/u otros trastornos psiquiátricos primarios. La ubicación educativa adecuada es esencial y la intervención psicosocial suele ser útil. La decisión de recetar un medicamento antipsicótico atípico dependerá de la evaluación del proveedor de atención médica sobre la cronicidad y la gravedad de los síntomas del paciente [ver INDICACIONES Y USO ].
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Carcinogénesis
Se realizaron estudios de carcinogenicidad oral en ratones y ratas. Se administró olanzapina a ratones en dos estudios de 78 semanas en dosis de 3, 10, 30/20 mg/kg/día (equivalente a 0,8-5 veces la MRHD oral diaria basada en mg/m² de área de superficie corporal) y 0,25, 2 , 8 mg/kg/día (equivalente a 0,06-2 veces la MRHD oral diaria basada en mg/m² de superficie corporal). Las ratas fueron dosificadas durante 2 años a dosis de 0,25, 1, 2,5, 4 mg/kg/día (machos) y 0,25, 1, 4, 8 mg/kg/día (hembras) (equivalentes a 0,13-2 y 0,13-4 veces la MRHD oral diaria basada en mg/m² de superficie corporal, respectivamente). La incidencia de hemangiomas y hemangiosarcomas hepáticos aumentó significativamente en 1 estudio con ratones hembra con 2 veces la MRHD oral diaria basada en mg/m² de área de superficie corporal. Estos tumores no aumentaron en otro estudio con ratones en hembras que recibieron dosis de hasta 2 a 5 veces la MRHD oral diaria basada en mg/m² de área de superficie corporal; en este estudio, hubo una alta incidencia de mortalidad temprana en los machos del grupo de 30/20 mg/kg/día. La incidencia de adenomas y adenocarcinomas de las glándulas mamarias aumentó significativamente en ratones hembra que recibieron dosis de ≥2 mg/kg/día y en ratas hembras que recibieron dosis de ≥4 mg/kg/día (0,5 y 2 veces la MRHD oral diaria basada en mg/m² superficie corporal, respectivamente). Se ha demostrado que los fármacos antipsicóticos elevan de forma crónica los niveles de prolactina en roedores. Los niveles de prolactina sérica no se midieron durante los estudios de carcinogenicidad de olanzapina; sin embargo, las mediciones durante los estudios de toxicidad subcrónica mostraron que la olanzapina elevó los niveles de prolactina sérica hasta 4 veces en ratas a las mismas dosis utilizadas en el estudio de carcinogenicidad. Se ha encontrado un aumento en las neoplasias de las glándulas mamarias en roedores después de la administración crónica de otros fármacos antipsicóticos y se considera que está mediado por la prolactina. Se desconoce la relevancia para el riesgo humano del hallazgo de tumores endocrinos mediados por prolactina en roedores [ver ADVERTENCIAS Y PRECAUCIONES ].
mutagénesis
No se encontró evidencia de potencial genotóxico para la olanzapina en la prueba de mutación inversa de Ames, la prueba de micronúcleo in vivo en ratones, la prueba de aberración cromosómica en células de ovario de hámster chino, la prueba de síntesis de ADN no programada en hepatocitos de rata, la prueba de inducción de mutación directa en células de linfoma de ratón , o prueba de intercambio de cromátidas hermanas in vivo en médula ósea de hámsteres chinos.
Deterioro de la fertilidad
En un estudio de rendimiento reproductivo y fertilidad oral en ratas, el rendimiento de apareamiento de los machos, pero no la fertilidad, se vio afectado con una dosis de 22,4 mg/kg/día y la fertilidad de las hembras disminuyó con una dosis de 3 mg/kg/día (11 y 1,5 veces la MRHD oral diaria basada en mg/m² de superficie corporal, respectivamente). La interrupción del tratamiento con olanzapina revirtió los efectos sobre el rendimiento de apareamiento de los machos. En ratas hembra, el período precoital aumentó y el índice de apareamiento se redujo a 5 mg/kg/día (2,5 veces la MRHD oral diaria basada en mg/m² de superficie corporal). El diestro se prolongó y el estro se retrasó a 1,1 mg/kg/día (0,6 veces la MRHD oral diaria basada en mg/m² de superficie corporal); por lo tanto, la olanzapina puede producir un retraso en la ovulación.
Uso en poblaciones específicas
Cuando use ZYPREXA y fluoxetina en combinación, consulte también la sección Uso en poblaciones específicas del prospecto de Symbyax.
El embarazo
Registro de exposición durante el embarazo
Existe un registro de exposición durante el embarazo que monitorea los resultados del embarazo en mujeres expuestas a antipsicóticos atípicos, incluido ZYPREXA, durante el embarazo. Se alienta a los proveedores de atención médica a registrar a los pacientes comunicándose con el Registro Nacional de Embarazo para Antipsicóticos Atípicos al 1-866-961-2388 o visitando http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/.
Resumen de riesgos
Los recién nacidos expuestos a fármacos antipsicóticos, incluido ZYPREXA, durante el tercer trimestre corren el riesgo de presentar síntomas extrapiramidales y/o de abstinencia después del parto (ver Consideraciones clínicas ). Los datos generales disponibles de los estudios epidemiológicos publicados de mujeres embarazadas expuestas a la olanzapina no han establecido un riesgo asociado al fármaco de anomalías congénitas importantes, aborto espontáneo o resultados maternos o fetales adversos (ver Datos ). Existen riesgos para la madre asociados con la esquizofrenia o el trastorno bipolar I no tratados y con la exposición a antipsicóticos, incluido ZYPREXA 7.5 mg, durante el embarazo (ver Consideraciones clínicas ).
La olanzapina no fue teratogénica cuando se administró por vía oral a ratas y conejas preñadas en dosis que son 9 y 30 veces la dosis oral máxima diaria recomendada en humanos (MRHD), en base a mg/m² de superficie corporal; Se observaron algunas toxicidades fetales a estas dosis (ver Datos ).
Se desconoce el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo para las poblaciones indicadas. Todos los embarazos tienen un riesgo de fondo de defectos congénitos, pérdidas u otros resultados adversos. En la población general de EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 % al 4 % y del 15 % al 20 %, respectivamente.
Consideraciones clínicas
Riesgo materno y embrionario/fetal asociado a la enfermedad
Existe un riesgo para la madre debido a la esquizofrenia o al trastorno bipolar I no tratados, incluido un mayor riesgo de recaída, hospitalización y suicidio. La esquizofrenia y el trastorno bipolar I se asocian con mayores resultados perinatales adversos, incluido el parto prematuro. No se sabe si esto es un resultado directo de la enfermedad o de otros factores comórbidos.
Reacciones adversas fetales/neonatales
Se han informado síntomas extrapiramidales y/o de abstinencia, que incluyen agitación, hipertonía, hipotonía, temblores, somnolencia, dificultad respiratoria y trastornos de la alimentación en recién nacidos que estuvieron expuestos a medicamentos antipsicóticos, incluido ZYPREXA 2.5 mg, durante el tercer trimestre del embarazo. Estos síntomas han variado en severidad. Supervise a los recién nacidos para detectar síntomas extrapiramidales y/o de abstinencia y maneje los síntomas adecuadamente. Algunos neonatos se recuperaron en horas o días sin tratamiento específico; otros requirieron hospitalización prolongada.
Datos
Datos humanos
El paso de la placenta se ha informado en informes de estudios publicados; sin embargo, la tasa de expulsión de la placenta fue muy variable, oscilando entre el 7 % y el 167 % al nacer después de la exposición durante el embarazo. Se desconoce la relevancia clínica de este hallazgo.
Los datos publicados de estudios observacionales, registros de nacimiento e informes de casos que han evaluado el uso de antipsicóticos atípicos durante el embarazo no establecen un mayor riesgo de defectos congénitos importantes. Un estudio de cohorte retrospectivo de una base de datos de Medicaid de 9258 mujeres expuestas a antipsicóticos durante el embarazo no indicó un mayor riesgo general de defectos congénitos importantes.
Datos de animales
En estudios de reproducción oral en ratas a dosis de hasta 18 mg/kg/día y en conejos a dosis de hasta 30 mg/kg/día (9 y 30 veces la MRHD oral diaria basada en mg/m² de superficie corporal, respectivamente), no se observó evidencia de teratogenicidad. En un estudio de teratología oral en ratas, se observaron reabsorciones tempranas y un mayor número de fetos no viables con una dosis de 18 mg/kg/día (9 veces la MRHD oral diaria basada en mg/m² de área de superficie corporal), y la gestación se prolongó a los 10 mg/kg/día (5 veces la MRHD oral diaria basada en mg/m² de superficie corporal). En un estudio de teratología oral en conejos, la toxicidad fetal se manifestó como un aumento de la reabsorción y una disminución del peso fetal a una dosis tóxica para la madre de 30 mg/kg/día (30 veces la MRHD oral diaria basada en mg/m² de superficie corporal).
Lactancia
Resumen de riesgos
La olanzapina está presente en la leche humana. Hay informes de exceso de sedación, irritabilidad, mala alimentación y síntomas extrapiramidales (temblores y movimientos musculares anormales) en lactantes expuestos a la olanzapina a través de la leche materna (ver Consideraciones clínicas ). No hay información sobre los efectos de la olanzapina en la producción de leche.
Los beneficios para el desarrollo y la salud de la lactancia materna se deben considerar junto con la necesidad clínica de ZYPREXA de la madre y cualquier posible efecto adverso en el niño amamantado debido a ZYPREXA oa la afección subyacente de la madre.
Consideraciones clínicas
Los bebés expuestos a ZYPREXA 7.5 mg deben ser monitoreados por exceso de sedación, irritabilidad, mala alimentación y síntomas extrapiramidales (temblores y movimientos musculares anormales).
Hembras y machos con potencial reproductivo
Esterilidad
Hembras
Según la acción farmacológica de la olanzapina (antagonismo del receptor D2), el tratamiento con ZYPREXA puede provocar un aumento de los niveles de prolactina sérica, lo que puede conducir a una reducción reversible de la fertilidad en mujeres con potencial reproductivo [ver ADVERTENCIAS Y PRECAUCIONES ].
Uso pediátrico
La seguridad y eficacia de ZYPREXA oral en el tratamiento de la esquizofrenia y los episodios maníacos o mixtos asociados con el trastorno bipolar I se establecieron en estudios a corto plazo en adolescentes (de 13 a 17 años). El uso de ZYPREXA en adolescentes está respaldado por evidencia de estudios adecuados y bien controlados de ZYPREXA 5 mg en los que 268 adolescentes recibieron ZYPREXA 20 mg en un rango de 2.5 a 20 mg/día [ver Estudios clínicos ]. La dosis inicial recomendada para adolescentes es más baja que para adultos [ver DOSIFICACIÓN Y ADMINISTRACIÓN ]. En comparación con los pacientes de ensayos clínicos en adultos, era probable que los adolescentes aumentaran más de peso, experimentaran una mayor sedación y tuvieran mayores aumentos en los niveles de colesterol total, triglicéridos, colesterol LDL, prolactina y aminotransferasa hepática [ver ADVERTENCIAS Y PRECAUCIONES y REACCIONES ADVERSAS ]. Al decidir entre los tratamientos alternativos disponibles para adolescentes, los médicos deben considerar el mayor potencial (en adolescentes en comparación con adultos) de aumento de peso y dislipidemia. Los médicos deben considerar los riesgos potenciales a largo plazo al prescribir a los adolescentes y, en muchos casos, esto puede llevarlos a considerar la prescripción de otros medicamentos primero en los adolescentes [ver INDICACIONES Y USO ].
No se ha establecido la seguridad y eficacia de la olanzapina en niños menores de 13 años [ver INFORMACIÓN DEL PACIENTE ].
Se ha establecido la seguridad y eficacia de ZYPREXA 7.5 mg y fluoxetina en combinación en niños y adolescentes (10 a 17 años de edad) para el tratamiento agudo de episodios depresivos asociados con el trastorno bipolar I.
No se ha establecido la seguridad y eficacia de ZYPREXA y fluoxetina en combinación en niños menores de 10 años.
Uso geriátrico
De los 2500 pacientes en estudios clínicos previos a la comercialización con olanzapina oral, el 11% (263) tenían 65 años o más. En pacientes con esquizofrenia, no hubo indicios de una tolerabilidad diferente de la olanzapina en los ancianos en comparación con los pacientes más jóvenes. Los estudios en pacientes de edad avanzada con psicosis relacionada con la demencia han sugerido que puede haber un perfil de tolerabilidad diferente en esta población en comparación con los pacientes más jóvenes con esquizofrenia. Los pacientes de edad avanzada con psicosis relacionada con la demencia tratados con olanzapina tienen un mayor riesgo de muerte en comparación con el placebo. En estudios controlados con placebo de olanzapina en pacientes de edad avanzada con psicosis relacionada con demencia, hubo una mayor incidencia de eventos adversos cerebrovasculares (p. ej., accidente cerebrovascular, ataque isquémico transitorio) en pacientes tratados con olanzapina en comparación con pacientes tratados con placebo. La olanzapina no está aprobada para el tratamiento de pacientes con psicosis relacionada con la demencia. Además, la presencia de factores que podrían disminuir el aclaramiento farmacocinético o aumentar la respuesta farmacodinámica a la olanzapina debe llevar a considerar una dosis inicial más baja para cualquier paciente geriátrico [ver ADVERTENCIA EN CAJA , DOSIFICACIÓN Y ADMINISTRACIÓN , y ADVERTENCIAS Y PRECAUCIONES ].
Los estudios clínicos de ZYPREXA y fluoxetina en combinación no incluyeron un número suficiente de pacientes ≥65 años para determinar si responden de manera diferente a los pacientes más jóvenes.
SOBREDOSIS
Experiencia humana
En ensayos previos a la comercialización que involucraron a más de 3100 pacientes y/o sujetos normales, se identificó una sobredosis aguda accidental o intencional de olanzapina en 67 pacientes. En el paciente que tomó la mayor cantidad identificada, 300 mg, los únicos síntomas informados fueron somnolencia y dificultad para hablar. En el número limitado de pacientes que fueron evaluados en hospitales, incluido el paciente que tomaba 300 mg, no hubo observaciones que indicaran un cambio adverso en los analitos de laboratorio o en el ECG. Los signos vitales generalmente estaban dentro de los límites normales después de una sobredosis.
En informes posteriores a la comercialización de sobredosis con olanzapina sola, se han informado síntomas en la mayoría de los casos. En pacientes sintomáticos, los síntomas con una incidencia ≥10 % incluyeron agitación/agresividad, disartria, taquicardia, diversos síntomas extrapiramidales y reducción del nivel de conciencia que va desde la sedación hasta el coma. Entre los síntomas notificados con menos frecuencia se encuentran las siguientes reacciones potencialmente graves desde el punto de vista médico: aspiración, paro cardiopulmonar, arritmias cardíacas (como taquicardia supraventricular y 1 paciente que experimentó una pausa sinusal con reanudación espontánea del ritmo normal), delirio, posible síndrome neuroléptico maligno, depresión/paro respiratorio , convulsiones, hipertensión e hipotensión. Eli Lilly and Company ha recibido informes de fatalidad en asociación con sobredosis de olanzapina sola. En 1 caso de muerte, se informó que la cantidad de olanzapina ingerida de forma aguda fue posiblemente tan baja como 450 mg de olanzapina oral; sin embargo, en otro caso, se informó que un paciente sobrevivió a una ingestión aguda de olanzapina de aproximadamente 2 g de olanzapina oral.
Manejo de sobredosis
Para obtener información actualizada sobre el manejo de una sobredosis de ZYPREXA (olanzapina), comuníquese con un centro de control de intoxicaciones certificado (1-800-222-1222 o www.poison.org). Debe considerarse la posibilidad de implicación de múltiples fármacos. En caso de sobredosis aguda, establezca y mantenga una vía aérea y asegure una oxigenación y ventilación adecuadas, lo que puede incluir la intubación. Debe considerarse el lavado gástrico (después de la intubación, si el paciente está inconsciente) y la administración de carbón activado junto con un laxante. La administración de carbón activado (1 g) redujo la Cmax y el AUC de la olanzapina oral en aproximadamente un 60 %. Dado que los niveles máximos de olanzapina normalmente no se obtienen hasta aproximadamente 6 horas después de la administración, el carbón vegetal puede ser un tratamiento útil para la sobredosis de olanzapina.
La posibilidad de obnubilación, convulsiones o reacción distónica de la cabeza y el cuello después de una sobredosis puede crear un riesgo de aspiración con emesis inducida. La monitorización cardiovascular debe iniciarse inmediatamente y debe incluir monitorización electrocardiográfica continua para detectar posibles arritmias.
No existe un antídoto específico para la olanzapina. Por lo tanto, se deben iniciar las medidas de apoyo adecuadas. La hipotensión y el colapso circulatorio deben tratarse con medidas adecuadas, como fluidos intravenosos y/o agentes simpaticomiméticos. (No use epinefrina, dopamina u otros simpaticomiméticos con actividad agonista beta, ya que la estimulación beta puede empeorar la hipotensión en el contexto del bloqueo alfa inducido por olanzapina). Se debe continuar con la supervisión y el control médico estricto hasta que el paciente se recupere.
Para obtener información específica sobre la sobredosis con litio o valproato, consulte la sección Sobredosis de los prospectos de estos productos. Para obtener información específica sobre la sobredosis con olanzapina y fluoxetina en combinación, consulte la sección Sobredosis del prospecto de Symbyax.
CONTRAINDICACIONES
- Ninguno con monoterapia con ZYPREXA.
- Cuando use ZYPREXA y fluoxetina en combinación, consulte también la sección Contraindicaciones del prospecto de Symbyax.
- Para obtener información específica sobre las contraindicaciones del litio o el valproato, consulte la sección Contraindicaciones de los prospectos de estos otros productos.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
El mecanismo de acción de la olanzapina, en las indicaciones enumeradas, no está claro. Sin embargo, la eficacia de la olanzapina en la esquizofrenia podría estar mediada por una combinación de antagonismo de dopamina y serotonina tipo 2 (5HT2).
Farmacodinámica
La olanzapina se une con alta afinidad a los siguientes receptores: serotonina 5HT2A/2C, 5HT6 (Ki=4, 11 y 5 nM, respectivamente), dopamina D1-4 (Ki=11-31 nM), histamina H1 (Ki=7 nM ), y receptores adrenérgicos α1 (Ki=19 nM). La olanzapina es un antagonista con afinidad moderada por la serotonina 5HT3 (Ki=57 nM) y muscarínico M1-5 (Ki=73, 96, 132, 32 y 48 nM, respectivamente). La olanzapina se une con poca afinidad a los receptores GABAA, BZD y β-adrenérgicos (Ki>10 μM).
Farmacocinética
Administración Oral, Monoterapia
La olanzapina se absorbe bien y alcanza concentraciones máximas aproximadamente 6 horas después de una dosis oral. Se elimina ampliamente por metabolismo de primer paso, con aproximadamente el 40% de la dosis metabolizada antes de llegar a la circulación sistémica. Los alimentos no afectan la velocidad ni el grado de absorción de la olanzapina. Los estudios farmacocinéticos demostraron que las tabletas de 5 mg de ZYPREXA y las formas de dosificación de olanzapina de ZYPREXA ZYDIS (tabletas de desintegración oral de olanzapina) son bioequivalentes.
La olanzapina muestra una cinética lineal en el rango de dosificación clínica. Su vida media varía de 21 a 54 horas (percentil 5 a 95; media de 30 horas), y el aclaramiento plasmático aparente varía de 12 a 47 l/h (percentil 5 a 95; media de 25 l/h).
La administración de olanzapina una vez al día conduce a concentraciones en estado estacionario en aproximadamente 1 semana que son aproximadamente el doble de las concentraciones después de dosis únicas. Las concentraciones plasmáticas, la vida media y la depuración de la olanzapina pueden variar entre los individuos en función del tabaquismo, el sexo y la edad.
La olanzapina se distribuye ampliamente por todo el cuerpo, con un volumen de distribución de aproximadamente 1000 l. Se une en un 93 % a las proteínas plasmáticas en el rango de concentración de 7 a 1100 ng/ml, uniéndose principalmente a la albúmina y a la glicoproteína ácida α1.
Metabolismo y eliminación
Después de una dosis oral única de olanzapina marcada con 14C, el 7 % de la dosis de olanzapina se recuperó en la orina como fármaco sin cambios, lo que indica que la olanzapina se metaboliza mucho. Aproximadamente el 57 % y el 30 % de la dosis se recuperó en la orina y las heces, respectivamente. En el plasma, la olanzapina representó solo el 12 % del AUC para la radiactividad total, lo que indica una exposición significativa a los metabolitos. Después de dosis múltiples, los principales metabolitos circulantes fueron el 10-N-glucurónido, presente en estado estacionario al 44 % de la concentración de olanzapina, y 4´-N-desmetil olanzapina, presente en estado estacionario al 31 % de la concentración de olanzapina. . Ambos metabolitos carecen de actividad farmacológica a las concentraciones observadas.
La glucuronidación directa y la oxidación mediada por el citocromo P450 (CYP) son las principales vías metabólicas de la olanzapina. Los estudios in vitro sugieren que los CYP 1A2 y 2D6 y el sistema monooxigenasa que contiene flavina están involucrados en la oxidación de la olanzapina. La oxidación mediada por CYP2D6 parece ser una vía metabólica menor in vivo, porque el aclaramiento de olanzapina no se reduce en sujetos con deficiencia de esta enzima.
Administración Intramuscular
ZYPREXA IntraMuscular da como resultado una absorción rápida con concentraciones plasmáticas máximas que ocurren dentro de los 15 a 45 minutos. Basado en un estudio farmacocinético en voluntarios sanos, una dosis de 5 mg de olanzapina intramuscular inyectable produce, en promedio, una concentración plasmática máxima aproximadamente 5 veces mayor que la concentración plasmática máxima producida por una dosis de 5 mg de olanzapina oral. El área bajo la curva que se logra después de una dosis intramuscular es similar a la que se logra después de la administración oral de la misma dosis. La vida media observada después de la administración intramuscular es similar a la observada después de la administración oral. La farmacocinética es lineal en el rango de dosificación clínica. Los perfiles metabólicos tras la administración intramuscular son cualitativamente similares a los perfiles metabólicos tras la administración oral.
Poblaciones Específicas
Insuficiencia renal
Debido a que la olanzapina se metaboliza mucho antes de la excreción y solo el 7% del fármaco se excreta sin cambios, es poco probable que la disfunción renal por sí sola tenga un impacto importante en la farmacocinética de la olanzapina. Las características farmacocinéticas de la olanzapina fueron similares en pacientes con insuficiencia renal grave y sujetos normales, lo que indica que no es necesario ajustar la dosis según el grado de insuficiencia renal. Además, la olanzapina no se elimina por diálisis. No se ha estudiado el efecto de la insuficiencia renal sobre la eliminación de metabolitos.
Deterioro hepático
Aunque cabe esperar que la presencia de insuficiencia hepática reduzca el aclaramiento de la olanzapina, un estudio del efecto de la insuficiencia hepática en sujetos (n=6) con cirrosis clínicamente significativa (Clasificación A y B de Childs Pugh) reveló poco efecto sobre la farmacocinética. de olanzapina.
geriátrico
En un estudio en el que participaron 24 sujetos sanos, la semivida de eliminación media de la olanzapina fue aproximadamente 1,5 veces mayor en los ancianos (≥65 años) que en los no ancianos ( DOSIFICACIÓN Y ADMINISTRACIÓN ].
Género
El aclaramiento de la olanzapina es aproximadamente un 30% menor en mujeres que en hombres. Sin embargo, no hubo diferencias aparentes entre hombres y mujeres en cuanto a la eficacia o los efectos adversos. No deberían ser necesarias modificaciones de dosis basadas en el género.
Estado de tabaquismo
El aclaramiento de olanzapina es alrededor de un 40% mayor en fumadores que en no fumadores, aunque no se recomiendan modificaciones de dosis de forma rutinaria.
La raza
Los estudios in vivo han demostrado que las exposiciones son similares entre japoneses, chinos y caucásicos, especialmente después de la normalización de las diferencias de peso corporal. Por lo tanto, no se recomiendan modificaciones de dosis para la raza.
Efectos Combinados
Los efectos combinados de la edad, el tabaquismo y el sexo podrían dar lugar a diferencias farmacocinéticas sustanciales en las poblaciones. El aclaramiento en varones jóvenes fumadores, por ejemplo, puede ser 3 veces mayor que en mujeres mayores no fumadoras. Puede ser necesario modificar la dosis en pacientes que presenten una combinación de factores que pueden dar lugar a un metabolismo más lento de la olanzapina [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Adolescentes (de 13 a 17 años)
En los estudios clínicos, la mayoría de los adolescentes no fumaban y esta población tenía un peso corporal promedio más bajo, lo que resultó en una exposición promedio más alta a la olanzapina en comparación con los adultos.
Toxicología Animal Y/o Farmacología
En estudios en animales con olanzapina, los principales hallazgos hematológicos fueron citopenias periféricas reversibles en perros individuales que recibieron una dosis de 10 mg/kg (17 veces la MRHD oral diaria basada en mg/m² de área de superficie corporal), disminuciones relacionadas con la dosis en linfocitos y neutrófilos en ratones y linfopenia en ratas. Algunos perros tratados con 10 mg/kg desarrollaron neutropenia reversible y/o anemia hemolítica reversible entre 1 y 10 meses de tratamiento. Se observaron disminuciones relacionadas con la dosis en linfocitos y neutrófilos en ratones que recibieron dosis de 10 mg/kg (igual a 2 veces la MRHD oral diaria basada en mg/m² de área de superficie corporal) en estudios de 3 meses de duración. Se produjo linfopenia inespecífica, consistente con una disminución del aumento de peso corporal, en ratas que recibieron 22,5 mg/kg (11 veces la MRHD oral diaria basada en mg/m² de área de superficie corporal) durante 3 meses o 16 mg/kg (8 veces la MRHD oral diaria basada en en mg/m² de superficie corporal) durante 6 o 12 meses. No se encontró evidencia de citotoxicidad de la médula ósea en ninguna de las especies examinadas. Las médulas óseas eran normocelulares o hipercelulares, lo que indica que las reducciones en las células sanguíneas circulantes probablemente se debieron a factores periféricos (no medulares).
Estudios clínicos
Cuando use ZYPREXA 7.5 mg y fluoxetina en combinación, consulte también la sección Estudios clínicos del prospecto de Symbyax.
Esquizofrenia
Adultos
La eficacia de la olanzapina oral en el tratamiento de la esquizofrenia se estableció en 2 ensayos controlados a corto plazo (6 semanas) de pacientes adultos hospitalizados que cumplían con los criterios del DSM III-R para la esquizofrenia. Se incluyó un solo brazo de haloperidol como tratamiento comparativo en 1 de los 2 ensayos, pero este ensayo no comparó estos 2 fármacos en el rango completo de dosis clínicamente relevantes para ambos.
En estos estudios se utilizaron varios instrumentos para evaluar los signos y síntomas psiquiátricos, entre ellos la Escala Breve de Calificación Psiquiátrica (BPRS), un inventario de múltiples ítems de psicopatología general tradicionalmente utilizado para evaluar los efectos del tratamiento farmacológico en la esquizofrenia. El grupo de psicosis BPRS (desorganización conceptual, comportamiento alucinatorio, suspicacia y contenido de pensamiento inusual) se considera un subconjunto particularmente útil para evaluar a los pacientes esquizofrénicos activamente psicóticos. Una segunda evaluación tradicional, la Impresión Clínica Global (CGI), refleja la impresión de un observador experto, totalmente familiarizado con las manifestaciones de la esquizofrenia, sobre el estado clínico general del paciente. Además, se emplearon 2 escalas desarrolladas más recientemente; estos incluían la Escala de Síntomas Positivos y Negativos (PANSS) de 30 ítems, en la que están integrados los 18 ítems de la BPRS, y la Escala para la Evaluación de Síntomas Negativos (SANS). Los resúmenes de ensayos a continuación se centran en los siguientes resultados: total de PANSS y/o total de BPRS; grupo de psicosis BPRS; subescala negativa de PANSS o SANS; y gravedad CGI. Los resultados de los ensayos son los siguientes:
(1) En un ensayo controlado con placebo de 6 semanas (n=149) que involucró 2 dosis fijas de olanzapina de 1 y 10 mg/día (programa de una vez al día), olanzapina, a 10 mg/día (pero no a 1 mg/día). día), fue superior al placebo en la puntuación total de la PANSS (también en la BPRS total extraída), en el grupo de psicosis de la BPRS, en la subescala negativa de la PANSS y en la gravedad de la CGI.
(2) En un ensayo controlado con placebo de 6 semanas (n=253) que incluyó 3 rangos de dosis fijas de olanzapina (5 ± 2,5 mg/día, 10 ± 2,5 mg/día y 15 ± 2,5 mg/día) en un una vez al día, los 2 grupos de dosis más altas de olanzapina (dosis medias reales de 12 y 16 mg/día, respectivamente) fueron superiores al placebo en la puntuación total de la BPRS, el grupo de psicosis de la BPRS y la puntuación de gravedad CGI; el grupo con la dosis más alta de olanzapina fue superior al placebo en la SANS. No hubo una ventaja clara para el grupo de dosis alta sobre el grupo de dosis media.
(3) En un ensayo a más largo plazo, los pacientes adultos ambulatorios (n = 326) que cumplían predominantemente con los criterios del DSM-IV para la esquizofrenia y que se mantuvieron estables con olanzapina durante el tratamiento abierto durante al menos 8 semanas fueron aleatorizados para continuar con su tratamiento actual con olanzapina. dosis (que oscilan entre 10 y 20 mg/día) o al placebo. El período de seguimiento para observar a los pacientes en busca de recaídas, definido en términos de aumento de los síntomas positivos de BPRS u hospitalización, se planificó para 12 meses; sin embargo, se cumplieron los criterios para detener el ensayo antes de tiempo debido a un exceso de recaídas con placebo en comparación con las recaídas con olanzapina. , y la olanzapina fue superior al placebo en cuanto al tiempo hasta la recaída, el resultado primario de este estudio. Por lo tanto, la olanzapina fue más eficaz que el placebo para mantener la eficacia en pacientes estabilizados durante aproximadamente 8 semanas y seguidos durante un período de observación de hasta 8 meses.
El examen de los subconjuntos de población (raza y género) no reveló ninguna respuesta diferencial sobre la base de estos subgrupos.
Adolescentes
La eficacia de la olanzapina oral en el tratamiento agudo de la esquizofrenia en adolescentes (edades de 13 a 17 años) se estableció en un ensayo aleatorizado, doble ciego, controlado con placebo de 6 semanas de duración de pacientes hospitalizados y ambulatorios con esquizofrenia (n=107) que cumplieron criterios de diagnóstico según DSM-IV-TR y confirmados por Kiddie Schedule for Affective Disorders and Schizophrenia for School Aged Children-Present and Lifetime Version (K-SADS-PL).
El instrumento de calificación principal utilizado para evaluar los signos y síntomas psiquiátricos en este ensayo fue la puntuación total de la versión anclada de la escala breve de calificación psiquiátrica para niños (BPRS-C).
En este ensayo de dosis flexible, la olanzapina de 2,5 a 20 mg/día (dosis modal media de 12,5 mg/día, dosis media de 11,1 mg/día) fue más eficaz que el placebo en el tratamiento de adolescentes diagnosticados con esquizofrenia, según lo respaldan las estadísticas reducción media significativamente mayor en la puntuación total de BPRS-C para los pacientes en el grupo de tratamiento con olanzapina que en el grupo de placebo.
Si bien no hay un cuerpo de evidencia disponible para responder a la pregunta de cuánto tiempo debe mantenerse el paciente adolescente tratado con ZYPREXA, la eficacia de mantenimiento puede extrapolarse a partir de datos de adultos junto con comparaciones de parámetros farmacocinéticos de olanzapina en pacientes adultos y adolescentes. En general, se recomienda que los pacientes que respondan continúen más allá de la respuesta aguda, pero a la dosis más baja necesaria para mantener la remisión. Los pacientes deben ser reevaluados periódicamente para determinar la necesidad de un tratamiento de mantenimiento.
Trastorno bipolar I (episodios maníacos o mixtos)
Adultos
Monoterapia
La eficacia de la olanzapina oral en el tratamiento de episodios maníacos o mixtos se estableció en 2 ensayos controlados con placebo a corto plazo (uno de 3 semanas y otro de 4 semanas) en pacientes adultos que cumplían los criterios del DSM-IV para el trastorno bipolar I con Episodios maníacos o mixtos. Estos ensayos incluyeron pacientes con o sin características psicóticas y con o sin un ciclo rápido.
El principal instrumento de calificación utilizado para evaluar los síntomas maníacos en estos ensayos fue la Young Mania Rating Scale (Y-MRS), una escala calificada por médicos de 11 ítems que tradicionalmente se usa para evaluar el grado de sintomatología maníaca (irritabilidad, comportamiento disruptivo/agresivo, sueño , estado de ánimo elevado, habla, aumento de la actividad, interés sexual, trastorno del lenguaje/pensamiento, contenido del pensamiento, apariencia e introspección) en un rango de 0 (sin características maníacas) a 60 Â (puntuación máxima). El resultado primario en estos ensayos fue el cambio desde el inicio en la puntuación total de la Y-MRS. Los resultados de los ensayos son los siguientes:
(1) En un ensayo controlado con placebo de 3 semanas (n=67) que involucró un rango de dosis de olanzapina (5-20 mg/día, una vez al día, comenzando con 10 mg/día), la olanzapina fue superior al placebo en el reducción de la puntuación total de Y-MRS. En un ensayo de diseño idéntico realizado simultáneamente con el primer ensayo, la olanzapina demostró una diferencia de tratamiento similar, pero posiblemente debido al tamaño de la muestra y la variabilidad del sitio, no se demostró que fuera superior al placebo en este resultado.
(2) En un ensayo controlado con placebo de 4 semanas (n=115) que involucró un rango de dosis de olanzapina (5-20 mg/día, una vez al día, comenzando con 15 mg/día), la olanzapina fue superior al placebo en el reducción de la puntuación total de Y-MRS.
(3) En otro ensayo, 361 pacientes que cumplían con los criterios del DSM-IV para un episodio maníaco o mixto de trastorno bipolar I que habían respondido durante una fase inicial de tratamiento abierto durante aproximadamente 2 semanas, en promedio, a olanzapina 5 a 20 mg/ día se aleatorizaron a la continuación de la olanzapina en la misma dosis (n=225) o al placebo (n=136), para la observación de la recaída. Aproximadamente el 50 % de los pacientes habían interrumpido el tratamiento con olanzapina el día 59 y el 50 % del grupo con placebo habían interrumpido el tratamiento doble ciego el día 23. La respuesta durante la fase abierta se definió por una disminución de la puntuación total de Y-MRS a ≤12 y HAM-D 21 a ≤8. La recaída durante la fase doble ciego se definió como un aumento de la puntuación total de Y-MRS o HAM-D 21 a ≥15, o una hospitalización por manía o depresión. En la fase aleatoria, los pacientes que recibieron olanzapina continua experimentaron un tiempo significativamente mayor hasta la recaída.
Adjunto a litio o valproato
La eficacia de la olanzapina oral con litio o valproato concomitante en el tratamiento de episodios maníacos o mixtos se estableció en 2 ensayos controlados en pacientes que cumplían los criterios del DSM-IV para el trastorno bipolar I con episodios maníacos o mixtos. Estos ensayos incluyeron pacientes con o sin características psicóticas y con o sin un ciclo rápido. Los resultados de los ensayos son los siguientes:
(1) En un ensayo combinado de 6 semanas controlado con placebo, 175 pacientes ambulatorios en tratamiento con litio o valproato con síntomas maníacos o mixtos controlados inadecuadamente (Y-MRS ≥16) fueron aleatorizados para recibir olanzapina o placebo, en combinación con su tratamiento original . Olanzapina (en un rango de dosis de 5-20 mg/día, una vez al día, comenzando con 10 mg/día) combinada con litio o valproato (en un rango terapéutico de 0,6 mEq/L a 1,2 mEq/L o 50 μg/mL a 125 μg/ml, respectivamente) fue superior al litio o al valproato solos en la reducción de la puntuación total de la Y-MRS.
(2) En un segundo ensayo de combinación controlado con placebo de 6 semanas, 169 pacientes ambulatorios en tratamiento con litio o valproato con síntomas maníacos o mixtos controlados inadecuadamente (Y-MRS ≥16) fueron aleatorizados para recibir olanzapina o placebo, en combinación con su tratamiento original. terapia. Olanzapina (en un rango de dosis de 5-20 mg/día, una vez al día, comenzando con 10 mg/día) combinada con litio o valproato (en un rango terapéutico de 0,6 mEq/L a 1,2 mEq/L o 50 μg/mL a 125 μg/ml, respectivamente) fue superior al litio o al valproato solos en la reducción de la puntuación total de la Y-MRS.
Adolescentes
Monoterapia aguda
La eficacia de la olanzapina oral en el tratamiento de los episodios maníacos agudos o mixtos en adolescentes (de 13 a 17 años de edad) se estableció en un ensayo aleatorizado, doble ciego, controlado con placebo, de 3 semanas de duración, de pacientes adolescentes hospitalizados y ambulatorios que cumplieron con los requisitos de diagnóstico. criterios de episodios maníacos o mixtos asociados al trastorno bipolar I (con o sin rasgos psicóticos) según el DSM-IV-TR (n=161). El diagnóstico fue confirmado por el K-SADS-PL.
El instrumento de calificación principal utilizado para evaluar los síntomas maníacos en este ensayo fue la puntuación total de la escala de calificación de manía joven estructurada para adolescentes (Y-MRS).
En este ensayo de dosis flexible, la olanzapina de 2,5 a 20 mg/día (dosis modal media de 10,7 mg/día, dosis media de 8,9 mg/día) fue más eficaz que el placebo en el tratamiento de adolescentes con episodios maníacos o mixtos asociados con trastorno bipolar I trastorno, como lo respalda la reducción media estadísticamente significativamente mayor en la puntuación total de Y-MRS para los pacientes en el grupo de tratamiento con olanzapina que en el grupo de placebo.
Si bien no hay un cuerpo de evidencia disponible para responder a la pregunta de cuánto tiempo debe mantenerse el paciente adolescente tratado con ZYPREXA, la eficacia de mantenimiento puede extrapolarse a partir de datos de adultos junto con comparaciones de parámetros farmacocinéticos de olanzapina en pacientes adultos y adolescentes. En general, se recomienda que los pacientes que respondan continúen más allá de la respuesta aguda, pero a la dosis más baja necesaria para mantener la remisión. Los pacientes deben ser reevaluados periódicamente para determinar la necesidad de un tratamiento de mantenimiento.
Agitación asociada con la esquizofrenia y la manía bipolar I
La eficacia de la inyección intramuscular de olanzapina para el tratamiento de la agitación se estableció en 3 ensayos controlados con placebo a corto plazo (24 horas de tratamiento IM) en pacientes hospitalizados adultos agitados de 2 grupos de diagnóstico: esquizofrenia y trastorno bipolar I (episodios maníacos o mixtos) . Cada uno de los ensayos incluyó un solo brazo de tratamiento con comparador activo de inyección de haloperidol (estudios de esquizofrenia) o inyección de lorazepam (estudio de manía bipolar I). Los pacientes inscritos en los ensayos debían ser: (1) considerados por los investigadores clínicos como clínicamente agitados y candidatos clínicamente apropiados para el tratamiento con medicación intramuscular, y (2) exhibiendo un nivel de agitación que alcanzara o excediera una puntuación de umbral de ≥14 en los 5 ítems que comprenden el Componente Excitado de la Escala del Síndrome Positivo y Negativo (PANSS) (es decir, ítems sobre control de impulsos deficiente, tensión, hostilidad, falta de cooperación y entusiasmo) con al menos 1 puntaje individual de ítem ≥4 utilizando un sistema de puntaje de 1-7 (1= ausente, 4=moderado, 7=extremo). En los estudios, la puntuación inicial media del componente excitado de la PANSS fue de 18,4, con puntuaciones que oscilaban entre 13 y 32 (de una puntuación máxima de 35), lo que sugiere niveles de agitación predominantemente moderados y algunos pacientes experimentaron niveles de agitación leves o graves. La principal medida de eficacia utilizada para evaluar los signos y síntomas de agitación en estos ensayos fue el cambio desde el valor inicial en el componente excitado de la PANSS 2 horas después de la inyección. Los pacientes podían recibir hasta 3 inyecciones durante los períodos de tratamiento IM de 24 horas; sin embargo, los pacientes no podían recibir la segunda inyección hasta después del período inicial de 2 horas cuando se evaluó la medida de eficacia principal. Los resultados de los ensayos son los siguientes:
(1) En un ensayo controlado con placebo en pacientes hospitalizados agitados que cumplían los criterios del DSM-IV para la esquizofrenia (n=270), se evaluaron 4 dosis inyectables de olanzapina intramuscular fija de 2,5 mg, 5 mg, 7,5 mg y 10 mg. Todas las dosis fueron estadísticamente superiores al placebo en el componente excitado de PANSS 2 horas después de la inyección. Sin embargo, el efecto fue mayor y más consistente para las 3 dosis más altas. No hubo diferencias significativas por pares para las dosis de 7,5 y 10 mg sobre la dosis de 5 mg.
(2) En un segundo ensayo controlado con placebo en pacientes hospitalizados agitados que cumplían los criterios del DSM-IV para la esquizofrenia (n=311), se evaluó 1 olanzapina intramuscular fija para inyección en dosis de 10 mg. La olanzapina inyectable fue estadísticamente superior al placebo en el componente excitado de la PANSS 2 horas después de la inyección.
(3) En un ensayo controlado con placebo en pacientes hospitalizados agitados que cumplían los criterios del DSM-IV para el trastorno bipolar I (y que actualmente mostraban un episodio maníaco agudo o mixto con o sin características psicóticas) (n = 201), 1 dosis fija de olanzapina intramuscular para inyección de 10 mg fue evaluado. La olanzapina inyectable fue estadísticamente superior al placebo en el componente excitado de la PANSS 2 horas después de la inyección.
El examen de los subconjuntos de población (edad, raza y género) no reveló ninguna respuesta diferencial sobre la base de estos subgrupos.
INFORMACIÓN DEL PACIENTE
ZYPREXA® (zy-PREX-a) (olanzapina) Tableta
ZYPREXA® ZYDIS® (zy-PREX-a ZY-dis) (olanzapina) Tableta, desintegración oral
Lea la Guía del medicamento que viene con ZYPREXA antes de comenzar a tomarlo y cada vez que renueve su receta. Es posible que haya nueva información. Esta Guía del medicamento no reemplaza la conversación con su médico sobre su condición médica o tratamiento. Hable con su médico o farmacéutico si hay algo que no entiende o si desea obtener más información sobre ZYPREXA.
¿Cuál es la información más importante que debo saber sobre ZYPREXA?
ZYPREXA 20 mg puede causar efectos secundarios graves, que incluyen:
Estos efectos secundarios graves se describen a continuación.
1. Mayor riesgo de muerte en personas mayores que están confundidas, tienen pérdida de memoria y han perdido el contacto con la realidad (psicosis relacionada con la demencia). ZYPREXA no está aprobado para el tratamiento de la psicosis en personas mayores con demencia.
2. Nivel alto de azúcar en la sangre (hiperglucemia). El nivel alto de azúcar en la sangre puede ocurrir si ya tiene diabetes o si nunca ha tenido diabetes. Un nivel alto de azúcar en la sangre podría conducir a:
- una acumulación de ácido en la sangre debido a las cetonas (cetoacidosis)
- coma
- muerte
Su médico debe realizar pruebas para comprobar su nivel de azúcar en sangre antes de empezar a tomar ZYPREXA 7,5 mg y durante el tratamiento. En las personas que no tienen diabetes, a veces el nivel alto de azúcar en la sangre desaparece cuando se interrumpe el tratamiento con ZYPREXA 7.5 mg. Las personas con diabetes y algunas personas que no tenían diabetes antes de tomar ZYPREXA necesitan tomar medicamentos para el nivel alto de azúcar en la sangre incluso después de dejar de tomar ZYPREXA.
Si tiene diabetes, siga las instrucciones de su médico acerca de la frecuencia con la que debe controlar su nivel de azúcar en la sangre mientras toma ZYPREXA.
Llame a su médico si tiene alguno de estos síntomas de nivel alto de azúcar en sangre (hiperglucemia) mientras toma ZYPREXA:
- sentir mucha sed
- necesidad de orinar más de lo normal
- sentir mucha hambre
- sentirse débil o cansado
- sentirse mal del estómago
- se siente confundido o su aliento huele afrutado
3. Altos niveles de grasas en sangre (colesterol y triglicéridos). Los niveles altos de grasa pueden ocurrir en personas tratadas con ZYPREXA 10 mg, especialmente en adolescentes (de 13 a 17 años), o cuando se usa en combinación con fluoxetina en niños (de 10 a 17 años). Es posible que no tenga ningún síntoma, por lo que su médico debe realizar análisis de sangre para controlar sus niveles de colesterol y triglicéridos antes de comenzar a tomar ZYPREXA y durante el tratamiento.
4. Aumento de peso. El aumento de peso es muy común en las personas que toman ZYPREXA. Los adolescentes (de 13 a 17 años) tienen más probabilidades de aumentar de peso y aumentar más de peso que los adultos. Los niños (de 10 a 17 años) también tienen más probabilidades de aumentar de peso que los adultos cuando se usa ZYPREXA 7.5 mg en combinación con fluoxetina. Algunas personas pueden aumentar mucho de peso mientras toman ZYPREXA, por lo que usted y su médico deben controlar su peso con regularidad. Hable con su médico acerca de las formas de controlar el aumento de peso, como seguir una dieta sana y equilibrada y hacer ejercicio.
¿Qué es ZYPREXA®?
ZYPREXA es un medicamento recetado que se usa para tratar:
- esquizofrenia en personas de 13 años o más.
- trastorno bipolar, incluyendo:
- episodios maníacos o mixtos que ocurren con el trastorno bipolar I en personas de 13 años o más.
- episodios maníacos o mixtos que ocurren con el trastorno bipolar I, cuando se usa con el medicamento litio o valproato, en adultos.
- tratamiento a largo plazo del trastorno bipolar I en adultos.
- episodios de depresión que ocurren con el trastorno bipolar I, cuando se usa con el medicamento fluoxetina (Prozac®) en personas de 10 años o más.
- episodios de depresión que no mejoran después de otros 2 medicamentos, también llamada depresión resistente al tratamiento, cuando se usa con el medicamento fluoxetina (Prozac), en adultos.
ZYPREXA 7.5 mg no ha sido aprobado para uso en niños menores de 13 años. ZYPREXA 10 mg en combinación con fluoxetina no ha sido aprobado para uso en niños menores de 10 años.
Los síntomas de la esquizofrenia incluyen escuchar voces, ver cosas que no existen, tener creencias que no son ciertas y desconfiar o retraerse.
Los síntomas del trastorno bipolar I incluyen períodos alternos de depresión y estado de ánimo irritable, aumento de la actividad e inquietud, pensamientos acelerados, hablar rápido, comportamiento impulsivo y disminución de la necesidad de dormir.
Los síntomas de la depresión resistente al tratamiento incluyen disminución del estado de ánimo, disminución del interés, aumento de los sentimientos de culpa, disminución de la energía, disminución de la concentración, cambios en el apetito y pensamientos o conductas suicidas.
Algunos de sus síntomas pueden mejorar con el tratamiento. Si cree que no está mejorando, llame a su médico.
¿Qué debo decirle a mi médico antes de tomar ZYPREXA?
ZYPREXA puede no ser adecuado para usted. Antes de comenzar con ZYPREXA, informe a su médico si tiene o ha tenido:
- problemas del corazón
- convulsiones
- diabetes o niveles altos de azúcar en la sangre (hiperglucemia)
- niveles altos de colesterol o triglicéridos en la sangre
- problemas hepáticos
- presión arterial baja o alta
- accidentes cerebrovasculares o "mini accidentes cerebrovasculares", también llamados ataques isquémicos transitorios (AIT)
- enfermedad de alzheimer
- glaucoma de ángulo estrecho
- próstata agrandada en hombres
- obstrucción intestinal
- fenilcetonuria, porque ZYPREXA 5 mg ZYDIS contiene fenilalanina
- cáncer de mama
- pensamientos de suicidio o de lastimarse a sí mismo
- cualquier otra condición médica
- está embarazada o planea quedar embarazada. No se sabe si ZYPREXA 2.5mg dañará a su bebé por nacer.
- Si queda embarazada mientras recibe ZYPREXA 20 mg, hable con su proveedor de atención médica acerca de registrarse en el Registro Nacional de Embarazo para Antipsicóticos Atípicos. Puede registrarse llamando al 1-866-961-2388 o visitando http://womensmentalhealth.org/clinical-andresearch-programs/pregnancyregistry/.
- está amamantando o planea amamantar. ZYPREXA pasa a la leche materna. Hable con su médico sobre la mejor manera de alimentar a su bebé si toma ZYPREXA.
Informe a su médico si hace mucho ejercicio o está en lugares calurosos con frecuencia.
Los síntomas del trastorno bipolar I, la depresión resistente al tratamiento o la esquizofrenia pueden incluir pensamientos de suicidio o de lastimarse a sí mismo oa otros. Si tiene estos pensamientos en cualquier momento, informe a su médico o vaya a la sala de emergencias de inmediato.
Informe a su médico sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos a base de hierbas. ZYPREXA 20 mg y algunos medicamentos pueden interactuar entre sí y pueden no funcionar tan bien o causar posibles efectos secundarios graves. Su médico puede decirle si es seguro tomar ZYPREXA con sus otros medicamentos. No empiece ni suspenda ningún medicamento mientras esté tomando ZYPREXA sin antes hablar con su médico.
¿Cómo debo tomar ZYPREXA 7,5 mg?
- Tome ZYPREXA exactamente según lo recetado. Es posible que su médico necesite cambiar (ajustar) la dosis de ZYPREXA 15 mg hasta que sea adecuada para usted.
- Si olvida una dosis de ZYPREXA 20 mg, tome la dosis olvidada tan pronto como lo recuerde. Si es casi la hora de la próxima dosis, simplemente omita la dosis olvidada y tome la próxima dosis a la hora habitual. No tome dos dosis de ZYPREXA 10 mg al mismo tiempo.
- Para prevenir efectos secundarios graves, no deje de tomar ZYPREXA repentinamente. Si necesita dejar de tomar ZYPREXA, su médico puede decirle cómo dejar de tomarlo de manera segura.
- Si toma demasiado ZYPREXA, llame a su médico o centro de control de envenenamiento al 1-800-222-1222 de inmediato, o busque tratamiento de emergencia.
- ZYPREXA 10 mg se puede tomar con o sin alimentos.
- Por lo general, ZYPREXA se toma una vez al día.
- Tome ZYPREXA 20 mg ZYDIS de la siguiente manera:
- Asegúrese de que sus manos estén secas.
- Abra el sobre y retire la lámina del blister. No empuje la tableta a través de la lámina.
- Tan pronto como abra el blíster, retire la tableta y colóquela en su boca.
- La tableta se desintegrará rápidamente en su saliva para que pueda tragarla fácilmente con o sin beber líquido.
- Llame a su médico si cree que no está mejorando o si tiene alguna inquietud sobre su condición mientras toma ZYPREXA.
¿Qué debo evitar mientras tomo ZYPREXA?
- ZYPREXA puede causar somnolencia y puede afectar su capacidad para tomar decisiones, pensar con claridad o reaccionar rápidamente. No debe conducir, operar maquinaria pesada ni realizar otras actividades peligrosas hasta que sepa cómo le afecta ZYPREXA 7.5mg.
- Evite beber alcohol mientras toma ZYPREXA. Beber alcohol mientras toma ZYPREXA puede causarle más sueño que si toma ZYPREXA 15 mg solo.
¿Cuáles son los posibles efectos secundarios de ZYPREXA 5 mg?
Pueden ocurrir efectos secundarios graves cuando toma ZYPREXA 5 mg, que incluyen:
- Consulte "¿Cuál es la información más importante que debo saber sobre ZYPREXA?", que describe el mayor riesgo de muerte en personas mayores con psicosis relacionada con la demencia y los riesgos de niveles altos de azúcar en la sangre, niveles altos de colesterol y triglicéridos y aumento de peso.
- Aumento de la incidencia de accidentes cerebrovasculares o "mini accidentes cerebrovasculares" llamados ataques isquémicos transitorios (AIT) en personas mayores con psicosis relacionada con la demencia (personas mayores que han perdido el contacto con la realidad debido a la confusión y la pérdida de memoria). ZYPREXA no está aprobado para estos pacientes.
- Síndrome Neuroléptico Maligno (SNM): El SNM es una afección rara pero muy grave que puede ocurrir en personas que toman medicamentos antipsicóticos, incluido ZYPREXA. El SNM puede causar la muerte y debe tratarse en un hospital. Llame a su médico de inmediato si se enferma gravemente y tiene alguno de estos síntomas:
- fiebre alta
- sudoración excesiva
- músculos rígidos
- confusión
- cambios en la respiración, los latidos del corazón y la presión arterial.
- Reacción a medicamentos con eosinofilia y síntomas sistémicos (DRESS): DRESS puede ocurrir con ZYPREXA. Las características de DRESS pueden incluir sarpullido, fiebre, glándulas inflamadas y otros órganos internos como el hígado, los riñones, los pulmones y el corazón. VESTIR es a veces fatal; por lo tanto, informe a su médico de inmediato si experimenta alguno de estos síntomas.
- Discinesia tardía: Esta condición provoca movimientos corporales que se siguen sucediendo y que no puedes controlar. Estos movimientos suelen afectar a la cara y la lengua. Es posible que la discinesia tardía no desaparezca, incluso si deja de tomar ZYPREXA. También puede comenzar después de dejar de tomar ZYPREXA. Informe a su médico si experimenta algún movimiento corporal que no pueda controlar.
- Disminución de la presión arterial al cambiar de posición, con síntomas de mareos, latidos cardíacos rápidos o lentos, o desmayos.
- Dificultad para tragar, que puede hacer que los alimentos o líquidos entren en los pulmones.
- Convulsiones: informe a su médico si tiene una convulsión durante el tratamiento con ZYPREXA.
- Problemas con el control de la temperatura corporal: Puede tener mucho calor, por ejemplo, cuando hace mucho ejercicio o permanece en un área muy caliente. Es importante que beba agua para evitar la deshidratación. Llame a su médico de inmediato si se enferma gravemente y tiene alguno de estos síntomas de deshidratación:
- sudar demasiado o nada
- boca seca
- sintiendo mucho calor
- sintiendo sed
- incapaz de producir orina.
Los efectos secundarios comunes de ZYPREXA incluyen: falta de energía, boca seca, aumento del apetito, somnolencia, temblores (temblores), heces duras o poco frecuentes, mareos, cambios en el comportamiento o inquietud.
Otros efectos secundarios comunes en adolescentes (13-17 años) incluyen: dolor de cabeza, dolor en el área del estómago (abdominal), dolor en sus brazos o piernas, o cansancio. Los adolescentes experimentaron mayores aumentos de prolactina, enzimas hepáticas y somnolencia, en comparación con los adultos.
Informe a su médico sobre cualquier efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de ZYPREXA. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar ZYPREXA?
- Guarde ZYPREXA a temperatura ambiente, entre 68 °F y 77 °F (20 °C y 25 °C).
- Mantenga ZYPREXA alejado de la luz.
- Mantenga ZYPREXA 15 mg seco y alejado de la humedad.
Mantenga ZYPREXA 5 mg y todos los medicamentos fuera del alcance de los niños.
Información general sobre ZYPREXA
veces, los medicamentos se recetan para fines distintos a los enumerados en la Guía del medicamento. No use ZYPREXA para una condición para la cual no fue recetado. No le dé ZYPREXA 5 mg a otras personas, incluso si tienen la misma afección. Puede que les haga daño.
Esta Guía del medicamento resume la información más importante sobre ZYPREXA. Si desea obtener más información, hable con su médico. Puede pedirle a su médico o farmacéutico información sobre ZYPREXA 20 mg que fue escrita para profesionales de la salud. Para obtener más información sobre ZYPREXA, llame al 1-800-Lilly-Rx (1-800-545-5979).
¿Cuáles son los ingredientes de ZYPREXA?
Ingrediente activo: olanzapina
Ingredientes inactivos:
cera de carnauba, crospovidona, hidroxipropilcelulosa, hipromelosa, lactosa, estearato de magnesio, celulosa microcristalina y otros ingredientes inactivos. El revestimiento de color contiene: dióxido de titanio, laca de aluminio n.° 2 azul FD&C u óxido de hierro rojo sintético.
ZYDIS - gelatina, manitol, aspartamo, metilparabeno de sodio y propilparabeno de sodio.
Esta Guía del medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de EE. UU.
