Gotas para los ojos: Lumigan 3ml Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Lumigan y cómo se usa?
Lumigan 3ml es un medicamento recetado que se usa para tratar los síntomas de la presión intraocular elevada causada por ciertos tipos de glaucoma e hipotricosis de las pestañas. Lumigan se puede usar solo o con otros medicamentos.
Lumigan pertenece a una clase de medicamentos llamados antiglaucoma, agonistas de prostaglandina.
No se sabe si Lumigan es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Lumigan?
Lumigan puede causar efectos secundarios graves que incluyen:
- hinchazón de los ojos,
- enrojecimiento del ojo,
- incomodidad severa en el ojo,
- formación de costras o drenaje del ojo,
- cambios en la visión y
- párpados rojos, hinchados o con picazón
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Lumigan incluyen:
- enrojecimiento de los ojos
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Lumigan. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
LUMIGAN® (solución oftálmica de bimatoprost) 0,03% es un análogo sintético de la prostamida con actividad hipotensora ocular. Su nombre químico es (Z)-7-[(1R,2R,3R,5S)-3,5-Dihidroxi-2[(1E,3S)-3-hidroxi-5-fenil-1-pentenil]ciclopentilo]- 5-N-etilheptenamida, y su peso molecular es 415,58. Su fórmula molecular es C25H37NO4. Su estructura química es:
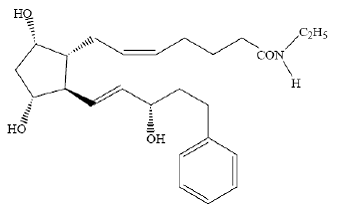
Bimatoprost es un polvo, que es muy soluble en alcohol etílico y alcohol metílico y ligeramente soluble en agua. LUMIGAN® 0.03% es una solución oftálmica estéril, transparente, isotónica e incolora con una osmolalidad de aproximadamente 290 mOsmol/kg.
LUMIGAN® 0,03% contiene Activo: bimatoprost 0,3 mg/mL; Inactivos: cloruro de benzalconio 0,05 mg/mL; cloruro de sodio; fosfato de sodio, dibásico; ácido cítrico; y agua purificada. Se puede agregar hidróxido de sodio y/o ácido clorhídrico para ajustar el pH. El pH durante su vida útil oscila entre 6,8 y 7,8.
INDICACIONES
LUMIGAN® (solución oftálmica de bimatoprost) 0,01% está indicado para la reducción de la presión intraocular elevada en pacientes con glaucoma de ángulo abierto o hipertensión ocular.
DOSIFICACIÓN Y ADMINISTRACIÓN
La dosis recomendada es de una gota en el(los) ojo(s) afectado(s) una vez al día por la noche. LUMIGAN® (solución oftálmica de bimatoprost) al 0,01 % no debe administrarse más de una vez al día, ya que se ha demostrado que la administración más frecuente de análogos de prostaglandinas puede disminuir el efecto reductor de la presión intraocular.
La reducción de la presión intraocular comienza aproximadamente 4 horas después de la primera administración y se alcanza el efecto máximo dentro de aproximadamente 8 a 12 horas.
LUMIGAN® 0.01% se puede usar junto con otros productos farmacéuticos oftálmicos tópicos para reducir la presión intraocular. Si se usa más de un fármaco oftálmico tópico, los fármacos deben administrarse al menos con cinco (5) minutos de diferencia.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Solución oftálmica que contiene bimatoprost 0,1 mg/mL.
almacenamiento y manejo
LUMIGAN® (solución oftálmica de bimatoprost) 0,01% se presenta estéril en frascos dispensadores oftálmicos de polietileno de baja densidad blanco opaco y puntas con tapones de poliestireno turquesa en los siguientes tamaños:
Relleno de 2,5 ml en un recipiente de 5 ml - CDN 0023-3205-03 Relleno de 5 mL en un recipiente de 10 mL - CDN 0023-3205-05 Relleno de 7,5 mL en un recipiente de 10 mL - CDN 0023-3205-08
Almacenamiento: Almacenar a una temperatura de 2°C a 25°C (36°F a 77°F).
Una vez abierto, LUMIGAN® 0,01 % se puede utilizar hasta la fecha de caducidad que figura en el frasco.
Distribuido por: Allergan USA, Inc. Madison, NJ 07940. Revisado: marzo de 2022
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas se describen en otra parte de la etiqueta:
- Pigmentación, incluida la pigmentación de la blefa y la hiperpigmentación del iris [ver ADVERTENCIAS Y PRECAUCIONES ]
- Cambios en las pestañas [ver ADVERTENCIAS Y PRECAUCIONES ]
- Inflamación intraocular [ver ADVERTENCIAS Y PRECAUCIONES ]
- Edema macular [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hipersensibilidad [ver CONTRAINDICACIONES ]
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
En un estudio clínico de 12 meses con soluciones oftálmicas de bimatoprost al 0,01 %, la reacción adversa más frecuente fue la hiperemia conjuntival (31 %). Aproximadamente el 1,6 % de los pacientes interrumpieron el tratamiento debido a hiperemia conjuntival. Otras reacciones adversas a medicamentos (informadas en 1 a 4% de los pacientes) con LUMIGAN® El 0,01 % en este estudio incluyó edema conjuntival, hemorragia conjuntival, irritación ocular, dolor ocular, prurito ocular, eritema palpebral, prurito palpebral, crecimiento de pestañas, hipertricosis, irritación del sitio de instilación, queratitis puntiforme, hiperpigmentación de la piel, visión borrosa y agudeza visual reducido.
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de LUMIGAN® 0,01%. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco. Estas reacciones, que se han elegido para su inclusión debido a su gravedad, frecuencia de notificación, posible conexión causal con LUMIGAN® , o una combinación de estos factores incluyen: síntomas parecidos al asma, mareos, ojo seco, disnea, secreción ocular, edema ocular, sensación de cuerpo extraño, dolor de cabeza, hipersensibilidad, incluidos signos y síntomas de alergia ocular y dermatitis alérgica, hipertensión, aumento del lagrimeo, cambios periorbitarios y palpebrales, incluida la profundización del surco palpebral y fotofobia.
INTERACCIONES CON LA DROGAS
No se proporcionó información
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Pigmentación
Se ha informado que la solución oftálmica de bimatoprost provoca cambios en los tejidos pigmentados. Los cambios informados con mayor frecuencia han sido el aumento de la pigmentación del iris, el tejido periorbitario (párpado) y las pestañas. Se espera que la pigmentación aumente siempre que se administre bimatoprost. El cambio de pigmentación se debe a un mayor contenido de melanina en los melanocitos más que a un aumento en el número de melanocitos. Después de suspender el bimatoprost, es probable que la pigmentación del iris sea permanente, mientras que se ha informado que la pigmentación del tejido periorbitario y los cambios en las pestañas son reversibles en algunos pacientes. Los pacientes que reciben tratamiento deben ser informados de la posibilidad de un aumento de la pigmentación. Se desconocen los efectos a largo plazo del aumento de la pigmentación.
Es posible que el cambio de color del iris no se note durante varios meses o años. Por lo general, la pigmentación marrón alrededor de la pupila se extiende concéntricamente hacia la periferia del iris y todo el iris o partes del iris se vuelven más marrones. Ni los nevos ni las pecas del iris parecen verse afectados por el tratamiento. Si bien el tratamiento con LUMIGAN® (solución oftálmica de bimatoprost) al 0,01 % puede continuarse en pacientes que desarrollan una pigmentación del iris notablemente mayor, estos pacientes deben ser examinados con regularidad.
Cambios de pestañas
LUMIGAN® 0.01% puede cambiar gradualmente las pestañas y el vello del ojo tratado. Estos cambios incluyen mayor longitud, grosor y número de pestañas. Los cambios en las pestañas suelen ser reversibles al suspender el tratamiento.
Inflamación Intraocular
Se ha informado que los análogos de las prostaglandinas, incluido el bimatoprost, causan inflamación intraocular. Además, debido a que estos productos pueden exacerbar la inflamación, se debe tener precaución en pacientes con inflamación intraocular activa (p. ej., uveítis).
Edema macular
Se ha notificado edema macular, incluido edema macular cistoide, durante el tratamiento con solución oftálmica de bimatoprost. LUMIGAN® 0.01% debe usarse con precaución en pacientes afáquicos, en pacientes pseudofáquicos con una cápsula posterior del cristalino desgarrada o en pacientes con factores de riesgo conocidos de edema macular.
queratitis bacteriana
Ha habido informes de queratitis bacteriana asociada con el uso de envases de dosis múltiples de productos oftálmicos tópicos. Estos recipientes habían sido contaminados inadvertidamente por pacientes que, en la mayoría de los casos, tenían una enfermedad corneal concurrente o una alteración de la superficie epitelial ocular.
Uso de lentes de contacto
LUMIGAN® 0,01 % contiene cloruro de benzalconio, que puede ser absorbido por los lentes de contacto blandos y provocar su decoloración. Los lentes de contacto deben retirarse antes de la instilación de LUMIGAN® 0.01% y pueden reinsertarse 15 minutos después de su administración.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Carcinogénesis
Bimatoprost no fue cancerígeno ni en ratones ni en ratas cuando se administró por sonda oral durante 104 semanas en dosis de hasta 2 mg/kg/día y 1 mg/kg/día, respectivamente (192 y 291 veces la exposición sistémica humana estimada a bimatoprost 0,03 % dosificados de forma bilateral una vez al día, respectivamente, en función de los niveles de AUC en sangre)
mutagénesis
Bimatoprost no fue mutagénico ni clastogénico en la prueba de Ames, en la prueba de linfoma de ratón o en las pruebas de micronúcleo de ratón in vivo.
Deterioro de la fertilidad
Bimatoprost no afectó la fertilidad en ratas macho o hembra hasta dosis de 0,6 mg/kg/día (al menos 103 veces la exposición humana recomendada a bimatoprost 0,03% dosificado bilateralmente una vez al día según los niveles de AUC en sangre).
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
No existen estudios adecuados y bien controlados de la administración de LUMIGAN® (solución oftálmica de bimatoprost) al 0,01% en mujeres embarazadas. No hay un aumento en el riesgo de defectos congénitos importantes o abortos espontáneos según la experiencia posterior a la comercialización de bimatoprost.
En estudios de desarrollo embriofetal, la administración de bimatoprost a ratones y ratas embarazadas durante la organogénesis resultó en aborto y parto prematuro en dosis orales de al menos 33 veces (ratones) o 94 veces (ratas) la exposición humana a bimatoprost 0.03% dosificado bilateralmente una vez al día ( basado en los niveles de área de sangre bajo la curva [AUC]). Estos efectos adversos no se observaron a 2,6 veces (ratones) y 47 veces (ratas) la exposición humana a bimatoprost 0,03 % dosificado bilateralmente una vez al día (basado en los niveles de AUC en sangre).
En estudios de desarrollo pre/postnatal, la administración de bimatoprost a ratas preñadas desde la organogénesis hasta el final de la lactancia redujo la duración de la gestación y el peso corporal fetal, y aumentó la mortalidad fetal y de crías en dosis orales de al menos 41 veces la exposición sistémica humana a bimatoprost 0,03 % dosificado bilateralmente una vez al día (basado en los niveles de AUC en sangre). No se observaron efectos adversos en crías de ratas con exposiciones estimadas en 14 veces la exposición humana a bimatoprost al 0,03% dosificado bilateralmente una vez al día (basado en los niveles de AUC en sangre).
Debido a que los estudios de reproducción animal no siempre predicen la respuesta humana, LUMIGAN® 0.01 % debe administrarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto.
Datos
Datos de animales
En un estudio de desarrollo embriofetal en ratas, se observó aborto en ratas preñadas a las que se administró bimatoprost por vía oral durante la organogénesis a 0,6 mg/kg/día (94 veces la exposición sistémica humana a bimatoprost 0,03 % dosificado bilateralmente una vez al día, según el AUC). El nivel sin efectos adversos observados (NOAEL, por sus siglas en inglés) para el aborto fue de 0,3 mg/kg/día (estimado en 47 veces la exposición sistémica humana a bimatoprost al 0,03 % dosificado bilateralmente una vez al día, según el AUC). No se observaron anomalías en fetos de rata a dosis de hasta 0,6 mg/kg/día.
En un estudio de desarrollo embriofetal en ratones, se observaron abortos y partos prematuros en ratones preñados a los que se les administró bimatoprost por vía oral durante la organogénesis en dosis mayores o iguales a 0,3 mg/kg/día (33 veces la exposición sistémica humana a bimatoprost 0,03% dosificado bilateralmente una vez al día, basado en el AUC). El NOAEL para el aborto y el parto prematuro fue de 0,1 mg/kg/día (2,6 veces la exposición sistémica humana a bimatoprost al 0,03 % dosificado bilateralmente una vez al día, según el AUC). No se observaron anomalías en fetos de ratón con dosis de hasta 0,6 mg/kg/día (72 veces la exposición sistémica humana a bimatoprost 0,03 % dosificado bilateralmente una vez al día, según el AUC).
En un estudio de desarrollo pre/postnatal, el tratamiento de ratas preñadas con bimatoprost por vía oral desde el día 7 de gestación hasta el día 20 de lactancia resultó en una reducción de la duración de la gestación, un aumento de las reabsorciones tardías, muertes fetales y mortalidad postnatal de las crías, y una reducción del peso corporal de las crías a dosis superiores a o igual a 0,3 mg/kg/día. Estos efectos se observaron con exposiciones de al menos 41 veces la exposición sistémica humana a bimatoprost al 0,03 % dosificado bilateralmente una vez al día, según el AUC. El NOAEL para el desarrollo posnatal y el apareamiento de las crías fue de 0,1 mg/kg/día (estimado en 14 veces la exposición sistémica humana a bimatoprost al 0,03 % dosificado bilateralmente una vez al día, según el AUC).
Lactancia
Resumen de riesgos
No se sabe si el tratamiento ocular tópico con LUMIGAN® 0.01% podría resultar en una absorción sistémica suficiente para producir cantidades detectables en la leche humana. En estudios con animales, se ha demostrado que el bimatoprost está presente en la leche materna de ratas lactantes a una dosis intravenosa (es decir, 1 mg/kg) 970 veces la RHOD (sobre una base de mg/rn 2); sin embargo, no hay datos disponibles en animales. a dosis clínicamente relevantes.
Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de la madre de LUMIGAN® 0,01 % y cualquier posible efecto adverso en el niño amamantado de LUMIGAN® 0,01 %.
Uso pediátrico
No se recomienda el uso en pacientes pediátricos menores de 16 años debido a posibles problemas de seguridad relacionados con el aumento de la pigmentación después del uso crónico a largo plazo.
Uso geriátrico
No se han observado diferencias clínicas generales en cuanto a seguridad o eficacia entre pacientes de edad avanzada y otros pacientes adultos.
SOBREDOSIS
No hay información disponible sobre sobredosis en humanos. En caso de sobredosis con LUMIGAN® (solución oftálmica de bimatoprost) al 0,01%, el tratamiento debe ser sintomático.
En estudios orales (por sonda) en ratones y ratas, las dosis de hasta 100 mg/kg/día no produjeron ninguna toxicidad. Esta dosis expresada en mg/m2 es al menos 210 veces superior a la dosis accidental de un frasco de LUMIGAN® 0,01% para un niño de 10 kg.
CONTRAINDICACIONES
LUMIGAN® 0.01% está contraindicado en pacientes con hipersensibilidad al bimatoprost o a cualquiera de los ingredientes [ver REACCIONES ADVERSAS ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
El bimatoprost, un análogo de la prostaglandina, es un análogo estructural sintético de la prostaglandina con actividad hipotensora ocular. Imita selectivamente los efectos de las sustancias naturales, las prostamidas. Se cree que el bimatoprost reduce la presión intraocular (PIO) en los seres humanos al aumentar la salida del humor acuoso a través de la red trabecular y las rutas uveoesclerales. La PIO elevada presenta un factor de riesgo importante para la pérdida de campo glaucomatosa. Cuanto mayor sea el nivel de PIO, mayor será la probabilidad de daño del nervio óptico y pérdida del campo visual.
Farmacocinética
Absorción
Después de administrar una gota de solución oftálmica de bimatoprost al 0,03% una vez al día en ambos ojos de 15 sujetos sanos durante dos semanas, las concentraciones en sangre alcanzaron su punto máximo dentro de los 10 minutos posteriores a la administración y estuvieron por debajo del límite inferior de detección (0,025 ng/mL) en la mayoría de los sujetos dentro de 1,5 horas después de la dosificación. Los valores medios de Cmax y AUC0-24hr fueron similares en los días 7 y 14 a aproximadamente 0,08 ng/mL y 0,09 ng•hr/mL, respectivamente, lo que indica que se alcanzó el estado estacionario durante la primera semana de dosificación ocular. No hubo acumulación significativa de fármaco sistémico a lo largo del tiempo.
Distribución
Bimatoprost se distribuye moderadamente en los tejidos corporales con un volumen de distribución en estado estacionario de 0,67 l/kg. En la sangre humana, el bimatoprost reside principalmente en el plasma. Aproximadamente el 12% del bimatoprost permanece libre en el plasma humano.
Eliminación
Metabolismo
El bimatoprost es la principal especie circulante en la sangre una vez que alcanza la circulación sistémica después de la dosificación ocular. Luego, el bimatoprost sufre oxidación, N-desetilación y glucuronidación para formar una variedad diversa de metabolitos.
Excreción
Después de una dosis intravenosa de bimatoprost radiomarcado (3,12 mcg/kg) a seis sujetos sanos, la concentración sanguínea máxima del fármaco inalterado fue de 12,2 ng/ml y disminuyó rápidamente con una vida media de eliminación de aproximadamente 45 minutos. El aclaramiento sanguíneo total de bimatoprost fue de 1,5 l/h/kg. Hasta el 67 % de la dosis administrada se excretó en la orina, mientras que el 25 % de la dosis se recuperó en las heces.
Estudios clínicos
En un estudio clínico de 12 meses de pacientes con glaucoma de ángulo abierto o hipertensión ocular con una PIO inicial promedio de 23,5 mmHg, el efecto reductor de la PIO de LUMIGAN® 0,01 % una vez al día (por la noche) fue de hasta 7,5 mmHg.
INFORMACIÓN DEL PACIENTE
Potencial de pigmentación
Advierta a los pacientes sobre la posibilidad de un aumento de la pigmentación marrón del iris, que puede ser permanente. También informe a los pacientes sobre la posibilidad de oscurecimiento de la piel de los párpados, que puede ser reversible después de la interrupción de LUMIGAN® (solución oftálmica de bimatoprost) al 0,01%.
Potencial de cambios en las pestañas
Informar a los pacientes de la posibilidad de cambios en las pestañas y el vello del ojo tratado durante el tratamiento con LUMIGAN® 0,01%. Estos cambios pueden resultar en una disparidad entre los ojos en cuanto a longitud, grosor, pigmentación, número de pestañas o vellos y/o dirección del crecimiento de las pestañas. Los cambios en las pestañas suelen ser reversibles al suspender el tratamiento.
Manejo del contenedor
Indique a los pacientes que eviten que la punta del recipiente dispensador entre en contacto con el ojo, las estructuras circundantes, los dedos o cualquier otra superficie para evitar la contaminación de la solución por bacterias comunes que se sabe que causan infecciones oculares. El uso de soluciones contaminadas puede provocar daños graves en los ojos y la subsiguiente pérdida de la visión.
Cuándo buscar el consejo de un médico
Aconseje a los pacientes que si desarrollan una afección ocular intercurrente (p. ej., traumatismo o infección), se someten a una cirugía ocular o desarrollan cualquier reacción ocular, en particular conjuntivitis y reacciones en los párpados, deben buscar de inmediato el consejo de su médico sobre el uso continuado de LUMIGAN® 0,01 %. .
Uso de lentes de contacto
Informe a los pacientes que LUMIGAN® 0.01% contiene cloruro de benzalconio, que puede ser absorbido por lentes de contacto blandas. Los lentes de contacto deben retirarse antes de la instilación de LUMIGAN® 0.01% y pueden reinsertarse 15 minutos después de su administración.
Uso con otras drogas oftálmicas
Indique a los pacientes que si se usa más de un fármaco oftálmico tópico, los fármacos deben administrarse al menos cinco (5) minutos entre aplicaciones.
