Propecia 1mg, 5mg Finasteride Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Propecia 1mg y cómo se usa?
Propecia es un medicamento recetado que se usa para tratar los síntomas de la hiperplasia prostática benigna (HPB), la pérdida de cabello de patrón masculino (alopecia androgénica). Propecia puede usarse solo o con otros medicamentos.
Propecia 1 mg pertenece a una clase de medicamentos llamados inhibidores de la 5-alfa-reductasa.
No se sabe si Propecia 1 mg es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Propecia 5mg?
Propecia 1 mg puede causar efectos secundarios graves que incluyen:
- bultos en los senos,
- dolor o sensibilidad en los senos,
- secreción del pezón y
- cualquier otro cambio en los senos
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Propecia 5 mg incluyen:
- pérdida de interés en el sexo,
- impotencia,
- problemas para tener un orgasmo, y
- eyaculación anormal
Informe a su médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Propecia. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
Las tabletas de PROPECIA (finasteride) contienen finasteride como ingrediente activo. La finasterida, un compuesto sintético de 4-azasteroides, es un inhibidor específico de la 5α-reductasa de esteroides tipo II, una enzima intracelular que convierte el andrógeno testosterona en 5α-dihidrotestosterona (DHT).
El nombre químico de la finasterida es N-terc-butil-3-oxo-4-aza-5α-androst-1-ene-17β-carboxamida. La fórmula empírica de la finasterida es C23H36N2O2 y su peso molecular es 372,55. Su fórmula estructural es:
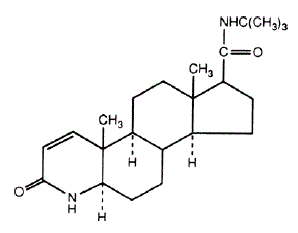
La finasterida es un polvo cristalino blanco con un punto de fusión cercano a los 250°C. Es fácilmente soluble en cloroformo y en disolventes alcohólicos inferiores, pero es prácticamente insoluble en agua.
Los comprimidos de PROPECIA (finasteride) son comprimidos recubiertos con película para administración oral. Cada tableta contiene 1 mg de finasteride y los siguientes ingredientes inactivos: lactosa monohidrato, celulosa microcristalina, almidón pregelatinizado, glicolato de almidón de sodio, hidroxipropilmetilcelulosa, hidroxipropilcelulosa, dióxido de titanio, estearato de magnesio, talco, docusato de sodio, óxido férrico amarillo y férrico rojo. óxido.
INDICACIONES
PROPECIA® está indicado para el tratamiento de la pérdida de cabello de patrón masculino (alopecia androgenética) SOLO EN HOMBRES.
No se ha establecido la eficacia en la recesión bitemporal.
PROPECIA no está indicado para su uso en mujeres.
DOSIFICACIÓN Y ADMINISTRACIÓN
PROPECIA puede administrarse con o sin comidas.
La dosis recomendada de PROPECIA es de un comprimido (1 mg) una vez al día.
En general, es necesario el uso diario durante tres meses o más antes de que se observe el beneficio. Se recomienda el uso continuado para mantener el beneficio, que debe reevaluarse periódicamente. La retirada del tratamiento lleva a la reversión del efecto dentro de los 12 meses.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Los comprimidos de PROPECIA de 5 mg (1 mg) son comprimidos convexos recubiertos con película, octogonales, de color canela, con el logotipo “P estilizado” en un lado y PROPECIA de 5 mg en el otro.
PROPECIA Los comprimidos, 1 mg, son comprimidos convexos recubiertos con película, octogonales, de color canela, con el logotipo “P estilizado” en un lado y PROPECIA en el otro. Se suministran de la siguiente manera:
CDN 78206-152-01 botellas de 30 (con desecante) CDN 78206-152-02 Frascos PROPAK de 90 ® (con desecante).
Almacenamiento y manipulación
Almacenar a temperatura ambiente, 15-30°C (59-86°F). Mantenga el recipiente cerrado y protéjalo de la humedad.
Las mujeres no deben manipular tabletas de PROPECIA trituradas o rotas cuando estén embarazadas o puedan estar embarazadas debido a la posibilidad de absorción de finasterida y el consiguiente riesgo potencial para un feto masculino. Los comprimidos de PROPECIA 5 mg están recubiertos y evitarán el contacto con el ingrediente activo durante la manipulación normal, siempre que los comprimidos no se rompan o trituren [ver ADVERTENCIAS Y PRECAUCIONES , Uso en poblaciones específicas y Información de asesoramiento para pacientes ].
Dist. por: Organon LLC, una subsidiaria de ORGANON & Co., Jersey City, NJ 07302, EE. UU. Revisado: junio de 2021
EFECTOS SECUNDARIOS
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica clínica.
Estudios clínicos para PROPECIA (finasteride 1 mg) en el tratamiento de la pérdida de cabello de patrón masculino
En tres ensayos clínicos controlados de PROPECIA 5 mg de 12 meses de duración, el 1,4 % de los pacientes que tomaban PROPECIA (n=945) interrumpieron el tratamiento debido a experiencias adversas que se consideraron posiblemente, probablemente o definitivamente relacionadas con el fármaco (1,6 % para el placebo; n=934).
Las experiencias adversas clínicas que se informaron como posiblemente, probablemente o definitivamente relacionadas con el medicamento en ≥1 % de los pacientes tratados con PROPECIA o placebo se presentan en la Tabla 1.
TABLA 1: Experiencias adversas relacionadas con el fármaco para PROPECIA (finasteride 1 mg) en el año 1 (%) PÉRDIDA DE CABELLO DE PATRÓN MASCULINO
El análisis integrado de las experiencias adversas clínicas mostró que durante el tratamiento con PROPECIA 1 mg, 36 (3,8 %) de 945 hombres informaron una o más de estas experiencias adversas en comparación con 20 (2,1 %) de 934 hombres tratados con placebo (p=0,04) . La resolución ocurrió en los hombres que descontinuaron la terapia con PROPECIA debido a estos efectos secundarios y en la mayoría de los que continuaron la terapia. La incidencia de cada una de las experiencias adversas anteriores disminuyó a ≤0,3 % al quinto año de tratamiento con PROPECIA.
En un estudio de 1 mg diario de finasterida en hombres sanos, se observó una mediana de disminución en el volumen de eyaculación de 0,3 ml (-11 %) en comparación con 0,2 ml (-8 %) para el placebo después de 48 semanas de tratamiento. Otros dos estudios mostraron que la finasterida en dosis 5 veces mayores que la de PROPECIA (5 mg diarios) produjo disminuciones medias significativas de aproximadamente 0,5 ml (-25 %) en comparación con el placebo en el volumen de eyaculación, pero esto fue reversible después de la interrupción del tratamiento.
En los estudios clínicos con PROPECIA, las incidencias de hipersensibilidad y agrandamiento de las mamas, reacciones de hipersensibilidad y dolor testicular en pacientes tratadas con finasterida no fueron diferentes de las de las pacientes tratadas con placebo.
Ensayos clínicos controlados y estudios abiertos de extensión a largo plazo para PROSCAR® (finasteride 5 mg) y AVODART (dutasteride) en el tratamiento de la hiperplasia prostática benigna
En el Estudio de seguridad y eficacia a largo plazo (PLESS) de PROSCAR, un estudio clínico controlado de 4 años, se evaluó la seguridad de 3040 pacientes entre las edades de 45 y 78 años con HPB sintomática y agrandamiento de la próstata durante un período de 4 años (1524 con PROSCAR 5 mg/día y 1516 con placebo). El 3,7 % (57 pacientes) tratados con PROSCAR 5 mg y el 2,1 % (32 pacientes) tratados con placebo interrumpieron el tratamiento como consecuencia de reacciones adversas relacionadas con la función sexual, que son las reacciones adversas notificadas con mayor frecuencia.
La Tabla 2 presenta las únicas reacciones adversas clínicas consideradas posible, probable o definitivamente relacionadas con el fármaco por el investigador, para las cuales la incidencia en PROSCAR fue ≥1 % y mayor que el placebo durante los 4 años del estudio. En los años 2-4 del estudio, no hubo diferencias significativas entre los grupos de tratamiento en las incidencias de impotencia, disminución de la libido y trastorno de la eyaculación.
TABLA 2: Experiencias adversas relacionadas con el fármaco para PROSCAR (finasteride 5 mg) HIPERPLASIA PROSTÁTICA BENIGNA
Los perfiles de experiencias adversas en los estudios de HPB de Fase III controlados con placebo de 1 año y las extensiones abiertas de 5 años con PROSCAR 5 mg y PLESS fueron similares.
No hay evidencia de un aumento de las experiencias sexuales adversas con una mayor duración del tratamiento con PROSCAR 5 mg. Los nuevos informes de experiencias adversas sexuales relacionadas con los medicamentos disminuyeron con la duración de la terapia.
Durante el estudio de Terapia Médica de Síntomas Prostáticos (MTOPS) controlado con placebo y comparador de 4 a 6 años que inscribió a 3047 hombres, hubo 4 casos de cáncer de mama en hombres tratados con PROSCAR pero ningún caso en hombres no tratados con PROSCAR. Durante el estudio PLESS controlado con placebo de 4 años que inscribió a 3040 hombres, hubo 2 casos de cáncer de mama en hombres tratados con placebo, pero no se informaron casos en hombres tratados con PROSCAR.
Durante el ensayo de prevención del cáncer de próstata (PCPT) controlado con placebo de 7 años que inscribió a 18 882 hombres, hubo 1 caso de cáncer de mama en hombres tratados con PROSCAR y 1 caso de cáncer de mama en hombres tratados con placebo. Actualmente se desconoce la relación entre el uso a largo plazo de finasterida y la neoplasia mamaria masculina.
El ensayo PCPT fue un ensayo aleatorizado, doble ciego, controlado con placebo de 7 años que inscribió a 18 882 hombres sanos ≥ 55 años de edad con un tacto rectal normal y un PSA ≤ 3,0 ng/ml. Los hombres recibieron PROSCAR (finasteride 5 mg) o placebo diariamente. Los pacientes fueron evaluados anualmente con PSA y tacto rectal. Se realizaron biopsias por PSA elevado, un examen rectal digital anormal o el final del estudio. La incidencia de cáncer de próstata con una puntuación de Gleason de 8 a 10 fue mayor en los hombres tratados con finasterida (1,8 %) que en los tratados con placebo (1,1 %). En un ensayo clínico controlado con placebo de 4 años con otro inhibidor de la 5α-reductasa [AVODART (dutasterida)], se observaron resultados similares para el cáncer de próstata con una puntuación de Gleason de 8 a 10 (1 % de dutasterida frente a 0,5 % de placebo). Se desconoce la importancia clínica de estos hallazgos con respecto al uso de PROPECIA en hombres.
No se ha demostrado beneficio clínico en pacientes con cáncer de próstata tratados con PROSCAR. PROSCAR no está aprobado para reducir el riesgo de desarrollar cáncer de próstata.
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de PROPECIA. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco:
Reacción de hipersensibilidad: reacciones de hipersensibilidad como sarpullido, prurito, urticaria y angioedema (incluyendo hinchazón de labios, lengua, garganta y cara);
Sistema reproductivo: disfunción sexual que continuó después de la interrupción del tratamiento, incluida la disfunción eréctil, trastornos de la libido, trastornos de la eyaculación y trastornos del orgasmo; infertilidad masculina y/o calidad seminal deficiente (se ha informado normalización o mejora de la calidad seminal después de la interrupción de la finasterida); dolor testicular; hematospermia.
Neoplasias: cáncer de mama masculino;
Trastornos mamarios: sensibilidad y agrandamiento de los senos;
Sistema Nervioso/Psiquiátrico: depresión
INTERACCIONES CON LA DROGAS
Sistema de enzimas metabolizadoras de fármacos ligadas al citocromo P450
No se han identificado interacciones medicamentosas de importancia clínica. Finasteride no parece afectar el sistema enzimático metabolizador de fármacos ligado al citocromo P450. Los compuestos que se han probado en humanos incluyen antipirina, digoxina, propranolol, teofilina y warfarina y no se encontraron interacciones clínicamente significativas.
Otra terapia concomitante
Aunque no se realizaron estudios de interacción específicos, en estudios clínicos se usaron dosis de finasterida de 1 mg o más concomitantemente con paracetamol, ácido acetilsalicílico, bloqueadores alfa, analgésicos, inhibidores de la enzima convertidora de angiotensina (ECA), anticonvulsivos, benzodiazepinas, bloqueadores beta, calcio. -bloqueadores de canales, nitratos cardíacos, diuréticos, antagonistas H2, inhibidores de la HMG-CoA reductasa, inhibidores de la prostaglandina sintetasa (también denominados AINE) y antiinfecciosos de quinolona sin evidencia de interacciones adversas clínicamente significativas.
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Exposición de las mujeres: riesgo para el feto masculino
PROPECIA no está indicado para su uso en mujeres. Las mujeres no deben manipular tabletas de PROPECIA trituradas o rotas cuando estén embarazadas o puedan estar embarazadas debido a la posibilidad de absorción de finasterida y el consiguiente riesgo potencial para un feto masculino. Las tabletas de PROPECIA están recubiertas y evitarán el contacto con el ingrediente activo durante la manipulación normal, siempre que las tabletas no hayan sido rotas o trituradas. [Ver INDICACIONES Y USO , CONTRAINDICACIONES , Uso en poblaciones específicas , CÓMO SUMINISTRADO / Almacenamiento y manipulación y Información de asesoramiento para pacientes ]
Efectos sobre el antígeno prostático específico (PSA)
En estudios clínicos con PROPECIA (finasteride, 1 mg) en hombres de 18 a 41 años de edad, el valor medio del antígeno prostático específico (PSA) en suero disminuyó de 0,7 ng/mL al inicio a 0,5 ng/mL en el Mes 12. Además, en estudios clínicos con PROSCAR (finasteride, 5 mg) cuando se usa en hombres mayores que tienen hiperplasia prostática benigna (HPB), los niveles de PSA se reducen en aproximadamente un 50 %. Otros estudios con PROSCAR mostraron que también puede causar disminuciones en el PSA sérico en presencia de cáncer de próstata. Estos hallazgos deben tenerse en cuenta para una interpretación adecuada del PSA sérico al evaluar a los hombres tratados con finasterida. Cualquier aumento confirmado desde el valor más bajo de PSA mientras toma PROPECIA puede indicar la presencia de cáncer de próstata y debe evaluarse, incluso si los niveles de PSA aún se encuentran dentro del rango normal para los hombres que no toman un inhibidor de la 5α-reductasa. El incumplimiento del tratamiento con PROPECIA 5 mg también puede afectar los resultados de la prueba de PSA.
Mayor riesgo de cáncer de próstata de alto grado con inhibidores de la 5α-reductasa
Los hombres de 55 años o más con un tacto rectal normal y PSA ≤3,0 ng/mL al inicio del estudio que tomaban 5 mg/día de finasterida (5 veces la dosis de PROPECIA) en el ensayo de prevención del cáncer de próstata (PCPT) de 7 años tenían un mayor riesgo de cáncer de próstata con puntuación de Gleason 8-10 (finasteride 1,8 % frente a placebo 1,1 %). [Ver REACCIONES ADVERSAS ] Se observaron resultados similares en un ensayo clínico controlado con placebo de 4 años con otro inhibidor de la 5α-reductasa (dutasterida, AVODART) (1 % de dutasterida frente a 0,5 % de placebo). Los inhibidores de la 5α-reductasa pueden aumentar el riesgo de desarrollar cáncer de próstata de alto grado. No se ha establecido si el efecto de los inhibidores de la 5α-reductasa para reducir el volumen de la próstata o los factores relacionados con el estudio afectaron los resultados de estos estudios.
Pacientes pediátricos
PROPECIA no está indicado para uso en pacientes pediátricos [ver Uso en poblaciones específicas ].
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( INFORMACIÓN DEL PACIENTE ).
Exposición de las mujeres: riesgo para el feto masculino
Los médicos deben informar a los pacientes que las mujeres embarazadas o que puedan estar embarazadas no deben manipular tabletas de PROPECIA trituradas o rotas debido a la posibilidad de absorción de finasterida y el consiguiente riesgo potencial para un feto masculino. Los comprimidos de PROPECIA de 5 mg están recubiertos y evitarán el contacto con el ingrediente activo durante la manipulación normal, siempre que los comprimidos no se hayan roto o triturado. Si una mujer embarazada o potencialmente embarazada entra en contacto con comprimidos de PROPECIA de 1 mg triturados o partidos, el área de contacto debe lavarse inmediatamente con agua y jabón [ver CONTRAINDICACIONES , ADVERTENCIAS Y PRECAUCIONES , Uso en poblaciones específicas y CÓMO SUMINISTRADO / Almacenamiento y manipulación ].
Mayor riesgo de cáncer de próstata de alto grado
Se debe informar a los pacientes que hubo un aumento en el cáncer de próstata de alto grado en hombres tratados con inhibidores de la 5α-reductasa indicados para el tratamiento de la HPB, en comparación con los tratados con placebo en estudios que analizaron el uso de estos medicamentos para prevenir el cáncer de próstata [ver ADVERTENCIAS Y PRECAUCIONES y REACCIONES ADVERSAS ].
Instrucciones adicionales
Los médicos deben instruir a sus pacientes para que informen de inmediato cualquier cambio en sus senos, como bultos, dolor o secreción del pezón. Se han informado cambios en los senos que incluyen agrandamiento de los senos, sensibilidad y neoplasia [ver REACCIONES ADVERSAS ].
Los médicos deben instruir a sus pacientes para que lean el prospecto del paciente antes de comenzar la terapia con PROPECIA y que lo lean nuevamente cada vez que renueven la receta para que estén al tanto de la información actual para los pacientes con respecto a PROPECIA.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
No se observó evidencia de un efecto tumorigénico en un estudio de 24 meses en ratas Sprague-Dawley que recibieron dosis de finasterida de hasta 160 mg/kg/día en machos y 320 mg/kg/día en hembras. Estas dosis produjeron una exposición sistémica respectiva en ratas de 888 y 2192 veces la observada en humanos que recibieron la dosis humana recomendada de 1 mg/día. Todos los cálculos de exposición se basaron en el AUC calculado (0-24 h) para animales y el AUC medio (0-24 h) para el hombre (0,05 μg•h/mL).
En un estudio de carcinogenicidad de 19 meses en ratones CD-1, se observó un aumento estadísticamente significativo (p≤0,05) en la incidencia de adenomas testiculares de células de Leydig a 1824 veces la exposición humana (250 mg/kg/día). En ratones a 184 veces la exposición humana, estimada (25 mg/kg/día) y en ratas a 312 veces la exposición humana (≥40 mg/kg/día) se observó un aumento en la incidencia de hiperplasia de células de Leydig. Se ha demostrado una correlación positiva entre los cambios proliferativos en las células de Leydig y un aumento en los niveles séricos de LH (2 a 3 veces por encima del control) en ambas especies de roedores tratadas con altas dosis de finasteride. No se observaron cambios en las células de Leydig relacionados con el fármaco en ratas o perros tratados con finasteride durante 1 año a 240 y 2800 veces (20 mg/kg/día y 45 mg/kg/día, respectivamente), o en ratones tratados durante 19 meses a 18,4 veces la exposición humana, estimada (2,5 mg/kg/día).
No se observó evidencia de mutagenicidad en un ensayo de mutagénesis bacteriana in vitro, un ensayo de mutagénesis en células de mamíferos o en un ensayo de elución alcalina in vitro. En un ensayo de aberraciones cromosómicas in vitro, utilizando células de ovario de hámster chino, hubo un ligero aumento en las aberraciones cromosómicas. En un ensayo de aberración cromosómica in vivo en ratones, no se observó un aumento de la aberración cromosómica relacionado con el tratamiento con finasterida a la dosis máxima tolerada de 250 mg/kg/día (1824 veces la exposición humana) según lo determinado en los estudios de carcinogenicidad.
En conejos machos sexualmente maduros tratados con finasteride a 4344 veces la exposición humana (80 mg/kg/día) durante un máximo de 12 semanas, no se observaron efectos sobre la fertilidad, el recuento de espermatozoides o el volumen de eyaculación. En ratas macho sexualmente maduras tratadas con 488 veces la exposición humana (80 mg/kg/día), no hubo efectos significativos sobre la fertilidad después de 6 o 12 semanas de tratamiento; sin embargo, cuando el tratamiento se continuó hasta por 24 o 30 semanas, hubo una disminución aparente en la fertilidad, la fecundidad y una disminución significativa asociada en los pesos de las vesículas seminales y la próstata. Todos estos efectos fueron reversibles dentro de las 6 semanas posteriores a la interrupción del tratamiento. No se han observado efectos relacionados con el fármaco en los testículos o en el apareamiento en ratas o conejos. Esta disminución de la fertilidad en las ratas tratadas con finasterida es secundaria a su efecto sobre los órganos sexuales accesorios (próstata y vesículas seminales), lo que provoca que no se forme un tapón seminal. El tapón seminal es esencial para la fertilidad normal en ratas pero no es relevante en el hombre.
Uso en poblaciones específicas
El embarazo
Embarazo Categoría X [ver CONTRAINDICACIONES ]. PROPECIA 5 mg está contraindicado para su uso en mujeres que están o pueden quedar embarazadas. PROPECIA 5 mg es un inhibidor de la 5α-reductasa tipo II que evita la conversión de testosterona en 5α-dihidrotestosterona (DHT), una hormona necesaria para el desarrollo normal de los genitales masculinos. En estudios con animales, la finasterida provocó un desarrollo anormal de los genitales externos en los fetos masculinos. Si este medicamento se usa durante el embarazo, o si la paciente queda embarazada mientras toma este medicamento, se debe informar a la paciente sobre el peligro potencial para el feto masculino.
El desarrollo genital masculino anormal es una consecuencia esperada cuando los inhibidores de la 5α-reductasa inhiben la conversión de testosterona en 5α-dihidrotestosterona (DHT). Estos resultados son similares a los informados en lactantes varones con deficiencia genética de 5α-reductasa. Las mujeres pueden estar expuestas a la finasterida a través del contacto con tabletas de PROPECIA de 5 mg trituradas o rotas o con el semen de una pareja masculina que toma PROPECIA. Con respecto a la exposición a la finasterida a través de la piel, las tabletas de PROPECIA están recubiertas y evitarán el contacto de la piel con la finasterida durante la manipulación normal si las tabletas no han sido trituradas o rotas. Las mujeres embarazadas o que puedan quedar embarazadas no deben manipular comprimidos de PROPECIA 5 mg triturados o partidos debido a la posible exposición de un feto masculino. Si una mujer embarazada entra en contacto con tabletas de PROPECIA 1 mg trituradas o rotas, el área de contacto debe lavarse inmediatamente con agua y jabón. Con respecto a la posible exposición a la finasterida a través del semen, se realizó un estudio en hombres que recibieron PROPECIA 1 mg/día que midió las concentraciones de finasterida en el semen [ver FARMACOLOGÍA CLÍNICA ].
En un estudio de desarrollo embriofetal, ratas preñadas recibieron finasterida durante el período de mayor organogénesis (días 6 a 17 de gestación). Con dosis maternas de finasteride oral de aproximadamente 1 a 684 veces la dosis humana recomendada (RHD) de 1 mg/día (basado en el AUC en dosis para animales de 0,1 a 100 mg/kg/día) hubo un aumento dependiente de la dosis en hipospadias que ocurrió en 3,6 a 100% de descendencia masculina. Los múltiplos de exposición se estimaron utilizando datos de ratas no preñadas. Los días 16 a 17 de gestación es un período crítico en ratas fetales macho para la diferenciación de los genitales externos. Con dosis maternas orales de aproximadamente 0,2 veces la RHD (basado en el AUC de la dosis para animales de 0,03 mg/kg/día), la descendencia masculina presentó una disminución del peso prostático y de las vesículas seminales, retraso en la separación del prepucio y desarrollo transitorio del pezón. Se produjo una disminución de la distancia anogenital en las crías macho de ratas preñadas que recibieron aproximadamente 0,02 veces la RHD (basado en el AUC de la dosis animal de 0,003 mg/kg/día). No se observaron anomalías en las crías expuestas a ninguna dosis de finasterida en el útero.
No se observaron anomalías del desarrollo en las crías de hembras no tratadas apareadas con ratas macho tratadas con finasterida que recibieron aproximadamente 488 veces la RHD (basado en el AUC de la dosis animal de 80 mg/kg/día). Se observó una ligera disminución de la fertilidad en las crías macho después de la administración de aproximadamente 20 veces la RHD (basado en el AUC de la dosis para animales de 3 mg/kg/día) a ratas hembra durante la última etapa de la gestación y la lactancia. No se observaron efectos sobre la fertilidad en las crías hembras en estas condiciones.
No se observó evidencia de malformaciones genitales externas masculinas u otras anomalías en fetos de conejo expuestos a finasterida durante el período de mayor organogénesis (días 6-18 de gestación) a dosis maternas de hasta 100 mg/kg/día (los niveles de exposición a finasterida no se midieron en conejos). Sin embargo, es posible que este estudio no haya incluido el período crítico para los efectos de la finasterida en el desarrollo de los genitales externos masculinos en el conejo.
Los efectos fetales de la exposición materna a la finasterida durante el período de desarrollo embrionario y fetal se evaluaron en el mono rhesus (días de gestación 20-100), en una especie y un período de desarrollo más predictivo de efectos específicos en humanos que los estudios en ratas y conejos. La administración intravenosa de finasterida a monas preñadas en dosis de hasta 800 ng/día (concentración sanguínea máxima estimada de 1,86 ng/mL o aproximadamente 930 veces la exposición más alta estimada de mujeres embarazadas a finasterida del semen de hombres que toman 1 mg/día) resultó en ninguna anormalidad en los fetos masculinos. En confirmación de la relevancia del modelo rhesus para el desarrollo fetal humano, la administración oral de una dosis de finasterida (2 mg/kg/día o aproximadamente 120 000 veces los niveles sanguíneos más altos estimados de finasterida en el semen de hombres que toman 1 mg/día) para monos preñados resultó en anormalidades genitales externas en fetos machos. No se observaron otras anomalías en los fetos masculinos y no se observaron anomalías relacionadas con la finasterida en los fetos femeninos en cualquier dosis.
Madres lactantes
PROPECIA no está indicado para su uso en mujeres.
No se sabe si la finasterida se excreta en la leche humana.
Uso pediátrico
PROPECIA 1 mg no está indicado para uso en pacientes pediátricos.
No se ha establecido la seguridad y eficacia en pacientes pediátricos.
Uso geriátrico
Los estudios de eficacia clínica con PROPECIA no incluyeron sujetos de 65 años o más. Según la farmacocinética de 5 mg de finasterida, no es necesario ajustar la dosis de PROPECIA en ancianos [ver FARMACOLOGÍA CLÍNICA ]. Sin embargo, no se ha establecido la eficacia de PROPECIA 1 mg en ancianos.
Deterioro hepático
Se debe tener precaución en la administración de PROPECIA 5 mg en aquellos pacientes con anomalías en la función hepática, ya que la finasterida se metaboliza extensamente en el hígado [ver FARMACOLOGÍA CLÍNICA ].
Insuficiencia renal
No es necesario ajustar la dosis en pacientes con insuficiencia renal [ver FARMACOLOGÍA CLÍNICA ].
SOBREDOSIS
En estudios clínicos, las dosis únicas de finasterida de hasta 400 mg y las dosis múltiples de finasterida de hasta 80 mg/día durante tres meses no provocaron reacciones adversas. Hasta que se obtenga más experiencia, no se puede recomendar un tratamiento específico para una sobredosis de finasterida.
Se observó una letalidad significativa en ratones macho y hembra con dosis orales únicas de 1500 mg/m² (500 mg/kg) y en ratas macho y hembra con dosis orales únicas de 2360 mg/m² (400 mg/kg) y 5900 mg/m (1000 mg/kg), respectivamente.
CONTRAINDICACIONES
PROPECIA 5 mg está contraindicado en los siguientes casos:
- El embarazo. El uso de finasteride está contraindicado en mujeres que están o pueden estar potencialmente embarazadas. Debido a la capacidad de los inhibidores de la 5α-reductasa tipo II para inhibir la conversión de testosterona en 5α-dihidrotestosterona (DHT), la finasterida puede causar anomalías en los genitales externos de un feto masculino de una mujer embarazada que recibe finasterida. Si este medicamento se usa durante el embarazo, o si se produce un embarazo mientras se toma este medicamento, se debe informar a la mujer embarazada sobre el peligro potencial para el feto masculino. [Ver ADVERTENCIAS Y PRECAUCIONES , Uso en poblaciones específicas , CÓMO SUMINISTRADO / Almacenamiento y manipulación y Información de asesoramiento para pacientes ] En ratas hembras, las dosis bajas de finasterida administradas durante el embarazo han producido anomalías en los genitales externos de las crías macho.
- Hipersensibilidad a cualquier componente de este medicamento.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
Finasteride es un inhibidor competitivo y específico de la 5α-reductasa tipo II, una enzima intracelular que convierte el andrógeno testosterona en DHT. Dos isoenzimas distintas se encuentran en ratones, ratas, monos y humanos: Tipo I y II. Cada una de estas isoenzimas se expresa diferencialmente en tejidos y etapas de desarrollo. En los seres humanos, la 5α-reductasa tipo I predomina en las glándulas sebáceas de la mayoría de las regiones de la piel, incluido el cuero cabelludo y el hígado. La 5α-reductasa tipo I es responsable de aproximadamente un tercio de la DHT circulante. La isoenzima 5α-reductasa tipo II se encuentra principalmente en la próstata, las vesículas seminales, los epidídimos y los folículos pilosos, así como en el hígado, y es responsable de dos tercios de la DHT circulante.
En humanos, el mecanismo de acción de la finasterida se basa en su inhibición preferencial de la isoenzima Tipo II. Usando tejidos nativos (cuero cabelludo y próstata), los estudios de unión in vitro que examinaron el potencial de la finasterida para inhibir cualquiera de las isoenzimas revelaron una selectividad de 100 veces para la 5α-reductasa humana tipo II sobre la isoenzima tipo I (IC50 = 500 y 4,2 nM para el tipo I). y II, respectivamente). Para ambas isoenzimas, la inhibición por finasterida se acompaña de la reducción del inhibidor a dihidrofinasterida y la formación de aductos con NADP+. El recambio del complejo enzimático es lento (t ½ aproximadamente 30 días para el complejo enzimático Tipo II y 14 días para el complejo Tipo I). La inhibición de la 5α-reductasa tipo II bloquea la conversión periférica de testosterona en DHT, lo que da como resultado disminuciones significativas en las concentraciones de DHT en suero y tejido.
En hombres con pérdida de cabello de patrón masculino (alopecia androgenética), el cuero cabelludo calvo contiene folículos pilosos miniaturizados y mayores cantidades de DHT en comparación con el cuero cabelludo peludo. La administración de finasteride disminuye las concentraciones de DHT en el cuero cabelludo y en suero en estos hombres. No se han definido las contribuciones relativas de estas reducciones al efecto del tratamiento con finasterida. Por este mecanismo, la finasterida parece interrumpir un factor clave en el desarrollo de la alopecia androgenética en aquellos pacientes genéticamente predispuestos.
Farmacodinámica
Finasteride produce una rápida reducción en la concentración sérica de DHT, alcanzando una supresión del 65% dentro de las 24 horas posteriores a la dosificación oral con una tableta de 1 mg. Los niveles circulantes medios de testosterona y estradiol aumentaron aproximadamente un 15 % en comparación con el valor inicial, pero se mantuvieron dentro del rango fisiológico.
Finasteride no tiene afinidad por el receptor de andrógenos y no tiene efectos androgénicos, antiandrogénicos, estrogénicos, antiestrogénicos o progestacionales. En estudios con finasterida, no se detectaron cambios clínicamente significativos en la hormona luteinizante (LH), la hormona estimulante del folículo (FSH) o la prolactina. En voluntarios sanos, el tratamiento con finasteride no alteró la respuesta de LH y FSH a la hormona liberadora de gonadotropina, lo que indica que el eje hipotálamo-pituitario-testicular no se vio afectado.
Finasteride no tuvo efecto sobre los niveles circulantes de cortisol, hormona estimulante de la tiroides o tiroxina, ni afectó el perfil de lípidos plasmáticos (p. ej., colesterol total, lipoproteínas de baja densidad, lipoproteínas de alta densidad y triglicéridos) o la densidad mineral ósea.
Farmacocinética
Absorción
En un estudio en 15 sujetos varones jóvenes sanos, la biodisponibilidad media de las tabletas de 1 mg de finasterida fue del 65 % (rango 26-170 %), según la relación del área bajo la curva (AUC) en relación con una referencia intravenosa (IV). dosis. En el estado estacionario después de la administración de 1 mg/día (n=12), la concentración plasmática máxima de finasterida promedió 9,2 ng/mL (rango, 4,9-13,7 ng/mL) y se alcanzó de 1 a 2 horas después de la dosis; El AUC fue de 53 ng•hr/mL (rango, 20-154 ng•hr/mL). La biodisponibilidad de la finasterida no se vio afectada por los alimentos.
Distribución
El volumen medio de distribución en estado estacionario fue de 76 litros (rango, 44-96 litros; n=15). Aproximadamente el 90% de la finasterida circulante se une a las proteínas plasmáticas. Hay una fase de acumulación lenta para la finasterida después de dosis múltiples.
Se ha descubierto que la finasterida cruza la barrera hematoencefálica.
Se midieron los niveles de semen en 35 hombres que tomaron 1 mg/día de finasterida durante 6 semanas. En el 60 % (21 de 35) de las muestras, los niveles de finasterida fueron indetectables ( Uso en poblaciones específicas ]
Metabolismo
La finasterida se metaboliza ampliamente en el hígado, principalmente a través de la subfamilia de enzimas citocromo P450 3A4. Se han identificado dos metabolitos, los metabolitos monohidroxilados de cadena lateral de t-butilo y ácido monocarboxílico, que no poseen más del 20 % de la actividad inhibidora de la 5α-reductasa de la finasterida.
Excreción
Después de la infusión intravenosa en sujetos jóvenes sanos (n=15), el aclaramiento plasmático medio de finasterida fue de 165 ml/min (rango, 70-279 ml/min). La vida media terminal media en plasma fue de 4,5 horas (rango, 3,3-13,4 horas; n=12). Después de una dosis oral de 14C-finasterida en humanos (n=6), una media del 39 % (rango, 32-46 %) de la dosis se excretó en la orina en forma de metabolitos; El 57% (rango, 51-64%) se excretó en las heces.
La vida media terminal promedio es de aproximadamente 5 a 6 horas en hombres de 18 a 60 años y de 8 horas en hombres mayores de 70 años.
TABLA 3: Parámetros farmacocinéticos medios (DE) en hombres sanos (de 18 a 26 años)
TABLA 4: Parámetros farmacocinéticos no compartimentales medios (DE) después de dosis múltiples de 1 mg/día en hombres sanos (de 19 a 42 años)
Insuficiencia renal
No es necesario ajustar la dosis en pacientes con insuficiencia renal. En pacientes con insuficiencia renal crónica, con aclaramientos de creatinina que oscilan entre 9,0 y 55 ml/min, el AUC, la concentración plasmática máxima, la vida media y la unión a proteínas después de una dosis única de 14C-finasterida fueron similares a los obtenidos en voluntarios sanos. La excreción urinaria de metabolitos disminuyó en pacientes con insuficiencia renal. Esta disminución se asoció con un aumento en la excreción fecal de metabolitos. Las concentraciones plasmáticas de metabolitos fueron significativamente más altas en pacientes con insuficiencia renal (basado en un aumento del 60 % en el AUC de radiactividad total). Sin embargo, la finasterida ha sido tolerada en hombres con función renal normal que recibieron hasta 80 mg/día durante 12 semanas, donde la exposición de estos pacientes a los metabolitos sería presumiblemente mucho mayor.
Deterioro hepático
No se ha estudiado el efecto de la insuficiencia hepática sobre la farmacocinética de la finasterida. Se debe tener precaución en la administración de PROPECIA 1 mg en pacientes con anomalías en la función hepática, ya que la finasterida se metaboliza extensamente en el hígado.
Estudios clínicos
Estudios en hombres
La eficacia de PROPECIA 1 mg se demostró en hombres (88% caucásicos) con alopecia androgenética leve a moderada (pérdida de cabello de patrón masculino) entre 18 y 41 años de edad. Para prevenir la dermatitis seborreica que podría confundir la evaluación del crecimiento del cabello en estos estudios, se indicó a todos los hombres, ya fueran tratados con finasteride o placebo, que usaran un champú medicado específico a base de alquitrán (Neutrogena T/Gel® Shampoo) durante el tratamiento. los 2 primeros años de la carrera.
Hubo tres estudios doble ciego, aleatorizados, controlados con placebo de 12 meses de duración. Los dos criterios de valoración principales fueron el recuento de cabello y la autoevaluación del paciente; los dos criterios de valoración secundarios fueron la evaluación del investigador y las calificaciones de las fotografías. Además, se recopiló información sobre la función sexual (basada en un cuestionario autoadministrado) y el crecimiento del vello corporal fuera del cuero cabelludo. Los tres estudios se realizaron en 1879 hombres con pérdida de cabello de leve a moderada, pero no completa. Dos de los estudios reclutaron a hombres con pérdida de cabello en el vértice predominantemente de leve a moderada (n = 1553). El tercero inscribió a hombres que tenían pérdida de cabello de leve a moderada en el área anterior del cuero cabelludo medio con o sin calvicie en el vértice (n = 326).
Estudios en hombres con calvicie de vértice
De los hombres que completaron los primeros 12 meses de los dos ensayos de calvicie de vértice, 1215 optaron por continuar en estudios de extensión de 12 meses, doble ciego, controlados con placebo. Hubo 547 hombres que recibieron PROPECIA 5 mg tanto para el estudio inicial como para los primeros períodos de extensión (hasta 2 años de tratamiento) y 60 hombres que recibieron placebo durante los mismos períodos. Los estudios de extensión continuaron durante 3 años adicionales, con 323 hombres con PROPECIA 5 mg y 23 con placebo que ingresaron al quinto año del estudio.
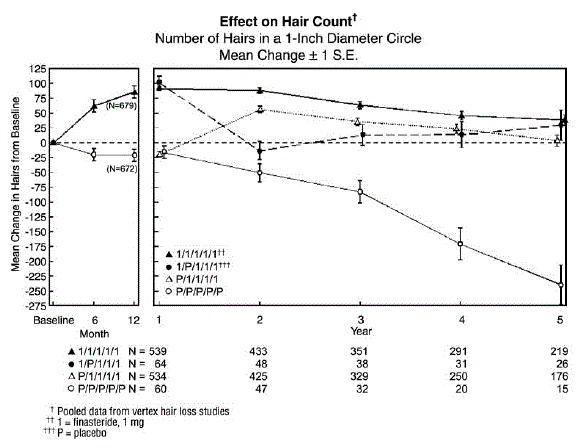
Para evaluar el efecto de la interrupción de la terapia, hubo 65 hombres que recibieron PROPECIA 5 mg durante los primeros 12 meses seguidos de placebo en el primer período de extensión de 12 meses. Algunos de estos hombres continuaron en estudios de extensión adicionales y volvieron al tratamiento con PROPECIA 5 mg, con 32 hombres ingresando al quinto año del estudio. Por último, hubo 543 hombres que recibieron placebo durante los primeros 12 meses seguidos de PROPECIA en el primer período de extensión de 12 meses. Algunos de estos hombres continuaron en estudios de extensión adicionales recibiendo PROPECIA 5 mg, con 290 hombres ingresando al quinto año del estudio (ver la Figura 1 a continuación).
Los recuentos de cabello se evaluaron mediante ampliaciones fotográficas de un área representativa de pérdida activa de cabello. En estos dos estudios en hombres con calvicie de vértice, se demostraron aumentos significativos en el recuento de cabello a los 6 y 12 meses en hombres tratados con PROPECIA 5 mg, mientras que se demostró una pérdida significativa de cabello desde el inicio en aquellos tratados con placebo. A los 12 meses hubo una diferencia de 107 cabellos con respecto al placebo (p
Los pacientes que cambiaron de placebo a PROPECIA (n=425) tuvieron una disminución en el recuento de cabello al final del período inicial de 12 meses con placebo, seguido de un aumento en el recuento de cabello después de 1 año de tratamiento con PROPECIA. Este aumento en el número de cabellos fue menor (56 cabellos por encima del valor inicial original) que el aumento (91 cabellos por encima del valor inicial original) observado después de 1 año de tratamiento en hombres inicialmente asignados al azar a PROPECIA. Aunque el aumento en el recuento de cabello, en relación con el momento en que se inició la terapia, fue comparable entre estos dos grupos, se logró un recuento absoluto de cabello más alto en los pacientes que comenzaron el tratamiento con PROPECIA en el estudio inicial. Esta ventaja se mantuvo durante los 3 años restantes de los estudios. Un cambio de tratamiento de PROPECIA 5 mg a placebo (n=48) al final de los primeros 12 meses dio como resultado la reversión del aumento en el recuento de cabello 12 meses después, a los 24 meses (consulte la Figura 1 a continuación).
los 12 meses, el 58 % de los hombres en el grupo de placebo tenían más pérdida de cabello (definida como cualquier disminución en el recuento de cabello desde el inicio), en comparación con el 14 % de los hombres tratados con PROPECIA. En los hombres tratados durante un máximo de 2 años, el 72 % de los hombres en el grupo de placebo demostraron pérdida de cabello, en comparación con el 17 % de los hombres tratados con PROPECIA. A los 5 años, el 100 % de los hombres en el grupo de placebo demostraron pérdida de cabello, en comparación con el 35 % de los hombres tratados con PROPECIA.
Figura 1
La autoevaluación del paciente se obtuvo en cada visita a la clínica a partir de un cuestionario autoadministrado, que incluía preguntas sobre su percepción del crecimiento del cabello, la pérdida del cabello y la apariencia. Esta autoevaluación demostró un aumento en la cantidad de cabello, una disminución en la pérdida de cabello y una mejoría en la apariencia de los hombres tratados con PROPECIA. La mejora general en comparación con el placebo se observó a los 3 meses (p
La evaluación del investigador se basó en una escala de 7 puntos que evaluaba los aumentos o disminuciones del cabello del cuero cabelludo en cada visita del paciente. Esta evaluación mostró aumentos significativamente mayores en el crecimiento del cabello en los hombres tratados con PROPECIA en comparación con el placebo a los 3 meses (p
Un panel independiente evaluó fotografías estandarizadas de la cabeza de manera ciega en función de los aumentos o disminuciones del cabello del cuero cabelludo utilizando la misma escala de 7 puntos que la evaluación del investigador. A los 12 meses, el 48 % de los hombres tratados con PROPECIA tuvo un aumento en comparación con el 7 % de los hombres tratados con placebo. A los 2 años, se demostró un aumento en el crecimiento del cabello en el 66 % de los hombres tratados con PROPECIA 5 mg, en comparación con el 7 % de los hombres tratados con placebo. A los 5 años, el 48 % de los hombres tratados con PROPECIA 5 mg demostraron un aumento en el crecimiento del cabello, se calificó que el 42 % no tenía cambios (sin progresión visible adicional de la pérdida de cabello desde el inicio) y el 10 % se calificó con pérdida de cabello en comparación con base. En comparación, el 6 % de los hombres tratados con placebo demostraron un aumento en el crecimiento del cabello, el 19 % no tuvo cambios y el 75 % perdió cabello en comparación con la línea de base.
Un estudio controlado con placebo de 48 semanas de duración diseñado para evaluar mediante fototricograma el efecto de PROPECIA en el vello total y en crecimiento activo (anágeno) del cuero cabelludo en casos de calvicie de vértice inscribió a 212 hombres con alopecia androgenética. Al inicio y a las 48 semanas, se obtuvieron recuentos de cabello total y anágeno en un área objetivo de 1 cm² del cuero cabelludo. Los hombres tratados con PROPECIA mostraron aumentos desde el inicio en el recuento de cabello total y anágeno de 7 cabellos y 18 cabellos, respectivamente, mientras que los hombres tratados con placebo tuvieron disminuciones de 10 cabellos y 9 cabellos, respectivamente. Estos cambios en el recuento de cabellos dieron como resultado una diferencia entre grupos de 17 cabellos en el recuento total de cabellos (p
Otros resultados en estudios de calvicie de vértice
Los pacientes que participaron en los dos ensayos de calvicie de vértice se autoadministraron un cuestionario de función sexual para detectar cambios más sutiles en la función sexual. En el Mes 12, se encontraron diferencias estadísticamente significativas a favor del placebo en 3 de 4 dominios (interés sexual, erecciones y percepción de problemas sexuales). Sin embargo, no se observaron diferencias significativas en la pregunta sobre la satisfacción general con la vida sexual.
En uno de los dos estudios de calvicie de vértice, se preguntó a los pacientes sobre el crecimiento del vello corporal fuera del cuero cabelludo. PROPECIA no pareció afectar el vello corporal fuera del cuero cabelludo.
Estudio en hombres con pérdida de cabello en el área anterior del cuero cabelludo medio
Un estudio de 12 meses de duración, diseñado para evaluar la eficacia de PROPECIA 5 mg en hombres con pérdida de cabello en la parte anterior del cuero cabelludo medio, también demostró aumentos significativos en el recuento de cabello en comparación con el placebo. Los aumentos en el recuento de cabello estuvieron acompañados de mejoras en la autoevaluación del paciente, la evaluación del investigador y las calificaciones basadas en fotografías estandarizadas. Los conteos de cabello se obtuvieron en el área anterior del cuero cabelludo medio y no incluyeron el área de recesión bitemporal o la línea anterior del cabello.
Resumen de estudios clínicos en hombres
Los estudios clínicos se realizaron en hombres de 18 a 41 años con grados leves a moderados de alopecia androgenética. Todos los hombres tratados con PROPECIA 5 mg o placebo recibieron un champú a base de alquitrán (Neutrogena T/Gel® Shampoo) durante los primeros 2 años de los estudios. La mejoría clínica se observó tan pronto como a los 3 meses en los pacientes tratados con PROPECIA 5 mg y condujo a un aumento neto en el recuento de cabello en el cuero cabelludo y en la regeneración del cabello. En estudios clínicos de hasta 5 años, el tratamiento con PROPECIA 5 mg desaceleró la progresión adicional de la pérdida de cabello observada en el grupo de placebo. En general, la diferencia entre los grupos de tratamiento siguió aumentando a lo largo de los 5 años de los estudios.
Análisis étnico de datos clínicos de hombres
En un análisis combinado de los dos estudios sobre la calvicie de vértice, los cambios medios en el recuento de cabello desde el inicio fueron 91 frente a -19 cabellos (PROPECIA 5 mg frente a placebo) entre los caucásicos (n=1185), 49 frente a -27 cabellos entre los negros (n=84) , 53 vs -38 cabellos entre asiáticos (n=17), 67 vs 5 cabellos entre hispanos (n=45) y 67 vs -15 cabellos entre otros grupos étnicos (n=20). La autoevaluación de los pacientes mostró una mejoría en todos los grupos raciales con el tratamiento con PROPECIA, excepto por la satisfacción de la línea frontal del cabello y el vértice en los hombres negros, que estaban satisfechos en general.
estudiar en mujeres
En un estudio en el que participaron 137 mujeres posmenopáusicas con alopecia androgenética que fueron tratadas con PROPECIA (n=67) o placebo (n=70) durante 12 meses, no se pudo demostrar la eficacia. No hubo mejoría en el conteo de cabello, la autoevaluación del paciente, la evaluación del investigador o las calificaciones de fotografías estandarizadas en las mujeres tratadas con PROPECIA en comparación con el grupo de placebo [ver INDICACIONES Y USO ].
INFORMACIÓN DEL PACIENTE
PROPECIA (Pro-pee-sha) (finasterida) Tabletas
PROPECIA® es para uso exclusivo de HOMBRES y NO debe ser utilizado por mujeres o niños.
Lea esta información para el paciente antes de comenzar a tomar PROPECIA 5 mg y cada vez que renueve su receta. Es posible que haya nueva información. Esta información no reemplaza la conversación con su proveedor de atención médica sobre su condición médica o tratamiento.
¿Qué es PROPECIA 5mg?
PROPECIA 5 mg es un medicamento recetado que se usa para el tratamiento de la pérdida de cabello de patrón masculino (alopecia androgenética).
No se sabe si PROPECIA 5 mg funciona para la entrada de cabello a ambos lados y arriba de la frente (área temporal).
PROPECIA 5 mg no es para uso de mujeres y niños.
¿Quién no debe tomar PROPECIA 5mg?
No tome PROPECIA 1 mg si usted:
- está embarazada o puede quedar embarazada. PROPECIA puede dañar a su bebé por nacer.
- Los comprimidos de PROPECIA de 1 mg están recubiertos y evitarán el contacto con el medicamento durante su manipulación, siempre que los comprimidos no se rompan o trituren. Las mujeres embarazadas o que puedan quedar embarazadas no deben entrar en contacto con tabletas de PROPECIA rotas o trituradas. Si una mujer embarazada entra en contacto con tabletas de PROPECIA 5 mg trituradas o rotas, lave el área de contacto de inmediato con agua y jabón. Si una mujer embarazada entra en contacto con el ingrediente activo de PROPECIA 5 mg, se debe consultar a un proveedor de atención médica.
- Si una mujer que está embarazada de un bebé varón traga o entra en contacto con el medicamento de PROPECIA, el bebé varón puede nacer con órganos sexuales que no son normales.
- es alérgico a alguno de los ingredientes de PROPECIA. Consulte el final de este folleto para obtener una lista completa de los ingredientes de PROPECIA.
¿Qué debo decirle a mi proveedor de atención médica antes de tomar PROPECIA 5 mg?
Antes de tomar PROPECIA 5mg, informe a su proveedor de atención médica si usted:
- tiene otras afecciones médicas, incluidos problemas con la próstata o el hígado
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos herbales.
Conozca los medicamentos que toma. Mantenga una lista de ellos para mostrársela a su proveedor de atención médica y farmacéutico cuando obtenga un nuevo medicamento.
¿Cómo debo tomar PROPECIA 5mg?
- Tome PROPECIA 5 mg exactamente como se lo indique su proveedor de atención médica.
- Puede tomar PROPECIA 5 mg con o sin alimentos.
- Si olvidó tomar PROPECIA 1 mg, no tome un comprimido extra. Tome el siguiente comprimido como de costumbre.
PROPECIA no funcionará más rápido ni mejor si lo toma más de una vez al día.
¿Cuáles son los posibles efectos secundarios de PROPECIA?
- disminución de los niveles de antígeno prostático específico (PSA) en sangre. PROPECIA puede afectar a un análisis de sangre llamado PSA (antígeno prostático específico) para la detección del cáncer de próstata. Si se realiza una prueba de PSA, debe informar a su proveedor de atención médica que está tomando PROPECIA porque PROPECIA 1 mg disminuye los niveles de PSA. Los cambios en los niveles de PSA deberán ser evaluados por su proveedor de atención médica. Cualquier aumento en los niveles de PSA de seguimiento desde su punto más bajo puede indicar la presencia de cáncer de próstata y debe evaluarse, incluso si los resultados de la prueba todavía están dentro del rango normal para los hombres que no toman PROPECIA. También debe informar a su proveedor de atención médica si no ha estado tomando PROPECIA 1 mg según lo prescrito porque esto puede afectar los resultados de la prueba de PSA. Para obtener más información, hable con su proveedor de atención médica.
- Puede haber un mayor riesgo de una forma más grave de cáncer de próstata en los hombres que toman finasterida en una dosis 5 veces superior a la de PROPECIA.
Los efectos secundarios más comunes de PROPECIA incluyen:
- disminución del deseo sexual
- problemas para conseguir o mantener una erección
- una disminución en la cantidad de semen
Se ha informado lo siguiente en uso general con PROPECIA:
- sensibilidad y agrandamiento de los senos. Informe a su proveedor de atención médica sobre cualquier cambio en sus senos, como bultos, dolor o secreción del pezón.
- depresión;
- disminución del deseo sexual que continuó después de suspender el medicamento;
- reacciones alérgicas que incluyen sarpullido, picazón, urticaria e hinchazón de los labios, la lengua, la garganta y la cara;
- problemas con la eyaculación que continuaron después de suspender la medicación;
- dolor testicular;
- sangre en el semen;
- dificultad para lograr una erección que continuó después de suspender el medicamento;
- infertilidad masculina y/o mala calidad del semen.
- en casos raros, cáncer de mama masculino.
Informe a su proveedor de atención médica si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de PROPECIA. Para obtener más información, consulte a su proveedor de atención médica o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo conservar PROPECIA 1mg?
- Guarde PROPECIA 5 mg a temperatura ambiente, entre 15 °C y 30 °C (59 °F y 86 °F).
- Mantenga PROPECIA en un recipiente cerrado y mantenga los comprimidos de PROPECIA de 5 mg secos (protegidos de la humedad).
Mantenga PROPECIA y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de PROPECIA.
A veces, los medicamentos se recetan para fines distintos a los enumerados en este prospecto de información para el paciente. No use PROPECIA 5 mg para una condición para la cual no fue recetado. No le dé PROPECIA a otras personas, incluso si tienen los mismos síntomas que usted tiene. Puede que les haga daño.
Este folleto de información para el paciente resume la información más importante sobre PROPECIA. Si desea obtener más información, hable con su proveedor de atención médica. Puede pedirle a su farmacéutico o proveedor de atención médica información sobre PROPECIA escrita para profesionales de la salud. Para obtener más información, llame al 1-844-674-3200.
¿Cuáles son los ingredientes de PROPECIA 1mg?
Principio activo: finasterida.
Ingredientes inactivos: lactosa monohidrato, celulosa microcristalina, almidón pregelatinizado, glicolato de almidón de sodio, hidroxipropilmetilcelulosa, hidroxipropilcelulosa, dióxido de titanio, estearato de magnesio, talco, docusato de sodio, óxido férrico amarillo y óxido férrico rojo.
Esta información para el paciente ha sido aprobada por la Administración de Drogas y Alimentos de los Estados Unidos.
