Zanaflex 2mg, 4mg Tizanidine Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Zanaflex 2 mg y cómo se usa?
Zanaflex 2 mg es un medicamento recetado que se usa para tratar los síntomas de rigidez muscular (espasticidad) asociados con afecciones como la parálisis cerebral u otros trastornos neurológicos. Zanaflex 2 mg se puede usar solo o con otros medicamentos.
Zanaflex 2 mg pertenece a una clase de medicamentos llamados agonistas alfa-2-adrenérgicos centrales.
No se sabe si Zanaflex es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Zanaflex?
Zanaflex 2 mg puede causar efectos secundarios graves, que incluyen:
- presión arterial baja,
- pruebas de función hepática anormales,
- somnolencia,
- alucinaciones,
- somnolencia excesiva,
- ritmo cardíaco lento,
- boca seca,
- cansancio, y
- debilidad
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Zanaflex incluyen:
- boca seca,
- cansancio,
- debilidad,
- fatiga,
- cansancio,
- mareo,
- infección del tracto urinario,
- estreñimiento,
- pruebas de función hepática anormales,
- vómitos,
- desorden del habla,
- ojo vago (ambliopía),
- frecuencia urinaria,
- sintomas de gripe,
- movimientos musculares descontrolados,
- nerviosismo,
- dolor de garganta, y
- nariz que moquea
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Zanaflex. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
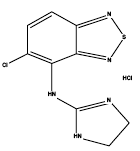
Zanaflex® (clorhidrato de tizanidina) es un agonista alfa2-adrenérgico central. El clorhidrato de tizanidina es un polvo cristalino fino de color blanco a blanquecino, inodoro o con un ligero olor característico. La tizanidina es ligeramente soluble en agua y metanol; la solubilidad en agua disminuye a medida que aumenta el pH. Su nombre químico es monoclorhidrato de 5-cloro-4-(2-imidazolin-2-ilamino)-2,1,3-benzotiadiazol. La fórmula molecular de la tizanidina es C9H8ClN5S-HCl, su peso molecular es 290,2 y su fórmula estructural es:
Zanaflex 4mg Capsules® se suministra en cápsulas de 2, 4 y 6 mg para administración oral. Zanaflex Capsules® contiene el ingrediente activo, clorhidrato de tizanidina (2,29 mg equivalentes a 2 mg de tizanidina base, 4,58 mg equivalentes a 4 mg de tizanidina base y 6,87 mg equivalentes a 6 mg de tizanidina base) y los ingredientes inactivos, hipromelosa, dióxido de silicio, esferas de azúcar, dióxido de titanio, gelatina y colorantes.
Los comprimidos de Zanaflex® se suministran en comprimidos de 4 mg para administración oral. Los comprimidos de Zanaflex® contienen el ingrediente activo, clorhidrato de tizanidina (4,58 mg equivalentes a 4 mg de base de tizanidina), y los ingredientes inactivos, dióxido de silicio coloidal, ácido esteárico, celulosa microcristalina y lactosa anhidra.
INDICACIONES
Zanaflex está indicado para el manejo de la espasticidad. Debido a la corta duración del efecto terapéutico, el tratamiento con Zanaflex debe reservarse para aquellas actividades diarias y momentos en los que el alivio de la espasticidad es más importante [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
DOSIFICACIÓN Y ADMINISTRACIÓN
Información de dosificación
Zanaflex 2mg Capsules® o Zanaflex® comprimidos se pueden recetar con o sin alimentos. Una vez seleccionada la formulación y tomada la decisión de tomar con o sin alimentos, esta pauta no debe modificarse.
Los alimentos tienen efectos complejos sobre la farmacocinética de la tizanidina, que difieren con las diferentes formulaciones. Las cápsulas de Zanaflex y las tabletas de Zanaflex son bioequivalentes entre sí en condiciones de ayuno (más de 3 horas después de una comida), pero no en condiciones de alimentación (dentro de los 30 minutos de una comida). Estas diferencias farmacocinéticas pueden resultar en diferencias clínicamente significativas cuando se cambia la administración de tabletas y cápsulas y cuando se cambia la administración entre el estado con alimentos o en ayunas. Estos cambios pueden provocar un aumento de los eventos adversos o un inicio de actividad más lento o más rápido, según la naturaleza del cambio. Por esta razón, el prescriptor debe estar completamente familiarizado con los cambios en la cinética asociados con estas diferentes condiciones [ver FARMACOLOGÍA CLÍNICA ].
La dosis inicial recomendada es de 2 mg. Debido a que el efecto de Zanaflex alcanza su punto máximo aproximadamente de 1 a 2 horas después de la dosis y se disipa entre 3 y 6 horas después de la dosis, el tratamiento puede repetirse en intervalos de 6 a 8 horas, según sea necesario, hasta un máximo de tres dosis en 24 horas.
La dosis se puede aumentar gradualmente de 2 mg a 4 mg en cada dosis, con 1 a 4 días entre aumentos de dosis, hasta que se logre una reducción satisfactoria del tono muscular. La dosis diaria total no debe exceder los 36 mg. No se han estudiado dosis únicas superiores a 16 mg.
Posología en pacientes con insuficiencia renal
Zanaflex se debe utilizar con precaución en pacientes con insuficiencia renal (aclaramiento de creatinina ADVERTENCIAS Y PRECAUCIONES ].
Posología en pacientes con insuficiencia hepática
Zanaflex 4 mg debe usarse con precaución en pacientes con insuficiencia hepática. En estos pacientes, durante la titulación, se deben reducir las dosis individuales. Si se requieren dosis más altas, se deben aumentar las dosis individuales en lugar de la frecuencia de dosificación. Se recomienda monitorear los niveles de aminotransferasa al inicio y 1 mes después de alcanzar la dosis máxima, o si se sospecha daño hepático [ver Uso en poblaciones específicas ].
Descontinuación de Medicamentos
Si es necesario suspender el tratamiento, particularmente en pacientes que han estado recibiendo dosis altas (20 mg a 36 mg al día) durante períodos prolongados (9 semanas o más) o que pueden estar en tratamiento concomitante con narcóticos, la dosis debe disminuirse lentamente ( 2 mg a 4 mg por día) para minimizar el riesgo de abstinencia e hipertensión de rebote, taquicardia e hipertonía [ver Abuso y dependencia de drogas ].
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Cápsulas
mg: Cuerpo opaco azul claro con una tapa opaca azul claro con “2 MG” impreso en la tapa 4 mg: Cuerpo opaco blanco con una tapa opaca azul con “4 MG” impreso en la tapa 6 mg: Cuerpo opaco azul con una raya blanca y tapa azul opaca con “6 MG” impreso en la tapa
tabletas
Comprimidos blancos sin recubrir de 4 mg con una ranura cuádruple en una cara y grabado con “A594” en la otra cara
Almacenamiento y manipulación
Cápsulas Zanaflex®
Cápsulas de Zanaflex Capsules® (clorhidrato de tizanidina) están disponibles en tres concentraciones como cápsulas de gelatina dura de dos piezas que contienen clorhidrato de tizanidina 2,29 mg, 4,58 mg y 6,87 mg, equivalente a 2 mg, 4 mg y 6 mg de tizanidina base.
Las cápsulas de 2 mg tienen un cuerpo opaco azul claro con una tapa opaca azul claro con “2 MG” impreso en la tapa: frascos de 150 cápsulas ( CDN 70515-602-15)
Las cápsulas de 4 mg tienen un cuerpo blanco opaco con una tapa azul opaca con “4 MG” impreso en la tapa: frascos de 150 cápsulas ( CDN 70515-604-15)
Las cápsulas de 6 mg tienen un cuerpo azul opaco con una franja blanca y una tapa azul opaca con “6 MG” impreso en las cápsulas: frascos de 150 cápsulas ( CDN 70515-606-15)
Almacenar a 25°C (77°F); excursiones permitidas a 15°C a 30°C (59°F a 86°F) [ver Temperatura ambiente controlada por USP ]. Dispensar en envases con cierre a prueba de niños.
Tabletas Zanaflex®
Los comprimidos de Zanaflex® (clorhidrato de tizanidina) están disponibles en comprimidos blancos sin recubrimiento de 4 mg que contienen 4,58 mg de clorhidrato de tizanidina, equivalente a 4 mg de base de tizanidina. Las tabletas tienen una ranura cuadrisectiva en un lado y están grabadas con "A594" en el otro lado. Las tabletas se proporcionan de la siguiente manera: frascos de 150 tabletas (NDC 70515-594-15).
Almacenar a 25°C (77°F); excursiones permitidas a 15°C a 30°C (59°F a 86°F) [ver Temperatura ambiente controlada por USP ].
Dispensar en envases con cierre a prueba de niños.
Fabricado para: Covis Pharma Zug, 6300 Suiza. Revisado: diciembre de 2020
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas se describen en otras secciones de la información de prescripción:
- Hipotensión [ver ADVERTENCIAS Y PRECAUCIONES ]
- Lesión del hígado [ver ADVERTENCIAS Y PRECAUCIONES ]
- Sedación [ver ADVERTENCIAS Y PRECAUCIONES ]
- Alucinosis/síntomas similares a los psicóticos [ver ADVERTENCIAS Y PRECAUCIONES ]
- Reacciones de hipersensibilidad [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en ensayos clínicos
Debido a que los estudios clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los estudios clínicos de un fármaco no pueden compararse directamente con las tasas de los estudios clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica clínica.
Se realizaron tres estudios clínicos doble ciego, aleatorizados y controlados con placebo para evaluar el efecto de la tizanidina en el control de la espasticidad. Se realizaron dos estudios en pacientes con esclerosis múltiple y uno en pacientes con lesión de la médula espinal. Cada estudio tuvo un período de tratamiento activo de 13 semanas que incluyó una fase de titulación de 3 semanas hasta la dosis máxima tolerada de hasta 36 mg/día en tres dosis divididas, una fase de meseta de 9 semanas en la que la dosis de tizanidina se mantuvo constante y una Disminución de la dosis de 1 semana. En total, 264 pacientes recibieron tizanidina y 261 pacientes recibieron placebo. En los tres estudios, las edades de los pacientes oscilaron entre 15 y 69 años y el 51,4 por ciento eran mujeres. La dosis media durante la fase de meseta osciló entre 20 y 28 mg/día.
Las reacciones adversas notificadas con más frecuencia en estudios clínicos controlados con placebo y de dosis múltiples en los que participaron 264 pacientes con espasticidad fueron sequedad de boca, somnolencia/sedación, astenia (debilidad, fatiga y/o cansancio) y mareos. Tres cuartas partes de los pacientes calificaron los eventos como leves a moderados y una cuarta parte de los pacientes calificaron los eventos como graves. Estos eventos parecían estar relacionados con la dosis.
La Tabla 1 enumera los signos y síntomas que se informaron en más del 2% de los pacientes en tres estudios controlados con placebo de dosis múltiples que recibieron Zanaflex, donde la frecuencia en el grupo de Zanaflex fue mayor que en el grupo de placebo. Con fines de comparación, también se proporciona la frecuencia correspondiente del evento (por 100 pacientes) entre los pacientes tratados con placebo.
En el estudio de dosis única controlado con placebo en el que participaron 142 pacientes con espasticidad debida a esclerosis múltiple (Estudio 1) [ver Estudios clínicos ], se preguntó específicamente a los pacientes si habían experimentado alguna de las cuatro reacciones adversas más comunes: sequedad de boca, somnolencia (somnolencia), astenia (debilidad, fatiga y/o cansancio) y mareos. Además, se observaron hipotensión y bradicardia. La ocurrencia de estas reacciones se resume en la Tabla 2. En general, se informaron otros eventos a una tasa del 2% o menos.
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de Zanaflex. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Ciertos eventos, como somnolencia, sequedad de boca, hipotensión, disminución de la presión arterial, bradicardia, mareos, debilidad o astenia, espasmos musculares, alucinaciones, fatiga, anomalías en las pruebas de función hepática y hepatotoxicidad, se han observado en ensayos clínicos y posteriores a la comercialización y se analizan. en secciones anteriores de este documento.
Se han identificado las siguientes reacciones adversas durante la experiencia posterior a la comercialización de Zanaflex. Según la información proporcionada sobre estas reacciones, no se puede excluir por completo una relación causal con Zanaflex. Los eventos se enumeran en orden de importancia clínica decreciente; no se informa la gravedad en el entorno posterior a la comercialización.
- Síndrome de Stevens Johnson
- Reaccion anafiláctica
- Dermatitis exfoliativa
- Taquicardia ventricular
- Hepatitis
- Convulsión
- Depresión
- Artralgia
- parestesia
- Sarpullido
- Temblor
INTERACCIONES CON LA DROGAS
fluvoxamina
Está contraindicado el uso concomitante de fluvoxamina y Zanaflex 4 mg. Los cambios en la farmacocinética de la tizanidina cuando se administró con fluvoxamina dieron como resultado una disminución significativa de la presión arterial, un aumento de la somnolencia y un aumento del deterioro psicomotor [ver CONTRAINDICACIONES y FARMACOLOGÍA CLÍNICA ].
Ciprofloxacino
El uso concomitante de ciprofloxacino y Zanaflex está contraindicado. Los cambios en la farmacocinética de la tizanidina cuando se administró con ciprofloxacina dieron como resultado una disminución significativa de la presión arterial, un aumento de la somnolencia y un aumento del deterioro psicomotor [ver CONTRAINDICACIONES y FARMACOLOGÍA CLÍNICA ].
Inhibidores de CYP1A2 distintos de fluvoxamina y ciprofloxacina
Debido a las posibles interacciones farmacológicas, el uso concomitante de Zanaflex con otros inhibidores de CYP1A2, como zileuton, fluoroquinolonas distintas de los inhibidores potentes de CYP1A2 (que están contraindicados), antiarrítmicos (amiodarona, mexiletina, propafenona y verapamilo), cimetidina, famotidina, anticonceptivos orales, aciclovir y ticlopidina) deben evitarse. Si su uso es clínicamente necesario, la terapia debe iniciarse con una dosis de 2 mg y aumentarse en pasos de 2 a 4 mg diarios según la respuesta del paciente a la terapia. Si se producen reacciones adversas como hipotensión, bradicardia o somnolencia excesiva, reduzca o interrumpa el tratamiento con Zanaflex [ver ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ].
Anticonceptivos orales
No se recomienda el uso concomitante de Zanaflex 2 mg con anticonceptivos orales. Sin embargo, si el uso concomitante es clínicamente necesario, inicie Zanaflex 4 mg con una dosis única de 2 mg y aumente en pasos de 2 a 4 mg diariamente según la respuesta del paciente a la terapia. Si se producen reacciones adversas como hipotensión, bradicardia o somnolencia excesiva, reduzca o interrumpa el tratamiento con Zanaflex [ver FARMACOLOGÍA CLÍNICA ].
Alcohol
El alcohol aumenta la cantidad total de droga en el torrente sanguíneo después de una dosis de Zanaflex. Esto se asoció con un aumento de las reacciones adversas de Zanaflex. Los efectos depresores del SNC de Zanaflex y el alcohol son aditivos [ver FARMACOLOGÍA CLÍNICA ].
Otros depresores del SNC
Los efectos sedantes de Zanaflex con depresores del SNC (p. ej., benzodiazepinas, opioides, antidepresivos tricíclicos) pueden ser aditivos. Supervise a los pacientes que toman Zanaflex 2 mg con otro depresor del SNC para detectar síntomas de sedación excesiva [ver FARMACOLOGÍA CLÍNICA ].
Agonistas α2-adrenérgicos
Debido a que los efectos hipotensores pueden ser acumulativos, no se recomienda usar Zanaflex 4 mg con otros agonistas adrenérgicos α2 [ver ADVERTENCIAS Y PRECAUCIONES ].
Abuso y dependencia de drogas
Abuso
El potencial de abuso no se evaluó en estudios en humanos. Las ratas pudieron distinguir la tizanidina de la solución salina en un paradigma de discriminación estándar, después del entrenamiento, pero no pudieron generalizar los efectos de la morfina, la cocaína, el diazepam o el fenobarbital a la tizanidina.
Dependencia
La tizanidina está estrechamente relacionada con la clonidina, de la que a menudo se abusa en combinación con narcóticos y se sabe que provoca síntomas de rebote tras una suspensión brusca. Se han notificado tres casos de síntomas de rebote tras la retirada repentina de tizanidina. Los informes de casos sugieren que estos pacientes también estaban abusando de los narcóticos. Los síntomas de abstinencia incluyeron hipertensión, taquicardia, hipertonía, temblor y ansiedad. Es más probable que ocurran síntomas de abstinencia en los casos en que se usan dosis altas, especialmente durante períodos prolongados, o con el uso concomitante de narcóticos. Si es necesario interrumpir el tratamiento, la dosis debe reducirse lentamente para minimizar el riesgo de síntomas de abstinencia [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Se demostró que los monos se autoadministraban tizanidina de forma dependiente de la dosis, y el cese abrupto de la tizanidina produjo signos transitorios de abstinencia a dosis > 35 veces la dosis máxima recomendada en humanos en mg/m². Estos signos de abstinencia transitorios (aumento de la locomoción, espasmos corporales y comportamiento aversivo hacia el observador) no se revirtieron con la administración de naloxona.
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Hipotensión
La tizanidina es un agonista adrenérgico α2 que puede producir hipotensión. Se ha informado síncope en el entorno posterior a la comercialización. La posibilidad de una hipotensión significativa puede posiblemente minimizarse ajustando la dosis y centrando la atención en los signos y síntomas de hipotensión antes de aumentar la dosis. Además, los pacientes que pasan de una posición supina a una posición erguida fija pueden tener un mayor riesgo de hipotensión y efectos ortostáticos.
Vigile la hipotensión cuando Zanaflex se usa en pacientes que reciben terapia antihipertensiva concurrente. No se recomienda el uso de Zanaflex 2 mg con otros agonistas adrenérgicos α2. Se ha notificado hipotensión clínicamente significativa (disminución de la presión tanto sistólica como diastólica) con la administración concomitante de fluvoxamina o ciprofloxacino y dosis únicas de 4 mg de Zanaflex. Por tanto, está contraindicado el uso concomitante de Zanaflex con fluvoxamina o ciprofloxacino, potentes inhibidores de CYP1A2 [ver CONTRAINDICACIONES y INTERACCIONES CON LA DROGAS ].
Riesgo de lesión hepática
Zanaflex puede causar daño hepático hepatocelular. Zanaflex 4 mg debe usarse con precaución en pacientes con insuficiencia hepática. Se recomienda monitorear los niveles de aminotransferasa al inicio y 1 mes después de alcanzar la dosis máxima, o si se sospecha daño hepático [ver DOSIFICACIÓN Y ADMINISTRACIÓN y Uso en poblaciones específicas ].
Sedación
Zanaflex puede causar sedación, lo que puede interferir con la actividad diaria. En los estudios de dosis múltiples, la prevalencia de pacientes con sedación alcanzó su punto máximo después de la primera semana de titulación y luego se mantuvo estable durante la fase de mantenimiento del estudio. Los efectos depresores del SNC de Zanaflex con alcohol y otros depresores del SNC (p. ej., benzodiazepinas, opioides, antidepresivos tricíclicos) pueden ser aditivos. Controle a los pacientes que toman Zanaflex 4 mg con otro depresor del SNC para detectar síntomas de sedación excesiva [ver INTERACCIONES CON LA DROGAS ].

Alucinosis/síntomas similares a los psicóticos
El uso de Zanaflex 4 mg se ha asociado con alucinaciones. Se han informado alucinaciones o delirios visuales formados en 5 de 170 pacientes (3 %) en dos estudios clínicos controlados en América del Norte. La mayoría de los pacientes eran conscientes de que los hechos eran irreales. Un paciente desarrolló psicosis en asociación con las alucinaciones. Un paciente entre estos 5 continuó teniendo problemas durante al menos 2 semanas después de la interrupción de la tizanidina. Considere descontinuar Zanaflex en pacientes que desarrollan alucinaciones.
Interacción con inhibidores de CYP1A2
Debido a las posibles interacciones farmacológicas, Zanaflex 4 mg está contraindicado en pacientes que toman inhibidores potentes de CYP1A2, como fluvoxamina o ciprofloxacina. Pueden producirse reacciones adversas como hipotensión, bradicardia o somnolencia excesiva cuando Zanaflex se toma con otros inhibidores de CYP1A2, como zileuton, fluoroquinolonas distintas de ciprofloxacino (que está contraindicado), antiarrítmicos (amiodarona, mexiletina, propafenona), cimetidina, famotidina, anticonceptivos, aciclovir y ticlopidina). Debe evitarse el uso concomitante a menos que la necesidad de una terapia con Zanaflex 2 mg sea clínicamente evidente. En tal caso, utilice con precaución [ver INTERACCIONES CON LA DROGAS y FARMACOLOGÍA CLÍNICA ].
Reacciones hipersensibles
Zanaflex puede causar anafilaxia. Se han informado signos y síntomas que incluyen compromiso respiratorio, urticaria y angioedema de garganta y lengua. Se debe informar a los pacientes sobre los signos y síntomas de reacciones alérgicas graves y se les debe indicar que descontinúen Zanaflex y busquen atención médica inmediata si estos signos y síntomas ocurren [ver CONTRAINDICACIONES ].
Mayor riesgo de reacciones adversas en pacientes con insuficiencia renal
Zanaflex se debe utilizar con precaución en pacientes con insuficiencia renal (aclaramiento de creatinina DOSIFICACIÓN Y ADMINISTRACIÓN y Uso en poblaciones específicas ].
Reacciones adversas de abstinencia
Las reacciones adversas por abstinencia incluyen hipertensión de rebote, taquicardia e hipertonía. Para minimizar el riesgo de estas reacciones, particularmente en pacientes que han estado recibiendo dosis altas (20 a 28 mg diarios) durante períodos prolongados (9 semanas o más) o que pueden estar en tratamiento concomitante con narcóticos, se debe disminuir la dosis. lentamente (2 a 4 mg por día) [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Carcinogénesis
Se administró tizanidina a ratones durante 78 semanas en dosis orales de hasta 16 mg/kg/día, que es 2 veces la dosis máxima recomendada en humanos (DMRH) de 36 mg/día sobre la base del área de superficie corporal (mg/m²). Se administró tizanidina a ratas durante 104 semanas en dosis orales de hasta 9 mg/kg/día, que es 2,5 veces la MRHD sobre una base de mg/m². No hubo aumento de tumores en ninguna de las especies.
mutagénesis
La tizanidina fue negativa in vitro (mutación inversa bacteriana [Ames], mutación genética de mamíferos y prueba de aberración cromosómica en células de mamíferos) e in vivo (micronúcleo de médula ósea y citogenética).
Deterioro de la fertilidad
La administración oral de tizanidina a ratas antes y durante el apareamiento y continuada durante el embarazo temprano en hembras resultó en una reducción de la fertilidad en ratas macho y hembra en dosis de 30 y 10 mg/kg/día, respectivamente. No se observó ningún efecto sobre la fertilidad con dosis de 10 (hombres) y 3 (mujeres) mg/kg/día, que son aproximadamente 3 veces y similares a la MRHD, respectivamente, sobre una base de mg/m².
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
No existen datos adecuados sobre el riesgo de desarrollo asociado con el uso de Zanaflex 2 mg en mujeres embarazadas. En estudios con animales, la administración de tizanidina durante el embarazo produjo toxicidad en el desarrollo (mortalidad embriofetal y postnatal de la descendencia y déficit de crecimiento) a dosis inferiores a las utilizadas clínicamente, que no se asociaron con toxicidad materna (ver Datos de animales ).
En la población general de los EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 % al 4 % y del 15 % al 20 %, respectivamente. Se desconoce el riesgo de fondo de defectos congénitos importantes y abortos espontáneos para la población indicada.
Datos
Datos de animales
La administración oral de tizanidina (0,3 a 100 mg/kg/día) a ratas preñadas durante el período de organogénesis provocó la mortalidad embriofetal y postnatal de las crías y reducciones en el peso corporal a dosis de 30 mg/kg/día y superiores. Se observó toxicidad materna a la dosis más alta probada. La dosis sin efecto para la toxicidad del desarrollo embriofetal en ratas (3 mg/kg/día) es similar a la dosis máxima recomendada en humanos (MRHD) de 36 mg/día sobre la base del área de superficie corporal (mg/m²).
La administración oral de tizanidina (1 a 100 mg/kg/día) a conejas preñadas durante el período de organogénesis resultó en mortalidad embriofetal y posnatal de las crías en todas las dosis. Se observó toxicidad materna a la dosis más alta probada. La administración oral de tizanidina (10 y 30 mg/kg/día) durante el período perinatal del embarazo (2 a 6 días antes del parto) resultó en un aumento de la mortalidad postnatal de la descendencia en ambas dosis. No se identificó una dosis sin efecto para la toxicidad del desarrollo embriofetal en conejos. La dosis más baja probada (1 mg/kg/día) es menor que la MRHD en base a mg/m².
En un estudio de desarrollo prenatal y posnatal en ratas, la administración oral de tizanidina (3 a 30 mg/kg/día) resultó en un aumento de la mortalidad posnatal de las crías. No se identificó una dosis sin efecto para la toxicidad del desarrollo prenatal y posnatal. La dosis más baja probada (3 mg/kg/día) es similar a la MRHD en mg/m², respectivamente.
Lactancia
Resumen de riesgos
No hay datos sobre la presencia de tizanidina en la leche humana, los efectos en el lactante o los efectos en la producción de leche humana. Estudios en animales han reportado la presencia de tizanidina en la leche de animales lactantes.
Los beneficios para el desarrollo y la salud de la lactancia materna se deben considerar junto con la necesidad clínica de la madre de Zanaflex 4 mg y cualquier posible efecto adverso en el lactante amamantado por Zanaflex o por la afección materna subyacente.
Hembras y machos con potencial reproductivo
No existen estudios adecuados y bien controlados en humanos sobre el efecto de Zanaflex 4 mg en el potencial reproductivo femenino o masculino. La administración oral de tizanidina a ratas macho y hembra produjo efectos adversos sobre la fertilidad [ver Toxicología no clínica ].
Uso pediátrico
No se ha establecido la seguridad y eficacia en pacientes pediátricos.
Uso geriátrico
Se sabe que Zanaflex 2 mg se excreta sustancialmente por vía renal, y el riesgo de reacciones adversas a este fármaco puede ser mayor en pacientes con insuficiencia renal. Debido a que es más probable que los pacientes de edad avanzada tengan una función renal disminuida, se debe tener cuidado en la selección de la dosis y puede ser útil monitorear la función renal.
Los estudios clínicos de Zanaflex 2 mg no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes. La comparación de estudios cruzados de los datos farmacocinéticos luego de la administración de una dosis única de 6 mg de Zanaflex 2 mg mostró que los sujetos más jóvenes eliminaron el fármaco cuatro veces más rápido que los sujetos de edad avanzada. En pacientes de edad avanzada con insuficiencia renal (aclaramiento de creatinina
Insuficiencia renal
Se sabe que Zanaflex se excreta sustancialmente por vía renal, y el riesgo de reacciones adversas a este fármaco puede ser mayor en pacientes con insuficiencia renal. En pacientes con insuficiencia renal (aclaramiento de creatinina DOSIFICACIÓN Y ADMINISTRACIÓN , ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ].
Función hepática deteriorada
No se ha evaluado la influencia de la insuficiencia hepática en la farmacocinética de tizanidina. Debido a que la tizanidina se metaboliza extensamente en el hígado, se esperaría que la insuficiencia hepática tuviera efectos significativos en la farmacocinética de la tizanidina [ver DOSIFICACIÓN Y ADMINISTRACIÓN , ADVERTENCIAS Y PRECAUCIONES , y FARMACOLOGÍA CLÍNICA ].
SOBREDOSIS
Una revisión de la base de datos de vigilancia de seguridad reveló casos de sobredosis intencional y accidental de Zanaflex. Algunos de los casos resultaron en fatalidad y muchas de las sobredosis intencionales fueron con múltiples drogas, incluyendo depresores del SNC. Las manifestaciones clínicas de la sobredosis de tizanidina fueron consistentes con su farmacología conocida. En la mayoría de los casos se observó una disminución del sensorio que incluía letargo, somnolencia, confusión y coma. También se observa una función cardíaca deprimida que incluye con mayor frecuencia bradicardia e hipotensión. La depresión respiratoria es otra característica común de la sobredosis de tizanidina.
En caso de sobredosis, se deben tomar medidas básicas para garantizar la idoneidad de las vías respiratorias y la monitorización de los sistemas cardiovascular y respiratorio. La tizanidina es un fármaco soluble en lípidos, que es solo ligeramente soluble en agua y metanol. Por lo tanto, no es probable que la diálisis sea un método eficaz para eliminar el fármaco del organismo. En general, los síntomas se resuelven dentro de uno a tres días después de la suspensión de la tizanidina y la administración de la terapia adecuada. Debido al mecanismo de acción similar, los síntomas y el manejo de la sobredosis de tizanidina son similares a los de la sobredosis de clonidina. Para obtener la información más reciente sobre el manejo de una sobredosis, comuníquese con un centro de control de envenenamiento.
CONTRAINDICACIONES
Zanaflex está contraindicado en pacientes que toman inhibidores potentes de CYP1A2, como fluvoxamina o ciprofloxacina [ver INTERACCIONES CON LA DROGAS ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
La tizanidina es un agonista del receptor alfa-2-adrenérgico central y presumiblemente reduce la espasticidad al aumentar la inhibición presináptica de las neuronas motoras. Los efectos de la tizanidina son mayores en las vías polisinápticas. Se cree que el efecto general de estas acciones reduce la facilitación de las neuronas motoras espinales.
Farmacocinética
Absorción y Distribución
Después de la administración oral, la tizanidina se absorbe esencialmente por completo. La biodisponibilidad oral absoluta de la tizanidina es de aproximadamente el 40 % (CV = 24 %), debido al extenso metabolismo hepático de primer paso. La tizanidina se distribuye ampliamente por todo el organismo con un volumen de distribución medio en estado estacionario de 2,4 l/kg (CV = 21 %) tras la administración intravenosa en voluntarios adultos sanos. La tizanidina se une aproximadamente en un 30% a las proteínas plasmáticas.
Diferencias entre Zanaflex 4mg Capsules® y Zanaflex® Tablets
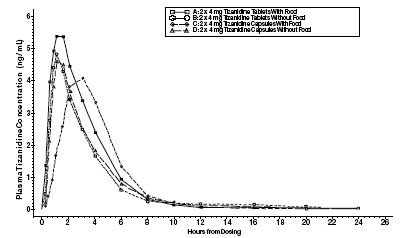
Zanaflex 2mg Capsules® y Zanaflex® comprimidos son bioequivalentes entre sí en condiciones de ayuno, pero no en condiciones de alimentación. Se administró una dosis única de dos comprimidos de 4 mg o dos cápsulas de 4 mg con alimentos y en ayunas en un estudio cruzado aleatorizado abierto de cuatro períodos en 96 voluntarios humanos, de los cuales 81 fueron elegibles para el análisis estadístico. Luego de la administración oral de la tableta o la cápsula (en ayunas), las concentraciones plasmáticas máximas de tizanidina ocurrieron 1,0 horas después de la dosificación con una vida media de aproximadamente 2 horas. Cuando se administraron dos comprimidos de 4 mg con alimentos, la concentración plasmática máxima media aumentó aproximadamente un 30 % y la mediana del tiempo hasta la concentración plasmática máxima aumentó de 25 minutos a 1 hora y 25 minutos. Por el contrario, cuando se administraron dos cápsulas de 4 mg con alimentos, la concentración plasmática máxima media disminuyó en un 20 %, la mediana del tiempo hasta la concentración plasmática máxima aumentó de 2 a 3 horas. En consecuencia, la Cmax media de la cápsula cuando se administra con alimentos es aproximadamente el 66 % de la Cmax de la tableta cuando se administra con alimentos. Los alimentos también aumentaron el grado de absorción tanto de las tabletas como de las cápsulas. El aumento con la tableta (~30%) fue significativamente mayor que con la cápsula (~10%). En consecuencia, cuando cada uno se administró con alimentos, la cantidad absorbida de la cápsula fue aproximadamente el 80 % de la cantidad absorbida de la tableta. La administración del contenido de la cápsula espolvoreado sobre compota de manzana no fue bioequivalente a la administración de una cápsula intacta en ayunas. La administración del contenido de la cápsula en compota de manzana dio como resultado un aumento del 15 % al 20 % en la Cmax y el AUC de la tizanidina y una disminución de 15 minutos en la mediana del tiempo de retraso y el tiempo hasta la concentración máxima en comparación con la administración de una cápsula intacta en ayunas.
Figura 1: Concentración media de tizanidina frente a perfiles de tiempo para comprimidos y cápsulas de Zanaflex (2 × 4 mg) en ayunas y con alimentos
Metabolismo y excreción
La tizanidina tiene una farmacocinética lineal sobre las dosis estudiadas en desarrollo clínico (1-20 mg). La tizanidina tiene una vida media de aproximadamente 2,5 horas (CV=33%). Aproximadamente el 95% de una dosis administrada se metaboliza. La principal isoenzima del citocromo P450 involucrada en el metabolismo de la tizanidina es CYP1A2. No se sabe que los metabolitos de tizanidina sean activos; sus vidas medias oscilan entre 20 y 40 horas.
Después de la administración oral única y múltiple de 14C-tizanidina, se recuperó un promedio del 60 % y el 20 % de la radiactividad total en la orina y las heces, respectivamente.
Poblaciones Específicas
Efectos de la edad
No se realizó ningún estudio farmacocinético específico para investigar los efectos de la edad. La comparación de estudios cruzados de los datos farmacocinéticos después de la administración de una dosis única de 6 mg de Zanaflex 2 mg mostró que los sujetos más jóvenes eliminaron el fármaco cuatro veces más rápido que los sujetos de edad avanzada. Zanaflex 4 mg no ha sido evaluado en niños [ver Uso en poblaciones específicas ].
Deterioro hepático
No se ha evaluado la influencia de la insuficiencia hepática en la farmacocinética de tizanidina. Debido a que la tizanidina se metaboliza extensamente en el hígado, se esperaría que la insuficiencia hepática tuviera efectos significativos en la farmacocinética de la tizanidina. Zanaflex no está recomendado en esta población de pacientes [ver Uso en poblaciones específicas ].
Insuficiencia renal
El aclaramiento de tizanidina se reduce en más del 50 % en pacientes de edad avanzada con insuficiencia renal (aclaramiento de creatinina ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
Efectos de género
No se realizó ningún estudio farmacocinético específico para investigar los efectos de género. Sin embargo, el análisis retrospectivo de los datos farmacocinéticos, luego de la administración de dosis únicas y múltiples de 4 mg de Zanaflex 2 mg, mostró que el género no tuvo efecto sobre la farmacocinética de la tizanidina.
Efectos de carrera
No se han estudiado las diferencias farmacocinéticas debidas a la raza.
Interacciones con la drogas
Inhibidores de CYP1A2
La interacción entre Zanaflex y fluvoxamina o ciprofloxacina probablemente se deba a la inhibición de CYP1A2 por fluvoxamina o ciprofloxacina. El efecto de la fluvoxamina sobre la farmacocinética de una dosis única de 4 mg de Zanaflex se estudió en 10 sujetos sanos. La Cmax, el AUC y la semivida de la tizanidina aumentaron 12, 33 y 3 veces, respectivamente. El efecto de ciprofloxacino sobre la farmacocinética de una dosis única de 4 mg de Zanaflex 4 mg se estudió en 10 sujetos sanos. La Cmax y el AUC de la tizanidina aumentaron 7 y 10 veces, respectivamente [ver CONTRAINDICACIONES ].
Aunque no se han realizado estudios clínicos que evalúen los efectos de otros inhibidores de CYP1A2 sobre la tizanidina, otros inhibidores de CYP1A2, como zileuton, otras fluoroquinolonas, antiarrítmicos (amiodarona, mexiletina, propafenona y verapamilo), cimetidina, famotidina, anticonceptivos orales, aciclovir y ticlopidina, también puede conducir a aumentos sustanciales en las concentraciones sanguíneas de tizanidina [ver ADVERTENCIAS Y PRECAUCIONES ].
Los estudios in vitro de las isoenzimas del citocromo P450 utilizando microsomas hepáticos humanos indican que es probable que ni la tizanidina ni los metabolitos principales afecten el metabolismo de otros fármacos metabolizados por las isoenzimas del citocromo P450.
Anticonceptivos orales
No se realizó ningún estudio farmacocinético específico para investigar la interacción entre los anticonceptivos orales y Zanaflex. Sin embargo, el análisis retrospectivo de los datos farmacocinéticos de la población después de la administración de dosis únicas y múltiples de 4 mg de Zanaflex mostró que las mujeres que tomaban anticonceptivos orales al mismo tiempo tenían un aclaramiento de tizanidina un 50 % menor en comparación con las mujeres que no tomaban anticonceptivos orales [ver ADVERTENCIAS Y PRECAUCIONES ].
Paracetamol
La tizanidina retrasó la Tmax del paracetamol en 16 minutos. El paracetamol no afectó la farmacocinética de la tizanidina.
Alcohol
El alcohol aumentó el AUC de la tizanidina en aproximadamente un 20 %, mientras que también aumentó su Cmax en aproximadamente un 15 %. Esto se asoció con un aumento de los efectos secundarios de la tizanidina. Los efectos depresores del SNC de la tizanidina y el alcohol son aditivos.
Estudios clínicos
La capacidad de la tizanidina para reducir el aumento del tono muscular asociado con la espasticidad se demostró en dos estudios adecuados y bien controlados en pacientes con esclerosis múltiple o lesión de la médula espinal (estudios 1 y 2).
Estudio de dosis única en pacientes con esclerosis múltiple con espasticidad
En el Estudio 1, los pacientes con esclerosis múltiple fueron aleatorizados para recibir dosis orales únicas del fármaco o placebo. Los pacientes y los evaluadores desconocían la asignación del tratamiento y se hicieron esfuerzos para reducir la probabilidad de que los evaluadores se enteraran indirectamente de la asignación del tratamiento (p. ej., no brindaron atención directa a los pacientes y se les prohibió hacer preguntas sobre los efectos secundarios). En total, 140 pacientes recibieron placebo, 8 mg o 16 mg de Zanaflex.
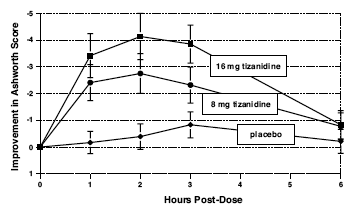
La respuesta se evaluó mediante examen físico; el tono muscular se calificó en una escala de 5 puntos (puntuación de Ashworth), con una puntuación de 0 utilizada para describir el tono muscular normal. Una puntuación de 1 indicaba una ligera captura espástica mientras que una puntuación de 2 indicaba una resistencia muscular más marcada. Se utilizó una puntuación de 3 para describir un aumento considerable del tono, lo que dificulta el movimiento pasivo. A un músculo inmovilizado por espasticidad se le dio una puntuación de 4. También se recogieron recuentos de espasmos.
Las evaluaciones se realizaron a las 1, 2, 3 y 6 horas después del tratamiento. Se detectó una reducción estadísticamente significativa de la puntuación de Ashworth para Zanaflex 2 mg en comparación con el placebo 1, 2 y 3 horas después del tratamiento. La figura 2 a continuación muestra una comparación del cambio medio en el tono muscular desde el inicio medido por la escala de Ashworth. La mayor reducción en el tono muscular fue de 1 a 2 horas después del tratamiento. A las 6 horas después del tratamiento, el tono muscular en los grupos de 8 y 16 mg de Zanaflex 2 mg era indistinguible del tono muscular en los pacientes tratados con placebo. Dentro de un paciente dado, la mejora en el tono muscular se correlacionó con la concentración plasmática. Las concentraciones plasmáticas variaron de un paciente a otro a una dosis determinada. Aunque 16 mg produjeron un efecto mayor, los eventos adversos, incluida la hipotensión, fueron más frecuentes y más graves que en el grupo de 8 mg. No hubo diferencias en el número de espasmos que ocurrieron en cada grupo.
Figura 2: Estudio de dosis única: cambio medio en el tono muscular desde el inicio medido por la escala de Ashworth ± 95 % de intervalo de confianza (una puntuación de Ashworth negativa significa una mejora en el tono muscular desde el inicio)
Estudio de siete semanas en pacientes con lesión de la médula espinal con espasticidad
En un estudio de 7 semanas (Estudio 2), 118 pacientes con espasticidad secundaria a una lesión de la médula espinal fueron aleatorizados para recibir placebo o Zanaflex. Se emplearon pasos similares a los tomados en el primer estudio para asegurar la integridad del cegamiento.
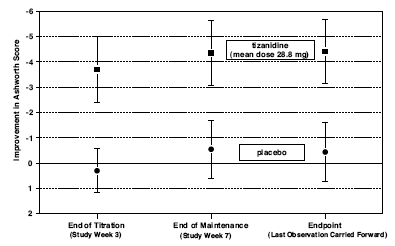
Los pacientes fueron titulados durante 3 semanas hasta una dosis máxima tolerada o 36 mg diarios administrados en tres dosis desiguales (p. ej., 10 mg administrados por la mañana y por la tarde y 16 mg administrados por la noche). Luego se mantuvo a los pacientes con la dosis máxima tolerada durante 4 semanas adicionales (es decir, fase de mantenimiento). A lo largo de la fase de mantenimiento, se evaluó el tono muscular en la escala de Ashworth en un período de 2,5 horas después de la dosis de la mañana o de la tarde. Los pacientes registraron diariamente el número de espasmos diurnos.
Al final (el momento de la evaluación de resultados especificado en el protocolo), hubo una reducción estadísticamente significativa en el tono muscular y la frecuencia de los espasmos en el grupo tratado con Zanaflex en comparación con el grupo placebo. La reducción del tono muscular no se asoció con una reducción de la fuerza muscular (un resultado deseable), pero tampoco condujo a ninguna ventaja constante de los pacientes tratados con Zanaflex en las medidas de las actividades de la vida diaria. La figura 3 a continuación muestra una comparación del cambio medio en el tono muscular desde el inicio medido por la escala de Ashworth.
Figura 3: Estudio de siete semanas: cambio medio en el tono muscular de 0,5 a 2,5 horas después de la dosificación según lo medido por la escala de Ashworth ± 95 % de intervalo de confianza (una puntuación de Ashworth negativa significa una mejora en el tono muscular desde el inicio)
INFORMACIÓN DEL PACIENTE
Interacciones medicamentosas graves
Aconseje a los pacientes que no deben tomar Zanaflex si están tomando fluvoxamina o ciprofloxacina debido al mayor riesgo de reacciones adversas graves, incluida la disminución severa de la presión arterial y la sedación. Indique a los pacientes que informen a sus médicos o farmacéuticos cuando comiencen o dejen de tomar cualquier medicamento debido a los riesgos asociados con la interacción entre Zanaflex y otros medicamentos.
Dosificación de Zanaflex
Dígales a los pacientes que tomen Zanaflex 2 mg exactamente como se les recetó (siempre con o sin alimentos) y que no cambien de tabletas a cápsulas. Informe a los pacientes que no deben tomar más Zanaflex 2 mg de lo recetado debido al riesgo de eventos adversos con dosis únicas superiores a 8 mg o dosis diarias totales superiores a 36 mg. Dígales a los pacientes que no deben interrumpir repentinamente Zanaflex 4 mg, ya que pueden producirse hipertensión de rebote y taquicardia.
Efectos de Zanaflex
Advierta a los pacientes que pueden experimentar hipotensión y que tengan cuidado al cambiar de una posición acostada o sentada a una de pie. Dígales a los pacientes que Zanaflex puede hacer que se sientan sedados o somnolientos y que deben tener cuidado al realizar actividades que requieran estar alerta, como conducir un vehículo u operar maquinaria. Informe a los pacientes que la sedación puede ser aditiva cuando Zanaflex 4 mg se toma junto con medicamentos (baclofeno, benzodiazepinas) o sustancias (p. ej., alcohol) que actúan como depresores del SNC. Recuerde a los pacientes que si dependen de su espasticidad para mantener la postura y el equilibrio en la locomoción, o siempre que se utilice la espasticidad para obtener una mayor función, Zanaflex disminuye la espasticidad y se debe usar con precaución.
