Brand Temovate 15g Clobetasol Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Temovate y cómo se usa?
Temovate es un medicamento recetado que se usa para tratar los síntomas de la psoriasis en placa y del cuero cabelludo y las dermatosis sensibles a los corticosteroides. Temovate se puede usar solo o con otros medicamentos.
Temovate pertenece a una clase de medicamentos llamados corticosteroides tópicos.
No se sabe si Temovate es seguro y eficaz en niños menores de 12 años.
¿Cuáles son los posibles efectos secundarios de Temovate?
Temovate puede causar efectos secundarios graves que incluyen:
- empeoramiento de la condición de su piel,
- enrojecimiento, calor, hinchazón, supuración o irritación severa de cualquier piel tratada,
- visión borrosa,
- visión de túnel,
- dolor de ojo,
- viendo halos alrededor de las luces,
- aumento de la sed,
- boca seca,
- aliento con olor afrutado,
- aumento de peso en la cara y los hombros,
- cicatrización lenta de heridas,
- decoloración de la piel,
- adelgazamiento de la piel,
- aumento del vello corporal,
- cansancio,
- cambios de humor,
- cambios menstruales y
- cambios sexuales
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Temovate incluyen:
- ardor, picor, hinchazón o irritación de la piel tratada,
- piel seca o agrietada,
- enrojecimiento o formación de costras alrededor de los folículos pilosos,
- venas de araña,
- estrías,
- adelgazamiento de la piel,
- sarpullido o urticaria,
- acné, y
- pérdida temporal del cabello
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Temovate. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
TEMOVATE® (crema y ungüento de propionato de clobetasol) La crema y el ungüento, al 0,05 %, contienen el compuesto activo propionato de clobetasol, un corticosteroide sintético, para uso dermatológico tópico. El clobetasol, un análogo de la prednisolona, tiene un alto grado de actividad glucocorticoide y un ligero grado de actividad mineralocorticoide.
Químicamente, el propionato de clobetasol es (11ß,16ß)-21-cloro-9-fluoro-11-hidroxi-16-metil-17-(1-oxopropoxi)-pregna-1,4-dieno-3,20-diona, y tiene la siguiente fórmula estructural:
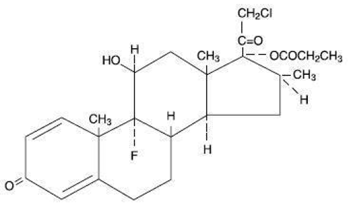
El propionato de clobetasol tiene la fórmula molecular C25H32CIFO5 y un peso molecular de 467. Es un polvo cristalino de color blanco a crema insoluble en agua.
TEMOVATE® Crema contiene 0,5 mg/g de propionato de clobetasol en una base de crema de propilenglicol, monoestearato de glicerilo, alcohol cetoestearílico, estearato de glicerilo, estearato de PEG 100, cera blanca, clorocresol, citrato de sodio, monohidrato de ácido cítrico y agua purificada.
TEMOVATE® Pomada contiene 0,5 mg/g de propionato de clobetasol en una base de propilenglicol, sesquioleato de sorbitán y vaselina blanca.
INDICACIONES
La crema y el ungüento TEMOVATE® son formulaciones de corticosteroides de potencia súper alta indicadas para el alivio de las manifestaciones inflamatorias y pruriginosas de las dermatosis sensibles a los corticosteroides. No se recomienda el tratamiento por más de 2 semanas consecutivas, y la dosis total no debe exceder los 50 g/semana debido al potencial del fármaco para suprimir el eje hipotálamo-pituitario-suprarrenal (HPA). No se recomienda el uso en pacientes pediátricos menores de 12 años.
Al igual que con otros corticosteroides altamente activos, la terapia debe suspenderse cuando se haya logrado el control. Si no se observa mejoría dentro de las 2 semanas, puede ser necesaria una reevaluación del diagnóstico.
DOSIFICACIÓN Y ADMINISTRACIÓN
Aplique una capa delgada de TEMOVATE® Crema o Pomada en las áreas afectadas de la piel dos veces al día y frote suave y completamente (ver INDICACIONES Y USO ).
La crema y el ungüento TEMOVATE® son corticosteroides tópicos de súper alta potencia; por lo tanto, el tratamiento debe limitarse a 2 semanas consecutivas y no deben utilizarse cantidades superiores a 50 g/semana.
Al igual que con otros corticosteroides altamente activos, la terapia debe suspenderse cuando se haya logrado el control. Si no se observa mejoría dentro de las 2 semanas, puede ser necesaria una reevaluación del diagnóstico.
La crema y el ungüento TEMOVATE® no deben usarse con apósitos oclusivos.
Uso geriátrico
En estudios donde los pacientes geriátricos (65 años de edad o mayores, ver PRECAUCIONES han sido tratados con TEMOVATE® Crema o Pomada, la seguridad no difirió de la de los pacientes más jóvenes; por lo tanto, no se recomienda ajustar la dosis.
CÓMO SUMINISTRADO
TEMOVATE® (crema de propionato de clobetasol) Crema, 0,05% se suministra en:
tubos de 30 g ( CDN 10337-163-30), y tubos de 60 g ( CDN 10337-163-60).
TEMOVATE® (ungüento de propionato de clobetasol) Ungüento, 0,05% se presenta en:
tubos de 15 g ( CDN 10337-162-15), y tubos de 30 g ( CDN 10337-162-30).
Almacenar entre 15° y 30°C (59° y 86°F). La Crema TEMOVATE® no debe refrigerarse. PharmaDerm
Una división de Fougera Pharmaceuticals Inc., Melville, NY 11747 EE. UU. Revisado: enero de 2012
EFECTOS SECUNDARIOS
En ensayos clínicos controlados, las reacciones adversas más frecuentes notificadas para TEMOVATE® Crema fueron sensación de ardor y escozor en el 1 % de los pacientes tratados. Las reacciones adversas menos frecuentes fueron picor, atrofia cutánea y agrietamiento y fisuras de la piel.
En ensayos clínicos controlados, los eventos adversos más frecuentes informados para el ungüento TEMOVATE® fueron sensación de ardor, irritación y picazón en el 0,5 % de los pacientes tratados. Las reacciones adversas menos frecuentes fueron escozor, agrietamiento, eritema, foliculitis, entumecimiento de los dedos, atrofia de la piel y telangiectasias.
Se ha notificado síndrome de Cushing en lactantes y adultos como resultado del uso prolongado de formulaciones tópicas de propionato de clobetasol.
Las siguientes reacciones adversas locales adicionales se han informado con corticosteroides tópicos y pueden ocurrir con mayor frecuencia con el uso de apósitos oclusivos y corticosteroides de mayor potencia. Estas reacciones se enumeran en orden aproximadamente decreciente de aparición: sequedad, erupciones acneiformes, hipopigmentación, dermatitis perioral, dermatitis alérgica de contacto, infección secundaria, irritación, estrías y miliaria.

INTERACCIONES CON LA DROGAS
No se proporcionó información.
ADVERTENCIAS
No se proporcionó información. Por favor mira PRECAUCIONES sección a continuación.
PRECAUCIONES
General
La crema y el ungüento TEMOVATE® no deben usarse en el tratamiento de la rosácea o la dermatitis perioral, y no deben usarse en la cara, la ingle o las axilas.
La absorción sistémica de los corticosteroides tópicos puede producir una supresión reversible del eje HPA con el potencial de insuficiencia de glucocorticosteroides después de la suspensión del tratamiento. Las manifestaciones del síndrome de Cushing, la hiperglucemia y la glucosuria también se pueden producir en algunos pacientes por la absorción sistémica de corticosteroides tópicos durante la terapia.
Los pacientes que aplican un esteroide tópico en un área de superficie grande o en áreas bajo oclusión deben evaluarse periódicamente para detectar evidencia de supresión del eje HPA. Esto se puede hacer usando las pruebas de estimulación con ACTH, cortisol plasmático AM y cortisol libre en orina. Los pacientes que reciben corticosteroides súper potentes no deben recibir tratamiento durante más de 2 semanas a la vez, y solo deben tratarse áreas pequeñas a la vez debido al mayor riesgo de supresión de HPA.
TEMOVATE® Cream and Ointment produjo supresión del eje HPA cuando se usó en dosis tan bajas como 2 g/día durante 1 semana en pacientes con eczema.
Si se observa supresión del eje HPA, se debe intentar retirar el fármaco, reducir la frecuencia de aplicación o sustituirlo por un corticosteroide menos potente. La recuperación de la función del eje HPA generalmente es rápida al suspender los corticosteroides tópicos. Con poca frecuencia, pueden presentarse signos y síntomas de insuficiencia de glucocorticosteroides que requieran corticosteroides sistémicos suplementarios. Para obtener información sobre la suplementación sistémica, consulte la información de prescripción de esos productos.
Los pacientes pediátricos pueden ser más susceptibles a la toxicidad sistémica de dosis equivalentes debido a su mayor proporción de superficie cutánea a masa corporal (ver PRECAUCIONES : Uso pediátrico ).
Si se desarrolla irritación, se debe suspender la crema y el ungüento TEMOVATE® e instituir la terapia adecuada. La dermatitis alérgica de contacto con corticosteroides generalmente se diagnostica observando una falla en la cicatrización en lugar de notar una exacerbación clínica como con la mayoría de los productos tópicos que no contienen corticosteroides. Tal observación debe corroborarse con pruebas de parche de diagnóstico adecuadas.
Si hay infecciones cutáneas concomitantes o se desarrollan, se debe usar un agente antifúngico o antibacteriano apropiado. Si no se produce una respuesta favorable de inmediato, se debe suspender el uso de TEMOVATE® Crema y Pomada hasta que la infección se haya controlado adecuadamente.
Pruebas de laboratorio
Las siguientes pruebas pueden ser útiles en la evaluación de pacientes para la supresión del eje HPA:
Prueba de estimulación con ACTH Prueba de cortisol en plasma AM Prueba de cortisol libre en orina
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
No se han realizado estudios a largo plazo en animales para evaluar el potencial carcinogénico del propionato de clobetasol.
Los estudios en ratas luego de la administración subcutánea a niveles de dosis de hasta 50 mcg/kg/día revelaron que las hembras exhibieron un aumento en el número de embriones reabsorbidos y una disminución en el número de fetos vivos con la dosis más alta.
El propionato de clobetasol no fue mutagénico en 3 sistemas de prueba diferentes: la prueba de Ames, el ensayo de conversión génica de Saccharomyces cerevisiae y la prueba de fluctuación de E. coli B WP2.
El embarazo
Efectos teratogénicos
Embarazo Categoría C. Se ha demostrado que los corticosteroides son teratogénicos en animales de laboratorio cuando se administran sistémicamente en dosis relativamente bajas. Se ha demostrado que algunos corticoesteroides son teratogénicos después de la aplicación dérmica a animales de laboratorio.
No se ha probado la teratogenicidad del propionato de clobetasol cuando se aplica tópicamente; sin embargo, se absorbe por vía percutánea, y cuando se administró por vía subcutánea fue un teratógeno significativo tanto en el conejo como en el ratón. El propionato de clobetasol tiene un mayor potencial teratogénico que los esteroides que son menos potentes.
Los estudios de teratogenicidad en ratones utilizando la vía subcutánea dieron como resultado fetotoxicidad a la dosis más alta probada (1 mg/kg) y teratogenicidad en todos los niveles de dosis probados hasta 0,03 mg/kg. Estas dosis son aproximadamente 1,4 y 0,04 veces, respectivamente, la dosis tópica humana de TEMOVATE® Crema y Pomada. Las anomalías observadas incluyeron paladar hendido y anomalías esqueléticas.
En conejos, el propionato de clobetasol fue teratogénico a dosis de 3 y 10 mcg/kg. Estas dosis son aproximadamente 0,02 y 0,05 veces, respectivamente, la dosis tópica humana de TEMOVATE® Crema y Pomada. Las anomalías observadas incluyeron paladar hendido, craneosquisis y otras anomalías esqueléticas.
No existen estudios adecuados y bien controlados sobre el potencial teratogénico del propionato de clobetasol en mujeres embarazadas. La crema y el ungüento TEMOVATE® deben usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto.
Madres lactantes
Los corticosteroides administrados sistémicamente aparecen en la leche humana y podrían suprimir el crecimiento, interferir con la producción endógena de corticosteroides o causar otros efectos adversos. No se sabe si la administración tópica de corticosteroides podría resultar en una absorción sistémica suficiente para producir cantidades detectables en la leche humana. Debido a que muchos medicamentos se excretan en la leche humana, se debe tener precaución cuando se administra TEMOVATE® Crema o Pomada a una mujer lactante.
Uso pediátrico
No se ha establecido la seguridad y eficacia de la crema y el ungüento TEMOVATE® en pacientes pediátricos. No se recomienda el uso en pacientes pediátricos menores de 12 años. Debido a una relación más alta entre el área de superficie de la piel y la masa corporal, los pacientes pediátricos tienen un mayor riesgo que los adultos de supresión del eje HPA y síndrome de Cushing cuando reciben tratamiento con corticosteroides tópicos. Por lo tanto, también tienen un mayor riesgo de insuficiencia suprarrenal durante o después de la suspensión del tratamiento. Se han informado efectos adversos que incluyen estrías con el uso inadecuado de corticosteroides tópicos en bebés y niños.
Se ha informado supresión del eje HPA, síndrome de Cushing, retraso del crecimiento lineal, aumento de peso retrasado e hipertensión intracraneal en niños que reciben corticosteroides tópicos. Las manifestaciones de supresión suprarrenal en niños incluyen niveles bajos de cortisol en plasma y ausencia de respuesta a la estimulación con ACTH. Las manifestaciones de la hipertensión intracraneal incluyen fontanelas abultadas, dolores de cabeza y papiledema bilateral.
Uso geriátrico
Un número limitado de pacientes de 65 años o más han sido tratados con TEMOVATE® Cream (n = 231) y con TEMOVATE® Ointment (n = 101) en ensayos clínicos en EE. UU. y fuera de EE. UU. Si bien el número de pacientes es demasiado pequeño para permitir un análisis separado de la eficacia y la seguridad, las reacciones adversas notificadas en esta población fueron similares a las notificadas por pacientes más jóvenes. Según los datos disponibles, no se justifica ningún ajuste de la dosis de TEMOVATE® Crema y Pomada en pacientes geriátricos.
SOBREDOSIS
La crema y el ungüento TEMOVATE® aplicados tópicamente pueden absorberse en cantidades suficientes para producir efectos sistémicos (ver PRECAUCIONES ).
CONTRAINDICACIONES
TEMOVATE® (crema y pomada de propionato de clobetasol) Crema y Pomada, 0,05% están contraindicados en aquellos pacientes con antecedentes de hipersensibilidad a cualquiera de los componentes de los preparados.
FARMACOLOGÍA CLÍNICA
Al igual que otros corticosteroides tópicos, el propionato de clobetasol tiene propiedades antiinflamatorias, antipruriginosas y vasoconstrictoras. El mecanismo de la actividad antiinflamatoria de los esteroides tópicos, en general, no está claro. Sin embargo, se cree que los corticosteroides actúan mediante la inducción de proteínas inhibidoras de la fosfolipasa A2, denominadas colectivamente lipocortinas. Se postula que estas proteínas controlan la biosíntesis de potentes mediadores de la inflamación como las prostaglandinas y los leucotrienos al inhibir la liberación de su precursor común, el ácido araquidónico. El ácido araquidónico es liberado de los fosfolípidos de la membrana por la fosfolipasa A2.
Farmacocinética
El grado de absorción percutánea de los corticosteroides tópicos está determinado por muchos factores, incluido el vehículo y la integridad de la barrera epidérmica. No se ha demostrado que el apósito oclusivo con hidrocortisona durante un máximo de 24 horas aumente la penetración; sin embargo, la oclusión de hidrocortisona durante 96 horas mejora notablemente la penetración. Los corticosteroides tópicos se pueden absorber en la piel normal intacta. La inflamación y/u otros procesos patológicos en la piel pueden aumentar la absorción percutánea.
Los estudios realizados con la crema y el ungüento TEMOVATE® indican que se encuentran en el rango súper alto de potencia en comparación con otros corticosteroides tópicos.
INFORMACIÓN DEL PACIENTE
Los pacientes que usan corticosteroides tópicos deben recibir la siguiente información e instrucciones:
