Elocon 5g Mometasone Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Elocon 5g y cómo se usa?
Elocon (furoato de mometasona) Cream, 0.1% es una crema, loción o pomada tópica de corticosteroides indicada para el alivio de las manifestaciones inflamatorias y pruriginosas de las dermatosis sensibles a los corticosteroides en pacientes de 2 años de edad o más.
¿Cuáles son los efectos secundarios de Elocon 5g?
Los efectos secundarios comunes de Elocon incluyen:
- erupción cutanea,
- Comezón,
- incendio,
- enrojecimiento,
- sequedad,
- adelgazamiento o ablandamiento de la piel,
- erupción cutánea o irritación alrededor de la boca,
- folículos pilosos hinchados,
- venas de araña,
- entumecimiento u hormigueo,
- cambios en el color de la piel tratada,
- ampollas,
- espinillas,
- formación de costras en la piel tratada, o
- estrías.
DESCRIPCIÓN
ELOCON (furoato de mometasona) Crema, 0.1% contiene furoato de mometasona para uso tópico. El furoato de mometasona es un corticosteroide sintético con actividad antiinflamatoria.
Químicamente, el furoato de mometasona es 9α,21-dicloro-11β,17-dihidroxi-16α-metilpregna-1,4-dieno3,20-diona 17-(2-furoato), con la fórmula empírica C27 H30CI2O6, un peso molecular de 521.4 y la siguiente fórmula estructural:
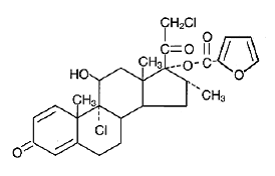
El furoato de mometasona es un polvo de color blanco a blanquecino prácticamente insoluble en agua, ligeramente soluble en octanol y moderadamente soluble en alcohol etílico.
Cada gramo de ELOCON 5g Cream, 0.1% contiene 1 mg de furoato de mometasona en una base de crema blanca a blanquecina de octenilsuccinato de almidón de aluminio (irradiado con rayos gamma), hexilenglicol, lecitina de soja hidrogenada, ácido fosfórico, agua purificada, dióxido de titanio, blanco suave parafina y cera blanca.
INDICACIONES
ELOCON® Cream es un corticosteroide indicado para el alivio de las manifestaciones inflamatorias y pruriginosas de las dermatosis que responden a los corticosteroides en pacientes de 2 años de edad o mayores.
DOSIFICACIÓN Y ADMINISTRACIÓN
Aplique una capa delgada de ELOCON Cream en las áreas de la piel afectadas una vez al día. ELOCON Cream puede usarse en pacientes pediátricos de 2 años de edad o mayores. Dado que la seguridad y la eficacia de ELOCON Crema no se han establecido en pacientes pediátricos menores de 2 años; no se recomienda su uso en este grupo de edad [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
La terapia debe suspenderse cuando se logre el control. Si no se observa mejoría dentro de las 2 semanas, puede ser necesaria una reevaluación del diagnóstico. No se ha establecido la seguridad y eficacia de ELOCON Crema en pacientes pediátricos durante más de 3 semanas de uso.
ELOCON Cream no debe usarse con vendajes oclusivos a menos que lo indique un médico. No se debe aplicar ELOCON 5g Crema en el área del pañal si el niño todavía requiere pañales o calzones de plástico, ya que estas prendas pueden constituir un vendaje oclusivo.
ELOCON Cream es solo para uso tópico. No es para uso oral, oftálmico o intravaginal.
Evite el uso en la cara, la ingle o las axilas.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Crema, 0,1%. Cada gramo de ELOCON Crema contiene 1 mg de furoato de mometasona en una base de crema suave y homogénea de color blanco a blanquecino.
Almacenamiento y manipulación
Crema ELOCON es de color blanco a blanquecino y se suministra en paquetes de 15 gramos (NDC 0085-3149-01) y 50 gramos ( CDN 0085-3149-03) tubos.
Almacenar a 25°C (77°F); excursiones permitidas a 15-30°C (59-86°F) [ver Temperatura ambiente controlada por USP ]. Evite el calor excesivo.
Fabricado para: Merck Sharp & Dohme Corp., una subsidiaria de Merck & Co., Inc., Whitehouse Station, NJ 08889, EE. UU. Fabricado por: Schering-Plough Labo NV Heist-op-den-Berg, Bélgica. Revisado: abril de 2013EFECTOS SECUNDARIOS
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica clínica.
En ensayos clínicos controlados en los que participaron 319 sujetos, la incidencia de reacciones adversas asociadas con el uso de ELOCON 5g Crema fue del 1,6 %. Las reacciones informadas incluyeron ardor, prurito y atrofia de la piel. También se han recibido informes de rosácea asociada con el uso de ELOCON 5g Crema. En ensayos clínicos controlados (n=74) que involucraron sujetos pediátricos de 2 a 12 años de edad, la incidencia de experiencias adversas asociadas con el uso de ELOCON 5g Crema fue de aproximadamente 7%. Las reacciones notificadas incluyeron escozor, prurito y forunculosis.
Se informó que las siguientes reacciones adversas están posiblemente o probablemente relacionadas con el tratamiento con ELOCON 5g Crema durante los ensayos clínicos en el 4 % de 182 sujetos pediátricos de 6 meses a 2 años de edad: disminución de los niveles de glucocorticoides, 2; parestesia, 2; foliculitis, 1; moniliasis, 1; infección bacteriana, 1; despigmentación de la piel, 1. Los siguientes signos de atrofia de la piel también se observaron entre 97 sujetos tratados con ELOCON Crema en un ensayo clínico: brillo, 4; telangiectasia, 1; pérdida de elasticidad, 4; pérdida de las marcas normales de la piel, 4; delgadez, 1; y hematomas, 1.
Las siguientes reacciones adversas locales adicionales se han informado con corticosteroides tópicos, pero pueden ocurrir con mayor frecuencia con el uso de apósitos oclusivos. Estas reacciones son: irritación, sequedad, foliculitis, hipertricosis, erupciones acneiformes, hipopigmentación, dermatitis perioral, dermatitis alérgica de contacto, infección secundaria, estrías y miliaria.
INTERACCIONES CON LA DROGAS
No se han realizado estudios de interacción farmacológica con ELOCON Crema.
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Efectos sobre el sistema endocrino
La absorción sistémica de los corticosteroides tópicos puede producir una supresión reversible del eje hipotálamo-pituitario-suprarrenal (HPA) con el potencial de insuficiencia de glucocorticosteroides. Esto puede ocurrir durante el tratamiento o después de la suspensión del tratamiento. Las manifestaciones del síndrome de Cushing, la hiperglucemia y la glucosuria también se pueden producir en algunos pacientes por absorción sistémica de corticosteroides tópicos durante el tratamiento. Los factores que predisponen a un paciente que usa un corticosteroide tópico a la supresión del eje HPA incluyen el uso de esteroides de alta potencia, grandes áreas de tratamiento, uso prolongado, uso de apósitos oclusivos, barrera cutánea alterada, insuficiencia hepática y edad joven.
Debido al potencial de absorción sistémica, el uso de corticosteroides tópicos puede requerir que los pacientes sean evaluados periódicamente para la supresión del eje HPA. Esto se puede hacer usando la prueba de estimulación de la hormona adrenocorticotrópica (ACTH).
En un estudio que evaluó los efectos de la crema de furoato de mometasona en el eje HPA, se aplicaron 15 gramos dos veces al día durante 7 días a seis sujetos adultos con psoriasis o dermatitis atópica. Los resultados muestran que el fármaco provocó una ligera disminución de la secreción de corticosteroides suprarrenales.
Si se observa supresión del eje HPA, se debe intentar retirar gradualmente el fármaco, reducir la frecuencia de aplicación o sustituirlo por un corticosteroide menos potente. La recuperación de la función del eje HPA generalmente es rápida al suspender los corticosteroides tópicos. Con poca frecuencia, pueden presentarse signos y síntomas de insuficiencia de glucocorticosteroides, lo que requiere corticosteroides sistémicos complementarios.
Los pacientes pediátricos pueden ser más susceptibles a la toxicidad sistémica de dosis equivalentes debido a sus mayores proporciones de superficie de piel a masa corporal [ver Uso en poblaciones específicas ].
Dermatitis alérgica de contacto
Si se desarrolla irritación, se debe descontinuar la crema ELOCON e instituir la terapia adecuada. La dermatitis alérgica de contacto con corticosteroides generalmente se diagnostica observando una falla en la cicatrización en lugar de notar una exacerbación clínica como con la mayoría de los productos tópicos que no contienen corticosteroides. Tal observación debe corroborarse con pruebas de parche de diagnóstico adecuadas.
Infecciones cutáneas concomitantes
Si hay infecciones cutáneas concomitantes o se desarrollan, se debe usar un agente antifúngico o antibacteriano apropiado. Si no se produce una respuesta favorable rápidamente, se debe suspender el uso de ELOCON 5g Crema hasta que la infección se haya controlado adecuadamente.

Toxicología no clínica
Carcinogénesis, mutagénesis, deterioro de la fertilidad
No se han realizado estudios a largo plazo en animales para evaluar el potencial carcinogénico de ELOCON 5g Crema. Se realizaron estudios de carcinogenicidad a largo plazo de furoato de mometasona por vía de inhalación en ratas y ratones. En un estudio de carcinogenicidad de 2 años en ratas Sprague Dawley, el furoato de mometasona no demostró un aumento estadísticamente significativo de los tumores en dosis de inhalación de hasta 67 mcg/kg (aproximadamente 0,04 veces la dosis tópica clínica máxima estimada de ELOCON 5g Crema sobre una base de mcg/m²). ). En un estudio de carcinogenicidad de 19 meses en ratones Swiss CD-1, el furoato de mometasona no demostró un aumento estadísticamente significativo en la incidencia de tumores a dosis de inhalación de hasta 160 mcg/kg (aproximadamente 0,05 veces la dosis tópica clínica máxima estimada de ELOCON Crema en una base de mcg/m²).
El furoato de mometasona aumentó las aberraciones cromosómicas en un ensayo de células de ovario de hámster chino in vitro, pero no aumentó las aberraciones cromosómicas en un ensayo de células de pulmón de hámster chino in vitro. El furoato de mometasona no fue mutagénico en la prueba de Ames ni en el ensayo de linfoma de ratón, y no fue clastogénico en un ensayo de micronúcleo de ratón in vivo, un ensayo de aberración cromosómica de médula ósea de rata o un ensayo de aberración cromosómica de células germinales de ratón macho. El furoato de mometasona tampoco indujo la síntesis de ADN no programada in vivo en hepatocitos de rata.
En estudios reproductivos en ratas, no se produjo deterioro de la fertilidad en ratas macho o hembra con dosis subcutáneas de hasta 15 mcg/kg (aproximadamente 0,01 veces la dosis tópica clínica máxima estimada de ELOCON 5g Crema, sobre una base de mcg/m²).
Uso en poblaciones específicas
El embarazo
Efectos teratogénicos - Embarazo Categoría C
No existen estudios adecuados y bien controlados en mujeres embarazadas. Por lo tanto, ELOCON 5g Crema debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto.
Se ha demostrado que los corticosteroides son teratogénicos en animales de laboratorio cuando se administran sistémicamente en dosis relativamente bajas. Se ha demostrado que algunos corticosteroides son teratogénicos después de la aplicación dérmica en animales de laboratorio.
Cuando se administró a ratas, conejos y ratones preñados, el furoato de mometasona aumentó las malformaciones fetales. Las dosis que produjeron malformaciones también redujeron el crecimiento fetal, medido por menores pesos fetales y/o retraso en la osificación. El furoato de mometasona también causó distocia y complicaciones relacionadas cuando se administró a ratas al final del embarazo.
En ratones, el furoato de mometasona causó paladar hendido en dosis subcutáneas de 60 mcg/kg y superiores. La supervivencia fetal se redujo a 180 mcg/kg. No se observó toxicidad a 20 mcg/kg. (Las dosis de 20, 60 y 180 mcg/kg en el ratón son aproximadamente 0,01, 0,02 y 0,05 veces la dosis tópica clínica máxima estimada de ELOCON Cream sobre una base de mcg/m²).
En ratas, el furoato de mometasona produjo hernias umbilicales en dosis tópicas de 600 mcg/kg y superiores. Una dosis de 300 mcg/kg produjo retrasos en la osificación, pero no malformaciones. (Las dosis de 300 y 600 mcg/kg en la rata son aproximadamente 0,2 y 0,4 veces la dosis tópica clínica máxima estimada de ELOCON 5g Crema sobre una base de mcg/m²).
En conejos, el furoato de mometasona causó múltiples malformaciones (p. ej., patas delanteras flexionadas, agenesia de la vesícula biliar, hernia umbilical, hidrocefalia) a dosis tópicas de 150 mcg/kg y superiores (aproximadamente 0,2 veces la dosis tópica clínica máxima estimada de ELOCON Crema en un mcg/ base m²). En un estudio oral, el furoato de mometasona aumentó las reabsorciones y causó paladar hendido y/o malformaciones de la cabeza (hidrocefalia y cabeza abovedada) a 700 mcg/kg. A 2800 mcg/kg, la mayoría de las camadas fueron abortadas o reabsorbidas. No se observó toxicidad a 140 mcg/kg. (Las dosis de 140, 700 y 2800 mcg/kg en el conejo son aproximadamente 0,2, 0,9 y 3,6 veces la dosis tópica clínica máxima estimada de ELOCON 5g Crema sobre una base de mcg/m²).
Cuando las ratas recibieron dosis subcutáneas de furoato de mometasona durante el embarazo o durante las últimas etapas del embarazo, 15 mcg/kg provocaron un parto prolongado y difícil y redujeron el número de nacidos vivos, el peso al nacer y la supervivencia temprana de las crías. No se observaron efectos similares con 7,5 mcg/kg. (Las dosis de 7,5 y 15 mcg/kg en la rata son aproximadamente 0,005 y 0,01 veces la dosis tópica clínica máxima estimada de ELOCON Cream en base a mcg/m²).
Madres lactantes
Los corticosteroides administrados sistémicamente aparecen en la leche humana y podrían suprimir el crecimiento, interferir con la producción endógena de corticosteroides o causar otros efectos adversos. No se sabe si la administración tópica de corticosteroides podría resultar en una absorción sistémica suficiente para producir cantidades detectables en la leche humana. Debido a que muchos medicamentos se excretan en la leche humana, se debe tener precaución cuando se administre ELOCON 5g Crema a mujeres lactantes.
Uso pediátrico
ELOCON Cream se puede usar con precaución en pacientes pediátricos de 2 años de edad o mayores, aunque no se ha establecido la seguridad y eficacia del uso del fármaco durante más de 3 semanas. Dado que no se ha establecido la seguridad y eficacia de ELOCON 5g Crema en pacientes pediátricos menores de 2 años, no se recomienda su uso en este grupo de edad.
En un ensayo pediátrico, 24 sujetos con dermatitis atópica, de los cuales 19 sujetos tenían entre 2 y 12 años de edad, fueron tratados con ELOCON Crema una vez al día. La mayoría de los sujetos se recuperaron en 3 semanas. ELOCON 5g Cream causó la supresión del eje HPA en aproximadamente el 16 % de los sujetos pediátricos de 6 a 23 meses de edad, que mostraron una función suprarrenal normal mediante la prueba de Cortrosyn antes de comenzar el tratamiento y fueron tratados durante aproximadamente 3 semanas durante un superficie corporal media del 41% (rango 15%-94%). Los criterios para la supresión fueron: nivel de cortisol basal de ≤ 5 mcg/dL, nivel posterior a la estimulación de 30 minutos de ≤ 18 mcg/dL o un aumento de FARMACOLOGÍA CLÍNICA ].
Debido a una relación más alta entre el área de superficie de la piel y la masa corporal, los pacientes pediátricos tienen un mayor riesgo que los adultos de supresión del eje HPA y síndrome de Cushing cuando son tratados con corticosteroides tópicos. Por lo tanto, también tienen un mayor riesgo de insuficiencia suprarrenal durante y/o después de la suspensión del tratamiento. Los pacientes pediátricos pueden ser más susceptibles que los adultos a la atrofia de la piel, incluidas las estrías, cuando reciben tratamiento con corticosteroides tópicos. Los pacientes pediátricos que aplican corticosteroides tópicos en más del 20 % de la superficie corporal tienen un mayor riesgo de supresión del eje HPA.
Se ha informado supresión del eje HPA, síndrome de Cushing, retraso del crecimiento lineal, aumento de peso retrasado e hipertensión intracraneal en pacientes pediátricos que reciben corticosteroides tópicos. Las manifestaciones de supresión suprarrenal en niños incluyen niveles bajos de cortisol en plasma y ausencia de respuesta a la estimulación con ACTH. Las manifestaciones de la hipertensión intracraneal incluyen fontanelas abultadas, dolores de cabeza y papiledema bilateral.
ELOCON Crema no debe usarse en el tratamiento de la dermatitis del pañal.
Uso geriátrico
Los estudios clínicos de ELOCON 5g Cream incluyeron a 190 sujetos de 65 años o más y 39 sujetos de 75 años o más. No se observaron diferencias generales en la seguridad o la eficacia entre estos sujetos y los sujetos más jóvenes, y otra experiencia clínica notificada no ha identificado diferencias en las respuestas entre los pacientes de edad avanzada y los más jóvenes. Sin embargo, no se puede descartar una mayor sensibilidad de algunos individuos mayores.
SOBREDOSIS
La crema ELOCON aplicada tópicamente se puede absorber en cantidades suficientes para producir efectos sistémicos [ver ADVERTENCIAS Y PRECAUCIONES ].
CONTRAINDICACIONES
Ninguna.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
Al igual que otros corticosteroides tópicos, el furoato de mometasona tiene propiedades antiinflamatorias, antipruriginosas y vasoconstrictoras. El mecanismo de la actividad antiinflamatoria de los esteroides tópicos, en general, no está claro. Sin embargo, se cree que los corticosteroides actúan mediante la inducción de proteínas inhibidoras de la fosfolipasa A2, denominadas colectivamente lipocortinas. Se postula que estas proteínas controlan la biosíntesis de potentes mediadores de la inflamación, como las prostaglandinas y los leucotrienos, al inhibir la liberación de su precursor común, el ácido araquidónico. El ácido araquidónico es liberado de los fosfolípidos de la membrana por la fosfolipasa A2.
Farmacodinámica
Los estudios realizados con ELOCON 5g Cream indican que se encuentra en el rango medio de potencia en comparación con otros corticosteroides tópicos.
En un estudio que evaluó los efectos de la crema de furoato de mometasona en el eje HPA, se aplicaron 15 gramos dos veces al día durante 7 días a seis sujetos adultos con psoriasis o dermatitis atópica. La crema se aplicó sin oclusión en al menos el 30% de la superficie corporal. Los resultados mostraron que el fármaco provocó una ligera disminución de la secreción de corticosteroides suprarrenales [ver ADVERTENCIAS Y PRECAUCIONES ].
Noventa y siete sujetos pediátricos de 6 a 23 meses de edad con dermatitis atópica se inscribieron en un estudio abierto de seguridad del eje HPA. ELOCON Crema se aplicó una vez al día durante aproximadamente 3 semanas sobre una superficie corporal media del 41% (rango 15%-94%). En aproximadamente el 16 % de los sujetos que mostraron una función suprarrenal normal mediante la prueba de Cortrosyn antes de comenzar el tratamiento, se observó supresión suprarrenal al final del tratamiento con ELOCON 5g Crema. Los criterios para la supresión fueron: nivel de cortisol basal de ≤ 5 mcg/dL, nivel posterior a la estimulación de 30 minutos de ≤ 18 mcg/dL o un aumento de Uso en poblaciones específicas ].
Farmacocinética
El grado de absorción percutánea de los corticosteroides tópicos está determinado por muchos factores, incluido el vehículo y la integridad de la barrera epidérmica. Estudios en humanos indican que aproximadamente el 0,4% de la dosis aplicada de ELOCON 5g Crema ingresa a la circulación luego de 8 horas de contacto sobre piel normal sin oclusión. La inflamación y/u otros procesos patológicos en la piel pueden aumentar la absorción percutánea.
Estudios clínicos
La seguridad y eficacia de ELOCON 5g Crema para el tratamiento de dermatosis que responden a corticosteroides se evaluaron en dos ensayos clínicos aleatorizados, doble ciego, controlados con vehículo, uno en psoriasis y otro en dermatitis atópica. En estos ensayos se evaluó un total de 366 sujetos (12-81 años de edad), de los cuales 177 recibieron ELOCON Crema y 181 sujetos recibieron crema vehículo. ELOCON Cream o la crema vehículo se aplicaron una vez al día durante 21 días.
Los dos ensayos demostraron que ELOCON 5g Cream es eficaz en el tratamiento de la psoriasis y la dermatitis atópica.
INFORMACIÓN DEL PACIENTE
Informar a los pacientes de lo siguiente:
- Use ELOCON 5g Crema según las indicaciones del médico. Es sólo para uso externo.
- Evite el contacto con los ojos.
- No use la crema ELOCON en la cara, las axilas o las ingles a menos que lo indique el médico.
- No use ELOCON 5g Crema para ningún otro trastorno que no sea para el que se le recetó.
- El área de la piel tratada no debe vendarse ni cubrirse o envolverse de otra manera para que quede oclusiva, a menos que lo indique el médico.
- Informe cualquier signo de reacciones adversas locales al médico.
- Aconseje a los pacientes que no usen ELOCON 5g Crema en el tratamiento de la dermatitis del pañal. No aplique la Crema ELOCON en el área del pañal, ya que los pañales o los calzoncillos de plástico pueden constituir un vendaje oclusivo.
- Suspender la terapia cuando se logre el control. Si no se observa mejoría dentro de 2 semanas, comuníquese con el médico.
- No use otros productos que contengan corticosteroides con ELOCON Cream sin consultar primero con el médico.
