Crestor 10mg, 20mg, 5mg Rosuvastatin Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Crestor y cómo se usa?
Crestor es un medicamento recetado que se usa para reducir el colesterol LDL (lipoproteína de baja densidad) y los triglicéridos en la sangre, retardar la progresión de la placa en los vasos sanguíneos y reducir el riesgo de accidente cerebrovascular y ataque cardíaco. Crestor 20 mg se puede usar solo o con otros medicamentos.
Crestor es un agente hipolipemiante, estatinas e inhibidores de la HMG-CoA reductasa.
No se sabe si Crestor es seguro y efectivo en niños menores de 8 años.
¿Cuáles son los posibles efectos secundarios de Crestor?
Crestor puede causar efectos secundarios graves que incluyen:
- dolor muscular inexplicable
- sensibilidad muscular
- debilidad muscular
- confusión
- problemas de memoria
- dolor de estomago superior
- cansancio
- pérdida de apetito
- orina oscura
- coloración amarillenta de la piel o los ojos (ictericia)
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Crestor incluyen:
- dolor de cabeza
- debilidad
- dolores musculares
- náuseas
- dolor de estómago
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Crestor. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
CRESTOR (rosuvastatina cálcica) es un agente hipolipemiante sintético para administración oral.
El nombre químico de la rosuvastatina cálcica es bis[(E)-7-[4-(4-fluorofenil)-6-isopropil-2- [metil(metilsulfonil)amino]pirimidin-5-il](3R,5S)-3 sal de calcio del ácido ,5-dihidroxihept-6-enoico] con la siguiente fórmula estructural:
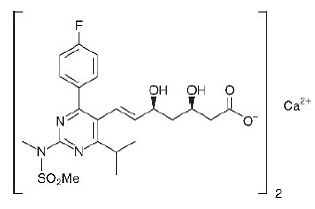
La fórmula empírica de la rosuvastatina cálcica es (C22H27FN3O6S)2Ca y el peso molecular es 1001,14. La rosuvastatina cálcica es un polvo blanco amorfo que es escasamente soluble en agua y metanol, y ligeramente soluble en etanol. La rosuvastatina cálcica es un compuesto hidrófilo con un coeficiente de partición (octanol/agua) de 0,13 a un pH de 7,0.
Los comprimidos de CRESTOR para administración oral contienen 5, 10, 20 o 40 mg de rosuvastatina y los siguientes ingredientes inactivos: Cada comprimido contiene: celulosa microcristalina NF, lactosa monohidrato NF, fosfato de calcio tribásico NF, crospovidona NF, estearato de magnesio NF, hipromelosa NF, triacetina NF, dióxido de titanio USP, óxido férrico amarillo y óxido férrico rojo NF.
INDICACIONES
Hiperlipidemia y dislipidemia mixta
CRESTOR está indicado como terapia adyuvante a la dieta para reducir los niveles elevados de C-total, LDL-C, ApoB, no-HDL-C y triglicéridos y para aumentar el HDL-C en pacientes adultos con hiperlipidemia primaria o dislipidemia mixta. Los agentes que alteran los lípidos deben usarse además de una dieta restringida en grasas saturadas y colesterol cuando la respuesta a la dieta y las intervenciones no farmacológicas por sí solas ha sido inadecuada.
Pacientes pediátricos con hipercolesterolemia familiar
CRESTOR 10mg está indicado como complemento de la dieta para:
- reducir los niveles de C-Total, C-LDL y ApoB en niños y adolescentes de 8 a 17 años con hipercolesterolemia familiar heterocigota si después de una prueba adecuada de terapia dietética se presentan los siguientes hallazgos: C-LDL >190 mg/dL, o >160 mg/dl junto con antecedentes familiares positivos de enfermedad cardiovascular prematura (ECV) o dos o más factores de riesgo de ECV.
- reducir LDL-C, Total-C, nonHDL-C y ApoB en niños y adolescentes de 7 a 17 años de edad con hipercolesterolemia familiar homocigota, ya sea solo o con otros tratamientos hipolipemiantes (p. ej., aféresis de LDL).
Hipertrigliceridemia
CRESTOR está indicado como terapia adjunta a la dieta para el tratamiento de pacientes adultos con hipertrigliceridemia.
Disbetalipoproteinemia primaria (hiperlipoproteinemia tipo III)
CRESTOR está indicado como complemento de la dieta para el tratamiento de pacientes adultos con disbetalipoproteinemia primaria (hiperlipoproteinemia tipo III).
Pacientes adultos con hipercolesterolemia familiar homocigótica
CRESTOR está indicado como terapia complementaria a otros tratamientos para reducir los lípidos (por ejemplo, aféresis de LDL) o solo si tales tratamientos no están disponibles para reducir el LDL-C, Total-C y ApoB en pacientes adultos con hipercolesterolemia familiar homocigota.
Disminución de la progresión de la aterosclerosis
CRESTOR 5 mg está indicado como terapia complementaria a la dieta para retardar la progresión de la aterosclerosis en pacientes adultos como parte de una estrategia de tratamiento para reducir el C-Total y el C-LDL a los niveles objetivo.
Prevención primaria de enfermedades cardiovasculares
En individuos sin cardiopatía coronaria clínicamente evidente pero con un mayor riesgo de enfermedad cardiovascular según la edad ≥50 años en hombres y ≥60 años en mujeres, hsCRP ≥2 mg/L y la presencia de al menos una enfermedad cardiovascular adicional factor de riesgo como hipertensión, HDL-C bajo, tabaquismo o antecedentes familiares de enfermedad coronaria prematura, CRESTOR está indicado para:
- reducir el riesgo de accidente cerebrovascular
- reducir el riesgo de infarto de miocardio
- reducir el riesgo de procedimientos de revascularización arterial
Limitaciones de uso
CRESTOR no se ha estudiado en las dislipidemias tipo I y V de Fredrickson.
DOSIFICACIÓN Y ADMINISTRACIÓN
Información general de dosificación
El rango de dosis de CRESTOR 5 mg en adultos es de 5 a 40 mg por vía oral una vez al día. La dosis inicial habitual es de 10 a 20 mg una vez al día. La dosis inicial habitual en pacientes adultos con hipercolesterolemia familiar homocigótica es de 20 mg una vez al día.
La dosis máxima de 20 mg de CRESTOR de 40 mg debe usarse solo para aquellos pacientes que no han logrado su objetivo de C-LDL utilizando la dosis de 20 mg [ver ADVERTENCIAS Y PRECAUCIONES ].
CRESTOR 5mg se puede administrar como dosis única en cualquier momento del día, con o sin alimentos. El comprimido debe tragarse entero.
Al iniciar el tratamiento con CRESTOR o cambiar desde otro tratamiento con un inhibidor de la reductasa de la HMG-CoA, primero se debe utilizar la dosis inicial adecuada de 10 mg de CRESTOR y solo luego ajustarla de acuerdo con la respuesta del paciente y el objetivo individualizado del tratamiento.
Después del inicio o tras la titulación de CRESTOR, los niveles de lípidos deben analizarse dentro de 2 a 4 semanas y la dosis debe ajustarse en consecuencia.
Dosificación pediátrica
En la hipercolesterolemia familiar heterocigota, el rango de dosis recomendado es de 5 a 10 mg por vía oral una vez al día en pacientes de 8 a menos de 10 años de edad, y de 5 a 20 mg por vía oral una vez al día en pacientes de 10 a 17 años de edad.
En la hipercolesterolemia familiar homocigota, la dosis recomendada es de 20 mg por vía oral una vez al día en pacientes de 7 a 17 años de edad.
Dosificación en pacientes asiáticos
En pacientes asiáticos, considere el inicio de la terapia con CRESTOR 20 mg con 5 mg una vez al día debido al aumento de las concentraciones plasmáticas de rosuvastatina. El aumento de la exposición sistémica debe tenerse en cuenta cuando se tratan pacientes asiáticos que no están adecuadamente controlados con dosis de hasta 20 mg/día [ver Uso en poblaciones específicas y FARMACOLOGÍA CLÍNICA ].
Uso con terapia concomitante
Pacientes que toman ciclosporina
La dosis de CRESTOR 20 mg no debe exceder los 5 mg una vez al día [ver ADVERTENCIAS Y PRECAUCIONES , INTERACCIONES CON LA DROGAS y FARMACOLOGÍA CLÍNICA ].
Pacientes que toman gemfibrozilo
Evite el uso concomitante de CRESTOR con gemfibrozilo. Si no se puede evitar el uso concomitante, inicie CRESTOR con 5 mg una vez al día. La dosis de CRESTOR no debe exceder los 10 mg una vez al día [ver ADVERTENCIAS Y PRECAUCIONES , INTERACCIONES CON LA DROGAS y FARMACOLOGÍA CLÍNICA ].
Pacientes que toman atazanavir y ritonavir, lopinavir y ritonavir o simeprevir
Inicie la terapia con CRESTOR 10 mg con 5 mg una vez al día. La dosis de CRESTOR no debe exceder los 10 mg una vez al día [ver ADVERTENCIAS Y PRECAUCIONES , INTERACCIONES CON LA DROGAS y FARMACOLOGÍA CLÍNICA ].
Posología en pacientes con insuficiencia renal grave
Para pacientes con insuficiencia renal grave (CLcr Uso en poblaciones específicas y FARMACOLOGÍA CLÍNICA ].
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
5 mg: Comprimidos recubiertos, redondos, biconvexos, amarillos. Grabado "CRESTOR" y "5" en un lado de la tableta.
10 mg: comprimidos recubiertos de color rosa, redondos, biconvexos. Grabado "CRESTOR" y "10" en un lado de la tableta.
20 mg: comprimidos recubiertos de color rosa, redondos, biconvexos. Grabado "CRESTOR" y "20" en un lado de la tableta.
40 mg: comprimidos recubiertos de color rosa, ovalados, biconvexos. Grabado "CRESTOR" en un lado y "40" en el otro lado de la tableta.
Almacenamiento y manipulación
CRESTOR® (rosuvastatina cálcica) Tabletas se suministran como:
CDN 0310-0755-90: 5 mg. Comprimidos recubiertos, redondos, biconvexos, amarillos. Grabado “CRESTOR” y “5” en una cara; botella de 90 tabletas
CDN 0310-0751-90: 10 mg. Comprimidos recubiertos de color rosa, redondos, biconvexos. Grabado “CRESTOR” y “10” en una cara; botella de 90 tabletas
CDN 0310-0751-39: 10 mg. Comprimidos recubiertos de color rosa, redondos, biconvexos. Grabado “CRESTOR” y “10” en una cara; envases monodosis de 100
CDN 0310-0752-90: 20 mg. Comprimidos recubiertos de color rosa, redondos, biconvexos. Grabado “CRESTOR” y “20” en una cara; botellas de 90
CDN 0310-0752-39: 20 mg. Comprimidos recubiertos de color rosa, redondos, biconvexos. Grabado “CRESTOR” y “20” en una cara; envases monodosis de 100
CDN 0310-0754-30: 40 mg. Comprimidos recubiertos de color rosa, ovalados, biconvexos. Grabado “CRESTOR” por una cara y “40” por la otra; botellas de 30
Almacenamiento
Almacenar a temperatura ambiente controlada, 20-25°C (68-77°F) [ver Temperatura ambiente controlada por USP ]. Proteger de la humedad.
Distribuido por: AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. Revisado: septiembre de 2018
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas graves se analizan con mayor detalle en otras secciones de la etiqueta:
- Rabdomiólisis con mioglobinuria e insuficiencia renal aguda y miopatía (incluyendo miositis) [ver ADVERTENCIAS Y PRECAUCIONES ]
- Anomalías de las enzimas hepáticas [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en estudios clínicos
Debido a que los estudios clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los estudios clínicos de un fármaco no pueden compararse directamente con las tasas de los estudios clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica clínica.
En la base de datos de ensayos clínicos controlados de CRESTOR (placebo o control activo) de 5394 pacientes con una duración media del tratamiento de 15 semanas, el 1,4 % de los pacientes interrumpieron el tratamiento debido a reacciones adversas. Las reacciones adversas más comunes que llevaron a la interrupción del tratamiento fueron:
- mialgia
- dolor abdominal
- náuseas
Las reacciones adversas notificadas con mayor frecuencia (incidencia ≥2 %) en la base de datos de ensayos clínicos controlados de CRESTOR 5 mg de 5394 pacientes fueron:
- dolor de cabeza
- mialgia
- dolor abdominal
- astenia
- náuseas
Las reacciones adversas notificadas en ≥2 % de los pacientes en estudios clínicos controlados con placebo y en una tasa superior a la del placebo se muestran en la Tabla 1. Estos estudios tuvieron una duración del tratamiento de hasta 12 semanas.
Otras reacciones adversas notificadas en los estudios clínicos fueron dolor abdominal, mareos, hipersensibilidad (incluidos sarpullido, prurito, urticaria y angioedema) y pancreatitis. También se han informado las siguientes anomalías de laboratorio: proteinuria con tira reactiva positiva y hematuria microscópica [ver ADVERTENCIAS Y PRECAUCIONES ]; creatina fosfoquinasa elevada, transaminasas, glucosa, glutamil transpeptidasa, fosfatasa alcalina y bilirrubina; y anomalías de la función tiroidea.
En el estudio METEOR, en el que participaron 981 participantes tratados con rosuvastatina 40 mg (n=700) o placebo (n=281) con una duración media del tratamiento de 1,7 años, el 5,6 % de los sujetos tratados con CRESTOR 5 mg frente al 2,8 % de los sujetos tratados con placebo descontinuado debido a reacciones adversas. Las reacciones adversas más comunes que llevaron a la interrupción del tratamiento fueron: mialgia, aumento de las enzimas hepáticas, dolor de cabeza y náuseas [ver Estudios clínicos ].
Las reacciones adversas notificadas en ≥2 % de los pacientes y en una tasa superior a la del placebo se muestran en la Tabla 2.
En el estudio JUPITER, 17 802 participantes fueron tratados con 20 mg de rosuvastatina (n=8901) o placebo (n=8901) durante una duración media de 2 años. Un mayor porcentaje de pacientes tratados con rosuvastatina frente a pacientes tratados con placebo, 6,6 % y 6,2 %, respectivamente, interrumpieron la medicación del estudio debido a un evento adverso, independientemente de la causalidad del tratamiento. La mialgia fue la reacción adversa más común que condujo a la interrupción del tratamiento.
En JUPITER, se notificó una frecuencia significativamente mayor de diabetes mellitus en pacientes que tomaban rosuvastatina (2,8 %) frente a pacientes que tomaban placebo (2,3 %). La HbA1c media aumentó significativamente en un 0,1 % en los pacientes tratados con rosuvastatina en comparación con los pacientes tratados con placebo. El número de pacientes con una HbA1c >6,5 % al final del ensayo fue significativamente mayor en los pacientes tratados con rosuvastatina que en los tratados con placebo [ver ADVERTENCIAS Y PRECAUCIONES y Estudios clínicos ].
Las reacciones adversas notificadas en ≥2 % de los pacientes y en una tasa superior a la del placebo se muestran en la Tabla 3.
Pacientes pediátricos con hipercolesterolemia familiar heterocigota
En un estudio controlado de 12 semanas en niños y niñas posmenárquicas de 10 a 17 años de edad con hipercolesterolemia familiar heterocigota con CRESTOR 5 a 20 mg al día [ver Uso en poblaciones específicas y Estudios clínicos ], se observaron elevaciones de la creatina fosfoquinasa sérica (CK) >10 x ULN con mayor frecuencia en rosuvastatina en comparación con los niños tratados con placebo. Cuatro de 130 (3 %) niños tratados con rosuvastatina (2 tratados con 10 mg y 2 tratados con 20 mg) habían aumentado la CK >10 x LSN, en comparación con 0 de 46 niños con placebo.
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de CRESTOR: artralgia, insuficiencia hepática fatal y no fatal, hepatitis, ictericia, trombocitopenia, depresión, trastornos del sueño (incluidos insomnio y pesadillas), neuropatía periférica, enfermedad pulmonar intersticial y ginecomastia. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Ha habido informes raros de miopatía necrotizante inmunomediada asociada con el uso de estatinas [ver ADVERTENCIAS Y PRECAUCIONES ].
Ha habido informes posteriores a la comercialización raros de deterioro cognitivo (p. ej., pérdida de memoria, olvidos, amnesia, deterioro de la memoria y confusión) asociado con el uso de estatinas. Estos problemas cognitivos se han informado para todas las estatinas. Los informes generalmente no son graves y son reversibles con la interrupción de la estatina, con tiempos variables para el inicio de los síntomas (1 día a años) y resolución de los síntomas (mediana de 3 semanas).
INTERACCIONES CON LA DROGAS
ciclosporina
La ciclosporina aumentó la exposición a la rosuvastatina y puede aumentar el riesgo de miopatía. Por lo tanto, en pacientes que toman ciclosporina, la dosis de CRESTOR 10 mg no debe exceder los 5 mg una vez al día [ver DOSIFICACIÓN Y ADMINISTRACIÓN , ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ].
gemfibrozilo
Gemfibrozil aumentó significativamente la exposición a rosuvastatina. Debido a un mayor riesgo observado de miopatía/rabdomiolisis, se debe evitar la terapia combinada con CRESTOR y gemfibrozilo. Si se usan juntos, la dosis de CRESTOR 10 mg no debe exceder los 10 mg una vez al día [ver FARMACOLOGÍA CLÍNICA ].
Inhibidores de la proteasa
La coadministración de rosuvastatina con ciertos inhibidores de la proteasa tiene diferentes efectos sobre la exposición a la rosuvastatina y puede aumentar el riesgo de miopatía. Simeprevir, que es un inhibidor de la proteasa del virus de la hepatitis C (VHC), o combinaciones de atazanavir/ritonavir o lopinavir/ritonavir, que son inhibidores de la proteasa del VIH-1, aumentan la exposición a la rosuvastatina [consulte la Tabla 4 - FARMACOLOGÍA CLÍNICA ]. Para estos inhibidores de la proteasa, la dosis de CRESTOR 5 mg no debe exceder los 10 mg una vez al día. Las combinaciones de fosamprenavir/ritonavir o tipranavir/ritonavir, que son inhibidores de la proteasa del VIH-1, producen poco o ningún cambio en la exposición a la rosuvastatina. Se debe tener precaución cuando se coadministra rosuvastatina con inhibidores de la proteasa [ver DOSIFICACIÓN Y ADMINISTRACIÓN , ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ].
Anticoagulantes cumarínicos
CRESTOR 20 mg aumentó significativamente el INR en pacientes que recibieron anticoagulantes cumarínicos. Por lo tanto, se debe tener precaución cuando se administren anticoagulantes cumarínicos junto con CRESTOR. En pacientes que toman anticoagulantes cumarínicos y CRESTOR de manera concomitante, se debe determinar el INR antes de comenzar con CRESTOR y con la frecuencia suficiente durante el inicio del tratamiento para garantizar que no se produzca una alteración significativa del INR [ver ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ].
niacina
El riesgo de efectos sobre el músculo esquelético puede aumentar cuando CRESTOR 5 mg se usa en combinación con dosis modificadoras de lípidos (≥1 g/día) de niacina; se debe tener precaución al prescribir con CRESTOR [ver ADVERTENCIAS Y PRECAUCIONES ].
fenofibrato
Cuando se coadministró CRESTOR 20 mg con fenofibrato, no se observó un aumento clínicamente significativo en el AUC de rosuvastatina o fenofibrato. Debido a que se sabe que el riesgo de miopatía durante el tratamiento con inhibidores de la HMG-CoA reductasa aumenta con el uso concomitante de fenofibratos, se debe tener precaución al prescribir fenofibratos con CRESTOR [ver ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ].
colchicina
Se han informado casos de miopatía, incluida la rabdomiólisis, con inhibidores de la HMG-CoA reductasa, incluida la rosuvastatina, coadministrados con colchicina, y se debe tener precaución al prescribir CRESTOR con colchicina [ver ADVERTENCIAS Y PRECAUCIONES ].
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Efectos del músculo esquelético
Se han notificado casos de miopatía y rabdomiólisis con insuficiencia renal aguda secundaria a mioglobinuria con inhibidores de la HMG-CoA reductasa, incluido CRESTOR. Estos riesgos pueden ocurrir a cualquier nivel de dosis, pero aumentan con la dosis más alta (40 mg).
CRESTOR 5 mg se debe prescribir con precaución en pacientes con factores predisponentes para la miopatía (p. ej., edad ≥65 años, hipotiroidismo tratado inadecuadamente, insuficiencia renal). El riesgo de miopatía durante el tratamiento con CRESTOR 5 mg puede aumentar con la administración concomitante de otras terapias hipolipemiantes (fibratos o niacina), gemfibrozilo, ciclosporina, atazanavir/ritonavir, lopinavir/ritonavir o simeprevir [ver DOSIFICACIÓN Y ADMINISTRACIÓN y INTERACCIONES CON LA DROGAS ]. Se han informado casos de miopatía, incluida la rabdomiólisis, con inhibidores de la HMG-CoA reductasa, incluida la rosuvastatina, coadministrados con colchicina, y se debe tener precaución al prescribir CRESTOR con colchicinas [ver INTERACCIONES CON LA DROGAS ].
El tratamiento con CRESTOR debe suspenderse si se presentan niveles de creatina quinasa marcadamente elevados o si se diagnostica o sospecha miopatía. El tratamiento con 5 mg de CRESTOR también debe suspenderse temporalmente en cualquier paciente con una afección aguda y grave que sugiera miopatía o que predisponga al desarrollo de insuficiencia renal secundaria a rabdomiólisis (p. ej., sepsis, hipotensión, deshidratación, cirugía mayor, y trastornos electrolíticos, o convulsiones no controladas).
Ha habido informes raros de miopatía necrotizante inmunomediada (IMNM), una miopatía autoinmune, asociada con el uso de estatinas. La IMNM se caracteriza por: debilidad muscular proximal y aumento de la creatina cinasa sérica, que persisten a pesar de la interrupción del tratamiento con estatinas; biopsia muscular que muestra miopatía necrosante sin inflamación significativa; mejoría con agentes inmunosupresores.
Se debe recomendar a todos los pacientes que informen de inmediato a su médico sobre cualquier dolor, sensibilidad o debilidad muscular inexplicable, especialmente si se acompaña de malestar general o fiebre, o si los signos y síntomas musculares persisten después de interrumpir el tratamiento con CRESTOR.
Anomalías de las enzimas hepáticas
Se recomienda realizar pruebas de enzimas hepáticas antes del inicio de CRESTOR 10 mg y si se presentan signos o síntomas de daño hepático.
Se han informado aumentos en las transaminasas séricas [AST (SGOT) o ALT (SGPT)] con los inhibidores de la HMG-CoA reductasa, incluido CRESTOR. En la mayoría de los casos, las elevaciones fueron transitorias y se resolvieron o mejoraron con la terapia continua o después de una breve interrupción de la terapia. Hubo dos casos de ictericia, para los cuales no se pudo determinar una relación con la terapia con CRESTOR, que se resolvieron después de la interrupción de la terapia. No hubo casos de insuficiencia hepática o enfermedad hepática irreversible en estos ensayos. En un análisis combinado de ensayos controlados con placebo, se produjeron aumentos de las transaminasas séricas > 3 veces el límite superior normal en el 1,1 % de los pacientes que tomaban CRESTOR 5 mg frente al 0,5 % de los pacientes tratados con placebo.
Ha habido informes posteriores a la comercialización raros de insuficiencia hepática fatal y no fatal en pacientes que toman estatinas, incluida la rosuvastatina. Si ocurre una lesión hepática grave con síntomas clínicos y/o hiperbilirrubinemia o ictericia durante el tratamiento con CRESTOR 20 mg, interrumpa de inmediato la terapia. Si no se encuentra una etiología alternativa, no reinicie CRESTOR.
CRESTOR 5 mg debe usarse con precaución en pacientes que consumen cantidades importantes de alcohol y/o tienen antecedentes de enfermedad hepática crónica [ver FARMACOLOGÍA CLÍNICA ]. La enfermedad hepática activa, que puede incluir elevaciones persistentes de transaminasas inexplicables, es una contraindicación para el uso de CRESTOR [ver CONTRAINDICACIONES ].
Anticoagulantes cumarínicos concomitantes
Se debe tener precaución cuando se administran anticoagulantes junto con CRESTOR debido a que potencia el efecto de los anticoagulantes de tipo cumarínico en la prolongación del tiempo de protrombina/INR. En pacientes que toman anticoagulantes cumarínicos y CRESTOR de manera concomitante, se debe determinar el INR antes de comenzar con CRESTOR 10 mg y con la frecuencia suficiente durante el inicio del tratamiento para asegurar que no ocurra una alteración significativa del INR [ver INTERACCIONES CON LA DROGAS ].
proteinuria y hematuria
En el programa de ensayos clínicos CRESTOR, se observaron proteinuria con tira reactiva positiva y hematuria microscópica entre los pacientes tratados con CRESTOR. Estos hallazgos fueron más frecuentes en pacientes que tomaban CRESTOR 40 mg, en comparación con dosis más bajas de CRESTOR 20 mg o inhibidores de la reductasa de la HMG-CoA de comparación, aunque generalmente fue transitorio y no se asoció con un empeoramiento de la función renal. Aunque se desconoce la importancia clínica de este hallazgo, se debe considerar una reducción de la dosis para los pacientes en tratamiento con CRESTOR con proteinuria y/o hematuria persistentes inexplicables durante las pruebas de análisis de orina de rutina.
Efectos endocrinos
Se han informado aumentos en los niveles de HbA1c y glucosa sérica en ayunas con inhibidores de la HMG-CoA reductasa, incluido CRESTOR. Según los datos de ensayos clínicos con CRESTOR, en algunos casos estos aumentos pueden exceder el umbral para el diagnóstico de diabetes mellitus [ver REACCIONES ADVERSAS ].
Aunque los estudios clínicos han demostrado que CRESTOR 10 mg solo no reduce la concentración de cortisol plasmático basal ni altera la reserva suprarrenal, se debe tener precaución si CRESTOR se administra concomitantemente con medicamentos que pueden disminuir los niveles o la actividad de las hormonas esteroides endógenas como ketoconazol, espironolactona y cimetidina.
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( INFORMACIÓN DEL PACIENTE ).
Se debe indicar a los pacientes que no tomen 2 dosis de CRESTOR dentro de las 12 horas de diferencia.
Efectos del músculo esquelético
Se debe advertir a los pacientes que notifiquen de inmediato cualquier dolor, sensibilidad o debilidad muscular inexplicable, especialmente si se acompaña de malestar general o fiebre, o si estos signos o síntomas musculares persisten después de interrumpir el tratamiento con CRESTOR.
Uso concomitante de antiácidos
Cuando tome CRESTOR 5 mg con una combinación de antiácidos de hidróxido de aluminio y magnesio, el antiácido debe tomarse al menos 2 horas después de la administración de CRESTOR 10 mg.
Toxicidad embriofetal
Aconseje a las mujeres con potencial reproductivo sobre el riesgo para un feto, que usen métodos anticonceptivos efectivos durante el tratamiento y que informen a su proveedor de atención médica sobre un embarazo conocido o sospechado. [ver CONTRAINDICACIONES y Uso en poblaciones específicas ].
Lactancia
Aconseje a las mujeres que no amamanten durante el tratamiento con CRESTOR [ver CONTRAINDICACIONES y Uso en poblaciones específicas ].
Enzimas del hígado
Se recomienda realizar pruebas de enzimas hepáticas antes del inicio de CRESTOR y si se presentan signos o síntomas de daño hepático. Se debe recomendar a todos los pacientes tratados con CRESTOR que notifiquen de inmediato cualquier síntoma que pueda indicar una lesión hepática, como fatiga, anorexia, molestias en la parte superior derecha del abdomen, orina oscura o ictericia.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
En un estudio de carcinogenicidad de 104 semanas en ratas a niveles de dosis de 2, 20, 60 u 80 mg/kg/día por sonda oral, la incidencia de pólipos del estroma uterino aumentó significativamente en hembras a dosis de 80 mg/kg/día a nivel sistémico. exposición 20 veces la exposición humana a 40 mg/día en base al AUC. No se observó una mayor incidencia de pólipos con dosis más bajas.
En un estudio de carcinogenicidad de 107 semanas en ratones que recibieron 10, 60 o 200 mg/kg/día por sonda oral, se observó una mayor incidencia de adenoma/carcinoma hepatocelular con 200 mg/kg/día en exposiciones sistémicas 20 veces superiores a la exposición humana. a 40 mg/día según el AUC. No se observó una mayor incidencia de tumores hepatocelulares con dosis más bajas.
La rosuvastatina no fue mutagénica ni clastogénica con o sin activación metabólica en la prueba de Ames con Salmonella typhimurium y Escherichia coli, el ensayo de linfoma de ratón y el ensayo de aberración cromosómica en células de pulmón de hámster chino. La rosuvastatina fue negativa en la prueba de micronúcleos de ratón in vivo.
En estudios de fertilidad en ratas con dosis de sonda oral de 5, 15, 50 mg/kg/día, los machos fueron tratados durante 9 semanas antes y durante el apareamiento y las hembras fueron tratadas 2 semanas antes del apareamiento y durante el apareamiento hasta el día 7 de gestación. se observó un efecto sobre la fertilidad con 50 mg/kg/día (exposiciones sistémicas de hasta 10 veces la exposición humana con 40 mg/día según el AUC). En testículos de perros tratados con rosuvastatina a 30 mg/kg/día durante un mes, se observaron células gigantes espermátidas. Se observaron células gigantes espermáticas en monos después de un tratamiento de 6 meses con 30 mg/kg/día además de la vacuolización del epitelio tubular seminífero. Las exposiciones en el perro fueron 20 veces y en el mono 10 veces la exposición humana a 40 mg/día según el área de superficie corporal. Se han observado resultados similares con otros fármacos de esta clase.
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
CRESTOR 5 mg está contraindicado para su uso en mujeres embarazadas ya que no se ha establecido la seguridad en mujeres embarazadas y no hay un beneficio aparente de la terapia con CRESTOR 20 mg durante el embarazo. Debido a que los inhibidores de la HMG-CoA reductasa disminuyen la síntesis de colesterol y posiblemente la síntesis de otras sustancias biológicamente activas derivadas del colesterol, CRESTOR puede causar daño fetal cuando se administra a mujeres embarazadas. CRESTOR 5 mg debe suspenderse tan pronto como se reconozca el embarazo [ver CONTRAINDICACIONES ]. Los datos publicados limitados sobre el uso de rosuvastatina son insuficientes para determinar un riesgo asociado con el fármaco de malformaciones congénitas importantes o aborto espontáneo. En estudios de reproducción en animales, no hubo efectos adversos en el desarrollo con la administración oral de rosuvastatina durante la organogénesis a exposiciones sistémicas equivalentes a una dosis humana máxima recomendada (MRHD) de 40 mg/día en ratas o conejos (basado en el AUC y el área de superficie corporal, respectivamente). ). En ratas y conejos, se produjo una disminución de la supervivencia fetal/de las crías a 12 veces y equivalente, respectivamente, a la MRHD de 40 mg/día [ver Datos ].
Se desconoce el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo para la población indicada. En la población general de EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 al 4 % y del 15 al 20 %, respectivamente.
Datos
Datos humanos
Los datos limitados publicados sobre la rosuvastatina no han mostrado un aumento del riesgo de malformaciones congénitas importantes o abortos espontáneos. Se han recibido informes raros de anomalías congénitas después de la exposición intrauterina a otras estatinas. En una revisión de aproximadamente 100 embarazos seguidos prospectivamente en mujeres expuestas a simvastatina o lovastatina, las incidencias de anomalías congénitas, abortos espontáneos y muertes fetales/mortinatos no excedieron lo esperado en la población general. El número de casos es adecuado para excluir un aumento de ≥3 a 4 veces de anomalías congénitas sobre la incidencia de fondo. En el 89% de los embarazos seguidos prospectivamente, el tratamiento farmacológico se inició antes del embarazo y se interrumpió en algún momento del primer trimestre cuando se identificó el embarazo.
Datos de animales
La rosuvastatina atraviesa la placenta en ratas y conejos y se encuentra en el tejido fetal y el líquido amniótico al 3 % y al 20 %, respectivamente, de la concentración plasmática materna después de una dosis única de 25 mg/kg por sonda oral el día 16 de gestación en ratas. Se observó una mayor distribución en el tejido fetal (concentración plasmática materna del 25 %) en conejos después de una dosis única por sonda oral de 1 mg/kg en el día 18 de gestación.
La administración de rosuvastatina no indicó un efecto teratogénico en ratas a ≤25 mg/kg/día o en conejos ≤3 mg/kg/día (dosis equivalentes a la MRHD de 40 mg/día según el AUC y el área de superficie corporal, respectivamente).
En ratas hembras que recibieron 5, 15 y 50 mg/kg/día antes del apareamiento y hasta el día 7 de gestación, dieron como resultado una disminución del peso corporal fetal (crías) y un retraso en la osificación a 50 mg/kg/día (10 veces la exposición humana en la dosis MRHD de 40 mg/día basada en el AUC).
En ratas preñadas que recibieron 2, 10 y 50 mg/kg/día de rosuvastatina desde el día 7 de gestación hasta el día 21 de lactancia (destete), se produjo una disminución de la supervivencia de las crías con 50 mg/kg/día (dosis equivalente a 12 veces la MRHD de 40 mg /día basado en superficie corporal).
En conejas preñadas que recibieron 0,3, 1 y 3 mg/kg/día de rosuvastatina desde el día 6 hasta el día 18 de gestación, se observó una disminución de la viabilidad fetal y mortalidad materna con 3 mg/kg/día (dosis equivalente a la MRHD de 40 mg/día). día en función de la superficie corporal).
Lactancia
Resumen de riesgos
El uso de rosuvastatina está contraindicado durante la lactancia [ver CONTRAINDICACIONES ]. Los datos limitados indican que CRESTOR está presente en la leche humana. No hay información disponible sobre los efectos del fármaco en el lactante o los efectos del fármaco en la producción de leche. Debido al potencial de reacciones adversas graves en un bebé amamantado, informe a los pacientes que no se recomienda amamantar durante el tratamiento con CRESTOR.
Hembras y machos con potencial reproductivo
Anticoncepción
CRESTOR puede causar daño fetal cuando se administra a una mujer embarazada [ver Uso en poblaciones específicas ]. Aconseje a las mujeres con potencial reproductivo que utilicen métodos anticonceptivos efectivos durante el tratamiento con CRESTOR.
Uso pediátrico
En niños y adolescentes de 8 a 17 años de edad con hipercolesterolemia familiar heterocigota, la seguridad y eficacia de CRESTOR 10 mg como complemento de la dieta para reducir los niveles de colesterol total, LDL-C y ApoB cuando, después de una prueba adecuada de terapia dietética, LDL -C excede 190 mg/dL o cuando LDL-C excede 160 mg/dL y hay antecedentes familiares positivos de ECV prematura o dos o más factores de riesgo de ECV, se establecieron en un ensayo controlado y en un ensayo abierto, no controlado. juicio [ver Estudios clínicos ]. No se ha establecido la eficacia a largo plazo del tratamiento con CRESTOR iniciado en la infancia para reducir la morbilidad y la mortalidad en la edad adulta.
La seguridad y eficacia de CRESTOR 5 mg en niños y adolescentes de 10 a 17 años con hipercolesterolemia familiar heterocigota se evaluaron en un ensayo clínico controlado de 12 semanas de duración seguido de 40 semanas de exposición abierta. Los pacientes tratados con 5 mg, 10 mg y 20 mg diarios de CRESTOR 10 mg tuvieron un perfil de experiencias adversas generalmente similar al de los pacientes tratados con placebo. No hubo ningún efecto detectable de CRESTOR sobre el crecimiento, el peso, el IMC (índice de masa corporal) o la maduración sexual [ver Estudios clínicos ] en niños y adolescentes (10 a 17 años de edad).
CRESTOR no se ha estudiado en ensayos clínicos controlados con pacientes prepúberes o menores de 10 años con hipercolesterolemia familiar heterocigota. Sin embargo, la seguridad y la eficacia de CRESTOR se evaluaron en un ensayo no controlado abierto de dos años que incluyó a niños y adolescentes de 8 a 17 años de edad con hipercolesterolemia familiar heterocigota [ver Estudios clínicos ]. La seguridad y la eficacia de CRESTOR 5 mg para reducir el LDL-C parecían generalmente consistentes con las observadas en pacientes adultos, a pesar de las limitaciones del diseño del estudio no controlado.
Se estudiaron niños y adolescentes de 7 a 15 años de edad con hipercolesterolemia familiar homocigota en un estudio cruzado, aleatorizado, controlado con placebo, de 6 semanas con CRESTOR 20 mg una vez al día seguido de 12 semanas de tratamiento abierto [ver Estudios clínicos ]. En general, el perfil de seguridad en este ensayo fue consistente con el perfil de seguridad previamente establecido en adultos.
Aunque no todas las reacciones adversas identificadas en la población adulta se han observado en ensayos clínicos de pacientes niños y adolescentes, se deben considerar las mismas advertencias y precauciones para adultos para niños y adolescentes. Se debe asesorar a las mujeres adolescentes sobre los métodos anticonceptivos apropiados mientras reciben la terapia con CRESTOR 5 mg [ver Uso en poblaciones específicas ].
Uso geriátrico
De los 10 275 pacientes en estudios clínicos con CRESTOR, 3159 (31 %) tenían 65 años o más y 698 (6,8 %) tenían 75 años o más. No se observaron diferencias generales en la seguridad o la eficacia entre estos sujetos y los sujetos más jóvenes, y otra experiencia clínica notificada no ha identificado diferencias en las respuestas entre los ancianos y los pacientes más jóvenes, pero no se puede descartar una mayor sensibilidad de algunos individuos mayores.
Los pacientes de edad avanzada tienen un mayor riesgo de miopatía y CRESTOR se debe prescribir con precaución en los pacientes de edad avanzada [ver ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ].
Insuficiencia renal
La exposición a rosuvastatina no se ve afectada por insuficiencia renal de leve a moderada (CLcr ≥30 ml/min/1,73 m²). La exposición a la rosuvastatina aumenta en un grado clínicamente significativo en pacientes con insuficiencia renal grave (CLcr DOSIFICACIÓN Y ADMINISTRACIÓN , ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ].
Deterioro hepático
CRESTOR está contraindicado en pacientes con enfermedad hepática activa, que puede incluir elevaciones persistentes e inexplicables de los niveles de transaminasas hepáticas. Se sabe que la hepatopatía alcohólica crónica aumenta la exposición a la rosuvastatina; CRESTOR 20 mg debe usarse con precaución en estos pacientes [ver CONTRAINDICACIONES , ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ].
Pacientes asiáticos
Los estudios farmacocinéticos han demostrado un aumento de aproximadamente 2 veces en la mediana de la exposición a la rosuvastatina en sujetos asiáticos en comparación con los controles caucásicos. La dosis de CRESTOR debe ajustarse en pacientes asiáticos [ver DOSIFICACIÓN Y ADMINISTRACIÓN y FARMACOLOGÍA CLÍNICA ].
SOBREDOSIS
No existe un tratamiento específico en caso de sobredosis. En caso de sobredosis, el paciente debe recibir tratamiento sintomático e instituirse las medidas de apoyo necesarias. La hemodiálisis no mejora significativamente el aclaramiento de rosuvastatina.
CONTRAINDICACIONES
CRESTOR 20mg está contraindicado en las siguientes condiciones:
- Pacientes con hipersensibilidad conocida a cualquier componente de este producto. Se han informado reacciones de hipersensibilidad que incluyen sarpullido, prurito, urticaria y angioedema con CRESTOR [ver REACCIONES ADVERSAS ].
- Pacientes con enfermedad hepática activa, que puede incluir elevaciones persistentes e inexplicables de los niveles de transaminasas hepáticas [ver ADVERTENCIAS Y PRECAUCIONES ].
- Embarazo [ver Uso en poblaciones específicas ].
- Lactancia. Los datos limitados indican que CRESTOR 20 mg está presente en la leche humana. Debido a que las estatinas tienen el potencial de causar reacciones adversas graves en los lactantes, las mujeres que requieren tratamiento con CRESTOR no deben amamantar a sus bebés [ver Uso en poblaciones específicas ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
CRESTOR 10 mg es un inhibidor selectivo y competitivo de la HMG-CoA reductasa, la enzima limitante de la velocidad que convierte la 3-hidroxi-3-metilglutaril coenzima A en mevalonato, un precursor del colesterol. Los estudios in vivo en animales y los estudios in vitro en células animales y humanas cultivadas han demostrado que la rosuvastatina tiene una alta captación y selectividad para la acción en el hígado, el órgano diana para la reducción del colesterol. En estudios in vivo e in vitro, la rosuvastatina produce sus efectos modificadores de lípidos de dos maneras. En primer lugar, aumenta el número de receptores de LDL hepáticos en la superficie celular para mejorar la captación y el catabolismo de LDL. En segundo lugar, la rosuvastatina inhibe la síntesis hepática de VLDL, lo que reduce el número total de partículas de VLDL y LDL.
Farmacodinámica
La dosis de 5 mg de CRESTOR reduce el colesterol LDL elevado y reduce el colesterol total y los triglicéridos, y aumenta el colesterol HDL [ver Estudios clínicos ]. Una respuesta terapéutica a CRESTOR 5 mg es evidente dentro de 1 semana de comenzar la terapia y el 90 % de la respuesta máxima generalmente se logra en 2 semanas. La respuesta máxima generalmente se logra a las 4 semanas y se mantiene después de eso. La individualización de la dosis del fármaco debe basarse en la respuesta terapéutica [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Farmacocinética
Absorción
En estudios de farmacología clínica en humanos, las concentraciones plasmáticas máximas de rosuvastatina se alcanzaron de 3 a 5 horas después de la administración oral. Tanto la Cmax como el AUC aumentaron en una proporción aproximada a la dosis de 10 mg de CRESTOR. La biodisponibilidad absoluta de la rosuvastatina es de aproximadamente el 20%.
La administración de CRESTOR con alimentos no afectó el AUC de rosuvastatina.
El AUC de la rosuvastatina no difiere después de la administración del fármaco por la noche o por la mañana.
Distribución
El volumen medio de distribución en estado estacionario de rosuvastatina es de aproximadamente 134 litros. La rosuvastatina se une en un 88 % a las proteínas plasmáticas, principalmente a la albúmina. Esta unión es reversible e independiente de las concentraciones plasmáticas.
Eliminación
La rosuvastatina se elimina principalmente por excreción en las heces. La vida media de eliminación de la rosuvastatina es de aproximadamente 19 horas.
Metabolismo
La rosuvastatina no se metaboliza extensamente; aproximadamente el 10% de una dosis radiomarcada se recupera como metabolito. El principal metabolito es la N-desmetil rosuvastatina, que se forma principalmente por el citocromo P450 \ 2C9, y los estudios in vitro han demostrado que la N-desmetil rosuvastatina tiene aproximadamente entre un sexto y la mitad de la actividad inhibidora de la HMG-CoA reductasa del compuesto original. . En general, más del 90 % de la actividad inhibidora de la HMG-CoA reductasa activa en plasma se explica por el compuesto original.
Excreción
Tras la administración oral, la rosuvastatina y sus metabolitos se excretan principalmente en las heces (90%). Después de una dosis intravenosa, aproximadamente el 28 % del aclaramiento corporal total se realizó por vía renal y el 72 % por vía hepática.
Poblaciones Específicas
Grupos raciales o étnicos
Un análisis farmacocinético poblacional no reveló diferencias clínicamente relevantes en la farmacocinética entre los grupos caucásicos, hispanos y negros o afrocaribeños. Sin embargo, los estudios farmacocinéticos, incluido uno realizado en los EE. UU., han demostrado una elevación de aproximadamente el doble en la exposición media (AUC y Cmax) en sujetos asiáticos en comparación con un grupo de control caucásico.
Pacientes masculinos y femeninos
No hubo diferencias en las concentraciones plasmáticas de rosuvastatina entre hombres y mujeres.
Pacientes pediátricos
En un análisis farmacocinético poblacional de dos ensayos pediátricos que incluyeron pacientes con hipercolesterolemia familiar heterocigota de 10 a 17 años y de 8 a 17 años, respectivamente, la exposición a rosuvastatina pareció ser comparable o menor que la exposición a rosuvastatina en pacientes adultos.
Pacientes geriátricos
No hubo diferencias en las concentraciones plasmáticas de rosuvastatina entre las poblaciones no ancianas y ancianas (edad ≥65 años).
Pacientes con insuficiencia renal
La insuficiencia renal de leve a moderada (CLcr ≥30 ml/min/1,73 m²) no influyó en las concentraciones plasmáticas de rosuvastatina. Sin embargo, las concentraciones plasmáticas de rosuvastatina aumentaron de forma clínicamente significativa (unas 3 veces) en pacientes con insuficiencia renal grave (CLcr 80 ml/min/ 1,73 m²).
Hemodiálisis
Las concentraciones plasmáticas en estado estacionario de rosuvastatina en pacientes en hemodiálisis crónica fueron aproximadamente un 50 % mayores en comparación con sujetos voluntarios sanos con función renal normal.
Pacientes con insuficiencia hepática
En pacientes con hepatopatía alcohólica crónica, las concentraciones plasmáticas de rosuvastatina aumentaron ligeramente.
En pacientes con enfermedad de Child-Pugh A, la Cmax y el AUC aumentaron en un 60 % y un 5 %, respectivamente, en comparación con pacientes con función hepática normal. En pacientes con enfermedad de Child-Pugh B, la Cmax y el AUC aumentaron un 100 % y un 21 %, respectivamente, en comparación con pacientes con función hepática normal.
Estudios de interacciones farmacológicas
El aclaramiento de rosuvastatina no depende del metabolismo por el citocromo P450 3A4 en un grado clínicamente significativo.
La rosuvastatina es un sustrato para ciertas proteínas transportadoras, incluida la poliproteína transportadora de aniones orgánicos 1B1 del transportador hepático (OATP1B1) y la proteína resistente al cáncer de mama transportadora de eflujo (BCRP). La administración concomitante de CRESTOR 10 mg con medicamentos que son inhibidores de estas proteínas transportadoras (p. ej., ciclosporina, ciertos inhibidores de la proteasa del VIH) puede provocar un aumento de las concentraciones plasmáticas de rosuvastatina [ver DOSIFICACIÓN Y ADMINISTRACIÓN y INTERACCIONES CON LA DROGAS ].
farmacogenómica
La disposición de los inhibidores de la HMG-CoA reductasa, incluida la rosuvastatina, involucra a OATP1B1 y otras proteínas transportadoras. Se han informado concentraciones plasmáticas más altas de rosuvastatina en grupos muy pequeños de pacientes (n=3 a 5) que tienen dos alelos de función reducida del gen que codifica OATP1B1 (SLCO1B1 521T > C). La frecuencia de este genotipo (es decir, SLCO1B1 521 C/C) es generalmente inferior al 5 % en la mayoría de los grupos raciales/étnicos. El impacto de este polimorfismo sobre la eficacia y/o seguridad de rosuvastatina no ha sido claramente establecido.
Toxicología Animal Y/o Farmacología
Toxicidad del sistema nervioso central
Se han observado lesiones vasculares del SNC, caracterizadas por hemorragias perivasculares, edema e infiltración de células mononucleares de los espacios perivasculares, en perros tratados con varios otros miembros de esta clase de fármacos. Un fármaco químicamente similar de esta clase produjo degeneración del nervio óptico dependiente de la dosis (degeneración walleriana de fibras retinogeniculadas) en perros, a una dosis que produjo niveles plasmáticos del fármaco unas 30 veces más altos que el nivel medio del fármaco en seres humanos que tomaban la dosis más alta recomendada. Se observó edema, hemorragia y necrosis parcial en el intersticio del plexo coroideo en una perra sacrificada moribunda el día 24 a 90 mg/kg/día por sonda oral (exposiciones sistémicas 100 veces la exposición humana a 40 mg/día en base a AUC). Se observó opacidad de la córnea en perros tratados durante 52 semanas con 6 mg/kg/día por sonda oral (exposiciones sistémicas 20 veces la exposición humana a 40 mg/día según el AUC). Se observaron cataratas en perros tratados durante 12 semanas por sonda oral a 30 mg/kg/día (exposiciones sistémicas 60 veces la exposición humana a 40 mg/día según el AUC). Se observaron displasia retinal y pérdida retinal en perros tratados durante 4 semanas con sonda oral a 90 mg/kg/día (exposiciones sistémicas 100 veces la exposición humana a 40 mg/día según el AUC). Las dosis ≤30 mg/kg/día (exposiciones sistémicas ≤60 veces la exposición humana a 40 mg/día según el AUC) no revelaron hallazgos en la retina durante el tratamiento hasta por un año.
Estudio de Toxicología Juvenil
En un estudio juvenil, las ratas recibieron dosis por sonda oral de 10 o 50 mg/kg/día desde el destete durante 9 semanas antes del apareamiento, durante el apareamiento y hasta el día anterior a la necropsia para los machos o hasta el día 7 de gestación para las hembras. No se observaron efectos sobre el desarrollo sexual, la apariencia testicular y del epidídimo o la fertilidad en ninguno de los niveles de dosis (2 veces o hasta 24 veces la exposición humana (AUC) a la dosis pediátrica máxima de 20 mg/día).
Estudios clínicos
Hiperlipidemia y dislipidemia mixta
CRESTOR 5mg reduce el C-Total, LDL-C, ApoB, no-HDL-C y TG, y aumenta el HDL-C, en pacientes adultos con hiperlipidemia y dislipidemia mixta.
Estudio de rango de dosis
En un estudio multicéntrico, doble ciego, controlado con placebo, de rango de dosis en pacientes con hiperlipidemia, CRESTOR administrado como una dosis diaria única durante 6 semanas redujo significativamente el C-total, el C-LDL, el C-no-HDL y la ApoB, a lo largo de la dosis rango (Cuadro 6).
Estudio controlado activo
CRESTOR 5 mg se comparó con los inhibidores de la HMG-CoA reductasa atorvastatina, simvastatina y pravastatina en un estudio multicéntrico, abierto y de rango de dosis de 2240 pacientes con hiperlipidemia o dislipidemia mixta. Después de la aleatorización, los pacientes fueron tratados durante 6 semanas con una dosis diaria única de CRESTOR 20 mg, atorvastatina, simvastatina o pravastatina (Figura 1 y Tabla 7).
Figura 1: Cambio porcentual de LDL-C por dosis de CRESTOR 20 mg, atorvastatina, simvastatina y pravastatina en la semana 6 en pacientes con hiperlipidemia o dislipidemia mixta 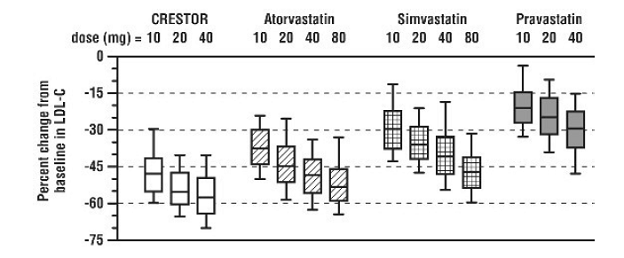
Los diagramas de caja son una representación de los valores de los percentiles 25, 50 y 75, con bigotes que representan los valores de los percentiles 10 y 90. C-LDL basal medio: 189 mg/Dl
Hipercolesterolemia familiar heterocigota
Estudio controlado activo
En un estudio de pacientes con HF heterocigota (LDL promedio inicial de 291), los pacientes fueron aleatorizados para recibir CRESTOR 20 mg o atorvastatina 20 mg. La dosis se aumentó en intervalos de 6 semanas. Se observaron reducciones significativas de C-LDL con respecto al valor inicial en cada dosis en ambos grupos de tratamiento (Tabla 8).
Hipertrigliceridemia
Estudio de dosis-respuesta
En un estudio de respuesta a la dosis, doble ciego, controlado con placebo en pacientes con niveles iniciales de TG de 273 a 817 mg/dL, CRESTOR 10 mg administrados como dosis única diaria (5 a 40 mg) durante 6 semanas redujo significativamente los niveles séricos de TG ( Tabla 9).
Disbetalipoproteinemia primaria (hiperlipoproteinemia tipo III)
En un estudio aleatorizado, multicéntrico, cruzado, doble ciego, 32 pacientes (27 con ε2/ε2 y 4 con mutación apo E [Arg145Cys] con disbetalipoproteinemia primaria (hiperlipoproteinemia tipo III) ingresaron a un período de introducción dietética de 6 semanas en el NCEP Dieta de Cambio Terapéutico en el Estilo de Vida (TLC) Después de la introducción dietética, los pacientes fueron aleatorizados a una secuencia de tratamientos junto con la dieta TLC durante 6 semanas cada uno: rosuvastatina 10 mg seguida de rosuvastatina 20 mg o rosuvastatina 20 mg seguida de rosuvastatina 10 mg CRESTOR redujo los niveles de lipoproteínas remanentes circulantes y no HDL-C (criterio de valoración principal) Los resultados se muestran en la siguiente tabla.
Hipercolesterolemia familiar homocigota
Estudio de titulación de dosis
En un estudio abierto de titulación forzada, se evaluó la respuesta de pacientes con HF homocigotos (n=40, 8-63 años) a CRESTOR 20 a 40 mg titulados en un intervalo de 6 semanas. En la población general, la reducción media de C-LDL desde el inicio fue del 22 %. Alrededor de un tercio de los pacientes se beneficiaron del aumento de la dosis de 20 mg a 40 mg con una reducción adicional de LDL de más del 6 %. En los 27 pacientes con al menos una reducción del 15 % en LDL-C, la reducción media de LDL-C fue del 30 % (mediana de reducción del 28 %). Entre 13 pacientes con una reducción de LDL-C de
Pacientes pediátricos con hipercolesterolemia familiar homocigótica
CRESTOR se estudió en un estudio cruzado, aleatorizado, doble ciego, controlado con placebo, multicéntrico, en 14 niños y adolescentes con hipercolesterolemia familiar homocigótica. El estudio incluyó una fase introductoria dietética de 4 semanas durante la cual los pacientes recibieron CRESTOR 10 mg al día, una fase cruzada que incluyó dos períodos de tratamiento de 6 semanas con CRESTOR 20 mg o placebo en orden aleatorio, seguido de un período de 12 semanas. semana de fase abierta durante la cual todos los pacientes recibieron CRESTOR 20 mg. Los pacientes tenían entre 7 y 15 años de edad (mediana de 11 años), el 50 % eran hombres, el 71 % eran caucásicos, el 21 % eran asiáticos, el 7 % eran negros y ningún paciente era de etnia hispana. El cincuenta por ciento estaba en terapia de aféresis y el 57% estaba tomando ezetimiba. Los pacientes que ingresaron al estudio con terapia de aféresis o ezetimiba continuaron con el tratamiento durante todo el estudio. La media de C-LDL al inicio del estudio fue de 416 mg/dL (rango de 152 a 716 mg/dL). Un total de 13 pacientes completaron ambos períodos de tratamiento de la fase cruzada aleatoria; un paciente retiró el consentimiento debido a la imposibilidad de extraer sangre durante la fase cruzada.
CRESTOR 20 mg redujo significativamente el C-LDL, el colesterol total, la ApoB y el C-no-HDL en comparación con el placebo (Tabla 11).
Pacientes pediátricos con hipercolesterolemia familiar heterocigota
En un estudio doble ciego, aleatorizado, multicéntrico, controlado con placebo, de 12 semanas, 176 (97 hombres y 79 mujeres) niños y adolescentes con hipercolesterolemia familiar heterocigota fueron aleatorizados para recibir rosuvastatina 5, 10 o 20 mg o placebo al día. Los pacientes tenían entre 10 y 17 años de edad (mediana de edad de 14 años) con aproximadamente el 30 % de los pacientes entre 10 y 13 años y aproximadamente el 17 %, 18 %, 40 % y 25 % en los estadios de Tanner II, III, IV, y V, respectivamente. Las hembras tenían al menos 1 año después de la menarquia. La media de C-LDL al inicio del estudio fue de 233 mg/dL (rango de 129 a 399). La fase doble ciego de 12 semanas fue seguida por una fase abierta de titulación de dosis de 40 semanas, en la que todos los pacientes (n=173) recibieron 5 mg, 10 mg o 20 mg de rosuvastatina al día.
La rosuvastatina redujo significativamente los niveles de LDL-C (punto final primario), colesterol total y ApoB en cada dosis en comparación con el placebo. Los resultados se muestran en la Tabla 12 a continuación.
Al final del período de tratamiento doble ciego de 12 semanas, el porcentaje de pacientes que lograron el objetivo de C-LDL de menos de 110 mg/dl (2,8 mmol/l) fue del 0 % para el placebo y del 12 % para la rosuvastatina de 5 mg. , 41% para rosuvastatina 10 mg y 41% para rosuvastatina 20 mg. Para la fase abierta de 40 semanas, el 71 % de los pacientes se ajustaron a la dosis máxima de 20 mg y el 41 % de los pacientes alcanzaron la meta de C-LDL de 110 mg/dl.
La rosuvastatina también se estudió en un ensayo abierto, no controlado, de titulación hasta el objetivo de dos años que incluyó a 175 niños y adolescentes con hipercolesterolemia familiar heterocigota que tenían entre 8 y 17 años (79 niños y 96 niñas). Todos los pacientes tenían un defecto genético documentado en el receptor de LDL o en ApoB. Aproximadamente el 89 % eran caucásicos, el 7 % asiáticos, el 1 % negros y menos del 1 % hispanos. La media de C-LDL al inicio del estudio fue de 236 mg/dl. Cincuenta y ocho (33%) pacientes eran prepuberales al inicio del estudio. La dosis inicial de rosuvastatina para todos los niños y adolescentes fue de 5 mg una vez al día. Los niños de 8 a menos de 10 años (n=41 al inicio del estudio) podían ajustar la dosis a una dosis máxima de 10 mg una vez al día, y los niños y adolescentes de 10 a 17 años podían ajustar la dosis a una dosis máxima de 20 mg una vez al día.
Las reducciones en LDL-C desde el inicio fueron generalmente consistentes en todos los grupos de edad dentro del ensayo, así como con la experiencia previa en ensayos controlados con adultos y pediátricos.
No se ha establecido la eficacia a largo plazo del tratamiento con rosuvastatina iniciado en la infancia para reducir la morbilidad y la mortalidad en la edad adulta.
Disminución de la progresión de la aterosclerosis
En el estudio Medición de los efectos sobre el grosor de la íntima media: una evaluación de la rosuvastatina de 40 mg (METEOR), se evaluó el efecto de la terapia con CRESTOR sobre la aterosclerosis carotídea mediante ultrasonografía en modo B en pacientes con LDL-C elevado, con bajo riesgo (riesgo de Framingham).
La tasa de cambio anualizada desde el inicio para el grupo de placebo fue de +0,0131 mm/año (p
A nivel de paciente individual en el grupo tratado con CRESTOR, el 52,1 % de los pacientes demostraron una ausencia de progresión de la enfermedad (definida como una tasa de cambio anualizada negativa), en comparación con el 37,7 % de los pacientes en el grupo de placebo.
Prevención primaria de enfermedades cardiovasculares
En el estudio Justification for the Use of Statins in Primary Prevention: An Intervention Trial Evaluating Rosuvastatin (JUPITER), se evaluó el efecto de CRESTOR (rosuvastatina cálcica) en la aparición de eventos de enfermedades cardiovasculares (CV) mayores en 17 802 hombres (≥50 años). ) y mujeres (≥ 60 años) que no tenían enfermedad cardiovascular clínicamente evidente, niveles de LDL-C
El criterio principal de valoración fue un criterio de valoración compuesto que consistía en el tiempo transcurrido hasta la primera aparición de cualquiera de los siguientes eventos CV importantes: muerte CV, infarto de miocardio no mortal, accidente cerebrovascular no mortal, hospitalización por angina inestable o un procedimiento de revascularización arterial.
La rosuvastatina redujo significativamente el riesgo de eventos cardiovasculares mayores (252 eventos en el grupo de placebo frente a 142 eventos en el grupo de rosuvastatina) con una reducción estadísticamente significativa (p
Figura 2: Tiempo hasta la primera ocurrencia de eventos cardiovasculares mayores en JUPITER 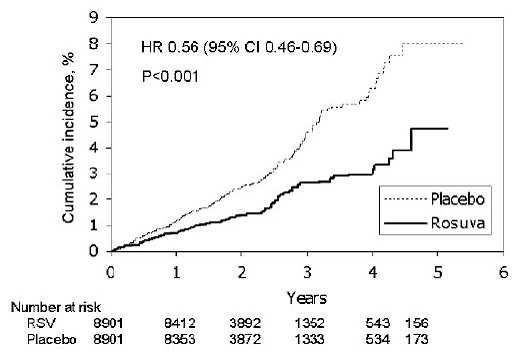
Los componentes individuales del punto final primario se presentan en la Figura 3. La rosuvastatina redujo significativamente el riesgo de infarto de miocardio no fatal, accidente cerebrovascular no fatal y procedimientos de revascularización arterial. No hubo diferencias de tratamiento significativas entre los grupos de rosuvastatina y placebo para la muerte por causas cardiovasculares o las hospitalizaciones por angina inestable.
Rosuvastatina redujo significativamente el riesgo de infarto de miocardio (6 eventos fatales y 62 eventos no fatales en sujetos tratados con placebo frente a 9 eventos fatales y 22 eventos no fatales en sujetos tratados con rosuvastatina) y el riesgo de accidente cerebrovascular (6 eventos fatales y 58 eventos no fatales en sujetos tratados con rosuvastatina). sujetos tratados con placebo frente a 3 eventos fatales y 30 eventos no fatales en sujetos tratados con rosuvastatina).
En un análisis de subgrupos post-hoc de sujetos JUPITER (n=1405; rosuvastatina=725, placebo=680) con PCRhs ≥2 mg/L y sin otros factores de riesgo tradicionales (tabaquismo, PA ≥140/90 o tomando antihipertensivos, niveles bajos de HDL-C) aparte de la edad, después del ajuste por HDL-C alto, no hubo un beneficio significativo del tratamiento con rosuvastatina.
Figura 3: Eventos CV Mayores por Grupo de Tratamiento en JUPITER 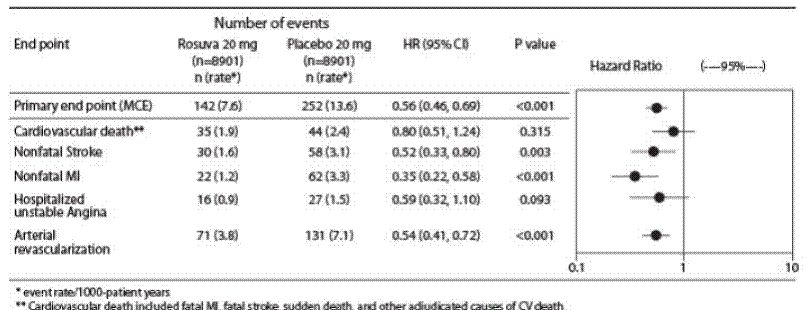
Al año, la rosuvastatina aumentó el HDL-C y redujo los niveles de LDL-C, hsCRP, colesterol total y triglicéridos séricos (p
INFORMACIÓN DEL PACIENTE
CRESTOR® (Kres-tor) tabletas de rosuvastatina cálcica
Lea detenidamente esta Información para el paciente antes de comenzar a tomar CRESTOR 20 mg y cada vez que renueve su receta. Si tiene alguna duda sobre CRESTOR, consulte a su médico. Solo su médico puede determinar si CRESTOR es adecuado para usted.
¿Qué es CRESTOR?
CRESTOR 20 mg es un medicamento recetado que contiene un medicamento para reducir el colesterol llamado rosuvastatina cálcica. La mayor parte del colesterol en la sangre se produce en el hígado. CRESTOR 20 mg funciona al reducir el colesterol de dos maneras: CRESTOR 5 mg bloquea una enzima en el hígado que hace que el hígado produzca menos colesterol, y CRESTOR 20 mg aumenta la absorción y descomposición por parte del hígado del colesterol que ya está en la sangre.
- CRESTOR se utiliza junto con la dieta para:
- reducir el nivel de su colesterol "malo" (LDL)
- aumentar el nivel de su colesterol "bueno" (HDL)
- reducir el nivel de grasa en la sangre (triglicéridos)
- retardar la acumulación de depósitos de grasa (placa) en las paredes de los vasos sanguíneos
- CRESTOR se utiliza para tratar:
- adultos que no pueden controlar sus niveles de colesterol solo con dieta y ejercicio
- niños de 8 a 17 años de edad con hipercolesterolemia familiar heterocigota (una condición hereditaria que causa niveles altos de LDL)
- niños de 7 a 17 años de edad con hipercolesterolemia familiar homocigota (una condición hereditaria que causa altos niveles de LDL).
CRESTOR 20 mg no está aprobado para uso en niños con hipercolesterolemia familiar heterocigota menores de 8 años o para uso en niños con hipercolesterolemia familiar homocigota menores de 7 años.
CRESTOR 5mg se usa para reducir el riesgo de ataques cardíacos y accidentes cerebrovasculares en hombres mayores de 50 años y mujeres mayores de 60 años que no tienen enfermedad cardíaca conocida pero tienen ciertos factores de riesgo adicionales.
No se sabe si CRESTOR 10 mg es seguro y efectivo en personas que tienen dislipidemias tipo I y V de Fredrickson.
¿Quién no debe tomar CRESTOR?
No tome CRESTOR si usted:
- es alérgico a la rosuvastatina cálcica o a cualquiera de los ingredientes de CRESTOR. Consulte el final de este folleto para obtener una lista completa de los ingredientes de CRESTOR.
- tiene problemas hepáticos.
- está embarazada o cree que podría estarlo, o tiene intención de quedarse embarazada. CRESTOR 20 mg puede dañar a su bebé nonato. Si queda embarazada, deje de tomar CRESTOR y llame a su médico de inmediato. Si no planea quedar embarazada, debe usar un método anticonceptivo eficaz (anticoncepción) mientras esté tomando CRESTOR.
- están amamantando. Los medicamentos como CRESTOR 5 mg pueden pasar a la leche materna y dañar a su bebé.
¿Qué debo decirle a mi médico antes y durante el tratamiento con CRESTOR?
Informe a su médico si usted:
- tiene dolores musculares o debilidad inexplicables
- tiene o ha tenido problemas renales
- tiene o ha tenido problemas hepáticos
- beber más de 2 vasos de alcohol al día
- tiene problemas de tiroides
- tiene 65 años de edad o más
- son de ascendencia asiática
- está embarazada o cree que puede estar embarazada, o planea quedar embarazada
- están amamantando
Informe a su médico sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos a base de hierbas.
Hable con su médico antes de empezar a tomar cualquier medicamento nuevo.
Tomar CRESTOR 20 mg con ciertos otros medicamentos puede afectarse entre sí y causar efectos secundarios. CRESTOR puede afectar la forma en que funcionan otros medicamentos y otros medicamentos pueden afectar la forma en que funciona CRESTOR.
Informe especialmente a su médico si toma:
- ciclosporina (un medicamento para su sistema inmunitario)
- gemfibrozil (un medicamento de ácido fíbrico para reducir el colesterol)
- medicamentos antivirales, incluidos los inhibidores de la proteasa del VIH o de la hepatitis C (como lopinavir, ritonavir, fosamprenavir, tipranavir, atazanavir o simeprevir)
- ciertos medicamentos antifúngicos (como itraconazol, ketoconazol y fluconazol)
- anticoagulantes cumarínicos (medicamentos que previenen la formación de coágulos de sangre, como la warfarina)
- niacina o ácido nicotínico
- derivados del ácido fíbrico (como fenofibrato)
- colchicina (un medicamento utilizado para tratar la gota)
Pídale a su médico o farmacéutico una lista de estos medicamentos si no está seguro.
Conozca todos los medicamentos que toma. Mantenga una lista de ellos para mostrársela a su médico y farmacéutico cuando obtenga un nuevo medicamento.
¿Cómo debo tomar CRESTOR 10mg?
- Tome CRESTOR exactamente como su médico le indique que lo tome.
- Tome CRESTOR, por vía oral, 1 vez al día. Trague la tableta entera.
- CRESTOR se puede tomar a cualquier hora del día, con o sin alimentos.
- No haga cambie su dosis o suspenda CRESTOR 10 mg sin hablar con su médico, incluso si se siente bien.
- Su médico puede realizarle análisis de sangre para controlar sus niveles de colesterol antes y durante su tratamiento con CRESTOR. Su médico puede cambiar su dosis de CRESTOR 10 mg si es necesario.
- Su médico puede comenzar con una dieta para reducir el colesterol antes de darle CRESTOR. Siga esta dieta cuando tome CRESTOR.
- Espere al menos 2 horas después de tomar CRESTOR para tomar un antiácido que contenga una combinación de hidróxido de aluminio y magnesio.
- Si olvida una dosis de CRESTOR 10 mg, tómela tan pronto como lo recuerde. Sin embargo, no tome 2 dosis de CRESTOR 10 mg dentro de las 12 horas de diferencia.
- Si toma demasiado CRESTOR 20 mg o tiene una sobredosis, llame a su médico o vaya a la sala de emergencias del hospital más cercano de inmediato.
¿Cuáles son los posibles efectos secundarios de CRESTOR 20mg?
CRESTOR 10 mg puede causar efectos secundarios graves, que incluyen:
- Dolor muscular, sensibilidad y debilidad (miopatía). Los problemas musculares, incluida la degradación muscular, pueden ser graves en algunas personas y rara vez causan daño renal que puede causar la muerte. Informe a su médico de inmediato si:
- tiene dolor muscular, sensibilidad o debilidad inexplicable, especialmente si tiene fiebre o se siente más cansado de lo normal, mientras toma CRESTOR.
- tiene problemas musculares que no desaparecen incluso después de que su médico le haya dicho que deje de tomar CRESTOR. Su médico puede realizar más pruebas para diagnosticar la causa de sus problemas musculares.
Sus posibilidades de tener problemas musculares son mayores si usted:
- está tomando ciertos otros medicamentos mientras toma CRESTOR
- tiene 65 años de edad o más
- tiene problemas de tiroides (hipotiroidismo) que no están controlados
- tiene problemas renales
- están tomando dosis más altas de CRESTOR
- Problemas hepáticos. Su médico debe realizar análisis de sangre para controlar su hígado antes de comenzar a tomar CRESTOR 5 mg y si tiene síntomas de problemas hepáticos mientras toma CRESTOR. Llame a su médico de inmediato si tiene alguno de los siguientes síntomas de problemas hepáticos:
- sentirse inusualmente cansado o débil
- pérdida de apetito
- dolor en la parte superior del vientre
- orina oscura
- coloración amarillenta de la piel o del blanco de los ojos
Los efectos secundarios más comunes pueden incluir: dolor de cabeza, dolores y molestias musculares, dolor abdominal, debilidad y náuseas.
Los efectos secundarios adicionales que se han informado con CRESTOR incluyen pérdida de memoria y confusión.
Informe a su médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de CRESTOR. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar CRESTOR 20mg?
- Guarde CRESTOR 10 mg a temperatura ambiente, entre 20 °C y 25 °C (68 °F y 77 °F) y en un lugar seco.
- Deseche de forma segura los medicamentos vencidos o que ya no necesite.
Mantenga CRESTOR 10 mg y todos los medicamentos fuera del alcance de los niños.
¿Cuáles son los ingredientes de CRESTOR?
Ingrediente activo: rosuvastatina como rosuvastatina cálcica
Ingredientes inactivos: celulosa microcristalina NF, lactosa monohidrato NF, fosfato de calcio tribásico NF, crospovidona NF, estearato de magnesio NF, hipromelosa NF, triacetina NF, dióxido de titanio USP, óxido férrico amarillo y óxido férrico rojo NF.
Información general sobre el uso seguro y eficaz de CRESTOR
veces, los medicamentos se recetan para fines distintos a los enumerados en el folleto de información para el paciente. No use CRESTOR 10 mg para una condición para la cual no fue recetado. No le dé CRESTOR 20 mg a otras personas, incluso si tienen la misma condición médica que usted tiene. Puede que les haga daño.
Puede pedirle a su farmacéutico o médico información sobre CRESTOR 5mg que está escrita para profesionales de la salud.
Esta información para el paciente ha sido aprobada por la Administración de Drogas y Alimentos de los EE. UU. Revisado el 9/2018
