Zetia 10mg Ezetimibe Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Zetia y cómo se usa?
Zetia es un medicamento recetado que se usa para tratar los síntomas del colesterol alto y para reducir el colesterol. Zetia se puede usar solo o con otros medicamentos.
Zetia pertenece a una clase de medicamentos llamados agentes reductores de lípidos, 2-azetidinonas.
No se sabe si Zetia 10 mg es seguro y eficaz en niños menores de 10 años.
¿Cuáles son los posibles efectos secundarios de Zetia?
Zetia puede causar efectos secundarios graves que incluyen:
- dolor muscular,
- sensibilidad o debilidad muscular,
- fiebre,
- cansancio inusual, y
- orina de color oscuro
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Zetia 10 mg incluyen:
- dolor muscular o articular,
- congestión nasal,
- dolor de sinusitis,
- dolor de garganta,
- diarrea, y
- dolor en un brazo o una pierna
Informe a su médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Zetia. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
ZETIA (ezetimiba) pertenece a una clase de compuestos reductores de lípidos que inhiben selectivamente la absorción intestinal de colesterol y fitoesteroles relacionados. El nombre químico de ezetimiba es 1-(4-fluorofenil)-3(R)-[3-(4-fluorofenil)-3(S)-hidroxipropil]-4(S)-(4-hidroxifenil)-2-azetidinona . La fórmula empírica es C24H21F2NO3. Su peso molecular es 409,4 y su fórmula estructural es:
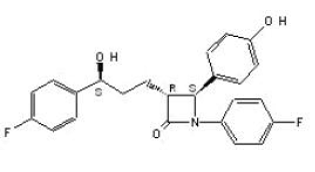
La ezetimiba es un polvo cristalino blanco que es de libre a muy soluble en etanol, metanol y acetona y prácticamente insoluble en agua. Ezetimibe tiene un punto de fusión de aproximadamente 163°C y es estable a temperatura ambiente. ZETIA 10 mg está disponible como tableta para administración oral que contiene 10 mg de ezetimiba y los siguientes ingredientes inactivos: croscarmelosa sódica NF, lactosa monohidrato NF, estearato de magnesio NF, celulosa microcristalina NF, povidona USP y lauril sulfato de sodio NF.
INDICACIONES
La terapia con agentes que alteran los lípidos debe ser solo un componente de la intervención de múltiples factores de riesgo en individuos con un riesgo significativamente mayor de enfermedad vascular aterosclerótica debido a la hipercolesterolemia. La farmacoterapia está indicada como complemento de la dieta cuando la respuesta a una dieta restringida en grasas saturadas y colesterol y otras medidas no farmacológicas solas ha sido inadecuada.
Hiperlipidemia primaria
Monoterapia
ZETIA®, administrado solo, está indicado como terapia complementaria a la dieta para reducir el colesterol total elevado (C-total), el colesterol de lipoproteínas de baja densidad (LDL-C), la apolipoproteína B (Apo B) y el colesterol de lipoproteínas de baja densidad. (no-HDL-C) en pacientes con hiperlipidemia primaria (familiar heterocigota y no familiar).
Terapia combinada con inhibidores de la HMG-CoA reductasa (estatinas)
ZETIA 10 mg, administrado en combinación con un inhibidor de la reductasa (estatina) de 3-hidroxi-3-metilglutaril-coenzima A (HMG-CoA), está indicado como terapia complementaria a la dieta para reducir los niveles elevados de C-total, LDL-C, Apo B, y no HDL-C en pacientes con hiperlipidemia primaria (familiar heterocigota y no familiar).
Terapia combinada con fenofibrato
ZETIA 10 mg, administrado en combinación con fenofibrato, está indicado como tratamiento complementario a la dieta para reducir los niveles elevados de C-total, LDL-C, Apo B y no-HDL-C en pacientes adultos con hiperlipidemia mixta.
Hipercolesterolemia Familiar Homocigota (HoFH)
La combinación de ZETIA 10 mg y atorvastatina o simvastatina está indicada para la reducción de los niveles elevados de C-total y LDL-C en pacientes con HoFH, como complemento de otros tratamientos para reducir los lípidos (p. ej., aféresis de LDL) o si dichos tratamientos no están disponibles. .
Sitosterolemia homocigota
ZETIA 10 mg está indicado como tratamiento complementario a la dieta para reducir los niveles elevados de sitosterol y campesterol en pacientes con sitosterolemia familiar homocigota.
Limitaciones de uso
No se ha determinado el efecto de ZETIA sobre la morbilidad y mortalidad cardiovascular.
ZETIA no se ha estudiado en las dislipidemias tipo I, III, IV y V de Fredrickson.
DOSIFICACIÓN Y ADMINISTRACIÓN
Información general de dosificación
La dosis recomendada de ZETIA es de 10 mg una vez al día.
ZETIA 10 mg se puede administrar con o sin alimentos.
Tratamiento hipolipemiante concomitante
ZETIA 10 mg se puede administrar con una estatina (en pacientes con hiperlipidemia primaria) o con fenofibrato (en pacientes con hiperlipidemia mixta) para aumentar el efecto. Por conveniencia, la dosis diaria de ZETIA puede tomarse al mismo tiempo que la estatina o el fenofibrato, de acuerdo con las recomendaciones de dosificación de los respectivos medicamentos.
Coadministra con secuestrantes de ácidos biliares
La dosificación de ZETIA debe ocurrir ≥2 horas antes o ≥4 horas después de la administración de un secuestrante de ácidos biliares [ver INTERACCIONES CON LA DROGAS ].
Pacientes con insuficiencia hepática
No es necesario ajustar la dosis en pacientes con insuficiencia hepática leve [ver ADVERTENCIAS Y PRECAUCIONES ].
Pacientes con Insuficiencia Renal
No es necesario ajustar la dosis en pacientes con insuficiencia renal [ver FARMACOLOGÍA CLÍNICA ]. Cuando se administre con simvastatina en pacientes con insuficiencia renal de moderada a grave (tasa de filtración glomerular estimada Uso en poblaciones específicas ].
Pacientes geriátricos
No es necesario ajustar la dosis en pacientes geriátricos [ver FARMACOLOGÍA CLÍNICA ].
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Las tabletas de 10 mg son de color blanco a blanquecino, en forma de cápsula, grabadas con "414" en un lado.
Almacenamiento y manipulación
No. 3861 - Tabletas ZETIA, 10 mg , son comprimidos de color blanco a blanquecino, con forma de cápsula, grabados con “414” en una cara. Se suministran de la siguiente manera:
CDN 66582-414-31 botellas de 30 CDN 66582-414-54 botellas de 90 CDN 66582-414-74 botellas de 500 CDN 66582-414-76 botellas de 5000 CDN 66582-414-28 envases monodosis de 100.
Almacenamiento
Almacenar a 25°C (77°F); excursiones permitidas a 15-30°C (59-86°F). [Ver Temperatura ambiente controlada por USP .] Proteger de la humedad.
Merck Sharp & Dohme Corp., una subsidiaria de MERCK & CO., INC., Whitehouse Station, NJ 08889, EE. UU. Revisado: agosto de 2013
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas graves se analizan con mayor detalle en otras secciones de la etiqueta:
- Anomalías de las enzimas hepáticas [ver ADVERTENCIAS Y PRECAUCIONES ]
- Rabdomiólisis y miopatía [ver ADVERTENCIAS Y PRECAUCIONES ]
Estudios de monoterapia
En la base de datos de ensayos clínicos controlados de ZETIA 10 mg (controlados con placebo) de 2396 pacientes con una mediana de duración del tratamiento de 12 semanas (rango de 0 a 39 semanas), el 3,3 % de los pacientes con ZETIA 10 mg y el 2,9 % de los pacientes con placebo interrumpieron el tratamiento debido a reacciones adversas. reacciones Las reacciones adversas más comunes en el grupo de pacientes tratados con ZETIA 10 mg que llevaron a la interrupción del tratamiento y que ocurrieron a una tasa mayor que el placebo fueron:
- Artralgia (0,3%)
- Mareos (0,2%)
- Aumento de gamma-glutamiltransferasa (0,2 %)
Las reacciones adversas notificadas con mayor frecuencia (incidencia ≥2 % y mayor que el placebo) en la base de datos de ensayos clínicos controlados de monoterapia con ZETIA de 2396 pacientes fueron: infección del tracto respiratorio superior (4,3 %), diarrea (4,1 %), artralgia (3,0 %), sinusitis (2,8%) y dolor en las extremidades (2,7%).
Estudios de coadministración de estatinas
En la base de datos de ensayos clínicos controlados de ZETIA + estatina de 11 308 pacientes con una mediana de duración del tratamiento de 8 semanas (rango de 0 a 112 semanas), el 4,0 % de los pacientes con ZETIA + estatina y el 3,3 % de los pacientes con estatina sola interrumpieron el tratamiento debido a reacciones adversas. Las reacciones adversas más frecuentes en el grupo de pacientes tratados con ZETIA + estatina que condujeron a la suspensión del tratamiento y se produjeron a una tasa superior a la de la estatina sola fueron:
- Alanina aminotransferasa aumentada (0,6 %)
- Mialgia (0,5%)
- Fatiga, aumento de la aspartato aminotransferasa, dolor de cabeza y dolor en las extremidades (cada uno al 0,2 %)
Las reacciones adversas notificadas con más frecuencia (incidencia ≥2 % y mayor que con estatina sola) en la base de datos de ensayos clínicos controlados ZETIA + estatina de 11 308 pacientes fueron: nasofaringitis (3,7 %), mialgia (3,2 %), infección del tracto respiratorio superior (2,9 % ), artralgia (2,6%) y diarrea (2,5%).
Experiencia en ensayos clínicos
Debido a que los estudios clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los estudios clínicos de un fármaco no pueden compararse directamente con las tasas de los estudios clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica clínica.
Monoterapia
En 10 ensayos clínicos doble ciego controlados con placebo, 2396 pacientes con hiperlipidemia primaria (rango de edad de 9 a 86 años, 50 % mujeres, 90 % caucásicos, 5 % negros, 3 % hispanos, 2 % asiáticos) y LDL-C elevado fueron tratados con ZETIA 10 mg/día durante una mediana de duración del tratamiento de 12 semanas (rango de 0 a 39 semanas).
Las reacciones adversas informadas en ≥2 % de los pacientes tratados con ZETIA y con una incidencia mayor que el placebo en estudios controlados con placebo de ZETIA 10 mg, independientemente de la evaluación de la causalidad, se muestran en la Tabla 1.
TABLA 1: Reacciones clínicas adversas que ocurren en ≥2 % de los pacientes tratados con ZETIA 10 mg y con una incidencia mayor que el placebo, independientemente de la causalidad
La frecuencia de reacciones adversas menos comunes fue comparable entre ZETIA 10 mg y placebo.
Combinación con una estatina
En 28 ensayos clínicos doble ciego controlados (placebo o control activo), 11 308 pacientes con hiperlipidemia primaria (rango de edad de 10 a 93 años, 48 % mujeres, 85 % caucásicos, 7 % negros, 4 % hispanos, 3 % asiáticos) y LDL-C elevado fueron tratados con ZETIA 10 mg/día simultáneamente con o agregados a la terapia con estatinas en curso durante una mediana de duración del tratamiento de 8 semanas (rango de 0 a 112 semanas).
La incidencia de transaminasas aumentadas consecutivas (≥3 × ULN) fue mayor en pacientes que recibieron ZETIA 10 mg administrados con estatinas (1,3 %) que en pacientes tratados con estatinas solas (0,4 %). [Ver ADVERTENCIAS Y PRECAUCIONES ]
Las reacciones adversas clínicas notificadas en ≥2 % de los pacientes tratados con ZETIA + estatina y con una incidencia mayor que la estatina, independientemente de la evaluación de la causalidad, se muestran en la Tabla 2.
TABLA 2: Reacciones adversas clínicas que ocurren en ≥2 % de los pacientes tratados con ZETIA 10 mg coadministrados con una estatina y con una incidencia mayor que la estatina, independientemente de la causalidad
Combinación con fenofibrato
Este estudio clínico en el que participaron 625 pacientes con dislipidemia mixta (rango de edad de 20 a 76 años, 44 % mujeres, 79 % caucásicos, 0,1 % negros, 11 % hispanos, 5 % asiáticos) tratados durante un máximo de 12 semanas y 576 pacientes tratados durante un máximo de 48 semanas adicionales evaluaron la coadministración de ZETIA y fenofibrato. Este estudio no fue diseñado para comparar grupos de tratamiento para eventos poco frecuentes. Las tasas de incidencia (IC del 95 %) para elevaciones clínicamente importantes (≥3 — LSN, consecutivas) en los niveles de transaminasas hepáticas fueron del 4,5 % (1,9, 8,8) y del 2,7 % (1,2, 5,4) para la monoterapia con fenofibrato (n=188) y ZETIA coadministrados con fenofibrato (n=183), respectivamente, ajustado por exposición al tratamiento. Las tasas de incidencia correspondientes para la colecistectomía fueron del 0,6 % (IC del 95 %: 0,0 %, 3,1 %) y del 1,7 % (IC del 95 %: 0,6 %, 4,0 %) para la monoterapia con fenofibrato y ZETIA 10 mg coadministrados con fenofibrato, respectivamente [ver INTERACCIONES CON LA DROGAS ]. El número de pacientes expuestos a la terapia de coadministración, así como a la monoterapia con fenofibrato y ezetimiba, fue inadecuado para evaluar el riesgo de enfermedad de la vesícula biliar. No hubo elevaciones de CPK > 10 — LSN en ninguno de los grupos de tratamiento.
Experiencia posterior a la comercialización
Debido a que las siguientes reacciones son informadas voluntariamente por una población de tamaño incierto, generalmente no es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Se han identificado las siguientes reacciones adversas adicionales durante el uso posterior a la aprobación de ZETIA:
Reacciones de hipersensibilidad, que incluyen anafilaxia, angioedema, erupción cutánea y urticaria; eritema multiforme; artralgia; mialgia; creatina fosfoquinasa elevada; miopatía/rabdomiolisis [ver ADVERTENCIAS Y PRECAUCIONES ]; elevaciones de las transaminasas hepáticas; hepatitis; dolor abdominal; trombocitopenia; pancreatitis; náuseas; mareo; parestesia; depresión; dolor de cabeza; colelitiasis; colecistitis
INTERACCIONES CON LA DROGAS
[Ver FARMACOLOGÍA CLÍNICA ]
ciclosporina
Se debe tener precaución al usar ZETIA 10 mg y ciclosporina de forma concomitante debido a una mayor exposición tanto a ezetimiba como a ciclosporina. Las concentraciones de ciclosporina deben monitorearse en pacientes que reciben ZETIA y ciclosporina.
El grado de aumento de la exposición a ezetimiba puede ser mayor en pacientes con insuficiencia renal grave. En pacientes tratados con ciclosporina, los efectos potenciales del aumento de la exposición a ezetimiba por el uso concomitante deben sopesarse cuidadosamente frente a los beneficios de las alteraciones en los niveles de lípidos proporcionados por ezetimiba.
Fibratos
No se ha estudiado la eficacia y seguridad de la coadministración de ezetimiba con fibratos distintos al fenofibrato.
Los fibratos pueden aumentar la excreción de colesterol en la bilis, lo que lleva a la colelitiasis. En un estudio preclínico en perros, la ezetimiba aumentó el colesterol en la bilis de la vesícula biliar [ver Toxicología no clínica ]. No se recomienda la coadministración de ZETIA con fibratos que no sean fenofibrato hasta que se estudie adecuadamente su uso en pacientes.
fenofibrato
Si se sospecha colelitiasis en un paciente que recibe ZETIA 10 mg y fenofibrato, se indican estudios de la vesícula biliar y se debe considerar una terapia hipolipemiante alternativa [ver REACCIONES ADVERSAS y el etiquetado del producto para el fenofibrato].
colestiramina
La administración concomitante de colestiramina redujo el área media bajo la curva (AUC) de la ezetimiba total en aproximadamente un 55 %. La reducción incremental de LDL-C debida a la adición de ezetimiba a la colestiramina puede verse reducida por esta interacción.
Anticoagulantes cumarínicos
Si se añade ezetimiba a la warfarina, un anticoagulante cumarínico, se debe controlar adecuadamente el índice internacional normalizado (INR).
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Uso con estatinas o fenofibrato
La administración simultánea de ZETIA con una estatina o fenofibrato específicos debe realizarse de acuerdo con la etiqueta del producto para ese medicamento.
Enzimas del hígado
En estudios clínicos controlados de monoterapia, la incidencia de elevaciones consecutivas (≥3 veces el límite superior normal [ULN]) en los niveles de transaminasas hepáticas fue similar entre ZETIA (0,5 %) y placebo (0,3 %).
En estudios clínicos controlados de combinación de ZETIA 10 mg iniciados simultáneamente con una estatina, la incidencia de elevaciones consecutivas (≥3 x LSN) en los niveles de transaminasas hepáticas fue del 1,3 % para los pacientes tratados con ZETIA administrado con estatinas y del 0,4 % para los pacientes tratados con estatinas solas. Estas elevaciones de las transaminasas generalmente fueron asintomáticas, no se asociaron con colestasis y regresaron a la línea de base después de la interrupción de la terapia o con la continuación del tratamiento. Cuando se coadministra ZETIA con una estatina, se deben realizar pruebas hepáticas al inicio de la terapia y de acuerdo con las recomendaciones de la estatina. Si persiste un aumento de ALT o AST ≥3 x ULN, considere retirar ZETIA 10 mg y/o la estatina.
Miopatía/Rabdomiolisis
En los ensayos clínicos, no hubo exceso de miopatía o rabdomiólisis asociada con ZETIA 10 mg en comparación con el grupo de control relevante (placebo o estatina sola). Sin embargo, la miopatía y la rabdomiólisis son reacciones adversas conocidas a las estatinas y otros fármacos hipolipemiantes. En ensayos clínicos, la incidencia de creatina fosfocinasa (CPK) > 10 x LSN fue del 0,2 % para ZETIA frente al 0,1 % para el placebo, y del 0,1 % para ZETIA coadministrado con una estatina frente al 0,4 % para las estatinas solas. El riesgo de toxicidad del músculo esquelético aumenta con dosis más altas de estatina, edad avanzada (> 65 años), hipotiroidismo, insuficiencia renal y, según la estatina utilizada, el uso concomitante de otros fármacos.
En la experiencia posterior a la comercialización de ZETIA, se han notificado casos de miopatía y rabdomiólisis. La mayoría de los pacientes que desarrollaron rabdomiolisis estaban tomando una estatina antes de iniciar ZETIA. Sin embargo, se ha informado rabdomiólisis con la monoterapia de ZETIA 10 mg y con la adición de ZETIA 10 mg a agentes que se sabe que están asociados con un mayor riesgo de rabdomiólisis, como los fibratos. ZETIA y cualquier estatina o fibrato que el paciente esté tomando de manera concomitante deben suspenderse inmediatamente si se diagnostica o sospecha miopatía. La presencia de síntomas musculares y un nivel de CPK > 10 x LSN indica miopatía.
Deterioro hepático
Debido a los efectos desconocidos del aumento de la exposición a ezetimiba en pacientes con insuficiencia hepática de moderada a grave, no se recomienda ZETIA en estos pacientes. [Ver FARMACOLOGÍA CLÍNICA ]
Información de asesoramiento para pacientes
Ver Etiquetado del paciente aprobado por la FDA (INFORMACIÓN DEL PACIENTE).
Se debe recomendar a los pacientes que sigan la dieta recomendada por el Programa Nacional de Educación sobre el Colesterol (NCEP), un programa de ejercicio regular y pruebas periódicas de un panel de lípidos en ayunas.
Dolor muscular
Se debe advertir a todos los pacientes que comienzan la terapia con ezetimiba sobre el riesgo de miopatía y se les debe indicar que informen de inmediato cualquier dolor, sensibilidad o debilidad muscular inexplicable. El riesgo de que esto ocurra aumenta cuando se toman ciertos tipos de medicamentos. Los pacientes deben discutir todos los medicamentos, tanto recetados como de venta libre, con su médico.
Enzimas del hígado
Se deben realizar pruebas hepáticas cuando se agrega ZETIA 10 mg a la terapia con estatinas y de acuerdo con las recomendaciones de estatinas.
El embarazo
Se debe recomendar a las mujeres en edad fértil que usen un método anticonceptivo eficaz para prevenir el embarazo mientras usan ZETIA junto con la terapia con estatinas. Analice los planes de embarazo futuro con sus pacientes y discuta cuándo suspender la combinación de ZETIA 10 mg y la terapia con estatinas si están tratando de concebir. Se debe advertir a las pacientes que, si quedan embarazadas, deben dejar de tomar la combinación de ZETIA 10 mg y la terapia con estatinas y llamar a su profesional de la salud.
Amamantamiento
Se debe recomendar a las mujeres que están amamantando que no usen ZETIA agregado a la terapia con estatinas. Se debe recomendar a las pacientes que tienen un trastorno de lípidos y están amamantando que discutan las opciones con sus profesionales de la salud.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Se llevó a cabo un estudio de carcinogenicidad dietética de 104 semanas con ezetimiba en ratas a dosis de hasta 1500 mg/kg/día (machos) y 500 mg/kg/día (hembras) (~20 veces la exposición humana a 10 mg diarios según el AUC0 -24 h para ezetimiba total). También se realizó un estudio de carcinogenicidad en la dieta de 104 semanas con ezetimiba en ratones a dosis de hasta 500 mg/kg/día (> 150 veces la exposición humana a 10 mg diarios según el AUC0-24 h para el total de ezetimiba). No hubo aumentos estadísticamente significativos en la incidencia de tumores en ratas o ratones tratados con el fármaco.
No se observó evidencia de mutagenicidad in vitro en una prueba de mutagenicidad microbiana (Ames) con Salmonella typhimurium y Escherichia coli con o sin activación metabólica. No se observó evidencia de clastogenicidad in vitro en un ensayo de aberración cromosómica en linfocitos de sangre periférica humana con o sin activación metabólica. Además, no hubo evidencia de genotoxicidad en la prueba de micronúcleos de ratón in vivo.
En estudios de fertilidad oral (por sonda) de ezetimiba realizados en ratas, no hubo evidencia de toxicidad reproductiva en dosis de hasta 1000 mg/kg/día en ratas macho o hembra (~7 veces la exposición humana a 10 mg diarios según el AUC0- 24 horas para ezetimiba total).
Uso en poblaciones específicas
El embarazo
Embarazo Categoría C
No hay estudios adecuados y bien controlados de ezetimiba en mujeres embarazadas. Ezetimibe debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo para el feto.
En estudios de desarrollo embriofetal orales (por sonda) de ezetimiba realizados en ratas y conejos durante la organogénesis, no hubo evidencia de efectos embrioletales a las dosis probadas (250, 500, 1000 mg/kg/día). En ratas, se observó un aumento en la incidencia de hallazgos esqueléticos fetales comunes (un par extra de costillas torácicas, centros vertebrales cervicales no osificados, costillas acortadas) con 1000 mg/kg/día (~10 veces la exposición humana a 10 mg diarios con base en AUC0-24hr para ezetimiba total). En conejos tratados con ezetimiba, se observó un aumento en la incidencia de costillas extratorácicas con 1000 mg/kg/día (150 veces la exposición humana con 10 mg diarios según el AUC0-24 h para el total de ezetimiba). Ezetimibe atravesó la placenta cuando se administraron dosis orales múltiples a ratas y conejas preñadas.
Los estudios de dosis múltiples de ezetimiba administrados en combinación con estatinas en ratas y conejos durante la organogénesis dan como resultado exposiciones más altas a ezetimiba y estatinas. Los hallazgos reproductivos ocurren a dosis más bajas en la terapia combinada en comparación con la monoterapia.
Todas las estatinas están contraindicadas en mujeres embarazadas y lactantes. Cuando se administre ZETIA 10 mg con una estatina en una mujer en edad fértil, consulte la categoría de embarazo y la etiqueta del producto para la estatina. [Ver CONTRAINDICACIONES]
Madres lactantes
No se sabe si ezetimiba se excreta en la leche materna humana. En estudios con ratas, la exposición a ezetimiba total en crías lactantes fue hasta la mitad de la observada en el plasma materno. Debido a que muchos medicamentos se excretan en la leche humana, se debe tener precaución cuando se administre ZETIA 10 mg a una mujer lactante. ZETIA no debe usarse en madres lactantes a menos que el beneficio potencial justifique el riesgo potencial para el lactante.
Uso pediátrico
Los efectos de ZETIA coadministrado con simvastatina (n=126) en comparación con la monoterapia con simvastatina (n=122) se evaluaron en niños y niñas adolescentes con hipercolesterolemia familiar heterocigota (HeFH). En un estudio multicéntrico, doble ciego, controlado seguido de una fase abierta, 142 niños y 106 niñas posmenárquicas, de 10 a 17 años de edad (edad media 14,2 años, 43 % mujeres, 82 % caucásicos, 4 % asiáticos, 2 % negros , 13 % multirracial) con HFHe fueron aleatorizados para recibir 10 mg de ZETIA coadministrados con simvastatina o monoterapia con simvastatina. La inclusión en el estudio requería 1) un nivel inicial de LDL-C entre 160 y 400 mg/dL y 2) un historial médico y una presentación clínica compatibles con HeFH. El valor basal medio de C-LDL fue de 225 mg/dL (rango: 161-351 mg/dL) en el grupo de ZETIA 10 mg coadministrado con simvastatina en comparación con 219 mg/dL (rango: 149-336 mg/dL) en el grupo de monoterapia con simvastatina grupo. Los pacientes recibieron ZETIA coadministrado y simvastatina (10 mg, 20 mg o 40 mg) o monoterapia con simvastatina (10 mg, 20 mg o 40 mg) durante 6 semanas, ZETIA coadministrado y simvastatina 40 mg o monoterapia con simvastatina 40 mg durante las siguientes 27 semanas, y ZETIA y simvastatina (10 mg, 20 mg o 40 mg) coadministrados de forma abierta durante las 20 semanas siguientes.
Los resultados del estudio en la Semana 6 se resumen en la Tabla 3. Los resultados en la Semana 33 fueron consistentes con los de la Semana 6.
TABLA 3: Diferencia porcentual media en la semana 6 entre el grupo combinado de ZETIA 10 mg coadministrado con simvastatina y el grupo combinado de monoterapia con simvastatina en pacientes adolescentes con hipercolesterolemia familiar heterocigota
Desde el comienzo del ensayo hasta el final de la semana 33, se produjeron interrupciones debido a una reacción adversa en 7 (6 %) pacientes del grupo de ZETIA coadministrado con simvastatina y en 2 (2 %) pacientes del grupo de monoterapia con simvastatina.
Durante el ensayo, se produjeron elevaciones de las transaminasas hepáticas (dos mediciones consecutivas de ALT y/o AST ≥3 x LSN) en cuatro (3 %) individuos del grupo de ZETIA 10 mg coadministrado con simvastatina y en dos (2 %) individuos del grupo de monoterapia con simvastatina grupo. Se produjeron elevaciones de CPK (≥10 x ULN) en dos (2%) individuos en el grupo de ZETIA coadministrado con simvastatina y en cero individuos en el grupo de monoterapia con simvastatina.
En este estudio controlado limitado, no hubo un efecto significativo sobre el crecimiento o la maduración sexual en los niños o niñas adolescentes, o sobre la duración del ciclo menstrual en las niñas.
No se ha estudiado la coadministración de ZETIA 10 mg con simvastatina en dosis superiores a 40 mg/día en adolescentes. Además, ZETIA 10 mg no se ha estudiado en pacientes menores de 10 años o en niñas premenárquicas.
En base a la ezetimiba total (ezetimiba + ezetimiba-glucurónido), no existen diferencias farmacocinéticas entre adolescentes y adultos. No se dispone de datos farmacocinéticos en la población pediátrica
Uso geriátrico
Estudios de monoterapia
De los 2396 pacientes que recibieron ZETIA 10 mg en estudios clínicos, 669 (28 %) tenían 65 años o más y 111 (5 %) tenían 75 años o más.
Estudios de coadministración de estatinas
De los 11 308 pacientes que recibieron ZETIA + estatina en estudios clínicos, 3587 (32 %) tenían 65 años o más y 924 (8 %) tenían 75 años o más.
No se observaron diferencias generales en la seguridad y la eficacia entre estos pacientes y los pacientes más jóvenes, y otra experiencia clínica notificada no ha identificado diferencias en las respuestas entre los pacientes de edad avanzada y los más jóvenes, pero no se puede descartar una mayor sensibilidad de algunas personas de mayor edad [ver FARMACOLOGÍA CLÍNICA ].

Insuficiencia renal
Cuando se usa como monoterapia, no es necesario ajustar la dosis de ZETIA 10 mg.
En el ensayo Study of Heart and Renal Protection (SHARP) de 9270 pacientes con insuficiencia renal de moderada a grave (6247 pacientes sin diálisis con una mediana de creatinina sérica de 2,5 mg/dl y una mediana de tasa de filtración glomerular estimada de 25,6 ml/min/1,73 m², y 3023 pacientes en diálisis), la incidencia de eventos adversos graves, eventos adversos que llevaron a la interrupción del tratamiento del estudio o eventos adversos de especial interés (eventos adversos musculoesqueléticos, anormalidades en las enzimas hepáticas, cáncer incidente) fue similar entre los pacientes asignados a ezetimiba 10 mg más simvastatina 20 mg (n=4650) o placebo (n=4620) durante una mediana de seguimiento de 4,9 años. Sin embargo, debido a que la insuficiencia renal es un factor de riesgo para la miopatía asociada con las estatinas, las dosis de simvastatina que superen los 20 mg se deben usar con precaución y control estricto cuando se administren de forma concomitante con ZETIA en pacientes con insuficiencia renal de moderada a grave.
Deterioro hepático
No se recomienda ZETIA en pacientes con insuficiencia hepática de moderada a grave [ver ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ].
ZETIA 10 mg administrado de forma concomitante con una estatina está contraindicado en pacientes con enfermedad hepática activa o elevaciones persistentes inexplicables de los niveles de transaminasas hepáticas [ver CONTRAINDICACIONES ; ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ].
SOBREDOSIS
En estudios clínicos, la administración de ezetimiba, 50 mg/día a 15 sujetos sanos por hasta 14 días, 40 mg/día a 18 pacientes con hiperlipidemia primaria por hasta 56 días y 40 mg/día a 27 pacientes con sitosterolemia homocigótica por 26 semanas fue generalmente bien tolerado. Una paciente con sitosterolemia homocigota tomó una sobredosis accidental de ezetimiba de 120 mg/día durante 28 días sin que se informaran eventos adversos clínicos o de laboratorio.
En caso de sobredosis, se deben emplear medidas sintomáticas y de apoyo.
CONTRAINDICACIONES
ZETIA está contraindicado en las siguientes condiciones:
- La combinación de ZETIA 10 mg con una estatina está contraindicada en pacientes con enfermedad hepática activa o elevaciones persistentes inexplicables en los niveles de transaminasas hepáticas.
- Mujeres embarazadas o que puedan quedar embarazadas. Debido a que las estatinas reducen la síntesis de colesterol y posiblemente la síntesis de otras sustancias biológicamente activas derivadas del colesterol, ZETIA en combinación con una estatina puede causar daño fetal cuando se administra a mujeres embarazadas. Además, no existe un beneficio aparente para la terapia durante el embarazo y no se ha establecido la seguridad en mujeres embarazadas. Si la paciente queda embarazada mientras toma este medicamento, se le debe informar sobre el peligro potencial para el feto y la falta de beneficio clínico conocido con el uso continuado durante el embarazo. [Ver Uso en poblaciones específicas ]
- Madres lactantes. Debido a que las estatinas pueden pasar a la leche materna y a que las estatinas tienen el potencial de causar reacciones adversas graves en los lactantes, se debe recomendar a las mujeres que requieren tratamiento con ZETIA en combinación con una estatina que no amamanten a sus bebés [ver Uso en poblaciones específicas ].
- Pacientes con hipersensibilidad conocida a cualquier componente de este producto. Se han informado reacciones de hipersensibilidad que incluyen anafilaxia, angioedema, erupción cutánea y urticaria con ZETIA [ver REACCIONES ADVERSAS ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
Ezetimibe reduce el colesterol en sangre al inhibir la absorción de colesterol en el intestino delgado. En un estudio clínico de 2 semanas en 18 pacientes hipercolesterolémicos, ZETIA 10 mg inhibió la absorción intestinal de colesterol en un 54 %, en comparación con el placebo. ZETIA no tuvo un efecto clínicamente significativo sobre las concentraciones plasmáticas de las vitaminas liposolubles A, D y E (en un estudio de 113 pacientes) y no afectó la producción de hormonas esteroides adrenocorticales (en un estudio de 118 pacientes).
El contenido de colesterol del hígado se deriva predominantemente de tres fuentes. El hígado puede sintetizar colesterol, absorber el colesterol de la sangre a partir de las lipoproteínas circulantes o absorber el colesterol absorbido por el intestino delgado. El colesterol intestinal se deriva principalmente del colesterol secretado en la bilis y del colesterol dietético.
La ezetimiba tiene un mecanismo de acción que difiere del de otras clases de compuestos reductores del colesterol (estatinas, secuestrantes de ácidos biliares [resinas], derivados del ácido fíbrico y estanoles vegetales). Se ha demostrado que el objetivo molecular de la ezetimiba es el transportador de esteroles, Niemann-Pick C1-Like 1 (NPC1L1), que participa en la absorción intestinal de colesterol y fitoesteroles.
Ezetimibe no inhibe la síntesis de colesterol en el hígado, ni aumenta la excreción de ácidos biliares. En cambio, la ezetimiba se localiza en el borde en cepillo del intestino delgado e inhibe la absorción de colesterol, lo que conduce a una disminución en la entrega de colesterol intestinal al hígado. Esto provoca una reducción de las reservas de colesterol hepático y un aumento del aclaramiento de colesterol de la sangre; este mecanismo distinto es complementario al de las estatinas y del fenofibrato [ver Estudios clínicos ].
Farmacodinámica
Los estudios clínicos han demostrado que los niveles elevados de C-total, LDL-C y Apo B, la principal proteína constituyente de LDL, promueven la aterosclerosis humana. Además, los niveles reducidos de HDL-C están asociados con el desarrollo de aterosclerosis. Estudios epidemiológicos han establecido que la morbilidad y mortalidad cardiovascular varían directamente con el nivel de C-total y LDL-C e inversamente con el nivel de HDL-C. Al igual que las LDL, las lipoproteínas ricas en triglicéridos enriquecidas con colesterol, incluidas las lipoproteínas de muy baja densidad (VLDL), las lipoproteínas de densidad intermedia (IDL) y los remanentes, también pueden promover la aterosclerosis. No se ha determinado el efecto independiente de elevar el HDL-C o disminuir los TG sobre el riesgo de morbilidad y mortalidad coronaria y cardiovascular.
ZETIA reduce el C-total, el LDL-C, la Apo B, el no-HDL-C y los TG, y aumenta el HDL-C en pacientes con hiperlipidemia. La administración de 10 mg de ZETIA con una estatina es eficaz para mejorar el C-total sérico, el C-LDL, la Apo B, el C-no-HDL, los TG y el C-HDL más allá de cualquier tratamiento por sí solo. La administración de 10 mg de ZETIA con fenofibrato es eficaz para mejorar el C-total sérico, el C-LDL, la Apo B y el C-no-HDL en pacientes con hiperlipidemia mixta en comparación con cualquiera de los tratamientos solos. No se han establecido los efectos de ezetimiba administrado solo o junto con una estatina o fenofibrato sobre la morbilidad y mortalidad cardiovascular.
Farmacocinética
Absorción
Después de la administración oral, la ezetimiba se absorbe y se conjuga ampliamente con un glucurónido fenólico farmacológicamente activo (ezetimiba-glucurónido). Después de una dosis única de 10 mg de ZETIA 10 mg a adultos en ayunas, se alcanzaron concentraciones plasmáticas máximas medias de ezetimiba (Cmax) de 3,4 a 5,5 ng/mL dentro de 4 a 12 horas (Tmax). Se alcanzaron valores medios de Cmax de ezetimiba-glucurónido de 45 a 71 ng/mL entre 1 y 2 horas (Tmax). No hubo una desviación sustancial de la proporcionalidad de la dosis entre 5 y 20 mg. No se puede determinar la biodisponibilidad absoluta de ezetimiba, ya que el compuesto es prácticamente insoluble en medios acuosos adecuados para inyección.
Efecto de los alimentos sobre la absorción oral
La administración concomitante de alimentos (comidas ricas en grasas o sin grasas) no tuvo efecto sobre el grado de absorción de ezetimiba cuando se administró en comprimidos de 10 mg de ZETIA. El valor C de ezetimiba aumentó en un 38 % con el consumo de comidas ricas en grasas. ZETIA se puede administrar con o sin alimentos.
Distribución
La ezetimiba y la ezetimiba-glucurónido se unen en gran medida (> 90 %) a las proteínas plasmáticas humanas.
Metabolismo y excreción
Ezetimibe se metaboliza principalmente en el intestino delgado y el hígado a través de la conjugación con glucurónido (una reacción de fase II) con la posterior excreción biliar y renal. Se ha observado un metabolismo oxidativo mínimo (una reacción de fase I) en todas las especies evaluadas.
En humanos, la ezetimiba se metaboliza rápidamente a ezetimiba-glucurónido. La ezetimiba y la ezetimibaglucurónida son los principales compuestos derivados de fármacos detectados en plasma y constituyen aproximadamente del 10 al 20 % y del 80 al 90 % del fármaco total en plasma, respectivamente. Tanto ezetimiba como ezetimiba-glucurónido se eliminan del plasma con una vida media de aproximadamente 22 horas tanto para ezetimiba como para ezetimibaglucurónido. Los perfiles de tiempo de concentración plasmática exhiben múltiples picos, lo que sugiere un reciclaje enterohepático.
Luego de la administración oral de 14C-ezetimiba (20 mg) a sujetos humanos, la ezetimiba total (ezetimiba + ezetimiba-glucurónido) representó aproximadamente el 93 % de la radiactividad total en plasma. Después de 48 horas, no había niveles detectables de radiactividad en el plasma.
Aproximadamente el 78 % y el 11 % de la radiactividad administrada se recuperó en las heces y la orina, respectivamente, durante un período de recolección de 10 días. La ezetimiba fue el componente principal en las heces y representó el 69 % de la dosis administrada, mientras que la ezetimiba-glucurónido fue el componente principal en la orina y representó el 9 % de la dosis administrada.
Poblaciones Específicas
Pacientes geriátricos: En un estudio de dosis múltiples con ezetimiba administrado 10 mg una vez al día durante 10 días, las concentraciones plasmáticas de ezetimiba total fueron aproximadamente 2 veces más altas en sujetos sanos mayores (≥65 años) en comparación con sujetos más jóvenes.
Pacientes pediátricos: [Ver Uso en poblaciones específicas ]
Género: En un estudio de dosis múltiples con ezetimiba administrado 10 mg una vez al día durante 10 días, las concentraciones plasmáticas de ezetimiba total fueron ligeramente más altas (
La raza: Según un metanálisis de estudios farmacocinéticos de dosis múltiples, no hubo diferencias farmacocinéticas entre sujetos negros y caucásicos. Los estudios en sujetos asiáticos indicaron que la farmacocinética de ezetimiba fue similar a la observada en sujetos caucásicos.
Deterioro hepático: Después de una dosis única de 10 mg de ezetimiba, el AUC medio de ezetimiba total aumentó aproximadamente 1,7 veces en pacientes con insuficiencia hepática leve (puntuación de Child-Pugh de 5 a 6), en comparación con sujetos sanos. Los valores medios de AUC para ezetimiba total y ezetimiba aumentaron aproximadamente de 3 a 4 veces y de 5 a 6 veces, respectivamente, en pacientes con insuficiencia hepática moderada (puntuación de Child-Pugh de 7 a 9) o grave (puntuación de Child-Pugh 10 a 15). En un estudio de dosis múltiples de 14 días (10 mg diarios) en pacientes con insuficiencia hepática moderada, los valores medios de AUC para el total de ezetimiba y ezetimiba aumentaron aproximadamente 4 veces el día 1 y el día 14 en comparación con sujetos sanos. Debido a los efectos desconocidos del aumento de la exposición a ezetimiba en pacientes con insuficiencia hepática moderada o grave, no se recomienda ZETIA en estos pacientes [ver ADVERTENCIAS Y PRECAUCIONES ].
Insuficiencia renal: Después de una dosis única de 10 mg de ezetimiba en pacientes con enfermedad renal grave (n = 8; CrCl medio ≥ 30 ml/min/1,73 m²), los valores medios de AUC para ezetimiba total, ezetimiba-glucurónido y ezetimiba aumentaron aproximadamente 1,5 veces, en comparación con sujetos sanos (n = 9).
Interacciones con la drogas
[Ver también INTERACCIONES CON LA DROGAS ]
ZETIA 10 mg no tuvo un efecto significativo en una serie de fármacos de prueba (cafeína, dextrometorfano, tolbutamida y midazolam intravenoso) que se sabe que son metabolizados por el citocromo P450 (1A2, 2D6, 2C8/9 y 3A4) en un estudio "cóctel" de doce personas sanas machos adultos. Esto indica que ezetimiba no es ni un inhibidor ni un inductor de estas isoenzimas del citocromo P450, y es poco probable que ezetimiba afecte el metabolismo de los fármacos que son metabolizados por estas enzimas.
TABLA 4: Efecto de los fármacos coadministrados sobre la ezetimiba total
TABLA 5: Efecto de la coadministración de ezetimiba sobre la exposición sistémica a otras drogas
Toxicología Animal Y/o Farmacología
El efecto hipocolesterolémico de la ezetimiba se evaluó en modelos de metabolismo del colesterol humano en monos Rhesus, perros, ratas y ratones alimentados con colesterol. Se encontró que ezetimiba tiene un valor ED50 de 0,5 μg/kg/día para inhibir el aumento de los niveles de colesterol plasmático en monos. Los valores de ED50 en perros, ratas y ratones fueron 7, 30 y 700 μg/kg/día, respectivamente. Estos resultados son consistentes con que ZETIA sea un potente inhibidor de la absorción de colesterol.
En un modelo de rata, donde el metabolito glucurónido de ezetimiba (SCH 60663) se administró por vía intraduodenal, el metabolito fue tan potente como el compuesto original (SCH 58235) para inhibir la absorción de colesterol, lo que sugiere que el metabolito glucurónido tenía una actividad similar a la del metabolito original. droga.
En estudios de 1 mes en perros que recibieron ezetimiba (0,03 a 300 mg/kg/día), la concentración de colesterol en la bilis de la vesícula biliar aumentó ~2 a 4 veces. Sin embargo, una dosis de 300 mg/kg/día administrada a perros durante un año no provocó la formación de cálculos biliares ni ningún otro efecto hepatobiliar adverso. En un estudio de 14 días en ratones que recibieron ezetimiba (0,3 a 5 mg/kg/día) y alimentados con una dieta baja en grasas o rica en colesterol, la concentración de colesterol en la bilis de la vesícula biliar no se vio afectada o se redujo a niveles normales, respectivamente.
Se realizó una serie de estudios preclínicos agudos para determinar la selectividad de ZETIA para inhibir la absorción de colesterol. Ezetimibe inhibió la absorción de colesterol 14C sin efecto sobre la absorción de triglicéridos, ácidos grasos, ácidos biliares, progesterona, etinilestradiol o las vitaminas liposolubles A y D.
En estudios de toxicidad de 4 a 12 semanas en ratones, ezetimiba no indujo las enzimas metabolizadoras de fármacos del citocromo P450. En estudios de toxicidad, se observó una interacción farmacocinética de ezetimiba con estatinas (los padres o sus metabolitos activos de hidroxiácidos) en ratas, perros y conejos.
Estudios clínicos
Hiperlipidemia primaria
ZETIA 10 mg reduce el C-total, LDL-C, Apo B, no-HDL-C y TG, y aumenta el HDL-C en pacientes con hiperlipidemia. La respuesta máxima a casi máxima generalmente se logra dentro de las 2 semanas y se mantiene durante la terapia crónica.
Monoterapia
En dos estudios multicéntricos, doble ciego, controlados con placebo, de 12 semanas en 1719 pacientes con hiperlipidemia primaria, ZETIA redujo significativamente el C-total, LDL-C, Apo B, no-HDL-C y TG, y aumentó el HDL-C. C en comparación con el placebo (ver Tabla 6). La reducción en LDL-C fue consistente a través de la edad, sexo y LDL-C inicial.
TABLA 6: Respuesta a ZETIA 10 mg en pacientes con hiperlipidemia primaria (% de cambio medio desde el inicio sin tratamiento†)
Combinación con Estatinas
ZETIA 10 mg agregado a la terapia continua con estatinas
En un estudio multicéntrico, doble ciego, controlado con placebo, de 8 semanas, 769 pacientes con hiperlipidemia primaria, enfermedad coronaria conocida o múltiples factores de riesgo cardiovascular que ya estaban recibiendo monoterapia con estatinas, pero que no habían alcanzado su meta de LDL NCEP ATP II -C objetivo fueron aleatorizados para recibir ZETIA 10 mg o placebo además de su estatina en curso.
ZETIA 10 mg, agregado al tratamiento continuo con estatinas, redujo significativamente el C-total, el C-LDL, la Apo B, el C-no-HDL y los TG, y aumentó el C-HDL en comparación con una estatina administrada sola (consulte la Tabla 7). Las reducciones de LDL-C inducidas por ZETIA 10 mg fueron generalmente consistentes en todas las estatinas.
TABLA 7: Respuesta a la adición de 10 mg de ZETIA a la terapia con estatinas en curso en pacientes con hiperlipidemia (% de cambio medio desde el inicio tratado‡)
ZETIA iniciado simultáneamente con una estatina
En cuatro ensayos multicéntricos, doble ciego, controlados con placebo, de 12 semanas, en 2382 pacientes con hiperlipidemia, se administró ZETIA o placebo solos o con varias dosis de atorvastatina, simvastatina, pravastatina o lovastatina.
Cuando se compararon todos los pacientes que recibieron ZETIA con una estatina con todos los que recibieron la estatina correspondiente sola, ZETIA 10 mg redujo significativamente el C-total, el C-LDL, la Apo B, el C-no-HDL y los TG y, con la excepción de pravastatina , aumentó el HDL-C en comparación con la estatina administrada sola. Las reducciones de LDL-C inducidas por ZETIA 10 mg fueron generalmente consistentes en todas las estatinas. (Ver nota al pie, Tablas 8 a 11.)
TABLA 8: Respuesta a ZETIA 10 mg y atorvastatina iniciados simultáneamente en pacientes con hiperlipidemia primaria (% de cambio medio desde el inicio sin tratamiento†)
TABLA 9: Respuesta a ZETIA 10 mg y simvastatina iniciados simultáneamente en pacientes con hiperlipidemia primaria (% de cambio medio desde el inicio sin tratamiento†)
TABLA 10: Respuesta a ZETIA y pravastatina iniciados simultáneamente en pacientes con hiperlipidemia primaria (% de cambio medio desde el inicio sin tratamiento†)
TABLA 11: Respuesta a ZETIA y lovastatina iniciados simultáneamente en pacientes con hiperlipidemia primaria (% de cambio medio desde el inicio sin tratamiento†)
Combinación con fenofibrato
En un estudio clínico multicéntrico, doble ciego, controlado con placebo en pacientes con hiperlipidemia mixta, 625 pacientes fueron tratados durante un máximo de 12 semanas y 576 durante un máximo de 48 semanas adicionales. Los pacientes fueron aleatorizados para recibir placebo, ZETIA solo, 160 mg de fenofibrato solo o ZETIA 10 mg y 160 mg de fenofibrato en el estudio de 12 semanas. Después de completar el estudio de 12 semanas, los pacientes elegibles fueron asignados a ZETIA coadministrado con fenofibrato o monoterapia con fenofibrato durante 48 semanas adicionales.
ZETIA 10 mg coadministrado con fenofibrato redujo significativamente el C-total, LDL-C, Apo B y no-HDL-C en comparación con fenofibrato administrado solo. El porcentaje de disminución de TG y el porcentaje de aumento de HDLC para ZETIA coadministrado con fenofibrato fueron comparables a los del fenofibrato administrado solo (consulte la Tabla 12).
TABLA 12: Respuesta a ZETIA 10 mg y fenofibrato iniciados simultáneamente en pacientes con hiperlipidemia mixta (% de cambio medio desde el inicio sin tratamiento† a las 12 semanas†)
Los cambios en los criterios de valoración de lípidos después de 48 semanas adicionales de tratamiento con ZETIA coadministrado con fenofibrato o con fenofibrato solo fueron consistentes con los datos de 12 semanas que se muestran arriba.
Hipercolesterolemia Familiar Homocigota (HoFH)
Se realizó un estudio para evaluar la eficacia de ZETIA en el tratamiento de la HFHo. Este estudio doble ciego, aleatorizado, de 12 semanas inscribió a 50 pacientes con un diagnóstico clínico y/o genotípico de HFHo, con o sin aféresis de LDL concomitante, que ya recibían atorvastatina o simvastatina (40 mg). Los pacientes fueron aleatorizados a uno de tres grupos de tratamiento, atorvastatina o simvastatina (80 mg), ZETIA 10 mg administrado con atorvastatina o simvastatina (40 mg) o ZETIA administrado con atorvastatina o simvastatina (80 mg). Debido a la disminución de la biodisponibilidad de ezetimiba en pacientes que reciben colestiramina de forma concomitante [ver INTERACCIONES CON LA DROGAS ], se dosificó ezetimiba al menos 4 horas antes o después de la administración de las resinas. El C-LDL inicial medio fue de 341 mg/dl en los pacientes asignados al azar a 80 mg de atorvastatina o 80 mg de simvastatina sola y de 316 mg/dl en el grupo asignado al azar a 10 mg de ZETIA más 40 u 80 mg de atorvastatina o 40 u 80 mg de simvastatina. ZETIA 10 mg, administrado con atorvastatina o simvastatina (grupos de estatinas de 40 y 80 mg combinados), redujo significativamente el C-LDL (21 %) en comparación con el aumento de la dosis de simvastatina o atorvastatina en monoterapia de 40 a 80 mg (7 %). En aquellos tratados con ZETIA 10 mg más 80 mg de atorvastatina o con ZETIA 10 mg más 80 mg de simvastatina, el C-LDL se redujo en un 27 %.
Sitosterolemia homocigótica (fitosterolemia)
Se realizó un estudio para evaluar la eficacia de ZETIA en el tratamiento de la sitosterolemia homocigótica. En este ensayo multicéntrico, doble ciego, controlado con placebo, de 8 semanas, 37 pacientes con homocigotositosterolemia con niveles elevados de sitosterol en plasma (> 5 mg/dL) en su régimen terapéutico actual (dieta, resinas de unión a ácidos biliares, estatinas, cirugía de derivación ileal y/o aféresis de LDL), fueron aleatorizados para recibir ZETIA (n=30) o placebo (n=7). Debido a la disminución de la biodisponibilidad de ezetimiba en pacientes que reciben colestiramina de forma concomitante [ver INTERACCIONES CON LA DROGAS ], se dosificó ezetimiba al menos 2 horas antes o 4 horas después de la administración de las resinas. Excluyendo al único sujeto que recibió aféresis de LDL, ZETIA redujo significativamente el sitosterol y el campesterol plasmáticos, en un 21 % y un 24 % desde el inicio, respectivamente. Por el contrario, los pacientes que recibieron placebo tuvieron aumentos de sitosterol y campesterol del 4 % y el 3 % desde el inicio, respectivamente. Para los pacientes tratados con ZETIA 10 mg, los niveles plasmáticos medios de esteroles vegetales se redujeron progresivamente a lo largo del estudio. No se han establecido los efectos de reducir el sitosterol y el campesterol plasmáticos sobre la reducción de los riesgos de morbilidad y mortalidad cardiovascular.
Las reducciones en sitosterol y campesterol fueron consistentes entre los pacientes que tomaban ZETIA 10 mg de manera concomitante con secuestrantes de ácidos biliares (n=8) y los pacientes que no recibían una terapia concomitante con secuestrantes de ácidos biliares (n=21).
Limitaciones de uso
No se ha determinado el efecto de ZETIA 10 mg sobre la morbilidad y mortalidad cardiovascular.
INFORMACIÓN DEL PACIENTE
ZETIA® (ezetimiba) Tabletas
Información del paciente sobre ZETIA (zet´-ea)
Nombre genérico: ezetimiba (e-zet´-e-mib)
Lea atentamente esta información antes de empezar a tomar ZETIA® y cada vez que reciba más ZETIA. Es posible que haya nueva información. Esta información no reemplaza la conversación con su médico sobre su condición médica o su tratamiento. Si tiene alguna pregunta sobre ZETIA, consulte a su médico. Solo su médico puede determinar si ZETIA es adecuado para usted.
¿Qué es ZETIA?
ZETIA es un medicamento que se utiliza para reducir los niveles de colesterol total y colesterol LDL (malo) en la sangre. ZETIA es para pacientes que no pueden controlar sus niveles de colesterol solo con dieta y ejercicio. Se puede usar solo o con otros medicamentos para tratar el colesterol alto. Debe seguir una dieta para reducir el colesterol mientras toma este medicamento.
ZETIA trabaja para reducir la cantidad de colesterol que absorbe su cuerpo. ZETIA 10mg no te ayuda a perder peso. No se ha demostrado que ZETIA 10 mg prevenga enfermedades cardíacas o ataques cardíacos.
Para obtener más información sobre el colesterol, consulte la sección “¿Qué debo saber sobre el colesterol alto?” sección que sigue.
¿Quién no debe tomar ZETIA 10mg?
- No tome ZETIA 10 mg si es alérgico a la ezetimiba, el ingrediente activo de ZETIA, oa los ingredientes inactivos. Para obtener una lista de ingredientes inactivos, consulte la sección "Ingredientes inactivos" a continuación.
- Si tiene una enfermedad hepática activa, no tome ZETIA 10 mg mientras toma medicamentos para reducir el colesterol llamados estatinas.
- Si está embarazada o amamantando, no tome ZETIA mientras toma una estatina.
- Si es una mujer en edad fértil, debe usar un método anticonceptivo eficaz para prevenir el embarazo mientras usa ZETIA agregado a la terapia con estatinas.
ZETIA no se ha estudiado en niños menores de 10 años.
¿Qué debo decirle a mi médico antes y durante el tratamiento con ZETIA 10 mg?
Informe a su médico sobre cualquier medicamento recetado y de venta libre que esté tomando o planee tomar, incluidos los remedios naturales o a base de hierbas.
Informe a su médico acerca de todas sus condiciones médicas, incluidas las alergias.
Informe a su médico si usted:
- alguna vez ha tenido problemas hepáticos. ZETIA 10 mg puede no ser adecuado para usted.
- está embarazada o planea quedar embarazada. Su médico discutirá con usted si ZETIA 10 mg es adecuado para usted.
- están amamantando. No sabemos si ZETIA 10 mg puede pasar a su bebé a través de la leche. Su médico discutirá con usted si ZETIA 10 mg es adecuado para usted.
- experimentar dolor, sensibilidad o debilidad muscular inexplicable.
¿Cómo debo tomar ZETIA 10 mg?
- Tome ZETIA una vez al día, con o sin alimentos. Puede ser más fácil recordar tomar su dosis si lo hace a la misma hora todos los días, como con el desayuno, la cena o antes de acostarse. Si también toma otro medicamento para reducir el colesterol, pregunte a su médico si puede tomarlos al mismo tiempo.
- Si olvida tomar ZETIA, tómelo tan pronto como lo recuerde. Sin embargo, no tome más de una dosis de ZETIA al día.
- Siga una dieta para reducir el colesterol mientras toma ZETIA. Pregúntele a su médico si necesita información sobre la dieta.
- Siga tomando ZETIA 10 mg a menos que su médico le indique que deje de hacerlo. Es importante que siga tomando ZETIA 10 mg incluso si no se siente enfermo.
- Consulte a su médico regularmente para controlar su nivel de colesterol y para detectar efectos secundarios. Su médico puede hacerle análisis de sangre para controlar su hígado antes de que comience a tomar ZETIA con una estatina y durante el tratamiento.
¿Cuáles son los posibles efectos secundarios de ZETIA?
En estudios clínicos, los pacientes informaron pocos efectos secundarios mientras tomaban ZETIA. Estos incluían diarrea, dolores en las articulaciones y sensación de cansancio.
Los pacientes han experimentado problemas musculares graves mientras tomaban ZETIA 10 mg, generalmente cuando se añadía ZETIA 10 mg a una estatina. Si experimenta dolor muscular, sensibilidad o debilidad inexplicable mientras toma ZETIA, comuníquese con su médico de inmediato. Debe hacer esto con prontitud, porque en raras ocasiones, estos problemas musculares pueden ser graves y la degradación muscular resulta en daño renal.
Además, se han informado los siguientes efectos secundarios en el uso general: reacciones alérgicas (que pueden requerir tratamiento inmediato) que incluyen hinchazón de la cara, los labios, la lengua y/o la garganta que pueden causar dificultad para respirar o tragar, sarpullido y urticaria ; erupción roja elevada, a veces con lesiones en forma de diana; dolor en las articulaciones; dolores musculares; alteraciones en algunos análisis de sangre de laboratorio; problemas hepáticos; dolor de estómago; inflamación del páncreas; náuseas; mareo; sensación de hormigueo; depresión; dolor de cabeza; cálculos biliares; inflamación de la vesícula biliar.
Informe a su médico si tiene estos u otros problemas médicos mientras toma ZETIA. Para obtener una lista completa de los efectos secundarios, consulte a su médico o farmacéutico.
¿Qué debo saber sobre el colesterol alto?
El colesterol es un tipo de grasa que se encuentra en la sangre. Su colesterol total se compone de colesterol LDL y HDL.
El colesterol LDL se llama colesterol “malo” porque puede acumularse en la pared de las arterias y formar placa. Con el tiempo, la acumulación de placa puede causar un estrechamiento de las arterias. Este estrechamiento puede retardar o bloquear el flujo de sangre al corazón, el cerebro y otros órganos. El colesterol LDL alto es una de las principales causas de enfermedades cardíacas y una de las causas de los accidentes cerebrovasculares.
El colesterol HDL se llama colesterol “bueno” porque evita que el colesterol malo se acumule en las arterias.
Los triglicéridos también son grasas que se encuentran en la sangre.
Información general sobre ZETIA
A veces se recetan medicamentos para afecciones que no se mencionan en los folletos de información para el paciente. No use ZETIA 10 mg para una condición para la cual no fue recetado. No le dé ZETIA a otras personas, incluso si tienen la misma condición que usted. Puede que les haga daño.
Aquí se resume la información más importante sobre ZETIA. Si desea obtener más información, hable con su médico. Puede pedirle a su farmacéutico o médico información sobre ZETIA 10 mg que está escrita para profesionales de la salud.
Ingredientes inactivos :
Croscarmelosa de sodio, lactosa monohidrato, estearato de magnesio, celulosa microcristalina, povidona y lauril sulfato de sodio.
