Lopid 300mg Gemfibrozil Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Lopid 300mg y cómo se usa?
Lopid (gemfibrozil) es un agente regulador de lípidos que se usa para tratar los niveles muy altos de colesterol y triglicéridos en personas con pancreatitis, y también se usa para reducir el riesgo de accidente cerebrovascular, ataque cardíaco u otras complicaciones cardíacas en personas con niveles altos de colesterol y triglicéridos que tienen no ha sido ayudado por otros tratamientos. Lopid está disponible en forma genérica.
¿Cuáles son los efectos secundarios de Lopid 300mg?
Los efectos secundarios comunes de Lopid 300 mg incluyen:
- malestar estomacal,
- dolor estomacal/abdominal,
- náuseas,
- vómitos,
- Diarrea,
- dolor de cabeza,
- mareo,
- somnolencia,
- dolor articular o muscular,
- pérdida de interés en el sexo,
- impotencia,
- dificultad para tener un orgasmo,
- entumecimiento o sensación de hormigueo,
- sabor inusual, o
- síntomas de resfriado como congestión nasal, estornudos, dolor de garganta.
Lopid 300mg con poca frecuencia puede causar cálculos biliares y problemas hepáticos.
Informe a su médico si nota alguno de los siguientes efectos secundarios poco probables pero graves de Lopid 300 mg, que incluyen:
- dolor estomacal/abdominal intenso,
- náuseas o vómitos persistentes,
- ojos o piel amarillentos, y
- orina oscura.
DESCRIPCIÓN
LOPID® (comprimidos de gemfibrozil, USP) es un agente regulador de lípidos. Está disponible en forma de comprimidos para administración oral. Cada comprimido contiene 600 mg de gemfibrozilo. Cada tableta también contiene estearato de calcio, NF; cera de candelilla, FCC; celulosa microcristalina, NF; hidroxipropilcelulosa, NF; hipromelosa, USP; metilparabeno, NF; blanco opaspray; polietilenglicol, NF; polisorbato 80, NF; propilparabeno, NF; dióxido de silicio coloidal, NF; almidón pregelatinizado, NF. El nombre químico es ácido 5-(2,5-dimetilfenoxi)-2,2-dimetilpentanoico, con la siguiente fórmula estructural:
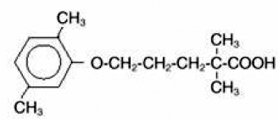
La fórmula empírica es C15H22O3 y el peso molecular es 250,35; la solubilidad en agua y ácido es del 0,0019% y en base diluida es superior al 1%. El punto de fusión es de 58° a 61°C. Gemfibrozil es un sólido blanco que es estable en condiciones ordinarias.
INDICACIONES
LOPID (comprimidos de gemfibrozil, USP) está indicado como terapia complementaria a la dieta para:
En un análisis de subgrupos de pacientes en el Helsinki Heart Study con valores basales de colesterol HDL por encima de la mediana (superiores a 46,4 mg/dL), la incidencia de eventos coronarios graves fue similar para los subgrupos de gemfibrozil y placebo (ver Tabla I).
El tratamiento inicial para la dislipidemia es una terapia dietética específica para el tipo de anormalidad de las lipoproteínas. El exceso de peso corporal y la ingesta excesiva de alcohol pueden ser factores importantes en la hipertrigliceridemia y deben controlarse antes de cualquier tratamiento farmacológico. El ejercicio físico puede ser una medida auxiliar importante y se ha asociado con aumentos en el colesterol HDL. Las enfermedades que contribuyen a la hiperlipidemia, como el hipotiroidismo o la diabetes mellitus, deben buscarse y tratarse adecuadamente. La terapia con estrógenos a veces se asocia con aumentos masivos de los triglicéridos plasmáticos, especialmente en sujetos con hipertrigliceridemia familiar. En tales casos, la interrupción de la terapia con estrógenos puede obviar la necesidad de una terapia farmacológica específica para la hipertrigliceridemia. El uso de fármacos debe considerarse sólo cuando se hayan realizado intentos razonables para obtener resultados satisfactorios con métodos no farmacológicos. Si se toma la decisión de usar medicamentos, se debe instruir al paciente que esto no reduce la importancia de adherirse a la dieta.
DOSIFICACIÓN Y ADMINISTRACIÓN
La dosis recomendada para adultos es de 1200 mg administrados en dos tomas 30 minutos antes del desayuno y la cena (ver FARMACOLOGÍA CLÍNICA ).
CÓMO SUMINISTRADO
LOPID (Tableta 737), tabletas blancas, elípticas, recubiertas con película, ranuradas, cada una con 600 mg de gemfibrozilo, están disponibles de la siguiente manera:
CDN 0071-0737-20: Botellas de 60 CDN 0071-0737-30: Botellas de 500
Almacenar a temperatura ambiente controlada de 20° a 25°C (68° a 77°F) [ver USP]. Proteger de la luz y la humedad.
Distribuido por Parke-Davis Division of Pfizer Inc, NY, NY 10017. Revisado: diciembre de 2020
EFECTOS SECUNDARIOS
En la fase controlada doble ciego del componente de prevención primaria del Helsinki Heart Study, 2046 pacientes recibieron LOPID durante un máximo de cinco años. En ese estudio, las siguientes reacciones adversas fueron estadísticamente más frecuentes en sujetos del grupo LOPID:
Cirugía de vesícula biliar se realizó en el 0,9% de LOPID 300mg y en el 0,5% de los sujetos placebo en el componente de prevención primaria, un exceso del 64%, que no es estadísticamente diferente del exceso de cirugía de vesícula biliar observado en el grupo de clofibrato en comparación con el grupo placebo del estudio de la OMS . La cirugía de la vesícula biliar también se realizó con mayor frecuencia en el grupo LOPID en comparación con el grupo placebo (1,9% frente a 0,3%, p = 0,07) en el componente de prevención secundaria. También se observó un aumento estadísticamente significativo en la apendicectomía en el grupo de gemfibrozil en el componente de prevención secundaria (6 con gemfibrozil versus 0 con placebo, p=0,014).
Las reacciones adversas del sistema nervioso y de los sentidos especiales fueron más frecuentes en el grupo de LOPID de 300 mg. Estos incluyeron hipoestesia, parestesias y alteración del gusto. Otras reacciones adversas que fueron más comunes entre los sujetos del grupo de tratamiento con 300 mg de LOPID, pero en las que no se estableció una relación causal, incluyen cataratas, enfermedad vascular periférica y hemorragia intracerebral.
partir de otros estudios, parece probable que LOPID 300 mg esté causalmente relacionado con la aparición de SÍNTOMAS MUSCULOESQUELÉTICOS (ver ADVERTENCIAS ) y a PRUEBAS ANORMALES DE FUNCIÓN HEPÁTICA y CAMBIOS HEMATOLÓGICOS (ver PRECAUCIONES ).
Los informes de infecciones virales y bacterianas (resfriado común, tos, infecciones del tracto urinario) fueron más comunes en pacientes tratados con gemfibrozil en otros ensayos clínicos controlados de 805 pacientes. Las reacciones adversas adicionales que se han informado para gemfibrozil se enumeran a continuación por sistema. Se categorizan según sea probable o no establecida una relación causal con el tratamiento con LOPID:
Las reacciones adversas adicionales que se han informado incluyen colecistitis y colelitiasis. (ver ADVERTENCIAS ).
INTERACCIONES CON LA DROGAS
Inhibidores de la HMG-CoA reductasa
Está contraindicada la administración concomitante de LOPID 300 mg con simvastatina (ver CONTRAINDICACIONES y ADVERTENCIAS ). Evitar el uso concomitante de LOPID con rosuvastatina. Si no se puede evitar el uso concomitante, iniciar rosuvastatina a 5 mg una vez al día. La dosis de rosuvastatina no debe exceder los 10 mg una vez al día. El riesgo de miopatía y rabdomiolisis aumenta con la terapia combinada de gemfibrozilo e inhibidores de la HMG-CoA reductasa. Se han notificado casos de miopatía o rabdomiólisis con o sin insuficiencia renal aguda tres semanas después del inicio de la terapia combinada o después de varios meses (ver ADVERTENCIAS ). No hay garantía de que el control periódico de la creatina quinasa prevenga la aparición de miopatía grave y daño renal.
anticoagulantes
SE DEBE TENER PRECAUCIÓN CUANDO SE ADMINISTRE WARFARINA JUNTO CON LOPID. LA DOSIS DE WARFARINA DEBE SER REDUCIDA PARA MANTENER EL TIEMPO DE PROTROMBINA EN EL NIVEL DESEADO PARA PREVENIR COMPLICACIONES HEMORRÁGICAS. SE RECOMIENDA REALIZAR DETERMINACIONES DE PROTROMBINA HASTA QUE SE HAYA DETERMINADO DEFINITIVAMENTE QUE EL NIVEL DE PROTROMBINA SE HA ESTABILIZADO.
Sustratos CYP2C8
Gemfibrozil es un inhibidor potente de CYP2C8 y puede aumentar la exposición de fármacos metabolizados principalmente por CYP2C8 (p. ej., dabrafenib, enzalutamida, loperamida, montelukast, paclitaxel, pioglitazona, rosiglitazona). Por lo tanto, puede ser necesaria una reducción de la dosis de los fármacos que son metabolizados principalmente por la enzima CYP2C8 cuando se usa concomitantemente con gemfibrozilo (ver ADVERTENCIAS ).
repaglinida
En voluntarios sanos, la coadministración con gemfibrozil (600 mg dos veces al día durante 3 días) dio como resultado un AUC de repaglinida 8,1 veces (rango de 5,5 a 15,0 veces) mayor y un AUC de 28,6 veces (rango de 18,5 a 80,1 veces) mayor mayor concentración plasmática de repaglinida 7 horas después de la dosis. En el mismo estudio, gemfibrozil (600 mg dos veces al día durante 3 días) + itraconazol (200 mg por la mañana y 100 mg por la noche el Día 1, luego 100 mg dos veces al día los Días 2-3) resultó en un 19,4-( 7 horas después de la dosis. Además, gemfibrozilo solo o gemfibrozilo + itraconazol prolongaron los efectos hipoglucemiantes de la repaglinida. La administración conjunta de gemfibrozilo y repaglinida aumenta el riesgo de hipoglucemia grave y está contraindicada (ver CONTRAINDICACIONES ).
Dasabuvir
La coadministración de gemfibrozil con dasabuvir aumentó el AUC y la Cmax de dasabuvir (cocientes: 11,3 y 2,01, respectivamente) debido a la inhibición de CYP2C8. Una mayor exposición a dasabuvir puede aumentar el riesgo de prolongación del intervalo QT, por lo tanto, está contraindicada la coadministración de gemfibrozil con dasabuvir (ver CONTRAINDICACIONES ).
Selexipag
La administración conjunta de gemfibrozilo con selexipag duplicó la exposición a selexipag y aumentó la exposición al metabolito activo en aproximadamente 11 veces. Está contraindicada la administración concomitante de gemfibrozilo con selexipag (ver CONTRAINDICACIONES ).
enzalutamida
En voluntarios sanos que recibieron una dosis única de 160 mg de enzalutamida después de 600 mg de gemfibrozil dos veces al día, el AUC de enzalutamida más el metabolito activo (N-desmetil enzalutamida) aumentó 2,2 veces y la Cmáx correspondiente disminuyó un 16 %. Una mayor exposición a enzalutamida puede aumentar el riesgo de convulsiones. Si se considera necesaria la administración conjunta, se debe reducir la dosis de enzalutamida (ver ADVERTENCIAS ).
Sustratos OATP1B1
Gemfibrozil es un inhibidor del transportador OATP1B1 y puede aumentar la exposición de fármacos que son sustratos de OATP1B1 (p. ej., atrasentan, atorvastatina, bosentan, ezetimiba, fluvastatina, gliburida, SN-38 [metabolito activo de irinotecán], rosuvastatina, pitavastatina, pravastatina, rifampicina , valsartán, olmesartán). Por lo tanto, pueden ser necesarias reducciones de dosis de fármacos que son sustratos de OATP1B1 cuando se usa gemfibrozil de forma concomitante (ver ADVERTENCIAS ). Está contraindicada la terapia combinada de gemfibrozilo con simvastatina o repaglinida, que son sustratos de OATP1B1 (ver CONTRAINDICACIONES ).
Estudios in vitro de enzimas CYP, enzimas UGTA y transportador OATP1B1
Los estudios in vitro han demostrado que gemfibrozilo es un inhibidor de CYP1A2, CYP2C8, CYP2C9, CYP2C19, OATP1B1 y UDP-glucuronosiltransferasa (UGT) 1A1 y 1A3 (ver ADVERTENCIAS ).
Resinas de unión a ácidos biliares
El AUC de gemfibrozil se redujo en un 30 % cuando se administró gemfibrozil (600 mg) simultáneamente con fármacos granulados de resina como el colestipol (5 g). Se recomienda la administración de los medicamentos con dos horas o más de diferencia porque la exposición al gemfibrozil no se vio afectada significativamente cuando se administró con dos horas de diferencia con el colestipol.
colchicina
Se ha informado miopatía, incluida rabdomiolisis, con la administración crónica de colchicina a dosis terapéuticas. El uso concomitante de LOPID puede potenciar el desarrollo de miopatía. Los pacientes con disfunción renal y los pacientes de edad avanzada tienen un mayor riesgo. Se debe tener precaución al prescribir LOPID con colchicina, especialmente en pacientes de edad avanzada o pacientes con disfunción renal.
ADVERTENCIAS
Debido al tamaño más limitado del Helsinki Heart Study, la diferencia observada en la mortalidad por cualquier causa entre los grupos de LOPID 300 mg y placebo no es significativamente diferente desde el punto de vista estadístico del exceso de mortalidad del 29 % notificado en el grupo de clofibrato en el estudio separado de la OMS en el seguimiento de nueve años (ver FARMACOLOGÍA CLÍNICA ). La mortalidad relacionada con enfermedades cardíacas no coronarias mostró un exceso en el grupo originalmente aleatorizado a LOPID principalmente debido a las muertes por cáncer observadas durante la extensión de etiqueta abierta.
Durante el componente de prevención primaria de cinco años del Helsinki Heart Study, la mortalidad por cualquier causa fue de 44 (2,2 %) en el grupo de LOPID de 300 mg y de 43 (2,1 %) en el grupo de placebo; incluido el período de seguimiento de 3,5 años desde que se completó el ensayo, la mortalidad acumulada por cualquier causa fue de 101 (4,9 %) en el grupo de LOPID y de 83 (4,1 %) en el grupo originalmente aleatorizado a placebo (razón de riesgo 1:20 a favor de placebo). Debido al tamaño más limitado del Helsinki Heart Study, la diferencia observada en la mortalidad por cualquier causa entre los grupos de LOPID 300 mg y placebo en el año 5 o en el año 8,5 no es significativamente diferente desde el punto de vista estadístico del exceso de mortalidad del 29 % informado en el grupo de clofibrato en el estudio separado de la OMS a los nueve años de seguimiento. La mortalidad relacionada con enfermedades cardíacas no coronarias mostró un exceso en el grupo originalmente aleatorizado a LOPID 300 mg en el seguimiento de 8,5 años (65 LOPID 300 mg versus 45 muertes no coronarias con placebo).
La incidencia de cáncer (excluido el carcinoma de células basales) descubierto durante el ensayo y en los 3,5 años posteriores a la finalización del ensayo fue de 51 (2,5 %) en ambos grupos originalmente aleatorizados. Además, hubo 16 carcinomas de células basales en el grupo originalmente aleatorizado a LOPID 300 mg y 9 en el grupo originalmente aleatorizado a placebo (p=0,22). Hubo 30 (1,5 %) muertes atribuidas al cáncer en el grupo originalmente aleatorizado a LOPID 300 mg y 18 (0,9 %) en el grupo originalmente aleatorizado a placebo (p=0,11). Los resultados adversos, incluidos los eventos coronarios, fueron mayores en pacientes con gemfibrozil en un estudio correspondiente en hombres con antecedentes de enfermedad coronaria conocida o sospechada en el componente de prevención secundaria del Helsinki Heart Study (ver FARMACOLOGÍA CLÍNICA ).
También se realizó un estudio comparativo de carcinogenicidad en ratas comparando tres fármacos de esta clase: fenofibrato (10 y 60 mg/kg; 0,3 y 1,6 veces la dosis humana, respectivamente), clofibrato (400 mg/kg; 1,6 veces la dosis humana), y gemfibrozilo (250 mg/kg; 1,7 veces la dosis humana). Los adenomas acinares pancreáticos aumentaron en hombres y mujeres con fenofibrato; el carcinoma hepatocelular y los adenomas acinares pancreáticos aumentaron en los hombres y los nódulos neoplásicos hepáticos en las mujeres tratadas con clofibrato; los nódulos neoplásicos hepáticos aumentaron en hombres y mujeres tratados con clofibrato; los nódulos neoplásicos hepáticos aumentaron en hombres y mujeres tratados con gemfibrozilo, mientras que los tumores de células intersticiales testiculares (células de Leydig) aumentaron en hombres con los tres fármacos.
PRECAUCIONES
Terapia Inicial
Se deben realizar estudios de laboratorio para asegurarse de que los niveles de lípidos sean consistentemente anormales. Antes de iniciar el tratamiento con LOPID, se debe intentar por todos los medios controlar los lípidos séricos con una dieta adecuada, ejercicio, pérdida de peso en pacientes obesos y control de cualquier problema médico, como diabetes mellitus e hipotiroidismo, que contribuya a las anomalías de los lípidos.
Terapia continua
Debe obtenerse una determinación periódica de los lípidos séricos y retirarse el fármaco si la respuesta lipídica es inadecuada después de tres meses de tratamiento.
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Se han realizado estudios a largo plazo en ratas a 0,2 y 1,3 veces la exposición humana (basado en el AUC). La incidencia de nódulos hepáticos benignos y carcinomas hepáticos aumentó significativamente en ratas macho a dosis altas. La incidencia de carcinomas hepáticos también aumentó en los machos que recibieron dosis bajas, pero este aumento no fue estadísticamente significativo (p=0,1). Las ratas macho tuvieron un aumento estadísticamente significativo y relacionado con la dosis de tumores benignos de células de Leydig. La dosis más alta de ratas hembra tuvo un aumento significativo en la incidencia combinada de neoplasias hepáticas benignas y malignas.
Se han realizado estudios a largo plazo en ratones a 0,1 y 0,7 veces la exposición humana (basado en el AUC). No hubo diferencias estadísticamente significativas con respecto a los controles en la incidencia de tumores hepáticos, pero las dosis probadas fueron más bajas que las que demostraron ser cancerígenas con otros fibratos.
Los estudios de microscopía electrónica han demostrado una proliferación florida de peroxisomas hepáticos después de la administración de LOPID a la rata macho. No se ha realizado un estudio adecuado para evaluar la proliferación de peroxisomas en humanos, pero se han observado cambios en la morfología de los peroxisomas. Se ha demostrado que la proliferación de peroxisomas ocurre en humanos con cualquiera de los otros dos fármacos de la clase de los fibratos cuando se compararon biopsias de hígado antes y después del tratamiento en el mismo individuo.
La administración de aproximadamente 2 veces la dosis humana (basada en el área de superficie) a ratas macho durante 10 semanas resultó en una disminución de la fertilidad relacionada con la dosis. Estudios posteriores demostraron que este efecto se revirtió después de un período libre de drogas de aproximadamente ocho semanas y no se transmitió a la descendencia.
El embarazo
Se ha demostrado que LOPID 300 mg produce efectos adversos en ratas y conejos en dosis entre 0,5 y 3 veces la dosis humana (basado en el área de superficie). No existen estudios adecuados y bien controlados en mujeres embarazadas. LOPID 300 mg debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto.
La administración de 300 mg de LOPID a ratas hembra al doble de la dosis humana (basada en el área de superficie) antes y durante la gestación provocó una disminución relacionada con la dosis en la tasa de concepción, un aumento en los mortinatos y una ligera reducción en el peso de las crías durante la lactancia. También hubo variaciones esqueléticas aumentadas relacionadas con la dosis. Ocurrió anoftalmía, pero raramente.
La administración de 0,6 y 2 veces la dosis humana (basada en el área de superficie) de LOPID a ratas hembra desde el día 15 de gestación hasta el destete provocó disminuciones relacionadas con la dosis en el peso al nacer y supresiones del crecimiento de las crías durante la lactancia.
La administración de 1 y 3 veces la dosis humana (basada en el área de superficie) de LOPID 300 mg a conejos hembra durante la organogénesis provocó una disminución relacionada con la dosis en el tamaño de la camada y, con la dosis alta, una mayor incidencia de variaciones en el hueso parietal.
Madres lactantes
No se sabe si este fármaco se excreta en la leche humana. Debido a que muchos fármacos se excretan en la leche humana y debido al potencial de tumorigenicidad mostrado por LOPID en estudios con animales, se debe tomar la decisión de interrumpir la lactancia o interrumpir el fármaco, teniendo en cuenta la importancia del fármaco para la madre.
Cambios hematológicos
Se han observado disminuciones leves de hemoglobina, hematocrito y glóbulos blancos en pacientes ocasionales después del inicio de la terapia con LOPID. Sin embargo, estos niveles se estabilizan durante la administración a largo plazo. En raras ocasiones, se han notificado casos de anemia grave, leucopenia, trombocitopenia e hipoplasia de la médula ósea.
Por lo tanto, se recomiendan hemogramas periódicos durante los primeros 12 meses de la administración de LOPID 300 mg.
Función del hígado
Ocasionalmente se han observado pruebas de función hepática anormales durante la administración de LOPID, incluidas elevaciones de AST, ALT, LDH, bilirrubina y fosfatasa alcalina. Estos suelen ser reversibles cuando se suspende LOPID 300 mg. Por lo tanto, se recomiendan estudios periódicos de la función hepática y se debe interrumpir el tratamiento con LOPID 300 mg si persisten las anomalías.
Función del riñón
Ha habido informes de empeoramiento de la insuficiencia renal tras la adición de la terapia con LOPID en personas con creatinina plasmática inicial >2,0 mg/dl. En tales pacientes, se debe considerar el uso de una terapia alternativa frente a los riesgos y beneficios de una dosis más baja de LOPID.
Uso pediátrico
No se ha establecido la seguridad y eficacia en pacientes pediátricos.
SOBREDOSIS
Se han notificado casos de sobredosis con LOPID. En un caso, un niño de 7 años se recuperó tras ingerir hasta 9 gramos de LOPID. Los síntomas informados con sobredosis fueron calambres abdominales, pruebas de función hepática anormales, diarrea, aumento de CPK, dolor articular y muscular, náuseas y vómitos. Se deben tomar medidas de apoyo sintomáticas, en caso de que ocurra una sobredosis.
CONTRAINDICACIONES
FARMACOLOGÍA CLÍNICA
LOPID es un agente regulador de lípidos que disminuye los triglicéridos séricos y el colesterol de lipoproteínas de muy baja densidad (VLDL), y aumenta el colesterol de lipoproteínas de alta densidad (HDL). Si bien se pueden observar disminuciones modestas en el colesterol total y de lipoproteínas de baja densidad (LDL) con la terapia con 300 mg de LOPID, el tratamiento de pacientes con triglicéridos elevados debido a la hiperlipoproteinemia tipo IV a menudo resulta en un aumento del colesterol LDL. Los niveles de colesterol LDL en pacientes de tipo IIb con elevaciones tanto del colesterol LDL sérico como de los triglicéridos se ven, en general, mínimamente afectados por el tratamiento con LOPID 300 mg; sin embargo, LOPID de 300 mg suele aumentar significativamente el colesterol HDL en este grupo. LOPID 300mg aumenta los niveles de las subfracciones HDL2 y HDL3 de lipoproteínas de alta densidad (HDL), así como las apolipoproteínas AI y AII. Los estudios epidemiológicos han demostrado que tanto el colesterol HDL bajo como el colesterol LDL alto son factores de riesgo independientes para la enfermedad coronaria.
En el componente de prevención primaria del Helsinki Heart Study, en el que se estudiaron 4081 pacientes masculinos entre las edades de 40 y 55 años de forma aleatoria, doble ciego y controlado con placebo, la terapia con LOPID de 300 mg se asoció con reducciones significativas en los triglicéridos plasmáticos totales y un aumento significativo en el colesterol de lipoproteínas de alta densidad. Se observaron reducciones moderadas en el colesterol plasmático total y el colesterol de lipoproteínas de baja densidad para el grupo de tratamiento con LOPID en su conjunto, pero la respuesta lipídica fue heterogénea, especialmente entre los diferentes tipos de Fredrickson. El estudio involucró a sujetos con colesterol sérico no HDL de más de 200 mg/dL y sin antecedentes de enfermedad coronaria. Durante el período de estudio de cinco años, el grupo de LOPID de 300 mg experimentó una reducción absoluta del 1,4 % (relativa del 34 %) en la tasa de eventos coronarios graves (muertes cardíacas súbitas más infartos de miocardio fatales y no fatales) en comparación con el placebo, p = 0,04 (ver Tabla I). Hubo una reducción relativa del 37 % en la tasa de infarto de miocardio no fatal en comparación con el placebo, equivalente a una diferencia relacionada con el tratamiento de 13,1 eventos por mil personas. Las muertes por cualquier causa durante la parte doble ciego del estudio totalizaron 44 (2,2 %) en el grupo de aleatorización de LOPID 300 mg y 43 (2,1 %) en el grupo de placebo.
Entre los tipos de Fredrickson, durante la parte doble ciego de 5 años del componente de prevención primaria del Helsinki Heart Study, la mayor reducción en la incidencia de eventos coronarios graves se produjo en pacientes de tipo IIb que tenían elevaciones tanto del colesterol LDL como del plasma total. triglicéridos Este subgrupo de pacientes del grupo gemfibrozil Tipo IIb tenía un nivel medio de colesterol HDL más bajo al inicio del estudio que el subgrupo Tipo IIa que tenía elevaciones de colesterol LDL y triglicéridos plasmáticos normales. El aumento medio del colesterol HDL entre los pacientes de tipo IIb en este estudio fue del 12,6 % en comparación con el placebo. El cambio medio en el colesterol LDL entre los pacientes de tipo IIb fue del –4,1 % con LOPID en comparación con un aumento del 3,9 % en el subgrupo de placebo. Los sujetos de tipo IIb en el Helsinki Heart Study tuvieron 26 eventos coronarios menos por cada mil personas durante cinco años en el grupo de gemfibrozil en comparación con el placebo. La diferencia en eventos coronarios fue sustancialmente mayor entre LOPID 300 mg y placebo para ese subgrupo de pacientes con la tríada de colesterol LDL >175 mg/dL (>4,5 mmol), triglicéridos >200 mg/dL (>2,2 mmol) y HDL. -colesterol
Hay más información disponible a partir de un seguimiento de 3,5 años (8,5 años acumulativos) de todos los sujetos que habían participado en el Helsinki Heart Study. Al finalizar el Helsinki Heart Study, los sujetos podían elegir comenzar, detener o continuar recibiendo LOPID; sin conocimiento de sus propios valores de lípidos o tratamiento doble ciego, el 60 % de los pacientes originalmente asignados al azar a placebo comenzaron la terapia con 300 mg de LOPID y el 60 % de los pacientes originalmente asignados al azar a LOPID continuaron con la medicación. Después de aproximadamente 6,5 años después de la aleatorización, se informó a todos los pacientes sobre su grupo de tratamiento original y los valores de lípidos durante los cinco años del tratamiento doble ciego. Después de más cambios electivos en el estado del tratamiento con LOPID, el 61 % de los pacientes del grupo asignado originalmente al azar a LOPID estaban tomando el fármaco; en el grupo originalmente aleatorizado para recibir placebo, el 65 % tomaba LOPID. La tasa de eventos por 1000 que ocurren durante el período de seguimiento de etiqueta abierta se detalla en la Tabla II.
La mortalidad acumulada a lo largo de 8,5 años mostró un exceso relativo de muertes del 20 % en el grupo originalmente aleatorizado a LOPID 300 mg frente al grupo de placebo originalmente aleatorizado y una disminución relativa del 20 % en eventos cardíacos en el grupo originalmente aleatorizado a LOPID 300 mg frente al grupo de placebo originalmente aleatorizado (ver Tabla III). Este análisis de la población originalmente aleatorizada con "intención de tratar" ignora los posibles efectos de complicación del cambio de tratamiento durante la fase abierta. El ajuste de los cocientes de riesgos instantáneos, teniendo en cuenta el estado de tratamiento abierto de los años 6,5 a 8,5, podría cambiar los cocientes de riesgos instantáneos informados para la mortalidad hacia la unidad.
No está claro en qué medida los hallazgos del componente de prevención primaria del Helsinki Heart Study pueden extrapolarse a otros segmentos de la población dislipidémica no estudiada (como mujeres, hombres jóvenes o mayores, o aquellos con anomalías lipídicas limitadas únicamente a HDL). -colesterol) o a otros fármacos que alteran los lípidos.
El componente de prevención secundaria del Helsinki Heart Study se llevó a cabo durante cinco años en paralelo y en los mismos centros de Finlandia en 628 hombres de mediana edad excluidos del componente de prevención primaria del Helsinki Heart Study debido a antecedentes de angina, infarto de miocardio, o cambios de ECG inexplicables. La variable principal de eficacia del estudio fueron los eventos cardíacos (la suma de infartos de miocardio fatales y no fatales y muertes cardíacas súbitas). El cociente de riesgos instantáneos (LOPID:placebo) para eventos cardíacos fue de 1,47 (límites de confianza del 95 %: 0,88–2,48, p=0,14). De los 35 pacientes en el grupo de LOPID 300 mg que experimentaron eventos cardíacos, 12 pacientes sufrieron eventos después de la interrupción del estudio. De los 24 pacientes en el grupo de placebo con eventos cardíacos, 4 pacientes sufrieron eventos después de la interrupción del estudio. Hubo 17 muertes cardíacas en el grupo LOPID y 8 en el grupo placebo (razón de riesgo 2,18; límites de confianza del 95% 0,94-5,05, p = 0,06). Diez de estas muertes en el grupo de LOPID y 3 en el grupo de placebo se produjeron después de la interrupción del tratamiento. En este estudio de pacientes con enfermedad coronaria conocida o sospechada, no se observó ningún beneficio del tratamiento con LOPID 300 mg en la reducción de eventos cardíacos o muertes cardíacas. Por lo tanto, LOPID 300 mg ha mostrado beneficio solo en pacientes dislipidémicos seleccionados sin enfermedad coronaria sospechada o establecida. Incluso en pacientes con cardiopatía coronaria y la tríada de colesterol LDL elevado, triglicéridos elevados y colesterol HDL bajo, no se ha estudiado adecuadamente el posible efecto de LOPID en los eventos coronarios.
No se observó eficacia en los pacientes con cardiopatía coronaria establecida durante el Coronary Drug Project con el fármaco relacionado química y farmacológicamente, el clofibrato. El Coronary Drug Project fue un estudio doble ciego aleatorizado de 6 años que involucró a 1000 pacientes con clofibrato, 1000 con ácido nicotínico y 3000 pacientes con placebo con enfermedad coronaria conocida. Se observó una reducción clínica y estadísticamente significativa de los infartos de miocardio en el grupo de ácido nicotínico concurrente en comparación con el placebo; no se observó reducción con clofibrato.
El mecanismo de acción de gemfibrozilo no se ha establecido definitivamente. En el hombre, se ha demostrado que LOPID 300 mg inhibe la lipólisis periférica y disminuye la extracción hepática de ácidos grasos libres, reduciendo así la producción hepática de triglicéridos. LOPID 300 mg inhibe la síntesis y aumenta la eliminación de la apolipoproteína B portadora de VLDL, lo que conduce a una disminución en la producción de VLDL.
Los estudios en animales sugieren que el gemfibrozil puede, además de elevar el colesterol HDL, reducir la incorporación de ácidos grasos de cadena larga en los triglicéridos recién formados, acelerar la renovación y eliminación del colesterol del hígado y aumentar la excreción de colesterol en las heces. LOPID 300 mg se absorbe bien en el tracto gastrointestinal después de la administración oral. Los niveles plasmáticos máximos ocurren en 1 a 2 horas con una vida media plasmática de 1,5 horas después de dosis múltiples.
Gemfibrozilo se absorbe por completo después de la administración oral de comprimidos de 300 mg de LOPID, alcanzando concentraciones plasmáticas máximas de 1 a 2 horas después de la administración. La farmacocinética de gemfibrozil se ve afectada por el momento de las comidas en relación con el momento de la dosificación. En un estudio (ref. 4), tanto la velocidad como el grado de absorción del fármaco aumentaron significativamente cuando se administró 0,5 horas antes de las comidas. El AUC promedio se redujo entre un 14 % y un 44 % cuando se administró LOPID después de las comidas en comparación con 0,5 horas antes de las comidas. En un estudio posterior, la tasa de absorción de LOPID 300 mg fue máxima cuando se administró 0,5 horas antes de las comidas, con una Cmáx de 50 a 60 % mayor que cuando se administró con las comidas o en ayunas. En este estudio, no hubo efectos significativos sobre el AUC del momento de la dosis en relación con las comidas (ver DOSIFICACIÓN Y ADMINISTRACIÓN ).
LOPID se somete principalmente a la oxidación de un grupo metilo del anillo para formar sucesivamente un metabolito hidroximetilo y carboxilo. Aproximadamente el setenta por ciento de la dosis humana administrada se excreta en la orina, principalmente como conjugado de glucurónido, con menos del 2% excretado como gemfibrozilo sin cambios. El seis por ciento de la dosis se contabiliza en las heces. Gemfibrozilo se une en gran medida a las proteínas plasmáticas y existe la posibilidad de interacciones de desplazamiento con otros fármacos (ver PRECAUCIONES ).
INFORMACIÓN DEL PACIENTE
No se proporcionó información. por favor refiérase a ADVERTENCIAS y PRECAUCIONES secciones.
