Zocor 5mg, 10mg, 20mg, 40mg Simvastatin Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Zocor y cómo se usa?
Zocor (simvastatina) es un medicamento recetado que se usa para reducir los niveles de colesterol "malo" (lipoproteína de baja densidad o LDL) y para aumentar los niveles de colesterol "bueno" (lipoproteína de alta densidad o HDL) y para reducir los niveles de triglicerina, así como para reducir el riesgo de accidentes cerebrovasculares y ataques cardíacos. Zocor se puede usar solo o con otros medicamentos.
Zocor pertenece a una clase de medicamentos llamados agentes reductores de lípidos, estatinas, inhibidores de la HMG-CoA reductasa.
No se sabe si Zocor es seguro y efectivo en niños menores de 10 años.
¿Cuáles son los posibles efectos secundarios de Zocor?
Zocor 20 mg puede causar efectos secundarios graves, que incluyen:
- pérdida de apetito,
- dolor de estómago en el lado superior derecho,
- cansancio,
- Comezón,
- orina oscura,
- heces de color arcilla, y
- coloración amarillenta de la piel o los ojos
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Zocor incluyen:
- dolor de cabeza,
- náuseas,
- dolor de estómago,
- estreñimiento, y
- síntomas de resfriado (nariz tapada, estornudos o dolor de garganta)
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Zocor. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
ZOCOR (simvastatina) es un agente reductor de lípidos que se deriva sintéticamente de un producto de fermentación de Aspergillus terreus. Después de la ingestión oral, la simvastatina, que es una lactona inactiva, se hidroliza a la forma β-hidroxiácido correspondiente. Este es un inhibidor de la 3-hidroxi-3-metilglutaril-coenzima A (HMG-CoA) reductasa. Esta enzima cataliza la conversión de HMG-CoA en mevalonato, que es un paso temprano y limitante en la biosíntesis del colesterol.
La simvastatina es ácido butanoico, 2,2-dimetil-,1,2,3,7,8,8a-hexahidro-3,7-dimetil-8-[2-(tetrahidro-4hidroxi-6-oxo-2H-pirano- 2-il)-etil]-1-naftalenilo éster, [1S-[1α,3α,7β,8β(2S*,4S*),-8aβ]]. La fórmula empírica de la simvastatina es C25H38O5 y su peso molecular es 418,57. Su fórmula estructural es:
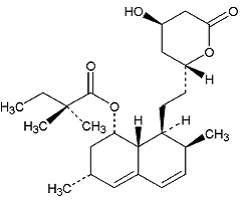
La simvastatina es un polvo cristalino, no higroscópico, de color blanco a blanquecino, prácticamente insoluble en agua y fácilmente soluble en cloroformo, metanol y etanol.
Los comprimidos de ZOCOR para administración oral contienen 5 mg, 10 mg, 20 mg, 40 mg u 80 mg de simvastatina y los siguientes ingredientes inactivos: ácido ascórbico, ácido cítrico, hidroxipropilcelulosa, hipromelosa, óxidos de hierro, lactosa, estearato de magnesio, celulosa microcristalina , almidón, talco y dióxido de titanio. Se añade hidroxianisol butilado como conservante.
INDICACIONES
La terapia con agentes que alteran los lípidos debe ser solo un componente de la intervención de múltiples factores de riesgo en individuos con un riesgo significativamente mayor de enfermedad vascular aterosclerótica debido a la hipercolesterolemia. La farmacoterapia está indicada como complemento de la dieta cuando la respuesta a una dieta restringida en grasas saturadas y colesterol y otras medidas no farmacológicas solas ha sido inadecuada. En pacientes con cardiopatía coronaria (CHD) o con alto riesgo de CHD, ZOCOR® puede iniciarse simultáneamente con la dieta.
Reducciones en el riesgo de mortalidad por cardiopatía coronaria y eventos cardiovasculares
En pacientes con alto riesgo de eventos coronarios debido a enfermedad coronaria existente, diabetes, enfermedad vascular periférica, antecedentes de accidente cerebrovascular u otra enfermedad cerebrovascular, ZOCOR 5 mg está indicado para:
- Reducir el riesgo de mortalidad total al reducir las muertes por cardiopatía coronaria.
- Reducir el riesgo de infarto de miocardio no fatal y accidente cerebrovascular.
- Reducir la necesidad de procedimientos de revascularización coronaria y no coronaria.
Hiperlipidemia
ZOCOR está indicado para:
- Reducir los niveles elevados de colesterol total (C-total), colesterol de lipoproteínas de baja densidad (LDL-C), apolipoproteína B (Apo B) y triglicéridos (TG), y aumentar el colesterol de lipoproteínas de alta densidad (HDL-C) en pacientes con hiperlipidemia primaria (Fredrickson tipo IIa, heterocigota familiar y no familiar) o dislipidemia mixta (Fredrickson tipo IIb).
- Reducir los TG elevados en pacientes con hipertrigliceridemia (hiperlipidemia tipo IV de Fredrickson).
- Reducir los niveles elevados de TG y VLDL-C en pacientes con disbetalipoproteinemia primaria (hiperlipidemia tipo III de Fredrickson).
- Reducir el C-total y el LDL-C en pacientes con hipercolesterolemia familiar homocigota (HoFH) como complemento de otros tratamientos para reducir los lípidos (p. ej., aféresis de LDL) o si dichos tratamientos no están disponibles.
Pacientes adolescentes con hipercolesterolemia familiar heterocigota (HeFH)
ZOCOR está indicado como complemento de la dieta para reducir los niveles de C-total, C-LDL y Apo B en niños y niñas adolescentes que tienen al menos un año después de la menarquia, de 10 a 17 años de edad, con HFHe, si después de una prueba adecuada de la terapia de dieta los siguientes hallazgos están presentes:
- Hay antecedentes familiares positivos de enfermedad cardiovascular prematura (ECV) o
- Dos o más factores de riesgo de ECV están presentes en el paciente adolescente.
El objetivo mínimo del tratamiento en pacientes pediátricos y adolescentes es alcanzar un C-LDL medio
Limitaciones de uso
ZOCOR 20 mg no se ha estudiado en condiciones en las que la anomalía principal es la elevación de quilomicrones (es decir, hiperlipidemia Fredrickson tipos I y V).
DOSIFICACIÓN Y ADMINISTRACIÓN
Dosis recomendada
El rango de dosificación habitual es de 5 a 40 mg/día. En pacientes con cardiopatía coronaria o con alto riesgo de cardiopatía coronaria, ZOCOR puede iniciarse simultáneamente con la dieta. La dosis inicial habitual recomendada es de 10 o 20 mg una vez al día por la noche. Para pacientes con alto riesgo de un evento de CC debido a CC existente, diabetes, enfermedad vascular periférica, antecedentes de accidente cerebrovascular u otra enfermedad cerebrovascular, la dosis inicial recomendada es de 40 mg/día. Las determinaciones de lípidos deben realizarse después de 4 semanas de tratamiento y periódicamente a partir de entonces.
Dosificación restringida para 80 mg
Debido al mayor riesgo de miopatía, incluida la rabdomiólisis, particularmente durante el primer año de tratamiento, el uso de la dosis de 80 mg de ZOCOR debe restringirse a los pacientes que han estado tomando simvastatina de 80 mg de forma crónica (p. ej., durante 12 meses o más). sin evidencia de toxicidad muscular [ver ADVERTENCIAS Y PRECAUCIONES ].
Los pacientes que actualmente toleran la dosis de 80 mg de ZOCOR que necesitan iniciar un fármaco interactivo que está contraindicado o está asociado con un límite de dosis para la simvastatina deben cambiar a una estatina alternativa con menos potencial de interacción fármaco-fármaco.
Debido al mayor riesgo de miopatía, incluida la rabdomiólisis, asociada con la dosis de 80 mg de ZOCOR 40 mg, los pacientes que no pueden lograr su objetivo de C-LDL utilizando la dosis de 40 mg de ZOCOR 5 mg no deben ajustarse a la dosis de 80 mg. , pero debe recibir tratamientos alternativos para reducir el LDL-C que proporcionen una mayor reducción del LDL-C.
Coadministración con otras drogas
Pacientes que toman verapamilo, diltiazem o dronedarona
- La dosis de ZOCOR no debe exceder los 10 mg/día [ver ADVERTENCIAS Y PRECAUCIONES , INTERACCIONES CON LA DROGAS , y FARMACOLOGÍA CLÍNICA ].
Pacientes que toman amiodarona, amlodipino o ranolazina
- La dosis de ZOCOR 10 mg no debe exceder los 20 mg/día [ver ADVERTENCIAS Y PRECAUCIONES , INTERACCIONES CON LA DROGAS , y FARMACOLOGÍA CLÍNICA ].
Pacientes con hipercolesterolemia familiar homocigota
La dosis recomendada es de 40 mg/día por la noche [Ver DOSIFICACIÓN Y ADMINISTRACIÓN , Dosificación restringida para 80 mg ]. ZOCOR 5 mg debe usarse como complemento de otros tratamientos para reducir los lípidos (p. ej., aféresis de LDL) en estos pacientes o si dichos tratamientos no están disponibles.
La exposición a simvastatina se duplica aproximadamente con el uso concomitante de lomitapida; por lo tanto, la dosis de ZOCOR debe reducirse en un 50 % si se inicia el tratamiento con lomitapida. La dosis de 5 mg de ZOCOR no debe exceder los 20 mg/día (o 40 mg/día para pacientes que previamente tomaron 80 mg/día de ZOCOR de forma crónica, p. ej., durante 12 meses o más, sin evidencia de toxicidad muscular) mientras tomaban lomitapida.
Adolescentes (10-17 años de edad) con hipercolesterolemia familiar heterocigota
La dosis inicial habitual recomendada es de 10 mg una vez al día por la noche. El rango de dosificación recomendado es de 10 a 40 mg/día; la dosis máxima recomendada es de 40 mg/día. Las dosis deben individualizarse de acuerdo con el objetivo recomendado de la terapia [ver Directrices del panel pediátrico del NCEP1 y Estudios clínicos ]. Los ajustes deben hacerse a intervalos de 4 semanas o más.
Pacientes con insuficiencia renal
Debido a que 5 mg de ZOCOR no experimenta una excreción renal significativa, no debería ser necesario modificar la dosis en pacientes con insuficiencia renal de leve a moderada. Sin embargo, se debe tener precaución cuando se administra ZOCOR 20 mg a pacientes con insuficiencia renal grave; tales pacientes deben comenzar con 5 mg/día y ser monitoreados de cerca [ver ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ].
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
- Comprimidos ZOCOR 5 mg son comprimidos recubiertos con película ovalados, de color beige, codificados MSD 726 en un lado y ZOCOR 5 en el otro.
- Los comprimidos de ZOCOR 10 mg son comprimidos recubiertos con película de color melocotón, ovalados, codificados MSD 735 por una cara y lisos por la otra.
- Los comprimidos de ZOCOR 20 mg son comprimidos recubiertos con película, ovalados, de color canela, codificados MSD 740 por un lado y lisos por el otro.
- Los comprimidos de ZOCOR 40 mg son comprimidos recubiertos con película, ovalados, de color rojo ladrillo, codificados MSD 749 por una cara y lisos por la otra.
- Comprimidos ZOCOR 80 mg son comprimidos recubiertos con película, con forma de cápsula, de color rojo ladrillo, codificados 543 en una cara y 80 en la otra.
Almacenamiento y manipulación
Nº 8146 - Tabletas ZOCOR 10 mg son comprimidos recubiertos con película de color melocotón, ovalados, codificados MSD 735 por una cara y lisos por la otra. Se suministran de la siguiente manera:
CDN 0006-0735-31 unidad de uso botellas de 30 CDN 0006-0735-54 unidad de uso botellas de 90.
Nº 8147 - Tabletas ZOCOR 20 mg son comprimidos recubiertos con película, ovalados, de color canela, codificados MSD 740 en un lado y lisos en el otro. Se suministran de la siguiente manera:
CDN 0006-0740-31 unidad de uso botellas de 30 CDN 0006-0740-54 unidad de uso botellas de 90.
Nº 8148 - Tabletas ZOCOR 40 mg son comprimidos recubiertos con película, ovalados, de color rojo ladrillo, codificados MSD 749 por una cara y lisos por la otra. Se suministran de la siguiente manera:
CDN 0006-0749-31 unidad de uso botellas de 30 CDN 0006-0749-54 unidad de uso botellas de 90.
Nº 6577 - Tabletas ZOCOR 80 mg son comprimidos recubiertos con película, de color rojo ladrillo, con forma de cápsula, codificados 543 en una cara y 80 en la otra. Se suministran de la siguiente manera:
CDN 0006-0543-31 unidad de uso botellas de 30 CDN 0006-0543-54 unidad de uso botellas de 90.
Almacenamiento
Almacenar entre 5 y 30 °C (41 y 86 °F).
1Programa Nacional de Educación sobre el Colesterol (NCEP): Aspectos destacados del Informe del Panel de Expertos sobre Niveles de Colesterol en Sangre en Niños y Adolescentes. Pediatría. 89(3):495-501. 1992.
Fabricado por: Merck Sharp & Dohme Ltd. Cramlington, Northumberland, Reino Unido NE23 3JU. Revisado: septiembre de 2020
EFECTOS SECUNDARIOS
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
En los estudios clínicos controlados previos a la comercialización y sus extensiones abiertas (2.423 pacientes con una mediana de seguimiento de aproximadamente 18 meses), el 1,4 % de los pacientes interrumpieron el tratamiento debido a reacciones adversas. Las reacciones adversas más comunes que llevaron a la interrupción del tratamiento fueron: trastornos gastrointestinales (0,5%), mialgia (0,1%) y artralgia (0,1%). Las reacciones adversas notificadas con mayor frecuencia (incidencia ≥5 %) en los ensayos clínicos controlados de simvastatina fueron: infecciones de las vías respiratorias superiores (9,0 %), dolor de cabeza (7,4 %), dolor abdominal (7,3 %), estreñimiento (6,6 %) y náuseas (5,4 %). %).
Estudio escandinavo de supervivencia de la simvastatina
En 4S que involucró a 4444 (rango de edad 35-71 años, 19 % mujeres, 100 % caucásicos) tratados con 20-40 mg/día de ZOCOR (n=2221) o placebo (n=2223) durante una mediana de 5,4 años, efectos adversos las reacciones informadas en ≥2 % de los pacientes y en una tasa mayor que el placebo se muestran en la Tabla 2.
Estudio de protección del corazón
En el Estudio de Protección del Corazón (HPS), que involucró a 20 536 pacientes (rango de edad de 40 a 80 años, 25 % mujeres, 97 % caucásicos, 3 % de otras razas) tratados con 40 mg/día de ZOCOR (n=10 269) o placebo (n= 10,267) durante una media de 5 años, solo se registraron las reacciones adversas graves y las interrupciones debidas a cualquier reacción adversa. Las tasas de interrupción debido a reacciones adversas fueron del 4,8 % en pacientes tratados con 10 mg de ZOCOR en comparación con el 5,1 % en pacientes tratados con placebo. La incidencia de miopatía/rabdomiolisis fue
Otros estudios clínicos
En un ensayo clínico en el que 12.064 pacientes con antecedentes de infarto de miocardio fueron tratados con ZOCOR (seguimiento medio de 6,7 años), la incidencia de miopatía (definida como debilidad muscular inexplicable o dolor con una creatina quinasa sérica [CK] >10 veces límite superior de la normalidad [ULN]) en pacientes con 80 mg/día fue de aproximadamente 0,9 % en comparación con 0,02 % para pacientes con 20 mg/día. La incidencia de rabdomiólisis (definida como miopatía con una CK >40 veces el ULN) en pacientes que recibieron 80 mg/día fue de aproximadamente 0,4 % en comparación con 0 % para los pacientes que recibieron 20 mg/día. La incidencia de miopatía, incluida la rabdomiólisis, fue máxima durante el primer año y luego disminuyó notablemente durante los años siguientes de tratamiento. En este ensayo, los pacientes fueron monitoreados cuidadosamente y se excluyeron algunos medicamentos que interactuaban.
Otras reacciones adversas notificadas en los ensayos clínicos fueron: diarrea, exantema, dispepsia, flatulencia y astenia.
Pruebas de laboratorio
Se han observado marcados aumentos persistentes de las transaminasas hepáticas [ver ADVERTENCIAS Y PRECAUCIONES ]. También se han informado niveles elevados de fosfatasa alcalina y γ-glutamil transpeptidasa. Alrededor del 5% de los pacientes tuvieron elevaciones de los niveles de CK de 3 o más veces el valor normal en una o más ocasiones. Esto fue atribuible a la fracción no cardiaca de CK. [ver ADVERTENCIAS Y PRECAUCIONES ]
Pacientes adolescentes (de 10 a 17 años)
En un estudio controlado de 48 semanas en niños y niñas adolescentes que tenían al menos 1 año después de la menarquia, 10-17 años de edad (43,4 % mujeres, 97,7 % caucásicos, 1,7 % hispanos, 0,6 % multirraciales) con hipercolesterolemia familiar heterocigota (n=175), tratados con placebo o ZOCOR (10-40 mg diarios), las reacciones adversas más comunes observadas en ambos grupos fueron infección de las vías respiratorias superiores, dolor de cabeza, dolor abdominal y náuseas [ver Uso en poblaciones específicas y Estudios clínicos ].
Experiencia posterior a la comercialización
Debido a que las siguientes reacciones son informadas voluntariamente por una población de tamaño incierto, generalmente no es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco. Se han identificado las siguientes reacciones adversas adicionales durante el uso posterior a la aprobación de simvastatina: prurito, alopecia, una variedad de cambios en la piel (p. ej., nódulos, decoloración, sequedad de la piel/membranas mucosas, cambios en el cabello/uñas), mareos, calambres musculares, mialgia , pancreatitis, parestesia, neuropatía periférica, vómitos, anemia, disfunción eréctil, enfermedad pulmonar intersticial, rabdomiólisis, hepatitis/ictericia, insuficiencia hepática mortal y no mortal y depresión.
Ha habido informes raros de miopatía necrotizante inmunomediada asociada con el uso de estatinas [ver ADVERTENCIAS Y PRECAUCIONES ].
En raras ocasiones se ha notificado un síndrome de hipersensibilidad aparente que ha incluido algunas de las siguientes características: anafilaxia, angioedema, síndrome similar al lupus eritematoso, polimialgia reumática, dermatomiositis, vasculitis, púrpura, trombocitopenia, leucopenia, anemia hemolítica, ANA positivo, aumento de la VSG, eosinofilia , artritis, artralgia, urticaria, astenia, fotosensibilidad, fiebre, escalofríos, sofocos, malestar general, disnea, necrólisis epidérmica tóxica, eritema multiforme, incluido el síndrome de Stevens-Johnson.
Ha habido informes posteriores a la comercialización raros de deterioro cognitivo (p. ej., pérdida de memoria, olvidos, amnesia, deterioro de la memoria, confusión) asociado con el uso de estatinas. Estos problemas cognitivos se han informado para todas las estatinas. Los informes generalmente no son graves y son reversibles con la interrupción de la estatina, con tiempos variables para el inicio de los síntomas (1 día a años) y resolución de los síntomas (mediana de 3 semanas).
INTERACCIONES CON LA DROGAS
Inhibidores fuertes de CYP3A4, ciclosporina o danazol
Inhibidores potentes de CYP3A4: la simvastatina, al igual que otros inhibidores de la HMG-CoA reductasa, es un sustrato de CYP3A4. La simvastatina es metabolizada por CYP3A4 pero no tiene actividad inhibidora de CYP3A4; por lo tanto, no se espera que afecte las concentraciones plasmáticas de otros fármacos metabolizados por CYP3A4.
Los niveles plasmáticos elevados de la actividad inhibidora de la HMG-CoA reductasa aumentan el riesgo de miopatía y rabdomiolisis, particularmente con dosis más altas de simvastatina. [ver ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ] Está contraindicado el uso concomitante de medicamentos etiquetados como que tienen un fuerte efecto inhibidor sobre CYP3A4 [ver CONTRAINDICACIONES ]. Si el tratamiento con itraconazol, ketoconazol, posaconazol, voriconazol, eritromicina, claritromicina o telitromicina es inevitable, se debe suspender la terapia con simvastatina durante el curso del tratamiento.
Ciclosporina o danazol: el riesgo de miopatía, incluida la rabdomiólisis, aumenta con la administración concomitante de ciclosporina o danazol. Por lo tanto, el uso concomitante de estos medicamentos está contraindicado [ver CONTRAINDICACIONES , ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ].
Medicamentos hipolipemiantes que pueden causar miopatía cuando se administran solos
gemfibrozilo
Contraindicado con simvastatina [ver CONTRAINDICACIONES y ADVERTENCIAS Y PRECAUCIONES ].
Otros fibratos
Se debe tener precaución al prescribir con simvastatina [ver ADVERTENCIAS Y PRECAUCIONES ].
Amiodarona, dronedarona, ranolazina o bloqueadores de los canales de calcio
El riesgo de miopatía, incluida la rabdomiólisis, aumenta con la administración concomitante de amiodarona, dronedarona, ranolazina o bloqueadores de los canales de calcio como verapamilo, diltiazem o amlodipina [Ver DOSIFICACIÓN Y ADMINISTRACIÓN y ADVERTENCIAS Y PRECAUCIONES , y la Tabla 3 en FARMACOLOGÍA CLÍNICA ].
niacina
Se han observado casos de miopatía/rabdomiolisis con simvastatina coadministrada con dosis modificadoras de lípidos (≥1 g/día de niacina) de productos que contienen niacina. El riesgo de miopatía es mayor en pacientes chinos. En un ensayo clínico (mediana de seguimiento de 3,9 años) que involucró a pacientes con alto riesgo de enfermedad cardiovascular y con niveles de LDL-C bien controlados con simvastatina 40 mg/día con o sin ezetimiba 10 mg/día, no hubo un beneficio incremental en resultados cardiovasculares con la adición de dosis modificadoras de lípidos (≥1 g/día) de niacina. No se recomienda la coadministración de ZOCOR con dosis modificadoras de lípidos (≥1 g/día) de niacina en pacientes chinos. Se desconoce si este riesgo se aplica a otros pacientes asiáticos [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
Digoxina
En un estudio, la administración concomitante de digoxina con simvastatina resultó en una ligera elevación de las concentraciones de digoxina en plasma. Los pacientes que toman digoxina deben ser monitoreados apropiadamente cuando se inicia el tratamiento con simvastatina [ver FARMACOLOGÍA CLÍNICA ].
Anticoagulantes cumarínicos
En dos estudios clínicos, uno en voluntarios normales y el otro en pacientes hipercolesterolémicos, la simvastatina 20-40 mg/día potenció modestamente el efecto de los anticoagulantes cumarínicos: el tiempo de protrombina, informado como Razón Internacional Normalizada (INR), aumentó desde un valor inicial de 1,7 a 1,8 y de 2,6 a 3,4 en los estudios de voluntarios y pacientes, respectivamente. Con otras estatinas, se han informado hemorragias clínicamente evidentes y/o aumento del tiempo de protrombina en algunos pacientes que toman anticoagulantes cumarínicos concomitantemente. En tales pacientes, el tiempo de protrombina debe determinarse antes de comenzar con la simvastatina y con la frecuencia suficiente durante el tratamiento inicial para asegurar que no ocurra una alteración significativa del tiempo de protrombina. Una vez que se ha documentado un tiempo de protrombina estable, los tiempos de protrombina se pueden monitorear a los intervalos generalmente recomendados para pacientes que toman anticoagulantes cumarínicos. Si se cambia o suspende la dosis de simvastatina, se debe repetir el mismo procedimiento. La terapia con simvastatina no se ha asociado con sangrado o con cambios en el tiempo de protrombina en pacientes que no toman anticoagulantes.
colchicina
Se han notificado casos de miopatía, incluida la rabdomiólisis, con simvastatina coadministrada con colchicina, y se debe tener precaución al prescribir simvastatina con colchicina.
daptomicina
Se han notificado casos de rabdomiolisis con simvastatina administrada con daptomicina. Tanto la simvastatina como la daptomicina pueden causar miopatía y rabdomiólisis cuando se administran solas y el riesgo de miopatía y rabdomiólisis puede aumentar con la administración conjunta. Suspender temporalmente ZOCOR en pacientes que toman daptomicina [ver ADVERTENCIAS Y PRECAUCIONES ].
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Miopatía/Rabdomiolisis
La simvastatina ocasionalmente causa miopatía que se manifiesta como dolor muscular, sensibilidad o debilidad con creatina quinasa (CK) por encima de diez veces el límite superior normal (LSN). La miopatía a veces toma la forma de rabdomiólisis con o sin insuficiencia renal aguda secundaria a mioglobinuria, y se han producido muertes raras. El riesgo de miopatía aumenta con los niveles plasmáticos elevados de simvastatina y ácido de simvastatina. Los factores predisponentes para la miopatía incluyen la edad avanzada (≥65 años), el sexo femenino, el hipotiroidismo no controlado y la insuficiencia renal. Los pacientes chinos pueden tener un mayor riesgo de miopatía [ver Uso en poblaciones específicas ].
El riesgo de miopatía, incluida la rabdomiólisis, está relacionado con la dosis. En una base de datos de ensayos clínicos en la que 41 413 pacientes fueron tratados con 10 mg de ZOCOR, 24 747 (aproximadamente el 60 %) de los cuales se inscribieron en estudios con una mediana de seguimiento de al menos 4 años, la incidencia de miopatía fue de aproximadamente 0,03 % y 0,08 % a 20 y 40 mg/día, respectivamente. La incidencia de miopatía con 80 mg (0,61 %) fue desproporcionadamente mayor que la observada con las dosis más bajas. En estos ensayos, se controló cuidadosamente a los pacientes y se excluyeron algunos medicamentos que interactuaban.
En un ensayo clínico en el que 12.064 pacientes con antecedentes de infarto de miocardio fueron tratados con ZOCOR (seguimiento medio de 6,7 años), la incidencia de miopatía (definida como debilidad muscular inexplicable o dolor con una creatina quinasa sérica [CK] >10 veces límite superior de la normalidad [ULN]) en pacientes con 80 mg/día fue de aproximadamente 0,9 % en comparación con 0,02 % para pacientes con 20 mg/día. La incidencia de rabdomiólisis (definida como miopatía con una CK >40 veces el ULN) en pacientes que recibieron 80 mg/día fue de aproximadamente 0,4 % en comparación con 0 % para los pacientes que recibieron 20 mg/día. La incidencia de miopatía, incluida la rabdomiólisis, fue máxima durante el primer año y luego disminuyó notablemente durante los años siguientes de tratamiento. En este ensayo, los pacientes fueron monitoreados cuidadosamente y se excluyeron algunos medicamentos que interactuaban.
El riesgo de miopatía, incluida la rabdomiólisis, es mayor en pacientes que reciben 80 mg de simvastatina en comparación con otras terapias con estatinas con una eficacia similar o mayor para reducir el LDL-C y en comparación con dosis más bajas de simvastatina. Por lo tanto, la dosis de 80 mg de ZOCOR debe usarse solo en pacientes que hayan estado tomando 80 mg de simvastatina de forma crónica (p. ej., durante 12 meses o más) sin evidencia de toxicidad muscular. [Ver DOSIFICACIÓN Y ADMINISTRACIÓN , Dosificación restringida para 80 mg ]. Sin embargo, si un paciente que actualmente tolera la dosis de 80 mg de ZOCOR necesita iniciar un fármaco que interactúa que está contraindicado o está asociado con un límite de dosis para la simvastatina, ese paciente debe cambiarse a una estatina alternativa con menos potencial para el interacción fármaco-fármaco. Se debe advertir a los pacientes sobre el aumento del riesgo de miopatía, incluida la rabdomiólisis, y que informen de inmediato cualquier dolor, sensibilidad o debilidad muscular inexplicable. Si aparecen síntomas, el tratamiento debe suspenderse inmediatamente. [ver Miopatía necrotizante inmunomediada ]
Todos los pacientes que comiencen la terapia con ZOCOR 20 mg, o cuya dosis de ZOCOR se aumente, deben ser informados sobre el riesgo de miopatía, incluida la rabdomiólisis, y deben informar de inmediato cualquier dolor, sensibilidad o debilidad muscular inexplicable, especialmente si se acompaña de malestar general o fiebre o si hay signos musculares. y los síntomas persisten después de suspender ZOCOR. La terapia con ZOCOR debe suspenderse inmediatamente si se diagnostica o sospecha miopatía. En la mayoría de los casos, los síntomas musculares y los aumentos de CK se resolvieron cuando el tratamiento se interrumpió de inmediato. Se pueden considerar determinaciones periódicas de CK en pacientes que comienzan la terapia con 5 mg de ZOCOR o cuya dosis se está aumentando, pero no hay seguridad de que tal monitoreo prevenga la miopatía.
Muchos de los pacientes que han desarrollado rabdomiólisis durante el tratamiento con simvastatina han tenido antecedentes médicos complicados, incluida la insuficiencia renal, generalmente como consecuencia de una diabetes mellitus prolongada. Tales pacientes merecen un seguimiento más estrecho. El tratamiento con ZOCOR debe suspenderse si se presentan niveles de CPK marcadamente elevados o si se diagnostica o sospecha miopatía. La terapia con ZOCOR también debe suspenderse temporalmente en cualquier paciente que experimente una afección aguda o grave que predisponga al desarrollo de insuficiencia renal secundaria a rabdomiólisis, por ejemplo, sepsis; hipotensión; cirujía importante; trauma; trastornos metabólicos, endocrinos o electrolíticos graves; o epilepsia no controlada.
Interacciones con la drogas
El riesgo de miopatía y rabdomiólisis aumenta con los niveles plasmáticos elevados de simvastatina y ácido de simvastatina. La simvastatina es metabolizada por la isoforma 3A4 del citocromo P450. Ciertos fármacos que inhiben esta vía metabólica pueden elevar los niveles plasmáticos de simvastatina y pueden aumentar el riesgo de miopatía. Estos incluyen itraconazol, ketoconazol, posaconazol, voriconazol, los antibióticos macrólidos eritromicina y claritromicina, y el antibiótico cetólido telitromicina, inhibidores de la proteasa del VIH, boceprevir, telaprevir, el antidepresivo nefazodona, productos que contienen cobicistat o jugo de toronja [ver FARMACOLOGÍA CLÍNICA ]. La combinación de estos fármacos con simvastatina está contraindicada. Si el tratamiento a corto plazo con inhibidores potentes de CYP3A4 es inevitable, la terapia con simvastatina debe suspenderse durante el curso del tratamiento [ver CONTRAINDICACIONES y INTERACCIONES CON LA DROGAS ].
Está contraindicado el uso combinado de simvastatina con gemfibrozilo, ciclosporina o danazol [ver CONTRAINDICACIONES y INTERACCIONES CON LA DROGAS ].
Se debe tener precaución al prescribir otros fibratos con simvastatina, ya que estos agentes pueden causar miopatía cuando se administran solos y el riesgo aumenta cuando se administran conjuntamente [ver INTERACCIONES CON LA DROGAS ].
Se han informado casos de miopatía, incluida la rabdomiólisis, con simvastatina coadministrada con colchicina, y se debe tener precaución al prescribir simvastatina con colchicina [ver INTERACCIONES CON LA DROGAS ].
Los beneficios del uso combinado de simvastatina con los siguientes fármacos deben sopesarse cuidadosamente frente a los riesgos potenciales de las combinaciones: otros fármacos hipolipemiantes (fibratos o, para pacientes con HFHo, lomitapida), amiodarona, dronedarona, verapamilo, diltiazem, amlodipino, o ranolazina [Ver DOSIFICACIÓN Y ADMINISTRACIÓN , INTERACCIONES CON LA DROGAS ].
Se han observado casos de miopatía, incluyendo rabdomiolisis, con simvastatina coadministrada con dosis modificadoras de lípidos (≥1 g/día de niacina) de productos que contienen niacina [ver INTERACCIONES CON LA DROGAS ].
Se han notificado casos de rabdomiolisis con simvastatina administrada con daptomicina. Suspender temporalmente ZOCOR en pacientes que toman daptomicina [ver INTERACCIONES CON LA DROGAS ].
Las recomendaciones de prescripción para los agentes que interactúan se resumen en la Tabla 1 [ver también DOSIFICACIÓN Y ADMINISTRACIÓN , INTERACCIONES CON LA DROGAS , FARMACOLOGÍA CLÍNICA ].
Miopatía necrotizante inmunomediada
Ha habido informes raros de miopatía necrotizante inmunomediada (IMNM), una miopatía autoinmune, asociada con el uso de estatinas. La IMNM se caracteriza por: debilidad muscular proximal y aumento de la creatina cinasa sérica, que persisten a pesar de la interrupción del tratamiento con estatinas; anticuerpo anti-HMG CoA reductasa positivo; biopsia muscular que muestra miopatía necrosante; y mejoría con agentes inmunosupresores. Pueden ser necesarias pruebas neuromusculares y serológicas adicionales. Puede ser necesario el tratamiento con agentes inmunosupresores. Considere cuidadosamente el riesgo de IMNM antes de iniciar una estatina diferente. Si la terapia se inicia con una estatina diferente, controle los signos y síntomas de IMNM.
disfunción hepática
Se han producido aumentos persistentes (a más de 3 veces el LSN) en las transaminasas séricas en aproximadamente el 1 % de los pacientes que recibieron simvastatina en estudios clínicos. Cuando se interrumpió o interrumpió el tratamiento farmacológico en estos pacientes, los niveles de transaminasas por lo general cayeron lentamente a los niveles previos al tratamiento. Los aumentos no se asociaron con ictericia u otros signos o síntomas clínicos. No hubo evidencia de hipersensibilidad.
En el Scandinavian Simvastatin Survival Study (4S) [ver Estudios clínicos ], el número de pacientes con más de un aumento de transaminasas a >3X LSN, durante el transcurso del estudio, no fue significativamente diferente entre los grupos de simvastatina y placebo (14 [0,7 %] frente a 12 [0,6 %]). Las transaminasas elevadas provocaron la suspensión del tratamiento en 8 pacientes del grupo de simvastatina (n=2221) y en 5 del grupo de placebo (n=2223). De los 1.986 pacientes tratados con simvastatina en 4S con pruebas de función hepática (LFT) normales al inicio del estudio, 8 (0,4 %) desarrollaron elevaciones de LFT consecutivas a >3X ULN y/o se interrumpieron debido a elevaciones de transaminasas durante los 5,4 años (mediana de seguimiento). ) de El estudio. Entre estos 8 pacientes, 5 inicialmente desarrollaron estas anormalidades dentro del primer año. Todos los pacientes de este estudio recibieron una dosis inicial de 20 mg de simvastatina; 37% fueron titulados a 40 mg.
En 2 estudios clínicos controlados en 1.105 pacientes, la incidencia de 12 meses de elevación persistente de las transaminasas hepáticas sin tener en cuenta la relación con el fármaco fue del 0,9 % y del 2,1 % con la dosis de 40 y 80 mg, respectivamente. Ningún paciente desarrolló anomalías persistentes de la función hepática después de los primeros 6 meses de tratamiento con una dosis dada.
Se recomienda realizar pruebas de función hepática antes del inicio del tratamiento y posteriormente cuando esté clínicamente indicado. Ha habido informes posteriores a la comercialización raros de insuficiencia hepática fatal y no fatal en pacientes que toman estatinas, incluida la simvastatina. Si ocurre una lesión hepática grave con síntomas clínicos y/o hiperbilirrubinemia o ictericia durante el tratamiento con 5 mg de ZOCOR, interrumpa de inmediato la terapia. Si no se encuentra una etiología alternativa, no reinicie ZOCOR. Tenga en cuenta que la ALT puede emanar del músculo, por lo que el aumento de la ALT con la CK puede indicar miopatía [ver Miopatía/Rabdomiolisis ].
El medicamento debe usarse con precaución en pacientes que consumen cantidades importantes de alcohol y/o tienen antecedentes de enfermedad hepática. Las enfermedades hepáticas activas o las elevaciones de transaminasas inexplicables son contraindicaciones para el uso de simvastatina.
Se han informado elevaciones moderadas (menos de 3X ULN) de las transaminasas séricas después de la terapia con simvastatina. Estos cambios aparecieron poco después del inicio de la terapia con simvastatina, a menudo fueron transitorios, no estuvieron acompañados de ningún síntoma y no requirieron la interrupción del tratamiento.
Función endocrina
Se han informado aumentos en los niveles de HbA1c y glucosa sérica en ayunas con inhibidores de la HMG-CoA reductasa, incluido ZOCOR.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
En un estudio de carcinogenicidad de 72 semanas, a los ratones se les administraron dosis diarias de simvastatina de 25, 100 y 400 mg/kg de peso corporal, lo que resultó en niveles medios del fármaco en plasma aproximadamente 1, 4 y 8 veces más altos que el nivel medio del fármaco en plasma humano. nivel, respectivamente (como actividad inhibitoria total basada en el AUC) después de una dosis oral de 80 mg. Los carcinomas hepáticos aumentaron significativamente en las mujeres que recibieron dosis altas y en los hombres que recibieron dosis medias y altas, con una incidencia máxima del 90 % en los hombres. La incidencia de adenomas hepáticos aumentó significativamente en las hembras que recibieron dosis medias y altas. El tratamiento farmacológico también aumentó significativamente la incidencia de adenomas pulmonares en hombres y mujeres que recibieron dosis medias y altas. Los adenomas de la glándula de Harder (una glándula del ojo de los roedores) fueron significativamente más altos en los ratones que recibieron dosis altas que en los controles. No se observó evidencia de un efecto tumorigénico a 25 mg/kg/día.
En un estudio separado de carcinogenicidad de 92 semanas en ratones a dosis de hasta 25 mg/kg/día, no se observó evidencia de un efecto tumorigénico (los niveles medios del fármaco en plasma fueron 1 veces más altos que en humanos que recibieron 80 mg de simvastatina según lo medido por el AUC).
En un estudio de dos años en ratas a 25 mg/kg/día, hubo un aumento estadísticamente significativo en la incidencia de adenomas foliculares tiroideos en ratas hembra expuestas a niveles de simvastatina aproximadamente 11 veces más altos que en humanos que recibieron 80 mg de simvastatina (como medido por AUC).
Un segundo estudio de carcinogenicidad en ratas de dos años con dosis de 50 y 100 mg/kg/día produjo adenomas y carcinomas hepatocelulares (en ratas hembra con ambas dosis y en machos con 100 mg/kg/día). Los adenomas de células foliculares tiroideas aumentaron en hombres y mujeres con ambas dosis; los carcinomas de células foliculares de tiroides aumentaron en mujeres con 100 mg/kg/día. La mayor incidencia de neoplasias tiroideas parece ser consistente con los hallazgos de otras estatinas. Estos niveles de tratamiento representaron niveles de fármaco en plasma (AUC) de aproximadamente 7 y 15 veces (hombres) y 22 y 25 veces (mujeres) la exposición media al fármaco en plasma humano después de una dosis diaria de 80 miligramos.
No se observó evidencia de mutagenicidad en una prueba de mutagenicidad microbiana (Ames) con o sin activación metabólica hepática de rata o ratón. Además, no se observó evidencia de daño al material genético en un ensayo de elución alcalina in vitro usando hepatocitos de rata, un estudio de mutación directa de células de mamífero V-79, un estudio de aberración cromosómica in vitro en células CHO o un ensayo de aberración cromosómica in vivo en médula ósea de ratón.
Hubo una disminución de la fertilidad en ratas macho tratadas con simvastatina durante 34 semanas a 25 mg/kg de peso corporal (4 veces el nivel máximo de exposición en humanos, basado en el AUC, en pacientes que recibieron 80 mg/día); sin embargo, este efecto no se observó durante un estudio de fertilidad posterior en el que se administró simvastatina a este mismo nivel de dosis a ratas macho durante 11 semanas (el ciclo completo de espermatogénesis, incluida la maduración del epidídimo). No se observaron cambios microscópicos en los testículos de las ratas de ninguno de los estudios. A 180 mg/kg/día (que produce niveles de exposición 22 veces más altos que los de los seres humanos que toman 80 mg/día según el área de superficie, mg/m2), se observó degeneración de los túbulos seminíferos (necrosis y pérdida del epitelio espermatogénico). En perros, hubo atrofia testicular relacionada con el fármaco, disminución de la espermatogénesis, degeneración espermatocítica y formación de células gigantes con 10 mg/kg/día (aproximadamente 2 veces la exposición humana, según el AUC, con 80 mg/día). La importancia clínica de estos hallazgos no está clara.
Uso en poblaciones específicas
El embarazo
Embarazo Categoría X [Ver CONTRAINDICACIONES ]
ZOCOR está contraindicado en mujeres que están o pueden quedar embarazadas. Los medicamentos hipolipemiantes no ofrecen ningún beneficio durante el embarazo, porque el colesterol y los derivados del colesterol son necesarios para el desarrollo fetal normal. La aterosclerosis es un proceso crónico y la interrupción de los fármacos hipolipemiantes durante el embarazo debería tener poco impacto en los resultados a largo plazo del tratamiento de la hipercolesterolemia primaria. No existen estudios adecuados y bien controlados sobre el uso de ZOCOR durante el embarazo; sin embargo, hay informes raros de anomalías congénitas en bebés expuestos a estatinas en el útero. Los estudios de reproducción animal de simvastatina en ratas y conejos no mostraron evidencia de teratogenicidad. El colesterol y los triglicéridos séricos aumentan durante el embarazo normal, y el colesterol o sus derivados son esenciales para el desarrollo fetal. Debido a que las estatinas disminuyen la síntesis de colesterol y posiblemente la síntesis de otras sustancias biológicamente activas derivadas del colesterol, ZOCOR puede causar daño fetal cuando se administra a una mujer embarazada. Si se usa 5 mg de ZOCOR durante el embarazo o si la paciente queda embarazada mientras toma este medicamento, se debe informar a la paciente sobre el peligro potencial para el feto.
Hay informes raros de anomalías congénitas después de la exposición intrauterina a las estatinas. En una revisión2 de aproximadamente 100 embarazos seguidos prospectivamente en mujeres expuestas a simvastatina u otra estatina estructuralmente relacionada, las incidencias de anomalías congénitas, abortos espontáneos y muertes fetales/mortinatos no excedieron las esperadas en la población general. Sin embargo, el estudio solo pudo excluir un riesgo de anomalías congénitas de 3 a 4 veces mayor que la tasa de fondo. En el 89% de estos casos, el tratamiento farmacológico se inició antes del embarazo y se suspendió durante el primer trimestre cuando se identificó el embarazo.
La simvastatina no fue teratogénica en ratas o conejos en dosis (25, 10 mg/kg/día, respectivamente) que resultaron en 3 veces la exposición humana en base a mg/m2 de área de superficie. Sin embargo, en estudios con otra estatina relacionada estructuralmente, se observaron malformaciones esqueléticas en ratas y ratones.
Manson, JM, Freyssinges, C., Ducrocq, MB, Stephenson, WP, Vigilancia posterior a la comercialización de la exposición a lovastatina y simvastatina durante el embarazo, toxicología reproductiva, 10(6):439-446, 1996.
Se debe recomendar a las mujeres en edad fértil que requieran tratamiento con 5 mg de ZOCOR por un trastorno de los lípidos que utilicen un método anticonceptivo eficaz. Para las mujeres que intentan concebir, se debe considerar la interrupción de ZOCOR. Si ocurre un embarazo, ZOCOR debe suspenderse inmediatamente.
Madres lactantes
No se sabe si la simvastatina se excreta en la leche humana. Debido a que una pequeña cantidad de otro fármaco de esta clase se excreta en la leche humana y debido al potencial de reacciones adversas graves en los lactantes, las mujeres que toman simvastatina no deben amamantar a sus bebés. Se debe tomar la decisión de suspender la lactancia o suspender el fármaco, teniendo en cuenta la importancia del fármaco para la madre [ver CONTRAINDICACIONES ].
Uso pediátrico
La seguridad y la eficacia de la simvastatina en pacientes de 10 a 17 años de edad con hipercolesterolemia familiar heterocigota se evaluaron en un ensayo clínico controlado en niños y niñas adolescentes que tenían al menos 1 año después de la menarquia. Los pacientes tratados con simvastatina tuvieron un perfil de reacciones adversas similar al de los pacientes tratados con placebo. No se han estudiado dosis superiores a 40 mg en esta población. En este estudio controlado limitado, no hubo un efecto significativo sobre el crecimiento o la maduración sexual en los niños o niñas adolescentes, o sobre la duración del ciclo menstrual en las niñas. [Ver DOSIFICACIÓN Y ADMINISTRACIÓN , REACCIONES ADVERSAS , Estudios clínicos ] Se debe asesorar a las mujeres adolescentes sobre los métodos anticonceptivos apropiados durante el tratamiento con simvastatina [ver CONTRAINDICACIONES y El embarazo ]. La simvastatina no se ha estudiado en pacientes menores de 10 años ni en niñas premenárquicas.
Uso geriátrico
De los 2423 pacientes que recibieron 5 mg de ZOCOR en los estudios clínicos de fase III y los 10 269 pacientes del Estudio de protección cardíaca que recibieron 40 mg de ZOCOR, 363 (15 %) y 5366 (52 %), respectivamente, tenían ≥ 65 años. En HPS, 615 (6%) tenían ≥75 años. No se observaron diferencias generales en la seguridad o la eficacia entre estos sujetos y los sujetos más jóvenes, y otra experiencia clínica notificada no ha identificado diferencias en las respuestas entre los ancianos y los pacientes más jóvenes, pero no se puede descartar una mayor sensibilidad de algunos individuos mayores. Dado que la edad avanzada (≥65 años) es un factor predisponente para la miopatía, ZOCOR debe prescribirse con precaución en ancianos. [Ver FARMACOLOGÍA CLÍNICA ]
Un estudio farmacocinético con simvastatina mostró que el nivel plasmático medio de la actividad de las estatinas era aproximadamente un 45 % mayor en pacientes de edad avanzada entre 70 y 78 años en comparación con pacientes entre 18 y 30 años. En 4S, 1021 (23 %) de 4444 pacientes tenían 65 años o más. La eficacia hipolipemiante fue al menos tan grande en pacientes de edad avanzada como en pacientes más jóvenes, y ZOCOR redujo significativamente la mortalidad total y la mortalidad por cardiopatía coronaria en pacientes de edad avanzada con antecedentes de cardiopatía coronaria. En HPS, el 52% de los pacientes eran ancianos (4.891 pacientes de 65 a 69 años y 5.806 pacientes de 70 años o más). Las reducciones del riesgo relativo de muerte por cardiopatía coronaria, infarto de miocardio no mortal, procedimientos de revascularización coronaria y no coronaria y accidente cerebrovascular fueron similares en pacientes mayores y jóvenes [ver Estudios clínicos ]. En HPS, entre 32.145 pacientes que entraron en el período de preinclusión activo, hubo 2 casos de miopatía/rabdomiolisis; estos pacientes tenían 67 y 73 años. De los 7 casos de miopatía/rabdomiólisis entre 10 269 pacientes asignados a simvastatina, 4 tenían 65 años o más (al inicio del estudio), de los cuales uno tenía más de 75 años. No hubo diferencias generales en la seguridad entre pacientes de mayor edad. y pacientes más jóvenes en 4S o HPS.
Debido a que la edad avanzada (≥65 años) es un factor predisponente para la miopatía, incluida la rabdomiólisis, ZOCOR 40 mg debe prescribirse con precaución en ancianos. En un ensayo clínico de pacientes tratados con 80 mg/día de simvastatina, los pacientes ≥65 años tenían un mayor riesgo de miopatía, incluida rabdomiólisis, en comparación con los pacientes ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ]
Insuficiencia renal
Se debe tener precaución cuando se administra ZOCOR 20 mg a pacientes con insuficiencia renal grave. [Ver DOSIFICACIÓN Y ADMINISTRACIÓN ]
Deterioro hepático
ZOCOR 10 mg está contraindicado en pacientes con enfermedad hepática activa que puede incluir elevaciones persistentes inexplicables en los niveles de transaminasas hepáticas [ver CONTRAINDICACIONES y ADVERTENCIAS Y PRECAUCIONES ].
Pacientes chinos
En un ensayo clínico en el que se trató a pacientes con alto riesgo de enfermedad cardiovascular con 40 mg/día de simvastatina (mediana de seguimiento de 3,9 años), la incidencia de miopatía fue de aproximadamente 0,05 % para pacientes no chinos (n=7367) en comparación con 0,24% para pacientes chinos (n=5468). La incidencia de miopatía en pacientes chinos tratados con 40 mg/día de simvastatina o 10/40 mg/día de ezetimiba/simvastatina coadministrados con 2 g/día de niacina de liberación prolongada fue del 1,24 %.
Los pacientes chinos pueden tener un mayor riesgo de miopatía, controle a los pacientes adecuadamente. No se recomienda la coadministración de 10 mg de ZOCOR con dosis modificadoras de lípidos (≥1 g/día de niacina) de productos que contienen niacina en pacientes chinos [ver ADVERTENCIAS Y PRECAUCIONES , INTERACCIONES CON LA DROGAS ].
SOBREDOSIS
Se observó una letalidad significativa en ratones después de una dosis oral única de 9 g/m2. No se observó evidencia de letalidad en ratas o perros tratados con dosis de 30 y 100 g/m2, respectivamente. No se observaron signos de diagnóstico específicos en roedores. A estas dosis, los únicos signos observados en perros fueron emesis y heces mucoides.
Se han informado algunos casos de sobredosis con ZOCOR; la dosis máxima tomada fue de 3,6 g. Todos los pacientes se recuperaron sin secuelas. Se deben tomar medidas de apoyo en caso de sobredosis. Actualmente se desconoce la dializabilidad de la simvastatina y sus metabolitos en el hombre.
CONTRAINDICACIONES
ZOCOR 40 mg está contraindicado en las siguientes condiciones:
- La administración concomitante de inhibidores potentes de CYP3A4 (p. ej., itraconazol, ketoconazol, posaconazol, voriconazol, inhibidores de la proteasa del VIH, boceprevir, telaprevir, eritromicina, claritromicina, telitromicina, nefazodona y productos que contienen cobicistat) [ver ADVERTENCIAS Y PRECAUCIONES ].
- La administración concomitante de gemfibrozilo, ciclosporina o danazol [ver ADVERTENCIAS Y PRECAUCIONES ].
- Hipersensibilidad a cualquier componente de este medicamento [ver REACCIONES ADVERSAS ].
- Enfermedad hepática activa, que puede incluir elevaciones persistentes e inexplicables en los niveles de transaminasas hepáticas [ver ADVERTENCIAS Y PRECAUCIONES ].
- Mujeres embarazadas o que puedan quedar embarazadas. El colesterol y los triglicéridos séricos aumentan durante el embarazo normal, y el colesterol o sus derivados son esenciales para el desarrollo fetal. Debido a que los inhibidores de la HMG-CoA reductasa (estatinas) disminuyen la síntesis de colesterol y posiblemente la síntesis de otras sustancias biológicamente activas derivadas del colesterol, ZOCOR 40 mg puede causar daño fetal cuando se administra a una mujer embarazada. La aterosclerosis es un proceso crónico y la interrupción de los fármacos hipolipemiantes durante el embarazo debería tener poco impacto en el resultado del tratamiento a largo plazo de la hipercolesterolemia primaria. No existen estudios adecuados y bien controlados sobre el uso de ZOCOR durante el embarazo; sin embargo, en informes raros se observaron anomalías congénitas después de la exposición intrauterina a las estatinas. En estudios de reproducción animal en ratas y conejos, la simvastatina no reveló evidencia de teratogenicidad. ZOCOR debe administrarse a mujeres en edad fértil solo cuando es muy poco probable que dichas pacientes conciban. Si la paciente queda embarazada mientras toma este fármaco, se debe interrumpir el tratamiento con ZOCOR de inmediato y se debe informar a la paciente sobre el peligro potencial para el feto [ver Uso en poblaciones específicas ].
- Madres lactantes. No se sabe si la simvastatina se excreta en la leche humana; sin embargo, una pequeña cantidad de otro fármaco de esta clase pasa a la leche materna. Debido a que las estatinas tienen el potencial de causar reacciones adversas graves en los lactantes, las mujeres que requieren tratamiento con ZOCOR no deben amamantar a sus bebés [ver Uso en poblaciones específicas ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
La simvastatina es un profármaco y se hidroliza a su forma activa de hidroxiácido β, ácido de simvastatina, después de su administración. La simvastatina es un inhibidor específico de la 3-hidroxi-3-metilglutaril-coenzima A (HMG-CoA) reductasa, la enzima que cataliza la conversión de HMG-CoA en mevalonato, un paso temprano y limitante de la velocidad en la vía biosintética del colesterol. Además, la simvastatina reduce las VLDL y los TG y aumenta el HDL-C.
Farmacodinámica
Los estudios epidemiológicos han demostrado que los niveles elevados de C-total, LDL-C, así como los niveles reducidos de HDL-C están asociados con el desarrollo de aterosclerosis y un mayor riesgo cardiovascular. Reducir el LDL-C disminuye este riesgo. Sin embargo, no se ha determinado el efecto independiente de elevar el HDL-C o disminuir los TG sobre el riesgo de morbilidad y mortalidad coronaria y cardiovascular.
Farmacocinética
La simvastatina es una lactona que se hidroliza fácilmente in vivo al correspondiente β-hidroxiácido, un potente inhibidor de la HMG-CoA reductasa. La inhibición de la HMG-CoA reductasa es la base para un ensayo en estudios farmacocinéticos de los metabolitos β-hidroxiácidos (inhibidores activos) y, luego de la hidrólisis de la base, los inhibidores activos más latentes (inhibidores totales) en plasma luego de la administración de simvastatina.
Después de una dosis oral de simvastatina marcada con 14C en humanos, el 13 % de la dosis se excretó en la orina y el 60 % en las heces. Las concentraciones plasmáticas de radiactividad total (simvastatina más metabolitos de 14C) alcanzaron su punto máximo a las 4 horas y disminuyeron rápidamente hasta aproximadamente el 10 % del pico a las 12 horas después de la dosis. Dado que la simvastatina se somete a una extensa extracción de primer paso en el hígado, la disponibilidad del fármaco para la circulación general es baja (
Tanto la simvastatina como su metabolito β-hidroxiácido se unen en gran medida (aproximadamente en un 95 %) a las proteínas plasmáticas humanas. Los estudios en ratas indican que cuando se administró simvastatina radiomarcada, la radiactividad derivada de simvastatina cruzó la barrera hematoencefálica.
Los principales metabolitos activos de la simvastatina presentes en el plasma humano son el β-hidroxiácido de la simvastatina y sus derivados 6′-hidroxi, 6′-hidroximetilo y 6′-exometileno. Las concentraciones plasmáticas máximas de los inhibidores activos y totales se alcanzaron entre 1,3 y 2,4 horas después de la dosis. Si bien el rango de dosis terapéutica recomendada es de 5 a 40 mg/día, no hubo una desviación sustancial de la linealidad del AUC de los inhibidores en la circulación general con un aumento de la dosis de hasta 120 mg. En relación con el estado de ayuno, el perfil plasmático de los inhibidores no se vio afectado cuando la simvastatina se administró inmediatamente antes de una comida baja en grasas recomendada por la American Heart Association.
En un estudio que incluyó a 16 pacientes de edad avanzada entre 70 y 78 años que recibieron 40 mg/día de ZOCOR, el nivel plasmático medio de la actividad inhibidora de la HMG-CoA reductasa aumentó aproximadamente un 45 % en comparación con 18 pacientes entre 18 y 30 años de edad. La experiencia de estudios clínicos en ancianos (n=1522) sugiere que no hubo diferencias generales en la seguridad entre los pacientes ancianos y los más jóvenes [ver Uso en poblaciones específicas ].
Los estudios cinéticos con otra estatina, que tiene una ruta principal de eliminación similar, han sugerido que para un nivel de dosis determinado se puede lograr una exposición sistémica más alta en pacientes con insuficiencia renal grave (medida por el aclaramiento de creatinina).
El ácido de simvastatina es un sustrato de la proteína de transporte OATP1B1. La administración concomitante de medicamentos que son inhibidores de la proteína transportadora OATP1B1 puede provocar un aumento de las concentraciones plasmáticas de ácido de simvastatina y un mayor riesgo de miopatía. Por ejemplo, se ha demostrado que la ciclosporina aumenta el AUC de las estatinas; aunque el mecanismo no se comprende completamente, el aumento en el AUC del ácido de simvastatina se debe presumiblemente, en parte, a la inhibición de CYP3A4 y/o OATP1B1.
El riesgo de miopatía aumenta con niveles elevados de actividad inhibidora de la HMG-CoA reductasa en plasma. Los inhibidores de CYP3A4 pueden elevar los niveles plasmáticos de la actividad inhibidora de la HMG-CoA reductasa y aumentar el riesgo de miopatía [ver ADVERTENCIAS Y PRECAUCIONES y INTERACCIONES CON LA DROGAS ].
En un estudio de 12 voluntarios sanos, la simvastatina en dosis de 80 mg no tuvo ningún efecto sobre el metabolismo de los sustratos midazolam y eritromicina de la isoforma 3A4 (CYP3A4) del citocromo P450 sonda. Esto indica que la simvastatina no es un inhibidor de CYP3A4 y, por lo tanto, no se espera que afecte los niveles plasmáticos de otros fármacos metabolizados por CYP3A4.
La coadministración de simvastatina (40 mg una vez al día durante 10 días) resultó en un aumento de los niveles medios máximos de digoxina cardioactiva (administrada como una dosis única de 0,4 mg el día 10) en aproximadamente 0,3 ng/mL.
Toxicología Animal Y/o Farmacología
Toxicidad del SNC
Se observó degeneración del nervio óptico en perros clínicamente normales tratados con simvastatina durante 14 semanas a 180 mg/kg/día, una dosis que produjo niveles medios del fármaco en plasma unas 12 veces más altos que el nivel medio del fármaco en plasma en humanos que tomaban 80 mg/día.
Un fármaco químicamente similar de esta clase también produjo degeneración del nervio óptico (degeneración walleriana de las fibras retinogeniculadas) en perros clínicamente normales de forma dependiente de la dosis a partir de 60 mg/kg/día, una dosis que produjo niveles plasmáticos medios del fármaco unas 30 veces mayores que el nivel medio de fármaco en plasma en humanos que toman la dosis más alta recomendada (medida por la actividad inhibidora de la enzima total). Este mismo fármaco también produjo degeneración vestibulococlear de tipo walleriano y cromatólisis de células ganglionares de la retina en perros tratados durante 14 semanas con 180 mg/kg/día, una dosis que resultó en un nivel medio del fármaco en plasma similar al observado con la dosis de 60 mg/kg/día. dosis del día.
Se observaron lesiones vasculares del SNC, caracterizadas por hemorragia perivascular y edema, infiltración de células mononucleares de los espacios perivasculares, depósitos de fibrina perivascular y necrosis de pequeños vasos en perros tratados con simvastatina a una dosis de 360 mg/kg/día, dosis que produjo una concentración plasmática media de 360 mg/kg/día. niveles de fármaco que eran aproximadamente 14 veces más altos que los niveles medios de fármaco en plasma en humanos que tomaban 80 mg/día. Se han observado lesiones vasculares del SNC similares con varios otros fármacos de esta clase.
Hubo cataratas en ratas hembra después de dos años de tratamiento con 50 y 100 mg/kg/día (22 y 25 veces el AUC humana a 80 mg/día, respectivamente) y en perros después de tres meses con 90 mg/kg/día ( 19 veces) ya los dos años a 50 mg/kg/día (5 veces).
Estudios clínicos
Estudios clínicos en adultos
Reducciones en el riesgo de mortalidad por cardiopatía coronaria y eventos cardiovasculares
En 4S, se evaluó el efecto de la terapia con 20 mg de ZOCOR sobre la mortalidad total en 4444 pacientes con cardiopatía coronaria y colesterol total inicial de 212 a 309 mg/dl (5,5 a 8,0 mmol/l). En este estudio multicéntrico, aleatorizado, doble ciego, controlado con placebo, los pacientes recibieron tratamiento estándar, incluida la dieta, y 20-40 mg/día de ZOCOR (n=2221) o placebo (n=2223) durante una mediana de duración. de 5,4 años. Durante el transcurso del estudio, el tratamiento con ZOCOR condujo a reducciones medias del C-total, LDL-C y TG del 25 %, 35 % y 10 %, respectivamente, y un aumento medio del C-HDL del 8 %. ZOCOR redujo significativamente el riesgo de mortalidad en un 30 % (p = 0,0003, 182 muertes en el grupo de 40 mg de ZOCOR frente a 256 muertes en el grupo de placebo). El riesgo de mortalidad por cardiopatía coronaria se redujo significativamente en un 42 % (p = 0,00001, 111 frente a 189 muertes). No hubo diferencia estadísticamente significativa entre los grupos en la mortalidad no cardiovascular. ZOCOR redujo significativamente el riesgo de sufrir eventos coronarios importantes (mortalidad por cardiopatía coronaria más infarto de miocardio [IM] no fatal verificado en el hospital y silencioso) en un 34 % (p
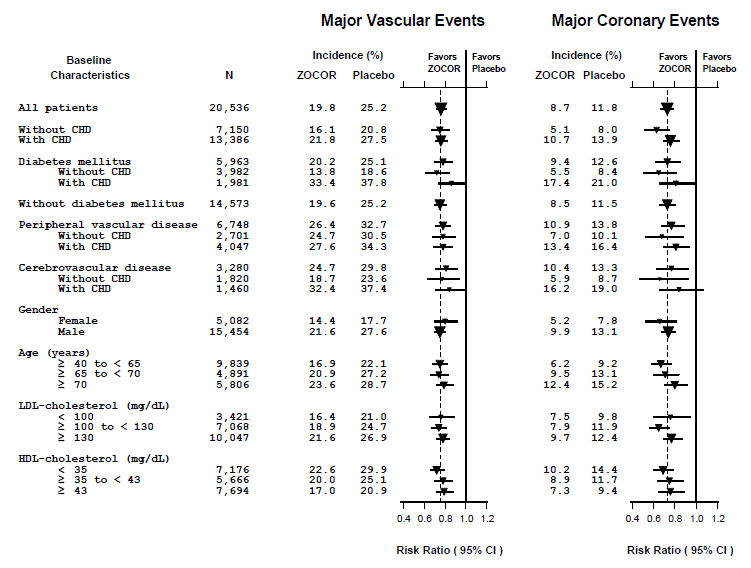
El estudio de protección del corazón (HPS) fue un gran estudio doble ciego, multicéntrico, controlado con placebo, con una duración media de 5 años, realizado en 20 536 pacientes (10 269 con ZOCOR 40 mg y 10 267 con placebo). Los pacientes fueron asignados al tratamiento utilizando un método adaptativo de covariables3 que tuvo en cuenta la distribución de 10 características basales importantes de los pacientes ya inscritos y minimizó el desequilibrio de esas características entre los grupos. Los pacientes tenían una edad media de 64 años (rango 40-80 años), eran 97 % caucásicos y tenían un alto riesgo de desarrollar un evento coronario importante debido a la cardiopatía coronaria existente (65 %), diabetes (tipo 2, 26 %; tipo 1 , 3 %), antecedentes de accidente cerebrovascular u otra enfermedad cerebrovascular (16 %), enfermedad vascular periférica (33 %) o hipertensión en varones ≥65 años (6 %). Al inicio del estudio, 3421 pacientes (17 %) tenían niveles de LDL-C por debajo de 100 mg/dL, de los cuales 953 (5 %) tenían niveles de LDL-C por debajo de 80 mg/dL; 7.068 pacientes (34%) tenían niveles entre 100 y 130 mg/dL; y 10.047 pacientes (49%) tenían niveles superiores a 130 mg/dL.
DR Taves, Minimización: un nuevo método de asignación de pacientes a grupos de tratamiento y control. clin. Farmacol. El r. 15 (1974), págs. 443-453
Los resultados de HPS mostraron que ZOCOR 40 mg/día redujo significativamente: la mortalidad total y por enfermedad coronaria; IM no mortal, accidente cerebrovascular y procedimientos de revascularización (coronario y no coronario) (ver Tabla 4).
Se definieron dos criterios de valoración compuestos para tener suficientes eventos para evaluar las reducciones del riesgo relativo en una variedad de características iniciales (consulte la Figura 1). Un compuesto de eventos coronarios mayores (MCE, por sus siglas en inglés) estuvo compuesto por mortalidad por cardiopatía coronaria e infarto de miocardio no fatal (analizado por tiempo hasta el primer evento; 898 pacientes tratados con 5 mg de ZOCOR tuvieron eventos y 1,212 pacientes con placebo tuvieron eventos). Un compuesto de eventos vasculares mayores (MVE) estuvo compuesto por MCE, accidente cerebrovascular y procedimientos de revascularización, incluidos procedimientos coronarios, periféricos y otros procedimientos no coronarios (analizados por tiempo hasta el primer evento; 2033 pacientes tratados con ZOCOR 10 mg tuvieron eventos y 2585 pacientes en el placebo tuvo eventos). Se observaron reducciones significativas del riesgo relativo para ambos criterios de valoración compuestos (27 % para MCE y 24 % para MVE, p
Figura 1 Efectos del tratamiento con 5 mg de ZOCOR en eventos vasculares mayores y eventos coronarios mayores en HPS
Estudios angiográficos
En el Multicenter Anti-Atheroma Study, el efecto de la simvastatina sobre la aterosclerosis se evaluó mediante angiografía coronaria cuantitativa en pacientes hipercolesterolémicos con cardiopatía coronaria. En este estudio aleatorizado, doble ciego y controlado, los pacientes fueron tratados con 20 mg/día de simvastatina o placebo. Los angiogramas se evaluaron al inicio del estudio, dos y cuatro años. Los criterios de valoración coprimarios del estudio fueron el cambio medio por paciente en los diámetros de luz mínimo y medio, lo que indica enfermedad focal y difusa, respectivamente. ZOCOR redujo significativamente la progresión de las lesiones según lo medido en el angiograma del año 4 por ambos parámetros, así como por el cambio en el porcentaje de estenosis de diámetro. Además, la simvastatina disminuyó significativamente la proporción de pacientes con nuevas lesiones y con nuevas oclusiones totales.
Modificaciones de los perfiles de lípidos
Hiperlipidemia primaria (Fredrickson tipo lla y llb)
Se ha demostrado que ZOCOR es eficaz para reducir el C-total y el LDL-C en las formas de hiperlipidemia familiar y no familiar heterocigota y en la hiperlipidemia mixta. La respuesta máxima a casi máxima generalmente se logra dentro de 4 a 6 semanas y se mantiene durante la terapia crónica. ZOCOR redujo significativamente el C-total, el C-LDL, la relación C-total/C-HDL y la relación C-LDL/C-HDL; ZOCOR también disminuyó los TG y aumentó el HDL-C (consulte la Tabla 5).
Hipertrigliceridemia (Fredrickson Tipo IV)
Los resultados de un análisis de subgrupos en 74 pacientes con hiperlipidemia tipo IV de un estudio cruzado de 3 períodos, doble ciego, controlado con placebo de 130 pacientes se presentan en la Tabla 6.
Disbetalipoproteinemia (Fredrickson Tipo III)
Los resultados de un análisis de subgrupos en 7 pacientes con hiperlipidemia tipo lll (disbetalipoproteinemia) (apo E2/2) (VLDL-C/TG>0.25) de un estudio cruzado de 3 períodos, doble ciego, controlado con placebo de 130 pacientes se presentan en la Tabla 7.
Hipercolesterolemia familiar homocigota
En un estudio clínico controlado, 12 pacientes de 15 a 39 años de edad con hipercolesterolemia familiar homocigota recibieron 40 mg/día de simvastatina en una dosis única o en 3 dosis divididas, o 80 mg/día en 3 dosis divididas. En 11 pacientes con reducciones en LDL-C, los cambios medios de LDL-C para las dosis de 40 y 80 mg fueron del 14 % (rango 8 % a 23 %, mediana 12 %) y 30 % (rango 14 % a 46 % , mediana 29%), respectivamente. Un paciente tuvo un aumento del 15% en LDL-C. Otro paciente con ausencia de función del receptor de LDL-C tuvo una reducción de LDL-C del 41 % con la dosis de 80 mg.
Función endocrina
En estudios clínicos, la simvastatina no deterioró la reserva suprarrenal ni redujo significativamente la concentración plasmática basal de cortisol. En los estudios clínicos con simvastatina se observaron pequeñas reducciones con respecto al valor inicial en la testosterona plasmática basal en hombres, un efecto que también se observó con otras estatinas y el secuestrante de ácidos biliares colestiramina. No hubo efecto sobre los niveles de gonadotropina en plasma. En un estudio de 12 semanas, controlado con placebo, no hubo un efecto significativo de 80 mg de simvastatina en la respuesta de la testosterona plasmática a la gonadotropina coriónica humana. En otro estudio de 24 semanas, la simvastatina de 20 a 40 mg no tuvo ningún efecto detectable sobre la espermatogénesis. En 4S, en el que 4.444 pacientes fueron aleatorizados para recibir 20-40 mg/día de simvastatina o placebo durante una mediana de 5,4 años, la incidencia de eventos adversos sexuales masculinos en los dos grupos de tratamiento no fue significativamente diferente. Debido a estos factores, es poco probable que los pequeños cambios en la testosterona plasmática sean clínicamente significativos. Se desconocen los efectos, si los hubiere, sobre el eje pituitario-gonadal en mujeres premenopáusicas.
Estudios clínicos en adolescentes
En un estudio doble ciego controlado con placebo, 175 pacientes (99 varones adolescentes y 76 niñas posmenárquicas) de 10 a 17 años de edad (edad media 14,1 años) con hipercolesterolemia familiar heterocigota (HeFH) fueron aleatorizados para recibir simvastatina (n= 106) o placebo (n=67) durante 24 semanas (estudio base). La inclusión en el estudio requería un nivel inicial de LDL-C entre 160 y 400 mg/dL y al menos uno de los padres con un nivel de LDL-C >189 mg/dL. La dosis de simvastatina (una vez al día por la noche) fue de 10 mg durante las primeras 8 semanas, 20 mg durante las segundas 8 semanas y 40 mg a partir de entonces. En una extensión de 24 semanas, 144 pacientes optaron por continuar la terapia con 40 mg de simvastatina o placebo.
ZOCOR 20 mg disminuyó significativamente los niveles plasmáticos de C-total, C-LDL y Apo B (consulte la Tabla 8). Los resultados de la extensión a las 48 semanas fueron comparables a los observados en el estudio base.
Después de 24 semanas de tratamiento, el valor medio de LDL-C alcanzado fue de 124,9 mg/dL (rango: 64,0289,0 mg/dL) en el grupo de 40 mg de ZOCOR en comparación con 207,8 mg/dL (rango: 128,0-334,0 mg/dL) en el grupo placebo.
No se ha estudiado la seguridad y eficacia de dosis superiores a 40 mg diarios en niños con HFHe. No se ha establecido la eficacia a largo plazo del tratamiento con simvastatina en la infancia para reducir la morbilidad y la mortalidad en la edad adulta.
INFORMACIÓN DEL PACIENTE
Se debe aconsejar a los pacientes que sigan la dieta recomendada por el Programa Nacional de Educación sobre el Colesterol (NCEP), un programa de ejercicio regular y pruebas periódicas de un panel de lípidos en ayunas.
Se debe advertir a los pacientes sobre las sustancias que no deben tomar concomitantemente con simvastatina. [ver CONTRAINDICACIONES y ADVERTENCIAS Y PRECAUCIONES ]. También se debe recomendar a los pacientes que informen a otros profesionales de la salud que prescriben un nuevo medicamento o aumentan la dosis de un medicamento existente que están tomando ZOCOR.
Dolor muscular
Se debe advertir a todos los pacientes que comienzan la terapia con ZOCOR sobre el riesgo de miopatía, incluida la rabdomiólisis, y se les debe indicar que informen de inmediato cualquier dolor, sensibilidad o debilidad muscular inexplicable, especialmente si se acompaña de malestar general o fiebre o si estos signos o síntomas musculares persisten después de suspender ZOCOR. Se debe informar a los pacientes que usan la dosis de 80 mg que el riesgo de miopatía, incluida la rabdomiolisis, aumenta con el uso de la dosis de 80 mg. El riesgo de miopatía, incluida la rabdomiolisis, que ocurre con el uso de 40 mg de ZOCOR aumenta cuando se toman ciertos tipos de medicamentos o se consume jugo de toronja. Los pacientes deben hablar sobre todos los medicamentos, tanto recetados como de venta libre, con su profesional de la salud.
Enzimas del hígado
Se recomienda realizar pruebas de función hepática antes de iniciar el tratamiento con 20 mg de ZOCOR y, posteriormente, cuando esté clínicamente indicado. Se debe recomendar a todos los pacientes tratados con ZOCOR que notifiquen de inmediato cualquier síntoma que pueda indicar una lesión hepática, como fatiga, anorexia, molestias en la parte superior derecha del abdomen, orina oscura o ictericia.
El embarazo
Se debe recomendar a las mujeres en edad fértil que utilicen un método anticonceptivo eficaz para evitar el embarazo mientras usan ZOCOR. Analice los planes de embarazo futuro con sus pacientes y discuta cuándo dejar de tomar ZOCOR 40 mg si están tratando de concebir. Se debe advertir a las pacientes que si quedan embarazadas deben dejar de tomar ZOCOR y llamar a su profesional de la salud.
Amamantamiento
Las mujeres que están amamantando no deben usar ZOCOR. Se debe recomendar a las pacientes que tienen un trastorno de lípidos y están amamantando que analicen las opciones con su profesional de la salud.
