Tricor 160mg, 200mg Fenofibrate Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Tricor y cómo se usa?
Tricor es un medicamento recetado que se usa para tratar reducir los síntomas del colesterol y los triglicéridos (ácidos grasos) en la sangre. Tricor se puede usar solo o con otros medicamentos.
- Tricor pertenece a una clase de medicamentos llamados agentes de ácido fíbrico.
- No se sabe si Tricor 200 mg es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Tricor?
Tricor 200 mg puede causar efectos secundarios graves, que incluyen:
- dolor de estómago agudo que se extiende a la espalda o al omóplato,
- pérdida de apetito,
- dolor de estómago después de una comida,
- coloración amarillenta de la piel o los ojos (ictericia),
- fiebre,
- escalofríos,
- debilidad,
- dolor de garganta,
- úlceras de boca,
- hematomas o sangrado inusuales,
- Dolor de pecho,
- tos repentina,
- sibilancias,
- respiración rápida,
- tos con sangre y
- hinchazón, calor o enrojecimiento en un brazo o una pierna
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Tricor incluyen:
- nariz que moquea,
- estornudos, y
- pruebas de laboratorio anormales
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Tricor. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
TRICOR (tabletas de fenofibrato), es un agente regulador de lípidos disponible en tabletas para administración oral. Cada comprimido contiene 54 mg o 160 mg de fenofibrato. El nombre químico del fenofibrato es éster 1-metiletílico del ácido 2-[4-(4-clorobenzoil) fenoxi]-2-metil-propanoico con la siguiente fórmula estructural:
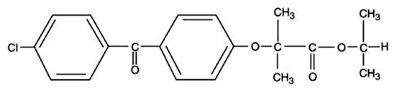
La fórmula empírica es C20H21O4Cl y el peso molecular es 360,83; fenofibrato es insoluble en agua. El punto de fusión es 79-82°C. El fenofibrato es un sólido blanco estable en condiciones ordinarias.
ingredientes inactivos
Cada comprimido contiene dióxido de silicio coloidal, crospovidona, lactosa monohidrato, lecitina, celulosa microcristalina, alcohol polivinílico, povidona, laurilsulfato de sodio, estearilfumarato de sodio, talco, dióxido de titanio y goma xantana. Además, las tabletas individuales de 54 mg contienen D&C Yellow No. 10, FD&C Yellow No. 6, FD&C Blue No. 2.
INDICACIONES
Hipercolesterolemia Primaria O Dislipidemia Mixta
TRICOR está indicado como terapia adjunta a la dieta para reducir los niveles elevados de colesterol de lipoproteínas de baja densidad (LDL-C), colesterol total (Total-C), triglicéridos y apolipoproteína B (Apo B), y para aumentar el colesterol de lipoproteínas de alta densidad (HDL-C). C) en pacientes adultos con hipercolesterolemia primaria o dislipemia mixta.
Hipertrigliceridemia severa
TRICOR 200 mg también está indicado como terapia adjunta a la dieta para el tratamiento de pacientes adultos con hipertrigliceridemia severa. Mejorar el control glucémico en pacientes diabéticos que muestran quilomicronemia en ayunas generalmente obviará la necesidad de una intervención farmacológica.
Los niveles marcadamente elevados de triglicéridos séricos (p. ej., > 2000 mg/dL) pueden aumentar el riesgo de desarrollar pancreatitis. El efecto de la terapia con fenofibrato en la reducción de este riesgo no ha sido adecuadamente estudiado.
Importantes limitaciones de uso
No se demostró que el fenofibrato en una dosis equivalente a 145 mg de TRICOR reduzca la morbilidad y la mortalidad por enfermedad coronaria en un ensayo grande, aleatorizado y controlado de pacientes con diabetes mellitus tipo 2 [ver ADVERTENCIAS Y PRECAUCIONES ].
DOSIFICACIÓN Y ADMINISTRACIÓN
Consideraciones Generales
Los pacientes deben seguir una dieta adecuada para reducir los lípidos antes de recibir TRICOR 160 mg y deben continuar con esta dieta durante el tratamiento con TRICOR. Los comprimidos de TRICOR se pueden administrar independientemente de las comidas.
El tratamiento inicial para la dislipidemia es una terapia dietética específica para el tipo de anormalidad de las lipoproteínas. El exceso de peso corporal y la ingesta excesiva de alcohol pueden ser factores importantes en la hipertrigliceridemia y deben abordarse antes de cualquier tratamiento farmacológico. El ejercicio físico puede ser una importante medida auxiliar. Las enfermedades que contribuyen a la hiperlipidemia, como el hipotiroidismo o la diabetes mellitus, deben buscarse y tratarse adecuadamente. La terapia con estrógenos, los diuréticos tiazídicos y los bloqueadores beta a veces se asocian con aumentos masivos de los triglicéridos plasmáticos, especialmente en sujetos con hipertrigliceridemia familiar. En tales casos, la suspensión del agente etiológico específico puede obviar la necesidad de un tratamiento farmacológico específico de la hipertrigliceridemia.
Los niveles de lípidos deben monitorearse periódicamente y se debe considerar la reducción de la dosis de TRICOR si los niveles de lípidos caen significativamente por debajo del rango objetivo.
La terapia debe retirarse en pacientes que no tengan una respuesta adecuada después de dos meses de tratamiento con la dosis máxima recomendada de 145 mg una vez al día.
Hipercolesterolemia Primaria O Dislipidemia Mixta
La dosis inicial de TRICOR 200 mg es de 145 mg una vez al día.
Hipertrigliceridemia severa
La dosis inicial es de 48 a 145 mg por día. La dosis debe individualizarse de acuerdo con la respuesta del paciente y debe ajustarse si es necesario luego de repetir las determinaciones de lípidos en intervalos de 4 a 8 semanas. La dosis máxima es de 145 mg una vez al día.
Insuficiencia renal
El tratamiento con TRICOR 200 mg debe iniciarse a una dosis de 48 mg por día en pacientes con insuficiencia renal de leve a moderada, y aumentarse solo después de evaluar los efectos sobre la función renal y los niveles de lípidos a esta dosis. Debe evitarse el uso de TRICOR en pacientes con insuficiencia renal grave [ver Uso en poblaciones específicas y FARMACOLOGÍA CLÍNICA ].
Pacientes geriátricos
La selección de la dosis para los ancianos debe hacerse sobre la base de la función renal [ver Uso en poblaciones específicas ].
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
- Comprimidos amarillos de 48 mg, impresos con las letras de identificación del código “FI”.
- Comprimidos amarillos de 48 mg, impresos con el logotipo “a” y las letras de identificación del código “FI”.
- Comprimidos blancos de 145 mg, impresos con las letras de identificación del código “FO”.
- Comprimidos blancos de 145 mg, impresos con el logotipo “a” y las letras de identificación del código “FO”.
Almacenamiento y manipulación
TRICOR® (tabletas de fenofibrato) está disponible en dos concentraciones:
48 miligramos
Comprimidos amarillos, impresos con las letras de identificación del código “FI”, disponibles en frascos de 90 ( CDN 0074-3173-90).
Comprimidos amarillos, impresos con el logotipo “a” y las letras de identificación del código “FI”, disponibles en frascos de 90 ( CDN 0074-6122-90).
145 miligramos
Comprimidos blancos, impresos con las letras de identificación del código “FO”, disponibles en frascos de 90 ( CDN 0074-3189-90).
Comprimidos blancos, impresos con el logotipo "a" y las letras de identificación del código "FO", disponibles en frascos de 90 ( CDN 0074-6123-90).
Almacenamiento
Almacenar a 25°C (77°F); excursiones permitidas a 15-30°C (59-86°F).
[Consulte Temperatura ambiente controlada por la USP]. Mantener fuera del alcance de los niños. Proteger de la humedad.
Fabricado para AbbVie Inc., North Chicago, IL 60064, EE. UU. por Fournier Laboratories Ireland Limited, Anngrove, Carrigtwohill Co. Cork, Irlanda. Revisado: marzo de 2021
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas graves se describen a continuación y en otras partes de la etiqueta:
- Mortalidad y morbilidad por enfermedad coronaria [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hepatoxicidad [ver ADVERTENCIAS Y PRECAUCIONES ]
- Pancreatitis [ver ADVERTENCIAS Y PRECAUCIONES ]
- Reacciones de hipersensibilidad [ver ADVERTENCIAS Y PRECAUCIONES ]
- Enfermedad venotromboembólica [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en ensayos clínicos
Debido a que los estudios clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los estudios clínicos de un fármaco no pueden compararse directamente con las tasas de los estudios clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Los eventos adversos informados por el 2 % o más de los pacientes tratados con fenofibrato (y más que con placebo) durante los ensayos doble ciego controlados con placebo, independientemente de la causalidad, se enumeran en la Tabla 1 a continuación. Los eventos adversos llevaron a la interrupción del tratamiento en el 5,0 % de los pacientes tratados con fenofibrato y en el 3,0 % de los tratados con placebo. Los aumentos en las pruebas de función hepática fueron los eventos más frecuentes, lo que provocó la interrupción del tratamiento con fenofibrato en el 1,6% de los pacientes en ensayos doble ciego.
Se observó urticaria en el 1,1 % frente al 0 %, y sarpullido en el 1,4 % frente al 0,8 % de los pacientes con fenofibrato y placebo, respectivamente, en ensayos controlados.
Aumentos en las enzimas hepáticas
En un análisis combinado de 10 ensayos controlados con placebo, se produjeron aumentos de ALT a > 3 veces el límite superior normal en el 5,3 % de los pacientes que tomaban fenofibrato en dosis equivalentes a 96 mg a 145 mg de TRICOR al día frente al 1,1 % de los pacientes tratados con placebo [ver ADVERTENCIAS Y PRECAUCIONES ]. En un estudio de 8 semanas, la incidencia de elevaciones de ALT o AST ≥ 3 veces el límite superior normal fue del 13 % en pacientes que recibieron dosis equivalentes a 96 mg a 145 mg de TRICOR diariamente y fue del 0 % en aquellos que recibieron dosis equivalentes a 48 mg o menos TRICOR diariamente o placebo.
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de fenofibrato. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de forma fiable su frecuencia o establecer una relación causal con la exposición al fármaco: mialgia, rabdomiolisis, pancreatitis, insuficiencia renal aguda, espasmo muscular, hepatitis, cirrosis, aumento bilirrubina total, anemia, artralgia, disminución de la hemoglobina, disminución del hematocrito, disminución de los glóbulos blancos, astenia, niveles de colesterol HDL gravemente reducidos y enfermedad pulmonar intersticial. Se han producido reacciones de fotosensibilidad días o meses después del inicio; en algunos de estos casos, los pacientes reportaron una reacción previa de fotosensibilidad al ketoprofeno.
INTERACCIONES CON LA DROGAS
Anticoagulantes cumarínicos
Se ha observado una potenciación de los efectos anticoagulantes de tipo cumarina con la prolongación del PT/INR.
Se debe tener precaución cuando se administran anticoagulantes cumarínicos junto con TRICOR. La dosis de los anticoagulantes debe reducirse para mantener el PT/INR en el nivel deseado para prevenir complicaciones hemorrágicas. Se recomiendan determinaciones frecuentes de PT/INR hasta que se haya determinado definitivamente que el PT/INR se ha estabilizado [ver ADVERTENCIAS Y PRECAUCIONES ].
inmunosupresores
Los inmunosupresores, como la ciclosporina y el tacrolimus, pueden producir nefrotoxicidad con disminuciones en el aclaramiento de creatinina y aumentos en la creatinina sérica, y debido a que la excreción renal es la principal vía de eliminación de los fibratos, incluido TRICOR, existe el riesgo de que una interacción conduzca al deterioro de la función renal. Los beneficios y riesgos del uso de TRICOR (comprimidos de fenofibrato) con inmunosupresores y otros agentes potencialmente nefrotóxicos se deben considerar cuidadosamente, y se debe emplear la dosis efectiva más baja y monitorear la función renal.
Resinas de unión de ácidos biliares
Dado que las resinas de unión de ácidos biliares pueden unirse a otros medicamentos administrados simultáneamente, los pacientes deben tomar TRICOR 200 mg al menos 1 hora antes o de 4 a 6 horas después de una resina de unión de ácidos biliares para evitar impedir su absorción.
colchicina
Se han notificado casos de miopatía, incluida la rabdomiólisis, con fenofibratos coadministrados con colchicina, y se debe tener precaución al prescribir fenofibrato con colchicina.
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Mortalidad y morbilidad por enfermedad coronaria
No se ha establecido el efecto de TRICOR 160 mg sobre la morbilidad y mortalidad por enfermedad coronaria y la mortalidad no cardiovascular.
El ensayo Action to Control Cardiovascular Risk in Diabetes Lipid (ACCORD Lipid) fue un estudio aleatorizado controlado con placebo de 5518 pacientes con diabetes mellitus tipo 2 en tratamiento con estatinas de base tratados con fenofibrato. La duración media del seguimiento fue de 4,7 años. La terapia de combinación de fenofibrato más estatinas mostró una reducción no significativa del 8% del riesgo relativo en el resultado primario de eventos cardiovasculares adversos mayores (MACE), un compuesto de infarto de miocardio no fatal, accidente cerebrovascular no fatal y muerte por enfermedad cardiovascular (razón de riesgo [hazard ratio] [ HR] 0,92, IC 95% 0,79-1,08) (p=0,32) en comparación con la monoterapia con estatinas. En un análisis de subgrupos de género, el cociente de riesgos instantáneos para MACE en hombres que recibieron terapia combinada versus monoterapia con estatinas fue de 0,82 (IC del 95 %: 0,69-0,99), y el índice de riesgo para MACE en mujeres que recibieron terapia combinada versus monoterapia con estatinas fue de 1,38 (IC del 95 % 0,98-1,94) (interacción p=0,01). La importancia clínica de este hallazgo de subgrupo no está clara.
El estudio Fenofibrate Intervention and Event Lowering in Diabetes (FIELD) fue un estudio aleatorizado controlado con placebo de 5 años de duración de 9795 pacientes con diabetes mellitus tipo 2 tratados con fenofibrato. El fenofibrato demostró una reducción relativa no significativa del 11 % en el resultado primario de eventos de enfermedad coronaria (hazard ratio [HR] 0,89, IC del 95 % 0,75-1,05, p=0,16) y una reducción significativa del 11 % en el resultado secundario de eventos de enfermedad coronaria total. eventos de enfermedad cardiovascular (HR 0,89 [0,80-0,99], p=0,04). Hubo un aumento no significativo del 11 % (HR 1,11 [0,95, 1,29], p=0,18) y del 19 % (HR 1,19 [0,90, 1,57], p=0,22) en la mortalidad total y por enfermedad coronaria, respectivamente, con fenofibrato en comparación con el placebo.
Debido a las similitudes químicas, farmacológicas y clínicas entre TRICOR (tabletas de fenofibrato), clofibrato y gemfibrozil, los hallazgos adversos en 4 grandes estudios clínicos aleatorizados, controlados con placebo con estos otros fármacos de fibrato también pueden aplicarse a TRICOR.
En el Coronary Drug Project, un gran estudio de pacientes tratados con clofibrato durante 5 años después de un infarto de miocardio, no se observaron diferencias en la mortalidad entre el grupo de clofibrato y el grupo de placebo. Sin embargo, hubo una diferencia en la tasa de colelitiasis y colecistitis que requirieron cirugía entre los dos grupos (3,0 % frente a 1,8 %).
En un estudio realizado por la Organización Mundial de la Salud (OMS), 5000 sujetos sin enfermedad arterial coronaria conocida fueron tratados con placebo o clofibrato durante 5 años y seguidos durante un año adicional. Hubo una mayor mortalidad por todas las causas ajustada por edad estadísticamente significativa en el grupo de clofibrato en comparación con el grupo de placebo (5,70 % frente a 3,96 %, p =
El Helsinki Heart Study fue un gran estudio (n=4081) de hombres de mediana edad sin antecedentes de enfermedad arterial coronaria. Los sujetos recibieron placebo o gemfibrozil durante 5 años, con una extensión abierta de 3,5 años después. La mortalidad total fue numéricamente mayor en el grupo de aleatorización de gemfibrozilo, pero no alcanzó significación estadística (p = 0,19, intervalo de confianza del 95 % para el riesgo relativo G:P = 0,91-1,64). Aunque las muertes por cáncer tuvieron una tendencia más alta en el grupo de gemfibrozil (p = 0,11), los cánceres (excluyendo el carcinoma de células basales) se diagnosticaron con la misma frecuencia en ambos grupos de estudio. Debido al tamaño limitado del estudio, el riesgo relativo de muerte por cualquier causa no mostró ser diferente al observado en los datos de seguimiento de 9 años del estudio de la Organización Mundial de la Salud (RR = 1,29).
Un componente de prevención secundaria del Estudio del Corazón de Helsinki inscribió a hombres de mediana edad excluidos del estudio de prevención primaria debido a enfermedad coronaria conocida o sospechada. Los sujetos recibieron gemfibrozil o placebo durante 5 años. Aunque las muertes cardíacas tuvieron una tendencia más alta en el grupo de gemfibrozilo, esto no fue estadísticamente significativo (razón de riesgo 2,2, intervalo de confianza del 95 %: 0,94-5,05). La tasa de cirugía de la vesícula biliar no fue estadísticamente significativa entre los grupos de estudio, pero tuvo una tendencia más alta en el grupo de gemfibrozilo (1,9 % frente a 0,3 %, p = 0,07).
hepatotoxicidad
Se han informado lesiones hepáticas graves inducidas por fármacos (DILI, por sus siglas en inglés), incluido el trasplante de hígado y la muerte, después de la comercialización con TRICOR. Se ha informado DILI dentro de las primeras semanas de tratamiento o después de varios meses de terapia y, en algunos casos, se ha revertido con la interrupción del tratamiento con TRICOR 200 mg. Los pacientes con DILI han experimentado signos y síntomas que incluyen orina oscura, heces anormales, ictericia, malestar general, dolor abdominal, mialgia, pérdida de peso, prurito y náuseas. Muchos pacientes tenían elevaciones simultáneas de bilirrubina total, alanina transaminasa sérica (ALT) y aspartato transaminasa (AST). La DILI se ha caracterizado como hepatitis hepatocelular, crónica activa y colestásica, y se ha presentado cirrosis en asociación con hepatitis crónica activa.
En ensayos clínicos, el fenofibrato en dosis equivalentes a 96 mg a 145 mg de TRICOR 160 mg diarios se ha asociado con aumentos en la AST o ALT sérica. La incidencia de aumentos en las transaminasas puede estar relacionada con la dosis [ver REACCIONES ADVERSAS ].
TRICOR 160 mg está contraindicado en pacientes con enfermedad hepática activa, incluidos aquellos con cirrosis biliar primaria y anomalías persistentes inexplicables de la función hepática [ver CONTRAINDICACIONES ]. Controle la función hepática del paciente, incluidas las concentraciones séricas de ALT, AST y bilirrubina total, al inicio y periódicamente durante la terapia con TRICOR. Suspender TRICOR 200 mg si se desarrollan signos o síntomas de daño hepático o si persisten niveles elevados de enzimas (ALT o AST > 3 veces el límite superior normal, o si se acompaña de elevación de la bilirrubina). No reinicie TRICOR 160 mg en estos pacientes si no existe una explicación alternativa para la lesión hepática.
miopatía y rabdomiólisis
Los fibratos aumentan el riesgo de miopatía y se han asociado con rabdomiolisis. El riesgo de toxicidad muscular grave parece aumentar en pacientes de edad avanzada y en pacientes con diabetes, insuficiencia renal o hipotiroidismo.
Se debe considerar la miopatía en cualquier paciente con mialgias difusas, sensibilidad o debilidad muscular y/o elevaciones marcadas de los niveles de creatina fosfoquinasa (CPK).
Se debe advertir a los pacientes que notifiquen de inmediato cualquier dolor, sensibilidad o debilidad muscular inexplicable, especialmente si se acompaña de malestar general o fiebre. Los niveles de CPK deben evaluarse en pacientes que informen estos síntomas, y la terapia con TRICOR 200 mg debe interrumpirse si se presentan niveles de CPK marcadamente elevados o si se sospecha o se diagnostica miopatía/miositis.
Los datos de estudios observacionales indican que el riesgo de rabdomiólisis aumenta cuando se administran fibratos, en particular gemfibrozilo, con una estatina. La combinación debe evitarse a menos que el beneficio de alteraciones adicionales en los niveles de lípidos supere el mayor riesgo de esta combinación de medicamentos [ver FARMACOLOGÍA CLÍNICA ].
Se han notificado casos de miopatía, incluida la rabdomiólisis, con fenofibratos coadministrados con colchicina, y se debe tener precaución al prescribir fenofibrato con colchicina [ver INTERACCIONES CON LA DROGAS ].
Suero de creatinina
Se han informado elevaciones en la creatinina sérica en pacientes tratados con fenofibrato. Estas elevaciones tienden a volver a la línea de base luego de la interrupción del fenofibrato. Se desconoce el significado clínico de estas observaciones. Vigilar la función renal en pacientes con insuficiencia renal que toman TRICOR. También se debe considerar la monitorización renal para pacientes que toman TRICOR con riesgo de insuficiencia renal, como los ancianos y los pacientes con diabetes.
colelitiasis
El fenofibrato, como el clofibrato y el gemfibrozil, puede aumentar la excreción de colesterol en la bilis, lo que provoca colelitiasis. Si se sospecha colelitiasis, están indicados los estudios de la vesícula biliar. La terapia con TRICOR 160 mg debe suspenderse si se encuentran cálculos biliares.

Anticoagulantes cumarínicos
Se debe tener precaución cuando se administran anticoagulantes cumarínicos junto con TRICOR 160 mg debido a la potenciación de los efectos anticoagulantes de tipo cumarínico en la prolongación del tiempo de protrombina/índice internacional normalizado (PT/INR). Para prevenir complicaciones hemorrágicas, se recomienda la monitorización frecuente del PT/INR y el ajuste de la dosis del anticoagulante hasta que el PT/INR se haya estabilizado [ver INTERACCIONES CON LA DROGAS ].
pancreatitis
Se ha informado pancreatitis en pacientes que toman fenofibrato, gemfibrozilo y clofibrato. Este hecho puede representar una falta de eficacia en pacientes con hipertrigliceridemia grave, un efecto directo del fármaco o un fenómeno secundario mediado por la formación de cálculos o sedimentos en las vías biliares con obstrucción del conducto biliar común.
Cambios hematológicos
Se han observado disminuciones leves a moderadas de la hemoglobina, el hematocrito y los glóbulos blancos en pacientes después del inicio de la terapia con fenofibrato. Sin embargo, estos niveles se estabilizan durante la administración a largo plazo. Se han informado trombocitopenia y agranulocitosis en individuos tratados con fenofibrato. Se recomienda el control periódico de los recuentos de glóbulos rojos y blancos durante los primeros 12 meses de la administración de TRICOR.
Reacciones hipersensibles
Hipersensibilidad aguda
Se ha informado anafilaxia y angioedema después de la comercialización con fenofibrato. En algunos casos, las reacciones pusieron en peligro la vida y requirieron tratamiento de emergencia. Si un paciente desarrolla signos o síntomas de una reacción de hipersensibilidad aguda, aconséjele que busque atención médica inmediata y suspenda el fenofibrato.
Hipersensibilidad Retardada
Se han informado reacciones adversas cutáneas graves a medicamentos (SCAR), incluido el síndrome de Stevens-Johnson, la necrólisis epidérmica tóxica y la reacción a medicamentos con eosinofilia y síntomas sistémicos (DRESS), posteriores a la comercialización, que ocurrieron días o semanas después del inicio del fenofibrato. Los casos de DRESS se asociaron con reacciones cutáneas (como exantema o dermatitis exfoliativa) y una combinación de eosinofilia, fiebre, compromiso de órganos sistémicos (renal, hepático o respiratorio). Suspenda el fenofibrato y trate a los pacientes adecuadamente si se sospecha SCAR.
Enfermedad venotromboembólica
En el ensayo FIELD, se observaron tasas más altas de embolia pulmonar (EP) y trombosis venosa profunda (TVP) en el grupo tratado con fenofibrato que en el grupo tratado con placebo. De 9795 pacientes inscritos en FIELD, había 4900 en el grupo de placebo y 4895 en el grupo de fenofibrato. Para la TVP, hubo 48 eventos (1 %) en el grupo de placebo y 67 (1 %) en el grupo de fenofibrato (p = 0,074); y para PE, hubo 32 (0,7%) eventos en el grupo de placebo y 53 (1%) en el grupo de fenofibrato (p = 0,022).
En el Coronary Drug Project, una mayor proporción del grupo de clofibrato experimentó tromboflebitis o embolia pulmonar letal o no letal definitiva o sospechosa que el grupo de placebo (5,2 % frente a 3,3 % a los cinco años; p
Disminuciones paradójicas en los niveles de colesterol HDL
Ha habido informes posteriores a la comercialización y de ensayos clínicos de disminuciones graves en los niveles de colesterol HDL (tan bajas como 2 mg/dl) que se produjeron en pacientes diabéticos y no diabéticos que iniciaron la terapia con fibratos. La disminución de HDL-C se refleja en una disminución de la apolipoproteína A1. Se ha informado que esta disminución ocurre dentro de las 2 semanas a los años posteriores al inicio de la terapia con fibratos. Los niveles de HDL-C permanecen bajos hasta que se suspende la terapia con fibratos; la respuesta a la retirada del tratamiento con fibratos es rápida y sostenida. Se desconoce el significado clínico de esta disminución de HDL-C. Se recomienda que los niveles de HDL-C se controlen dentro de los primeros meses después del inicio de la terapia con fibratos. Si se detecta un nivel de HDL-C severamente reducido, la terapia con fibratos debe suspenderse y el nivel de HDL-C debe monitorearse hasta que regrese a la línea base, y la terapia con fibratos no debe reiniciarse.
Toxicología no clínica
Carcinogénesis y mutagénesis y deterioro de la fertilidad
Se han realizado dos estudios de carcinogenicidad dietética en ratas con fenofibrato. En el primer estudio de 24 meses, las ratas Wistar recibieron dosis de fenofibrato de 10, 45 y 200 mg/kg/día, aproximadamente 0,3, 1 y 6 veces la dosis máxima recomendada en humanos (MRHD) de 300 mg de fenofibrato al día, equivalente a 145 mg de TRICOR 160 mg diarios, en base a comparaciones de área de superficie corporal. A una dosis de 200 mg/kg/día (a 6 veces la MRHD), la incidencia de carcinomas hepáticos aumentó significativamente en ambos sexos. Se observó un aumento estadísticamente significativo de carcinomas de páncreas en hombres con 1 y 6 veces la MRHD; se observó un aumento de adenomas pancreáticos y tumores benignos de células intersticiales testiculares a 6 veces la MRHD en los hombres. En un segundo estudio de carcinogenicidad en ratas de 24 meses en una raza diferente de ratas (Sprague-Dawley), las dosis de 10 y 60 mg/kg/día (0.3 y 2 veces la MRHD) produjeron aumentos significativos en la incidencia de adenomas acinares pancreáticos en ambos sexos y aumentos en los tumores de células intersticiales testiculares en hombres a 2 veces la MRHD.
Se realizó un estudio de carcinogenicidad de 117 semanas en ratas que comparó tres fármacos: fenofibrato 10 y 60 mg/kg/día (0,3 y 2 veces la MRHD, según las comparaciones del área de superficie corporal), clofibrato (400 mg/kg/día; 2 veces la dosis humana) y gemfibrozil (250 mg/kg/día; 2 veces la dosis humana, en base a mg/m² de área de superficie). El fenofibrato aumentó los adenomas acinares pancreáticos en ambos sexos. El clofibrato aumentó el carcinoma hepatocelular y los adenomas acinares pancreáticos en los hombres y los nódulos neoplásicos hepáticos en las mujeres. Gemfibrozil aumentó los nódulos neoplásicos hepáticos en hombres y mujeres, mientras que los tres fármacos aumentaron los tumores de células intersticiales testiculares en hombres.
En un estudio de 21 meses en ratones CF-1, 10, 45 y 200 mg/kg/día de fenofibrato (aproximadamente 0.2, 1 y 3 veces la MRHD, según las comparaciones del área de superficie corporal) aumentaron significativamente los carcinomas hepáticos en ambos sexos a 3 veces la MRHD. En un segundo estudio de 18 meses a 10, 60 y 200 mg/kg/día, el fenofibrato aumentó significativamente los carcinomas hepáticos en ratones machos y los adenomas hepáticos en ratones hembras a 3 veces la MRHD.
Los estudios de microscopía electrónica han demostrado proliferación peroxisomal después de la administración de fenofibrato a la rata. No se ha realizado un estudio adecuado para probar la proliferación de peroxisomas en humanos, pero se han observado cambios en la morfología y el número de peroxisomas en humanos después del tratamiento con otros miembros de la clase de fibratos cuando se compararon biopsias de hígado antes y después del tratamiento en el mismo individuo.
Se ha demostrado que el fenofibrato carece de potencial mutagénico en las siguientes pruebas: Ames, linfoma de ratón, aberración cromosómica y síntesis de ADN no programada en hepatocitos primarios de rata.
En estudios de fertilidad, las ratas recibieron dosis dietéticas orales de fenofibrato, los machos recibieron 61 días antes del apareamiento y las hembras 15 días antes del apareamiento hasta el destete, lo que no produjo ningún efecto adverso sobre la fertilidad en dosis de hasta 300 mg/kg/día (10 veces la MRHD, basado en comparaciones de área de superficie corporal).
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
Los datos disponibles limitados con el uso de fenofibrato en mujeres embarazadas son insuficientes para determinar un riesgo asociado con el fármaco de defectos congénitos importantes, aborto espontáneo o resultados maternos o fetales adversos. En estudios de reproducción en animales, no se observó evidencia de toxicidad embriofetal con la administración oral de fenofibrato en ratas y conejos durante la organogénesis en dosis menores o equivalentes a la dosis clínica máxima recomendada de 145 mg diarios, según el área de superficie corporal (mg/ m²). Se produjeron resultados reproductivos adversos con dosis más altas en presencia de toxicidad materna (ver Datos ). TRICOR 200 mg debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto.
Se desconoce el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo para la población indicada. En la población general de EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 al 4 % y del 15 al 20 %, respectivamente.
Datos
Datos de animales
En ratas preñadas que recibieron dosis dietéticas orales de 14, 127 y 361 mg/kg/día desde el día 6-15 de gestación durante el período de organogénesis, no se observaron hallazgos adversos en el desarrollo con 14 mg/kg/día (menos que la exposición clínica). a la dosis humana máxima recomendada [MRHD] de 300 mg de fenofibrato al día, equivalente a 145 mg de TRICOR al día, según las comparaciones del área de superficie corporal). Se observaron malformaciones esqueléticas fetales aumentadas a dosis tóxicas para la madre (361 mg/kg/día, que corresponde a 12 veces la exposición clínica en la MRHD) que suprimieron significativamente el aumento de peso corporal materno.
En conejas preñadas que recibieron dosis por sonda oral de 15, 150 y 300 mg/kg/día desde el día 618 de gestación durante el período de organogénesis y a las que se les permitió dar a luz, no se observaron hallazgos adversos en el desarrollo con 15 mg/kg/día (una dosis que se aproxima a la exposición clínica en la MRHD, según las comparaciones del área de superficie corporal). Se observaron camadas abortadas a dosis tóxicas para la madre (≥ 150 mg/kg/día, que corresponde a ≥ 10 veces la exposición clínica en la MRHD) que suprimieron el aumento de peso corporal materno.
En ratas preñadas que recibieron dosis dietéticas orales de 15, 75 y 300 mg/kg/día desde el día 15 de gestación hasta el día 21 de lactancia (destete), no se observaron efectos adversos en el desarrollo con 15 mg/kg/día (menos que la exposición clínica en la MRHD, con base en comparaciones de área de superficie corporal), a pesar de la toxicidad materna (disminución del aumento de peso). Se observó pérdida posterior a la implantación a ≥ 75 mg/kg/día (≥ 2 veces la exposición clínica en la MRHD) en presencia de toxicidad materna (disminución del aumento de peso). Se observó una disminución de la supervivencia de las crías con 300 mg/kg/día (10 veces la exposición clínica en la MRHD), que se asoció con una disminución del aumento de peso corporal materno/negligencia materna.
Lactancia
Resumen de riesgos
No hay información disponible sobre la presencia de fenofibrato en la leche humana, los efectos del fármaco en el lactante o los efectos en la producción de leche. El fenofibrato está presente en la leche de las ratas y, por lo tanto, es probable que esté presente en la leche humana. Debido al potencial de reacciones adversas graves en los lactantes, como la interrupción del metabolismo de los lípidos del lactante, las mujeres no deben amamantar durante el tratamiento con TRICOR 200 mg y durante los 5 días posteriores a la dosis final [ver CONTRAINDICACIONES ].
Uso pediátrico
No se ha establecido la seguridad y eficacia en pacientes pediátricos.
Uso geriátrico
Se sabe que el ácido fenofíbrico se excreta sustancialmente por vía renal, y el riesgo de reacciones adversas a este fármaco puede ser mayor en pacientes con insuficiencia renal. La exposición al ácido fenofíbrico no está influenciada por la edad. Dado que los pacientes de edad avanzada tienen una mayor incidencia de insuficiencia renal, la selección de la dosis para los pacientes de edad avanzada debe hacerse en función de la función renal [ver DOSIFICACIÓN Y ADMINISTRACIÓN y FARMACOLOGÍA CLÍNICA ]. Los pacientes de edad avanzada con función renal normal no deben requerir modificaciones de dosis. Considere monitorear la función renal en pacientes de edad avanzada que toman TRICOR.
Insuficiencia renal
Debe evitarse el uso de TRICOR 160 mg en pacientes con insuficiencia renal grave [ver CONTRAINDICACIONES ]. Se requiere una reducción de la dosis en pacientes con insuficiencia renal de leve a moderada [ver DOSIFICACIÓN Y ADMINISTRACIÓN y FARMACOLOGÍA CLÍNICA ]. Se recomienda monitorear la función renal en pacientes con insuficiencia renal.
Deterioro hepático
No se ha evaluado el uso de TRICOR 200 mg en sujetos con insuficiencia hepática [ver CONTRAINDICACIONES y FARMACOLOGÍA CLÍNICA ].
SOBREDOSIS
No existe un tratamiento específico para la sobredosis de TRICOR. Está indicada la atención general de apoyo del paciente, incluida la monitorización de los signos vitales y la observación del estado clínico, en caso de que se produzca una sobredosis. Si está indicado, la eliminación del fármaco no absorbido debe lograrse mediante emesis o lavado gástrico; se deben observar las precauciones habituales para mantener la vía aérea. Debido a que el ácido fenofíbrico se une en gran medida a las proteínas plasmáticas, no se debe considerar la hemodiálisis.
CONTRAINDICACIONES
TRICOR 200mg está contraindicado en:
- pacientes con insuficiencia renal grave, incluidos los que reciben diálisis [ver FARMACOLOGÍA CLÍNICA ].
- pacientes con enfermedad hepática activa, incluidos aquellos con cirrosis biliar primaria y anomalías persistentes inexplicables de la función hepática [ver ADVERTENCIAS Y PRECAUCIONES ].
- pacientes con enfermedad de la vesícula biliar preexistente [ver ADVERTENCIAS Y PRECAUCIONES ].
- madres lactantes [ver Uso en poblaciones específicas ].
- pacientes con hipersensibilidad conocida al fenofibrato o al ácido fenofíbrico [ver ADVERTENCIAS Y PRECAUCIONES ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
La fracción activa de TRICOR es el ácido fenofíbrico. Los efectos farmacológicos del ácido fenofíbrico tanto en animales como en humanos se han estudiado ampliamente mediante la administración oral de fenofibrato.
Los efectos modificadores de lípidos del ácido fenofíbrico observados en la práctica clínica se han explicado in vivo en ratones transgénicos e in vitro en cultivos de hepatocitos humanos mediante la activación del receptor activado por el proliferador de peroxisomas α (PPARα). A través de este mecanismo, el fenofibrato aumenta la lipólisis y la eliminación de partículas ricas en triglicéridos del plasma al activar la lipoproteína lipasa y reducir la producción de apoproteína C-III (un inhibidor de la actividad de la lipoproteína lipasa).
La disminución resultante de TG produce una alteración en el tamaño y la composición de las LDL desde partículas pequeñas y densas (que se cree que son aterogénicas debido a su susceptibilidad a la oxidación), hasta partículas grandes flotantes. Estas partículas más grandes tienen una mayor afinidad por los receptores de colesterol y se catabolizan rápidamente. La activación de PPARα también induce un aumento en la síntesis de apolipoproteínas AI, A-II y HDL-colesterol.
El fenofibrato también reduce los niveles séricos de ácido úrico en individuos hiperuricémicos y normales al aumentar la excreción urinaria de ácido úrico.
Farmacodinámica
Una variedad de estudios clínicos han demostrado que los niveles elevados de C-total, LDL-C y apo B, un complejo de membrana LDL, están asociados con la aterosclerosis humana. De manera similar, los niveles reducidos de HDL-C y su complejo de transporte, la apolipoproteína A (apo AI y apo AII) están asociados con el desarrollo de aterosclerosis. Investigaciones epidemiológicas han establecido que la morbilidad y mortalidad cardiovascular varían directamente con el nivel de C-total, LDL-C y TG, e inversamente con el nivel de HDL-C. No se ha determinado el efecto independiente de elevar el HDL-C o disminuir los triglicéridos (TG) sobre el riesgo de morbilidad y mortalidad cardiovascular.
El ácido fenofíbrico, el metabolito activo del fenofibrato, produce reducciones en el colesterol total, el colesterol LDL, la apolipoproteína B, los triglicéridos totales y la lipoproteína rica en triglicéridos (VLDL) en los pacientes tratados. Además, el tratamiento con fenofibrato produce aumentos en las lipoproteínas de alta densidad (HDL) y las apolipoproteínas apoAI y apoAII.
Farmacocinética
Las concentraciones plasmáticas de ácido fenofíbrico después de la administración de tres comprimidos de 48 mg o uno de 145 mg son equivalentes en condiciones de alimentación a una cápsula de fenofibrato micronizado de 200 mg.
El fenofibrato es un profármaco de la fracción química activa ácido fenofíbrico. El fenofibrato se convierte por hidrólisis del éster en el cuerpo en ácido fenofíbrico, que es el componente activo medible en la circulación.
Absorción
No se puede determinar la biodisponibilidad absoluta de fenofibrato ya que el compuesto es prácticamente insoluble en medios acuosos adecuados para inyección. Sin embargo, el fenofibrato se absorbe bien en el tracto gastrointestinal. Después de la administración oral en voluntarios sanos, aproximadamente el 60 % de una dosis única de fenofibrato radiomarcado apareció en la orina, principalmente como ácido fenofíbrico y su conjugado de glucuronato, y el 25 % se excretó en las heces. Los niveles plasmáticos máximos de ácido fenofíbrico ocurren dentro de las 6 a 8 horas posteriores a la administración.
La exposición al ácido fenofíbrico en plasma, medida por Cmax y AUC, no es significativamente diferente cuando se administra una dosis única de 145 mg de fenofibrato en ayunas o sin ayunar.
Distribución
Con dosis múltiples de fenofibrato, el estado estacionario del ácido fenofíbrico se alcanza en 9 días. Las concentraciones plasmáticas de ácido fenofíbrico en estado estacionario son aproximadamente el doble de las que siguen a una dosis única. La unión a proteínas séricas fue de aproximadamente el 99 % en sujetos normales e hiperlipidémicos.
Metabolismo
Después de la administración oral, el fenofibrato es rápidamente hidrolizado por esterasas al metabolito activo, ácido fenofíbrico; no se detecta fenofibrato inalterado en plasma.
El ácido fenofíbrico se conjuga principalmente con ácido glucurónico y luego se excreta en la orina. Una pequeña cantidad de ácido fenofíbrico se reduce en el resto carbonilo a un metabolito de benzhidrol que, a su vez, se conjuga con ácido glucurónico y se excreta en la orina.
Los datos de metabolismo in vivo indican que ni el fenofibrato ni el ácido fenofíbrico experimentan un metabolismo oxidativo (p. ej., citocromo P450) en un grado significativo.
Eliminación
Después de la absorción, el fenofibrato se excreta principalmente en la orina en forma de metabolitos, principalmente ácido fenofíbrico y glucurónido de ácido fenofíbrico. Después de la administración de fenofibrato radiomarcado, aproximadamente el 60 % de la dosis apareció en la orina y el 25 % se excretó en las heces.
El ácido fenofíbrico se elimina con una vida media de 20 horas, permitiéndose la dosificación una vez al día.
Poblaciones Especiales
Geriatría
En voluntarios de edad avanzada de 77 a 87 años de edad, el aclaramiento oral de ácido fenofíbrico después de una dosis oral única de fenofibrato fue de 1,2 l/h, en comparación con 1,1 l/h en adultos jóvenes. Esto indica que se puede usar un régimen de dosificación similar en ancianos con función renal normal, sin aumentar la acumulación del fármaco o los metabolitos [ver DOSIFICACIÓN Y ADMINISTRACIÓN y Uso en poblaciones específicas ].
Pediatría
La farmacocinética de TRICOR 160 mg no se ha estudiado en poblaciones pediátricas.
Género
No se han observado diferencias farmacocinéticas entre hombres y mujeres para el fenofibrato.
La raza
No se ha estudiado la influencia de la raza en la farmacocinética del fenofibrato; sin embargo, el fenofibrato no es metabolizado por enzimas conocidas por exhibir variabilidad interétnica.
Insuficiencia renal
Se examinó la farmacocinética del ácido fenofíbrico en pacientes con insuficiencia renal leve, moderada y grave. Los pacientes con insuficiencia renal grave (tasa de filtración glomerular estimada [TFGe] DOSIFICACIÓN Y ADMINISTRACIÓN ].
Deterioro hepático
No se han realizado estudios farmacocinéticos en pacientes con insuficiencia hepática.
Interacciones fármaco-fármaco
Los estudios in vitro con microsomas hepáticos humanos indican que el fenofibrato y el ácido fenofíbrico no son inhibidores de las isoformas CYP3A4, CYP2D6, CYP2E1 o CYP1A2 del citocromo (CYP) P450. Son inhibidores débiles de CYP2C8, CYP2C19 y CYP2A6 e inhibidores leves a moderados de CYP2C9 en concentraciones terapéuticas.
La Tabla 2 describe los efectos de los fármacos coadministrados sobre la exposición sistémica al ácido fenofíbrico. La Tabla 3 describe los efectos de la administración conjunta de fenofibrato o ácido fenofíbrico sobre otros fármacos.
Estudios clínicos
Hipercolesterolemia Primaria (Heterocigota Familiar Y No Familiar) Y Dislipidemia Mixta
Los efectos del fenofibrato a una dosis equivalente a 145 mg de TRICOR (comprimidos de fenofibrato) por día se evaluaron en cuatro estudios aleatorizados, controlados con placebo, doble ciego, de grupos paralelos que incluyeron pacientes con los siguientes valores medios de lípidos iniciales: C total 306,9 mg/dL; LDL-C 213,8 mg/dL; HDL-C 52,3 mg/dL; y triglicéridos 191,0 mg/dL. La terapia con 200 mg de TRICOR redujo el LDL-C, el Total-C y la relación LDL-C/HDL-C. La terapia con TRICOR también redujo los triglicéridos y elevó el HDL-C (consulte la Tabla 4).
En un subconjunto de sujetos, se realizaron mediciones de apo B. El tratamiento con 200 mg de TRICOR redujo significativamente la apo B desde el inicio hasta el final en comparación con el placebo (-25,1 % frente a 2,4 %, p
Hipertrigliceridemia severa
Los efectos del fenofibrato sobre los triglicéridos séricos se estudiaron en dos ensayos clínicos aleatorizados, doble ciego, controlados con placebo de 147 pacientes con hipertrigliceridemia. Los pacientes fueron tratados durante ocho semanas bajo protocolos que diferían solo en que uno ingresó pacientes con niveles de TG basales de 500 a 1500 mg/dL, y los otros niveles de TG de 350 a 500 mg/dL. En pacientes con hipertrigliceridemia y colesterolemia normal con o sin hiperquilomicronemia, el tratamiento con fenofibrato en dosis equivalentes a TRICOR 145 mg por día disminuyó principalmente los triglicéridos de lipoproteínas de muy baja densidad (VLDL) y el colesterol VLDL. El tratamiento de pacientes con triglicéridos elevados a menudo resulta en un aumento de LDL-C (ver Tabla 5).
No se ha determinado el efecto de TRICOR 160 mg sobre la morbilidad y mortalidad cardiovascular.
INFORMACIÓN DEL PACIENTE
Se debe advertir a los pacientes:
- de los posibles beneficios y riesgos de TRICOR.
- no usar TRICOR si existe hipersensibilidad conocida al fenofibrato o al ácido fenofíbrico.
- de medicamentos que no deben tomarse en combinación con TRICOR.
- que si están tomando anticoagulantes cumarínicos, TRICOR 160 mg puede aumentar su efecto anticoagulante y puede ser necesario un mayor control.
- continuar con una dieta modificadora de lípidos apropiada mientras toma TRICOR.
- tomar TRICOR 160 mg una vez al día, independientemente de la comida, a la dosis prescrita, tragando cada comprimido entero.
- regresar al consultorio de su médico para un control de rutina.
- para informar a su médico de todos los medicamentos, suplementos y preparaciones a base de hierbas que están tomando y cualquier cambio en su condición médica. También se debe aconsejar a los pacientes que informen a sus médicos que prescriben un nuevo medicamento que están tomando TRICOR.
- informar a su médico sobre los síntomas de daño hepático (p. ej., ictericia, dolor abdominal, náuseas, malestar general, orina oscura, heces anormales, prurito); cualquier dolor muscular, sensibilidad o debilidad; o cualquier otro síntoma nuevo.
- no amamantar durante el tratamiento con TRICOR y durante los 5 días posteriores a la última dosis.
