Leukeran 2mg, 5mg Chlorambucil Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Leukeran 5mg y cómo se usa?
Leukeran 5mg es un medicamento recetado que se usa para tratar los síntomas de la leucemia linfática crónica (linfocítica) y el linfoma de Hodgkin. Leukeran 5 mg se puede usar solo o con otros medicamentos.
Leukeran 5 mg pertenece a una clase de medicamentos llamados antineoplásicos alquilantes.
No se sabe si Leukeran es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Leukeran?
Leukeran puede causar efectos secundarios graves que incluyen:
- urticaria,
- respiración dificultosa,
- hinchazón de la cara, los labios, la lengua o la garganta,
- convulsiones,
- masa o bulto inusual,
- vómitos o diarrea severos,
- tos nueva o que empeora,
- moretones con facilidad,
- sangrado inusual (nariz, boca, vagina o recto),
- puntos morados o rojos debajo de la piel,
- náuseas,
- dolor de estómago superior,
- Comezón,
- cansancio,
- pérdida de apetito,
- orina oscura,
- heces de color arcilla,
- coloración amarillenta de la piel o los ojos (ictericia),
- fiebre,
- encías hinchadas,
- llagas dolorosas en la boca,
- dolor al tragar,
- llagas en la piel,
- síntomas de resfriado o gripe,
- tos,
- dificultad para respirar,
- dolor de garganta,
- dolor de piel, y
- una erupción cutánea roja o morada que se extiende (especialmente en la cara o la parte superior del cuerpo) y causa ampollas y descamación
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Leukeran incluyen:
- fiebre,
- sangrado, y
- sintomas de gripe
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Leukeran. Para obtener más información, consulte a su médico o farmacéutico.
ADVERTENCIA
LEUKERAN (clorambucilo) puede suprimir severamente la función de la médula ósea. El clorambucilo es un carcinógeno en humanos. El clorambucil es probablemente mutagénico y teratogénico en humanos. El clorambucilo produce infertilidad humana (ver ADVERTENCIAS Y PRECAUCIONES ).
DESCRIPCIÓN
LEUKERAN (clorambucilo) fue sintetizado por primera vez por Everett et al. Es un agente alquilante bifuncional del tipo mostaza nitrogenada que se ha encontrado activo contra enfermedades neoplásicas humanas seleccionadas. El clorambucilo se conoce químicamente como ácido 4-[bis(2-cloroetil)amino]bencenobutanoico y tiene la siguiente fórmula estructural:
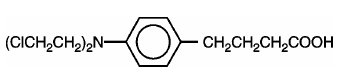
El clorambucilo se hidroliza en agua y tiene un pKa de 5,8.
LEUKERAN (clorambucilo) está disponible en forma de tabletas para administración oral. Cada comprimido recubierto con película contiene 2 mg de clorambucilo y los ingredientes inactivos dióxido de silicio coloidal, hipromelosa, lactosa (anhidra), macrogol/PEG 400, celulosa microcristalina, óxido de hierro rojo, ácido esteárico, dióxido de titanio y óxido de hierro amarillo.
INDICACIONES
LEUKERAN (clorambucilo) está indicado en el tratamiento de la leucemia linfática crónica (linfocítica), linfomas malignos que incluyen linfosarcoma, linfoma folicular gigante y enfermedad de Hodgkin. No es curativo en ninguno de estos trastornos, pero puede producir paliación clínicamente útil.
DOSIFICACIÓN Y ADMINISTRACIÓN
La dosis oral habitual es de 0,1 a 0,2 mg/kg de peso corporal al día durante 3 a 6 semanas, según sea necesario. Esto generalmente asciende a 4 a 10 mg por día para el paciente promedio. La dosis diaria completa se puede administrar de una sola vez. Estas dosis son para el inicio de la terapia o para cursos cortos de tratamiento. La dosis debe ajustarse cuidadosamente de acuerdo con la respuesta del paciente y debe reducirse tan pronto como haya una caída abrupta en el recuento de glóbulos blancos. Los pacientes con enfermedad de Hodgkin generalmente requieren 0,2 mg/kg al día, mientras que los pacientes con otros linfomas o leucemia linfocítica crónica generalmente solo requieren 0,1 mg/kg al día. Cuando hay infiltración linfocítica de la médula ósea, o cuando la médula ósea es hipoplásica, la dosis diaria no debe exceder los 0,1 mg/kg (alrededor de 6 mg para el paciente promedio).
Se han informado esquemas alternativos para el tratamiento de la leucemia linfocítica crónica que emplean dosis intermitentes, quincenales o mensuales de clorambucilo. Los programas intermitentes de clorambucilo comienzan con una dosis única inicial de 0,4 mg/kg. Las dosis generalmente se aumentan en 0,1 mg/kg hasta que se observa el control de la linfocitosis o la toxicidad. Las dosis posteriores se modifican para producir toxicidad hematológica leve. Se considera que la tasa de respuesta de la leucemia linfocítica crónica al programa de administración de clorambucilo cada dos semanas o una vez al mes es similar o mejor a la informada previamente con la administración diaria y que la toxicidad hematológica fue menor o igual a la encontrada en estudios que utilizaron clorambucilo diario. .
La radiación y los fármacos citotóxicos hacen que la médula ósea sea más vulnerable al daño, y el clorambucil debe usarse con especial precaución dentro de las 4 semanas posteriores a un curso completo de radioterapia o quimioterapia. Sin embargo, las dosis pequeñas de radiación paliativa sobre focos aislados alejados de la médula ósea no suelen deprimir el recuento de neutrófilos y plaquetas. En estos casos, se puede administrar clorambucilo en la dosis habitual.
Actualmente se considera que los cursos cortos de tratamiento son más seguros que la terapia de mantenimiento continuo, aunque ambos métodos han sido efectivos. Debe reconocerse que la terapia continua puede dar la apariencia de "mantenimiento" en pacientes que en realidad están en remisión y no tienen necesidad inmediata de más medicamentos. Si se utiliza una dosis de mantenimiento, no debe exceder los 0,1 mg/kg al día y puede ser tan baja como 0,03 mg/kg al día. Una dosis típica de mantenimiento es de 2 mg a 4 mg diarios, o menos, según el estado de los hemogramas. Por lo tanto, puede ser deseable retirar el fármaco después de que se haya logrado el control máximo, ya que la terapia intermitente reinstituida en el momento de la recaída puede ser tan eficaz como el tratamiento continuo.
Se deben utilizar procedimientos para el manejo y la eliminación adecuados de los medicamentos contra el cáncer. Se han publicado varias guías sobre este tema.1-4 No existe un acuerdo general de que todos los procedimientos recomendados en las guías sean necesarios o apropiados.
Poblaciones Especiales
Deterioro hepático
Los pacientes con insuficiencia hepática deben ser monitoreados de cerca por toxicidad. Dado que el clorambucilo se metaboliza principalmente en el hígado, se puede considerar una reducción de la dosis en pacientes con insuficiencia hepática cuando se tratan con LEUKERAN. Sin embargo, no hay datos suficientes en pacientes con insuficiencia hepática para proporcionar una recomendación de dosificación específica.
CÓMO SUMINISTRADO
LEUKERANO se presenta en forma de comprimidos marrones, recubiertos con película, redondos, biconvexos que contienen 2 mg de clorambucilo en frascos de vidrio ámbar con cierres a prueba de niños. Un lado tiene grabado "GX EG3" y el otro lado tiene grabado una "L".
Botella de 25 ( CDN 76388-635-25)
Almacene en un refrigerador, 2° a 8°C (36° a 46°F).
REFERENCIAS
1. Alerta de NIOSH: Prevención de exposiciones ocupacionales a medicamentos antineoplásicos y otros medicamentos peligrosos en entornos de atención médica. 2004. Departamento de Salud y Servicios Humanos de EE. UU., Servicio de Salud Pública, Centros para el Control y la Prevención de Enfermedades, Instituto Nacional para la Seguridad y Salud Ocupacional, DHHS (NIOSH) Publicación No. 2004-165.
2. Manual técnico de OSHA, TED 1-0.15A, Sección VI: Capítulo 2. Control de la exposición ocupacional a medicamentos peligrosos. OSHA, 1999. http://www.osha.gov/dts/osta/otm/otm_vi/otm_vi_2.html
3. Sociedad Americana de Farmacéuticos del Sistema de Salud. Directrices de ASHP sobre el manejo de medicamentos peligrosos. Soy J Salud-Syst Pharm. (2006) 63:1172-1193.
4. Polovich, M., White, JM y Kelleher, LO (eds.) 2005. Pautas y recomendaciones para la práctica de quimioterapia y bioterapia (2.ª ed.) Pittsburgh, PA: Oncology Nursing Society.
Fabricado por: Excella GmbH & Co. KG, Feucht, Alemania. Revisado: marzo de 2017
EFECTOS SECUNDARIOS
Para informar SOSPECHAS DE REACCIONES ADVERSAS, comuníquese con Aspen Global Inc. sin cargo al 1-855-800-8165 o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
hematológico
El efecto secundario más común es la supresión de la médula ósea, anemia, leucopenia, neutropenia, trombocitopenia o pancitopenia. Aunque la supresión de la médula ósea ocurre con frecuencia, generalmente es reversible si el clorambucilo se retira lo suficientemente temprano. Sin embargo, se ha informado insuficiencia irreversible de la médula ósea.
Gastrointestinal
Los trastornos gastrointestinales como náuseas y vómitos, diarrea y ulceración oral ocurren con poca frecuencia.
SNC
Se han informado temblores, espasmos musculares, mioclonía, confusión, agitación, ataxia, paresia flácida y alucinaciones como experiencias adversas raras al clorambucilo que se resuelven al suspender el fármaco. Se han notificado casos raros de convulsiones focales y/o generalizadas tanto en niños como en adultos, tanto en dosis terapéuticas diarias como en regímenes de dosificación en pulsos, y en sobredosis aguda (ver PRECAUCIONES : General ).
dermatológico
Se han informado reacciones alérgicas como urticaria y edema angioneurótico después de la dosificación inicial o posterior. Se ha notificado hipersensibilidad cutánea (incluidos informes raros de erupción cutánea que progresa a eritema multiforme, necrólisis epidérmica tóxica y síndrome de Stevens-Johnson) (ver ADVERTENCIAS ).
Misceláneas
Otras reacciones adversas notificadas incluyen: fibrosis pulmonar, hepatotoxicidad e ictericia, fiebre por fármacos, neuropatía periférica, neumonía intersticial, cistitis estéril, infertilidad, leucemia y neoplasias malignas secundarias (ver ADVERTENCIAS ).

INTERACCIONES CON LA DROGAS
No se conocen interacciones farmacológicas con clorambucilo.
ADVERTENCIAS
Debido a sus propiedades cancerígenas, el clorambucilo no debe administrarse a pacientes con afecciones distintas de la leucemia linfática crónica o los linfomas malignos. Se han observado convulsiones, infertilidad, leucemia y neoplasias malignas secundarias cuando se empleó clorambucilo en el tratamiento de enfermedades malignas y no malignas.
Hay muchos informes de leucemia aguda que surge en pacientes con enfermedades malignas y no malignas después del tratamiento con clorambucilo. En muchos casos, estos pacientes también recibieron otros agentes quimioterapéuticos o alguna forma de radioterapia. No es posible cuantificar el riesgo de inducción de leucemia o carcinoma por clorambucilo en humanos. La evaluación de los informes publicados sobre el desarrollo de leucemia en pacientes que recibieron clorambucilo (y otros agentes alquilantes) sugiere que el riesgo de leucemogénesis aumenta tanto con la cronicidad del tratamiento como con grandes dosis acumuladas. Sin embargo, ha resultado imposible definir una dosis acumulativa por debajo de la cual no haya riesgo de inducción de malignidad secundaria. Los posibles beneficios del tratamiento con clorambucilo deben sopesarse de forma individual frente al posible riesgo de inducción de una neoplasia maligna secundaria.
Se ha demostrado que el clorambucilo causa daño cromático o cromosómico en humanos. Se ha observado esterilidad tanto reversible como permanente en ambos sexos que recibieron clorambucilo.
Se ha documentado una alta incidencia de esterilidad cuando se administra clorambucilo a varones prepúberes y púberes. También se ha observado azoospermia prolongada o permanente en hombres adultos. Si bien la mayoría de los informes de disfunción gonadal secundaria al clorambucilo se han relacionado con hombres, la inducción de amenorrea en mujeres con agentes alquilantes está bien documentada y el clorambucilo es capaz de producir amenorrea. Los estudios de autopsia de los ovarios de mujeres con linfoma maligno tratadas con quimioterapia combinada que incluye clorambucilo han mostrado diversos grados de fibrosis, vasculitis y agotamiento de los folículos primordiales.
Se han informado casos raros de erupción cutánea que progresa a eritema multiforme, necrólisis epidérmica tóxica o síndrome de Stevens-Johnson. El clorambucilo debe interrumpirse de inmediato en pacientes que desarrollen reacciones cutáneas.
El embarazo
Embarazo Categoría D
El clorambucilo puede causar daño fetal cuando se administra a una mujer embarazada. Se ha observado agenesia renal unilateral en 2 crías cuyas madres recibieron clorambucilo durante el primer trimestre. Se encontraron malformaciones urogenitales, incluida la ausencia de un riñón, en fetos de ratas que recibieron clorambucilo. No existen estudios adecuados y bien controlados en mujeres embarazadas. Si este medicamento se usa durante el embarazo, o si la paciente queda embarazada mientras toma este medicamento, se debe informar a la paciente sobre el peligro potencial para el feto. Se debe advertir a las mujeres en edad fértil que eviten quedarse embarazadas.
PRECAUCIONES
General
Muchos pacientes desarrollan una linfopenia lentamente progresiva durante el tratamiento. El recuento de linfocitos por lo general regresa rápidamente a los niveles normales al finalizar la terapia con medicamentos. La mayoría de los pacientes tienen algo de neutropenia después de la tercera semana de tratamiento y esto puede continuar hasta 10 días después de la última dosis. Posteriormente, el recuento de neutrófilos suele volver rápidamente a la normalidad. La neutropenia severa parece estar relacionada con la dosis y generalmente ocurre solo en pacientes que han recibido una dosis total de 6,5 mg/kg o más en un curso de terapia con dosis continua. Se puede esperar que alrededor de una cuarta parte de todos los pacientes que reciben el programa de dosis continua, y un tercio de los que reciben esta dosis en 8 semanas o menos, desarrollen neutropenia grave.
Si bien no es necesario descontinuar el clorambucilo ante la primera evidencia de una caída en el recuento de neutrófilos, se debe recordar que la caída puede continuar durante 10 días después de la última dosis, y que a medida que la dosis total se acerca a 6,5 mg/kg, hay un riesgo de causar daños irreversibles en la médula ósea. La dosis de clorambucilo debe disminuirse si los recuentos de leucocitos o plaquetas caen por debajo de los valores normales y debe interrumpirse en caso de depresión más grave.
El clorambucilo debe no administrarse en dosis completas antes de 4 semanas después de un curso completo de radioterapia o quimioterapia debido a la vulnerabilidad de la médula ósea al daño en estas condiciones. Si los recuentos de leucocitos o plaquetas previos a la terapia están deprimidos debido al proceso de enfermedad de la médula ósea antes de la institución de la terapia, el tratamiento debe instituirse con una dosis reducida.
Los recuentos persistentemente bajos de neutrófilos y plaquetas o la linfocitosis periférica sugieren infiltración de la médula ósea. Si se confirma mediante un examen de médula ósea, la dosis diaria de clorambucilo no debe exceder los 0,1 mg/kg. Clorambucilo parece estar relativamente libre de efectos secundarios gastrointestinales u otra evidencia de toxicidad aparte de la acción depresora de la médula ósea. En humanos, dosis orales únicas de 20 mg o más pueden producir náuseas y vómitos.
Los niños con síndrome nefrótico y los pacientes que reciben dosis altas de clorambucilo pueden tener un mayor riesgo de convulsiones. Al igual que con cualquier fármaco potencialmente epileptógeno, se debe tener precaución al administrar clorambucilo a pacientes con antecedentes de convulsiones o traumatismo craneoencefálico, o que estén recibiendo otros fármacos potencialmente epileptógenos.
Debe evitarse la administración de vacunas vivas a pacientes inmunocomprometidos.
Pruebas de laboratorio
Se debe realizar un seguimiento cuidadoso de los pacientes para evitar daños en la médula ósea que pongan en peligro la vida durante el tratamiento. Se debe realizar un examen semanal de la sangre para determinar los niveles de hemoglobina, los recuentos de leucocitos totales y diferenciales y los recuentos cuantitativos de plaquetas. Además, durante las primeras 3 a 6 semanas de terapia, se recomienda realizar recuentos de glóbulos blancos 3 o 4 días después de cada uno de los hemogramas completos semanales. Galton et al han sugerido que en el seguimiento de los pacientes es útil trazar los recuentos sanguíneos en un gráfico al mismo tiempo que se registran el peso corporal, la temperatura, el tamaño del bazo, etc. Se considera peligroso permitir que un paciente pase más de 2 semanas sin examen hematológico y clínico durante el tratamiento.
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Ver ADVERTENCIAS sección para obtener información sobre la carcinogénesis, la mutagénesis y el deterioro de la fertilidad.
El embarazo
Efectos teratogénicos
Embarazo Categoría D
Ver ADVERTENCIAS sección.
Madres lactantes
No se sabe si este fármaco se excreta en la leche humana. Debido a que muchos medicamentos se excretan en la leche humana y debido a la posibilidad de que el clorambucilo provoque reacciones adversas graves en los lactantes, se debe tomar la decisión de suspender la lactancia o suspender el medicamento, teniendo en cuenta la importancia del medicamento para la madre.
Uso pediátrico
No se ha establecido la seguridad y eficacia en pacientes pediátricos.
Uso geriátrico
Los estudios clínicos de clorambucilo no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes. Otra experiencia clínica informada no ha identificado diferencias en las respuestas entre los ancianos y los pacientes más jóvenes. En general, la selección de la dosis para un paciente de edad avanzada debe ser cautelosa, generalmente comenzando en el extremo inferior del rango de dosificación, lo que refleja la mayor frecuencia de disminución de la función hepática, renal o cardíaca, y de enfermedades concomitantes u otra terapia con medicamentos.
Uso en pacientes con insuficiencia renal
No se ha estudiado formalmente el impacto de la insuficiencia renal en la eliminación del clorambucilo. La eliminación renal del clorambucil inalterado y de sus principales metabolitos activos, la mostaza con ácido fenilacético, representa menos del 1% de la dosis administrada. Además, no fue necesario ajustar la dosis en 2 pacientes en diálisis tratados con clorambucilo. Por lo tanto, no se espera que la insuficiencia renal afecte significativamente la eliminación del clorambucilo.
Uso en pacientes con insuficiencia hepática
No se han realizado estudios formales en pacientes con insuficiencia hepática. Dado que el clorambucilo se metaboliza principalmente en el hígado, los pacientes con insuficiencia hepática deben ser monitoreados de cerca por si presentan toxicidad y se puede considerar una reducción de la dosis en pacientes con insuficiencia hepática cuando son tratados con LEUKERAN (ver DOSIFICACIÓN Y ADMINISTRACIÓN ).
SOBREDOSIS
La pancitopenia reversible fue el principal hallazgo de las sobredosis inadvertidas de clorambucilo. También se ha producido toxicidad neurológica que va desde comportamiento agitado y ataxia hasta múltiples convulsiones de gran mal. Como no existe un antídoto conocido, el cuadro sanguíneo debe controlarse de cerca y se deben instituir medidas generales de apoyo, junto con las transfusiones de sangre apropiadas, si es necesario. El clorambucilo no es dializable.
Las dosis únicas orales de DL50 en ratones son de 123 mg/kg. En ratas, una dosis intraperitoneal única de 12,5 mg/kg de clorambucilo produce los efectos típicos de la mostaza nitrogenada; éstos incluyen atrofia de la membrana mucosa intestinal y de los tejidos linfoides, linfopenia grave que llega a ser máxima en 4 días, anemia y trombocitopenia. Después de esta dosis, los animales comienzan a recuperarse dentro de los 3 días y parecen normales en aproximadamente una semana, aunque es posible que la médula ósea no se normalice por completo durante aproximadamente 3 semanas. Una dosis intraperitoneal de 18,5 mg/kg mata aproximadamente al 50% de las ratas que desarrollan convulsiones. Se han administrado por vía oral hasta 50 mg/kg a ratas como dosis única, con recuperación. Tal dosis causa bradicardia, salivación excesiva, hematuria, convulsiones y disfunción respiratoria.
CONTRAINDICACIONES
El clorambucilo debe no utilizarse en pacientes cuya enfermedad ha demostrado una resistencia previa al agente. Los pacientes que han demostrado hipersensibilidad al clorambucilo no deben recibir el medicamento. Puede haber hipersensibilidad cruzada (erupción cutánea) entre el clorambucilo y otros agentes alquilantes.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
El clorambucilo, un derivado aromático de la mostaza nitrogenada, es un agente alquilante. El clorambucilo interfiere con la replicación del ADN e induce la apoptosis celular a través de la acumulación de p53 citosólico y la posterior activación de Bax, un promotor de la apoptosis.
Farmacocinética
En un estudio de 12 pacientes que recibieron dosis orales únicas de 0,2 mg/kg de LEUKERAN 5 mg, la Cmax plasmática media ajustada a la dosis (±SD) de clorambucilo fue de 492 ± 160 ng/mL, el AUC fue de 883 ± 329 ng.h/mL , la vida media de eliminación media (t½) fue de 1,3 ± 0,5 horas y la Tmax fue de 0,83 ± 0,53 horas. Para el metabolito principal, mostaza con ácido fenilacético (PAAM), la Cmax plasmática media ajustada a la dosis (± DE) fue de 306 ± 73 ng/mL, el AUC fue de 1204 ± 285 ng.h/mL, la t½ media fue de 1,8 ± 0,4 horas , y el Tmax fue de 1,9 ± 0,7 horas.
Después de dosis orales únicas de 0,6 a 1,2 mg/kg, los niveles plasmáticos máximos de clorambucilo (Cmax) se alcanzan en 1 hora y la vida media de eliminación terminal (t ) del fármaco original se estima en 1,5 horas.
Absorción
El clorambucilo se absorbe rápida y completamente (>70%) en el tracto gastrointestinal. De acuerdo con la rápida y predecible absorción de clorambucilo, se ha demostrado que la variabilidad interindividual en la farmacocinética plasmática de clorambucilo es relativamente pequeña luego de dosis orales de entre 15 y 70 mg (variabilidad intrapaciente de 2 veces y una variación de 2 a 4 veces). variabilidad interpaciente en el AUC). La absorción de clorambucilo se reduce cuando se toma después de las comidas. En un estudio de diez pacientes, la ingesta de alimentos aumentó la mediana de Tmax en 2 veces y redujo los valores de Cmax y AUC ajustados a la dosis en un 55 % y un 20 %, respectivamente.
Distribución
El volumen aparente de distribución promedió 0,31 l/kg después de una dosis oral única de 0,2 mg/kg de clorambucilo en 11 pacientes con cáncer y leucemia linfocítica crónica.
El clorambucilo y sus metabolitos se unen ampliamente a las proteínas plasmáticas y tisulares. In vitro, el clorambucilo se une en un 99% a las proteínas plasmáticas, específicamente a la albúmina. No se han determinado los niveles de clorambucilo en el líquido cefalorraquídeo.
Metabolismo
El clorambucilo se metaboliza ampliamente en el hígado principalmente a mostaza con ácido fenilacético, que tiene actividad antineoplásica. El clorambucilo y su principal metabolito sufren degradación oxidativa a derivados monohidroxi y dihidroxi.
Excreción
Después de una dosis única de clorambucilo radiomarcado (14C), aproximadamente del 20% al 60% de la radioactividad aparece en la orina después de 24 horas. De nuevo, menos del 1% de la radiactividad urinaria se encuentra en forma de clorambucilo o mostaza con ácido fenilacético.
INFORMACIÓN DEL PACIENTE
Se debe informar a los pacientes que las principales toxicidades del clorambucilo están relacionadas con hipersensibilidad, fiebre por fármacos, mielosupresión, hepatotoxicidad, infertilidad, convulsiones, toxicidad gastrointestinal y neoplasias malignas secundarias. Nunca se debe permitir que los pacientes tomen el medicamento sin supervisión médica y deben consultar a su médico si experimentan erupción cutánea, sangrado, fiebre, ictericia, tos persistente, convulsiones, náuseas, vómitos, amenorrea o bultos/masas inusuales. Se debe advertir a las mujeres en edad fértil que eviten quedarse embarazadas.
