Neoral 25mg, 100mg Cyclosporine Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Neoral 25mg y cómo se usa?
Neoral 25 mg es un medicamento recetado que se usa como profilaxis para prevenir el rechazo de órganos después del trasplante y para tratar los síntomas de la artritis reumatoide y la psoriasis. Neoral puede usarse solo o con otros medicamentos.
Neoral pertenece a una clase de medicamentos llamados DMARD, inmunomoduladores; inmunosupresores; Inhibidores de calcineurina.
No se sabe si Neoral 25 mg es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Neoral?
Neoral puede causar efectos secundarios graves que incluyen:
- urticaria,
- respiración dificultosa,
- hinchazón de la cara, los labios, la lengua o la garganta,
- problemas con el habla, el pensamiento, la visión o el movimiento muscular,
- embargo,
- dolor de cabeza intenso,
- visión borrosa,
- latidos en el cuello o las orejas,
- piel pálida,
- moretones con facilidad,
- sangrado inusual,
- náuseas,
- debilidad,
- sensación de hormigueo,
- Dolor de pecho,
- latidos irregulares del corazón,
- pérdida de movimiento,
- orinar poco o nada,
- hinchazón en los pies o los tobillos,
- sensación de cansancio,
- dificultad para respirar,
- pérdida de apetito,
- dolor de estómago (parte superior derecha),
- coloración amarillenta de la piel o los ojos,
- fiebre,
- escalofríos,
- sintomas de gripe,
- úlceras de boca,
- llagas en la piel,
- dolor de garganta, y
- tos
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Neoral incluyen:
- temblores o temblores,
- acné,
- aumento del crecimiento del vello facial o corporal,
- aumento de la presión arterial,
- náuseas,
- diarrea, y
- encías hinchadas o dolorosas
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Neoral. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
ADVERTENCIA
Solo los médicos con experiencia en el manejo de la terapia inmunosupresora sistémica para la enfermedad indicada deben prescribir Neoral®. A las dosis utilizadas en el trasplante de órganos sólidos, solo los médicos con experiencia en terapia inmunosupresora y manejo de receptores de trasplantes de órganos deben prescribir Neoral®. Los pacientes que reciben el fármaco deben manejarse en instalaciones equipadas y dotadas de laboratorio adecuado y recursos médicos de apoyo. El médico responsable de la terapia de mantenimiento debe tener la información completa necesaria para el seguimiento del paciente. Neoral®, un inmunosupresor sistémico, puede aumentar la susceptibilidad a la infección y el desarrollo de neoplasia. En pacientes con trasplante de riñón, hígado y corazón, Neoral® puede administrarse con otros agentes inmunosupresores. La mayor susceptibilidad a la infección y el posible desarrollo de linfoma y otras neoplasias pueden resultar del aumento en el grado de inmunosupresión en pacientes trasplantados.
Las cápsulas de gelatina blanda de Neoral® (cápsulas de ciclosporina, USP) MODIFICADAS y la solución oral de Neoral® (solución oral de ciclosporina, USP) MODIFICADA tienen una mayor biodisponibilidad en comparación con las cápsulas de gelatina blanda de Sandimmune® (cápsulas de ciclosporina, USP) y la solución oral de Sandimmune® (solución oral de ciclosporina, USP). solución, USP). Neoral® y Sandimmune® no son bioequivalentes y no se pueden usar indistintamente sin la supervisión de un médico. Para una concentración mínima determinada, la exposición a la ciclosporina será mayor con Neoral® que con Sandimmune®. Si un paciente que está recibiendo dosis excepcionalmente altas de Sandimmune® se cambia a Neoral®, se debe tener especial precaución. Las concentraciones sanguíneas de ciclosporina deben controlarse en pacientes trasplantados y con artritis reumatoide que toman Neoral® para evitar la toxicidad debido a las altas concentraciones. Se deben realizar ajustes de dosis en pacientes trasplantados para minimizar el posible rechazo de órganos debido a las bajas concentraciones. La comparación de las concentraciones en sangre en la literatura publicada con las concentraciones en sangre obtenidas utilizando los ensayos actuales debe hacerse con un conocimiento detallado de los métodos de ensayo empleados.
Para pacientes con psoriasis (consulte también las ADVERTENCIAS EN RECUADRO anteriores)
Los pacientes con psoriasis tratados previamente con PUVA y, en menor medida, con metotrexato u otros agentes inmunosupresores, UVB, alquitrán de hulla o radioterapia, tienen un mayor riesgo de desarrollar tumores malignos de la piel cuando toman Neoral®.
La ciclosporina, el ingrediente activo de Neoral®, en las dosis recomendadas, puede causar hipertensión sistémica y nefrotoxicidad. El riesgo aumenta con el aumento de la dosis y la duración de la terapia con ciclosporina. La disfunción renal, incluido el daño renal estructural, es una consecuencia potencial de la ciclosporina y, por lo tanto, se debe monitorear la función renal durante la terapia.
DESCRIPCIÓN
Neoral® es una formulación oral de ciclosporina que forma inmediatamente una microemulsión en un ambiente acuoso.
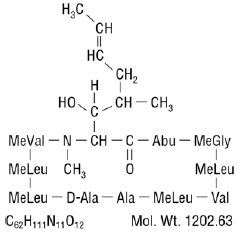
La ciclosporina, el principio activo de Neoral®, es un agente inmunosupresor de polipéptido cíclico que consta de 11 aminoácidos. Es producido como un metabolito por la especie de hongo Beauveria nivea.
Químicamente, la ciclosporina se designa como [R-[R*,R*-(E)]]-cíclico-(L-alanil-D-alanil-N-metil-L-leucilN-metil-L-leucil-N-metil -L-valil-3-hidroxi-N,4-dimetil-L-2-amino-6-octenoil-L-α -aminobutiril-N-metilglicil-N-metil-L-leucil-L-valil-N-metilo -L-leucil).
Las cápsulas de gelatina blanda Neoral® (cápsulas de ciclosporina, USP) MODIFICADAS están disponibles en concentraciones de 25 mg y 100 mg.
Cada cápsula de 25 mg contiene:
ciclosporina………………………………25 mg alcohol, USP deshidratado..........................11,9% v/v (9,5% peso/vol.)
Cada cápsula de 100 mg contiene:
ciclosporina………………………………...100 mg alcohol, USP deshidratado..........................11.9 % v/v (9,5 % p/v)
Ingredientes inactivos: Mono-di-triglicéridos de aceite de maíz, polioxil 40 aceite de ricino hidrogenado NF, DL-αtocoferol USP, gelatina NF, glicerol, óxido de hierro negro, propilenglicol USP, dióxido de titanio USP, carmín y otros ingredientes.
La solución oral de Neoral® (solución oral de ciclosporina, USP) MODIFICADA está disponible en frascos de 50 ml.
Cada ml contiene:
ciclosporina…………………………………………100 mg/mL alcohol, USP deshidratado…… ...........11,9 % v/v (9,5 % peso/vol.)
Ingredientes inactivos: Mono-di-triglicéridos de aceite de maíz, polioxil 40 aceite de ricino hidrogenado NF, DL-α tocoferol USP, propilenglicol USP.
La estructura química de la ciclosporina (también conocida como ciclosporina A) es:
INDICACIONES
Trasplante de riñón, hígado y corazón
Neoral 25 mg está indicado para la profilaxis del rechazo de órganos en trasplantes alogénicos de riñón, hígado y corazón. Neoral 100 mg se ha utilizado en combinación con azatioprina y corticosteroides.
Artritis Reumatoide
Neoral está indicado para el tratamiento de pacientes con artritis reumatoide activa grave en los que la enfermedad no ha respondido adecuadamente al metotrexato. Neoral puede usarse en combinación con metotrexato en pacientes con artritis reumatoide que no responden adecuadamente al metotrexato solo.
Soriasis
Neoral está indicado para el tratamiento de pacientes adultos no inmunocomprometidos con psoriasis en placas grave (es decir, extensa y/o incapacitante), recalcitrante, que no han respondido a al menos una terapia sistémica (p. ej., PUVA, retinoides o metotrexato) o en pacientes para quienes otras terapias sistémicas están contraindicadas o no pueden ser toleradas.
Si bien rara vez ocurre un rebote, la mayoría de los pacientes experimentarán una recaída con Neoral 100 mg al igual que con otras terapias al suspender el tratamiento.
DOSIFICACIÓN Y ADMINISTRACIÓN
Cápsulas de gelatina blanda de 25 mg de Neoral (cápsulas de ciclosporina, USP) MODIFICADAS y solución oral de Neoral (solución oral de ciclosporina, USP) MODIFICADA D
Neoral ha aumentado la biodisponibilidad en comparación con Sandimmune. Neoral 25 mg y Sandimmune no son bioequivalentes y no se pueden usar indistintamente sin la supervisión de un médico.
La dosis diaria de Neoral 100 mg siempre se debe administrar dividida en dos tomas (BID). Se recomienda que Neoral se administre en un horario constante con respecto a la hora del día y en relación con las comidas. La toronja y el jugo de toronja afectan el metabolismo, aumentando la concentración sanguínea de ciclosporina, por lo que deben evitarse.
Poblaciones Específicas
Insuficiencia renal en trasplantes de riñón, hígado y corazón
La ciclosporina experimenta una eliminación renal mínima y su farmacocinética no parece alterarse significativamente en pacientes con enfermedad renal en etapa terminal que reciben tratamientos de hemodiálisis de rutina (ver FARMACOLOGÍA CLÍNICA ). Sin embargo, debido a su potencial nefrotóxico (ver ADVERTENCIAS ), se recomienda una monitorización cuidadosa de la función renal; La dosis de ciclosporina debe reducirse si está indicado (ver ADVERTENCIAS y PRECAUCIONES ).
Insuficiencia renal en artritis reumatoide y psoriasis
Los pacientes con insuficiencia renal no deben recibir ciclosporina (ver CONTRAINDICACIONES , ADVERTENCIAS y PRECAUCIONES ).
Deterioro hepático
El aclaramiento de ciclosporina puede reducirse significativamente en pacientes con enfermedad hepática grave (ver FARMACOLOGÍA CLÍNICA ). Puede ser necesaria una reducción de la dosis en pacientes con insuficiencia hepática grave para mantener las concentraciones sanguíneas dentro del rango objetivo recomendado (ver ADVERTENCIAS y PRECAUCIONES ).
Pacientes recién trasplantados
La dosis oral inicial de Neoral de 25 mg se puede administrar de 4 a 12 horas antes del trasplante o después de la operación. La dosis inicial de Neoral 25mg varía en función del órgano trasplantado y de los demás inmunosupresores incluidos en el protocolo inmunosupresor. En pacientes recién trasplantados, la dosis oral inicial de Neoral es la misma que la dosis oral inicial de Sandimmune. Las dosis iniciales sugeridas están disponibles a partir de los resultados de una encuesta de 1994 sobre el uso de Sandimmune en los centros de trasplante de EE. UU. Las dosis iniciales medias ± DE fueron 9 ± 3 mg/kg/día para pacientes con trasplante renal (75 centros), 8 ± 4 mg/kg/día para pacientes con trasplante hepático (30 centros) y 7 ± 3 mg/kg/día para pacientes trasplantados de corazón (24 centros). Las dosis diarias totales se dividieron en dos dosis diarias iguales. La dosis de Neoral se ajusta posteriormente para alcanzar una concentración sanguínea de ciclosporina predefinida (ver Monitoreo de la concentración en sangre en pacientes trasplantados abajo). Si se utilizan concentraciones mínimas en sangre de ciclosporina, el rango objetivo es el mismo para Neoral 100 mg que para Sandimmune. Usar el mismo rango objetivo de concentración mínima para Neoral 100 mg que para Sandimmune da como resultado una mayor exposición a la ciclosporina cuando se administra Neoral (ver Farmacocinética, Absorción ). La dosificación debe ajustarse en función de las evaluaciones clínicas de rechazo y tolerabilidad. Las dosis más bajas de Neoral de 100 mg pueden ser suficientes como terapia de mantenimiento.
Inicialmente se recomienda la terapia adjunta con corticosteroides suprarrenales. Diferentes esquemas de dosificación gradual de prednisona parecen lograr resultados similares. Un programa de dosificación representativo basado en el peso del paciente comenzó con 2,0 mg/kg/día durante los primeros 4 días y se redujo a 1,0 mg/kg/día en 1 semana, 0,6 mg/kg/día en 2 semanas, 0,3 mg/kg/día por 1 mes, y 0,15 mg/kg/día por 2 meses y posteriormente como dosis de mantenimiento. Las dosis de esteroides pueden reducirse aún más de forma individualizada según el estado del paciente y la función del injerto. Se deben realizar ajustes en la dosis de prednisona de acuerdo con la situación clínica.
Conversión de Sandimmune a Neoral 25 mg en pacientes trasplantados
En pacientes trasplantados que se consideran para la conversión a Neoral desde Sandimmune, Neoral debe comenzar con la misma dosis diaria que se usó previamente con Sandimmune (conversión de dosis 1:1). La dosis de Neoral debe ajustarse posteriormente para alcanzar la concentración mínima de ciclosporina en sangre previa a la conversión. Usar el mismo rango objetivo de concentración mínima para Neoral 100 mg que para Sandimmune da como resultado una mayor exposición a la ciclosporina cuando se administra Neoral (ver Farmacocinética, Absorción ). Los pacientes con sospecha de mala absorción de Sandimmune requieren diferentes estrategias de dosificación (ver Pacientes trasplantados con mala absorción de Sandimmune, abajo). En algunos pacientes, el aumento de la concentración mínima en sangre es más pronunciado y puede tener importancia clínica.
Hasta que la concentración mínima en sangre alcance el valor anterior a la conversión, se recomienda encarecidamente controlar la concentración mínima en sangre de ciclosporina cada 4 a 7 días después de la conversión a Neoral. Además, los parámetros de seguridad clínica, como la creatinina sérica y la presión arterial, deben controlarse cada dos semanas durante los primeros dos meses después de la conversión. Si las concentraciones mínimas en sangre están fuera del rango deseado y/o si los parámetros de seguridad clínica empeoran, la dosis de Neoral 100 mg debe ajustarse en consecuencia.
Pacientes trasplantados con mala absorción de Sandimmune
Los pacientes con concentraciones mínimas de ciclosporina en sangre inferiores a las esperadas en relación con la dosis oral de Sandimmune pueden tener una absorción deficiente o inconsistente de la ciclosporina de Sandimmune. Después de la conversión a Neoral, los pacientes tienden a tener concentraciones más altas de ciclosporina. Debido al aumento de la biodisponibilidad de la ciclosporina luego de la conversión a Neoral, la concentración mínima de ciclosporina en sangre puede exceder el rango objetivo. Se debe tener especial precaución al convertir a los pacientes a Neoral 100 mg en dosis superiores a 10 mg/kg/día. La dosis de Neoral debe titularse individualmente en función de las concentraciones mínimas de ciclosporina, la tolerabilidad y la respuesta clínica. En esta población, la concentración mínima de ciclosporina en sangre debe medirse con mayor frecuencia, al menos dos veces por semana (diariamente, si la dosis inicial supera los 10 mg/kg/día) hasta que la concentración se estabilice dentro del rango deseado.
Artritis Reumatoide
La dosis inicial de Neoral es de 2,5 mg/kg/día, dos veces al día en una dosis oral dividida (BID). Se pueden continuar los salicilatos, los AINE y los corticosteroides orales (ver ADVERTENCIAS y PRECAUCIONES , INTERACCIONES CON LA DROGAS ). El inicio de la acción generalmente ocurre entre 4 y 8 semanas. Si se observa un beneficio clínico insuficiente y la tolerabilidad es buena (incluida la creatinina sérica inferior al 30 % por encima del valor inicial), la dosis puede aumentarse de 0,5 a 0,75 mg/kg/día después de 8 semanas y nuevamente después de 12 semanas hasta un máximo de 4 mg. /kg/día. Si no se observa ningún beneficio a las 16 semanas de tratamiento, se debe interrumpir el tratamiento con Neoral 25 mg.
Las disminuciones de dosis del 25% al 50% se deben hacer en cualquier momento para controlar los eventos adversos, por ejemplo, elevaciones de la hipertensión en la creatinina sérica (30% por encima del nivel previo al tratamiento del paciente) o anomalías de laboratorio clínicamente significativas (ver ADVERTENCIAS y PRECAUCIONES ).
Si la reducción de la dosis no es eficaz para controlar las anomalías o si el evento adverso o la anomalía es grave, se debe interrumpir el tratamiento con Neoral 25 mg. Se debe usar la misma dosis inicial y rango de dosis si Neoral 25 mg se combina con la dosis recomendada de metotrexato. La mayoría de los pacientes pueden ser tratados con dosis de 25 mg de Neoral de 3 mg/kg/día o menos cuando se combinan con dosis de metotrexato de hasta 15 mg/semana (ver FARMACOLOGÍA CLÍNICA , Ensayos clínicos ).
Hay datos limitados de tratamiento a largo plazo. La recurrencia de la actividad de la enfermedad de la artritis reumatoide es generalmente evidente dentro de las 4 semanas posteriores a la interrupción de la ciclosporina.
Soriasis
La dosis inicial de Neoral 100 mg debe ser de 2,5 mg/kg/día. Neoral debe tomarse dos veces al día, en una dosis oral dividida (1,25 mg/kg dos veces al día). Los pacientes deben mantenerse en esa dosis durante al menos 4 semanas, salvo eventos adversos. Si no se ha producido una mejoría clínica significativa en los pacientes en ese momento, la dosis del paciente debe aumentarse a intervalos de 2 semanas. Según la respuesta del paciente, se deben realizar aumentos de dosis de aproximadamente 0,5 mg/kg/día hasta un máximo de 4,0 mg/kg/día.
Las disminuciones de dosis del 25 % al 50 % deben realizarse en cualquier momento para controlar los eventos adversos, por ejemplo, hipertensión, elevaciones de la creatinina sérica (≥ 25 % por encima del nivel previo al tratamiento del paciente) o anomalías de laboratorio clínicamente significativas. Si la reducción de la dosis no es efectiva para controlar las anormalidades, o si el evento adverso o la anormalidad es grave, se debe suspender Neoral 25 mg (ver Seguimiento Especial De Pacientes Con Psoriasis ).
Los pacientes generalmente muestran alguna mejoría en las manifestaciones clínicas de la psoriasis en 2 semanas. El control satisfactorio y la estabilización de la enfermedad pueden tardar de 12 a 16 semanas en lograrse. Los resultados de un ensayo clínico de titulación de dosis con Neoral 25 mg indican que se logró una mejora de la psoriasis del 75 % o más (basado en PASI) en el 51 % de los pacientes después de 8 semanas y en el 79 % de los pacientes después de 16 semanas. El tratamiento debe suspenderse si no se puede lograr una respuesta satisfactoria después de 6 semanas a 4 mg/kg/día o la dosis máxima tolerada por el paciente. Una vez que un paciente está adecuadamente controlado y parece estable, la dosis de Neoral 25 mg debe reducirse y el paciente debe tratarse con la dosis más baja que mantenga una respuesta adecuada (esto no necesariamente debe ser la eliminación total del paciente). En ensayos clínicos, las dosis de ciclosporina en el extremo inferior del rango de dosis recomendado fueron efectivas para mantener una respuesta satisfactoria en el 60 % de los pacientes. Las dosis inferiores a 2,5 mg/kg/día también pueden ser igualmente eficaces.
Al suspender el tratamiento con ciclosporina, la recaída ocurrirá en aproximadamente 6 semanas (50% de los pacientes) a 16 semanas (75% de los pacientes). En la mayoría de los pacientes no se produce rebote tras la interrupción del tratamiento con ciclosporina. Se han notificado trece casos de transformación de psoriasis crónica en placas a formas más graves de psoriasis. Hubo 9 casos de psoriasis pustulosa y 4 casos de psoriasis eritrodérmica. La experiencia a largo plazo con Neoral en pacientes con psoriasis es limitada y no se recomienda el tratamiento continuo durante períodos prolongados superiores a un año. Se debe considerar la alternancia con otras formas de tratamiento en el manejo a largo plazo de pacientes con esta enfermedad de por vida.
Solución oral de 25 mg de Neoral (solución oral de ciclosporina, USP) MODIFICADA - Recomendaciones para la administración
Para que la solución oral de 25 mg de Neoral (solución oral de ciclosporina, USP) MODIFICADA sea más apetecible, debe diluirse con jugo de naranja o manzana a temperatura ambiente. Los pacientes deben evitar cambiar de diluyente con frecuencia. El jugo de toronja afecta el metabolismo de la ciclosporina y debe evitarse. La combinación de Neoral solución con leche puede resultar desagradable. No se ha evaluado el efecto de la leche sobre la biodisponibilidad de la ciclosporina cuando se administra como solución oral Neoral de 100 mg.
Tome la cantidad recetada de Neoral 25 mg Solución oral (solución oral de ciclosporina, USP) MODIFICADA del envase usando la jeringa dosificadora suministrada, después de quitar la cubierta protectora, y transfiera la solución a un vaso de jugo de naranja o manzana. Revuelva bien y beba de inmediato. No permita que la solución oral diluida repose antes de beberla. Utilice un recipiente de vidrio (no de plástico). Enjuague el vaso con más diluyente para asegurarse de que se consuma la dosis total. Después del uso, seque el exterior de la jeringa dosificadora con una toalla limpia y vuelva a colocar la cubierta protectora. No enjuague la jeringa dosificadora con agua u otros agentes de limpieza. Si la jeringa requiere limpieza, debe estar completamente seca antes de volver a usarla.
Monitoreo de la concentración en sangre en pacientes trasplantados
Los centros de trasplante han descubierto que el control de la concentración sanguínea de ciclosporina es un componente esencial del tratamiento del paciente. De importancia para el análisis de la concentración en sangre son el tipo de ensayo utilizado, el órgano trasplantado y otros agentes inmunosupresores que se administren. Si bien no se ha establecido una relación fija, el control de la concentración en sangre puede ayudar en la evaluación clínica del rechazo y la toxicidad, los ajustes de dosis y la evaluación del cumplimiento.
Se han utilizado varios ensayos para medir las concentraciones sanguíneas de ciclosporina. Los estudios más antiguos que utilizaron un ensayo no específico a menudo citaron concentraciones que eran aproximadamente el doble de las de los ensayos específicos. Por lo tanto, la comparación entre las concentraciones en la literatura publicada y la concentración de un paciente individual utilizando los ensayos actuales debe realizarse con un conocimiento detallado de los métodos de ensayo empleados. Los resultados de los ensayos actuales tampoco son intercambiables y su uso debe guiarse por su etiquetado aprobado. Una discusión de los diferentes métodos de ensayo se encuentra en Annals of Clinical Biochemistry 1994; 31: 420-446. Si bien se dispone de varios ensayos y matrices de ensayo, existe consenso en que los ensayos específicos del compuesto original se correlacionan mejor con los eventos clínicos. De estos, HPLC es la referencia estándar, pero los anticuerpos monoclonales RIA y los anticuerpos monoclonales FPIA ofrecen sensibilidad, reproducibilidad y conveniencia. La mayoría de los médicos basan su seguimiento en las concentraciones mínimas de ciclosporina. Applied Pharmacokinetics, Principles of Therapeutic Drug Monitoring (1992) contiene una amplia discusión sobre la farmacocinética de la ciclosporina y las técnicas de monitorización de fármacos. La monitorización de la concentración en sangre no sustituye a la monitorización de la función renal ni a las biopsias de tejido.
CÓMO SUMINISTRADO
Cápsulas de gelatina blanda Neoral® (Cápsulas de ciclosporina, USP) MODIFICADO
25 miligramos
Ovalado, gris azulado impreso en rojo, "Neoral" sobre "25 mg".
Envases de 30 blisters monodosis ( CDN 0078-0246-15).
100 miligramos
Oblongo, gris azulado impreso en rojo, "NEORAL" sobre "100 mg".
Envases de 30 blisters monodosis ( CDN 0078-0248-15).
almacenar y dispensar
En el envase original de dosis unitaria a temperatura ambiente controlada de 68 °F a 77 °F (20 °C a 25 °C).
Solución oral de Neoral® (solución oral de ciclosporina, USP) MODIFICADA
Líquido transparente de color amarillo suministrado en frascos de 50 ml que contienen 100 mg/ml ( CDN 0078-0274-22).
almacenar y dispensar
En el envase original a temperatura ambiente controlada de 68°F a 77°F (20° a 25°C). No almacenar en el refrigerador. Una vez abierto, el contenido debe utilizarse en el plazo de dos meses. A temperaturas inferiores a 20 °C (68 °F), la solución puede gelificarse; también puede ocurrir una floculación ligera o la formación de un sedimento ligero. No hay impacto en el rendimiento del producto o la dosificación con la jeringa provista. Deje que alcance la temperatura ambiente de 25 °C (77 °F) para revertir estos cambios.
Cápsulas de gelatina blanda Neoral® (cápsulas de ciclosporina, USP) MODIFICADO
Solución oral de Neoral® (solución oral de ciclosporina, USP) MODIFICADA
Distribuido por: Novartis Pharmaceuticals Corporation, East Hanover, New Jersey 07936. Revisado en junio de 2021.
EFECTOS SECUNDARIOS
Trasplante de riñón, hígado y corazón
Las principales reacciones adversas de la terapia con ciclosporina son disfunción renal, temblor, hirsutismo, hipertensión e hiperplasia de las encías.
Hipertensión
La hipertensión, que suele ser de leve a moderada, puede ocurrir en aproximadamente el 50 % de los pacientes después de un trasplante renal y en la mayoría de los pacientes con trasplante cardíaco.
Trombosis Capilar Glomerular
Se ha encontrado trombosis capilar glomerular en pacientes tratados con ciclosporina y puede progresar hasta falla del injerto. Los cambios patológicos se asemejaron a los observados en el síndrome urémico hemolítico e incluyeron trombosis de la microvasculatura renal, con trombos de plaquetas y fibrina que ocluyen los capilares glomerulares y las arteriolas aferentes, anemia hemolítica microangiopática, trombocitopenia y disminución de la función renal. Se han observado hallazgos similares cuando se han empleado otros inmunosupresores después del trasplante.
Hipomagnesemia
Se ha informado hipomagnesemia en algunos pacientes, pero no en todos, que presentaron convulsiones mientras recibían terapia con ciclosporina. Aunque los estudios de depleción de magnesio en sujetos normales sugieren que la hipomagnesemia está asociada con trastornos neurológicos, múltiples factores, que incluyen hipertensión, dosis altas de metilprednisolona, hipocolesterolemia y nefrotoxicidad asociada con concentraciones plasmáticas altas de ciclosporina, parecen estar relacionados con las manifestaciones neurológicas de la toxicidad de la ciclosporina.
INTERACCIONES CON LA DROGAS
Efecto de fármacos y otros agentes sobre la farmacocinética y/o seguridad de la ciclosporina
Todos los medicamentos individuales citados a continuación están bien fundamentados para interactuar con la ciclosporina. Además, el uso concomitante de AINE con ciclosporina, particularmente en caso de deshidratación, puede potenciar la disfunción renal. Se debe tener precaución al usar otros medicamentos que se sabe que alteran la función renal (ver ADVERTENCIAS , nefrotoxicidad ).
Fármacos que pueden potenciar la disfunción renal
Durante el uso concomitante de un fármaco que pueda presentar insuficiencia renal aditiva o sinérgica con la ciclosporina, se debe realizar un estrecho control de la función renal (en particular, la creatinina sérica). Si se produce un deterioro significativo de la función renal, se debe reducir la dosis del fármaco coadministrado o considerar un tratamiento alternativo.
La ciclosporina se metaboliza ampliamente por las isoenzimas CYP 3A, en particular CYP3A4, y es un sustrato de la glicoproteína P transportadora de eflujo de múltiples fármacos. Se sabe que varios agentes aumentan o disminuyen las concentraciones de ciclosporina en plasma o sangre total, generalmente mediante la inhibición o inducción de CYP3A4 o del transportador de glicoproteína P o ambos. Deben evitarse los compuestos que disminuyen la absorción de ciclosporina, como el orlistat. Es esencial ajustar la dosis de Neoral 100 mg para lograr las concentraciones de ciclosporina deseadas cuando se usan concomitantemente medicamentos que alteran significativamente las concentraciones de ciclosporina (ver B Monitoreo de concentración de sangre ).
1. Fármacos que aumentan las concentraciones de ciclosporina
Inhibidores de la proteasa del VIH
Se sabe que los inhibidores de la proteasa del VIH (p. ej., indinavir, nelfinavir, ritonavir y saquinavir) inhiben el citocromo P-450 3A y, por lo tanto, podrían aumentar potencialmente las concentraciones de ciclosporina; sin embargo, no se dispone de estudios formales de la interacción. Se debe tener cuidado cuando estos medicamentos se administran de forma concomitante.
Jugo de uva
La toronja y el jugo de toronja afectan el metabolismo, aumentando las concentraciones sanguíneas de ciclosporina, por lo que deben evitarse.
2. Medicamentos/suplementos dietéticos que disminuyen las concentraciones de ciclosporina
bosentán
La coadministración de bosentan (250 a 1000 mg cada 12 horas según la tolerabilidad) y ciclosporina (300 mg cada 12 horas durante 2 días y luego dosificación para lograr una Cmax de 200 a 250 ng/mL) durante 7 días en sujetos sanos resultó en disminuciones en el AUC normalizado por dosis media de ciclosporina, la Cmax y la concentración mínima de aproximadamente 50 %, 30 % y 60 %, respectivamente, en comparación con cuando se administró ciclosporina sola (ver Efecto de la ciclosporina sobre la farmacocinética y/o la seguridad de otros fármacos o agentes ). Debe evitarse la coadministración de ciclosporina con bosentan.
boceprevir
La coadministración de boceprevir (800 mg tres veces al día durante 7 días) y ciclosporina (dosis única de 100 mg) en sujetos sanos resultó en aumentos en el AUC medio y la Cmax de ciclosporina de aproximadamente 2,7 veces y 2 veces, respectivamente, en comparación con ciclosporina se dio solo.
telaprevir
La coadministración de telaprevir (750 mg cada 8 horas durante 11 días) con ciclosporina (10 mg en el día 8) en sujetos sanos resultó en aumentos en el AUC normalizado por dosis media y la Cmax de ciclosporina aproximadamente 4,5 veces y 1,3 veces, respectivamente. en comparación con cuando la ciclosporina (dosis única de 100 mg) se administró sola.
Hierba de San Juan
Ha habido informes de una interacción farmacológica grave entre la ciclosporina y el suplemento dietético herbal St. John's Wort. Se ha informado que esta interacción produce una marcada reducción en las concentraciones sanguíneas de ciclosporina, lo que resulta en niveles subterapéuticos, rechazo de órganos trasplantados y pérdida del injerto.
rifabutina
Se sabe que la rifabutina aumenta el metabolismo de otros fármacos metabolizados por el sistema del citocromo P-450. No se ha estudiado la interacción entre rifabutina y ciclosporina. Se debe tener cuidado cuando estos dos fármacos se administran de forma concomitante.
Efecto de la ciclosporina sobre la farmacocinética y/o la seguridad de otros fármacos o agentes
La ciclosporina es un inhibidor de CYP3A4 y de múltiples transportadores de salida de fármacos (p. ej., glicoproteína P) y puede aumentar las concentraciones plasmáticas de comedicaciones que son sustratos de CYP3A4, glicoproteína P o proteínas transportadoras de aniones orgánicos.
La ciclosporina puede reducir la depuración de digoxina, colchicina, prednisolona, inhibidores de la HMG-CoA reductasa (estatinas) y aliskiren, bosentan, dabigatrán, repaglinida, AINE, sirolimus, etopósido y otros fármacos.
Consulte la información de prescripción completa del otro medicamento para obtener más información y recomendaciones específicas. La decisión sobre la coadministración de ciclosporina con otros medicamentos o agentes debe tomarla el proveedor de atención médica luego de una evaluación cuidadosa de los beneficios y riesgos.
Digoxina
Se ha observado toxicidad digitálica grave a los pocos días de iniciar la ciclosporina en varios pacientes que toman digoxina. Si se usa digoxina junto con ciclosporina, se deben controlar las concentraciones séricas de digoxina.
colchicina
Hay informes sobre el potencial de la ciclosporina para potenciar los efectos tóxicos de la colchicina, como la miopatía y la neuropatía, especialmente en pacientes con disfunción renal. La administración concomitante de ciclosporina y colchicina produce aumentos significativos en las concentraciones plasmáticas de colchicina. Si se usa colchicina al mismo tiempo que ciclosporina, se recomienda una reducción de la dosis de colchicina.
Inhibidores de la HMG-CoA reductasa (estatinas)
Se han informado casos de miotoxicidad, incluidos dolor y debilidad muscular, miositis y rabdomiólisis, en la literatura y posteriores a la comercialización, con la administración concomitante de ciclosporina con lovastatina, simvastatina, atorvastatina, pravastatina y, rara vez, fluvastatina. Cuando se administra simultáneamente con ciclosporina, la dosis de estas estatinas debe reducirse de acuerdo con las recomendaciones de la etiqueta. El tratamiento con estatinas debe suspenderse o interrumpirse temporalmente en pacientes con signos y síntomas de miopatía o aquellos con factores de riesgo que predisponen a una lesión renal grave, incluida la insuficiencia renal, secundaria a rabdomiólisis.
repaglinida
La ciclosporina puede aumentar las concentraciones plasmáticas de repaglinida y, por lo tanto, aumentar el riesgo de hipoglucemia. En 12 sujetos masculinos sanos que recibieron dos dosis de 100 mg de ciclosporina en cápsulas por vía oral con 12 horas de diferencia con una dosis única de 0,25 mg de repaglinida en comprimidos (la mitad de un comprimido de 0,5 mg) por vía oral 13 horas después de la dosis inicial de ciclosporina, la Cmax media de repaglinida y AUC aumentaron 1,8 veces (rango: 0,6 a 3,7 veces) y 2,4 veces (rango 1,2 a 5,3 veces), respectivamente. Se recomienda un control estricto del nivel de glucosa en sangre para un paciente que toma ciclosporina y repaglinida concomitantemente.
Ambrisentán
La coadministración de ambrisentan (5 mg diarios) y ciclosporina (100 a 150 mg dos veces al día inicialmente, luego dosificación para lograr una Cmax de 150 a 200 ng/ml) durante 8 días en sujetos sanos resultó en aumentos medios en el AUC y la Cmax de ambrisentan de aproximadamente 2- veces y 1,5 veces, respectivamente, en comparación con ambrisentan solo. Cuando se coadministre ambrisentan con ciclosporina, la dosis de ambrisentan no debe ajustarse a la dosis diaria máxima recomendada.
Antibióticos de antraciclina
Las dosis altas de ciclosporina (p. ej., una dosis intravenosa inicial de 16 mg/kg/día) pueden aumentar la exposición a los antibióticos de antraciclina (p. ej., doxorrubicina, mitoxantrona, daunorrubicina) en pacientes con cáncer.
Aliskirén
La ciclosporina altera la farmacocinética de aliskiren, un sustrato de la glicoproteína P y CYP3A4. En 14 sujetos sanos que recibieron concomitantemente dosis únicas de ciclosporina (200 mg) y dosis reducidas de aliskiren (75 mg), la Cmáx media de aliskiren aumentó aproximadamente 2,5 veces (IC del 90 %: 1,96 a 3,17) y el AUC medio aumentó aproximadamente 4,3 veces (IC del 90 %: 3,52 a 5,21), en comparación con cuando estos sujetos recibieron aliskireno solo. La administración concomitante de aliskiren con ciclosporina prolongó la mediana de la vida media de eliminación de aliskiren (26 horas frente a 43 a 45 horas) y la Tmax (0,5 horas frente a 1,5 a 2,0 horas). El AUC y la Cmax medias de la ciclosporina fueron comparables a los valores publicados en la literatura. La coadministración de ciclosporina y aliskiren en estos sujetos también dio como resultado un aumento en el número y/o la intensidad de los eventos adversos, principalmente dolor de cabeza, sofocos, náuseas, vómitos y somnolencia. No se recomienda la coadministración de ciclosporina con aliskiren.
bosentán
En sujetos sanos, la coadministración de bosentan y ciclosporina dio como resultado aumentos medios dependientes del tiempo en la dosis normalizada.
concentraciones mínimas de bosentan (es decir, aproximadamente 21 veces el día 1 y 2 veces el día 8 (estado estacionario)) en comparación con cuando se administró bosentan solo como una dosis única el día 1 (ver Efecto de fármacos y otros agentes sobre la farmacocinética y/o seguridad de la ciclosporina ). Debe evitarse la coadministración de ciclosporina con bosentan.
dabigatrán
No se ha estudiado formalmente el efecto de la ciclosporina sobre las concentraciones de dabigatrán. La administración concomitante de dabigatrán y ciclosporina puede provocar un aumento de las concentraciones plasmáticas de dabigatrán debido a la actividad inhibidora de la P-gp de la ciclosporina. Debe evitarse la coadministración de ciclosporina con dabigatrán.
Diuréticos ahorradores de potasio
La ciclosporina no debe usarse con diuréticos ahorradores de potasio porque puede ocurrir hiperpotasemia. También se requiere precaución cuando la ciclosporina se coadministra con medicamentos ahorradores de potasio (p. ej., inhibidores de la enzima convertidora de angiotensina, antagonistas del receptor de angiotensina II), medicamentos que contienen potasio, así como en pacientes con una dieta rica en potasio. Es aconsejable el control de los niveles de potasio en estas situaciones.
Interacciones de medicamentos antiinflamatorios no esteroideos (AINE)
El estado clínico y la creatinina sérica deben controlarse de cerca cuando se usa ciclosporina con AINE en pacientes con artritis reumatoide (ver ADVERTENCIAS ).
Se ha informado que ocurren interacciones farmacodinámicas entre la ciclosporina y el naproxeno y el sulindaco, en el sentido de que el uso concomitante se asocia con disminuciones aditivas en la función renal, según lo determinado por las depuraciones de PAH de 99mTc-dietilentriaminopentaacético (DTPA) y (ácido p-aminohipúrico). Aunque la administración concomitante de diclofenaco no afecta las concentraciones sanguíneas de ciclosporina, se ha asociado con una duplicación aproximada de las concentraciones sanguíneas de diclofenaco y reportes ocasionales de disminuciones reversibles en la función renal. En consecuencia, la dosis de diclofenaco debe estar en el extremo inferior del rango terapéutico.
Interacción de metotrexato
Los datos preliminares indican que cuando se administraron conjuntamente metotrexato y ciclosporina a pacientes con artritis reumatoide (N = 20), las concentraciones de metotrexato (AUC) aumentaron aproximadamente un 30 % y las concentraciones (AUC) de su metabolito, 7-hidroxi metotrexato, disminuyeron aproximadamente un 80 %. % Se desconoce el significado clínico de esta interacción. Las concentraciones de ciclosporina no parecen haber sido alteradas (N = 6).
Sirolimus
Se observaron elevaciones en la creatinina sérica en estudios que utilizaron sirolimus en combinación con ciclosporina a dosis completa. Este efecto suele ser reversible con la reducción de la dosis de ciclosporina. La coadministración simultánea de ciclosporina aumenta significativamente los niveles sanguíneos de sirolimus. Para minimizar los aumentos en las concentraciones de sirolimus, se recomienda administrar sirolimus 4 horas después de la administración de ciclosporina.
nifedipina
Se ha informado hiperplasia gingival frecuente cuando se administra nifedipino junto con ciclosporina. Debe evitarse el uso concomitante de nifedipino en pacientes en los que se desarrolle hiperplasia gingival como efecto secundario de la ciclosporina.
Metilprednisolona
Se han notificado convulsiones cuando se administran dosis altas de metilprednisolona junto con ciclosporina.
Otros fármacos y agentes inmunosupresores
Los pacientes con psoriasis que reciben otros agentes inmunosupresores o radioterapia (incluidos PUVA y UVB) no deben recibir ciclosporina concomitante debido a la posibilidad de una inmunosupresión excesiva.
Efecto de la ciclosporina sobre la eficacia de las vacunas vivas
Durante el tratamiento con ciclosporina, la vacunación puede ser menos eficaz. Debe evitarse el uso de vacunas vivas.
Para obtener información adicional sobre las interacciones farmacológicas de la ciclosporina, comuníquese con el Departamento de Asuntos Médicos de Novartis al 1-888-NOW-NOVA [1-888-669-6682].
ADVERTENCIAS
(Ver también ADVERTENCIA EN CAJA )
Todos los pacientes
La ciclosporina, el ingrediente activo de Neoral 25 mg, puede causar nefrotoxicidad y hepatotoxicidad. El riesgo aumenta con dosis crecientes de ciclosporina. La disfunción renal, incluido el daño renal estructural, es una consecuencia potencial de Neoral 100 mg y, por lo tanto, se debe controlar la función renal durante la terapia. Se debe tener cuidado al usar ciclosporina con medicamentos nefrotóxicos. (ver PRECAUCIONES ).
Los pacientes que reciben Neoral requieren un control frecuente de la creatinina sérica (ver Seguimiento especial por debajo DOSIFICACIÓN Y ADMINISTRACIÓN ). Los pacientes de edad avanzada deben controlarse con especial cuidado, ya que con la edad también se producen disminuciones de la función renal. Si los pacientes no se monitorean adecuadamente y las dosis no se ajustan adecuadamente, la terapia con ciclosporina puede estar asociada con la aparición de daño renal estructural y disfunción renal persistente.
Se puede producir un aumento de la creatinina sérica y del BUN durante el tratamiento con Neoral, lo que refleja una reducción de la tasa de filtración glomerular. El deterioro de la función renal en cualquier momento requiere una estrecha vigilancia y puede estar indicado un ajuste frecuente de la dosis. La frecuencia y la gravedad de las elevaciones de la creatinina sérica aumentan con la dosis y la duración del tratamiento con ciclosporina. Es probable que estas elevaciones se vuelvan más pronunciadas sin la reducción de la dosis o la interrupción.
Debido a que Neoral 100 mg no es bioequivalente a Sandimmune, la conversión de Neoral a Sandimmune usando una proporción de 1:1 (mg/kg/día) puede resultar en concentraciones sanguíneas de ciclosporina más bajas. La conversión de Neoral a Sandimmune debe realizarse con un mayor control para evitar la posibilidad de una infradosificación.
Trasplante de riñón, hígado y corazón
nefrotoxicidad
La ciclosporina, el ingrediente activo de Neoral, puede causar nefrotoxicidad y hepatotoxicidad cuando se usa en dosis altas. No es inusual que los niveles séricos de creatinina y BUN se eleven durante la terapia con ciclosporina. Estas elevaciones en pacientes con trasplante renal no necesariamente indican rechazo, y cada paciente debe ser evaluado completamente antes de iniciar el ajuste de dosis.
Según la experiencia histórica de Sandimmune con la solución oral, se observó nefrotoxicidad asociada con la ciclosporina en el 25 % de los casos de trasplante renal, el 38 % de los casos de trasplante cardíaco y el 37 % de los casos de trasplante hepático. La nefrotoxicidad leve generalmente se observó de 2 a 3 meses después del trasplante renal y consistió en una detención en la caída de las elevaciones preoperatorias de BUN y creatinina en un rango de 35 a 45 mg/dL y 2,0 a 2,5 mg/dL, respectivamente. Estas elevaciones a menudo respondieron a la reducción de la dosis de ciclosporina.
Se observó una nefrotoxicidad más evidente poco después del trasplante y se caracterizó por un aumento rápido del BUN y la creatinina. Dado que estos eventos son similares a los episodios de rechazo renal, se debe tener cuidado para diferenciarlos. Esta forma de nefrotoxicidad generalmente responde a la reducción de la dosis de ciclosporina.
Aunque no se han encontrado criterios diagnósticos específicos que diferencien de forma fiable el rechazo del injerto renal de la toxicidad por fármacos, una serie de parámetros se han asociado significativamente con uno u otro. Cabe señalar, sin embargo, que hasta un 20% de los pacientes pueden tener nefrotoxicidad y rechazo simultáneos.
Una forma de nefropatía asociada a la ciclosporina se caracteriza por un deterioro en serie de la función renal y cambios morfológicos en los riñones. Del 5% al 15% de los receptores de trasplantes que han recibido ciclosporina no mostrarán una reducción en el aumento de la creatinina sérica a pesar de una disminución o interrupción de la terapia con ciclosporina. Las biopsias renales de estos pacientes demostrarán una o varias de las siguientes alteraciones: vacuolización tubular, microcalcificaciones tubulares, congestión capilar peritubular, arteriolopatía y una forma de fibrosis intersticial estriada con atrofia tubular. Aunque ninguno de estos cambios morfológicos es completamente específico, un diagnóstico de nefrotoxicidad estructural asociada con ciclosporina requiere evidencia de estos hallazgos.
Cuando se considera el desarrollo de nefropatía asociada a ciclosporina, cabe destacar que varios autores han informado una asociación entre la aparición de fibrosis intersticial y dosis acumuladas más altas o concentraciones mínimas circulantes persistentemente altas de ciclosporina. Esto es particularmente cierto durante los primeros 6 meses posteriores al trasplante cuando la dosis tiende a ser más alta y cuando, en los receptores de riñón, el órgano parece ser más vulnerable a los efectos tóxicos de la ciclosporina. Entre otros factores que contribuyen al desarrollo de fibrosis intersticial en estos pacientes se encuentran el tiempo de perfusión prolongado, el tiempo de isquemia caliente, así como episodios de toxicidad aguda y rechazo agudo y crónico. Aún no se ha determinado la reversibilidad de la fibrosis intersticial y su correlación con la función renal. Se ha informado la reversibilidad de la arteriolopatía después de suspender la ciclosporina o reducir la dosis.
El deterioro de la función renal en cualquier momento requiere una estrecha vigilancia y puede estar indicado un ajuste frecuente de la dosis.
En caso de rechazo severo e incesante, cuando la terapia de rescate con esteroides en pulsos y anticuerpos monoclonales no logra revertir el episodio de rechazo, puede ser preferible cambiar a una terapia inmunosupresora alternativa en lugar de aumentar la dosis de Neoral a concentraciones sanguíneas excesivas.
Debido al potencial de deterioro aditivo o sinérgico de la función renal, se debe tener precaución cuando se coadministre Neoral con otros medicamentos que puedan afectar la función renal (ver PRECAUCIONES , INTERACCIONES CON LA DROGAS ).
Microangiopatía trombótica
Ocasionalmente, los pacientes han desarrollado un síndrome de trombocitopenia y anemia hemolítica microangiopática que puede provocar el fracaso del injerto. La vasculopatía puede ocurrir en ausencia de rechazo y se acompaña de un ávido consumo de plaquetas dentro del injerto, como lo demuestran los estudios de plaquetas marcadas con indio 111. Ni la patogenia ni el manejo de este síndrome están claros. Aunque se ha producido una resolución después de la reducción o interrupción de la ciclosporina y 1) la administración de estreptoquinasa y heparina o 2) la plasmaféresis, esto parece depender de la detección temprana con gammagrafías de plaquetas marcadas con indio 111 (ver REACCIONES ADVERSAS ).
hiperpotasemia
Ocasionalmente se han observado hiperpotasemia significativa (a veces asociada con acidosis metabólica hiperclorémica) e hiperuricemia en pacientes individuales.
hepatotoxicidad
Se han informado casos de hepatotoxicidad y daño hepático, incluyendo colestasis, ictericia, hepatitis e insuficiencia hepática, en pacientes tratados con ciclosporina. La mayoría de los informes incluyeron pacientes con comorbilidades significativas, afecciones subyacentes y otros factores de confusión, incluidas complicaciones infecciosas y comedicaciones con potencial hepatotóxico. En algunos casos, principalmente en pacientes trasplantados, se han notificado desenlaces mortales (ver REACCIONES ADVERSAS , Experiencia posterior a la comercialización, trasplante de riñón, hígado y corazón ).
Se informó hepatotoxicidad, generalmente manifestada por elevaciones de las enzimas hepáticas y la bilirrubina, en pacientes tratados con ciclosporina en ensayos clínicos: 4 % en trasplante renal, 7 % en trasplante cardíaco y 4 % en trasplante hepático. Esto generalmente se notó durante el primer mes de terapia cuando se usaron dosis altas de ciclosporina. Las elevaciones químicas generalmente disminuyeron con una reducción en la dosis.
Neoplasias malignas
Al igual que los pacientes que reciben otros inmunosupresores, los pacientes que reciben ciclosporina tienen un mayor riesgo de desarrollar linfomas y otras neoplasias malignas, particularmente las de la piel. Se debe advertir a los pacientes que toman ciclosporina que eviten una exposición excesiva a la luz ultravioleta. El mayor riesgo parece estar relacionado con la intensidad y la duración de la inmunosupresión más que con el uso de agentes específicos. Debido al peligro de una supresión excesiva del sistema inmunitario que resulte en un mayor riesgo de infección o malignidad, se debe usar con precaución un régimen de tratamiento que contenga múltiples inmunosupresores. Algunas neoplasias malignas pueden ser fatales. Los pacientes trasplantados que reciben ciclosporina tienen un mayor riesgo de infección grave con desenlace fatal.
Infecciones graves
Los pacientes que reciben inmunosupresores, incluido Neoral 100 mg, tienen un mayor riesgo de desarrollar infecciones bacterianas, virales, fúngicas y protozoarias, incluidas las infecciones oportunistas. Estas infecciones pueden tener consecuencias graves, incluso mortales (ver ADVERTENCIA EN CAJA , y REACCIONES ADVERSAS ).
Infecciones por el virus del polioma
Los pacientes que reciben inmunosupresores, incluido Neoral 100 mg, tienen un mayor riesgo de infecciones oportunistas, incluidas las infecciones por el virus del polioma. Las infecciones por el virus del polioma en pacientes trasplantados pueden tener resultados graves y, a veces, fatales. Estos incluyen casos de leucoencefalopatía multifocal progresiva (LMP) asociada al virus JC y nefropatía asociada al virus del polioma (PVAN), especialmente debido a la infección por el virus BK, que se han observado en pacientes que reciben ciclosporina. PVAN se asocia con resultados graves, incluido el deterioro de la función renal y la pérdida del injerto renal (ver REACCIONES ADVERSAS , Experiencia posterior a la comercialización, trasplante de riñón, hígado y corazón ). El monitoreo del paciente puede ayudar a detectar pacientes en riesgo de PVAN.
Se han notificado casos de LMP en pacientes tratados con Neoral. La leucoencefalopatía multifocal progresiva, que a veces es mortal, suele presentarse con hemiparesia, apatía, confusión, deficiencias cognitivas y ataxia. Los factores de riesgo de la leucoencefalopatía multifocal progresiva incluyen el tratamiento con terapias inmunosupresoras y el deterioro de la función inmunitaria. En pacientes inmunodeprimidos, los médicos deben considerar la LMP en el diagnóstico diferencial en pacientes que reportan síntomas neurológicos y la consulta con un neurólogo debe considerarse clínicamente indicada.
Se debe considerar la reducción de la inmunosupresión total en pacientes trasplantados que desarrollan LMP o PVAN. Sin embargo, la inmunosupresión reducida puede poner en riesgo el injerto.
neurotoxicidad
Ha habido informes de convulsiones en pacientes adultos y pediátricos que reciben ciclosporina, particularmente en combinación con dosis altas de metilprednisolona.
La encefalopatía, incluido el Síndrome de Encefalopatía Posterior Reversible (PRES), se ha descrito tanto en informes posteriores a la comercialización como en la literatura. Las manifestaciones incluyen alteración de la conciencia, convulsiones, alteraciones visuales (incluida la ceguera), pérdida de la función motora, trastornos del movimiento y alteraciones psiquiátricas. En muchos casos, los cambios en la sustancia blanca se han detectado mediante técnicas de imagen y muestras patológicas. Se han observado factores predisponentes, como hipertensión, hipomagnesemia, hipocolesterolemia, dosis altas de corticosteroides, concentraciones sanguíneas altas de ciclosporina y enfermedad de injerto contra huésped, en muchos pero no en todos los casos notificados. En la mayoría de los casos, los cambios han sido reversibles al suspender la ciclosporina y, en algunos casos, se notó una mejoría después de la reducción de la dosis. Parece que los pacientes que reciben un trasplante de hígado son más susceptibles a la encefalopatía que los que reciben un trasplante de riñón. Otra rara manifestación de neurotoxicidad inducida por ciclosporina, que ocurre en pacientes trasplantados con más frecuencia que en otras indicaciones, es el edema del disco óptico, incluido el papiledema, con posible deterioro visual, secundario a hipertensión intracraneal benigna.
Se debe tener cuidado al usar ciclosporina con medicamentos nefrotóxicos (ver PRECAUCIONES ).
Artritis Reumatoide
Se detectó nefropatía por ciclosporina en biopsias renales de 6 de 60 (10 %) pacientes con artritis reumatoide después de una duración media del tratamiento de 19 meses. Solo un paciente, de estos 6 pacientes, fue tratado con una dosis ≤ 4 mg/kg/día. La creatinina sérica mejoró en todos menos en un paciente después de suspender la ciclosporina. El “aumento máximo de creatinina” parece ser un factor en la predicción de la nefropatía por ciclosporina.
Existe la posibilidad, al igual que con otros agentes inmunosupresores, de un aumento en la aparición de linfomas malignos con ciclosporina. No está claro si el riesgo con ciclosporina es mayor que en pacientes con artritis reumatoide o en pacientes con artritis reumatoide en tratamiento citotóxico para esta indicación. Se detectaron cinco casos de linfoma: cuatro en una encuesta de aproximadamente 2300 pacientes tratados con ciclosporina para la artritis reumatoide, y otro caso de linfoma se notificó en un ensayo clínico. Aunque también se informaron otros tumores (12 cánceres de piel, 24 tumores sólidos de diversos tipos y 1 mieloma múltiple) en esta encuesta, los análisis epidemiológicos no respaldaron una relación con la ciclosporina distinta de los linfomas malignos.
Se debe evaluar minuciosamente a los pacientes antes y durante el tratamiento con Neoral 25 mg para detectar el desarrollo de tumores malignos. Además, el uso de la terapia Neoral 25 mg con otros agentes inmunosupresores puede inducir una inmunosupresión excesiva que se sabe que aumenta el riesgo de malignidad.
Soriasis
(Ver también ADVERTENCIA EN RECUADRO para la psoriasis )
Dado que la ciclosporina es un agente inmunosupresor potente con una serie de efectos secundarios potencialmente graves, se deben considerar los riesgos y beneficios del uso de Neoral 100 mg antes del tratamiento de pacientes con psoriasis. La ciclosporina, el ingrediente activo de Neoral, puede causar nefrotoxicidad e hipertensión (ver PRECAUCIONES ) y el riesgo aumenta con el aumento de la dosis y la duración de la terapia. Los pacientes que pueden tener un mayor riesgo, como aquellos con función renal anormal, hipertensión no controlada o tumores malignos, no deben recibir Neoral.
La disfunción renal es una consecuencia potencial de Neoral, por lo que se debe controlar la función renal durante el tratamiento.
Los pacientes que reciben Neoral 100 mg requieren un control frecuente de la creatinina sérica (ver Seguimiento especial por debajo DOSIFICACIÓN Y ADMINISTRACIÓN ). Los pacientes de edad avanzada deben controlarse con especial cuidado, ya que con la edad también se producen disminuciones de la función renal. Si los pacientes no se controlan adecuadamente y las dosis no se ajustan adecuadamente, la terapia con ciclosporina puede causar daño renal estructural y disfunción renal persistente.
Puede ocurrir un aumento en la creatinina sérica y BUN durante la terapia con Neoral 25 mg y refleja una reducción en la tasa de filtración glomerular.
Las biopsias renales de 86 pacientes con psoriasis tratados durante una duración media de 23 meses con 1,2 a 7,6 mg/kg/día de ciclosporina mostraron evidencia de nefropatía por ciclosporina en 18/86 (21%) de los pacientes. La patología consistió en atrofia tubular renal y fibrosis intersticial. En la biopsia repetida de 13 de estos pacientes mantenidos con varias dosis de ciclosporina durante un promedio de 2 años adicionales, el número con nefropatía inducida por ciclosporina aumentó a 26/86 (30%). La mayoría de los pacientes (19/26) recibían una dosis de ≥ 5,0 mg/kg/día (la dosis máxima recomendada es de 4 mg/kg/día). Los pacientes también recibieron ciclosporina durante más de 15 meses (18/26) y/o tuvieron un aumento clínicamente significativo de la creatinina sérica durante más de 1 mes (21/26). Los niveles de creatinina volvieron al rango normal en 7 de 11 pacientes en los que se interrumpió el tratamiento con ciclosporina.
Existe un mayor riesgo de desarrollo de tumores malignos linfoproliferativos y de la piel en pacientes con psoriasis tratados con ciclosporina. El riesgo relativo de neoplasias malignas es comparable al observado en pacientes con psoriasis tratados con otros agentes inmunosupresores.
Se informaron tumores en 32 (2,2%) de 1439 pacientes con psoriasis tratados con ciclosporina en todo el mundo a partir de ensayos clínicos. Se informaron tumores adicionales en 7 pacientes en la experiencia posterior a la comercialización de ciclosporina. Se informaron neoplasias malignas de la piel en 16 (1,1 %) de estos pacientes; todos menos 2 de ellos habían recibido previamente terapia PUVA. El metotrexato fue recibido por 7 pacientes.
UVB y alquitrán de hulla habían sido utilizados por 2 y 3 pacientes, respectivamente. Siete pacientes tenían antecedentes de cáncer de piel previo o una lesión potencialmente predisponente estaba presente antes de la exposición a la ciclosporina. De los 16 pacientes con cáncer de piel, 11 pacientes tenían 18 carcinomas de células escamosas y 7 pacientes tenían 10 carcinomas de células basales.
Hubo dos neoplasias linfoproliferativas; un caso de linfoma no Hodgkin que requirió quimioterapia y un caso de micosis fungoide que remitió espontáneamente al suspender la ciclosporina. Hubo cuatro casos de infiltración linfocítica benigna: 3 retrocedieron espontáneamente al suspender la ciclosporina, mientras que el cuarto retrocedió a pesar de continuar con el fármaco. El resto de las neoplasias malignas, 13 casos (0,9%), involucraron varios órganos.
Los pacientes no deben ser tratados simultáneamente con ciclosporina y PUVA o UVB, otra radioterapia u otros agentes inmunosupresores, debido a la posibilidad de una inmunosupresión excesiva y el riesgo subsiguiente de neoplasias malignas. (ver CONTRAINDICACIONES ). También se debe advertir a los pacientes que se protejan adecuadamente cuando se expongan al sol y que eviten una exposición solar excesiva. Se debe evaluar minuciosamente a los pacientes antes y durante el tratamiento para detectar la presencia de tumores malignos, recordando que las lesiones malignas pueden estar ocultas por placas psoriásicas. Las lesiones cutáneas que no sean típicas de la psoriasis se deben biopsiar antes de iniciar el tratamiento. Los pacientes deben recibir tratamiento con Neoral solo después de la resolución completa de las lesiones sospechosas, y solo si no hay otras opciones de tratamiento (ver Seguimiento especial para pacientes con psoriasis ).
Excipientes especiales
Alcohol (etanol)
El contenido de alcohol (ver DESCRIPCIÓN de Neoral 100 mg debe tenerse en cuenta cuando se administre a pacientes en los que se deba evitar o minimizar la ingesta de alcohol, por ejemplo, mujeres embarazadas o lactantes, pacientes con enfermedad hepática o epilepsia, pacientes alcohólicos o pacientes pediátricos. Para un adulto de 70 kg de peso, la dosis oral máxima diaria proporcionaría alrededor de 1 gramo de alcohol, que es aproximadamente el 6 % de la cantidad de alcohol contenida en una bebida estándar.
PRECAUCIONES
General
Hipertensión
La ciclosporina es el principio activo de Neoral. La hipertensión es un efecto secundario común de la terapia con ciclosporina que puede persistir (ver REACCIONES ADVERSAS y DOSIFICACIÓN Y ADMINISTRACIÓN para monitorear las recomendaciones). La hipertensión leve o moderada se encuentra con más frecuencia que la hipertensión grave y la incidencia disminuye con el tiempo. En los receptores de aloinjertos de riñón, hígado y corazón tratados con ciclosporina, puede ser necesaria una terapia antihipertensiva (ver Seguimiento Especial De La Artritis Reumatoide y Pacientes con psoriasis ). Sin embargo, dado que la ciclosporina puede causar hiperpotasemia, no se deben usar diuréticos ahorradores de potasio. Si bien los antagonistas del calcio pueden ser agentes efectivos en el tratamiento de la hipertensión asociada a la ciclosporina, pueden interferir con el metabolismo de la ciclosporina (ver INTERACCIONES CON LA DROGAS ).
Vacunación
Durante el tratamiento con ciclosporina, la vacunación puede ser menos eficaz; y se debe evitar el uso de vacunas vivas atenuadas.
Seguimiento especial de pacientes con artritis reumatoide
Antes de iniciar el tratamiento, se debe realizar un examen físico cuidadoso, que incluya mediciones de la presión arterial (al menos en dos ocasiones) y dos niveles de creatinina para estimar la línea de base. La presión arterial y la creatinina sérica deben evaluarse cada 2 semanas durante los 3 meses iniciales y luego mensualmente si el paciente está estable. Es aconsejable controlar la creatinina sérica y la presión arterial siempre después de un aumento de la dosis de medicamentos antiinflamatorios no esteroideos (AINE) y después del inicio de una nueva terapia con AINE durante el tratamiento con Neoral 25 mg. Si se coadministra con metotrexato, se recomienda controlar mensualmente el CSC y las pruebas de función hepática (ver PRECAUCIONES , Generales, Hipertensión ).
En pacientes que reciben ciclosporina, la dosis de Neoral debe reducirse entre un 25 % y un 50 % si se produce hipertensión. Si la hipertensión persiste, se debe reducir aún más la dosis de Neoral 100 mg o se debe controlar la presión arterial con agentes antihipertensivos. En la mayoría de los casos, la presión arterial ha vuelto a la línea base cuando se interrumpió la ciclosporina.
En ensayos controlados con placebo de pacientes con artritis reumatoide, se produjo hipertensión sistólica (definida como la aparición de dos lecturas de presión arterial sistólica > 140 mmHg) e hipertensión diastólica (definida como dos lecturas de presión arterial diastólica > 90 mmHg) en el 33 % y el 19 % de los pacientes tratados con ciclosporina, respectivamente. Las tasas de placebo correspondientes fueron 22% y 8%.
Seguimiento especial para pacientes con psoriasis
Antes de iniciar el tratamiento, se debe realizar un cuidadoso examen dermatológico y físico, incluyendo mediciones de la presión arterial (al menos en dos ocasiones). Dado que Neoral es un agente inmunosupresor, los pacientes deben ser evaluados para detectar la presencia de infecciones ocultas en su primer examen físico y la presencia de tumores inicialmente y durante el tratamiento con Neoral. Las lesiones de la piel que no son típicas de la psoriasis deben someterse a una biopsia antes de comenzar con Neoral. Los pacientes con cambios malignos o premalignos de la piel deben ser tratados con Neoral 100 mg solo después del tratamiento adecuado de dichas lesiones y si no existe otra opción de tratamiento.
Los laboratorios de referencia deben incluir creatinina sérica (en dos ocasiones), BUN, CBC, magnesio sérico, potasio, ácido úrico y lípidos.
El riesgo de nefropatía por ciclosporina se reduce cuando la dosis inicial es baja (2,5 mg/kg/día), la dosis máxima no supera los 4,0 mg/kg/día, la creatinina sérica se controla regularmente mientras se administra la ciclosporina y la dosis de Neoral Se disminuyen 25 mg cuando el aumento de la creatinina es mayor o igual al 25 % por encima del nivel previo al tratamiento del paciente. El aumento de la creatinina generalmente es reversible con la disminución oportuna de la dosis de Neoral o su suspensión.
La creatinina sérica y el BUN deben evaluarse cada 2 semanas durante los primeros 3 meses de tratamiento y luego mensualmente si el paciente está estable. Si la creatinina sérica es mayor o igual al 25% por encima del nivel previo al tratamiento del paciente, la creatinina sérica debe repetirse dentro de dos semanas. Si el cambio en la creatinina sérica sigue siendo mayor o igual al 25 % por encima del valor inicial, Neoral 25 mg debe reducirse entre un 25 % y un 50 %. Estoy gordo cualquier momento la creatinina sérica aumenta en un 50 % o más por encima del nivel previo al tratamiento, Neoral 25 mg debe reducirse entre un 25 % y un 50 %. Neoral debe interrumpirse si no se puede lograr la reversibilidad (dentro del 25 % del valor inicial) de la creatinina sérica después de dos modificaciones de dosis. Es aconsejable controlar la creatinina sérica después de un aumento de la dosis del fármaco antiinflamatorio no esteroideo y después del inicio de una nueva terapia antiinflamatoria no esteroidea durante el tratamiento con Neoral 25 mg.
La presión arterial debe evaluarse cada 2 semanas durante los 3 meses iniciales de la terapia y luego mensualmente si el paciente está estable, o con mayor frecuencia cuando se realizan ajustes de dosis. A los pacientes sin antecedentes de hipertensión previa antes del inicio del tratamiento con Neoral, se les debe reducir el fármaco en un 25% a 50% si se descubre que tienen hipertensión sostenida. Si el paciente sigue siendo hipertenso a pesar de múltiples reducciones de Neoral 25 mg, entonces se debe suspender Neoral. Para los pacientes con hipertensión tratada, antes de iniciar la terapia con Neoral 100 mg, se debe ajustar su medicación para controlar la hipertensión mientras reciben Neoral. Neoral 100 mg debe interrumpirse si un cambio en el tratamiento de la hipertensión no es eficaz o tolerable.
El CBC, el ácido úrico, el potasio, los lípidos y el magnesio también deben controlarse cada 2 semanas durante los primeros 3 meses de terapia y luego mensualmente si el paciente está estable o con mayor frecuencia cuando se realizan ajustes de dosis. La dosis de 25 mg de Neoral debe reducirse entre un 25 % y un 50 % ante cualquier anomalía de interés clínico.
En ensayos controlados de ciclosporina en pacientes con psoriasis, las concentraciones sanguíneas de ciclosporina no se correlacionaron bien con la mejoría ni con los efectos secundarios, como la disfunción renal.
Pruebas de laboratorio
En todos los pacientes tratados con ciclosporina, las funciones renal y hepática deben evaluarse repetidamente midiendo la creatinina sérica, el BUN, la bilirrubina sérica y las enzimas hepáticas. También deben controlarse los lípidos séricos, el magnesio y el potasio.
Las concentraciones sanguíneas de ciclosporina deben controlarse de forma rutinaria en pacientes trasplantados (ver DOSIFICACIÓN Y ADMINISTRACIÓN , Monitoreo de la concentración en sangre en pacientes trasplantados ), y monitoreado periódicamente en pacientes con artritis reumatoide.
Carcinogénesis, mutagénesis y deterioro de la fertilidad
Se llevaron a cabo estudios de carcinogenicidad en ratas y ratones machos y hembras. En el estudio con ratones de 78 semanas, se encontró evidencia de una tendencia estadísticamente significativa para los linfomas linfocíticos en las hembras, y la incidencia de carcinomas hepatocelulares en los machos que recibieron la dosis media superó significativamente el valor de control. En el estudio de ratas de 24 meses, los adenomas de células de los islotes pancreáticos superaron significativamente la tasa de control en el nivel de dosis baja. Las dosis utilizadas en los estudios con ratones y ratas fueron de 0,01 a 0,16 veces la dosis clínica de mantenimiento (6 mg/kg). Los carcinomas hepatocelulares y los adenomas de células de los islotes pancreáticos no estuvieron relacionados con la dosis. Los informes publicados indican que el tratamiento conjunto de ratones sin pelo con radiación UV y ciclosporina u otros agentes inmunosupresores acortan el tiempo de formación de tumores en la piel en comparación con la radiación UV sola.
La ciclosporina no fue mutagénica en los sistemas de prueba apropiados. No se ha encontrado que la ciclosporina sea mutagénica/genotóxica en la prueba de Ames, la prueba V79-HGPRT, la prueba de micronúcleos en ratones y hámsters chinos, las pruebas de aberraciones cromosómicas en la médula ósea de hámsteres chinos, el ensayo letal dominante en ratones y el Test de reparación del ADN en espermatozoides de ratones tratados. Un estudio reciente que analizó la inducción del intercambio de cromátidas hermanas (SCE) por ciclosporina usando linfocitos humanos in vitro indicó un efecto positivo (es decir, inducción de SCE), a altas concentraciones en este sistema. En dos estudios de investigación publicados, los conejos expuestos a la ciclosporina en el útero (10 mg/kg/día por vía subcutánea) demostraron un número reducido de nefronas, hipertrofia renal, hipertensión sistémica e insuficiencia renal progresiva hasta las 35 semanas de edad. Las ratas preñadas que recibieron 12 mg/kg/día de ciclosporina por vía intravenosa (el doble de la dosis intravenosa humana recomendada) tuvieron fetos con una mayor incidencia de comunicación interventricular. Estos hallazgos no se han demostrado en otras especies y se desconoce su relevancia para los humanos.
No se demostró deterioro en la fertilidad en estudios en ratas macho y hembra.
Se observó papilomatosis de la piel ampliamente distribuida después del tratamiento crónico de perros con ciclosporina a 9 veces la dosis inicial de tratamiento de la psoriasis en humanos de 2,5 mg/kg, donde las dosis se expresan en función del área de superficie corporal. Esta papilomatosis mostró una regresión espontánea al suspender la ciclosporina.
Una mayor incidencia de malignidad es una complicación reconocida de la inmunosupresión en receptores de trasplantes de órganos y pacientes con artritis reumatoide y psoriasis. Las formas más comunes de neoplasias son el linfoma no Hodgkin y los carcinomas de piel. El riesgo de neoplasias malignas en los receptores de ciclosporina es mayor que en la población sana normal, pero similar al de los pacientes que reciben otras terapias inmunosupresoras. La reducción o interrupción de la inmunosupresión puede provocar la regresión de las lesiones.
En pacientes con psoriasis tratados con ciclosporina, se ha informado el desarrollo de tumores malignos, especialmente de la piel (ver ADVERTENCIAS ). Las lesiones cutáneas que no sean típicas de la psoriasis deben someterse a una biopsia antes de iniciar el tratamiento con ciclosporina. Los pacientes con cambios malignos o premalignos de la piel deben ser tratados con ciclosporina solo después del tratamiento adecuado de dichas lesiones y si no existe otra opción de tratamiento.
El embarazo
Estudios en animales han mostrado toxicidad reproductiva en ratas y conejos. La ciclosporina no dio evidencia de efectos mutagénicos o teratogénicos en los sistemas de prueba estándar con aplicación oral (ratas hasta 17 mg/kg y conejos hasta 30 mg/kg por día por vía oral). Solo a niveles de dosis tóxicos para las madres, se observaron efectos adversos. en estudios de reproducción en ratas. Se ha demostrado que la ciclosporina es embriotóxica y fetotóxica en ratas y conejos después de la administración oral en dosis tóxicas para la madre. Se observó toxicidad fetal en ratas a 0,8 y en conejos a 5,4 veces las dosis de trasplante en humanos de 6,0 mg/kg, donde las correcciones de dosis se basan en el área de superficie corporal. La ciclosporina fue embriotóxica y fetotóxica, como lo indica el aumento de la mortalidad pre y posnatal y la reducción del peso fetal junto con el retraso esquelético relacionado.
No existen estudios adecuados y bien controlados en mujeres embarazadas, por lo tanto, Neoral no debe usarse durante el embarazo a menos que el beneficio potencial para la madre justifique el riesgo potencial para el feto.
En las receptoras de trasplante embarazadas que están siendo tratadas con inmunosupresores, el riesgo de parto prematuro aumenta. Los siguientes datos representan los resultados informados de 116 embarazos en mujeres que recibieron ciclosporina durante el embarazo, el 90 % de las cuales fueron pacientes trasplantadas y la mayoría de las cuales recibieron ciclosporina durante todo el período gestacional. Los únicos patrones consistentes de anormalidad fueron nacimiento prematuro (período gestacional de 28 a 36 semanas) y bajo peso al nacer para la edad gestacional. Se produjeron dieciséis pérdidas fetales. La mayoría de los embarazos (85 de 100) se complicaron por trastornos; incluyendo preeclampsia, eclampsia, trabajo de parto prematuro, desprendimiento prematuro de placenta, oligohidramnios, incompatibilidad Rh y disfunción fetoplacentaria. El parto prematuro ocurrió en el 47%. Se informaron siete malformaciones en 5 bebés viables y en 2 casos de pérdida fetal. Veintiocho por ciento de los bebés eran pequeños para la edad gestacional. Las complicaciones neonatales ocurrieron en el 27%. Por lo tanto, se deben sopesar cuidadosamente los riesgos y beneficios de usar Neoral durante el embarazo.
Se dispone de un número limitado de observaciones en niños expuestos a la ciclosporina en el útero, hasta una edad de aproximadamente 7 años. La función renal y la presión arterial en estos niños eran normales.
Debido a la posible interrupción de la interacción materno-fetal, se debe sopesar cuidadosamente la relación riesgo/beneficio del uso de Neoral en pacientes con psoriasis durante el embarazo y considerar seriamente la interrupción de Neoral.
El grado alcohólico de las formulaciones de Neoral 100 mg también debe tenerse en cuenta en mujeres embarazadas (ver ADVERTENCIAS , Excipientes especiales ).
Madres lactantes
La ciclosporina está presente en la leche materna. Debido al potencial de reacciones adversas graves al medicamento en lactantes con Neoral 100 mg, se debe tomar la decisión de suspender la lactancia o suspender el fármaco, teniendo en cuenta la importancia del fármaco para la madre. Neoral contiene etanol. El etanol estará presente en la leche humana en niveles similares a los que se encuentran en el suero materno y, si está presente en la leche materna, el lactante lo absorberá por vía oral (ver ADVERTENCIAS ).
Uso pediátrico
Aunque no se han realizado estudios adecuados y bien controlados en niños, los receptores de trasplantes de tan solo un año de edad han recibido Neoral sin efectos adversos inusuales. No se ha establecido la seguridad y eficacia del tratamiento con Neoral en niños menores de 18 años con artritis reumatoide juvenil o psoriasis.
Uso geriátrico
En ensayos clínicos de artritis reumatoide con ciclosporina, el 17,5 % de los pacientes tenían 65 años o más. Estos pacientes tenían más probabilidades de desarrollar hipertensión sistólica durante el tratamiento y más probabilidades de mostrar aumentos de la creatinina sérica ≥ 50 % por encima del valor inicial después de 3 a 4 meses de tratamiento.
Los estudios clínicos de Neoral 100 mg en pacientes con trasplante y psoriasis no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes. Otras experiencias clínicas informadas no han identificado diferencias en la respuesta entre los ancianos y los pacientes más jóvenes. En general, la selección de la dosis para un paciente de edad avanzada debe ser cautelosa, generalmente comenzando en el extremo inferior del rango de dosificación, lo que refleja la mayor frecuencia de disminución de la función hepática, renal o cardíaca, y de enfermedades concomitantes u otra terapia con medicamentos.
SOBREDOSIS
Existe una experiencia mínima con la sobredosis de ciclosporina. La emesis forzada y el lavado gástrico pueden ser útiles hasta 2 horas después de la administración de Neoral. Puede ocurrir hepatotoxicidad y nefrotoxicidad transitorias que deben resolverse después de la suspensión del fármaco. Se han tolerado dosis orales de ciclosporina de hasta 10 g (alrededor de 150 mg/kg) con consecuencias clínicas relativamente menores, tales como vómitos, somnolencia, dolor de cabeza, taquicardia y, en unos pocos pacientes, deterioro moderadamente grave y reversible de la función renal. Sin embargo, se han informado síntomas graves de intoxicación luego de una sobredosis parenteral accidental con ciclosporina en recién nacidos prematuros. En todos los casos de sobredosis, se deben seguir las medidas generales de apoyo y el tratamiento sintomático. La ciclosporina no es dializable en gran medida, ni se elimina bien por hemoperfusión con carbón. La dosis oral a la que se estima que muere la mitad de los animales de experimentación es 31 veces, 39 veces y > 54 veces la dosis de mantenimiento en humanos para pacientes trasplantados (6 mg/kg; correcciones basadas en el área de superficie corporal) en ratones, ratas y conejos .
CONTRAINDICACIONES
General
Neoral 100 mg está contraindicado en pacientes con hipersensibilidad a la ciclosporina oa cualquiera de los ingredientes de la formulación.
Artritis Reumatoide
Los pacientes con artritis reumatoide con función renal anormal, hipertensión no controlada o tumores malignos no deben recibir Neoral.
Soriasis
Los pacientes con psoriasis tratados con Neoral 100 mg no deben recibir terapia PUVA o UVB concomitante, metotrexato u otros agentes inmunosupresores, alquitrán de hulla o radioterapia. Los pacientes con psoriasis con función renal anormal, hipertensión no controlada o neoplasias malignas no deben recibir Neoral.
FARMACOLOGÍA CLÍNICA
La ciclosporina es un agente inmunosupresor potente que en animales prolonga la supervivencia de trasplantes alogénicos que involucran piel, riñón, hígado, corazón, páncreas, médula ósea, intestino delgado y pulmón. Se ha demostrado que la ciclosporina suprime parte de la inmunidad humoral y, en mayor medida, las reacciones inmunitarias mediadas por células, como el rechazo del aloinjerto, la hipersensibilidad retardada, la encefalomielitis alérgica experimental, la artritis adyuvante de Freund y la enfermedad del injerto contra el huésped en muchas especies animales para una variedad de órganos. .
La eficacia de la ciclosporina resulta de la inhibición específica y reversible de los linfocitos inmunocompetentes en las fases G0 y G1 del ciclo celular. Los linfocitos T se inhiben preferentemente. La célula T colaboradora es el objetivo principal, aunque también se puede suprimir la célula Tsupresora. La ciclosporina también inhibe la producción y liberación de linfocinas, incluida la interleucina-2.
No se han detectado efectos sobre la función fagocítica (cambios en las secreciones enzimáticas, migración quimiotáctica de granulocitos, migración de macrófagos, eliminación de carbono in vivo) en animales. La ciclosporina no causa supresión de la médula ósea en modelos animales ni en el hombre.
Farmacocinética
La actividad inmunosupresora de la ciclosporina se debe principalmente al fármaco original. Después de la administración oral, la absorción de ciclosporina es incompleta. El grado de absorción de la ciclosporina depende del paciente individual, la población de pacientes y la formulación. La eliminación de la ciclosporina es principalmente biliar y solo el 6% de la dosis (fármaco original y metabolitos) se excreta en la orina. La eliminación de la ciclosporina de la sangre es generalmente bifásica, con una vida media terminal de aproximadamente 8,4 horas (rango de 5 a 18 horas). Después de la administración intravenosa, el aclaramiento sanguíneo de ciclosporina (ensayo: HPLC) es de aproximadamente 5 a 7 ml/min/kg en receptores adultos de aloinjertos renales o hepáticos. El aclaramiento de ciclosporina en sangre parece ser ligeramente más lento en pacientes con trasplante cardíaco.
Las cápsulas de gelatina blanda de Neoral (cápsulas de ciclosporina, USP) MODIFICADAS y la solución oral de Neoral (solución oral de ciclosporina, USP) MODIFICADAS son bioequivalentes. La solución oral de 25 mg de Neoral diluida con jugo de naranja o jugo de manzana es bioequivalente a la solución oral de Neoral diluida con agua. No se ha evaluado el efecto de la leche sobre la biodisponibilidad de la ciclosporina cuando se administra como solución oral de Neoral.
La relación entre la dosis administrada y la exposición (área bajo la curva de concentración versus tiempo, AUC) es lineal dentro del rango de dosis terapéutica. La variabilidad interindividual (total, %CV) de la exposición a la ciclosporina (AUC) cuando se administra Neoral o Sandimmune oscila entre aproximadamente el 20 % y el 50 % en pacientes con trasplante renal. Esta variabilidad entre sujetos contribuye a la necesidad de individualización del régimen de dosificación para una terapia óptima (ver DOSIFICACIÓN Y ADMINISTRACIÓN ).
La variabilidad intrasujeto del AUC en receptores de trasplante renal (%CV) fue del 9 % al 21 % para Neoral y del 19 % al 26 % para Sandimmune. En los mismos estudios, la variabilidad intrasujeto de las concentraciones mínimas (%CV) fue del 17 % al 30 % para Neoral y del 16 % al 38 % para Sandimmune.
Absorción
Neoral tiene una mayor biodisponibilidad en comparación con Sandimmune. La biodisponibilidad absoluta de ciclosporina administrada como Sandimmune depende de la población de pacientes, estimada en menos del 10 % en pacientes con trasplante de hígado y hasta el 89 % en algunos pacientes con trasplante renal. No se ha determinado la biodisponibilidad absoluta de la ciclosporina administrada como Neoral en adultos. En estudios de pacientes con trasplante renal, artritis reumatoide y psoriasis, el AUC medio de la ciclosporina fue aproximadamente un 20 % a un 50 % mayor y la concentración máxima de ciclosporina en sangre Cmax fue aproximadamente un 40 % a un 106 % mayor luego de la administración de Neoral 100 mg en comparación con la administración posterior de Sandimmune. . El AUC normalizado de la dosis en pacientes con trasplante hepático de novo que recibieron Neoral 28 días después del trasplante fue un 50 % mayor y la Cmax fue un 90 % mayor que en los pacientes a los que se administró Sandimmune. El AUC y la Cmax también aumentan (Neoral en relación con Sandimmune) en pacientes con trasplante de corazón, pero los datos son muy limitados. Aunque los valores de AUC y Cmax son más altos con Neoral 100 mg en comparación con Sandimmune, las concentraciones mínimas previas a la dosis (dosis normalizadas) son similares para las dos formulaciones.
Después de la administración oral de Neoral, el tiempo hasta alcanzar las concentraciones máximas de ciclosporina en sangre (Tmax) osciló entre 1,5 y 2,0 horas. La administración de alimentos con Neoral 25 mg disminuye el AUC y la Cmax de ciclosporina. Una comida rica en grasas (669 kcal, 45 gramos de grasa) consumida dentro de la media hora antes de la administración de 25 mg de Neoral disminuyó el AUC en un 13 % y la Cmax en un 33 %. Los efectos de una comida baja en grasas (667 kcal, 15 gramos de grasa) fueron similares.
Se investigó el efecto de la desviación de la bilis por el tubo en T sobre la absorción de ciclosporina de Neoral 25 mg en once pacientes con trasplante hepático de novo. Cuando a los pacientes se les administró Neoral con y sin derivación de bilis con tubo en T, se observó muy poca diferencia en la absorción, medida por el cambio en las concentraciones sanguíneas máximas de ciclosporina desde los valores previos a la dosis con el tubo en T cerrado en relación con cuando estaba cerrado. abierto: 6,9 ± 41% (rango 55% a 68%).
Poblacion de pacientesDistribución
La ciclosporina se distribuye en gran medida fuera del volumen sanguíneo. Se ha informado que el volumen de distribución en estado estacionario durante la dosificación intravenosa es de 3 a 5 l/kg en receptores de trasplantes de órganos sólidos. En sangre, la distribución depende de la concentración. Aproximadamente del 33% al 47% está en plasma, del 4% al 9% en linfocitos, del 5% al 12% en granulocitos y del 41% al 58% en eritrocitos. A altas concentraciones, la capacidad de unión de leucocitos y eritrocitos se satura. En plasma, aproximadamente el 90% se une a proteínas, principalmente lipoproteínas. La ciclosporina se excreta en la leche humana (ver PRECAUCIONES , Madres lactantes ).
Metabolismo
La ciclosporina se metaboliza ampliamente por el sistema enzimático citocromo P-450 3A en el hígado y, en menor grado, en el tracto gastrointestinal y el riñón. El metabolismo de la ciclosporina puede verse alterado por la coadministración de una variedad de agentes (ver PRECAUCIONES , INTERACCIONES CON LA DROGAS ). Se han identificado al menos 25 metabolitos en la bilis humana, las heces, la sangre y la orina. La actividad biológica de los metabolitos y sus contribuciones a la toxicidad son considerablemente menores que las del compuesto original. Los principales metabolitos (M1, M9 y M4N) resultan de la oxidación en las posiciones 1-beta, 9-gamma y 4-N-desmetiladas, respectivamente. En estado estacionario después de la administración oral de Sandimmune, las AUC medias para las concentraciones en sangre de M1, M9 y M4N son aproximadamente el 70 %, 21 % y 7,5 % del AUC para las concentraciones de ciclosporina en sangre, respectivamente. Según los datos de concentración en sangre de pacientes con trasplante renal estable (13 pacientes a los que se administró Neoral y Sandimmune en un estudio cruzado), y los datos de concentración de bilis de pacientes con trasplante de hígado de novo (4 a los que se les administró Neoral 100 mg, 3 a los que se les administró Sandimmune), el porcentaje de dosis presente como Los metabolitos M1, M9 y M4N son similares cuando se administra Neoral 25 mg o Sandimmune.
Excreción
Sólo el 0,1% de una dosis de ciclosporina se excreta sin cambios en la orina. La eliminación es principalmente biliar y solo el 6% de la dosis (fármaco original y metabolitos) se excreta en la orina. Ni la diálisis ni la insuficiencia renal alteran significativamente el aclaramiento de ciclosporina.
Interacciones con la drogas
(Ver PRECAUCIONES , INTERACCIONES CON LA DROGAS ) Cuando se coadministró diclofenaco o metotrexato con ciclosporina en pacientes con artritis reumatoide, el AUC de diclofenaco y metotrexato aumentó significativamente (ver PRECAUCIONES , INTERACCIONES CON LA DROGAS ). No se produjeron interacciones farmacocinéticas clínicamente significativas entre la ciclosporina y la aspirina, el ketoprofeno, el piroxicam o la indometacina.
Poblaciones Específicas
Insuficiencia renal
En un estudio realizado en 4 sujetos con enfermedad renal terminal (aclaramiento de creatinina
Deterioro hepático
La ciclosporina se metaboliza extensamente en el hígado. Dado que la insuficiencia hepática grave puede dar lugar a un aumento significativo de la exposición a la ciclosporina, es posible que sea necesario reducir la dosis de ciclosporina en estos pacientes.
Población pediátrica
Los datos farmacocinéticos de pacientes pediátricos a los que se administró Neoral o Sandimmune son muy limitados. En 15 pacientes con trasplante renal de 3 a 16 años de edad, el aclaramiento de ciclosporina en sangre total después de la administración IV de Sandimmune fue de 10,6 ± 3,7 ml/min/kg (ensayo: RIA específico de Cyclo-trac). En un estudio de 7 pacientes con trasplante renal de 2 a 16 años, el aclaramiento de ciclosporina varió de 9,8 a 15,5 ml/min/kg. En 9 pacientes con trasplante hepático de 0,6 a 5,6 años de edad, el aclaramiento fue de 9,3 ± 5,4 ml/min/kg (ensayo: HPLC).
En la población pediátrica, Neoral también demuestra una mayor biodisponibilidad en comparación con Sandimmune. En 7 pacientes con trasplante hepático de novo de 1,4 a 10 años de edad, la biodisponibilidad absoluta de Neoral fue del 43 % (rango del 30 % al 68 %) y de Sandimmune en los mismos individuos, la biodisponibilidad absoluta fue del 28 % (rango del 17 % al 42 %).
Población geriátrica
Comparación de datos de dosis única de voluntarios ancianos normales (N = 18, edad media 69 años) y pacientes ancianos con artritis reumatoide (N = 16, edad media 68 años) con datos de dosis única en voluntarios adultos jóvenes (N = 16, edad media 26 años) no mostró diferencias significativas en los parámetros farmacocinéticos.
Ensayos clínicos
Artritis Reumatoide
La eficacia de Sandimmune y Neoral 100 mg en el tratamiento de la artritis reumatoide grave se evaluó en 5 estudios clínicos en los que participaron un total de 728 pacientes tratados con ciclosporina y 273 pacientes tratados con placebo.
Se presenta un resumen de los resultados para las tasas de "respondedor" por grupo de tratamiento, con un respondedor definido como un paciente que completó el ensayo con una mejora del 20 % en el recuento de articulaciones inflamadas y dolorosas y una mejora del 20 % en 2 de 4 de investigador global, global del paciente, discapacidad y velocidad de sedimentación globular (VSG) para los estudios 651 y 652 y 3 de 5 de investigador global, global del paciente, discapacidad, dolor visual análogo y VSG para los estudios 2008, 654 y 302.
El estudio 651 reclutó a 264 pacientes con artritis reumatoide activa con al menos 20 articulaciones afectadas, que habían fracasado al menos con un fármaco principal para la AR, usando una aleatorización 3:3:2 a uno de los siguientes tres grupos: (1) ciclosporina dosificada en 2,5 a 5 mg/kg/día, (2) metotrexato de 7,5 a 15 mg/semana o (3) placebo. La duración del tratamiento fue de 24 semanas. La dosis media de ciclosporina en la última visita fue de 3,1 mg/kg/día. Ver gráfico a continuación.
El estudio 652 inscribió a 250 pacientes con AR activa con > 6 articulaciones activas dolorosas o sensibles que habían fracasado al menos con un fármaco principal para la AR. Los pacientes fueron aleatorizados utilizando una aleatorización 3:3:2 a 1 de 3 brazos de tratamiento: (1) 1,5 a 5 mg/kg/día de ciclosporina, (2) 2,5 a 5 mg/kg/día de ciclosporina y (3) placebo. La duración del tratamiento fue de 16 semanas. La dosis media de ciclosporina para el grupo 2 en la última visita fue de 2,92 mg/kg/día. Ver gráfico a continuación.
El estudio 2008 inscribió a 144 pacientes con AR activa y > 6 articulaciones activas que habían tenido ciclos de tratamiento sin éxito con aspirina y oro o penicilamina. Los pacientes fueron aleatorizados a 1 de 2 grupos de tratamiento (1) ciclosporina de 2,5 a 5 mg/kg/día con ajustes después del primer mes para alcanzar un nivel mínimo objetivo y (2) placebo. La duración del tratamiento fue de 24 semanas. La dosis media de ciclosporina en la última visita fue de 3,63 mg/kg/día. Ver gráfico a continuación.
El estudio 654 inscribió a 148 pacientes que permanecieron con recuentos articulares activos de 6 o más a pesar del tratamiento con dosis máximas de metotrexato toleradas durante al menos tres meses. Los pacientes continuaron tomando su dosis actual de metotrexato y fueron aleatorizados para recibir, además, uno de los siguientes medicamentos: (1) ciclosporina 2,5 mg/kg/día con aumentos de dosis de 0,5 mg/kg/día en las semanas 2 y 4 si no hubo evidencia de toxicidad y aumentos adicionales de 0,5 mg/kg/día en las semanas 8 y 16 si se produjo una disminución de
El estudio 302 inscribió a 299 pacientes con AR activa grave, el 99 % de los cuales no respondían o eran intolerantes a al menos un fármaco principal para la AR anterior. Los pacientes fueron aleatorizados a 1 de 2 grupos de tratamiento (1) Neoral 25 mg y (2) ciclosporina, ambos comenzaron con 2,5 mg/kg/día y aumentaron después de 4 semanas por ineficacia en incrementos de 0,5 mg/kg/día a un máximo de 5 mg/kg/día y disminuido en cualquier momento por toxicidad. La duración del tratamiento fue de 24 semanas. La dosis media de ciclosporina en la última visita fue de 2,91 mg/kg/día (rango: 0,72 a 5,17) para Neoral y de 3,27 mg/kg/día (rango: 0,73 a 5,68) para ciclosporina. Ver gráfico a continuación.
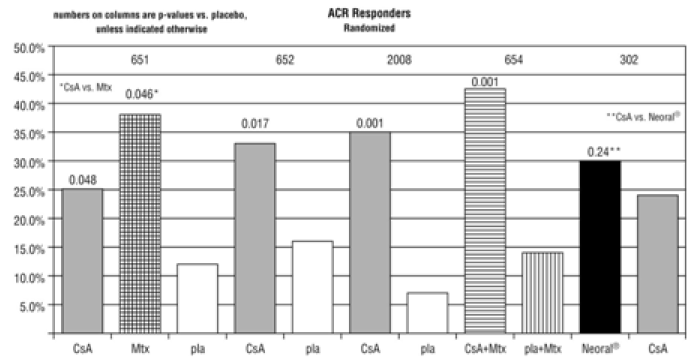
Estudios clínicos
En estudios controlados, la naturaleza, la gravedad y la incidencia de los eventos adversos que se observaron en 493 pacientes trasplantados tratados con Neoral fueron comparables con los observados en 208 pacientes trasplantados que recibieron Sandimmune en estos mismos estudios cuando se ajustó la dosis de los dos fármacos. para lograr las mismas concentraciones mínimas de ciclosporina en sangre.
Según la experiencia histórica con Sandimmune, las siguientes reacciones ocurrieron en el 3 % o más de 892 pacientes involucrados en ensayos clínicos de trasplantes de riñón, corazón e hígado.
Entre 705 pacientes con trasplante renal tratados con ciclosporina solución oral (Sandimmune) en ensayos clínicos, el motivo de la interrupción del tratamiento fue toxicidad renal en el 5,4 %, infección en el 0,9 %, falta de eficacia en el 1,4 %, necrosis tubular aguda en el 1,0 %, trastornos linfoproliferativos en el 0,3%, hipertensión en el 0,3% y otras causas en el 0,7% de los pacientes.
Las siguientes reacciones ocurrieron en el 2% o menos de los pacientes tratados con ciclosporina: reacciones alérgicas, anemia, anorexia, confusión, conjuntivitis, edema, fiebre, uñas quebradizas, gastritis, pérdida de audición, hipo, hiperglucemia, migraña (Neoral), dolor muscular, úlcera péptica, trombocitopenia, tinnitus.
En raras ocasiones ocurrieron las siguientes reacciones: ansiedad, dolor torácico, estreñimiento, depresión, rotura del cabello, hematuria, dolor articular, letargo, llagas en la boca, infarto de miocardio, sudores nocturnos, pancreatitis, prurito, dificultad para tragar, hormigueo, hemorragia digestiva alta, alteración visual, debilidad, pérdida de peso.
Los pacientes que reciben terapias inmunosupresoras, incluidos ciclosporina y regímenes que contienen ciclosporina, tienen un mayor riesgo de infecciones (virales, bacterianas, fúngicas, parasitarias). Pueden ocurrir infecciones tanto generalizadas como localizadas. Las infecciones preexistentes también pueden agravarse. Se han informado desenlaces fatales (ver ADVERTENCIAS ).
Experiencia posterior a la comercialización, trasplante de riñón, hígado y corazón
hepatotoxicidad
Casos de hepatotoxicidad y daño hepático, incluyendo colestasis, ictericia, hepatitis e insuficiencia hepática; Se han informado desenlaces graves y/o fatales (ver ADVERTENCIAS , hepatotoxicidad ).
Mayor riesgo de infecciones
Casos de leucoencefalopatía multifocal progresiva (LMP) asociada al virus JC, a veces fatal; y nefropatía asociada al virus del polioma (PVAN), especialmente el virus BK que resultó en la pérdida del injerto (ver ADVERTENCIAS , Infección por el virus del polioma ).
Dolor de cabeza, incluida la migraña
Se han notificado casos de migraña. En algunos casos, los pacientes no han podido continuar con la ciclosporina; sin embargo, la decisión final sobre la interrupción del tratamiento debe tomarla el médico tratante después de una cuidadosa evaluación de los beneficios frente a los riesgos.
Dolor de las extremidades inferiores
Se han notificado casos aislados de dolor en las extremidades inferiores en asociación con ciclosporina. El dolor de las extremidades inferiores también se ha observado como parte del síndrome de dolor inducido por inhibidores de la calcineurina (CIPS) como se describe en la literatura.
Artritis Reumatoide
Las principales reacciones adversas asociadas con el uso de ciclosporina en la artritis reumatoide son la disfunción renal (ver ADVERTENCIAS ), hipertensión (ver PRECAUCIONES ), dolor de cabeza, trastornos gastrointestinales e hirsutismo/hipertricosis.
En pacientes con artritis reumatoide tratados en ensayos clínicos dentro del rango de dosis recomendado, la terapia con ciclosporina se interrumpió en el 5,3 % de los pacientes debido a hipertensión y en el 7 % de los pacientes debido al aumento de la creatinina. Estos cambios suelen ser reversibles con la disminución oportuna de la dosis o la suspensión del fármaco. La frecuencia y la gravedad de las elevaciones de la creatinina sérica aumentan con la dosis y la duración del tratamiento con ciclosporina. Es probable que estas elevaciones se vuelvan más pronunciadas sin la reducción de la dosis o la interrupción.
Los siguientes eventos adversos ocurrieron en ensayos clínicos controlados:
Además, se informaron los siguientes eventos adversos en 1% a
Sistema nervioso autónomo: boca seca, aumento de la sudoración
Cuerpo como un todo: alergia, astenia, sofocos, malestar general, sobredosis, procedimiento SAI*, tumor SAI*, disminución de peso, aumento de peso
Cardiovascular: ruidos cardíacos anormales, insuficiencia cardíaca, infarto de miocardio, isquemia periférica
Sistema Nervioso Central y Periférico: hipoestesia, neuropatía, vértigo
Endocrino: coto
Gastrointestinal: estreñimiento, disfagia, enantema, eructos, esofagitis, úlcera gástrica, gastritis, gastroenteritis, sangrado gingival, glositis, úlcera péptica, agrandamiento de las glándulas salivales, trastorno de la lengua, trastorno dental
Infección: absceso, infección bacteriana, celulitis, foliculitis, infección por hongos, herpes simple, herpes zoster, absceso renal, moniliasis, amigdalitis, infección viral
hematológico: anemia, epistaxis, leucopenia, linfadenopatía
Hígado y Sistema Biliar: bilirrubinemia
Metabólicas y Nutricionales: diabetes mellitus, hiperpotasemia, hiperuricemia, hipoglucemia
Sistema musculoesquelético: artralgia, fractura ósea, bursitis, dislocación articular, mialgia, rigidez, quiste sinovial, trastorno tendinoso
Neoplasias: fibroadenosis de mama, carcinoma
Psiquiátrico: ansiedad, confusión, disminución de la libido, labilidad emocional, alteración de la concentración, aumento de la libido, nerviosismo, paroniria, somnolencia
Reproductivo (Mujer): dolor de mama, hemorragia uterina
Sistema respiratorio: ruidos torácicos anormales, broncoespasmo
Piel y apéndices: pigmentación anormal, angioedema, dermatitis, piel seca, eccema, trastorno de las uñas, prurito, trastorno de la piel, urticaria
Sentidos especiales: visión anormal, cataratas, conjuntivitis, sordera, dolor ocular, alteración del gusto, tinnitus, trastorno vestibular
Sistema urinario: orina anormal, hematuria, aumento de BUN, urgencia miccional, nicturia, poliuria, pielonefritis, incontinencia urinaria
*NOS = No especificado de otra manera
Soriasis
Las principales reacciones adversas asociadas con el uso de ciclosporina en pacientes con psoriasis son disfunción renal, cefalea, hipertensión, hipertrigliceridemia, hirsutismo/hipertricosis, parestesia o hiperestesia, síntomas gripales, náuseas/vómitos, diarrea, molestias abdominales, letargo y alteraciones musculoesqueléticas. o dolor en las articulaciones.
En pacientes con psoriasis tratados en estudios clínicos controlados en EE. UU. dentro del rango de dosis recomendado, la terapia con ciclosporina se interrumpió en el 1,0% de los pacientes debido a la hipertensión y en el 5,4% de los pacientes debido al aumento de la creatinina. En la mayoría de los casos, estos cambios fueron reversibles tras la reducción de la dosis o la suspensión de la ciclosporina.
Ha habido una muerte reportada asociada con el uso de ciclosporina en la psoriasis. Un hombre de 27 años desarrolló deterioro renal y continuó con ciclosporina. Sufrió insuficiencia renal progresiva que lo llevó a la muerte.
La frecuencia y la gravedad de la creatinina sérica aumentan con la dosis y la duración del tratamiento con ciclosporina. Es probable que estas elevaciones se vuelvan más pronunciadas y pueden resultar en daño renal irreversible sin reducción de dosis o discontinuación.
Los siguientes eventos ocurrieron en 1% a menos del 3% de los pacientes con psoriasis tratados con ciclosporina:
Cuerpo como un todo: fiebre, sofocos, sofocos
Cardiovascular: Dolor de pecho
Sistema Nervioso Central y Periférico: aumento del apetito, insomnio, mareos, nerviosismo, vértigo
Gastrointestinal: distensión abdominal, estreñimiento, sangrado gingival
Hígado y Sistema Biliar: hiperbilirrubinemia
Neoplasias: tumores malignos de la piel [carcinomas de células escamosas (0,9%) y de células basales (0,4%)]
reticuloendotelial: plaquetas, trastornos hemorrágicos y de la coagulación, trastorno de los glóbulos rojos
Respiratorio: infección, viral y otra infección
Piel y apéndices: acné, foliculitis, queratosis, prurito, erupción, piel seca
Sistema urinario: frecuencia de micción
Visión: visión anormal
Pueden ocurrir hipomagnesemia e hiperpotasemia leves, pero son asintomáticas. Pueden ocurrir aumentos en el ácido úrico y rara vez se han informado ataques de gota. Se ha observado una hiperbilirrubinemia menor y relacionada con la dosis en ausencia de daño hepatocelular. La terapia con ciclosporina puede asociarse con un aumento modesto de los triglicéridos o el colesterol séricos. Las elevaciones de triglicéridos (> 750 mg/dL) ocurren en alrededor del 15% de los pacientes con psoriasis; se observan elevaciones de colesterol (> 300 mg/dL) en menos del 3% de los pacientes con psoriasis. En general, estas anomalías de laboratorio son reversibles con la reducción de la dosis o la interrupción de la ciclosporina.
Experiencia posterior a la comercialización, Psoriasis
Se han notificado casos de transformación a psoriasis eritrodérmica o psoriasis pustulosa generalizada tras la retirada o reducción de la ciclosporina en pacientes con psoriasis crónica en placas.
INFORMACIÓN DEL PACIENTE
Se debe advertir a los pacientes que cualquier cambio en la formulación de ciclosporina se debe realizar con precaución y solo bajo la supervisión de un médico, ya que puede resultar en la necesidad de un cambio en la dosis.
Los pacientes deben ser informados de la necesidad de repetir las pruebas de laboratorio mientras reciben ciclosporina. Se debe advertir a las pacientes sobre los riesgos potenciales durante el embarazo e informarles sobre el aumento del riesgo de neoplasia. Los pacientes también deben ser informados del riesgo de hipertensión y disfunción renal.
Se debe advertir a los pacientes que durante el tratamiento con ciclosporina, la vacunación puede ser menos eficaz y se debe evitar el uso de vacunas vivas atenuadas.
Los pacientes deben recibir instrucciones cuidadosas de dosificación. La Solución Oral Neoral (ciclosporina solución oral, USP) MODIFICADA debe diluirse, preferiblemente con jugo de naranja o manzana que esté a temperatura ambiente. La combinación de Neoral Oral Solution (ciclosporina solución oral, USP) MODIFICADA con leche puede resultar desagradable.
Se debe recomendar a los pacientes que tomen Neoral 100 mg en un horario constante con respecto a la hora del día y la relación con las comidas. La toronja y el jugo de toronja afectan el metabolismo, aumentando la concentración sanguínea de ciclosporina, por lo que deben evitarse.
