Actos 15mg, 30mg Pioglitazone Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Actos y cómo se usa?
Actos 15 mg es un medicamento recetado que se usa para tratar los síntomas de la diabetes mellitus tipo 2. Actos se puede usar solo o con otros medicamentos.
Actos es un fármaco antidiabético, tiazolidinedionas.
No se sabe si Actos 15 mg es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Actos 15 mg?
Actos puede causar efectos secundarios graves que incluyen:
- dificultad para respirar (especialmente al acostarse),
- cansancio inusual,
- hinchazón,
- rápido aumento de peso,
- orina rosada o roja,
- micción dolorosa o difícil,
- necesidad nueva o que empeora de orinar,
- cambios en la visión y
- dolor repentino e inusual en la mano, el brazo o el pie
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Actos incluyen:
- dolor de cabeza,
- dolor muscular, y
- síntomas de resfriado (nariz tapada, dolor de sinusitis, estornudos, dolor de garganta)
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Estos no son todos los posibles efectos secundarios de Actos. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
ADVERTENCIA
INSUFICIENCIA CARDÍACA CONGESTIVA
- Las tiazolidinedionas, incluido ACTOS 15 mg, causan o exacerban la insuficiencia cardíaca congestiva en algunos pacientes [ver ADVERTENCIAS Y PRECAUCIONES ].
- Después de iniciar ACTOS 30 mg y después de aumentar la dosis, controle a los pacientes cuidadosamente para detectar signos y síntomas de insuficiencia cardíaca (p. ej., aumento de peso rápido y excesivo, disnea y/o edema). Si se desarrolla insuficiencia cardíaca, debe manejarse de acuerdo con los estándares de atención actuales y debe considerarse la suspensión o reducción de la dosis de ACTOS 15 mg.
- ACTOS no está recomendado en pacientes con insuficiencia cardíaca sintomática.
- Está contraindicado el inicio de ACTOS en pacientes con insuficiencia cardíaca clase III o IV establecida por la New York Heart Association (NYHA) [ver CONTRAINDICACIONES y ADVERTENCIAS Y PRECAUCIONES ].
DESCRIPCIÓN
Los comprimidos de ACTOS son una tiazolidinediona y un agonista del receptor gamma activado por el proliferador de peroxisomas (PPAR) que contiene un medicamento antidiabético oral: pioglitazona.
El monoclorhidrato de pioglitazona [(±)-5-[[4-[2-(5-etil-2-piridinil) etoxi] fenil] metil]-2,4-] tiazolidinediona contiene un carbono asimétrico, y el compuesto se sintetiza y utiliza como la mezcla racémica. Los dos enantiómeros de pioglitazona se interconvierten in vivo. No se encontraron diferencias en la actividad farmacológica entre los dos enantiómeros. La fórmula estructural es como se muestra:
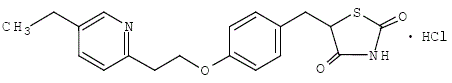
El clorhidrato de pioglitazona es un polvo cristalino blanco inodoro que tiene una fórmula molecular de C19H20N2O3S•HCl y un peso molecular de 392,90 daltons. Es soluble en N,Ndimetilformamida, ligeramente soluble en etanol anhidro, muy poco soluble en acetona y acetonitrilo, prácticamente insoluble en agua e insoluble en éter.
ACTOS está disponible en comprimidos para administración oral que contienen 15 mg, 30 mg o 45 mg de pioglitazona (como base) formulados con los siguientes excipientes: lactos 30 mg monohidrato NF, hidroxipropilcelulosa NF, carboximetilcelulosa cálcica NF y estearato de magnesio NF.
INDICACIONES
Monoterapia y terapia combinada
ACTOS 30 mg está indicado como complemento de la dieta y el ejercicio para mejorar el control glucémico en adultos con diabetes mellitus tipo 2 en múltiples entornos clínicos [ver Estudios clínicos ].
Importantes limitaciones de uso
ACTOS 15 mg ejerce su efecto antihiperglucemiante solo en presencia de insulina endógena. ACTOS 30 mg no debe usarse para tratar la diabetes tipo 1 o la cetoacidosis diabética, ya que no sería eficaz en estos entornos.
Tenga precaución en pacientes con enfermedad hepática [ver ADVERTENCIAS Y PRECAUCIONES ].
DOSIFICACIÓN Y ADMINISTRACIÓN
Recomendaciones para todos los pacientes
ACTOS 15 mg debe tomarse una vez al día y puede tomarse independientemente de las comidas.
La dosis inicial recomendada para pacientes sin insuficiencia cardíaca congestiva es de 15 mg o 30 mg una vez al día.
La dosis inicial recomendada para pacientes con insuficiencia cardíaca congestiva (clase I o II de la NYHA) es de 15 mg una vez al día.
La dosis se puede ajustar en incrementos de 15 mg hasta un máximo de 45 mg una vez al día según la respuesta glucémica determinada por HbA1c.
Después del inicio de ACTOS 30 mg o con un aumento de la dosis, vigile a los pacientes cuidadosamente para detectar reacciones adversas relacionadas con la retención de líquidos, como aumento de peso, edema y signos y síntomas de insuficiencia cardíaca congestiva [ver CUADRO DE ADVERTENCIA y ADVERTENCIAS Y PRECAUCIONES ].
Se deben obtener pruebas hepáticas (alanina sérica y aspartato aminotransferasas, fosfatasa alcalina y bilirrubina total) antes de iniciar ACTOS. No se recomienda el control periódico de rutina de las pruebas hepáticas durante el tratamiento con ACTOS 30 mg en pacientes sin enfermedad hepática. Los pacientes que tienen pruebas hepáticas anormales antes del inicio de ACTOS o que tienen pruebas hepáticas anormales mientras toman ACTOS deben manejarse como se describe en Advertencias y precauciones [ver ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ].
Uso concomitante con un secretagogo de insulina o insulina
Si se produce hipoglucemia en un paciente al que se le administra conjuntamente ACTOS 30 mg y un secretagogo de insulina (p. ej., sulfonilurea), se debe reducir la dosis del secretagogo de insulina.
Si se produce hipoglucemia en un paciente al que se le administra conjuntamente ACTOS 30 mg e insulina, la dosis de insulina debe reducirse entre un 10 % y un 25 %. Los ajustes posteriores de la dosis de insulina deben individualizarse en función de la respuesta glucémica.
Uso concomitante con inhibidores potentes de CYP2C8
La coadministración de ACTOS 30 mg y gemfibrozil, un inhibidor potente de CYP2C8, aumenta la exposición a pioglitazona aproximadamente 3 veces. Por lo tanto, la dosis máxima recomendada de ACTOS es de 15 mg al día cuando se usa en combinación con gemfibrozil u otros inhibidores potentes de CYP2C8 [ver INTERACCIONES CON LA DROGAS y FARMACOLOGÍA CLÍNICA ].
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
La tableta redonda contiene pioglitazona de la siguiente manera:
- 15 mg: blanco a blanquecino, grabado con "ACTOS" en un lado y "15" en el otro
- 30 mg: blanco a blanquecino, grabado con "ACTOS" en un lado y "30" en el otro
- 45 mg: blanco a blanquecino, grabado con "ACTOS" en un lado y "45" en el otro
Almacenamiento y manipulación
ACTOS está disponible en tabletas de 15 mg, 30 mg y 45 mg de la siguiente manera:
tableta de 15 mg : Comprimido de color blanco a blanquecino, redondo, convexo, sin ranuras, con “ACTOS” en una cara y “15” en la otra, disponible en:
CDN 64764-151-04 Botellas de 30 CDN 64764-151-05 Botellas de 90 CDN 64764-151-06 Botellas de 500
tableta de 30 mg Comprimido de color blanco a blanquecino, redondo, plano, sin ranuras, con “ACTOS” en una cara y “30” en la otra, disponible en:
CDN 64764-301-14 Botellas de 30 CDN 64764-301-15 Botellas de 90 CDN 64764-301-16 Botellas de 500
tableta de 45 mg : Comprimido de color blanco a blanquecino, redondo, plano, sin ranuras, con “ACTOS” en una cara y “45” en la otra, disponible en:
CDN 64764-451-24 Botellas de 30 CDN 64764-451-25 Botellas de 90 CDN 64764-451-26 Botellas de 500
Almacenamiento
Almacenar a 25°C (77°F); excursiones permitidas a 15-30°C (59-86°F) [consulte Temperatura ambiente controlada por USP]. Mantenga el recipiente bien cerrado y protéjalo de la luz, la humedad y la humedad.
Distribuido por: Takeda Pharmaceuticals America, Inc. Deerfield, IL 60015. Revisado: diciembre de 2017
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas graves se analizan en otra parte de la etiqueta:
- Insuficiencia cardíaca congestiva [ver CUADRO DE ADVERTENCIA y ADVERTENCIAS Y PRECAUCIONES ]
- Edema [ver ADVERTENCIAS Y PRECAUCIONES ]
- Fracturas [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Más de 8500 pacientes con diabetes tipo 2 han sido tratados con ACTOS en ensayos clínicos aleatorizados, doble ciego y controlados, incluidos 2605 pacientes con diabetes tipo 2 y enfermedad macrovascular tratados con ACTOS 30 mg en el ensayo clínico PROactive. En estos ensayos, más de 6000 pacientes recibieron tratamiento con ACTOS durante seis meses o más, más de 4500 pacientes recibieron tratamiento con ACTOS 15 mg durante un año o más y más de 3000 pacientes recibieron tratamiento con ACTOS durante al menos dos años.
En seis ensayos combinados de monoterapia controlados con placebo de 16 a 26 semanas de duración y de terapia de combinación complementaria de 16 a 24 semanas, la incidencia de retiros debido a eventos adversos fue del 4,5 % para los pacientes tratados con ACTOS 30 mg y del 5,8 % para el grupo de comparación. pacientes tratados. Los eventos adversos más comunes que llevaron a la abstinencia estuvieron relacionados con un control glucémico inadecuado, aunque la incidencia de estos eventos fue menor (1,5 %) con ACTOS 30 mg que con placebo (3,0 %).
En el ensayo PROactive, la incidencia de retiros debido a eventos adversos fue del 9,0 % para los pacientes tratados con ACTOS 30 mg y del 7,7 % para los pacientes tratados con placebo. La insuficiencia cardíaca congestiva fue el evento adverso grave más frecuente que provocó la abstinencia y se produjo en el 1,3 % de los pacientes tratados con ACTOS 30 mg y en el 0,6 % de los pacientes tratados con placebo.
Eventos adversos comunes: ensayos de monoterapia de 16 a 26 semanas
En la Tabla 1 se proporciona un resumen de la incidencia y el tipo de eventos adversos comunes informados en tres ensayos combinados de ACTOS en monoterapia controlados con placebo de 16 a 26 semanas de duración. Los términos que se informan representan aquellos que ocurrieron con una incidencia de >5% y más en pacientes tratados con ACTOS 15 mg que en pacientes que recibieron placebo. Ninguno de estos eventos adversos estuvo relacionado con la dosis de ACTOS.
Eventos adversos comunes: ensayos de terapia combinada complementaria de 16 a 24 semanas
En la Tabla 2 se proporciona un resumen de la incidencia general y los tipos de eventos adversos comunes informados en los ensayos de ACTOS como complemento de la sulfonilurea. Los términos que se informan representan aquellos que ocurrieron con una incidencia de >5 % y más dosis de ACTOS.
En la Tabla 3 se proporciona un resumen de la incidencia general y los tipos de eventos adversos comunes informados en los ensayos de ACTOS 30 mg como complemento de metformina. Los términos que se informan representan aquellos que ocurrieron con una incidencia de >5 % y más dosis probada de ACTOS.
La Tabla 4 resume la incidencia y los tipos de eventos adversos comunes informados en los ensayos de ACTOS como complemento de la insulina. Los términos que se informan representan aquellos que ocurrieron con una incidencia de >5 % y más comúnmente con la dosis más alta probada de ACTOS.
En la Tabla 5 se proporciona un resumen de la incidencia general y los tipos de eventos adversos comunes informados en el ensayo PROactive. Los términos que se informan representan aquellos que ocurrieron con una incidencia de >5% y más comúnmente en pacientes tratados con ACTOS que en pacientes que recibió placebo.
Insuficiencia cardíaca congestiva
En la Tabla 6 se proporciona un resumen de la incidencia de eventos adversos relacionados con la insuficiencia cardíaca congestiva para los ensayos complementarios de sulfonilurea de 16 a 24 semanas, para los ensayos complementarios de insulina de 16 a 24 semanas y para los ensayos complementarios de insulina de 16 a 24 semanas. el complemento de 16 a 24 semanas a los ensayos de metformina. Ninguno de los hechos fue fatal.
Los pacientes con diabetes tipo 2 e insuficiencia cardíaca congestiva clase II o clase III temprana de la NYHA fueron aleatorizados para recibir 24 semanas de tratamiento doble ciego con ACTOS 30 mg en dosis diarias de 30 mg a 45 mg (n=262) o gliburida en dosis diarias de 10 mg a 15 mg (n=256). En la Tabla 7 se proporciona un resumen de la incidencia de eventos adversos relacionados con la insuficiencia cardíaca congestiva informados en este estudio.
Los eventos de insuficiencia cardíaca congestiva que condujeron a la hospitalización que ocurrieron durante el ensayo PROactive se resumen en la Tabla 8.
Seguridad cardiovascular
En el ensayo PROactive, 5238 pacientes con diabetes tipo 2 y antecedentes de enfermedad macrovascular se aleatorizaron para recibir ACTOS (N=2605), ajustados a la fuerza hasta 45 mg diarios o placebo (N=2633) además del tratamiento estándar. Casi todos los pacientes (95%) estaban recibiendo medicamentos cardiovasculares (betabloqueadores, inhibidores de la ECA, bloqueadores de los receptores de angiotensina II, bloqueadores de los canales de calcio, nitratos, diuréticos, aspirina, estatinas y fibratos). Al inicio del estudio, los pacientes tenían una edad media de 62 años, una duración media de la diabetes de 9,5 años y una HbA1c media del 8,1 %. La duración media del seguimiento fue de 34,5 meses. El objetivo principal de este ensayo fue examinar el efecto de ACTOS sobre la mortalidad y la morbilidad macrovascular en pacientes con diabetes mellitus tipo 2 que tenían un alto riesgo de eventos macrovasculares. La variable principal de eficacia fue el tiempo transcurrido hasta la primera aparición de cualquier evento en un criterio de valoración cardiovascular compuesto que incluía mortalidad por todas las causas, infarto de miocardio (IM) no mortal, incluido IM silente, accidente cerebrovascular, síndrome coronario agudo, intervención cardiaca, incluido injerto de derivación de arteria coronaria o intervención percutánea, amputación mayor de pierna por encima del tobillo y cirugía de bypass o revascularización en la pierna. Un total de 514 (19,7 %) pacientes tratados con ACTOS 15 mg y 572 (21,7 %) pacientes tratados con placebo experimentaron al menos un evento del criterio principal de valoración compuesto (índice de riesgo 0,90; intervalo de confianza del 95 %: 0,80, 1,02; p=0,10) ).
Aunque no hubo una diferencia estadísticamente significativa entre ACTOS y el placebo para la incidencia de tres años de un primer evento dentro de este compuesto, no hubo un aumento en la mortalidad o en el total de eventos macrovasculares con ACTOS. El número de primeras ocurrencias y el total de eventos individuales que contribuyeron al criterio principal de valoración compuesto se muestra en la Tabla 9.
Aumento de peso
El aumento de peso relacionado con la dosis ocurre cuando ACTOS 30 mg se usa solo o en combinación con otros medicamentos antidiabéticos. El mecanismo del aumento de peso no está claro, pero probablemente implica una combinación de retención de líquidos y acumulación de grasa.
Las tablas 10 y 11 resumen los cambios en el peso corporal con ACTOS y placebo en los ensayos de monoterapia aleatorizados, doble ciego de 16 a 26 semanas y de terapia combinada de 16 a 24 semanas y en el ensayo PROactive.
Edema
El edema inducido por tomar ACTOS es reversible cuando se suspende ACTOS. El edema por lo general no requiere hospitalización a menos que exista una insuficiencia cardíaca congestiva coexistente. En la Tabla 12 se proporciona un resumen de la frecuencia y los tipos de eventos adversos de edema que ocurren en las investigaciones clínicas de ACTOS 30 mg.
Efectos hepáticos
No ha habido evidencia de hepatotoxicidad inducida con ACTOS en la base de datos de ensayos clínicos controlados de ACTOS hasta la fecha. Un ensayo aleatorizado, doble ciego de 3 años que comparó ACTOS 15 mg con gliburida como complemento de la metformina y la terapia con insulina se diseñó específicamente para evaluar la incidencia de elevación de la ALT sérica a más de tres veces el límite superior del rango de referencia, medido cada ocho semanas durante las primeras 48 semanas del ensayo y luego cada 12 semanas. Un total de 3/1051 (0,3 %) pacientes tratados con ACTOS y 9/1046 (0,9 %) pacientes tratados con gliburida desarrollaron valores de ALT superiores a tres veces el límite superior del rango de referencia. Ninguno de los pacientes tratados con ACTOS en la base de datos de ensayos clínicos controlados de ACTOS hasta la fecha ha tenido una ALT sérica superior a tres veces el límite superior del rango de referencia y una bilirrubina total correspondiente superior a dos veces el límite superior del rango de referencia, una combinación predictiva del potencial de lesión hepática grave inducida por fármacos.
Hipoglucemia
En los ensayos clínicos de ACTOS 15 mg, los eventos adversos de hipoglucemia se informaron según el criterio clínico de los investigadores y no requirieron confirmación con pruebas de glucosa por punción digital.
En el ensayo complementario de sulfonilurea de 16 semanas, la incidencia de hipoglucemia notificada fue del 3,7 % con ACTOS 30 mg y del 0,5 % con placebo. En el ensayo de complemento a la insulina de 16 semanas, la incidencia de hipoglucemia notificada fue del 7,9 % con ACTOS 15 mg, del 15,4 % con ACTOS 30 mg y del 4,8 % con placebo.
La incidencia de hipoglucemia notificada fue mayor con ACTOS 45 mg en comparación con ACTOS 30 mg tanto en el ensayo de 24 semanas como complemento de la sulfonilurea (15,7 % frente al 13,4 %) como en el ensayo de 24 semanas como complemento de la insulina (47,8 % vs 43,5%).
Tres pacientes en estos cuatro ensayos fueron hospitalizados debido a hipoglucemia. Los tres pacientes estaban recibiendo ACTOS 30 mg (0,9 %) en el ensayo adicional de insulina de 24 semanas. Otros 14 pacientes informaron hipoglucemia grave (definida como una interferencia considerable con las actividades habituales del paciente) que no requirió hospitalización. Estos pacientes estaban recibiendo ACTOS 45 mg en combinación con sulfonilurea (n=2) o ACTOS 30 mg o 45 mg en combinación con insulina (n=12).
Tumores de vejiga urinaria
Se observaron tumores en la vejiga urinaria de ratas macho en el estudio de carcinogenicidad de dos años [ver Toxicología no clínica ]. Durante el ensayo clínico PROactive de tres años, 14 pacientes de 2605 (0,54 %) asignados al azar a ACTOS y 5 de 2633 (0,19 %) asignados al azar a placebo fueron diagnosticados con cáncer de vejiga. Después de excluir a los pacientes en los que la exposición al fármaco del estudio fue inferior a un año en el momento del diagnóstico de cáncer de vejiga, hubo 6 (0,23 %) casos con ACTOS 15 mg y dos (0,08 %) casos con placebo. Después de completar el ensayo, se observó a un gran subconjunto de pacientes hasta por 10 años más, con poca exposición adicional a ACTOS. Durante los 13 años de seguimiento observacional y PROactive, la aparición de cáncer de vejiga no difirió entre los pacientes aleatorizados a ACTOS o placebo (HR = 1,00; IC del 95 %: 0,59-1,72) [ver ADVERTENCIAS Y PRECAUCIONES ].
Anomalías de laboratorio
Efectos hematológicos
ACTOS 15 mg puede causar disminuciones en la hemoglobina y el hematocrito. En ensayos de monoterapia controlados con placebo, los valores medios de hemoglobina disminuyeron entre un 2 % y un 4 % en pacientes tratados con ACTOS en comparación con un cambio medio en la hemoglobina de -1 % a +1 % en pacientes tratados con placebo. Estos cambios ocurrieron principalmente dentro de las primeras 4 a 12 semanas de terapia y permanecieron relativamente constantes a partir de entonces. Estos cambios pueden estar relacionados con el aumento del volumen plasmático asociado con la terapia con ACTOS 30 mg y no es probable que estén asociados con ningún efecto hematológico clínicamente significativo.
Creatina Fosfoquinasa
Durante la medición especificada por el protocolo de la creatina fosfoquinasa sérica (CPK) en los ensayos clínicos de ACTOS 15 mg, se observó una elevación aislada de la CPK a más de 10 veces el límite superior del rango de referencia en nueve (0,2 %) pacientes tratados con ACTOS (valores de 2150 a 11400 UI/L) y en pacientes no tratados con comparador. Seis de estos nueve pacientes continuaron recibiendo ACTOS 15 mg, se observó que dos pacientes tenían una elevación de CPK el último día de la dosificación y un paciente suspendió ACTOS debido a la elevación. Estas elevaciones se resolvieron sin secuelas clínicas aparentes. Se desconoce la relación de estos eventos con la terapia con ACTOS 30 mg.
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de ACTOS. Debido a que estas reacciones son reportadas voluntariamente por una población de tamaño incierto, generalmente no es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
- Edema macular diabético de nueva aparición o empeoramiento con disminución de la agudeza visual [ver ADVERTENCIAS Y PRECAUCIONES ].
- Insuficiencia hepática fatal y no fatal [ver ADVERTENCIAS Y PRECAUCIONES ].
Se han notificado informes posteriores a la comercialización de insuficiencia cardíaca congestiva en pacientes tratados con ACTOS, con y sin enfermedad cardíaca previamente conocida y con y sin administración concomitante de insulina.
En la experiencia posterior a la comercialización, ha habido informes de aumentos de peso inusualmente rápidos y aumentos superiores a los observados generalmente en los ensayos clínicos. Los pacientes que experimentan tales aumentos deben ser evaluados por acumulación de líquido y eventos relacionados con el volumen, como edema excesivo e insuficiencia cardíaca congestiva [ver CUADRO DE ADVERTENCIA y ADVERTENCIAS Y PRECAUCIONES ].
INTERACCIONES CON LA DROGAS
Inhibidores fuertes de CYP2C8
Un inhibidor de CYP2C8 (p. ej., gemfibrozil) aumenta significativamente la exposición (área bajo la curva de concentración sérica-tiempo o AUC) y la vida media (t½) de pioglitazona. Por lo tanto, la dosis máxima recomendada de ACTOS es de 15 mg diarios si se usa en combinación con gemfibrozil u otros inhibidores potentes de CYP2C8 [ver DOSIFICACIÓN Y ADMINISTRACIÓN y FARMACOLOGÍA CLÍNICA ].
Inductores CYP2C8
Un inductor de CYP2C8 (p. ej., rifampicina) puede disminuir significativamente la exposición (AUC) de pioglitazona. Por lo tanto, si se inicia o suspende un inductor de CYP2C8 durante el tratamiento con ACTOS 30 mg, es posible que se necesiten cambios en el tratamiento de la diabetes según la respuesta clínica sin exceder la dosis diaria máxima recomendada de 45 mg para ACTOS [ver FARMACOLOGÍA CLÍNICA ].
topiramato
Se observó una disminución en la exposición de pioglitazona y sus metabolitos activos con la administración concomitante de pioglitazona y topiramato [ver FARMACOLOGÍA CLÍNICA ]. Se desconoce la relevancia clínica de esta disminución; sin embargo, cuando ACTOS y topiramato se usan concomitantemente, controle a los pacientes para un control glucémico adecuado.
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Insuficiencia cardíaca congestiva
ACTOS 15 mg, al igual que otras tiazolidinedionas, puede causar retención de líquidos relacionada con la dosis cuando se usa solo o en combinación con otros medicamentos antidiabéticos y es más común cuando ACTOS 30 mg se usa en combinación con insulina. La retención de líquidos puede provocar o exacerbar la insuficiencia cardíaca congestiva. Se debe observar a los pacientes para detectar signos y síntomas de insuficiencia cardíaca congestiva. Si se desarrolla insuficiencia cardíaca congestiva, se debe manejar de acuerdo con los estándares de atención actuales y se debe considerar la interrupción o la reducción de la dosis de ACTOS [ver CUADRO DE ADVERTENCIA , CONTRAINDICACIONES , y REACCIONES ADVERSAS ].
Hipoglucemia
Los pacientes que reciben ACTOS en combinación con insulina u otros medicamentos antidiabéticos (particularmente los secretagogos de insulina como las sulfonilureas) pueden tener riesgo de hipoglucemia. Puede ser necesaria una reducción de la dosis de la medicación antidiabética concomitante para reducir el riesgo de hipoglucemia [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Efectos hepáticos
Ha habido informes posteriores a la comercialización de insuficiencia hepática fatal y no fatal en pacientes que toman ACTOS 15 mg, aunque los informes contienen información insuficiente para establecer la causa probable. No ha habido evidencia de hepatotoxicidad inducida por fármacos en la base de datos de ensayos clínicos controlados de ACTOS 30 mg hasta la fecha [ver REACCIONES ADVERSAS ].
Los pacientes con diabetes tipo 2 pueden tener enfermedad del hígado graso o enfermedad cardíaca con insuficiencia cardíaca congestiva episódica, las cuales pueden causar anomalías en las pruebas hepáticas, y también pueden tener otras formas de enfermedad hepática, muchas de las cuales pueden tratarse o controlarse. Por lo tanto, se recomienda obtener un panel de pruebas hepáticas (alanina aminotransferasa [ALT] sérica, aspartato aminotransferasa [AST], fosfatasa alcalina y bilirrubina total) y evaluar al paciente antes de iniciar la terapia con ACTOS. En pacientes con pruebas hepáticas anormales, ACTOS 15 mg debe iniciarse con precaución.
Medir las pruebas hepáticas con prontitud en pacientes que reportan síntomas que pueden indicar daño hepático, incluyendo fatiga, anorexia, molestias en la parte superior derecha del abdomen, orina oscura o ictericia. En este contexto clínico, si se descubre que el paciente tiene pruebas hepáticas anormales (ALT superior a 3 veces el límite superior del rango de referencia), se debe interrumpir el tratamiento con ACTOS 15 mg y se debe realizar una investigación para establecer la causa probable. ACTOS no debe reiniciarse en estos pacientes sin otra explicación para las anomalías de las pruebas hepáticas.
Los pacientes que tienen ALT sérica superior a tres veces el rango de referencia con bilirrubina total sérica superior a dos veces el rango de referencia sin etiologías alternativas están en riesgo de daño hepático grave inducido por fármacos, y no deben reiniciar ACTOS. Para pacientes con elevaciones menores de ALT sérica o bilirrubina y con una causa probable alternativa, el tratamiento con ACTOS puede usarse con precaución.
Tumores de vejiga urinaria
Se observaron tumores en la vejiga urinaria de ratas macho en el estudio de carcinogenicidad de dos años [ver Toxicología no clínica ]. Además, durante el ensayo clínico PROactive de tres años, 14 pacientes de 2605 (0,54 %) asignados al azar a ACTOS 15 mg y 5 de 2633 (0,19 %) asignados al azar a placebo fueron diagnosticados con cáncer de vejiga. Después de excluir a los pacientes en los que la exposición al fármaco del estudio fue inferior a un año en el momento del diagnóstico de cáncer de vejiga, hubo 6 (0,23 %) casos con ACTOS 30 mg y dos (0,08 %) casos con placebo. Después de completar el ensayo, se observó a un gran subconjunto de pacientes hasta por 10 años más, con poca exposición adicional a ACTOS. Durante los 13 años de seguimiento PROactive y observacional, la aparición de cáncer de vejiga no difirió entre los pacientes asignados al azar a ACTOS 30 mg o placebo (HR = 1,00; [IC del 95 %: 0,59-1,72]).
Los hallazgos sobre el riesgo de cáncer de vejiga en pacientes expuestos a ACTOS varían entre los estudios observacionales; algunos no encontraron un mayor riesgo de cáncer de vejiga asociado con ACTOS 30 mg, mientras que otros sí.
Un gran estudio de cohorte observacional prospectivo de 10 años realizado en los Estados Unidos no encontró un aumento estadísticamente significativo en el riesgo de cáncer de vejiga en pacientes diabéticos que alguna vez se expusieron a ACTOS, en comparación con aquellos que nunca se expusieron a ACTOS (HR = 1,06 [IC del 95 %: 0,89-1,26 ]).
Un estudio de cohortes retrospectivo realizado con datos del Reino Unido encontró una asociación estadísticamente significativa entre la exposición alguna vez a ACTOS y el cáncer de vejiga (HR: 1,63; [IC 95 %: 1,22-2,19]).
No se detectaron asociaciones entre la dosis acumulada o la duración acumulada de la exposición a ACTOS 15 mg y el cáncer de vejiga en algunos estudios, incluido el estudio observacional de 10 años en los EE. UU., pero sí en otros. Los hallazgos inconsistentes y las limitaciones inherentes a estos y otros estudios impiden interpretaciones concluyentes de los datos de observación.
ACTOS puede estar asociado con un aumento en el riesgo de tumores de vejiga urinaria. No hay datos suficientes para determinar si la pioglitazona es un promotor de tumores de vejiga urinaria.
En consecuencia, ACTOS no debe usarse en pacientes con cáncer de vejiga activo y los beneficios del control glucémico frente a los riesgos desconocidos de recurrencia del cáncer con ACTOS deben considerarse en pacientes con antecedentes de cáncer de vejiga.
Edema
En ensayos clínicos controlados, se notificó edema con mayor frecuencia en pacientes tratados con ACTOS 30 mg que en pacientes tratados con placebo y está relacionado con la dosis [ver REACCIONES ADVERSAS ]. En la experiencia posterior a la comercialización, se han recibido informes de edema de nueva aparición o empeoramiento.
ACTOS 15 mg debe usarse con precaución en pacientes con edema. Debido a que las tiazolidinedionas, incluido ACTOS, pueden causar retención de líquidos, lo que puede exacerbar o provocar insuficiencia cardíaca congestiva, ACTOS 30 mg debe usarse con precaución en pacientes con riesgo de insuficiencia cardíaca congestiva. Los pacientes tratados con ACTOS deben ser monitoreados para detectar signos y síntomas de insuficiencia cardíaca congestiva [ver CUADRO DE ADVERTENCIA , Insuficiencia cardíaca congestiva y INFORMACIÓN DEL PACIENTE ].
Fracturas
En PROactive (el ensayo clínico prospectivo de pioglitazona en eventos macrovasculares), 5238 pacientes con diabetes tipo 2 y antecedentes de enfermedad macrovascular se aleatorizaron para recibir ACTOS (N=2605), con ajuste forzado de hasta 45 mg diarios o placebo (N=2633) además del estándar de atención. Durante un seguimiento medio de 34,5 meses, la incidencia de fractura ósea en mujeres fue del 5,1 % (44/870) para ACTOS 30 mg frente al 2,5 % (23/905) para el placebo. Esta diferencia se notó después del primer año de tratamiento y persistió durante el curso del estudio. La mayoría de las fracturas observadas en pacientes de sexo femenino fueron fracturas no vertebrales, incluidas las extremidades inferiores y las extremidades superiores distales. No se observó un aumento en la incidencia de fracturas en hombres tratados con ACTOS (1,7 %) frente a placebo (2,1 %). Se debe considerar el riesgo de fractura en el cuidado de los pacientes tratados con ACTOS, especialmente las mujeres, y se debe prestar atención a la evaluación y el mantenimiento de la salud ósea de acuerdo con los estándares de atención actuales.
Edema macular
Se ha informado edema macular en la experiencia posterior a la comercialización en pacientes diabéticos que estaban tomando ACTOS u otra tiazolidinediona. Algunos pacientes presentaron visión borrosa o disminución de la agudeza visual, pero otros fueron diagnosticados en un examen oftalmológico de rutina.
La mayoría de los pacientes tenían edema periférico en el momento del diagnóstico de edema macular. Algunos pacientes tuvieron una mejoría en su edema macular después de la interrupción de la tiazolidinediona.
Los pacientes con diabetes deben someterse a exámenes oculares regulares realizados por un oftalmólogo de acuerdo con los estándares de atención actuales. Los pacientes con diabetes que informen cualquier síntoma visual deben ser remitidos de inmediato a un oftalmólogo, independientemente de los medicamentos subyacentes del paciente u otros hallazgos físicos [ver REACCIONES ADVERSAS ].
Resultados macrovasculares
No se han realizado estudios clínicos que establezcan pruebas concluyentes de la reducción del riesgo macrovascular con ACTOS.
Información de asesoramiento para pacientes
Consulte Etiquetado para pacientes aprobado por la FDA ( INFORMACIÓN DEL PACIENTE ).
- Es importante instruir a los pacientes para que se adhieran a las instrucciones dietéticas y para que se hagan pruebas periódicas de glucosa en sangre y de hemoglobina glicosilada. Durante los períodos de estrés, como fiebre, traumatismo, infección o cirugía, los requisitos de medicación pueden cambiar y se debe recordar a los pacientes que busquen atención médica de inmediato.
- Los pacientes que experimentan un aumento de peso inusualmente rápido o edema o que desarrollan dificultad para respirar u otros síntomas de insuficiencia cardíaca mientras toman ACTOS deben informar inmediatamente estos síntomas a un médico.
- Dígales a los pacientes que dejen de tomar ACTOS de inmediato y busquen atención médica inmediata si presentan náuseas, vómitos, dolor abdominal, fatiga, anorexia u orina oscura sin explicación, ya que estos síntomas pueden deberse a hepatotoxicidad.
- Indique a los pacientes que notifiquen de inmediato cualquier signo de hematuria macroscópica u otros síntomas, como disuria o urgencia urinaria, que se desarrollen o aumenten durante el tratamiento, ya que pueden deberse a cáncer de vejiga.
- Dígales a los pacientes que tomen ACTOS 15 mg una vez al día. ACTOS 15 mg se puede tomar con o sin comidas. Si se olvida una dosis en un día, la dosis no debe duplicarse al día siguiente.
- Cuando se utiliza la terapia combinada con insulina u otros medicamentos antidiabéticos, se deben explicar a los pacientes y sus familiares los riesgos de la hipoglucemia, sus síntomas y tratamiento, y las condiciones que predisponen a su desarrollo.
- Informe a las pacientes que el tratamiento con ACTOS 30 mg, al igual que otras tiazolidinedionas, puede provocar un embarazo no deseado en algunas mujeres premenopáusicas con anovulación debido a su efecto sobre la ovulación [ver Uso en poblaciones específicas ].
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Se realizó un estudio de carcinogenicidad de dos años en ratas macho y hembra con dosis orales de hasta 63 mg/kg (aproximadamente 14 veces la dosis oral máxima recomendada en humanos de 45 mg basada en mg/m2). No se observaron tumores inducidos por fármacos en ningún órgano excepto en la vejiga urinaria de ratas macho. Se observaron neoplasias de células de transición benignas y/o malignas en ratas macho a dosis de 4 mg/kg/día y superiores (aproximadamente igual a la dosis oral máxima recomendada en humanos basada en mg/m2). Los cálculos urinarios con irritación e hiperplasia posteriores se postularon como el mecanismo de los tumores de vejiga observados en ratas macho. En 2009 se completó un estudio mecanicista de dos años en ratas macho que utilizaron acidificación dietética para reducir la formación de cálculos. La acidificación dietética disminuyó pero no eliminó los cambios hiperplásicos en la vejiga. La presencia de cálculos exacerbó la respuesta hiperplásica a la pioglitazona pero no se consideró la causa principal de los cambios hiperplásicos.
No se puede excluir la relevancia para los seres humanos de los hallazgos en la vejiga de la rata macho.
También se realizó un estudio de carcinogenicidad de dos años en ratones machos y hembras con dosis orales de hasta 100 mg/kg/día (aproximadamente 11 veces la dosis oral máxima recomendada en humanos en mg/m2). No se observaron tumores inducidos por fármacos en ningún órgano.
El clorhidrato de pioglitazona no fue mutagénico en una batería de estudios de toxicología genética, incluido el ensayo bacteriano de Ames, un ensayo de mutación genética directa de células de mamíferos (CHO/HPRT y AS52/XPRT), un ensayo de citogenética in vitro usando células CHL, un ensayo de síntesis de ADN no programado , y un ensayo de micronúcleos in vivo.
No se observaron efectos adversos sobre la fertilidad en ratas macho y hembra con dosis orales de hasta 40 mg/kg de clorhidrato de pioglitazona al día antes y durante el apareamiento y la gestación (aproximadamente nueve veces la dosis oral máxima recomendada en humanos basada en mg/m2).
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
Los datos limitados con ACTOS en mujeres embarazadas no son suficientes para determinar un riesgo asociado con el fármaco de anomalías congénitas graves o abortos espontáneos. Existen riesgos para la madre y el feto asociados con la diabetes mal controlada durante el embarazo [ver Consideraciones clínicas ].
En estudios de reproducción animal, no se observaron efectos adversos en el desarrollo cuando se administró pioglitazona a ratas y conejas preñadas durante la organogénesis a exposiciones de hasta 5 y 35 veces la dosis clínica de 45 mg, respectivamente, según el área de superficie corporal [ver Datos ].
El riesgo de fondo estimado de defectos congénitos importantes es del 6 al 10 % en mujeres con diabetes pregestacional con HbA1c >7 y se ha informado que es tan alto como del 20 al 25 % en mujeres con HbA1c >10. Se desconoce el riesgo de fondo estimado de aborto espontáneo para la población indicada. En la población general de EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 al 4 % y del 15 al 20 %, respectivamente.
Consideraciones clínicas
Riesgo materno y/o embrionario/fetal asociado a la enfermedad
La diabetes mal controlada en el embarazo aumenta el riesgo materno de cetoacidosis diabética, preeclampsia, abortos espontáneos, parto prematuro, mortinatos y complicaciones en el parto. La diabetes mal controlada aumenta el riesgo fetal de defectos congénitos importantes, mortinatos y morbilidad relacionada con la macrosomía.
Datos
Datos de animales
La pioglitazona administrada a ratas preñadas durante la organogénesis no causó efectos adversos en el desarrollo a una dosis de 20 mg/kg (~5 veces la dosis clínica de 45 mg), pero retrasó el parto y redujo la viabilidad embriofetal a 40 y 80 mg/kg, o ≥ 9 veces la dosis clínica de 45 mg, por superficie corporal. En conejas preñadas a las que se administró pioglitazona durante la organogénesis, no se observaron efectos adversos en el desarrollo con 80 mg/kg (~35 veces la dosis clínica de 45 mg), pero se redujo la viabilidad embriofetal con 160 mg/kg, o ~69 veces la dosis clínica de 45 mg. dosis, por superficie corporal. Cuando las ratas preñadas recibieron pioglitazona durante el final de la gestación y la lactancia, se produjo un retraso en el desarrollo posnatal, atribuido a la disminución del peso corporal, en las crías con dosis maternas de 10 mg/kg y superiores o ≥2 veces la dosis clínica de 45 mg, por área de superficie corporal.
Lactancia
Resumen de riesgos
No hay información sobre la presencia de pioglitazona en la leche humana, los efectos en el lactante o los efectos en la producción de leche. La pioglitazona está presente en la leche de rata; sin embargo, debido a las diferencias específicas de la especie en la fisiología de la lactancia, los datos en animales pueden no predecir de manera confiable los niveles del fármaco en la leche humana. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de la madre de ACTOS 15 mg y cualquier posible efecto adverso en el bebé amamantado de ACTOS 30 mg o de la afección materna subyacente.
Hembras y machos con potencial reproductivo
Analice la posibilidad de un embarazo no deseado con mujeres premenopáusicas, ya que la terapia con ACTOS, al igual que otras tiazolidinedionas, puede provocar la ovulación en algunas mujeres anovulatorias.
Uso pediátrico
No se ha establecido la seguridad y eficacia de ACTOS en pacientes pediátricos.
No se recomienda el uso de ACTOS 15 mg en pacientes pediátricos debido a los efectos adversos observados en adultos, que incluyen retención de líquidos e insuficiencia cardíaca congestiva, fracturas y tumores de la vejiga urinaria [ver ADVERTENCIAS Y PRECAUCIONES ].
Uso geriátrico
Un total de 92 pacientes (15,2 %) tratados con ACTOS en los tres ensayos combinados de monoterapia, doble ciego, controlados con placebo, de 16 a 26 semanas de duración tenían ≥65 años y dos pacientes (0,3 %) tenían ≥75 años. En los dos ensayos combinados de sulfonilurea de 16 a 24 semanas de duración, 201 pacientes (18,7 %) tratados con ACTOS 30 mg tenían ≥65 años y 19 (1,8 %) tenían ≥75 años. En los dos ensayos combinados de metformina de 16 a 24 semanas de duración, 155 pacientes (15,5 %) tratados con ACTOS tenían ≥65 años y 19 (1,9 %) tenían ≥75 años. En los dos ensayos combinados de insulina de 16 a 24 semanas de duración, 272 pacientes (25,4 %) tratados con ACTOS tenían ≥65 años y 22 (2,1 %) tenían ≥75 años.
En PROactive, 1068 pacientes (41,0 %) tratados con ACTOS tenían ≥65 años y 42 (1,6 %) tenían ≥75 años.
En estudios farmacocinéticos con pioglitazona, no se observaron diferencias significativas en los parámetros farmacocinéticos entre pacientes de edad avanzada y jóvenes [ver FARMACOLOGÍA CLÍNICA ].
Aunque las experiencias clínicas no han identificado diferencias en la eficacia y seguridad entre pacientes de edad avanzada (≥65 años) y pacientes más jóvenes, estas conclusiones están limitadas por tamaños de muestra pequeños para pacientes ≥75 años.
SOBREDOSIS
Durante los ensayos clínicos controlados, se notificó un caso de sobredosis con ACTOS 30 mg. Un paciente masculino tomó 120 mg por día durante cuatro días, luego 180 mg por día durante siete días. El paciente negó síntomas clínicos durante este período.
En caso de sobredosis, se debe iniciar un tratamiento de soporte adecuado de acuerdo con los signos y síntomas clínicos del paciente.
CONTRAINDICACIONES
- Inicio en pacientes con insuficiencia cardíaca clase III o IV de la NYHA establecida [ver CUADRO DE ADVERTENCIA ].
- Uso en pacientes con hipersensibilidad conocida a la pioglitazona o a cualquier otro componente de ACTOS.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
ACTOS 15 mg es una tiazolidinediona que depende de la presencia de insulina para su mecanismo de acción. ACTOS disminuye la resistencia a la insulina en la periferia y en el hígado, lo que da como resultado una mayor eliminación de glucosa dependiente de la insulina y una disminución de la producción de glucosa hepática. La pioglitazona no es un secretagogo de insulina. La pioglitazona es un agonista del receptor gamma activado por el proliferador de peroxisomas (PPAR?). Los receptores PPAR se encuentran en tejidos importantes para la acción de la insulina, como el tejido adiposo, el músculo esquelético y el hígado. ¿Activación de PPAR? Los receptores nucleares modulan la transcripción de una serie de genes sensibles a la insulina implicados en el control del metabolismo de la glucosa y los lípidos.
En modelos animales de diabetes, la pioglitazona reduce la hiperglucemia, la hiperinsulinemia y la hipertrigliceridemia características de los estados de resistencia a la insulina, como la diabetes tipo 2. Los cambios metabólicos producidos por la pioglitazona dan como resultado una mayor capacidad de respuesta de los tejidos insulinodependientes y se observan en numerosos modelos animales de resistencia a la insulina.
Debido a que la pioglitazona aumenta los efectos de la insulina circulante (al disminuir la resistencia a la insulina), no reduce la glucosa en sangre en modelos animales que carecen de insulina endógena.
Farmacodinámica
Los estudios clínicos demuestran que ACTOS 15 mg mejora la sensibilidad a la insulina en pacientes resistentes a la insulina. ACTOS mejora la capacidad de respuesta celular a la insulina, aumenta la eliminación de glucosa dependiente de la insulina y mejora la sensibilidad hepática a la insulina. En pacientes con diabetes tipo 2, la disminución de la resistencia a la insulina producida por ACTOS da como resultado concentraciones de glucosa en plasma más bajas, concentraciones de insulina en plasma más bajas y valores de HbA1c más bajos. En ensayos clínicos controlados, ACTOS tuvo un efecto aditivo en el control glucémico cuando se usó en combinación con una sulfonilurea, metformina o insulina [ver Estudios clínicos ].
Los pacientes con anomalías de los lípidos se incluyeron en los ensayos clínicos con ACTOS. En general, los pacientes tratados con ACTOS 15 mg tuvieron disminuciones promedio en los triglicéridos séricos, aumentos promedio en el colesterol HDL y cambios promedio no consistentes en el colesterol LDL y total. No hay evidencia concluyente del beneficio macrovascular con ACTOS [ver ADVERTENCIAS Y PRECAUCIONES y REACCIONES ADVERSAS ].
En un estudio de monoterapia de rango de dosis, controlado con placebo, de 26 semanas de duración, los triglicéridos séricos medios disminuyeron en los grupos de dosis de 15 mg de ACTOS de 15 mg, 30 mg y 45 mg en comparación con un aumento medio en el grupo de placebo. El colesterol HDL medio aumentó en mayor medida en los pacientes tratados con ACTOS 30 mg que en los pacientes tratados con placebo. No hubo diferencias consistentes para el colesterol LDL y total en los pacientes tratados con ACTOS en comparación con el placebo (consulte la Tabla 14).
En los otros dos estudios de monoterapia (16 semanas y 24 semanas) y en los estudios de terapia combinada con sulfonilurea (16 semanas y 24 semanas), metformina (16 semanas y 24 semanas) o insulina (16 semanas y 24 semanas), los resultados fueron generalmente consistente con los datos anteriores.
Farmacocinética
Después de la administración una vez al día de 15 mg de ACTOS, las concentraciones séricas en estado estacionario tanto de pioglitazona como de sus principales metabolitos activos, M-III (cetoderivado de pioglitazona) y M-IV (derivado hidroxilado de pioglitazona), se alcanzan en siete días. En estado estacionario, M-III y M-IV alcanzan concentraciones séricas iguales o superiores a las de pioglitazona. En el estado estacionario, tanto en voluntarios sanos como en pacientes con diabetes tipo 2, la pioglitazona comprende aproximadamente del 30 % al 50 % de las concentraciones séricas máximas de pioglitazona total (pioglitazona más metabolitos activos) y del 20 % al 25 % del AUC total.
La Cmax, el AUC y las concentraciones séricas mínimas (Cmin) de pioglitazona y M-III y M-IV aumentaron proporcionalmente con las dosis administradas de 15 mg y 30 mg al día.
Absorción
Luego de la administración oral de pioglitazona, la Tmax de pioglitazona estuvo dentro de las dos horas. Los alimentos retrasan el Tmax de tres a cuatro horas pero no alteran el grado de absorción (AUC).
Distribución
El volumen de distribución aparente medio (Vd/F) de pioglitazona tras la administración de una dosis única es de 0,63 ± 0,41 (media ± DE) l/kg de peso corporal. La pioglitazona se une ampliamente a las proteínas (>99 %) en el suero humano, principalmente a la albúmina sérica. La pioglitazona también se une a otras proteínas séricas, pero con menor afinidad. M-III y M-IV también se unen extensamente (>98%) a la albúmina sérica.
Metabolismo
La pioglitazona se metaboliza ampliamente por hidroxilación y oxidación; los metabolitos también se convierten parcialmente en conjugados de glucurónido o sulfato. Los metabolitos M-III y M-IV son los principales metabolitos activos circulantes en humanos.
Los datos in vitro demuestran que múltiples isoformas de CYP están involucradas en el metabolismo de la pioglitazona, que incluyen CYP2C8 y, en menor grado, CYP3A4 con contribuciones adicionales de una variedad de otras isoformas, incluida la CYP1A1 principalmente extrahepática. El estudio in vivo de pioglitazona en combinación con gemfibrozilo, un potente inhibidor de CYP2C8, mostró que pioglitazona es un sustrato de CYP2C8 [ver DOSIFICACIÓN Y ADMINISTRACIÓN y INTERACCIONES CON LA DROGAS ]. Las proporciones urinarias de 6β-hidroxicortisol/cortisol medidas en pacientes tratados con ACTOS 30 mg mostraron que la pioglitazona no es un inductor potente de la enzima CYP3A4.
Excreción y Eliminación
Luego de la administración oral, aproximadamente del 15% al 30% de la dosis de pioglitazona se recupera en la orina. La eliminación renal de pioglitazona es insignificante y el fármaco se excreta principalmente como metabolitos y sus conjugados. Se supone que la mayor parte de la dosis oral se excreta en la bilis sin cambios o como metabolitos y se elimina en las heces.
La semivida sérica media (t1/2) de la pioglitazona y sus metabolitos (M-III y M-IV) varía de tres a siete horas y de 16 a 24 horas, respectivamente. La pioglitazona tiene un aclaramiento aparente, CL/F, calculado en cinco a siete L/hr.
Insuficiencia renal
La vida media de eliminación sérica de pioglitazona, M-III y M-IV permanece sin cambios en pacientes con insuficiencia renal moderada (aclaramiento de creatinina [CLcr] de 30 a 50 ml/min) y grave (CLcr
Deterioro hepático
En comparación con los controles sanos, los sujetos con función hepática alterada (Child-Turcotte-Pugh Grado B/C) tienen una reducción aproximada del 45 % en la pioglitazona y la pioglitazona total (pioglitazona, M-III y M-IV) en la Cmáx media, pero ningún cambio en los valores medios de AUC. Por lo tanto, no es necesario ajustar la dosis en pacientes con insuficiencia hepática.
Hay informes posteriores a la comercialización de insuficiencia hepática con ACTOS y los ensayos clínicos generalmente han excluido a los pacientes con ALT sérica > 2,5 veces el límite superior del rango de referencia. Tenga precaución en pacientes con enfermedad hepática [ver ADVERTENCIAS Y PRECAUCIONES ].
Pacientes geriátricos
En sujetos ancianos sanos, la Cmax de pioglitazona no fue significativamente diferente, pero los valores de AUC fueron aproximadamente un 21 % más altos que los alcanzados en sujetos más jóvenes. La t1/2 media de pioglitazona también se prolongó en sujetos de edad avanzada (alrededor de diez horas) en comparación con sujetos más jóvenes (alrededor de siete horas). Estos cambios no fueron de una magnitud que se consideraría clínicamente relevante.
Pacientes pediátricos
No se ha establecido la seguridad y eficacia de pioglitazona en pacientes pediátricos. No se recomienda el uso de ACTOS 15 mg en pacientes pediátricos [ver Uso en poblaciones específicas ].
Género
Los valores medios de Cmax y AUC de pioglitazona aumentaron entre un 20 % y un 60 % en mujeres en comparación con los hombres. En ensayos clínicos controlados, las disminuciones de HbA1c desde el inicio fueron generalmente mayores para las mujeres que para los hombres (diferencia media promedio en HbA1c 0,5%). Debido a que la terapia debe individualizarse para cada paciente a fin de lograr el control glucémico, no se recomienda ajustar la dosis basándose únicamente en el género.
Etnicidad
No se dispone de datos farmacocinéticos entre varios grupos étnicos.
Interacciones fármaco-fármaco
Toxicología Animal Y/o Farmacología
Se ha observado agrandamiento del corazón en ratones (100 mg/kg), ratas (4 mg/kg y más) y perros (3 mg/kg) tratados por vía oral con clorhidrato de pioglitazona (aproximadamente 11, 1 y 2 veces la cantidad máxima recomendada por vía oral en humanos). dosis para ratones, ratas y perros, respectivamente, basada en mg/m2). En un estudio de un año con ratas, se produjo una muerte prematura relacionada con el fármaco debido a una aparente disfunción cardíaca con una dosis oral de 160 mg/kg/día (aproximadamente 35 veces la dosis oral máxima recomendada en humanos basada en mg/m2). Se observó agrandamiento del corazón en un estudio de 13 semanas en monos con dosis orales de 8,9 mg/kg y superiores (aproximadamente cuatro veces la dosis oral máxima recomendada en humanos basada en mg/m2), pero no en un estudio de 52 semanas con dosis orales. hasta 32 mg/kg (aproximadamente 13 veces la dosis oral humana máxima recomendada en mg/m2).
Estudios clínicos
Monoterapia
Se realizaron tres ensayos aleatorizados, doble ciego, controlados con placebo con una duración de 16 a 26 semanas para evaluar el uso de ACTOS como monoterapia en pacientes con diabetes tipo 2. Estos ensayos examinaron ACTOS 15 mg en dosis de hasta 45 mg o placebo una vez al día en un total de 865 pacientes.
En un ensayo de monoterapia de rango de dosis de 26 semanas, 408 pacientes con diabetes tipo 2 fueron aleatorizados para recibir 7,5 mg, 15 mg, 30 mg o 45 mg de ACTOS o placebo una vez al día. La terapia con cualquier agente antidiabético anterior se interrumpió ocho semanas antes del período doble ciego. El tratamiento con 15 mg, 30 mg y 45 mg de ACTOS 30 mg produjo mejoras estadísticamente significativas en la HbA1c y la glucosa plasmática en ayunas (FPG) al final en comparación con el placebo (ver Figura 1, Tabla 17).
La Figura 1 muestra el curso temporal de los cambios en HbA1c en este estudio de 26 semanas.
Figura 1. Cambio medio desde el inicio para HbA1c en un estudio de rango de dosis controlado con placebo de 26 semanas (valores observados)
En un ensayo de monoterapia controlado con placebo de 24 semanas, 260 pacientes con diabetes tipo 2 fueron aleatorizados a uno de los dos grupos de tratamiento de ACTOS con titulación forzada o un grupo de placebo con titulación simulada. La terapia con cualquier agente antidiabético anterior se interrumpió seis semanas antes del período doble ciego. En un grupo de tratamiento con ACTOS 15 mg, los pacientes recibieron una dosis inicial de 7,5 mg una vez al día. Después de cuatro semanas, la dosis se aumentó a 15 mg una vez al día y después de otras cuatro semanas, la dosis se aumentó a 30 mg una vez al día durante el resto del ensayo (16 semanas). En el segundo grupo de tratamiento con ACTOS, los pacientes recibieron una dosis inicial de 15 mg una vez al día y se ajustó a 30 mg una vez al día y 45 mg una vez al día de manera similar. El tratamiento con ACTOS 15 mg, como se describe, produjo mejoras estadísticamente significativas en HbA1c y FPG al final del estudio en comparación con el placebo (consulte la Tabla 18).
En un ensayo de monoterapia de 16 semanas, 197 pacientes con diabetes tipo 2 fueron aleatorizados para recibir tratamiento con 30 mg de ACTOS o placebo una vez al día. La terapia con cualquier agente antidiabético anterior se interrumpió seis semanas antes del período doble ciego. El tratamiento con 30 mg de ACTOS produjo mejoras estadísticamente significativas en HbA1c y FPG al final en comparación con el placebo (consulte la Tabla 19).
Terapia de combinación
Se realizaron tres ensayos clínicos aleatorizados, doble ciego, controlados con placebo, de 16 semanas de duración para evaluar los efectos de ACTOS (15 mg y/o 30 mg) sobre el control glucémico en pacientes con diabetes tipo 2 que no estaban adecuadamente controlados (HbA1c ≥8 %) a pesar de la terapia actual con una sulfonilurea, metformina o insulina. Además, se realizaron tres ensayos clínicos aleatorizados y doble ciego de 24 semanas para evaluar los efectos de ACTOS 30 mg frente a ACTOS 45 mg en el control glucémico en pacientes con diabetes tipo 2 que no estaban adecuadamente controlados (HbA1c ≥8 %) a pesar de las medidas actuales. terapia con una sulfonilurea, metformina o insulina. El tratamiento anterior de la diabetes puede haber sido monoterapia o terapia combinada.
Adición a los ensayos de sulfonilurea
Se realizaron dos ensayos clínicos con ACTOS en combinación con una sulfonilurea. Ambos estudios incluyeron pacientes con diabetes tipo 2 en cualquier dosis de una sulfonilurea, ya sea sola o en combinación con otro agente antidiabético. Todos los demás agentes antidiabéticos se retiraron al menos tres semanas antes de comenzar el tratamiento del estudio.
En el primer estudio, 560 pacientes fueron aleatorizados para recibir 15 mg o 30 mg de ACTOS 30 mg o placebo una vez al día durante 16 semanas además de su régimen actual de sulfonilureas. El tratamiento con ACTOS como complemento de la sulfonilurea produjo mejoras estadísticamente significativas en la HbA1c y la GPA al final del estudio en comparación con el complemento del placebo con la sulfonilurea (consulte la Tabla 20).
En el segundo ensayo, 702 pacientes fueron aleatorizados para recibir 30 mg o 45 mg de ACTOS una vez al día durante 24 semanas además de su régimen actual de sulfonilureas. La reducción media desde el inicio en la semana 24 en HbA1c fue del 1,6 % para la dosis de 30 mg y del 1,7 % para la dosis de 45 mg (consulte la Tabla 21). La reducción media desde el inicio en la semana 24 en FPG fue de 52 mg/dl para la dosis de 30 mg y de 56 mg/dl para la dosis de 45 mg.
El efecto terapéutico de ACTOS en combinación con sulfonilurea se observó en pacientes independientemente de la dosis de sulfonilurea.
Adición a los ensayos de metformina
Se realizaron dos ensayos clínicos con ACTOS 30 mg en combinación con metformina. Ambos ensayos incluyeron pacientes con diabetes tipo 2 en cualquier dosis de metformina, ya sea sola o en combinación con otro agente antidiabético. Todos los demás agentes antidiabéticos se retiraron al menos tres semanas antes de comenzar el tratamiento del estudio.
En el primer ensayo, 328 pacientes fueron aleatorizados para recibir 30 mg de ACTOS o placebo una vez al día durante 16 semanas además de su régimen actual de metformina. El tratamiento con ACTOS 30 mg como complemento de metformina produjo mejoras estadísticamente significativas en HbA1c y GPA al final del estudio en comparación con el complemento de metformina con placebo (consulte la Tabla 22).
En el segundo ensayo, 827 pacientes fueron aleatorizados para recibir 30 mg o 45 mg de ACTOS 30 mg una vez al día durante 24 semanas además de su régimen actual de metformina. La reducción media desde el valor inicial en la semana 24 en HbA1c fue del 0,8 % para la dosis de 30 mg y del 1,0 % para la dosis de 45 mg (consulte la Tabla 23). La reducción media desde el inicio en la semana 24 en FPG fue de 38 mg/dl para la dosis de 30 mg y de 51 mg/dl para la dosis de 45 mg.
El efecto terapéutico de ACTOS en combinación con metformina se observó en pacientes independientemente de la dosis de metformina.
Complemento a los ensayos de insulina
Se realizaron dos ensayos clínicos con ACTOS 15 mg en combinación con insulina. Ambos ensayos incluyeron pacientes con diabetes tipo 2 que recibían insulina, ya sea sola o en combinación con otro agente antidiabético. Todos los demás agentes antidiabéticos se retiraron antes de comenzar el tratamiento del estudio. En el primer ensayo, 566 pacientes fueron aleatorizados para recibir 15 mg o 30 mg de ACTOS 15 mg o placebo una vez al día durante 16 semanas además de su régimen de insulina. El tratamiento con 30 mg de ACTOS como complemento de la insulina produjo mejoras estadísticamente significativas en la HbA1c y la GPA al final del estudio en comparación con el complemento de insulina con placebo (consulte la Tabla 24). La dosis diaria media de insulina al inicio del estudio en cada grupo de tratamiento fue de aproximadamente 70 unidades. La mayoría de los pacientes (75 % en general, 86 % tratados con placebo, 77 % tratados con ACTOS 15 mg y 61 % tratados con ACTOS 30 mg) no experimentaron cambios en su dosis diaria de insulina desde el inicio hasta la visita final del estudio. El cambio medio desde el inicio en la dosis diaria de insulina (incluidos los pacientes sin modificaciones de la dosis de insulina) fue de -3 unidades en los pacientes tratados con ACTOS 15 mg, -8 unidades en los pacientes tratados con ACTOS 30 mg y -1 unidad en los pacientes tratados con placebo.
En el segundo ensayo, 690 pacientes que recibieron una mediana de 60 unidades por día de insulina fueron aleatorizados para recibir 30 mg o 45 mg de ACTOS una vez al día durante 24 semanas además de su régimen de insulina actual. La reducción media desde el inicio en la semana 24 en HbA1c fue del 1,2 % para la dosis de 30 mg y del 1,5 % para la dosis de 45 mg. La reducción media desde el inicio en la Semana 24 en FPG fue de 32 mg/dl para la dosis de 30 mg y de 46 mg/dl para la dosis de 45 mg (consulte la Tabla 25). La dosis diaria media de insulina al inicio del estudio en ambos grupos de tratamiento fue de aproximadamente 70 unidades. La mayoría de los pacientes (55 % en general, 58 % tratados con ACTOS 30 mg y 52 % tratados con ACTOS 45 mg) no experimentaron cambios en su dosis diaria de insulina desde el inicio hasta la visita final del estudio. El cambio medio desde el inicio en la dosis diaria de insulina (incluidos los pacientes sin modificaciones de la dosis de insulina) fue de -5 unidades en los pacientes tratados con ACTOS 30 mg y -8 unidades en los pacientes tratados con ACTOS 45 mg.
El efecto terapéutico de ACTOS en combinación con insulina se observó en pacientes independientemente de la dosis de insulina.
INFORMACIÓN DEL PACIENTE
ACTOS (ak-TOS) (pioglitazona) Tabletas
Lea detenidamente esta Guía del medicamento antes de comenzar a tomar ACTOS 15 mg y cada vez que renueve su receta. Es posible que haya nueva información. Esta información no reemplaza la conversación con su médico sobre su condición médica o su tratamiento. Si tiene alguna duda sobre ACTOS, consulte a su médico o farmacéutico.
¿Cuál es la información más importante que debo saber sobre ACTOS?
ACTOS puede causar efectos secundarios graves, como insuficiencia cardíaca nueva o peor.
- ACTOS 15 mg puede hacer que su cuerpo retenga líquidos adicionales (retención de líquidos), lo que provoca hinchazón (edema) y aumento de peso. El exceso de líquido corporal puede empeorar algunos problemas cardíacos o provocar insuficiencia cardíaca. Insuficiencia cardíaca significa que su corazón no bombea sangre lo suficientemente bien
- No tome ACTOS si tiene insuficiencia cardíaca grave
- Si tiene insuficiencia cardíaca con síntomas (como dificultad para respirar o hinchazón), incluso si estos síntomas no son graves, es posible que ACTOS no sea adecuado para usted.
Llame a su médico de inmediato si tiene alguno de los siguientes:
- hinchazón o retención de líquidos, especialmente en los tobillos o las piernas
- dificultad para respirar o dificultad para respirar, especialmente cuando se acuesta
- un aumento de peso inusualmente rápido
- cansancio inusual
ACTOS puede tener otros efectos secundarios graves. Consulte "¿Cuáles son los posibles efectos secundarios de ACTOS?"
¿Qué es ACTOS?
ACTOS 15 mg es un medicamento recetado que se usa con dieta y ejercicio para mejorar el control del azúcar en la sangre (glucosa) en adultos con diabetes tipo 2. ACTOS es un medicamento para la diabetes llamado pioglitazona que se puede tomar solo o con otros medicamentos para la diabetes.
No se sabe si ACTOS es seguro y eficaz en niños menores de 18 años. No se recomienda el uso de ACTOS en niños.
ACTOS no es para personas con diabetes tipo 1.
ACTOS 30 mg no es para personas con cetoacidosis diabética (aumento de cetonas en la sangre o la orina).
¿Quién no debe tomar ACTOS?
Consulte "¿Cuál es la información más importante que debo saber sobre ACTOS 15 mg?"
No tome ACTOS 15 mg si usted:
- tiene insuficiencia cardíaca grave
- es alérgico a cualquiera de los ingredientes de ACTOS. Consulte el final de esta Guía del medicamento para obtener una lista completa de los ingredientes de ACTOS
Hable con su médico antes de tomar ACTOS si tiene alguna de estas condiciones.
¿Qué debo decirle a mi médico antes de tomar ACTOS 30 mg?
Antes de tomar ACTOS, informe a su médico si:
- tener insuficiencia cardíaca
- tiene diabetes tipo 1 (“juvenil”) o cetoacidosis diabética
- tiene un tipo de enfermedad ocular diabética que causa hinchazón en la parte posterior del ojo (edema macular)
- tiene problemas hepáticos
- tiene o ha tenido cáncer de vejiga
- está embarazada o planea quedar embarazada. No se sabe si ACTOS 15mg puede dañar a su bebé nonato. Hable con su médico si está embarazada o planea quedar embarazada sobre la mejor manera de controlar sus niveles de glucosa en sangre durante el embarazo.
- es una mujer premenopáusica (antes del “cambio de vida”) que no tiene períodos regulares o en absoluto. ACTOS 30 mg puede aumentar su probabilidad de quedar embarazada. Hable con su médico sobre las opciones de control de la natalidad mientras toma ACTOS. Informe a su médico de inmediato si queda embarazada mientras toma ACTOS
- están amamantando o planean amamantar. No se sabe si ACTOS pasa a la leche y si puede hacerle daño a su bebé. Hable con su médico sobre la mejor manera de controlar sus niveles de glucosa en sangre mientras amamanta.
Informe a su médico sobre todos los medicamentos que toma incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos a base de hierbas.
ACTOS 30 mg y algunos de sus otros medicamentos pueden afectarse entre sí. Es posible que necesite cambiar su dosis de ACTOS 15 mg o de ciertos otros medicamentos.
Conozca los medicamentos que toma. Mantenga una lista de sus medicamentos y muéstresela a su médico y farmacéutico antes de comenzar un nuevo medicamento. Le dirán si está bien tomar ACTOS 15 mg con otros medicamentos.
¿Cómo debo tomar ACTOS 15 mg?
- Tome ACTOS 15 mg exactamente como le indique su médico.
- Su médico puede cambiar su dosis de ACTOS. No cambie su dosis de ACTOS a menos que su médico se lo indique.
- ACTOS puede recetarse solo o con otros medicamentos para la diabetes. Esto dependerá de qué tan bien esté controlado su nivel de azúcar en la sangre.
- Tome ACTOS 15 mg una vez al día, con o sin alimentos
- Si olvida una dosis de ACTOS 15 mg, tome la siguiente dosis según lo prescrito, a menos que su médico le indique lo contrario. No tome dos dosis a la vez al día siguiente.
- Si toma demasiado ACTOS, llame a su médico o vaya a la sala de emergencias del hospital más cercano de inmediato.
- Si su cuerpo está bajo estrés, como por fiebre, infección, accidente o cirugía, es posible que deba cambiar la dosis de sus medicamentos para la diabetes. Llame a su doctor inmediatamente
- Manténgase en su dieta y programas de ejercicio y mida su nivel de azúcar en la sangre regularmente mientras toma ACTOS
- Su médico debe realizar ciertos análisis de sangre antes de comenzar y mientras toma ACTOS
- Su médico también debe realizar pruebas de hemoglobina A1C para verificar qué tan bien se controla su nivel de azúcar en la sangre con ACTOS.
- Su médico debe revisar sus ojos regularmente mientras toma ACTOS
¿Cuáles son los posibles efectos secundarios de ACTOS?
ACTOS puede causar efectos secundarios graves que incluyen:
- Consulte "¿Cuál es la información más importante que debo saber sobre ACTOS?"
- nivel bajo de azúcar en la sangre (hipoglucemia). Esto puede suceder si se salta comidas, si también usa otro medicamento que reduce el nivel de azúcar en la sangre o si tiene ciertos problemas médicos. Se pueden producir aturdimiento, mareos, temblores o hambre si su nivel de azúcar en la sangre es demasiado bajo. Llame a su médico si los niveles bajos de azúcar en la sangre son un problema para usted
- problemas hepáticos Llame a su médico de inmediato si tiene:
- náuseas o vómitos
- dolor de estómago
- cansancio inusual o inexplicable
- pérdida de apetito
- orina oscura
- coloración amarillenta de la piel o del blanco de los ojos
- cáncer de vejiga. Puede haber una mayor probabilidad de tener cáncer de vejiga cuando toma ACTOS. No debe tomar ACTOS 15 mg si está recibiendo tratamiento para el cáncer de vejiga. Informe a su médico de inmediato si tiene alguno de los siguientes síntomas de cáncer de vejiga:
- sangre o un color rojo en la orina
- una mayor necesidad de orinar
- dolor al orinar
- huesos rotos (fracturas). Por lo general, en la mano, la parte superior del brazo o el pie en las mujeres. Hable con su médico para que le aconseje sobre cómo mantener sus huesos sanos.
- enfermedad ocular diabética con hinchazón en la parte posterior del ojo (edema macular). Informe a su médico de inmediato si tiene algún cambio en su visión. Su médico debe revisar sus ojos regularmente.
- liberación de un óvulo de un ovario en una mujer (ovulación) que conduce al embarazo. La ovulación puede ocurrir cuando las mujeres premenopáusicas que no tienen períodos mensuales regulares toman ACTOS. Esto puede aumentar su probabilidad de quedar embarazada
- Síntomas similares a los del resfriado (infección del tracto respiratorio superior)
- dolor de cabeza
- Infección sinusal
- dolor muscular
- dolor de garganta
Los efectos secundarios más comunes de ACTOS incluyen:
Informe a su médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los efectos secundarios de ACTOS. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar ACTOS 15 mg?
- Almacene 15 mg de ACTOS a una temperatura de 20 °C a 25 °C (68 °F a 77 °F). Conservar ACTOS en el envase original y proteger de la luz
- Mantenga el frasco de ACTOS bien cerrado y mantenga las tabletas secas.
- Mantenga ACTOS y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de ACTOS
A veces, los medicamentos se recetan para fines distintos a los enumerados en la Guía del medicamento. No use ACTOS para una condición para la cual no fue recetado. No le dé ACTOS a otras personas, incluso si tienen los mismos síntomas que usted. Puede que les haga daño.
Esta Guía del medicamento resume la información más importante sobre ACTOS. Si desea obtener más información, hable con su médico. Puede pedirle a su médico o farmacéutico información sobre ACTOS escrita para profesionales de la salud. Para obtener más información, visite www.actos.com o llame al 1-877-825-3327.
¿Cuáles son los ingredientes de ACTOS 15mg?
Ingrediente activo: pioglitazona Ingredientes inactivos: lactos 15 mge monohidrato, hidroxipropilcelulosa, carboximetilcelulosa cálcica y estearato de magnesio
Esta Guía del medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de EE. UU.
