Amaryl 1mg, 2mg, 4mg Glimepiride Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Amaryl 1 mg y cómo se usa?
Amaryl 4mg es un medicamento recetado que se usa para tratar los síntomas de la diabetes mellitus tipo 2. Amaryl 4mg se puede usar solo o con otros medicamentos.
Amaryl 2mg pertenece a una clase de medicamentos llamados Antidiabéticos, Sulfonilureas.
No se sabe si Amaryl es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Amaryl?
Amaryl puede causar efectos secundarios graves que incluyen:
- piel pálida o amarillenta,
- orina de color oscuro,
- confusión,
- debilidad, y
- fiebre
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Amaryl incluyen:
- dolor de cabeza,
- mareo,
- debilidad,
- náuseas, y
- baja azúcar en la sangre
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Amaryl. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
AMARYL es una sulfonilurea oral que contiene el ingrediente activo glimepirida. Químicamente, la glimepirida se identifica como 1-[[p-[2-(3-etil-4-metil-2-oxo-3-pirrolina-1-carboxamido) etil]fenil]sulfonil]-3-(trans-4- metilciclohexil)urea (C24H34N4O5S) con un peso molecular de 490,62. La glimepirida es un polvo blanco a blanco amarillento, cristalino, inodoro o prácticamente inodoro y es prácticamente insoluble en agua. La fórmula estructural es:
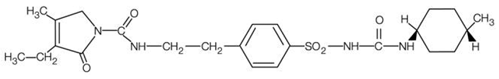
Las tabletas AMARYL contienen el ingrediente activo glimepirida y los siguientes ingredientes inactivos: lactosa (hidratada), glicolato de almidón sódico, povidona, celulosa microcristalina y estearato de magnesio. Además, las tabletas de 1 mg de AMARYL contienen rojo de óxido férrico, las tabletas de 2 mg de AMARYL contienen amarillo de óxido férrico y laca de aluminio n.° 2 azul FD&C, y las tabletas de 4 mg de AMARYL contienen laca de aluminio n.° 2 azul FD&C.
INDICACIONES
AMARYL 2 mg está indicado como complemento de la dieta y el ejercicio para mejorar el control glucémico en adultos con diabetes mellitus tipo 2 [ver Estudios clínicos ].
Importantes limitaciones de uso
AMARYL no debe usarse para el tratamiento de la diabetes mellitus tipo 1 o la cetoacidosis diabética, ya que no sería eficaz en estos entornos.
DOSIFICACIÓN Y ADMINISTRACIÓN
Dosis recomendada
AMARYL 1mg debe administrarse con el desayuno o la primera comida principal del día.
La dosis inicial recomendada de AMARYL es de 1 mg o 2 mg una vez al día. Los pacientes con mayor riesgo de hipoglucemia (p. ej., ancianos o pacientes con insuficiencia renal) deben comenzar con 1 mg una vez al día [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
Después de alcanzar una dosis diaria de 2 mg, se pueden realizar aumentos de dosis adicionales en incrementos de 1 mg o 2 mg según la respuesta glucémica del paciente. La titulación ascendente no debe ocurrir con más frecuencia que cada 1-2 semanas. Se recomienda un esquema de titulación conservador para pacientes con mayor riesgo de hipoglucemia [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
La dosis máxima recomendada es de 8 mg una vez al día.
Los pacientes que son transferidos a AMARYL 1 mg de sulfonilureas de vida media más prolongada (p. ej., clorpropamida) pueden tener un efecto farmacológico superpuesto durante 1 a 2 semanas y deben ser monitoreados apropiadamente para detectar hipoglucemia.
Cuando se coadministra colesevelam con glimepirida, se reduce la concentración plasmática máxima y la exposición total a glimepirida. Por lo tanto, AMARYL 2 mg debe administrarse al menos 4 horas antes que colesevelam.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
AMARYL 4mg está formulado en comprimidos de:
- 1 mg (rosado, de cara plana, oblongo con lados con muescas en doble bisección, impreso con "AMA RYL" en un lado)
- 2 mg (verde, de cara plana, oblongo con lados con muescas en doble bisección, impreso con "AMA RYL" en un lado)
- 4 mg (azul, cara plana, oblonga con lados con muescas en doble bisección, impreso con "AMA RYL" en un lado)
Almacenamiento y manipulación
AMARILO Las tabletas están disponibles en las siguientes concentraciones y tamaños de paquete:
1 mg (rosado, de cara plana, oblongo con lados con muescas en doble bisección, impreso con "AMA RYL" en un lado) en botellas de 100 ( CDN 0039-0221-10)
2 miligramos (verde, de cara plana, oblongo con lados con muescas en doble bisección, impreso con "AMA RYL" en un lado) en botellas de 100 ( CDN 0039-0222-10)
4 miligramos (azul, de cara plana, oblongo con lados con muescas en doble bisección, impreso con "AMA RYL" en un lado) en botellas de 100 ( CDN 0039-0223-10)
Almacenar a 25°C (77°F); excursiones permitidas a 20 - 25°C (68 - 77°F) (ver Temperatura ambiente controlada por USP ).
Dispensar en recipientes bien cerrados con cierres de seguridad.
sanofi-aventis US LLC, Bridgewater, NJ 08807, UNA EMPRESA DE SANOFI. Revisado diciembre 2016
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas graves se analizan con más detalle a continuación y en otras partes de la etiqueta:
- Hipoglucemia [ver ADVERTENCIAS Y PRECAUCIONES ]
- Anemia hemolítica [ver ADVERTENCIAS Y PRECAUCIONES ]
En los ensayos clínicos, las reacciones adversas más comunes con AMARYL 4 mg fueron hipoglucemia, mareos, astenia, dolor de cabeza y náuseas.
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Aproximadamente 2800 pacientes con diabetes tipo 2 han sido tratados con AMARYL 4 mg en los ensayos clínicos controlados. En estos ensayos, aproximadamente 1700 pacientes fueron tratados con AMARYL durante al menos 1 año.
La Tabla 1 resume los eventos adversos, además de la hipoglucemia, que se informaron en 11 ensayos combinados controlados con placebo, ya sea que se considere que posiblemente o probablemente no estén relacionados con la medicación del estudio. La duración del tratamiento varió de 13 semanas a 12 meses. Los términos que se informan representan aquellos que ocurrieron con una incidencia de ≥ 5 % entre los pacientes tratados con AMARYL y con mayor frecuencia que en los pacientes que recibieron placebo.
Hipoglucemia
En un ensayo de monoterapia aleatorizado, doble ciego, controlado con placebo de 14 semanas de duración, los pacientes que ya recibían tratamiento con sulfonilureas se sometieron a un período de lavado de 3 semanas y luego se aleatorizaron para recibir AMARYL 1 mg, 4 mg, 8 mg o placebo. Los pacientes asignados al azar a AMARYL 4 mg u 8 mg se sometieron a una titulación forzada de una dosis inicial de 1 mg a estas dosis finales, según lo toleraran [ver Estudios clínicos ]. La incidencia general de posible hipoglucemia (definida por la presencia de al menos un síntoma que el investigador creyó que podría estar relacionado con la hipoglucemia; no se requirió una medición de glucosa simultánea) fue del 4 % para AMARYL 1 mg, 17 % para AMARYL 4 mg, 16 % para AMARILO 8 mg y 0% para placebo. Todos estos eventos fueron autotratados.
En un ensayo de monoterapia aleatorizado, doble ciego, controlado con placebo de 22 semanas de duración, los pacientes recibieron una dosis inicial de 1 mg de AMARYL o placebo al día. La dosis de AMARYL 2 mg se ajustó a un objetivo de glucosa plasmática en ayunas de 90-150 mg/dL. Las dosis diarias finales de AMARYL 2 mg fueron 1, 2, 3, 4, 6 u 8 mg [ver Estudios clínicos ]. La incidencia general de posible hipoglucemia (como se definió anteriormente para el ensayo de 14 semanas) para AMARYL frente a placebo fue del 19,7 % frente al 3,2 %. Todos estos eventos fueron autotratados.
Aumento de peso: AMARYL, como todas las sulfonilureas, puede causar aumento de peso [ver Estudios clínicos ].
Reacciones alérgicas: En los ensayos clínicos, se produjeron reacciones alérgicas, como prurito, eritema, urticaria y erupciones morbiliformes o maculopapulares, en menos del 1 % de los pacientes tratados con AMARYL. Estos pueden resolverse a pesar del tratamiento continuo con AMARYL. Hay informes posteriores a la comercialización de reacciones alérgicas más graves (p. ej., disnea, hipotensión, shock) [ver ADVERTENCIAS Y PRECAUCIONES ].
Pruebas de laboratorio
Alanina aminotransferasa sérica elevada (ALT): En 11 ensayos combinados controlados con placebo de AMARYL, el 1,9 % de los pacientes tratados con AMARYL y el 0,8 % de los pacientes tratados con placebo desarrollaron ALT sérica superior a 2 veces el límite superior del rango de referencia.
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de AMARYL. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
- Reacciones graves de hipersensibilidad, que incluyen anafilaxia, angioedema y síndrome de Stevens-Johnson [ver ADVERTENCIAS Y PRECAUCIONES ]
- Anemia hemolítica en pacientes con y sin deficiencia de G6PD [ver ADVERTENCIAS Y PRECAUCIONES ]
- Deterioro de la función hepática (por ejemplo, con colestasis e ictericia), así como hepatitis, que puede progresar a insuficiencia hepática.
- Porfiria cutánea tardía, reacciones de fotosensibilidad y vasculitis alérgica
- Leucopenia, agranulocitosis, anemia aplásica y pancitopenia
- Trombocitopenia (incluidos casos graves con recuento de plaquetas inferior a 10 000/μL) y púrpura trombocitopénica
- Reacciones de porfiria hepática y reacciones tipo disulfiram
- Hiponatremia y síndrome de secreción inadecuada de hormona antidiurética (SIADH), con mayor frecuencia en pacientes que toman otros medicamentos o que tienen afecciones médicas que se sabe que causan hiponatremia o aumentan la liberación de hormona antidiurética
- disgeusia
- Alopecia
INTERACCIONES CON LA DROGAS
Medicamentos que afectan el metabolismo de la glucosa
Una serie de medicamentos afectan el metabolismo de la glucosa y pueden requerir un ajuste de la dosis de 4 mg de AMARYL y un control particularmente estrecho de la hipoglucemia o el empeoramiento del control glucémico.
Los siguientes son ejemplos de medicamentos que pueden aumentar el efecto reductor de glucosa de las sulfonilureas, incluido AMARYL 2 mg, lo que aumenta la susceptibilidad y/o la intensidad de la hipoglucemia: medicamentos antidiabéticos orales, acetato de pramlintida, insulina, inhibidores de la enzima convertidora de angiotensina (ECA), Antagonistas de los receptores H2, fibratos, propoxifeno, pentoxifilina, análogos de la somatostatina, esteroides anabólicos y andrógenos, ciclofosfamida, feniramidol, guanetidina, fluconazol, sulfinpirazona, tetraciclinas, claritromicina, disopiramida, quinolonas y aquellos medicamentos que se unen a proteínas, como la fluoxetina, antiinflamatorios no esteroideos, salicilatos, sulfonamidas, cloranfenicol, cumarinas, probenecid e inhibidores de la monoaminooxidasa. Cuando estos medicamentos se administran a un paciente que recibe AMARYL, controle de cerca al paciente para detectar hipoglucemia. Cuando se retiran estos medicamentos de un paciente que recibe AMARYL 2 mg, vigile de cerca al paciente por si empeora el control glucémico.
Los siguientes son ejemplos de medicamentos que pueden reducir el efecto hipoglucemiante de las sulfonilureas, incluido AMARYL, lo que empeora el control glucémico: danazol, glucagón, somatropina, inhibidores de la proteasa, medicamentos antipsicóticos atípicos (p. ej., olanzapina y clozapina), barbitúricos, diazóxido, laxantes , rifampicina, tiazidas y otros diuréticos, corticosteroides, fenotiazinas, hormonas tiroideas, estrógenos, anticonceptivos orales, fenitoína, ácido nicotínico, simpaticomiméticos (p. ej., epinefrina, albuterol, terbutalina) e isoniazida. Cuando estos medicamentos se administran a un paciente que recibe AMARYL 2 mg, vigile de cerca al paciente por si empeora el control glucémico. Cuando estos medicamentos se retiran de un paciente que recibe AMARYL 2 mg, vigile de cerca al paciente por hipoglucemia.
Los betabloqueantes, la clonidina y la reserpina pueden potenciar o debilitar el efecto hipoglucemiante de AMARYL.
Tanto la ingesta aguda como crónica de alcohol puede potenciar o debilitar la acción hipoglucemiante de AMARYL 1 mg de manera impredecible.
Los signos de hipoglucemia pueden reducirse o desaparecer en pacientes que toman medicamentos simpaticolíticos como betabloqueantes, clonidina, guanetidina y reserpina.
miconazol
Se ha informado una interacción potencial entre el miconazol oral y las sulfonilureas que conduce a una hipoglucemia grave. No se sabe si esta interacción también ocurre con otras formas de dosificación de miconazol.
Interacciones del citocromo P450 2C9
Puede haber una interacción entre la glimepirida y los inhibidores (p. ej., fluconazol) e inductores (p. ej., rifampicina) del citocromo P450 2C9. El fluconazol puede inhibir el metabolismo de la glimepirida, provocando un aumento de las concentraciones plasmáticas de glimepirida que puede provocar hipoglucemia. La rifampicina puede inducir el metabolismo de la glimepirida, provocando una disminución de las concentraciones plasmáticas de glimepirida, lo que puede conducir a un empeoramiento del control glucémico.
Administración concomitante de colesevelam
Colesevelam puede reducir la concentración plasmática máxima y la exposición total de glimepirida cuando se administran conjuntamente. Sin embargo, la absorción no se reduce cuando se administra glimepirida 4 horas antes que colesevelam. Por lo tanto, AMARYL debe administrarse al menos 4 horas antes que colesevelam.
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Hipoglucemia
Todas las sulfonilureas, incluido AMARYL, pueden causar hipoglucemia grave [ver REACCIONES ADVERSAS ]. La capacidad del paciente para concentrarse y reaccionar puede verse afectada como resultado de la hipoglucemia. Estas deficiencias pueden presentar un riesgo en situaciones en las que estas habilidades son especialmente importantes, como conducir u operar otra maquinaria. La hipoglucemia grave puede provocar pérdida del conocimiento o convulsiones y puede provocar un deterioro temporal o permanente de la función cerebral o la muerte.
Los pacientes deben ser educados para reconocer y manejar la hipoglucemia. Tenga cuidado al iniciar y aumentar las dosis de 2 mg de AMARYL en pacientes que pueden estar predispuestos a la hipoglucemia (p. ej., ancianos, pacientes con insuficiencia renal, pacientes que toman otros medicamentos antidiabéticos). Los pacientes debilitados o desnutridos, y aquellos con insuficiencia suprarrenal, pituitaria o hepática son particularmente susceptibles a la acción hipoglucemiante de los medicamentos para reducir la glucosa. La hipoglucemia también es más probable que ocurra cuando la ingesta calórica es deficiente, después de un ejercicio intenso o prolongado, o cuando se ingiere alcohol.
Los primeros síntomas de advertencia de hipoglucemia pueden ser diferentes o menos pronunciados en pacientes con neuropatía autonómica, ancianos y en pacientes que toman medicamentos bloqueadores beta-adrenérgicos u otros agentes simpaticolíticos. Estas situaciones pueden provocar una hipoglucemia grave antes de que el paciente se dé cuenta de la hipoglucemia.
Reacciones hipersensibles
Ha habido informes posteriores a la comercialización de reacciones de hipersensibilidad en pacientes tratados con AMARYL, incluidas reacciones graves como anafilaxia, angioedema y síndrome de Stevens-Johnson. Si se sospecha una reacción de hipersensibilidad, suspenda inmediatamente AMARYL, evalúe otras posibles causas de la reacción e instituya un tratamiento alternativo para la diabetes.
Anemia hemolítica
Las sulfonilureas pueden causar anemia hemolítica en pacientes con deficiencia de glucosa 6-fosfato deshidrogenasa (G6PD). Debido a que AMARYL 4 mg es una sulfonilurea, tenga cuidado en pacientes con deficiencia de G6PD y considere el uso de una alternativa sin sulfonilurea. También hay informes posteriores a la comercialización de anemia hemolítica en pacientes que reciben AMARYL 1 mg que no tenían deficiencia conocida de G6PD [ver REACCIONES ADVERSAS ].
Mayor riesgo de mortalidad cardiovascular con sulfonilureas
Se ha informado que la administración de hipoglucemiantes orales se asocia con una mayor mortalidad cardiovascular en comparación con el tratamiento con dieta sola o dieta más insulina. Esta advertencia se basa en el estudio realizado por el Programa de Diabetes del Grupo Universitario (UGDP), un ensayo clínico prospectivo a largo plazo diseñado para evaluar la eficacia de los medicamentos hipoglucemiantes para prevenir o retrasar las complicaciones vasculares en pacientes con diabetes no insulinodependiente. diabetes. El estudio involucró a 823 pacientes que fueron asignados aleatoriamente a uno de los cuatro grupos de tratamiento. UGDP informó que los pacientes tratados durante 5 a 8 años con dieta más una dosis fija de tolbutamida (1,5 gramos por día) tenían una tasa de mortalidad cardiovascular de aproximadamente 2 ½ veces la de los pacientes tratados con dieta sola. No se observó un aumento significativo de la mortalidad total, pero se suspendió el uso de tolbutamida en función del aumento de la mortalidad cardiovascular, lo que limita la oportunidad de que el estudio muestre un aumento de la mortalidad general. A pesar de la controversia sobre la interpretación de estos resultados, los hallazgos del estudio UGDP brindan una base adecuada para esta advertencia. El paciente debe ser informado de los riesgos y ventajas potenciales de AMARYL 4 mg y de modos alternativos de terapia. Aunque en este estudio solo se incluyó un fármaco de la clase de las sulfonilureas (tolbutamida), es prudente desde el punto de vista de la seguridad considerar que esta advertencia también puede aplicarse a otros hipoglucemiantes orales de esta clase, en vista de sus similitudes en el modo de acción. Acción y estructura química.
Resultados macrovasculares
No se han realizado estudios clínicos que establezcan evidencia concluyente de reducción del riesgo macrovascular con AMARYL o cualquier otro fármaco antidiabético.
Toxicología no clínica
Carcinogénesis, mutagénesis y deterioro de la fertilidad
Los estudios en ratas con dosis de hasta 5000 partes por millón (ppm) en el alimento completo (aproximadamente 340 veces la dosis máxima recomendada en humanos, según el área de superficie) durante 30 meses no mostraron evidencia de carcinogénesis. En ratones, la administración de glimepirida durante 24 meses dio como resultado un aumento en la formación de adenomas pancreáticos benignos que estaba relacionado con la dosis y se pensaba que era el resultado de una estimulación pancreática crónica. No se observó formación de adenomas en ratones a una dosis de 320 ppm en el alimento completo, o 46-54 mg/kg de peso corporal/día. Esto es aproximadamente 35 veces la dosis máxima recomendada en humanos de 8 mg una vez al día según el área de superficie.
La glimepirida no fue mutagénica en una batería de estudios de mutagenicidad in vitro e in vivo (prueba de Ames, mutación de células somáticas, aberración cromosómica, síntesis de ADN no programada y prueba de micronúcleo de ratón).
La glimepirida no tuvo ningún efecto sobre la fertilidad de los ratones macho en animales expuestos a dosis de hasta 2500 mg/kg de peso corporal (> 1700 veces la dosis máxima recomendada en humanos según el área de superficie). La glimepirida no tuvo ningún efecto sobre la fertilidad de ratas macho y hembra a las que se administró hasta 4000 mg/kg de peso corporal (aproximadamente 4000 veces la dosis máxima recomendada en humanos en función del área de superficie).
Uso en poblaciones específicas
El embarazo
Embarazo Categoría C
No hay estudios adecuados y bien controlados de AMARYL 2 mg en mujeres embarazadas. En estudios con animales no hubo un aumento en las anomalías congénitas, pero se produjo un aumento en las muertes fetales en ratas y conejos con dosis de glimepirida 50 veces (ratas) y 0,1 veces (conejos) la dosis máxima recomendada en humanos (basada en el área de superficie corporal). Se cree que esta fetotoxicidad, observada solo en dosis que inducen hipoglucemia materna, está directamente relacionada con la acción farmacológica (hipoglucémica) de la glimepirida y se ha observado de manera similar con otras sulfonilureas. AMARYL debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto. Debido a que los datos sugieren que la glucemia anormal durante el embarazo se asocia con una mayor incidencia de anomalías congénitas, el tratamiento de la diabetes durante el embarazo debe mantener la glucemia lo más cerca posible de lo normal.
Efectos no teratogénicos
Se ha informado hipoglucemia severa prolongada (4 a 10 días) en recién nacidos de madres que recibieron una sulfonilurea en el momento del parto.
Madres lactantes
No se sabe si AMARYL 1 mg se excreta en la leche humana. Durante los estudios prenatales y posnatales en ratas, se encontraron concentraciones significativas de glimepirida en la leche materna y el suero de las crías. Las crías de ratas expuestas a altos niveles de glimepirida durante el embarazo y la lactancia desarrollaron deformidades esqueléticas que consisten en acortamiento, engrosamiento y flexión del húmero durante el período posnatal. Se determinó que estas deformaciones esqueléticas eran el resultado de la lactancia de madres expuestas a la glimepirida. Con base en estos datos en animales y el potencial de hipoglucemia en un lactante, se debe tomar la decisión de suspender la lactancia o suspender AMARYL 2 mg, teniendo en cuenta la importancia de AMARYL para la madre.
Uso pediátrico
La farmacocinética, la eficacia y la seguridad de AMARYL 4 mg se evaluaron en pacientes pediátricos con diabetes tipo 2 como se describe a continuación. AMARYL 4mg no se recomienda en pacientes pediátricos debido a sus efectos adversos sobre el peso corporal y la hipoglucemia.
La farmacocinética de una dosis única de 1 mg de AMARYL se evaluó en 30 pacientes con diabetes tipo 2 (hombres = 7; mujeres = 23) entre 10 y 17 años de edad. El AUC medio (± DE) (339±203 ng·hr/mL), Cmax (102±48 ng/mL) y t½ (3,1±1,7 horas) para glimepirida fueron comparables a los datos históricos de adultos (AUC(0-último ) 315±96 ng·hr/mL, Cmax 103±34 ng/mL y t½ 5.3±4.1 horas).
La seguridad y eficacia de AMARYL en pacientes pediátricos se evaluó en un ensayo simple ciego de 24 semanas que aleatorizó a 272 pacientes (8-17 años de edad) con diabetes tipo 2 a AMARYL (n=135) o metformina (n=137 ). Tanto los pacientes sin tratamiento previo (aquellos tratados solo con dieta y ejercicio durante al menos 2 semanas antes de la aleatorización) como los pacientes previamente tratados (aquellos tratados previamente o actualmente tratados con otros medicamentos antidiabéticos orales durante al menos 3 meses) fueron elegibles para participar. Los pacientes que estaban recibiendo agentes antidiabéticos orales en el momento de ingresar al estudio suspendieron estos medicamentos antes de la aleatorización sin un período de lavado. AMARYL se inició con 1 mg y luego se ajustó hasta 2, 4 u 8 mg (última dosis media 4 mg) hasta la semana 12, con el objetivo de lograr un nivel de glucosa en sangre en ayunas autocontrolado por punción en el dedo
Después de 24 semanas, la diferencia media general del tratamiento en HbA1c entre AMARYL 4 mg y metformina fue del 0,2 %, a favor de la metformina (intervalo de confianza del 95 %: -0,3 % a +0,6 %). Según estos resultados, el ensayo no cumplió su objetivo principal de mostrar una reducción similar en HbA1c con AMARYL 4 mg en comparación con metformina.
El perfil de reacciones adversas en pacientes pediátricos tratados con AMARYL 2 mg fue similar al observado en adultos [ver REACCIONES ADVERSAS ].
Se observaron eventos hipoglucémicos documentados por valores de glucosa en sangre
Uso geriátrico
En los ensayos clínicos de AMARYL 2 mg, 1053 de 3491 pacientes (30 %) tenían > 65 años de edad. No se observaron diferencias generales en seguridad o eficacia entre estos pacientes y pacientes más jóvenes, pero no se puede descartar una mayor sensibilidad de algunos individuos mayores.
No hubo diferencias significativas en la farmacocinética de glimepirida entre pacientes con diabetes tipo 2 ≤ 65 años (n=49) y aquellos > 65 años (n=42) [ver FARMACOLOGÍA CLÍNICA ].
La glimepirida se excreta sustancialmente por vía renal. Los pacientes de edad avanzada son más propensos a tener insuficiencia renal. Además, la hipoglucemia puede ser difícil de reconocer en los ancianos [ver DOSIFICACIÓN Y ADMINISTRACIÓN y ADVERTENCIAS Y PRECAUCIONES ]. Tenga cuidado al iniciar AMARYL y aumentar la dosis de 1 mg de AMARYL en esta población de pacientes.
Insuficiencia renal
Para minimizar el riesgo de hipoglucemia, la dosis inicial recomendada de AMARYL es de 1 mg al día para todos los pacientes con diabetes tipo 2 e insuficiencia renal [ver DOSIFICACIÓN Y ADMINISTRACIÓN y ADVERTENCIAS Y PRECAUCIONES ].
Se realizó un estudio de titulación de dosis múltiples en 16 pacientes con diabetes tipo 2 e insuficiencia renal utilizando dosis que oscilaron entre 1 mg y 8 mg diarios durante 3 meses. El aclaramiento de creatinina basal osciló entre 10 y 60 ml/min. La farmacocinética de AMARYL se evaluó en el estudio de titulación de dosis múltiples y los resultados fueron consistentes con los observados en pacientes inscritos en un estudio de dosis única. En ambos estudios, el aclaramiento total relativo de AMARYL aumentó cuando la función renal estaba alterada. Ambos estudios también demostraron que la eliminación de los dos metabolitos principales se redujo en pacientes con insuficiencia renal [ver FARMACOLOGÍA CLÍNICA ].
SOBREDOSIS
Una sobredosis de AMARYL 2mg, al igual que con otras sulfonilureas, puede producir hipoglucemia severa. Los episodios leves de hipoglucemia se pueden tratar con glucosa oral. Las reacciones hipoglucémicas graves constituyen emergencias médicas que requieren tratamiento inmediato. La hipoglucemia grave con coma, convulsiones o deterioro neurológico se puede tratar con glucagón o glucosa intravenosa. La observación continua y la ingesta adicional de carbohidratos pueden ser necesarias porque la hipoglucemia puede reaparecer después de una aparente recuperación clínica [ver ADVERTENCIAS Y PRECAUCIONES ].
CONTRAINDICACIONES
AMARYL está contraindicado en pacientes con antecedentes de una reacción de hipersensibilidad a:
- Glimepirida o cualquiera de los ingredientes del producto [ver ADVERTENCIAS Y PRECAUCIONES ].
Derivados de sulfonamida: Los pacientes que han desarrollado una reacción alérgica a los derivados de sulfonamida pueden desarrollar una reacción alérgica a AMARYL. No use AMARYL 4mg en pacientes que tengan antecedentes de una reacción alérgica a los derivados de la sulfonamida.
Las reacciones de hipersensibilidad notificadas incluyen erupciones cutáneas con o sin prurito, así como reacciones más graves (p. ej., anafilaxia, angioedema, síndrome de Stevens-Johnson, disnea) [ver ADVERTENCIAS Y PRECAUCIONES y REACCIONES ADVERSAS ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
La glimepirida reduce principalmente la glucosa en sangre al estimular la liberación de insulina de las células beta pancreáticas. Las sulfonilureas se unen al receptor de sulfonilureas en la membrana plasmática de las células beta del páncreas, lo que lleva al cierre del canal de potasio sensible al ATP, lo que estimula la liberación de insulina.
Farmacodinámica
En sujetos sanos, el tiempo para alcanzar el efecto máximo (concentraciones mínimas de glucosa en sangre) fue de aproximadamente 2 a 3 horas después de dosis orales únicas de AMARYL. Los efectos de AMARYL sobre la HbA1c, la glucosa plasmática en ayunas y la glucosa posprandial se evaluaron en ensayos clínicos [ver Estudios clínicos ].
Farmacocinética
Absorción
Los estudios con dosis orales únicas de glimepirida en sujetos sanos y con dosis orales múltiples en pacientes con diabetes tipo 2 mostraron concentraciones máximas del fármaco (Cmax) de 2 a 3 horas después de la dosis. Cuando se administró glimepirida con las comidas, la Cmax y el AUC (área bajo la curva) medias se redujeron en un 8 % y un 9 %, respectivamente.
La glimepirida no se acumula en el suero después de múltiples dosis. La farmacocinética de glimepirida no difiere entre sujetos sanos y pacientes con diabetes tipo 2. El aclaramiento de glimepirida después de la administración oral no cambia en el rango de dosis de 1 mg a 8 mg, lo que indica una farmacocinética lineal.
En sujetos sanos, las variabilidades intra e interindividuales de los parámetros farmacocinéticos de glimepirida fueron del 15 al 23 % y del 24 al 29 %, respectivamente.
Distribución
Después de la administración intravenosa en sujetos sanos, el volumen de distribución (Vd) fue de 8,8 l (113 ml/kg) y el aclaramiento corporal total (CL) fue de 47,8 ml/min. La unión a proteínas fue superior al 99,5%.
Metabolismo
La glimepirida se metaboliza completamente por biotransformación oxidativa después de una dosis intravenosa u oral. Los principales metabolitos son el derivado de ciclohexil hidroximetilo (M1) y el derivado de carboxilo (M2). El citocromo P450 2C9 está involucrado en la biotransformación de glimepirida a M1. M1 se metaboliza aún más a M2 por una o varias enzimas citosólicas. M2 está inactivo. En animales, M1 posee aproximadamente un tercio de la actividad farmacológica de glimepirida, pero no está claro si M1 produce efectos clínicamente significativos sobre la glucosa en sangre en humanos.
Excreción
Cuando se administró 14C-glimepirida por vía oral a 3 hombres sanos, aproximadamente el 60 % de la radiactividad total se recuperó en la orina en 7 días. M1 y M2 representaron el 80-90% de la radiactividad recuperada en la orina. La proporción de M1 a M2 en la orina fue de aproximadamente 3:2 en dos sujetos y 4:1 en un sujeto. Aproximadamente el 40% de la radiactividad total se recuperó en las heces. M1 y M2 representaron alrededor del 70 % (la proporción de M1 a M2 fue de 1:3) de la radiactividad recuperada en las heces. No se recuperó el fármaco original de la orina o las heces. Después de la dosificación intravenosa en pacientes, no se observó excreción biliar significativa de glimepirida o su metabolito M1.
Pacientes geriátricos
Se evaluó una comparación de la farmacocinética de glimepirida en pacientes con diabetes tipo 2 ≤ 65 años y aquellos > 65 años en un estudio de dosis múltiples utilizando AMARYL 6 mg diarios. No hubo diferencias significativas en la farmacocinética de glimepirida entre los dos grupos de edad. El AUC medio en estado estacionario para los pacientes mayores fue aproximadamente un 13 % más bajo que el de los pacientes más jóvenes; el aclaramiento medio ajustado al peso para los pacientes mayores fue aproximadamente un 11 % más alto que el de los pacientes más jóvenes.
Género
No hubo diferencias entre hombres y mujeres en la farmacocinética de glimepirida cuando se hizo el ajuste por diferencias en el peso corporal.
La raza
No se han realizado estudios para evaluar los efectos de la raza en la farmacocinética de glimepirida, pero en ensayos controlados con placebo de AMARYL 2 mg en pacientes con diabetes tipo 2, la reducción de HbA fue comparable en caucásicos (n = 536), negros (n = 63) , e hispanos (n = 63).
Insuficiencia renal
En un estudio abierto, de dosis única, se administró AMARYL 3 mg a pacientes con insuficiencia renal leve, moderada y grave según lo estimado por el aclaramiento de creatinina (CLcr): el grupo I estaba formado por 5 pacientes con insuficiencia renal leve (CLcr > 50 ml/min). ), el grupo II estaba formado por 3 pacientes con insuficiencia renal moderada (CLcr = 20-50 ml/min) y el grupo III estaba formado por 7 pacientes con insuficiencia renal grave (CLcr
Deterioro hepático
Se desconoce si existe un efecto de la insuficiencia hepática en la farmacocinética de AMARYL 1 mg porque la farmacocinética de AMARYL 1 mg no se ha evaluado adecuadamente en pacientes con insuficiencia hepática.
Pacientes Obesos
La farmacocinética de glimepirida y sus metabolitos se midió en un estudio de dosis única en el que participaron 28 pacientes con diabetes tipo 2 que tenían un peso corporal normal o eran obesos mórbidos. Mientras que el tmax, el aclaramiento y el volumen de distribución de glimepirida en los pacientes con obesidad mórbida fueron similares a los del grupo de peso normal, los pacientes con obesidad mórbida tuvieron una Cmax y AUC más bajas que los de peso corporal normal. Los valores medios de Cmax, AUC0-24, AUC0-∞ de glimepirida en pacientes normales frente a obesos mórbidos fueron 547 ± 218 ng/ml frente a 410 ± 124 ng/ml, 3210 ± 1030 horas · ng/ml frente a 2820 ± 1110 horas·ng/ml y 4000 ± 1320 horas·ng/ml frente a 3280 ± 1360 horas·ng/ml, respectivamente.
Interacciones con la drogas
Aspirina: En un estudio cruzado aleatorizado, doble ciego, de dos períodos, a sujetos sanos se les administró placebo o aspirina 1 gramo tres veces al día durante un período de tratamiento total de 5 días. El Día 4 de cada período de estudio, se administró una dosis única de 1 mg de AMARYL 4 mg. Las dosis de 4 mg de AMARYL se separaron por un período de lavado de 14 días. La coadministración de aspirina y AMARYL 4 mg resultó en una disminución del 34 % en el AUC medio de glimepirida y una disminución del 4 % en el Cmax medio de glimepirida.
colesevelam: La administración concomitante de colesevelam y glimepirida produjo reducciones en el AUC0-∞ y la Cmax de glimepirida del 18 % y el 8 %, respectivamente. Cuando se administró glimepirida 4 horas antes que colesevelam, no hubo cambios significativos en el AUC0-∞ y la Cmax de glimepirida, -6 % y 3 %, respectivamente [ver DOSIFICACIÓN Y ADMINISTRACIÓN y INTERACCIONES CON LA DROGAS ].
Cimetidina y Ranitidina: En un estudio aleatorizado, abierto, cruzado de 3 vías, los sujetos sanos recibieron una dosis única de 4 mg de AMARYL solo, AMARYL con ranitidina (150 mg dos veces al día durante 4 días; se administró 2 mg de AMARYL el día 3) o AMARYL 2 mg con cimetidina (800 mg diarios durante 4 días; se administró AMARYL el día 3). La coadministración de cimetidina o ranitidina con una dosis oral única de 4 mg de AMARYL 4 mg no alteró significativamente la absorción y disposición de glimepirida.
Propranolol: En un estudio cruzado aleatorizado, doble ciego, de dos períodos, a sujetos sanos se les administró placebo o propranolol 40 mg tres veces al día durante un período de tratamiento total de 5 días. El Día 4 o cada período de estudio, se administró una dosis única de 2 mg de AMARYL 4 mg. Las dosis de 4 mg de AMARYL se separaron por un período de lavado de 14 días. La administración concomitante de propranolol y AMARYL 1 mg aumentó significativamente la Cmax, el AUC y el T½ de glimepirida en un 23 %, 22 % y 15 %, respectivamente, y disminuyó el CL/f de glimepirida en un 18 %. La recuperación de M1 y M2 de la orina no cambió.
Warfarina: En un estudio cruzado bidireccional abierto, los sujetos sanos recibieron 4 mg de AMARYL 2 mg al día durante 10 días. Se administraron dosis únicas de 25 mg de warfarina 6 días antes de comenzar con AMARYL y el día 4 de la administración de AMARYL. La administración concomitante de AMARYL no alteró la farmacocinética de los enantiómeros R- y S-warfarina. No se observaron cambios en la unión a proteínas plasmáticas de warfarina. AMARYL 1 mg resultó en una disminución estadísticamente significativa en la respuesta farmacodinámica a la warfarina. Las reducciones en el área media bajo la curva del tiempo de protrombina (PT) y los valores máximos de PT durante el tratamiento con AMARYL fueron de 3,3 % y 9,9 %, respectivamente, y es poco probable que sean clínicamente relevantes.
Estudios clínicos
Monoterapia
Un total de 304 pacientes con diabetes tipo 2 ya tratados con terapia con sulfonilureas participaron en un ensayo multicéntrico, aleatorizado, doble ciego, controlado con placebo, de 14 semanas de duración, que evaluó la seguridad y eficacia de AMARYL 1 mg en monoterapia. Los pacientes interrumpieron su tratamiento con sulfonilurea y luego ingresaron a un período de lavado con placebo de 3 semanas seguido de aleatorización en 1 de 4 grupos de tratamiento: placebo (n=74), AMARYL 1 mg (n=78), AMARYL 4 mg (n=76) y AMARYL 8 mg (n=76). Todos los pacientes asignados al azar a AMARYL 4 mg comenzaron con 1 mg diario. Los pacientes asignados aleatoriamente a AMARYL 4 mg u 8 mg tuvieron una titulación forzada y ciega de la dosis de AMARYL 2 mg a intervalos semanales, primero a 4 mg y luego a 8 mg, siempre que la dosis fuera tolerada, hasta que se alcanzó la dosis aleatoria. Los pacientes aleatorizados a la dosis de 4 mg alcanzaron la dosis asignada en la Semana 2. Los pacientes aleatorizados a la dosis de 8 mg alcanzaron la dosis asignada en la Semana 3. Una vez que se alcanzó el nivel de dosis aleatorizado, los pacientes debían mantenerse en esa dosis hasta la Semana 14. Aproximadamente el 66 % de los pacientes tratados con placebo completaron el ensayo en comparación con el 81 % de los pacientes tratados con glimepirida de 1 mg y el 92 % de los pacientes tratados con glimepirida de 4 mg u 8 mg. En comparación con el placebo, el tratamiento con AMARYL 1 mg, 4 mg y 8 mg diarios proporcionó mejoras estadísticamente significativas en la HbA1c en comparación con el placebo (Tabla 3).
Un total de 249 pacientes que no habían recibido tratamiento previo o que habían recibido tratamiento limitado con terapia antidiabética en el pasado fueron aleatorizados para recibir 22 semanas de tratamiento con AMARYL (n=123) o placebo (n=126) en un estudio multicéntrico aleatorizado. , doble ciego, controlado con placebo, ensayo de titulación de dosis. La dosis inicial de AMARYL fue de 1 mg al día y se ajustó hacia arriba o hacia abajo en intervalos de 2 semanas hasta un objetivo de FPG de 90-150 mg/dl. Los niveles de glucosa en sangre tanto para FPG como para PPG se analizaron en el laboratorio. Después de 10 semanas de ajuste de dosis, los pacientes se mantuvieron en su dosis óptima (1, 2, 3, 4, 6 u 8 mg) durante las 12 semanas restantes del ensayo. El tratamiento con AMARYL 2 mg proporcionó mejoras estadísticamente significativas en HbA1c y FPG en comparación con el placebo (Tabla 4).
INFORMACIÓN DEL PACIENTE
Informar a los pacientes sobre la importancia de seguir las instrucciones dietéticas, de un programa de ejercicio regular y de pruebas periódicas de glucosa en sangre.
Informe a los pacientes sobre los posibles efectos secundarios de AMARYL 1 mg, incluida la hipoglucemia y el aumento de peso.
Explicar los síntomas y el tratamiento de la hipoglucemia, así como las condiciones que predisponen a la hipoglucemia. Se debe informar a los pacientes que la capacidad para concentrarse y reaccionar puede verse afectada como resultado de la hipoglucemia. Esto puede presentar un riesgo en situaciones en las que estas habilidades son especialmente importantes, como conducir u operar otra maquinaria.
Se debe recomendar a los pacientes con diabetes que informen a su proveedor de atención médica si están embarazadas, contemplando el embarazo, amamantando o contemplando la lactancia.
