Prandin 0.5mg, 1mg, 2mg Repaglinide Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Prandin 2 mg y cómo se usa?
Prandin 1 mg es un medicamento recetado que se usa para tratar los síntomas de la diabetes mellitus tipo 2. Prandin se puede usar solo o con otros medicamentos.
Prandin pertenece a una clase de medicamentos llamados Antidiabéticos, Maglitinides Derivados.
No se sabe si Prandin 1 mg es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Prandin?
Prandin puede causar efectos secundarios graves que incluyen:
- urticaria,
- respiración dificultosa,
- hinchazón de la cara, los labios, la lengua o la garganta,
- dolor intenso en la parte superior del estómago que se extiende a la espalda,
- náuseas,
- vómitos,
- frecuencia cardíaca rápida,
- piel pálida o amarillenta,
- orina de color oscuro,
- fiebre,
- confusión,
- debilidad,
- dolor de garganta,
- ardiendo en tus ojos,
- dolor de piel, y
- seguido de una erupción cutánea roja o morada que se extiende (especialmente en la cara o la parte superior del cuerpo) y causa ampollas y descamación
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Prandin incluyen:
- baja azúcar en la sangre,
- náuseas,
- Diarrea,
- dolor de cabeza,
- dolor de espalda,
- dolor en las articulaciones, y
- síntomas de resfriado (nariz tapada, estornudos, dolor de garganta)
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Prandin. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
PRANDIN (repaglinida) es un fármaco hipoglucemiante oral de la clase glinida. La repaglinida, ácido S(+)2-etoxi-4(2((3-metil-1-(2-(1piperidinil) fenil)-butil) amino)-2-oxoetilo) benzoico, no tiene relación química con la insulina sulfonilurea oral secretagogos.
Fórmula estructural de repaglinida
La repaglinida es un polvo de color blanco a blanquecino con fórmula molecular C27H36N2O4 y un peso molecular de 452,6. Los comprimidos de PRANDIN contienen 0,5 mg, 1 mg o 2 mg de repaglinida. Además, cada tableta contiene los siguientes ingredientes inactivos: hidrogenofosfato de calcio (anhidro), celulosa microcristalina, almidón de maíz, polacrilina potásica, povidona, glicerol (85%), estearato de magnesio, meglumina y poloxámero. Los comprimidos de 1 mg y 2 mg contienen óxidos de hierro (amarillo y rojo, respectivamente) como agentes colorantes.
INDICACIONES
PRANDIN está indicado como complemento de la dieta y el ejercicio para mejorar el control glucémico en adultos con diabetes mellitus tipo 2.
Limitación de uso
PRANDIN no debe usarse en pacientes con diabetes mellitus tipo 1 o para el tratamiento de la cetoacidosis diabética.
DOSIFICACIÓN Y ADMINISTRACIÓN
Dosis recomendada y administración
La dosis inicial recomendada para pacientes cuya HbA1c es inferior al 8 % es de 0,5 mg por vía oral antes de cada comida. Para pacientes cuya HbA1c es del 8% o más, la dosis inicial es de 1 o 2 mg por vía oral antes de cada comida.
El rango de dosis recomendado es de 0,5 mg a 4 mg antes de las comidas, con una dosis diaria máxima de 16 mg. La dosis del paciente debe duplicarse hasta 4 mg con cada comida hasta que se logre un control glucémico satisfactorio. Debe transcurrir al menos una semana para evaluar la respuesta después de cada ajuste de dosis.
Indique a los pacientes que tomen PRANDIN dentro de los 30 minutos antes de las comidas. PRANDIN 2 mg se puede dosificar 2, 3 o 4 veces al día en respuesta a los cambios en el patrón de alimentación del paciente.
En pacientes que se saltan comidas, indíqueles a los pacientes que se salten la dosis programada de PRANDIN 1 mg para reducir el riesgo de hipoglucemia. En pacientes que experimentan hipoglucemia, se debe reducir la dosis de PRANDIN 1 mg [ver ADVERTENCIAS Y PRECAUCIONES ].
Pacientes con insuficiencia renal grave
En pacientes con insuficiencia renal grave (CrCl = 20 a 40 ml/min) inicie PRANDIN 0,5 mg por vía oral antes de cada comida. Titular gradualmente la dosis, si es necesario para lograr el control glucémico.
Modificaciones de dosis por interacciones farmacológicas
Se recomiendan ajustes de dosis en pacientes que toman concomitantemente inhibidores potentes de CYP3A4 o CYP2C8 o inductores potentes de CYP3A4 o CYP2C8 [ver INTERACCIONES CON LA DROGAS , FARMACOLOGÍA CLÍNICA ].
El uso concomitante con gemfibrozilo está contraindicado [ver CONTRAINDICACIONES ].
Evitar el uso concomitante de PRANDIN 2 mg con clopidogrel. Si no se puede evitar el uso concomitante, inicie PRANDIN con 0,5 mg antes de cada comida y no exceda una dosis diaria total de 4 mg [ver INTERACCIONES CON LA DROGAS , FARMACOLOGÍA CLÍNICA ].
No exceda una dosis diaria total de 6 mg de PRANDIN 2 mg en pacientes que reciben ciclosporina [ver INTERACCIONES CON LA DROGAS , FARMACOLOGÍA CLÍNICA ].
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
- Comprimidos de 1 mg (comprimidos amarillos, redondos, biconvexos, grabados con "745" en un lado y "C" en el otro lado)
- Comprimidos de 2 mg (comprimidos rosados, redondos, biconvexos, grabados con "747" en un lado y "C" en el otro lado)
PRANDIN (repaglinida) tabletas, 1 mg , se suministran en forma de comprimidos amarillos, redondos, biconvexos, grabados con “745” en una cara y “C” en la otra cara. Están disponibles de la siguiente manera:
Botellas de 100 CDN 60846-882-01
PRANDIN (repaglinida) tabletas, 2 mg , se suministran en forma de comprimidos biconvexos redondos de color rosa, grabados con “747” en una cara y “C” en la otra cara. Están disponibles de la siguiente manera:
Botellas de 100 CDN 60846-884-01
Almacene a una temperatura de 20° a 25°C (68° a 77°F) [consulte Temperatura ambiente controlada por la USP]. Proteger de la humedad. Mantenga las botellas bien cerradas.
Dispensar en recipientes herméticos con cierres de seguridad.
Distribuido por: Amneal Specialty, una división de Amneal Pharmaceuticals LLC Bridgewater, NJ 08807. Revisado: marzo de 2019
EFECTOS SECUNDARIOS
La siguiente reacción adversa grave también se describe en otra parte de la etiqueta:
Hipoglucemia [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo con diseños muy variados, es posible que las tasas de reacciones adversas informadas en un ensayo clínico no se comparen fácilmente con las tasas informadas en otro ensayo clínico, y es posible que no reflejen las tasas realmente observadas en la práctica clínica.
PRANDIN 1 mg se administró a 2931 personas durante los ensayos clínicos. Aproximadamente 1500 de estas personas con diabetes tipo 2 han sido tratadas durante al menos 3 meses, 1000 durante al menos 6 meses y 800 durante al menos 1 año. La mayoría de estos individuos (1228) recibieron PRANDIN en uno de los cinco ensayos controlados activos de 1 año. Durante un año, el 13 % de los pacientes con PRANDIN 1 mg suspendieron el tratamiento debido a reacciones adversas. Las reacciones adversas más comunes que llevaron a la abstinencia fueron hiperglucemia, hipoglucemia y síntomas relacionados.
La Tabla 1 enumera las reacciones adversas comunes para los pacientes con PRANDIN en comparación con el placebo en ensayos de 12 a 24 semanas de duración.
Hipoglucemia
En ensayos clínicos con PRANDIN 1 mg, la hipoglucemia es la reacción adversa observada con mayor frecuencia. Se produjo hipoglucemia leve o moderada en el 31 % de los pacientes tratados con PRANDIN 1 mg y en el 7 % de los pacientes tratados con placebo [ver ADVERTENCIAS Y PRECAUCIONES ].
Se informó hipoglucemia en el 16 % de 1228 pacientes con PRANDIN, el 20 % de 417 pacientes con gliburida y el 19 % de 81 pacientes con glipizida en ensayos controlados de 1 año. De los pacientes tratados con PRANDIN con hipoglucemia sintomática, ninguno desarrolló coma ni requirió hospitalización.
En un ensayo controlado con placebo de 24 semanas, los pacientes que no habían recibido tratamiento con agentes hipoglucemiantes orales y los pacientes con una HbA1c inferior al 8 % al inicio del estudio tuvieron una mayor frecuencia de hipoglucemia.
Aumento de peso
No hubo una ganancia promedio en el peso corporal cuando los pacientes tratados previamente con agentes hipoglucemiantes orales cambiaron a PRANDIN. El aumento de peso promedio en pacientes tratados con PRANDIN 0,5 mg y no tratados previamente con sulfonilureas fue del 3,3 %.
Eventos cardiovasculares
La incidencia total de eventos adversos cardiovasculares graves, incluida la isquemia, fue mayor para PRANDIN (51/1228 o 4 %) que para las sulfonilureas (13/498 o 3 %) en ensayos clínicos controlados de comparación.
Siete ensayos clínicos controlados incluyeron la terapia combinada de PRANDIN con insulina NPH (n=431), formulaciones de insulina sola (n=388) u otras combinaciones (sulfonilurea más insulina NPH o PRANDIN 1 mg más metformina) (n=120). Hubo seis eventos adversos graves de isquemia miocárdica en pacientes tratados con PRANDIN 0.5 mg más insulina NPH de dos estudios, y un evento en pacientes que usaron formulaciones de insulina sola de otro estudio [ver ADVERTENCIAS Y PRECAUCIONES ].
Terapia combinada con tiazolidinedionas
Hipoglucemia
Durante los ensayos clínicos de tratamiento de 24 semanas de la terapia de combinación PRANDIN-rosiglitazona o PRANDIN-pioglitazona (un total de 250 pacientes en terapia de combinación), se produjo hipoglucemia (glucosa en sangre
Edema periférico e insuficiencia cardíaca
Se notificó edema periférico en 12 de 250 (4,8 %) pacientes con tratamiento combinado con PRANDIN y tiazolidinediona y 3 de 124 (2,4 %) pacientes con monoterapia con tiazolidinediona, sin que se hayan notificado casos en estos ensayos con PRANDIN en monoterapia. Hubo informes en 2 de 250 pacientes (0,8 %) tratados con tratamiento con PRANDIN-tiazolidinediona de episodios de edema con insuficiencia cardíaca congestiva. Ambos pacientes tenían antecedentes de enfermedad arterial coronaria y se recuperaron después del tratamiento con agentes diuréticos. No se informaron casos comparables en los grupos de tratamiento con monoterapia.
Aumento de peso
Los aumentos de peso promedio asociados con la terapia de combinación, PRANDIN y pioglitazona fueron de 5,5 kg, 0,3 kg y 2,0 kg, respectivamente. Los aumentos de peso promedio asociados con la terapia de combinación, PRANDIN y rosiglitazona fueron de 4,5 kg, 1,3 kg y 3,3 kg, respectivamente.
Eventos adversos poco frecuentes (
Los eventos adversos clínicos o de laboratorio menos comunes observados en los ensayos clínicos incluyeron enzimas hepáticas elevadas, trombocitopenia, leucopenia y reacciones anafilactoides.
Experiencia posterior a la comercialización
Las siguientes reacciones adversas adicionales se han identificado durante el uso posterior a la aprobación de PRANDIN. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, generalmente no es posible estimar de manera confiable su frecuencia o una relación causal con la exposición al fármaco.
- Alopecia
- Anemia hemolítica
- pancreatitis
- Síndrome de Stevens-Johnson
- Disfunción hepática grave que incluye ictericia y hepatitis
INTERACCIONES CON LA DROGAS
Interacciones farmacológicas clínicamente importantes con PRANDIN
La Tabla 3 incluye una lista de medicamentos con interacciones medicamentosas clínicamente importantes cuando se administran concomitantemente con PRANDIN 1 mg e instrucciones para prevenirlas o manejarlas.
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Hipoglucemia
Todas las glinidas, incluido PRANDIN 0,5 mg, pueden causar hipoglucemia [ver REACCIONES ADVERSAS ]. La hipoglucemia grave puede causar convulsiones, poner en peligro la vida o causar la muerte. La hipoglucemia puede afectar la capacidad de concentración y el tiempo de reacción; esto puede poner en riesgo a una persona ya otras personas en situaciones en las que estas habilidades son importantes (p. ej., conducir u operar otra maquinaria).
La hipoglucemia puede ocurrir repentinamente y los síntomas pueden diferir en cada individuo y cambiar con el tiempo en el mismo individuo. La conciencia sintomática de la hipoglucemia puede ser menos pronunciada en pacientes con diabetes de larga evolución, en pacientes con neuropatía diabética, en pacientes que usan medicamentos que bloquean el sistema nervioso simpático (p. ej., betabloqueantes) [ver INTERACCIONES CON LA DROGAS ], o en pacientes que experimentan hipoglucemia recurrente.
Los factores que pueden aumentar el riesgo de hipoglucemia incluyen cambios en el patrón de comidas (p. ej., contenido de macronutrientes), cambios en el nivel de actividad física, cambios en la medicación coadministrada [ver INTERACCIONES CON LA DROGAS ], y uso concomitante con otros agentes antidiabéticos. Los pacientes con insuficiencia renal o hepática pueden tener un mayor riesgo de hipoglucemia [ver Uso en poblaciones específicas ].
Los pacientes deben administrar PRANDIN 0,5 mg antes de las comidas y se les debe indicar que se salten la dosis de PRANDIN si se saltan una comida. En pacientes que experimentan hipoglucemia, se debe reducir la dosis de PRANDIN [ver DOSIFICACIÓN Y ADMINISTRACIÓN ]. Se debe educar a los pacientes y cuidadores para que reconozcan y manejen la hipoglucemia. El autocontrol de la glucosa en sangre juega un papel esencial en la prevención y el manejo de la hipoglucemia. En pacientes con mayor riesgo de hipoglucemia y pacientes que tienen una conciencia sintomática reducida de hipoglucemia, se recomienda una mayor frecuencia de monitoreo de glucosa en sangre.
Reacciones adversas cardiovasculares graves con el uso concomitante con insulina NPH
En siete ensayos controlados, hubo seis eventos adversos graves de isquemia miocárdica en pacientes tratados con PRANDIN 0.5 mg más insulina NPH de dos estudios, y un evento en pacientes que usaron formulaciones de insulina sola de otro estudio [ver REACCIONES ADVERSAS ]. PRANDIN no está indicado para su uso en combinación con insulina NPH.
Resultados macrovasculares
No se han realizado estudios clínicos que establezcan evidencia concluyente de reducción del riesgo macrovascular con PRANDIN.

Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
En un estudio de carcinogenicidad de 104 semanas en ratas a dosis de hasta 120 mg/kg/día, que es aproximadamente 60 veces la exposición clínica en mg/m2, la incidencia de adenomas benignos de la tiroides y el hígado aumentó en ratas macho. No se encontró evidencia de carcinogenicidad en ratas hembra. Las incidencias más altas de tumores de tiroides e hígado en ratas macho no se observaron con dosis más bajas de 30 mg/kg/día y 60 mg/kg/día respectivamente (que son más de 15 y 30 veces, respectivamente, exposiciones clínicas en mg/m2). base). En un estudio de carcinogenicidad de 104 semanas en ratones con dosis de hasta 500 mg/kg/día, no se encontró evidencia de carcinogenicidad en ratones (que es aproximadamente 125 veces la exposición clínica en mg/m2).
La repaglinida no fue genotóxica en una batería de estudios in vivo e in vitro: mutagénesis bacteriana (prueba de Ames), ensayo de mutación celular directa in vitro en células V79 (HGPRT), ensayo de aberración cromosómica in vitro en linfocitos humanos, síntesis de ADN replicante y no programada en hígado de rata, y pruebas de micronúcleo de ratón y rata in vivo.
En un estudio de fertilidad en ratas, se administró repaglinida a ratas macho y hembra en dosis de hasta 300 y 80 mg/kg/día, respectivamente. No se observaron efectos adversos sobre la fertilidad (que son más de 40 veces la exposición clínica en mg/m2).
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
Los datos limitados con el uso de PRANDIN y repaglinida en mujeres embarazadas son insuficientes para informar un riesgo asociado con el fármaco de anomalías congénitas graves o abortos espontáneos. Existen riesgos para la madre y el feto asociados con la diabetes mal controlada durante el embarazo [ver Consideraciones clínicas ].
Se demostró que la repaglidina no es teratogénica en estudios con animales (ratas y conejos). Se observó embriotoxicidad, desarrollo anormal de extremidades en fetos de rata en ratas hembra expuestas a altas dosis en la última etapa del embarazo.
El riesgo de fondo estimado de defectos congénitos importantes es del 6 % al 10 % en mujeres con diabetes pregestacional con HbA1c >7 y se ha informado que es tan alto como del 20 % al 25 % en mujeres con HbA1c >10. Se desconoce el riesgo de fondo estimado de aborto espontáneo para la población indicada. En la población general de EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 % al 4 % y del 15 % al 20 %, respectivamente.
Consideraciones clínicas
Riesgo materno y/o embrionario/fetal asociado a la enfermedad
La diabetes mal controlada en el embarazo aumenta el riesgo materno de cetoacidosis diabética, preeclampsia, abortos espontáneos, parto prematuro, mortinatos y complicaciones en el parto. La diabetes mal controlada aumenta el riesgo fetal de defectos congénitos importantes, mortinatos y morbilidad relacionada con la macrosomía.
Datos
Datos humanos
No existen datos adecuados sobre los riesgos de desarrollo asociados con el uso de PRANDIN 2 mg en mujeres embarazadas.
Datos de animales
La repaglinida no fue teratogénica en ratas o conejos en dosis de 40 veces (ratas) y aproximadamente 0,8 veces (conejos) la exposición clínica (sobre una base de mg/m2) durante el embarazo. Las crías de ratas expuestas a repaglinida a 15 veces la exposición clínica en mg/m2 durante los días 17 a 22 de gestación y durante la lactancia desarrollaron deformidades esqueléticas no teratogénicas que consisten en acortamiento, engrosamiento y flexión del húmero durante el período posnatal. Este efecto no se observó en dosis de hasta 2,5 veces la exposición clínica (sobre una base de mg/m2) en los días 1 a 22 del embarazo o en dosis más altas administradas durante los días 1 a 16 del embarazo.
Lactancia
Resumen de riesgos
No hay información sobre la presencia de PRANDIN 0,5 mg en la leche humana, los efectos sobre el lactante o los efectos sobre la producción de leche. Se detectó repaglinida en la leche de rata, aunque debido a las diferencias específicas de la especie en la fisiología de la lactancia, es posible que los datos en animales no predigan de forma fiable los niveles del fármaco en la leche humana. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de PRANDIN de la madre y cualquier posible efecto adverso en el lactante a causa de PRANDIN o de afecciones maternas subyacentes.
Consideraciones clínicas
Aunque no se sabe si la repaglinida se excreta en la leche humana, se sabe que algunos agentes orales se excretan por esta vía. Debido a que puede existir el potencial de hipoglucemia en los lactantes y debido a los efectos en los animales lactantes, se debe tomar una decisión sobre si se debe suspender PRANDIN en las madres lactantes o si las madres deben interrumpir la lactancia. Si se suspende PRANDIN y si la dieta por sí sola no es adecuada para controlar la glucosa en sangre, se debe considerar la terapia con insulina.
Datos
En estudios de reproducción en ratas, se detectaron niveles mensurables de repaglinida en la leche materna de las madres y se observaron niveles más bajos de glucosa en sangre en las crías. Los estudios de adopción cruzada indicaron que los cambios esqueléticos [ver El embarazo ] podría inducirse en cachorros de control amamantados por madres tratadas, aunque esto ocurrió en menor grado que en los cachorros tratados en el útero.
Uso pediátrico
No se ha establecido la seguridad y eficacia en pacientes pediátricos.
Uso geriátrico
En estudios clínicos de 24 semanas o más de duración, 415 pacientes tenían más de 65 años y ningún paciente tenía más de 75 años. En ensayos con control activo de un año, no se observaron diferencias en la efectividad o los eventos adversos entre estos sujetos y los menores de 65 años. No hubo un aumento en la frecuencia o gravedad de la hipoglucemia en sujetos mayores, pero una mayor sensibilidad de algunos individuos mayores a No se puede descartar el tratamiento con PRANDIN 0,5 mg.
Insuficiencia renal
Se realizaron estudios farmacocinéticos de repaglinida en pacientes con deterioro de la función renal de leve a moderado (CrCl = 40 a 80 ml/min) y deterioro grave de la función renal (CrCl = 20 a 40 ml/min). No es necesario ajustar la dosis inicial en pacientes con disfunción renal de leve a moderada. Sin embargo, los pacientes con insuficiencia renal grave deben iniciar el tratamiento con PRANDIN con la dosis de 0,5 mg y ajustar la dosis cuidadosamente [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
No se realizaron estudios en pacientes con aclaramiento de creatinina por debajo de 20 ml/min o pacientes con insuficiencia renal que requerían hemodiálisis.
Deterioro hepático
Se realizó un estudio de dosis única en 12 pacientes con enfermedad hepática crónica. Los pacientes con insuficiencia hepática de moderada a grave tenían concentraciones séricas más altas y más prolongadas. Por lo tanto, PRANDIN 0,5 mg debe usarse con precaución en pacientes con insuficiencia hepática. Es posible que se necesiten intervalos más prolongados entre los ajustes de dosis para permitir una evaluación completa de la respuesta.
SOBREDOSIS
Pueden ocurrir reacciones hipoglucémicas severas con coma, convulsiones u otro deterioro neurológico y constituir emergencias médicas que requieren hospitalización inmediata. Los síntomas de hipoglucemia sin pérdida de conciencia o hallazgos neurológicos deben tratarse agresivamente con glucosa oral y ajustes en la dosis del fármaco y/o patrones de comidas. La vigilancia estrecha puede continuar hasta que el médico esté seguro de que el paciente está fuera de peligro. Se debe monitorear de cerca a los pacientes durante un mínimo de 24 a 48 horas, ya que la hipoglucemia puede reaparecer después de una aparente recuperación clínica. No hay evidencia de que PRANDIN sea dializable mediante hemodiálisis.
CONTRAINDICACIONES
PRANDIN está contraindicado en pacientes con:
- El uso concomitante de gemfibrozilo [ver INTERACCIONES CON LA DROGAS ]
- Hipersensibilidad conocida a la repaglinida o a cualquier ingrediente inactivo
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
La repaglinida reduce los niveles de glucosa en sangre al estimular la liberación de insulina del páncreas. Esta acción depende del funcionamiento de las células beta (ß) en los islotes pancreáticos. La liberación de insulina depende de la glucosa y disminuye a bajas concentraciones de glucosa.
La repaglinida cierra los canales de potasio dependientes de ATP en la membrana de las células ß uniéndose a sitios identificables. Este bloqueo de los canales de potasio despolariza las células ß, lo que conduce a la apertura de los canales de calcio. El aumento de la entrada de calcio resultante induce la secreción de insulina. El mecanismo del canal iónico es altamente selectivo de tejido con baja afinidad por el corazón y el músculo esquelético.
Farmacodinámica
Se llevó a cabo un ensayo de respuesta a la dosis, doble ciego, controlado con placebo, de cuatro semanas de duración, en 138 pacientes con diabetes tipo 2, utilizando dosis que oscilaban entre 0,25 (dosis no aprobada) y 4 mg con cada una de las tres comidas. La terapia con PRANDIN dio como resultado una disminución de la glucosa proporcional a la dosis en todo el rango de dosis. Los niveles de insulina en plasma aumentaron después de las comidas y revirtieron a la línea de base antes de la siguiente comida. La mayor parte del efecto reductor de la glucosa en sangre en ayunas se demostró en 1 a 2 semanas.
En un estudio de titulación de dosis de 3 meses, doble ciego, controlado con placebo, las dosis de PRANDIN de 0,5 mg o de placebo para cada paciente se aumentaron semanalmente de 0,25 mg (dosis no aprobada) a 0,5, 1 y 2 mg, hasta un máximo de 4 mg, hasta alcanzar un nivel de glucosa plasmática en ayunas (FPG)
La dosificación de PRANDIN 0,5 mg en relación con la liberación de insulina relacionada con las comidas se estudió en tres ensayos que incluían a 58 pacientes. El control glucémico se mantuvo durante un período en el que se varió el patrón de comidas y dosis (2, 3 o 4 comidas por día; antes de las comidas x 2, 3 o 4) en comparación con un período de 3 comidas regulares y 3 dosis por día ( antes de las comidas x 3). El efecto hipoglucemiante no difirió cuando se administró PRANDIN 0,5 mg al comienzo de una comida, 15 minutos antes o 30 minutos antes de la comida.
Farmacocinética
Los parámetros farmacocinéticos de repaglinida obtenidos de un estudio cruzado de dosis única en sujetos sanos y de un estudio paralelo de dosis múltiples de proporcionalidad de dosis (0,5, 1, 2 y 4 mg) en pacientes con diabetes tipo 2 se resumen en las tablas. 5 y 6. Estos datos indican que la repaglinida no se acumuló en el suero. El aclaramiento de repaglinida oral no cambió en el rango de dosis de 0,5 a 4 mg, lo que indica una relación lineal entre la dosis y los niveles plasmáticos del fármaco.
Absorción
Después de la administración oral, la repaglinida se absorbe por completo en el tracto gastrointestinal. Después de dosis orales únicas y múltiples en sujetos sanos o en pacientes, los niveles plasmáticos máximos del fármaco (Cmax) se alcanzan en 1 hora (Tmax). La repaglinida se elimina del torrente sanguíneo con una vida media de aproximadamente 1 hora. La biodisponibilidad absoluta media es del 56%. Cuando se administró repaglinida con alimentos, la Tmax media no cambió, pero la Cmax media y el AUC (área bajo la curva de tiempo/concentración plasmática) se redujeron un 20 % y un 12,4 %, respectivamente.
Distribución
Después de la dosificación intravenosa (IV) en sujetos sanos, el volumen de distribución en el estado estacionario (Vss) fue de 31 l y el aclaramiento corporal total (CL) fue de 38 l/h. La unión a proteínas y la unión a la albúmina sérica humana fue superior al 98 %.
Metabolismo y eliminación
La repaglinida se metaboliza completamente por biotransformación oxidativa y conjugación directa con ácido glucurónico después de una dosis intravenosa u oral. Los principales metabolitos son un ácido dicarboxílico oxidado (M2), la amina aromática (M1) y el acil glucurónido (M7). Se ha demostrado que el sistema enzimático del citocromo P-450, específicamente 2C8 y 3A4, está involucrado en la N-desalquilación de repaglinida a M2 y la posterior oxidación a M1. Los metabolitos no contribuyen al efecto hipoglucemiante de la repaglinida. Dentro de las 96 horas posteriores a la dosificación con 14C-repaglinida como dosis oral única, aproximadamente el 90 % del radiomarcador se recuperó en las heces y aproximadamente el 8 % en la orina. Solo el 0,1 % de la dosis se elimina en la orina como compuesto original. El metabolito principal (M2) representó el 60% de la dosis administrada. Menos del 2% del fármaco original se recuperó en las heces. La repaglinida parece ser un sustrato para el transportador de captación hepática activa (proteína transportadora de aniones orgánicos OATP1B1).
Variabilidad de la exposición
El AUC de repaglinida después de múltiples dosis de 0,25 a 4 mg con cada comida varía en un amplio rango. Los coeficientes de variación intraindividual e interindividual fueron 36% y 69%, respectivamente. El AUC sobre el rango de dosis terapéuticas incluía de 69 a 1005 ng/mL*hr, pero se alcanzó una exposición del AUC de hasta 5417 ng/mL*hr en estudios de aumento de dosis sin consecuencias adversas aparentes.
Poblaciones Específicas
geriátrico
Voluntarios sanos fueron tratados con un régimen de 2 mg de PRANDIN 0,5 mg tomados antes de cada una de las 3 comidas. No hubo diferencias significativas en la farmacocinética de repaglinida entre el grupo de pacientes Uso en poblaciones específicas ].
Género
Una comparación de la farmacocinética en hombres y mujeres mostró que el AUC en el rango de dosis de 0,5 mg a 4 mg era entre un 15 % y un 70 % mayor en mujeres con diabetes tipo 2. Esta diferencia no se reflejó en la frecuencia de episodios hipoglucémicos (hombres: 16 %; mujeres: 17 %) u otros eventos adversos.
La raza
No se han realizado estudios farmacocinéticos para evaluar los efectos de la raza, pero en un estudio estadounidense de 1 año de duración en pacientes con diabetes tipo 2, el efecto reductor de la glucosa en sangre fue comparable entre caucásicos (n=297) y afroamericanos (n= 33). En un estudio de dosis-respuesta de EE. UU., no hubo una diferencia aparente en la exposición (AUC) entre los caucásicos (n=74) y los hispanos (n=33).
Insuficiencia renal
Se comparó la farmacocinética de repaglinida en dosis única y en estado estacionario entre pacientes con diabetes tipo 2 y función renal normal (ClCr > 80 ml/min), insuficiencia renal de leve a moderada (ClCr = 40 a 80 ml/min) y función renal grave. deterioro de la función renal (CrCl = 20 a 40 ml/min). Tanto el AUC como la Cmax de repaglinida fueron similares en pacientes con función renal normal y con insuficiencia renal de leve a moderada (valores medios de 56,7 ng/ml*h frente a 57,2 ng/ml*h y 37,5 ng/ml frente a 37,7 ng/ml, respectivamente). Pacientes con función renal gravemente reducida tenían valores medios de AUC y Cmax elevados (98,0 ng/mL*hr y 50,7 ng/mL, respectivamente), pero este estudio mostró solo una correlación débil entre los niveles de repaglinida y el aclaramiento de creatinina.
Deterioro hepático
Se realizó un estudio abierto de dosis única en 12 sujetos sanos y 12 pacientes con enfermedad hepática crónica (CLD, por sus siglas en inglés) clasificados según la escala de Child-Pugh y el aclaramiento de cafeína. Los pacientes con deterioro de la función hepática de moderado a grave tenían concentraciones séricas más altas y más prolongadas de repaglinida total y libre que los sujetos sanos (AUCsaludable: 91,6 ng/mL*hr; pacientes con AUCCLD: 368,9 ng/mL*hr; Cmax, saludable: 46,7 ng/mL; Cmax, pacientes con EPC: 105,4 ng/mL). El AUC se correlacionó estadísticamente con el aclaramiento de cafeína. No se observaron diferencias en los perfiles de glucosa entre los grupos de pacientes.
Interacciones fármaco-fármaco
Los estudios de interacción farmacológica realizados en voluntarios sanos muestran que PRANDIN 0,5 mg no tuvo un efecto clínicamente relevante sobre las propiedades farmacocinéticas de la digoxina, la teofilina o la warfarina. La coadministración de cimetidina con PRANDIN 1 mg no alteró significativamente la absorción y disposición de repaglinida.
Además, los siguientes medicamentos se estudiaron en voluntarios sanos con administración conjunta de PRANDIN.
Estudios clínicos
Ensayos de monoterapia
Se llevó a cabo un ensayo doble ciego controlado con placebo en 362 pacientes tratados durante 24 semanas. La HbA1c para los grupos tratados con PRANDIN (grupos de 1 y 4 mg combinados) al final del estudio disminuyó en comparación con el grupo tratado con placebo en pacientes sin tratamiento previo y en pacientes tratados previamente con hipoglucemiantes orales en un 2,1 % y un 1,7 %. respectivamente. En este ensayo de dosis fija, los pacientes que no habían recibido tratamiento previo con agentes hipoglucemiantes orales y los pacientes con una HbA1c inferior al 8 % al inicio del estudio mostraron una mayor disminución de la glucosa en sangre.
Ensayos combinados
PRANDIN en combinación con metformina
PRANDIN se estudió en combinación con metformina en 83 pacientes no controlados satisfactoriamente con ejercicio, dieta y metformina sola. La dosis de 2 mg de PRANDIN se ajustó durante 4 a 8 semanas, seguida de un período de mantenimiento de 3 meses. La terapia combinada con PRANDIN 1 mg y metformina dio como resultado una mejora estadísticamente significativa en la HbA1c y la glucosa plasmática en ayunas (FPG) en comparación con la monoterapia con PRANDIN 2 mg o metformina (Tabla 8). En este estudio donde la dosis de metformina se mantuvo constante, la terapia de combinación de PRANDIN y metformina mostró efectos de ahorro de dosis con respecto a PRANDIN. La mejora en HbA1c y FPG del grupo de combinación se logró con una dosis diaria más baja de 0,5 mg de PRANDIN que en el grupo de monoterapia con PRANDIN (Tabla 8).
PRANDIN 1 mg en combinación con pioglitazona
Se comparó un régimen de tratamiento combinado de PRANDIN y pioglitazona (N=123) con PRANDIN solo (N=61) y pioglitazona sola (N=62) en un ensayo de 24 semanas en el que participaron 246 pacientes tratados previamente con monoterapia con sulfonilurea o metformina (HbA1c > 7,0%). La dosis de 1 mg de PRANDIN se ajustó durante las primeras 12 semanas, seguida de un período de mantenimiento de 12 semanas. La terapia combinada dio como resultado una mejora estadísticamente significativa en HbA1c y FPG en comparación con la monoterapia (Figura 1). Los cambios desde el inicio para los que completaron FPG (mg/dL) y HbA1c (%), respectivamente fueron: -39,8 mg/dL y -0,1 % para PRANDIN, -35,3 mg/dL y -0,1 % para pioglitazona y -92,4 mg/ dL y -1,9% para la combinación. En este estudio en el que la dosis de pioglitazona se mantuvo constante, el grupo de tratamiento combinado mostró efectos de ahorro de dosis con respecto a PRANDIN (consulte la leyenda de la Figura 1). La mejora en HbA1c y FPG del grupo de combinación se logró con una dosis diaria más baja de PRANDIN que en el grupo de monoterapia con PRANDIN.
Figura 1: PRANDIN en combinación con pioglitazona: valores de HbA1c
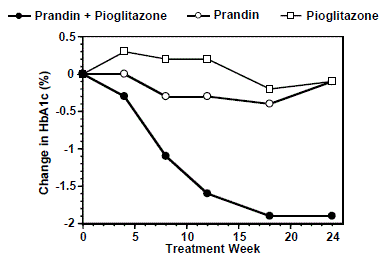
LEYENDA
Valores de HbA1c por semana de estudio para pacientes que completaron el estudio (combinación, N = 101; PRANDIN 1 mg, N = 35, pioglitazona, N = 26). Los sujetos con FPG por encima de 270 mg/dL fueron retirados del estudio.
Dosis de pioglitazona: fijada en 30 mg/día; PRANDIN 1 mg dosis final mediana: 6 mg/día para combinación y 10 mg/día para monoterapia.
PRANDIN en combinación con rosiglitazona
Se comparó un régimen de terapia combinada de PRANDIN y rosiglitazona con una monoterapia con cualquiera de los agentes solos en un ensayo de 24 semanas que inscribió a 252 pacientes previamente tratados con sulfonilurea o metformina (HbA1c > 7,0%). La terapia combinada dio como resultado una mejora estadísticamente significativa en HbA1c y FPG en comparación con la monoterapia (Tabla 9 a continuación). Los efectos glucémicos de la terapia combinada fueron moderados con respecto a la dosis diaria total de PRANDIN de 1 mg y la dosis diaria total de rosiglitazona (consulte la Leyenda de la Tabla 9). La mejora en HbA1c y FPG del grupo de terapia combinada se logró con una dosis diaria más baja de PRANDIN 1 mg y rosiglitazona, en comparación con los respectivos grupos de monoterapia.
INFORMACIÓN DEL PACIENTE
Hipoglucemia
Informe a los pacientes que PRANDIN 2 mg puede causar hipoglucemia e instruya a los pacientes y a sus cuidadores sobre los procedimientos de autocontrol, incluido el control de la glucosa y el control de la hipoglucemia. Informe a los pacientes que su capacidad para concentrarse y reaccionar puede verse afectada como resultado de la hipoglucemia. En pacientes con mayor riesgo de hipoglucemia y pacientes que tienen una conciencia sintomática reducida de hipoglucemia, se recomienda una mayor frecuencia de monitoreo de glucosa en sangre [ver ADVERTENCIAS Y PRECAUCIONES ].
Administración
Indique a los pacientes que tomen PRANDIN 0,5 mg dentro de los 30 minutos antes de las comidas. Indique a los pacientes que se salten su dosis de PRANDIN cuando se salte una comida [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Interacciones con la drogas
Analice las posibles interacciones farmacológicas con los pacientes e infórmeles sobre las posibles interacciones farmacológicas con PRANDIN [ver INTERACCIONES CON LA DROGAS ].
