Glucovance 400/2.50mg, 500/5mg Metformin Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Glucovance 2,50 mg y cómo se usa?
Glucovance 400 mg es un medicamento recetado que se usa para tratar los síntomas de la diabetes mellitus tipo 2. Glucovance se puede usar solo o con otros medicamentos.
Glucovance pertenece a una clase de medicamentos llamados antidiabéticos, sulfonilureas/biguanidas.
No se sabe si Glucovance 2.50mg es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Glucovance 400 mg?
Glucovance puede causar efectos secundarios graves que incluyen:
- urticaria,
- respiración dificultosa,
- hinchazón de la cara, los labios, la lengua o la garganta,
- hinchazón,
- rápido aumento de peso,
- dificultad para respirar,
- extrema debilidad,
- visión borrosa,
- transpiración,
- problemas para hablar,
- temblores,
- dolor de estómago,
- confusión,
- convulsiones,
- dolor muscular inusual,
- dificultad para respirar,
- dolor de estómago,
- vómitos,
- frecuencia cardíaca irregular,
- mareo,
- siento frio,
- debilidad, y
- cansancio
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Glucovance incluyen:
- baja azúcar en la sangre,
- náuseas,
- Diarrea,
- malestar estomacal y
- dolor de cabeza
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Glucovance. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
Las tabletas GLUCOVANCE® (Glyburide and Metformin HCl) contienen 2 medicamentos antihiperglucémicos orales utilizados en el control de la diabetes tipo 2, gliburide y clorhidrato de metformina.
La gliburida es un fármaco antihiperglucémico oral de la clase de las sulfonilureas. El nombre químico de la gliburida es 1-[[p-[2-(5-cloro-o-anisamido)etil]fenil]sulfonil]-3-ciclo-hexilurea. La gliburida es un compuesto cristalino de color blanco a blanquecino con una fórmula molecular de C23H28ClN3O5S y un peso molecular de 494,01. La gliburida utilizada en GLUCOVANCE 5 mg tiene una distribución de tamaño de partícula de 25 % de valor de tamaño inferior a 6 μm, 50 % de valor de tamaño inferior a no más de 7 a 10 μm y 75 % de valor de tamaño inferior a 21 μm. La fórmula estructural se representa a continuación.
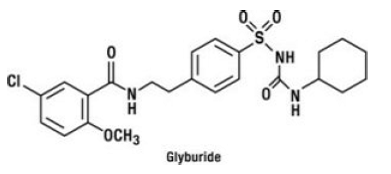
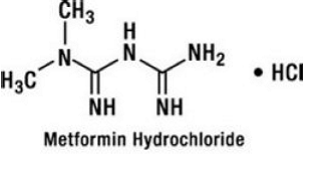
El clorhidrato de metformina es un fármaco antihiperglucemiante oral utilizado en el tratamiento de la diabetes tipo 2. El clorhidrato de metformina (monoclorhidrato de N,N-dimetilimidodicarbonimidica diamida) no está química ni farmacológicamente relacionado con las sulfonilureas, las tiazolidinedionas o los inhibidores de la α-glucosidasa. Es un compuesto cristalino de color blanco a blanquecino con una fórmula molecular de C4H12ClN5 (monoclorhidrato) y un peso molecular de 165,63. El clorhidrato de metformina es fácilmente soluble en agua y prácticamente insoluble en acetona, éter y cloroformo. El pKa de la metformina es 12,4. El pH de una solución acuosa al 1% de clorhidrato de metformina es 6,68. La fórmula estructural es como se muestra:
GLUCOVANCE 500 mg está disponible para administración oral en comprimidos que contienen 1,25 mg de gliburida con 250 mg de clorhidrato de metformina, 2,5 mg de gliburida con 500 mg de clorhidrato de metformina y 5 mg de gliburida con 500 mg de clorhidrato de metformina. Además, cada tableta contiene los siguientes ingredientes inactivos: celulosa microcristalina, povidona, croscarmelosa sódica y estearato de magnesio. Los comprimidos están recubiertos con película, lo que permite diferenciar los colores.
INDICACIONES
GLUCOVANCE (Glyburide and Metformin HCl) Tablets está indicado como complemento de la dieta y el ejercicio para mejorar el control glucémico en adultos con diabetes mellitus tipo 2.
DOSIFICACIÓN Y ADMINISTRACIÓN
Consideraciones Generales
La dosis de GLUCOVANCE debe individualizarse sobre la base de la eficacia y la tolerancia sin exceder la dosis diaria máxima recomendada de 20 mg de gliburida/2000 mg de metformina. GLUCOVANCE debe administrarse con las comidas y debe iniciarse con una dosis baja, con un aumento gradual de la dosis como se describe a continuación, para evitar la hipoglucemia (en gran parte debido a la gliburida), reducir los efectos secundarios gastrointestinales (en gran parte debido a la metformina) y permitir la determinación de la dosis mínima eficaz para el control adecuado de la glucosa en sangre para el paciente individual.
Con el tratamiento inicial y durante la titulación de la dosis, se debe utilizar un control adecuado de la glucosa en sangre para determinar la respuesta terapéutica a GLUCOVANCE 2,50 mg e identificar la dosis mínima eficaz para el paciente. Posteriormente, se debe medir la HbA1c a intervalos de aproximadamente 3 meses para evaluar la eficacia de la terapia. El objetivo terapéutico en todos los pacientes con diabetes tipo 2 es disminuir la FPG, PPG y HbA1c a valores normales o lo más cerca posible de lo normal. Idealmente, la respuesta a la terapia debe evaluarse utilizando HbA (hemoglobina glicosilada), que es un mejor indicador del control glucémico a largo plazo que la FPG sola.
No se han realizado estudios que examinen específicamente la seguridad y la eficacia de cambiar a la terapia con GLUCOVANCE 400 mg en pacientes que toman gliburida (u otra sulfonilurea) concomitantemente con metformina. Pueden ocurrir cambios en el control glucémico en tales pacientes, con posible hiperglucemia o hipoglucemia. Cualquier cambio en el tratamiento de la diabetes tipo 2 debe realizarse con cuidado y con un control adecuado.
GLUCOVANCE en pacientes con control glucémico inadecuado con dieta y ejercicio
Dosis inicial recomendada: 1,25 mg/250 mg una o dos veces al día con las comidas.
Para los pacientes con diabetes tipo 2 cuya hiperglucemia no puede controlarse satisfactoriamente solo con dieta y ejercicio, la dosis inicial recomendada de GLUCOVANCE 400 mg es de 1,25 mg/250 mg una vez al día con una comida. Como terapia inicial en pacientes con HbA1c inicial > 9 % o FPG > 200 mg/dL, se puede usar una dosis inicial de GLUCOVANCE de 1,25 mg/250 mg dos veces al día con las comidas de la mañana y la cena. Los aumentos de dosis deben hacerse en incrementos de 1,25 mg/250 mg por día cada 2 semanas hasta la dosis efectiva mínima necesaria para lograr un control adecuado de la glucosa en sangre. En ensayos clínicos de GLUCOVANCE como terapia inicial, no hubo experiencia con dosis diarias totales > 10 mg/2000 mg por día. GLUCOVANCE 5 mg/500 mg no debe usarse como terapia inicial debido a un mayor riesgo de hipoglucemia.
Uso de 500 mg de GLUCOVANCE en pacientes con control glucémico inadecuado con una sulfonilurea y/o metformina
Dosis inicial recomendada: 2,5 mg/500 mg o 5 mg/500 mg dos veces al día con las comidas.
Para los pacientes que no se controlan adecuadamente con gliburida (u otra sulfonilurea) o metformina sola, la dosis inicial recomendada de GLUCOVANCE es de 2,5 mg/500 mg o 5 mg/500 mg dos veces al día con el desayuno y la cena. Para evitar la hipoglucemia, la dosis inicial de GLUCOVANCE 2,50 mg no debe exceder las dosis diarias de gliburida o metformina que ya se toman. La dosis diaria debe titularse en incrementos de no más de 5 mg/500 mg hasta la dosis mínima eficaz para lograr un control adecuado de la glucosa en sangre o hasta una dosis máxima de 20 mg/2000 mg por día.
Para pacientes tratados previamente con terapia combinada de gliburida (u otra sulfonilurea) más metformina, si se cambia a GLUCOVANCE, la dosis inicial no debe exceder la dosis diaria de gliburida (o la dosis equivalente de otra sulfonilurea) y metformina que ya está tomando. Se debe monitorear de cerca a los pacientes para detectar signos y síntomas de hipoglucemia luego de dicho cambio y se debe ajustar la dosis de GLUCOVANCE como se describió anteriormente para lograr un control adecuado de la glucosa en sangre.
Adición de tiazolidinedionas a la terapia con GLUCOVANCE
Para los pacientes que no están adecuadamente controlados con GLUCOVANCE, se puede agregar una tiazolidinediona a la terapia de 400 mg de GLUCOVANCE. Cuando se agrega una tiazolidinediona a la terapia con GLUCOVANCE, se puede continuar con la dosis actual de GLUCOVANCE 500 mg y se puede iniciar la tiazolidinediona a su dosis inicial recomendada. Para los pacientes que necesitan un control glucémico adicional, la dosis de tiazolidinediona se puede aumentar según el programa de titulación recomendado. El mayor control glucémico que se puede lograr con GLUCOVANCE más una tiazolidinediona puede aumentar el potencial de hipoglucemia en cualquier momento del día. En pacientes que desarrollan hipoglucemia cuando reciben 5 mg de GLUCOVANCE y una tiazolidinediona, se debe considerar la reducción de la dosis del componente gliburida de GLUCOVANCE. Según se justifique clínicamente, también se debe considerar el ajuste de las dosis de los otros componentes del régimen antidiabético.
Pacientes que reciben colesevelam
Cuando se coadministra colesevelam con gliburida, se reducen la concentración plasmática máxima y la exposición total a la gliburida. Por lo tanto, GLUCOVANCE debe administrarse al menos 4 horas antes que colesevelam.
Poblaciones específicas de pacientes
No se recomienda el uso de GLUCOVANCE durante el embarazo. La dosificación inicial y de mantenimiento de GLUCOVANCE debe ser conservadora en pacientes de edad avanzada, debido al potencial de disminución de la función renal en esta población. Cualquier ajuste de dosis requiere una evaluación cuidadosa de la función renal. En general, los pacientes ancianos, debilitados y desnutridos no deben ajustarse a la dosis máxima de GLUCOVANCE para evitar el riesgo de hipoglucemia. Es necesario monitorear la función renal para ayudar en la prevención de la acidosis láctica asociada a la metformina, particularmente en los ancianos. (Ver ADVERTENCIAS .)
CÓMO SUMINISTRADO
GLUCOVANCE® (Gliburida y Metformina HCl) Tabletas
GLUCOVANCE 1,25 mg/250 mg comprimido es un comprimido recubierto con película de color amarillo pálido, con forma de cápsula, con bordes biselados, biconvexo y con “ BMS ” grabado en un lado y “ 6072 ” grabado en el lado opuesto.
GLUCOVANCE 2,5 mg/500 mg comprimido es un comprimido recubierto con película de color naranja pálido, en forma de cápsula, con bordes biselados, biconvexo, con “ BMS ” grabado en un lado y “ 6073 ” grabado en el lado opuesto.
GLUCOVANCE 5 mg/500 mg comprimido es un comprimido recubierto con película de color amarillo, con forma de cápsula, con bordes biselados, biconvexo y con “ BMS ” grabado en un lado y “ 6074 ” grabado en el lado opuesto.
Almacenamiento
Almacenar a temperaturas de hasta 25°C (77°F). [Ver Temperatura ambiente controlada por USP .]
Dispensar en recipientes resistentes a la luz.
Distribuido por: Bristol-Myers Squibb Company, Princeton, NJ 08543 EE. UU. 1158884A7. Rev Oct 2013
EFECTOS SECUNDARIOS
GLUCOVANCE
En ensayos clínicos doble ciego que involucraron GLUCOVANCE 2.50 mg como terapia inicial o como terapia de segunda línea, un total de 642 pacientes recibieron GLUCOVANCE 2.50 mg, 312 recibieron terapia con metformina, 324 recibieron terapia con gliburida y 161 recibieron placebo. El porcentaje de pacientes que informaron eventos y tipos de eventos adversos informados en ensayos clínicos de GLUCOVANCE (todas las concentraciones) como terapia inicial y terapia de segunda línea se enumeran en la Tabla 6.
En un ensayo clínico controlado de rosiglitazona versus placebo en pacientes tratados con GLUCOVANCE (n=365), 181 pacientes recibieron 5 mg de GLUCOVANCE con rosiglitazona y 184 recibieron GLUCOVANCE con placebo.
Se notificó edema en el 7,7 % (14/181) de los pacientes tratados con rosiglitazona en comparación con el 2,2 % (4/184) de los pacientes tratados con placebo. Se observó un aumento de peso medio de 3 kg en pacientes tratados con rosiglitazona.
Muy raramente se han notificado reacciones similares al disulfiram en pacientes tratados con comprimidos de gliburida.
Hipoglucemia
En ensayos clínicos controlados de GLUCOVANCE 5 mg no hubo episodios de hipoglucemia que requirieran intervención médica y/o terapia farmacológica; todos los eventos fueron manejados por los pacientes. La incidencia de los síntomas de hipoglucemia informados (como mareos, temblores, sudoración y hambre) en el ensayo de terapia inicial de GLUCOVANCE 2.50 mg se resumen en la Tabla 7. La frecuencia de los síntomas de hipoglucemia en pacientes tratados con GLUCOVANCE 1.25 mg/250 mg fue más alto en pacientes con una HbA1c inicial 8 %. Para pacientes con una HbA1c inicial entre 8% y 11% tratados con GLUCOVANCE 2.5 mg/500 mg como terapia inicial, la frecuencia de síntomas hipoglucémicos fue de 30% a 35%. Como terapia de segunda línea en pacientes controlados inadecuadamente con sulfonilurea sola, aproximadamente el 6,8 % de todos los pacientes tratados con GLUCOVANCE 2,50 mg experimentaron síntomas de hipoglucemia. Cuando se agregó rosiglitazona a la terapia con 2,50 mg de GLUCOVANCE, el 22 % de los pacientes informaron 1 o más mediciones de glucosa por punción en el dedo ≤ 50 mg/dl en comparación con el 3,3 % de los pacientes tratados con placebo. Todos los eventos hipoglucémicos fueron manejados por los pacientes y solo 1 paciente suspendió por hipoglucemia. (Ver PRECAUCIONES : General : Adición de tiazolidinedionas a la terapia GLUCOVANCE .)
Reacciones gastrointestinales
La incidencia de efectos secundarios gastrointestinales (GI) (diarrea, náuseas/vómitos y dolor abdominal) en el ensayo de terapia inicial se resumen en la Tabla 7. En todos los ensayos de GLUCOVANCE 500 mg, los síntomas gastrointestinales fueron los eventos adversos más comunes con GLUCOVANCE 400 mg y fueron más frecuentes a niveles de dosis más altos.
En ensayos controlados,
En los informes posteriores a la comercialización, rara vez se pueden producir ictericia colestática y hepatitis, que pueden progresar a insuficiencia hepática; GLUCOVANCE 5 mg debe suspenderse si esto ocurre.
INTERACCIONES CON LA DROGAS
GLUCOVANCE
Ciertos medicamentos tienden a producir hiperglucemia y pueden conducir a la pérdida del control de la glucosa en sangre. Estos fármacos incluyen tiazidas y otros diuréticos, corticosteroides, fenotiazinas, productos tiroideos, estrógenos, anticonceptivos orales, fenitoína, ácido nicotínico, simpaticomiméticos, bloqueadores de los canales de calcio e isoniazida. Cuando dichos medicamentos se administran a un paciente que recibe GLUCOVANCE 400 mg, se debe observar de cerca al paciente por si pierde el control de la glucosa en sangre. Cuando dichos medicamentos se retiran de un paciente que recibe GLUCOVANCE, el paciente debe ser observado de cerca por hipoglucemia. La metformina se une de manera insignificante a las proteínas plasmáticas y, por lo tanto, es menos probable que interactúe con fármacos altamente ligados a proteínas, como salicilatos, sulfonamidas, cloranfenicol y probenecid, en comparación con las sulfonilureas, que se unen extensamente a las proteínas séricas.
Gliburida
La acción hipoglucemiante de las sulfonilureas puede verse potenciada por ciertos fármacos, incluidos los agentes antiinflamatorios no esteroideos y otros fármacos que se unen en gran medida a proteínas, salicilatos, sulfonamidas, cloranfenicol, probenecid, cumarinas, inhibidores de la monoaminooxidasa y bloqueadores beta-adrenérgicos. Cuando dichos medicamentos se administran a un paciente que recibe GLUCOVANCE, se debe observar de cerca al paciente para detectar hipoglucemia. Cuando dichos medicamentos se retiran de un paciente que recibe GLUCOVANCE 2,50 mg, se debe observar de cerca al paciente por si pierde el control de la glucosa en sangre.
Se observó un mayor riesgo de elevación de las enzimas hepáticas en pacientes que recibieron gliburida de forma concomitante con bosentán. Por lo tanto, está contraindicada la administración concomitante de GLUCOVANCE y bosentan.
Se ha informado una posible interacción entre la gliburida y la ciprofloxacina, un antibiótico de fluoroquinolona, que da como resultado una potenciación de la acción hipoglucemiante de la gliburida. El mecanismo de esta interacción no se conoce.
Se ha informado una interacción potencial entre el miconazol oral y los agentes hipoglucemiantes orales que conduce a una hipoglucemia grave. No se sabe si esta interacción también ocurre con las preparaciones intravenosas, tópicas o vaginales de miconazol.
Colesevelam: la administración concomitante de colesevelam y gliburida resultó en reducciones en el AUC y Cmax de gliburida de 32% y 47%, respectivamente. Las reducciones en el AUC y la Cmax de la gliburida fueron del 20 % y el 15 %, respectivamente, cuando se administró 1 hora antes, y no cambiaron significativamente (-7 % y 4 %, respectivamente) cuando se administró 4 horas antes del colesevelam.
Clorhidrato de metformina
furosemida
Un estudio de interacción farmacológica de metformina-furosemida de dosis única en sujetos sanos demostró que los parámetros farmacocinéticos de ambos compuestos se vieron afectados por la administración conjunta. La furosemida aumentó la Cmáx de metformina en plasma y sangre en un 22 % y el AUC en sangre en un 15 %, sin cambios significativos en el aclaramiento renal de metformina. Cuando se administró con metformina, la Cmax y el AUC de furosemida fueron un 31 % y un 12 % menores, respectivamente, que cuando se administró sola, y la vida media terminal se redujo en un 32 %, sin cambios significativos en el aclaramiento renal de furosemida. No hay información disponible sobre la interacción de metformina y furosemida cuando se coadministran de forma crónica.
nifedipina
Un estudio de interacción farmacológica de metformina-nifedipina de dosis única en voluntarios sanos normales demostró que la coadministración de nifedipina aumentó la Cmax y el AUC de metformina en plasma en un 20 % y un 9 %, respectivamente, y aumentó la cantidad excretada en la orina. Tmax y la vida media no se vieron afectados. La nifedipina parece mejorar la absorción de la metformina. La metformina tuvo efectos mínimos sobre la nifedipina.
Drogas catiónicas
Los fármacos catiónicos (p. ej., amilorida, digoxina, morfina, procainamida, quinidina, quinina, ranitidina, triamtereno, trimetoprim o vancomicina) que se eliminan por secreción tubular renal teóricamente tienen el potencial de interactuar con la metformina al competir por los sistemas de transporte tubular renal comunes. Dicha interacción entre la metformina y la cimetidina oral se ha observado en voluntarios sanos normales en estudios de interacción farmacológica de metformina-cimetidina de dosis única y múltiple, con un aumento del 60 % en las concentraciones máximas de metformina en plasma y en sangre total y un aumento del 40 % en las concentraciones plasmáticas. y AUC de metformina en sangre entera. No hubo cambios en la vida media de eliminación en el estudio de dosis única. La metformina no tuvo efecto sobre la farmacocinética de la cimetidina. Aunque tales interacciones siguen siendo teóricas (excepto para la cimetidina), se recomienda un control cuidadoso del paciente y el ajuste de la dosis de GLUCOVANCE y/o el fármaco que interfiere en pacientes que toman medicamentos catiónicos que se excretan a través del sistema secretor tubular renal proximal.
Otro
En voluntarios sanos, la farmacocinética de metformina y propranolol y metformina e ibuprofeno no se vio afectada cuando se administraron conjuntamente en estudios de interacción de dosis única.
ADVERTENCIAS
Clorhidrato de metformina
Acidosis láctica
La acidosis láctica es una complicación metabólica rara, pero grave, que puede ocurrir debido a la acumulación de metformina durante el tratamiento con GLUCOVANCE (Glyburide and Metformin HCl) Tablets; cuando ocurre, es fatal en aproximadamente el 50% de los casos. La acidosis láctica también puede ocurrir en asociación con una serie de condiciones fisiopatológicas, incluida la diabetes mellitus, y siempre que haya hipoperfusión tisular e hipoxemia significativas. La acidosis láctica se caracteriza por niveles elevados de lactato en sangre (> 5 mmol/L), disminución del pH sanguíneo, alteraciones electrolíticas con un anión gap aumentado y una relación lactato/piruvato aumentada. Cuando la metformina está implicada como la causa de la acidosis láctica, generalmente se encuentran niveles plasmáticos de metformina > 5 μg/mL.
La incidencia notificada de acidosis láctica en pacientes que reciben clorhidrato de metformina es muy baja (aproximadamente 0,03 casos/1000 pacientes-año, con aproximadamente 0,015 casos mortales/1000 pacientes-año). En más de 20 000 años-paciente de exposición a metformina en ensayos clínicos, no hubo informes de acidosis láctica. Los casos informados ocurrieron principalmente en pacientes diabéticos con insuficiencia renal significativa, incluida la enfermedad renal intrínseca y la hipoperfusión renal, a menudo en el contexto de múltiples problemas médicos/quirúrgicos concomitantes y múltiples medicamentos concomitantes. Los pacientes con insuficiencia cardíaca congestiva que requieren tratamiento farmacológico, en particular aquellos con insuficiencia cardíaca congestiva aguda o inestable que tienen riesgo de hipoperfusión e hipoxemia, tienen un mayor riesgo de acidosis láctica. El riesgo de acidosis láctica aumenta con el grado de disfunción renal y la edad del paciente. Por lo tanto, el riesgo de acidosis láctica puede disminuir significativamente mediante el control regular de la función renal en pacientes que toman metformina y mediante el uso de la dosis mínima eficaz de metformina. En particular, el tratamiento de los ancianos debe ir acompañado de un control cuidadoso de la función renal. El tratamiento con GLUCOVANCE 2,50 mg no debe iniciarse en pacientes ≥ 80 años de edad a menos que la medición del aclaramiento de creatinina demuestre que la función renal no está reducida, ya que estos pacientes son más susceptibles de desarrollar acidosis láctica. Además, GLUCOVANCE debe suspenderse de inmediato en presencia de cualquier condición asociada con hipoxemia, deshidratación o sepsis. Debido a que el deterioro de la función hepática puede limitar significativamente la capacidad de eliminar el lactato, por lo general se debe evitar el uso de GLUCOVANCE en pacientes con evidencia clínica o de laboratorio de enfermedad hepática. Se debe advertir a los pacientes sobre el consumo excesivo de alcohol, ya sea agudo o crónico, cuando toman GLUCOVANCE 2,50 mg, ya que el alcohol potencia los efectos del clorhidrato de metformina sobre el metabolismo del lactato. Además, GLUCOVANCE 5 mg debe suspenderse temporalmente antes de cualquier estudio de radiocontraste intravascular y para cualquier procedimiento quirúrgico (ver también PRECAUCIONES).
El inicio de la acidosis láctica a menudo es sutil y se acompaña solo de síntomas inespecíficos como malestar general, mialgias, dificultad respiratoria, aumento de la somnolencia y malestar abdominal inespecífico. Puede haber hipotermia, hipotensión y bradiarritmias resistentes asociadas con acidosis más marcada. El paciente y el médico del paciente deben ser conscientes de la posible importancia de tales síntomas y se debe instruir al paciente para que notifique al médico inmediatamente si ocurren (ver también PRECAUCIONES). GLUCOVANCE 500 mg debe retirarse hasta que se aclare la situación. Los electrolitos séricos, las cetonas, la glucosa en sangre y, si está indicado, el pH en sangre, los niveles de lactato e incluso los niveles de metformina en sangre pueden ser útiles. Una vez que un paciente se estabiliza con cualquier nivel de dosis de GLUCOVANCE, es poco probable que los síntomas gastrointestinales, que son comunes durante el inicio de la terapia con metformina, estén relacionados con el medicamento. La aparición posterior de síntomas gastrointestinales podría deberse a acidosis láctica u otra enfermedad grave.
Los niveles de lactato en plasma venoso en ayunas por encima del límite superior de lo normal pero por debajo de 5 mmol/L en pacientes que toman GLUCOVANCE no necesariamente indican acidosis láctica inminente y pueden explicarse por otros mecanismos, como diabetes u obesidad mal controlada, actividad física vigorosa, o problemas técnicos en el manejo de muestras. (Ver también PRECAUCIONES.)
Debe sospecharse acidosis láctica en cualquier paciente diabético con acidosis metabólica sin evidencia de cetoacidosis (cetonuria y cetonemia).
La acidosis láctica es una emergencia médica que debe tratarse en un entorno hospitalario. En un paciente con acidosis láctica que esté tomando GLUCOVANCE 500 mg, se debe suspender el fármaco de inmediato y se deben instituir medidas generales de apoyo de inmediato. Debido a que el clorhidrato de metformina es dializable (con un aclaramiento de hasta 170 ml/min en buenas condiciones hemodinámicas), se recomienda hemodiálisis inmediata para corregir la acidosis y eliminar la metformina acumulada. Tal manejo a menudo da como resultado una pronta reversión de los síntomas y la recuperación. (Ver también CONTRAINDICACIONES y PRECAUCIONES.)
ADVERTENCIA ESPECIAL SOBRE EL AUMENTO DEL RIESGO DE MORTALIDAD CARDIOVASCULAR
Se ha informado que la administración de hipoglucemiantes orales se asocia con una mayor mortalidad cardiovascular en comparación con el tratamiento con dieta sola o dieta más insulina. Esta advertencia se basa en el estudio realizado por el Programa de Diabetes del Grupo Universitario (UGDP), un ensayo clínico prospectivo a largo plazo diseñado para evaluar la eficacia de los medicamentos hipoglucemiantes para prevenir o retrasar las complicaciones vasculares en pacientes con diabetes no insulinodependiente. El estudio involucró a 823 pacientes que fueron asignados aleatoriamente a 1 de 4 grupos de tratamiento (Diabetes 19 (Suppl. 2):747-830, 1970).
UGDP informó que los pacientes tratados durante 5 a 8 años con dieta más una dosis fija de tolbutamida (1,5 g por día) tenían una tasa de mortalidad cardiovascular aproximadamente 2½ veces mayor que la de los pacientes tratados con dieta sola. No se observó un aumento significativo de la mortalidad total, pero se suspendió el uso de tolbutamida en función del aumento de la mortalidad cardiovascular, lo que limita la oportunidad de que el estudio muestre un aumento de la mortalidad general. A pesar de la controversia con respecto a la interpretación de estos resultados, los hallazgos del estudio UGDP brindan una base adecuada para esta advertencia. El paciente debe ser informado de los riesgos y beneficios potenciales de la gliburida y de los modos alternativos de terapia.
Aunque en este estudio solo se incluyó un fármaco de la clase de las sulfonilureas (tolbutamida), es prudente desde el punto de vista de la seguridad considerar que esta advertencia también puede aplicarse a otros fármacos hipoglucemiantes de esta clase, en vista de sus similitudes en el modo de acción. y estructura química.
PRECAUCIONES
General
Resultados macrovasculares
No se han realizado estudios clínicos que establezcan evidencia concluyente de reducción del riesgo macrovascular con GLUCOVANCE 5 mg o cualquier otro fármaco antidiabético.
GLUCOVANCE
Hipoglucemia
GLUCOVANCE 400 mg es capaz de producir hipoglucemia o síntomas de hipoglucemia, por lo tanto, la selección adecuada del paciente, la dosificación y las instrucciones son importantes para evitar posibles episodios de hipoglucemia. El riesgo de hipoglucemia aumenta cuando la ingesta calórica es deficiente, cuando el ejercicio extenuante no se compensa con suplementos calóricos o durante el uso concomitante con otros agentes hipoglucemiantes o etanol. La insuficiencia renal o hepática puede causar niveles elevados de glibenclamida y clorhidrato de metformina, y la insuficiencia hepática también puede disminuir la capacidad gluconeogénica, lo que aumenta el riesgo de reacciones hipoglucémicas. Los pacientes ancianos, debilitados o desnutridos y aquellos con insuficiencia suprarrenal o pituitaria o intoxicación por alcohol son particularmente susceptibles a los efectos hipoglucemiantes. La hipoglucemia puede ser difícil de reconocer en los ancianos y en las personas que toman medicamentos bloqueadores beta-adrenérgicos.
Gliburida
Anemia hemolítica
El tratamiento de pacientes con deficiencia de glucosa-6-fosfato deshidrogenasa (G6PD) con agentes de sulfonilurea puede provocar anemia hemolítica. Debido a que GLUCOVANCE 400 mg pertenece a la clase de agentes de sulfonilurea, se debe tener precaución en pacientes con deficiencia de G6PD y se debe considerar una alternativa sin sulfonilurea. En informes posteriores a la comercialización, también se informó anemia hemolítica en pacientes que no tenían deficiencia conocida de G6PD.
Clorhidrato de metformina
Monitoreo de la Función Renal
Se sabe que la metformina se excreta sustancialmente por vía renal, y el riesgo de acumulación de metformina y acidosis láctica aumenta con el grado de deterioro de la función renal. Por lo tanto, los pacientes con niveles de creatinina sérica por encima del límite superior normal para su edad no deben recibir GLUCOVANCE. En pacientes de edad avanzada, se debe titular cuidadosamente GLUCOVANCE 400 mg para establecer la dosis mínima para lograr un efecto glucémico adecuado, ya que el envejecimiento se asocia con una función renal reducida. En pacientes de edad avanzada, particularmente aquellos ≥ 80 años de edad, la función renal debe controlarse periódicamente y, en general, GLUCOVANCE 2,50 mg no debe ajustarse a la dosis máxima (ver ADVERTENCIAS y DOSIFICACIÓN Y ADMINISTRACIÓN ). Antes de iniciar el tratamiento con GLUCOVANCE 2,50 mg y al menos una vez al año a partir de entonces, se debe evaluar y verificar que la función renal sea normal. En pacientes en los que se anticipa el desarrollo de disfunción renal, se debe evaluar la función renal con más frecuencia y suspender GLUCOVANCE si hay evidencia de insuficiencia renal.
Uso de medicamentos concomitantes que pueden afectar la función renal o la disposición de metformina
Medicamentos concomitantes que pueden afectar la función renal o resultar en cambios hemodinámicos significativos o pueden interferir con la eliminación de metformina, tales como fármacos catiónicos que se eliminan por secreción tubular renal (ver INTERACCIONES CON LA DROGAS ), debe utilizarse con precaución.
Estudios radiológicos que implican el uso de materiales de contraste yodados intravasculares (por ejemplo, urografía intravenosa, colangiografía intravenosa, angiografía y tomografías computarizadas (TC) con materiales de contraste intravascular)
Los estudios de contraste intravascular con materiales yodados pueden provocar una alteración aguda de la función renal y se han asociado con acidosis láctica en pacientes que reciben metformina (ver CONTRAINDICACIONES ). Por lo tanto, en pacientes en los que se planifique algún estudio de este tipo, GLUCOVANCE 400 mg debe suspenderse temporalmente en el momento del procedimiento o antes, y suspenderse durante las 48 horas posteriores al procedimiento y reinstituirse solo después de que se haya reevaluado la función renal y se haya determinado que está normal. normal.
Estados hipóxicos
El colapso cardiovascular (choque) por cualquier causa, la insuficiencia cardíaca congestiva aguda, el infarto agudo de miocardio y otras afecciones caracterizadas por hipoxemia se han asociado con acidosis láctica y también pueden causar hiperazoemia prerrenal. Cuando tales eventos ocurren en pacientes que reciben tratamiento con GLUCOVANCE 2.50 mg, el medicamento debe suspenderse de inmediato.
Procedimientos quirúrgicos
La terapia con GLUCOVANCE 400 mg debe suspenderse temporalmente para cualquier procedimiento quirúrgico (excepto procedimientos menores no asociados con la ingesta restringida de alimentos y líquidos) y no debe reiniciarse hasta que se haya reanudado la ingesta oral del paciente y se haya evaluado la función renal como normal.
Consumo de alcohol
Se sabe que el alcohol potencia el efecto de la metformina sobre el metabolismo del lactato. Por lo tanto, se debe advertir a los pacientes sobre el consumo excesivo de alcohol, agudo o crónico, mientras reciben GLUCOVANCE. Debido a su efecto sobre la capacidad gluconeogénica del hígado, el alcohol también puede aumentar el riesgo de hipoglucemia.
Función hepática deteriorada
Dado que el deterioro de la función hepática se ha asociado con algunos casos de acidosis láctica, GLUCOVANCE 500 mg generalmente debe evitarse en pacientes con evidencia clínica o de laboratorio de enfermedad hepática.
Niveles de vitamina B12
En ensayos clínicos controlados con metformina de 29 semanas de duración, se observó una disminución a niveles subnormales de vitamina B12 sérica previamente normales, sin manifestaciones clínicas, en aproximadamente el 7% de los pacientes. Tal disminución, posiblemente debido a la interferencia con la absorción de B12 del complejo B12-factor intrínseco, sin embargo, muy rara vez se asocia con anemia y parece ser rápidamente reversible con la interrupción de la metformina o la suplementación con vitamina B. Se recomienda la medición de los parámetros hematológicos anualmente en pacientes que toman metformina y cualquier anormalidad aparente debe investigarse y manejarse adecuadamente (ver PRECAUCIONES : Pruebas de laboratorio ).
Ciertas personas (aquellas con una ingesta o absorción inadecuada de vitamina B12 o calcio) parecen estar predispuestas a desarrollar niveles de vitamina B12 por debajo de lo normal. En estos pacientes, las mediciones de rutina de vitamina B12 en suero a intervalos de 2 a 3 años pueden ser útiles.
Cambio en el estado clínico de pacientes con diabetes tipo 2 previamente controlada
Un paciente con diabetes tipo 2 previamente bien controlado con metformina que desarrolla anormalidades de laboratorio o enfermedad clínica (especialmente enfermedad vaga y mal definida) debe ser evaluado de inmediato en busca de evidencia de cetoacidosis o acidosis láctica. La evaluación debe incluir electrolitos y cetonas séricos, glucosa en sangre y, si está indicado, niveles de pH, lactato, piruvato y metformina en sangre. Si se produce acidosis de cualquiera de las formas, se debe suspender GLUCOVANCE de inmediato y se deben iniciar otras medidas correctivas apropiadas (ver también ADVERTENCIAS ).
Adición de tiazolidinedionas a la terapia con GLUCOVANCE 500 mg
Hipoglucemia
Los pacientes que reciben GLUCOVANCE 2,50 mg en combinación con una tiazolidinediona pueden tener riesgo de hipoglucemia.
Aumento de peso
Se observó un aumento de peso con la adición de rosiglitazona a GLUCOVANCE 5 mg, similar al informado para la terapia con tiazolidinediona sola.
Efectos hepáticos
Cuando se usa una tiazolidinediona en combinación con GLUCOVANCE 2.50 mg, se debe realizar un control periódico de las pruebas de función hepática de acuerdo con las recomendaciones de la etiqueta para la tiazolidinediona.
Información para pacientes
GLUCOVANCE
Se debe informar a los pacientes sobre los posibles riesgos y beneficios de GLUCOVANCE 500 mg y modos alternativos de terapia. También se les debe informar sobre la importancia del cumplimiento de las instrucciones dietéticas; un programa regular de ejercicios; y análisis regulares de glucosa en sangre, hemoglobina glicosilada, función renal y parámetros hematológicos.
Se deben explicar a los pacientes los riesgos de acidosis láctica asociados con el tratamiento con metformina, sus síntomas y las condiciones que predisponen a su desarrollo, como se indica en las secciones ADVERTENCIAS y PRECAUCIONES. Se debe advertir a los pacientes que descontinúen GLUCOVANCE de inmediato y notifiquen de inmediato a su médico si se presentan hiperventilación inexplicable, mialgia, malestar, somnolencia inusual u otros síntomas inespecíficos. Una vez que un paciente se estabiliza con cualquier nivel de dosis de GLUCOVANCE, es poco probable que los síntomas gastrointestinales, que son comunes durante el inicio de la terapia con metformina, estén relacionados con el medicamento. La aparición posterior de síntomas gastrointestinales podría deberse a acidosis láctica u otra enfermedad grave.
Se deben explicar a los pacientes y familiares responsables los riesgos de la hipoglucemia, sus síntomas y tratamiento, y las condiciones que predisponen a su desarrollo.
Se debe advertir a los pacientes sobre el consumo excesivo de alcohol, ya sea agudo o crónico, mientras reciben GLUCOVANCE. (Ver INFORMACIÓN DEL PACIENTE impresa abajo.)
Pruebas de laboratorio
Se deben realizar mediciones periódicas de glucosa en sangre en ayunas (FBG) y HbA1c para controlar la respuesta terapéutica.
Debe realizarse un control inicial y periódico de los parámetros hematológicos (p. ej., hemoglobina/hematocrito e índices de glóbulos rojos) y de la función renal (creatinina sérica), al menos una vez al año. Si bien rara vez se ha observado anemia megaloblástica con la terapia con metformina, si se sospecha esto, se debe descartar la deficiencia de vitamina B12.
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
No se han realizado estudios en animales con los productos combinados de GLUCOVANCE. Los siguientes datos se basan en los resultados de los estudios realizados con los productos individuales.
Gliburida
Los estudios en ratas con gliburida sola en dosis de hasta 300 mg/kg/día (aproximadamente 145 veces la dosis diaria máxima recomendada en humanos [MRHD] de 20 mg para el componente de gliburida de 5 mg de GLUCOVANCE según las comparaciones del área de superficie corporal) durante 18 meses revelaron sin efectos cancerígenos. En un estudio de oncogenicidad de 2 años de gliburida en ratones, no hubo evidencia de tumores relacionados con el tratamiento.
No hubo evidencia de potencial mutagénico de la gliburida sola en las siguientes pruebas in vitro: prueba de microsomas de Salmonella (prueba de Ames) y en el ensayo de elución alcalina/daños en el ADN.
Clorhidrato de metformina
Se realizaron estudios de carcinogenicidad a largo plazo con metformina sola en ratas (duración de la dosis de 104 semanas) y ratones (duración de la dosis de 91 semanas) en dosis de hasta 900 mg/kg/día y 1500 mg/kg/día, respectivamente. Ambas dosis son aproximadamente 4 veces la dosis MRHD de 2000 mg del componente de metformina de GLUCOVANCE 400 mg según las comparaciones del área de superficie corporal. No se encontró evidencia de carcinogenicidad con metformina sola en ratones machos o hembras. De manera similar, no se observó potencial tumorigénico con metformina sola en ratas macho. Sin embargo, hubo una mayor incidencia de pólipos uterinos estromales benignos en ratas hembra tratadas con 900 mg/kg/día de metformina sola.
No hubo evidencia de un potencial mutagénico de la metformina sola en las siguientes pruebas in vitro: prueba de Ames (S. typhimurium), prueba de mutación genética (células de linfoma de ratón) o prueba de aberraciones cromosómicas (linfocitos humanos). Los resultados de la prueba de micronúcleos de ratón in vivo también fueron negativos.
La fertilidad de ratas macho o hembra no se vio afectada por la metformina sola cuando se administró en dosis de hasta 600 mg/kg/día, que es aproximadamente 3 veces la dosis MRHD del componente de metformina de GLUCOVANCE 400 mg según las comparaciones del área de superficie corporal.
El embarazo
Efectos teratogénicos
Embarazo Categoría B
La información reciente sugiere fuertemente que los niveles anormales de glucosa en sangre durante el embarazo están asociados con una mayor incidencia de anomalías congénitas. La mayoría de los expertos recomiendan que se use insulina durante el embarazo para mantener la glucosa en sangre lo más cerca posible de lo normal. Debido a que los estudios de reproducción en animales no siempre predicen la respuesta humana, GLUCOVANCE 400 mg no debe usarse durante el embarazo a menos que sea claramente necesario. (Vea abajo.)

No existen estudios adecuados y bien controlados en mujeres embarazadas con GLUCOVANCE o sus componentes individuales. No se han realizado estudios en animales con los productos combinados de GLUCOVANCE. Los siguientes datos se basan en los resultados de los estudios realizados con los productos individuales.
Gliburida
Se realizaron estudios de reproducción en ratas y conejos a dosis de hasta 500 veces la dosis máxima recomendada de 20 mg del componente gliburida de GLUCOVANCE 500 mg en base a comparaciones del área de superficie corporal y no revelaron evidencia de alteración de la fertilidad o daño al feto debido a la gliburida.
Clorhidrato de metformina
La metformina sola no fue teratogénica en ratas o conejos en dosis de hasta 600 mg/kg/día. Esto representa una exposición de aproximadamente 2 y 6 veces la dosis MRHD de 2000 mg del componente de metformina de GLUCOVANCE 500 mg según las comparaciones del área de superficie corporal para ratas y conejos, respectivamente. La determinación de las concentraciones fetales demostró una barrera placentaria parcial a la metformina.
Efectos no teratogénicos
Se ha informado hipoglucemia severa prolongada (4 a 10 días) en recién nacidos de madres que estaban recibiendo una sulfonilurea en el momento del parto. Esto se ha informado con mayor frecuencia con el uso de agentes con vidas medias prolongadas. No se recomienda el uso de GLUCOVANCE 400 mg durante el embarazo. Sin embargo, si se usa, GLUCOVANCE debe suspenderse al menos 2 semanas antes de la fecha prevista de parto. (Ver El embarazo : Efectos teratogénicos : Embarazo Categoría B .)
Madres lactantes
Aunque no se sabe si la gliburida se excreta en la leche humana, se sabe que algunas sulfonilureas se excretan en la leche humana. Los estudios en ratas lactantes muestran que la metformina se excreta en la leche y alcanza niveles comparables a los del plasma. No se han realizado estudios similares en madres lactantes. Debido a que puede existir el potencial de hipoglucemia en los lactantes, se debe tomar la decisión de interrumpir la lactancia o suspender GLUCOVANCE, teniendo en cuenta la importancia del fármaco para la madre. Si se suspende GLUCOVANCE y si la dieta por sí sola no es adecuada para controlar la glucosa en sangre, se debe considerar la terapia con insulina.
Uso pediátrico
La seguridad y la eficacia de GLUCOVANCE 500 mg se evaluaron en un ensayo aleatorizado de 26 semanas doble ciego con control activo que involucró a un total de 167 pacientes pediátricos (entre 9 y 16 años de edad) con diabetes tipo 2. No se demostró estadísticamente que GLUCOVANCE 500 mg fuera superior a la metformina o la gliburida con respecto a la reducción de la HbA1c desde el inicio (consulte la Tabla 5). No se asociaron resultados de seguridad inesperados con GLUCOVANCE 2.50 mg en este ensayo.
Uso geriátrico
De los 642 pacientes que recibieron GLUCOVANCE en estudios clínicos doble ciego, el 23,8 % tenía 65 años o más, mientras que el 2,8 % tenía 75 años o más. De los 1302 pacientes que recibieron GLUCOVANCE 500 mg en estudios clínicos abiertos, el 20,7 % tenía 65 años o más, mientras que el 2,5 % tenía 75 años o más. No se observaron diferencias generales en la eficacia o la seguridad entre estos pacientes y los pacientes más jóvenes, y otra experiencia clínica notificada no ha identificado diferencias en la respuesta entre los pacientes de edad avanzada y los más jóvenes, pero no se puede descartar una mayor sensibilidad de algunas personas mayores.
Se sabe que el clorhidrato de metformina se excreta sustancialmente por vía renal y debido a que el riesgo de reacciones adversas graves al medicamento es mayor en pacientes con función renal alterada, GLUCOVANCE 500 mg solo debe usarse en pacientes con función renal normal (ver CONTRAINDICACIONES , ADVERTENCIAS , y FARMACOLOGÍA CLÍNICA : Farmacocinética ). Debido a que el envejecimiento se asocia con una función renal reducida, GLUCOVANCE 5 mg debe usarse con precaución a medida que aumenta la edad. Se debe tener cuidado en la selección de la dosis y debe basarse en un control cuidadoso y regular de la función renal. En general, los pacientes de edad avanzada no deben ajustarse a la dosis máxima de GLUCOVANCE (ver también ADVERTENCIAS y DOSIFICACIÓN Y ADMINISTRACIÓN ).
SOBREDOSIS
Gliburida
La sobredosis de sulfonilureas, incluidas las tabletas de gliburida, puede producir hipoglucemia. Los síntomas hipoglucémicos leves, sin pérdida de conciencia ni hallazgos neurológicos, deben tratarse de forma agresiva con glucosa oral y ajustes en la dosis del fármaco y/o patrones de comidas. La vigilancia estrecha debe continuar hasta que el médico esté seguro de que el paciente está fuera de peligro. Las reacciones hipoglucémicas graves con coma, convulsiones u otro deterioro neurológico ocurren con poca frecuencia, pero constituyen emergencias médicas que requieren hospitalización inmediata. Si se diagnostica o sospecha un coma hipoglucémico, se debe administrar al paciente una inyección intravenosa rápida de solución de glucosa concentrada (50%). Esto debe ir seguido de una infusión continua de una solución de glucosa más diluida (10 %) a una velocidad que mantenga el nivel de glucosa en sangre por encima de 100 mg/dl. Se debe monitorear de cerca a los pacientes durante un mínimo de 24 a 48 horas, ya que la hipoglucemia puede reaparecer después de una aparente recuperación clínica.
Clorhidrato de metformina
Se ha producido una sobredosis de clorhidrato de metformina, incluida la ingestión de cantidades > 50 g. Se notificó hipoglucemia en aproximadamente el 10 % de los casos, pero no se ha establecido una asociación causal con el clorhidrato de metformina. Se ha notificado acidosis láctica en aproximadamente el 32 % de los casos de sobredosis de metformina (ver ADVERTENCIAS ). La metformina es dializable con un aclaramiento de hasta 170 ml/min en buenas condiciones hemodinámicas. Por lo tanto, la hemodiálisis puede ser útil para eliminar el fármaco acumulado en pacientes en quienes se sospecha una sobredosis de metformina.
CONTRAINDICACIONES
GLUCOVANCE 2,50 mg está contraindicado en pacientes con:
GLUCOVANCE 500 mg debe suspenderse temporalmente en pacientes sometidos a estudios radiológicos que involucren la administración intravascular de materiales de contraste yodados, porque el uso de dichos productos puede provocar una alteración aguda de la función renal. (Ver también PRECAUCIONES .)
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
GLUCOVANCE combina gliburida y clorhidrato de metformina, 2 agentes antihiperglucemiantes con mecanismos de acción complementarios, para mejorar el control glucémico en pacientes con diabetes tipo 2.
La gliburida parece reducir la glucosa en sangre de forma aguda al estimular la liberación de insulina del páncreas, un efecto que depende del funcionamiento de las células beta en los islotes pancreáticos. No se ha establecido claramente el mecanismo por el cual la gliburida reduce la glucosa en sangre durante la administración a largo plazo. Con la administración crónica en pacientes con diabetes tipo 2, el efecto hipoglucemiante persiste a pesar de una disminución gradual de la respuesta secretora de insulina al fármaco. Los efectos extrapancreáticos pueden estar involucrados en el mecanismo de acción de las sulfonilureas orales hipoglucemiantes.
El clorhidrato de metformina es un agente antihiperglucemiante que mejora la tolerancia a la glucosa en pacientes con diabetes tipo 2, reduciendo la glucosa plasmática tanto basal como posprandial. El clorhidrato de metformina disminuye la producción de glucosa hepática, disminuye la absorción intestinal de glucosa y mejora la sensibilidad a la insulina al aumentar la captación y utilización de glucosa periférica.
Farmacocinética
Absorción y biodisponibilidad
GLUCOVANCE
En estudios de biodisponibilidad de GLUCOVANCE 2.5 mg/500 mg y 5 mg/500 mg, el área media bajo la curva de concentración plasmática versus tiempo (AUC) para el componente de gliburida fue 18 % y 7 %, respectivamente, mayor que la de Micronase® marca de gliburida coadministrada con metformina. El componente de gliburida de GLUCOVANCE, por lo tanto, no es bioequivalente a Micronase®. El componente de metformina de GLUCOVANCE 400 mg es bioequivalente a la metformina coadministrada con gliburida.
Después de la administración de un solo comprimido de GLUCOVANCE 5 mg/500 mg con una solución de glucosa al 20 % o una solución de glucosa al 20 % con alimentos, no hubo ningún efecto de los alimentos en la Cmáx y un efecto relativamente pequeño de los alimentos en el AUC de la gliburida. componente. El Tmax para el componente de gliburida se redujo de 7,5 horas a 2,75 horas con alimentos en comparación con la misma concentración de tableta administrada en ayunas con una solución de glucosa al 20 %. Se desconoce la importancia clínica de un Tmax más temprano para la gliburida después de la comida. El efecto de los alimentos sobre la farmacocinética del componente metformina fue indeterminado.
Gliburida
Los estudios de dosis única con tabletas de Micronase® en sujetos normales demuestran una absorción significativa de gliburida en 1 hora, niveles máximos del fármaco a las 4 horas y niveles bajos pero detectables a las 24 horas. Los niveles séricos medios de gliburida, como se refleja en las áreas bajo la curva de concentración sérica-tiempo, aumentan en proporción a los aumentos correspondientes en la dosis. No se ha establecido la bioequivalencia entre GLUCOVANCE 500 mg y productos de gliburida de un solo ingrediente.
Clorhidrato de metformina
La biodisponibilidad absoluta de una tableta de clorhidrato de metformina de 500 mg administrada en ayunas es de aproximadamente 50% a 60%. Los estudios que utilizan dosis orales únicas de comprimidos de metformina de 500 mg y 1500 mg, y de 850 mg a 2550 mg, indican que existe una falta de proporcionalidad de la dosis con dosis crecientes, lo que se debe a una absorción disminuida más que a una alteración en la eliminación. Los alimentos disminuyen la extensión y retrasan ligeramente la absorción de metformina, como lo demuestra una concentración máxima aproximadamente un 40 % más baja y un AUC 25 % más bajo en plasma y una prolongación de 35 minutos del tiempo hasta la concentración plasmática máxima después de la administración de una dosis única de 850 mg. tableta de metformina con comida, en comparación con la misma concentración de tableta administrada en ayunas. Se desconoce la relevancia clínica de estas disminuciones.
Distribución
Gliburida
Las sulfonilureas se unen ampliamente a las proteínas séricas. El desplazamiento de los sitios de unión a proteínas por parte de otros fármacos puede conducir a una mayor acción hipoglucemiante. In vitro, la unión a proteínas que exhibe la gliburida es predominantemente no iónica, mientras que la de otras sulfonilureas (clorpropamida, tolbutamida, tolazamida) es predominantemente iónica. Los fármacos ácidos, como la fenilbutazona, la warfarina y los salicilatos, desplazan a las sulfonilureas de unión iónica de las proteínas séricas en una medida mucho mayor que la gliburida de unión no iónica. No se ha demostrado que esta diferencia en la unión a proteínas resulte en menos interacciones farmacológicas con las tabletas de gliburida en el uso clínico.
Clorhidrato de metformina
El volumen aparente de distribución (V/F) de metformina luego de dosis orales únicas de 850 mg promedió 654±358 L. La metformina se une insignificantemente a las proteínas plasmáticas. La metformina se divide en eritrocitos, probablemente en función del tiempo. A las dosis clínicas habituales y los programas de dosificación de metformina, las concentraciones plasmáticas de metformina en estado estacionario se alcanzan dentro de las 24 a 48 horas y generalmente son
Metabolismo y eliminación
Gliburida
La disminución de glibenclamida en el suero de individuos sanos normales es bifásica; la vida media terminal es de aproximadamente 10 horas. El principal metabolito de la gliburida es el derivado 4-trans-hidroxi. También se produce un segundo metabolito, el derivado 3-cis-hidroxi. Es probable que estos metabolitos no contribuyan a una acción hipoglucemiante significativa en humanos, ya que solo son débilmente activos (1/400 y 1/40 como activos, respectivamente, como gliburida) en conejos. La gliburida se excreta como metabolitos en la bilis y la orina, aproximadamente el 50% por cada vía. Esta vía excretora dual es cualitativamente diferente de la de otras sulfonilureas, que se excretan principalmente en la orina.
Clorhidrato de metformina
Los estudios de dosis única intravenosa en sujetos normales demuestran que la metformina se excreta sin cambios en la orina y no sufre metabolismo hepático (no se han identificado metabolitos en humanos) ni excreción biliar. El aclaramiento renal (ver Tabla 1) es aproximadamente 3,5 veces mayor que el aclaramiento de creatinina, lo que indica que la secreción tubular es la vía principal de eliminación de metformina. Tras la administración oral, aproximadamente el 90% del fármaco absorbido se elimina por vía renal en las primeras 24 horas, con una semivida de eliminación plasmática de aproximadamente 6,2 horas. En sangre, la vida media de eliminación es de aproximadamente 17,6 horas, lo que sugiere que la masa de eritrocitos puede ser un compartimento de distribución.
Poblaciones Especiales
Pacientes con diabetes tipo 2
Los estudios de dosis múltiples con gliburida en pacientes con diabetes tipo 2 demuestran curvas de concentración-tiempo del nivel del fármaco similares a los estudios de dosis única, lo que indica que no se acumula el fármaco en los depósitos tisulares.
En presencia de una función renal normal, no hay diferencias entre la farmacocinética de metformina de dosis única o múltiple entre pacientes con diabetes tipo 2 y sujetos normales (ver Tabla 1), ni hay acumulación de metformina en ninguno de los grupos en el nivel clínico habitual. dosis
insuficiencia hepática
No se han realizado estudios farmacocinéticos en pacientes con insuficiencia hepática para gliburida o metformina.
Insuficiencia renal
No hay información disponible sobre la farmacocinética de la gliburida en pacientes con insuficiencia renal.
En pacientes con función renal disminuida (basada en la depuración de creatinina), la vida media plasmática y sanguínea de la metformina se prolonga y la depuración renal disminuye en proporción a la disminución de la depuración de creatinina (ver Tabla 1; también, ver ADVERTENCIAS ).
Geriatría
No hay información sobre la farmacocinética de la gliburida en pacientes de edad avanzada.
Los datos limitados de estudios farmacocinéticos controlados de metformina en sujetos sanos de edad avanzada sugieren que el aclaramiento plasmático total disminuye, la vida media se prolonga y la Cmax aumenta, en comparación con sujetos jóvenes sanos. A partir de estos datos, parece que el cambio en la farmacocinética de metformina con el envejecimiento se explica principalmente por un cambio en la función renal (ver Tabla 1). El tratamiento con metformina no debe iniciarse en pacientes ≥ 80 años de edad a menos que la medición del aclaramiento de creatinina demuestre que la función renal no está reducida.
Pediatría
Después de la administración de un único comprimido oral de GLUCOPHAGE® (clorhidrato de metformina) de 500 mg con alimentos, la media geométrica de Cmax y AUC de metformina difería
Después de la administración de un único comprimido oral de GLUCOVANCE con alimentos, la media geométrica normalizada de la dosis de Cmax y AUC de gliburida en pacientes pediátricos con diabetes tipo 2 (11-16 años de edad, n=28, peso corporal medio de 97 kg) difirió
Género
No hay información sobre el efecto del género en la farmacocinética de la gliburida.
Los parámetros farmacocinéticos de metformina no difirieron significativamente en sujetos con o sin diabetes tipo 2 cuando se analizaron según el género (hombres = 19, mujeres = 16). De manera similar, en estudios clínicos controlados en pacientes con diabetes tipo 2, el efecto antihiperglucémico de la metformina fue comparable en hombres y mujeres.
La raza
No hay información disponible sobre las diferencias raciales en la farmacocinética de la gliburida.
No se han realizado estudios de los parámetros farmacocinéticos de metformina según la raza. En estudios clínicos controlados de metformina en pacientes con diabetes tipo 2, el efecto antihiperglucémico fue comparable en blancos (n=249), negros (n=51) e hispanos (n=24).
Estudios clínicos
Pacientes con control glucémico inadecuado solo con dieta y ejercicio
En un ensayo clínico de 20 semanas, doble ciego, multicéntrico en los EE. UU., un total de 806 pacientes con diabetes tipo 2 sin tratamiento previo con medicamentos, cuya hiperglucemia no se controló adecuadamente solo con dieta y ejercicio (glucosa plasmática en ayunas inicial [FPG]
El tratamiento con GLUCOVANCE dio como resultado una reducción significativamente mayor de la HbA y la glucosa plasmática posprandial (PPG) en comparación con la gliburida, la metformina o el placebo. Además, la terapia con GLUCOVANCE resultó en una mayor reducción de la FPG en comparación con la gliburida, la metformina o el placebo, pero las diferencias con la gliburida y la metformina no alcanzaron significación estadística.
Los cambios en el perfil de lípidos asociados con el tratamiento con GLUCOVANCE 2.50 mg fueron similares a los observados con gliburida, metformina y placebo.
El ensayo doble ciego controlado con placebo descrito anteriormente restringió la inscripción a pacientes con HbA1c
Pacientes con control glucémico inadecuado con sulfonilurea sola
En un ensayo clínico de EE. UU., doble ciego, con control activo, de 16 semanas, un total de 639 pacientes con diabetes tipo 2 no controlada adecuadamente (HbA1c inicial promedio 9.5 %, GPA inicial promedio 213 mg/dL) mientras recibían tratamiento con al menos la mitad de la dosis máxima de una sulfonilurea (p. ej., 10 mg de gliburida, 20 mg de glipizida) se aleatorizaron para recibir gliburida (dosis fija, 20 mg), metformina (500 mg), GLUCOVANCE 2,5 mg/500 mg o GLUCOVANCE 5 mg /500mg. Las dosis de metformina y GLUCOVANCE se ajustaron a un máximo de 4 comprimidos diarios según fuera necesario para lograr una FPG
Después de 16 semanas, no hubo cambios significativos en la HbA media en los pacientes asignados al azar a la terapia con gliburida o metformina. El tratamiento con GLUCOVANCE 2,50 mg en dosis de hasta 20 mg/2000 mg por día dio como resultado una reducción significativa de HbA, FPG y PPG desde el inicio en comparación con gliburida o metformina solas.
Adición de tiazolidinedionas a la terapia con GLUCOVANCE 400 mg
En un ensayo clínico multicéntrico, doble ciego, de 24 semanas en los EE. UU., los pacientes con diabetes tipo 2 que no se controlaban adecuadamente con la terapia antihiperglucemiante oral actual (ya sea monoterapia o terapia combinada) primero cambiaron a tabletas abiertas de GLUCOVANCE 2.5 mg/500 mg y se titularon a una dosis diaria máxima de 10 mg/2000 mg. Un total de 365 pacientes controlados inadecuadamente (HbA1c > 7,0 % y ≤ 10 %) después de 10 a 12 semanas de una dosis diaria de 500 mg de GLUCOVANCE de al menos 7,5 mg/1500 mg fueron aleatorizados para recibir una terapia adicional con rosiglitazona 4 mg o placebo una vez al día. . Después de 8 semanas, la dosis de rosiglitazona se aumentó a un máximo de 8 mg diarios según fuera necesario para alcanzar una glucosa diaria media objetivo de 126 mg/dl o HbA1c
Para los pacientes que no lograron un control glucémico adecuado con GLUCOVANCE 400 mg, la adición de rosiglitazona, en comparación con el placebo, resultó en una reducción significativa de la HbA y la GPA.
INFORMACIÓN DEL PACIENTE
GLUCOVANCE® (gliburida y metformina HCl) Tabletas
ADVERTENCIA: Un pequeño número de personas que han tomado clorhidrato de metformina han desarrollado una afección grave llamada acidosis láctica. Se necesitan riñones que funcionen correctamente para ayudar a prevenir la acidosis láctica. La mayoría de las personas con problemas renales no deben tomar GLUCOVANCE. (Vea las Preguntas No. 9-13.)
Q1. ¿Por qué necesito tomar GLUCOVANCE 5 mg?
Su médico le ha recetado GLUCOVANCE 500 mg para tratar su diabetes tipo 2. Esto también se conoce como diabetes mellitus no insulinodependiente.
Q2. ¿Qué es la diabetes tipo 2?
Las personas con diabetes no pueden producir suficiente insulina y/o no responden normalmente a la insulina que produce su cuerpo. Cuando esto sucede, el azúcar (glucosa) se acumula en la sangre. Esto puede provocar problemas médicos graves, como daño renal, amputaciones y ceguera. La diabetes también está estrechamente relacionada con las enfermedades del corazón. El objetivo principal del tratamiento de la diabetes es reducir el nivel de azúcar en la sangre a un nivel normal.
Q3. ¿Por qué es importante controlar la diabetes tipo 2?
El objetivo principal del tratamiento de la diabetes es reducir el nivel de azúcar en la sangre a un nivel normal. Los estudios han demostrado que un buen control del azúcar en la sangre puede prevenir o retrasar complicaciones, como enfermedades cardíacas, renales o ceguera.
Q4. ¿Cómo se suele controlar la diabetes tipo 2?
El nivel alto de azúcar en la sangre se puede reducir con dieta y ejercicio, varios medicamentos orales e inyecciones de insulina. Antes de tomar GLUCOVANCE 2,50 mg, primero debe tratar de controlar su diabetes mediante el ejercicio y la pérdida de peso. Incluso si está tomando GLUCOVANCE, aún debe hacer ejercicio y seguir la dieta recomendada para su diabetes.
P5. ¿GLUCOVANCE 400 mg funciona de manera diferente a otros medicamentos para el control de la glucosa?
Sí, lo hace. GLUCOVANCE 400mg combina 2 fármacos hipoglucemiantes, gliburida y metformina. Estos 2 medicamentos trabajan juntos para mejorar los diferentes defectos metabólicos que se encuentran en la diabetes tipo 2. La gliburida reduce el azúcar en la sangre principalmente al hacer que se libere más insulina del cuerpo, y la metformina reduce el azúcar en la sangre, en parte, al ayudar al cuerpo a usar su propia insulina de manera más efectiva. Juntos, son eficientes para ayudarlo a lograr un mejor control de la glucosa.
P6. ¿Qué sucede si mi nivel de azúcar en la sangre sigue siendo demasiado alto?
Cuando el nivel de azúcar en sangre no puede reducirse lo suficiente con GLUCOVANCE, su médico puede recetarle insulina inyectable o tomar otras medidas para controlar su diabetes.
P7. ¿Puede GLUCOVANCE 400mg causar efectos secundarios?
GLUCOVANCE 2.50mg, como todos los medicamentos para bajar el azúcar en la sangre, puede causar efectos secundarios en algunos pacientes. La mayoría de estos efectos secundarios son menores. Sin embargo, también hay efectos secundarios graves, pero raros, relacionados con GLUCOVANCE (ver Q9-Q13).
P8. ¿Cuáles son los efectos secundarios más comunes de GLUCOVANCE 500mg?
Los efectos secundarios más comunes de GLUCOVANCE 5 mg normalmente son leves, como diarrea, náuseas y malestar estomacal. Si ocurren estos efectos secundarios, generalmente ocurren durante las primeras semanas de terapia. Tomar GLUCOVANCE con las comidas puede ayudar a reducir estos efectos secundarios.
Con menos frecuencia, pueden presentarse síntomas de hipoglucemia (bajo nivel de azúcar en la sangre), como aturdimiento, mareos, temblores o hambre. El riesgo de síntomas de hipoglucemia aumenta cuando se saltan comidas, se consume demasiado alcohol o se hace ejercicio intenso sin suficiente comida. Seguir los consejos de su médico puede ayudarle a evitar estos síntomas.
P9. ¿Hay algún efecto secundario grave que pueda causar GLUCOVANCE?
Las personas que tienen una afección conocida como deficiencia de glucosa-6-fosfato deshidrogenasa (G6PD) y que toman GLUCOVANCE pueden desarrollar anemia hemolítica (descomposición rápida de los glóbulos rojos). La deficiencia de G6PD generalmente se presenta en familias. Informe a su médico si usted o algún miembro de su familia ha sido diagnosticado con deficiencia de G6PD antes de comenzar a tomar GLUCOVANCE.
GLUCOVANCE rara vez causa efectos secundarios graves. El efecto secundario más grave que puede causar GLUCOVANCE 2.50mg se llama acidosis láctica.
P10. ¿Qué es el ácido láctico y me puede pasar?
La acidosis láctica es causada por una acumulación de ácido láctico en la sangre. La acidosis láctica asociada con la metformina es rara y ha ocurrido principalmente en personas cuyos riñones no funcionaban normalmente. Se ha informado acidosis láctica en aproximadamente 1 de cada 33 000 pacientes que toman metformina en el transcurso de un año. Aunque es raro, si ocurre acidosis láctica, puede ser fatal hasta en la mitad de los casos.
También es importante que su hígado funcione normalmente cuando toma GLUCOVANCE. Su hígado ayuda a eliminar el ácido láctico de su torrente sanguíneo.
Su médico controlará su diabetes y es posible que le realice análisis de sangre de vez en cuando para asegurarse de que sus riñones y su hígado funcionen normalmente.
No hay evidencia de que GLUCOVANCE cause daño a los riñones o al hígado.
P11. ¿Existen otros factores de riesgo para la acidosis láctica?
Su riesgo de desarrollar acidosis láctica por tomar GLUCOVANCE 400 mg es muy bajo siempre que sus riñones e hígado estén sanos. Sin embargo, algunos factores pueden aumentar su riesgo porque pueden afectar la función renal y hepática. Debe discutir su riesgo con su médico.
No debe tomar GLUCOVANCE 400 mg si:
- Tiene problemas renales o hepáticos crónicos.
- Tiene insuficiencia cardíaca congestiva que se trata con medicamentos, por ejemplo, digoxina (Lanoxin®) o furosemida (Lasix®)
- Bebe alcohol en exceso (constantemente o “atracones” breves)
- Está gravemente deshidratado (ha perdido una gran cantidad de líquidos corporales)
- Va a tener ciertos procedimientos de rayos X con agentes de contraste inyectables.
- te vas a operar
- Desarrolla una afección grave, como un ataque al corazón, una infección grave o un accidente cerebrovascular
- Tiene ≥ 80 años de edad y NO se ha realizado una prueba de función renal.
P12. ¿Cuáles son los síntomas de la acidosis láctica?
Algunos de los síntomas incluyen: sentirse muy débil, cansado o incómodo; dolor muscular inusual; dificultad para respirar; malestar estomacal inusual o inesperado; siento frio; sentirse mareado o aturdido; o desarrollar repentinamente un latido cardíaco lento o irregular.
Si nota estos síntomas, o si su condición médica ha cambiado repentinamente, deje de tomar las tabletas de GLUCOVANCE y llame a su médico de inmediato. La acidosis láctica es una emergencia médica que debe ser tratada en un hospital.
P13. ¿Qué necesita saber mi médico para disminuir mi riesgo de acidosis láctica?
Informe a su médico si tiene una enfermedad que provoca vómitos intensos, diarrea y/o fiebre, o si su ingesta de líquidos se reduce significativamente. Estas situaciones pueden conducir a una deshidratación severa y puede ser necesario dejar de tomar GLUCOVANCE 400 mg temporalmente.
Debe informar a su médico si va a someterse a alguna cirugía o procedimiento especializado de rayos X que requiera la inyección de agentes de contraste. El tratamiento con GLUCOVANCE 2,50 mg deberá suspenderse temporalmente en tales casos.
P14. ¿Puedo tomar GLUCOVANCE 500 mg con otros medicamentos?
Recuerde a su médico que está tomando GLUCOVANCE 2,50 mg cuando le receten un medicamento nuevo o cuando se haga un cambio en la forma en que toma un medicamento ya recetado. GLUCOVANCE 400 mg puede interferir con la forma en que funcionan algunos medicamentos y algunos medicamentos pueden interferir con la acción de GLUCOVANCE.
No tome GLUCOVANCE si está tomando bosentán, que se usa para la hipertensión arterial pulmonar (HAP), que es presión arterial alta en los vasos de los pulmones.
P15. ¿Qué sucede si quedo embarazada mientras tomo GLUCOVANCE 400 mg?
Informe a su médico si planea quedar embarazada o ha quedado embarazada. Al igual que con otros medicamentos orales para el control de la glucosa, no debe tomar GLUCOVANCE durante el embarazo.
Por lo general, su médico le recetará insulina mientras esté embarazada. Al igual que con todos los medicamentos, usted y su médico deben analizar el uso de 5 mg de GLUCOVANCE si está amamantando a un niño.
P16. ¿Cómo tomo GLUCOVANCE?
Su médico le indicará cuántos comprimidos de GLUCOVANCE debe tomar y con qué frecuencia. Esto también debe estar impreso en la etiqueta de su receta. Probablemente comenzará con una dosis baja de GLUCOVANCE 400 mg y la dosis se aumentará gradualmente hasta que se controle el nivel de azúcar en la sangre.
P17. ¿Dónde puedo obtener más información sobre GLUCOVANCE 400mg?
Este prospecto es un resumen de la información más importante sobre GLUCOVANCE. Si tiene alguna pregunta o problema, debe hablar con su médico u otro proveedor de atención médica sobre la diabetes tipo 2, así como sobre GLUCOVANCE y sus efectos secundarios. También hay un prospecto (prospecto) escrito para profesionales de la salud que su farmacéutico puede permitirle leer.
