Clarinex 5mg Desloratadine Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
CLARINEX® (desloratadina) tabletas
DESCRIPCIÓN
Los comprimidos de CLARINEX (desloratadina) son comprimidos recubiertos con película, redondos, de color azul claro, que contienen 5 mg de desloratadina, un antihistamínico, para administrar por vía oral. Las tabletas de 5 mg de CLARINEX también contienen los siguientes excipientes: fosfato de calcio dibásico dihidrato USP, celulosa microcristalina NF, almidón de maíz NF, talco USP, cera de carnauba NF, cera blanca NF, material de recubrimiento que consiste en lactosa monohidrato, hipromelosa, dióxido de titanio, polietilenglicol y Laca de aluminio n.º 2 azul FD&C.
CLARINEX Solución oral es un líquido transparente de color naranja que contiene 0,5 mg/1 ml de desloratadina. La solución oral contiene los siguientes ingredientes inactivos: propilenglicol USP, solución de sorbitol USP, ácido cítrico (anhidro) USP, citrato de sodio dihidrato USP, benzoato de sodio NF, edetato disódico USP, agua purificada USP. También contiene azúcar granulada, sabor natural y artificial para chicle y colorante FDC Yellow #6.
La desloratadina es un polvo de color blanco a blanquecino que es ligeramente soluble en agua, pero muy soluble en etanol y propilenglicol. Tiene una fórmula empírica: C19H19ClN2 y un peso molecular de 310,8. El nombre químico es 8-cloro-6,11-dihidro-11-(4-piperdinilideno)-5H-benzo[5,6]ciclohepta[1,2-b]piridina y tiene la siguiente estructura:
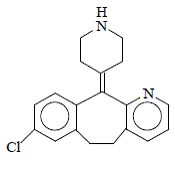
INDICACIONES
Rinitis alérgica estacional
CLARINEX® está indicado para el alivio de los síntomas nasales y no nasales de la rinitis alérgica estacional en pacientes a partir de los 2 años de edad.
Rinitis alérgica perenne
CLARINEX está indicado para el alivio de los síntomas nasales y no nasales de la rinitis alérgica perenne en pacientes a partir de los 6 meses de edad.
Urticaria idiopática crónica
CLARINEX 5 mg está indicado para el alivio sintomático del prurito, la reducción del número y tamaño de la urticaria en pacientes con urticaria idiopática crónica de 6 meses de edad en adelante.
DOSIFICACIÓN Y ADMINISTRACIÓN
Aunque una formulación de desloratadina en tabletas que se desintegran por vía oral puede estar disponible en el mercado, las tabletas CLARINEX® RediTabs® ya no se comercializan.
Las tabletas de 5 mg de CLARINEX, la solución oral o las tabletas RediTabs se pueden tomar independientemente de las comidas. Coloque las tabletas CLARINEX (desloratadina) RediTabs en la lengua y deje que se desintegren antes de tragarlas. La desintegración de la tableta ocurre rápidamente. Administrar con o sin agua. Tome el comprimido inmediatamente después de abrir el blister.
La dosis adecuada para la edad de CLARINEX Solución oral debe administrarse con un cuentagotas o una jeringa medidora disponible en el mercado que esté calibrada para administrar 2 ml y 2,5 ml (½ cucharadita).
Adultos y Adolescentes de 12 Años en Adelante
La dosis recomendada de CLARINEX Tabletas o CLARINEX RediTabs Tabletas es una tableta de 5 mg una vez al día. La dosis recomendada de CLARINEX Solución Oral es de 2 cucharaditas (5 mg en 10 mL) una vez al día.
Niños de 6 a 11 años de edad
La dosis recomendada de CLARINEX Solución Oral es de 1 cucharadita (2,5 mg en 5 mL) una vez al día. La dosis recomendada de tabletas CLARINEX RediTabs es una tableta de 2,5 mg una vez al día.
Niños de 12 meses a 5 años de edad
La dosis recomendada de CLARINEX 5 mg Solución oral es ½ cucharadita (1,25 mg en 2,5 ml) una vez al día.
Niños de 6 a 11 meses de edad
La dosis recomendada de CLARINEX Solución oral es de 2 ml (1 mg) una vez al día.
Adultos con insuficiencia hepática o renal
En pacientes adultos con insuficiencia hepática o renal, se recomienda una dosis inicial de un comprimido de 5 mg en días alternos según los datos farmacocinéticos. No se pueden hacer recomendaciones de dosificación para niños con insuficiencia hepática o renal debido a la falta de datos [ver FARMACOLOGÍA CLÍNICA ].
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Los comprimidos de CLARINEX son comprimidos recubiertos con película de color azul claro grabados con "C5" que contienen 5 mg de desloratadina. CLARINEX Solución oral es un líquido transparente de color naranja que contiene 0,5 mg de desloratadina/1 ml.
Almacenamiento y manipulación
CLARINEX 5mg Comprimidos: Comprimidos recubiertos con película de color azul claro con “C5” en relieve que se envasan en frascos de plástico de polietileno de alta densidad de 100 ( CDN 0085-1264-01).
CLARINEX 5mg Solución Oral: Líquido transparente de color naranja que contiene 0,5 mg/1 ml de desloratadina en un frasco de vidrio ámbar de 16 onzas ( CDN 0085-1334-01) y una botella de vidrio ámbar de 4 onzas ( CDN 0085-1334-02).
Almacenamiento
CLARINEX Tabletas: Proteja el empaque de la unidad de uso y el paquete hospitalario de dosis unitaria de la humedad excesiva. Almacenar a 25°C (77°F); excursiones permitidas a 15-30°C (59-86°F) [ver Temperatura ambiente controlada por USP ]. Sensible al calor. Evite la exposición a 30 °C (86 °F) o más.
Solución oral CLARINEX: Almacenar a 25°C (77°F); excursiones permitidas a 15-30°C (59-86°F) [ver Temperatura ambiente controlada por USP ]. Proteger de la luz.
Fabricado para: Merck Sharp & Dohme Corp., una subsidiaria de MERCK & CO., INC., Whitehouse Station, NJ 08889, EE. UU. Revisado: marzo de 2019
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas se analizan con mayor detalle en otras secciones de la etiqueta:
- Reacciones hipersensibles. [Ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica clínica.
Adultos Y Adolescentes
Rinitis alérgica
En ensayos controlados con placebo de dosis múltiples, 2834 pacientes de 12 años o más recibieron tabletas de CLARINEX en dosis de 2,5 mg a 20 mg al día, de los cuales 1655 pacientes recibieron la dosis diaria recomendada de 5 mg. En los pacientes que recibieron 5 mg diarios, la tasa de eventos adversos fue similar entre los pacientes tratados con CLARINEX 5 mg y los tratados con placebo. El porcentaje de pacientes que se retiraron prematuramente debido a eventos adversos fue del 2,4 % en el grupo de 5 mg de CLARINEX y del 2,6 % en el grupo de placebo. No hubo eventos adversos graves en estos ensayos en pacientes que recibieron desloratadina. Todos los eventos adversos que fueron informados por más o igual al 2 % de los pacientes que recibieron la dosis diaria recomendada de tabletas de 5 mg de CLARINEX (5 mg una vez al día), y que fueron más comunes con las tabletas de CLARINEX que con el placebo, se enumeran en la Tabla 1.
La frecuencia y magnitud de las anomalías de laboratorio y electrocardiográficas fueron similares en los pacientes tratados con CLARINEX y con placebo.
No hubo diferencias en los eventos adversos para los subgrupos de pacientes definidos por sexo, edad o raza.
Urticaria idiopática crónica
En ensayos de dosis múltiples controlados con placebo de urticaria idiopática crónica, 211 pacientes de 12 años o más recibieron tabletas de 5 mg de CLARINEX y 205 recibieron placebo. Los eventos adversos informados por más o igual al 2 % de los pacientes que recibieron tabletas de 5 mg de CLARINEX y que fueron más comunes con 5 mg de CLARINEX que con placebo fueron (tasas para 5 mg de CLARINEX y placebo, respectivamente): dolor de cabeza (14 %, 13 %) , náuseas (5 %, 2 %), fatiga (5 %, 1 %), mareos (4 %, 3 %), faringitis (3 %, 2 %), dispepsia (3 %, 1 %) y mialgia (3 %, 1%).
Pediatría
Doscientos cuarenta y seis sujetos pediátricos de 6 meses a 11 años de edad recibieron CLARINEX Solución oral durante 15 días en tres ensayos clínicos controlados con placebo. Los sujetos pediátricos de 6 a 11 años recibieron 2,5 mg una vez al día, los sujetos de 1 a 5 años recibieron 1,25 mg una vez al día y los sujetos de 6 a 11 meses de edad recibieron 1,0 mg una vez al día.
En sujetos de 6 a 11 años de edad, el 2 por ciento o más de los sujetos no informó ningún evento adverso individual.
En sujetos de 2 a 5 años de edad, los eventos adversos informados para CLARINEX y placebo en al menos el 2 por ciento de los sujetos que recibieron CLARINEX 5 mg Solución oral y con una frecuencia mayor que el placebo fueron fiebre (5.5 %, 5.4 %), infección del tracto urinario (3.6 %, 0%) y varicela (3,6%, 0%).
En sujetos de 12 a 23 meses de edad, los eventos adversos informados para el producto de 5 mg de CLARINEX y el placebo en al menos el 2 por ciento de los sujetos que recibieron la solución oral de CLARINEX y con una frecuencia mayor que el placebo fueron fiebre (16,9 %, 12,9 %), diarrea ( 15,4 %, 11,3 %), infecciones del tracto respiratorio superior (10,8 %, 9,7 %), tos (10,8 %, 6,5 %), aumento del apetito (3,1 %, 1,6 %), labilidad emocional (3,1 %, 0 %), epistaxis ( 3,1%, 0%), infección parasitaria (3,1%, 0%), faringitis (3,1%, 0%), exantema maculopapular (3,1%, 0%).
En sujetos de 6 meses a 11 meses de edad, los eventos adversos informados para CLARINEX 5 mg y placebo en al menos el 2 por ciento de los sujetos que recibieron CLARINEX 5 mg Solución oral y con una frecuencia mayor que el placebo fueron infecciones del tracto respiratorio superior (21,2 %, 12,9 %). diarrea (19,7%, 8,1%), fiebre (12,1%, 1,6%), irritabilidad (12,1%, 11,3%), tos (10,6%, 9,7%), somnolencia (9,1%, 8,1%), bronquitis (6,1%, 0 %), otitis media (6,1 %, 1,6 %), vómitos (6,1 %, 3,2 %), anorexia (4,5 %, 1,6 %), faringitis (4,5 %, 1,6 %), insomnio (4,5 %, 0 %), rinorrea (4,5 %, 3,2 %), eritema (3,0 %, 1,6 %) y náuseas (3,0 %, 0 %).
No hubo cambios clínicamente significativos en ningún parámetro electrocardiográfico, incluido el intervalo QTc. Solo uno de los 246 sujetos pediátricos que recibieron la solución oral de 5 mg de CLARINEX en los ensayos clínicos interrumpió el tratamiento debido a un evento adverso.
Experiencia posterior a la comercialización
Debido a que los eventos adversos son informados voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco. Se han notificado los siguientes eventos adversos espontáneos durante la comercialización de desloratadina:
Trastornos cardíacos: taquicardia, palpitaciones
Trastornos respiratorios, torácicos y mediastínicos: disnea
Trastornos de la piel y del tejido subcutáneo: sarpullido, prurito
Trastornos del sistema nervioso: hiperactividad psicomotora, trastornos del movimiento (incluyendo distonía, tics y síntomas extrapiramidales), convulsiones (informadas en pacientes con y sin un trastorno convulsivo conocido)
Trastornos del sistema inmunológico: reacciones de hipersensibilidad (como urticaria, edema y anafilaxia)
Investigaciones: enzimas hepáticas elevadas, incluida la bilirrubina
Trastornos hepatobiliares: hepatitis
Trastornos del metabolismo y de la nutrición: Apetito incrementado
INTERACCIONES CON LA DROGAS
Inhibidores del citocromo P450 3A4
En estudios clínicos controlados, la coadministración de desloratadina con ketoconazol, eritromicina o azitromicina resultó en un aumento de las concentraciones plasmáticas de desloratadina y 3 hidroxidesloratadina, pero no hubo cambios clínicamente relevantes en el perfil de seguridad de desloratadina. [Ver FARMACOLOGÍA CLÍNICA ]
fluoxetina
En estudios clínicos controlados, la coadministración de desloratadina con fluoxetina, un inhibidor selectivo de la recaptación de serotonina (ISRS), resultó en un aumento de las concentraciones plasmáticas de desloratadina y 3 hidroxidesloratadina, pero no hubo cambios clínicamente relevantes en el perfil de seguridad de desloratadina. [Ver FARMACOLOGÍA CLÍNICA ]
cimetidina
En estudios clínicos controlados, la coadministración de desloratadina con cimetidina, un antagonista del receptor H2 de la histamina, resultó en un aumento de las concentraciones plasmáticas de desloratadina y 3 hidroxidesloratadina, pero no hubo cambios clínicamente relevantes en el perfil de seguridad de desloratadina. [Ver FARMACOLOGÍA CLÍNICA ]
Abuso y dependencia de drogas
No hay información que indique que se produzca abuso o dependencia con CLARINEX Tabletas.
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Reacciones hipersensibles
Se han informado reacciones de hipersensibilidad que incluyen erupción cutánea, prurito, urticaria, edema, disnea y anafilaxia después de la administración de desloratadina. Si ocurre tal reacción, se debe suspender la terapia con CLARINEX 5 mg y se debe considerar un tratamiento alternativo. [Ver REACCIONES ADVERSAS ]
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( INFORMACIÓN DEL PACIENTE ).
Información para pacientes
- Se debe indicar a los pacientes que usen CLARINEX 5 mg según las indicaciones.
- Dado que los alimentos no tienen efectos sobre la biodisponibilidad, se puede indicar a los pacientes que las tabletas de 5 mg de CLARINEX, la solución oral o las tabletas RediTabs se pueden tomar independientemente de las comidas.
- Se debe advertir a los pacientes que no aumenten la dosis o la frecuencia de dosificación ya que los estudios no han demostrado una mayor eficacia a dosis más altas y puede ocurrir somnolencia.
- Fenilcetonúricos: Las tabletas CLARINEX RediTabs contienen fenilalanina.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Estudios de carcinogenicidad
El potencial carcinogénico de la desloratadina se evaluó mediante un estudio de loratadina en ratas y un estudio de desloratadina en ratones. En un estudio de 2 años en ratas, se administró loratadina en la dieta en dosis de hasta 25 mg/kg/día (las exposiciones estimadas de desloratadina y metabolitos de desloratadina fueron aproximadamente 30 veces el AUC en humanos con la dosis oral diaria recomendada). Se observó una incidencia significativamente mayor de tumores hepatocelulares (adenomas y carcinomas combinados) en hombres que recibieron 10 mg/kg/día de loratadina y en hombres y mujeres que recibieron 25 mg/kg/día de loratadina. Las exposiciones estimadas de desloratadina y metabolitos de desloratadina en ratas que recibieron 10 mg/kg de loratadina fueron aproximadamente 7 veces el AUC en humanos con la dosis oral diaria recomendada. Se desconoce la importancia clínica de estos hallazgos durante el uso a largo plazo de desloratadina.
En un estudio dietético de 2 años en ratones, machos y hembras que recibieron hasta 16 mg/kg/día y 32 mg/kg/día de desloratadina, respectivamente, no mostraron aumentos significativos en la incidencia de ningún tumor. Las exposiciones estimadas de desloratadina y metabolitos de desloratadina en ratones con estas dosis fueron 12 y 27 veces, respectivamente, el AUC en humanos con la dosis oral diaria recomendada.
Estudios de genotoxicidad
En estudios de genotoxicidad con desloratadina, no hubo evidencia de potencial genotóxico en un ensayo de mutación inversa (ensayo de mutagenicidad bacteriana en microsomas de mamíferos de Salmonella/E. coli) o en 2 ensayos para aberraciones cromosómicas (ensayo de clastogenicidad en linfocitos de sangre periférica humana y ensayo de micronúcleo en médula ósea de ratón). ).
Deterioro de la fertilidad
No hubo efecto sobre la fertilidad femenina en ratas con dosis de desloratadina de hasta 24 mg/kg/día (las exposiciones estimadas de desloratadina y metabolitos de desloratadina fueron aproximadamente 130 veces el AUC en humanos con la dosis oral diaria recomendada). Se produjo una disminución específica de la fertilidad masculina, demostrada por tasas reducidas de concepción femenina, disminución del número y la motilidad de los espermatozoides y cambios testiculares histopatológicos, con una dosis oral de desloratadina de 12 mg/kg en ratas (las exposiciones estimadas de desloratadina y metabolitos de desloratadina fueron aproximadamente 45 veces mayores que AUC en humanos a la dosis oral diaria recomendada). La desloratadina no tuvo efecto sobre la fertilidad en ratas a una dosis oral de 3 mg/kg/día (las exposiciones estimadas de desloratadina y metabolitos de desloratadina fueron aproximadamente 8 veces el AUC en humanos con la dosis oral diaria recomendada).
Uso en poblaciones específicas
El embarazo
Embarazo Categoría C
No existen estudios adecuados y bien controlados en mujeres embarazadas. Debido a que los estudios de reproducción en animales no siempre predicen la respuesta humana, la desloratadina debe usarse durante el embarazo solo si es claramente necesario.
La desloratadina no fue teratogénica en ratas o conejos en aproximadamente 210 y 230 veces, respectivamente, el área bajo la curva de concentración-tiempo (AUC) en humanos con la dosis oral diaria recomendada. Sin embargo, se observó un aumento en la pérdida previa a la implantación y una disminución en el número de implantaciones y fetos en un estudio separado en ratas hembra con aproximadamente 120 veces el AUC en humanos con la dosis oral diaria recomendada. Se informó reducción del peso corporal y reflejo de enderezamiento lento en cachorros en aproximadamente 50 veces o más que el AUC en humanos con la dosis oral diaria recomendada. La desloratadina no tuvo ningún efecto sobre el desarrollo de las crías en aproximadamente 7 veces el AUC en humanos con la dosis oral diaria recomendada. Las AUC en comparación se referían a la exposición a desloratadina en conejos y la suma de las exposiciones a desloratadina y sus metabolitos en ratas, respectivamente. [Ver Toxicología no clínica ]
Madres lactantes
La desloratadina pasa a la leche materna; por lo tanto, se debe tomar la decisión de suspender la lactancia o suspender la desloratadina, teniendo en cuenta el beneficio del fármaco para la madre lactante y el posible riesgo para el niño.
Uso pediátrico
La dosis recomendada de CLARINEX 5 mg Solución oral en la población pediátrica se basa en la comparación de estudios cruzados de la concentración plasmática de CLARINEX 5 mg en adultos y sujetos pediátricos. La seguridad de CLARINEX Solución oral se ha establecido en 246 sujetos pediátricos de 6 meses a 11 años en tres estudios clínicos controlados con placebo. Dado que el curso de la rinitis alérgica estacional y perenne y la urticaria idiopática crónica y los efectos de CLARINEX son suficientemente similares en las poblaciones pediátrica y adulta, permite la extrapolación de los datos de eficacia en adultos a los pacientes pediátricos. La eficacia de CLARINEX 5 mg Solución oral en estos grupos de edad está respaldada por la evidencia de estudios adecuados y bien controlados de CLARINEX 5 mg Tabletas en adultos. La seguridad y eficacia de CLARINEX 5 mg Tabletas o CLARINEX 5 mg Solución oral no han sido demostradas en pacientes pediátricos menores de 6 meses de edad. [Ver FARMACOLOGÍA CLÍNICA ]
La tableta CLARINEX RediTabs de 2.5 mg no ha sido evaluada en pacientes pediátricos. La bioequivalencia de la tableta RediTabs de 5 mg de CLARINEX y la tableta RediTabs comercializada anteriormente se estableció en adultos. Junto con los estudios de búsqueda de dosis en pediatría descritos, los datos farmacocinéticos de CLARINEX 5 mg RediTabs respaldan el uso de la dosis de 2,5 mg en pacientes pediátricos de 6 a 11 años de edad.
Uso geriátrico
Los estudios clínicos de desloratadina no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes. Otra experiencia clínica informada no ha identificado diferencias entre los pacientes de edad avanzada y los más jóvenes. En general, la selección de la dosis para un paciente anciano debe ser cautelosa, reflejando la mayor frecuencia de disminución de la función hepática, renal o cardíaca, y de enfermedades concomitantes u otra terapia con medicamentos. [Ver FARMACOLOGÍA CLÍNICA ]
Insuficiencia renal
Se recomienda ajustar la dosis para pacientes con insuficiencia renal [ver DOSIFICACIÓN Y ADMINISTRACIÓN y FARMACOLOGÍA CLÍNICA ].
Deterioro hepático
Se recomienda ajustar la dosis para pacientes con insuficiencia hepática [ver DOSIFICACIÓN Y ADMINISTRACIÓN y FARMACOLOGÍA CLÍNICA ].
SOBREDOSIS
En caso de sobredosis, considere las medidas estándar para eliminar cualquier fármaco no absorbido. Se recomienda tratamiento sintomático y de apoyo. La desloratadina y la 3-hidroxidesloratadina no se eliminan por hemodiálisis.
La información sobre sobredosis aguda se limita a la experiencia de los informes de eventos adversos posteriores a la comercialización y de los ensayos clínicos realizados durante el desarrollo del producto CLARINEX 5 mg. En un ensayo de rango de dosis, se notificó somnolencia a dosis de 10 mg y 20 mg/día.
En otro estudio, no se informaron eventos adversos clínicamente relevantes en voluntarios masculinos y femeninos normales que recibieron dosis diarias únicas de CLARINEX 45 mg durante 10 días [ver FARMACOLOGÍA CLÍNICA ].

Ocurrió letalidad en ratas con dosis orales de 250 mg/kg o mayores (las exposiciones estimadas de desloratadina y metabolitos de desloratadina fueron aproximadamente 120 veces el AUC en humanos con la dosis oral diaria recomendada). La dosis letal media oral en ratones fue de 353 mg/kg (las exposiciones estimadas a desloratadina fueron aproximadamente 290 veces la dosis oral diaria en humanos sobre una base de mg/m²). No se produjeron muertes con dosis orales de hasta 250 mg/kg en monos (las exposiciones estimadas de desloratadina fueron aproximadamente 810 veces la dosis oral diaria en humanos sobre una base de mg/m²).
CONTRAINDICACIONES
Las tabletas de 5 mg de CLARINEX, las tabletas RediTabs y la solución oral están contraindicadas en pacientes hipersensibles a este medicamento o a cualquiera de sus ingredientes o a la loratadina [ver ADVERTENCIAS Y PRECAUCIONES y REACCIONES ADVERSAS ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
La desloratadina es un antagonista tricíclico de la histamina de acción prolongada con actividad antagonista selectiva de la histamina del receptor H1. Los datos de unión al receptor indican que a una concentración de 2-3 ng/mL (7 nanomolar), la desloratadina muestra una interacción significativa con el receptor H1 de la histamina humana. La desloratadina inhibió la liberación de histamina de los mastocitos humanos in vitro. Los resultados de un estudio de distribución de tejido radiomarcado en ratas y un estudio de unión del radioligando H1-receptor en cobayos mostraron que la desloratadina no cruza fácilmente la barrera hematoencefálica. La importancia clínica de este hallazgo es desconocida.
Farmacodinámica
roncha y bengala
Los estudios de ronchas cutáneas por histamina en humanos después de dosis únicas y repetidas de 5 mg de desloratadina han demostrado que el fármaco exhibe un efecto antihistamínico en 1 hora; esta actividad puede persistir hasta 24 horas. No hubo evidencia de taquifilaxia de ronchas cutáneas inducida por histamina en el grupo de 5 mg de desloratadina durante el período de tratamiento de 28 días. Se desconoce la relevancia clínica de la prueba cutánea de la roncha con histamina.
Efectos sobre QTc
Se administraron dosis únicas diarias de 45 mg a voluntarios normales masculinos y femeninos durante 10 días. Todos los ECG obtenidos en este estudio fueron leídos manualmente de forma ciega por un cardiólogo. En los sujetos tratados con CLARINEX, hubo un aumento en la frecuencia cardíaca media de 9,2 lpm en relación con el placebo. El intervalo QT fue corregido por la frecuencia cardíaca (QTc) por los métodos de Bazett y Fridericia. Utilizando el QTc (Bazett), hubo un aumento medio de 8,1 ms en los sujetos tratados con CLARINEX en relación con el placebo. Con QTc (Fridericia) hubo un aumento medio de 0,4 ms en los sujetos tratados con CLARINEX en relación con el placebo. No se informaron eventos adversos clínicamente relevantes.
Farmacocinética
Absorción
Después de la administración oral de un comprimido de 5 mg de desloratadina una vez al día durante 10 días a voluntarios sanos normales, el tiempo medio hasta las concentraciones plasmáticas máximas (Tmax) se produjo aproximadamente 3 horas después de la dosis y las concentraciones plasmáticas máximas medias en estado estacionario (Cmax) y AUC de Se observaron 4 ng/mL y 56,9 ng.hr/mL, respectivamente. Ni los alimentos ni el jugo de toronja tuvieron efecto sobre la biodisponibilidad (Cmax y AUC) de desloratadina.
El perfil farmacocinético de CLARINEX Solución oral se evaluó en un estudio cruzado de tres vías en 30 voluntarios adultos. Una dosis única de 10 ml de CLARINEX Solución oral que contenía 5 mg de desloratadina fue bioequivalente a una dosis única de 5 mg de tableta CLARINEX. Los alimentos no tuvieron efecto sobre la biodisponibilidad (AUC y Cmax) de CLARINEX 5 mg Solución oral.
El perfil farmacocinético de CLARINEX 5 mg RediTabs Tablets se evaluó en un estudio cruzado de tres vías en 24 voluntarios adultos. Una sola tableta CLARINEX RediTabs que contenía 5 mg de desloratadina fue bioequivalente a una sola tableta CLARINEX RediTabs de 5 mg (formulación original) tanto para desloratadina como para 3-hidroxidesloratadina. Los alimentos y el agua no tuvieron efecto sobre la biodisponibilidad (AUC y Cmax) de las tabletas CLARINEX RediTabs.
Distribución
La desloratadina y la 3-hidroxidesloratadina se unen aproximadamente del 82% al 87% y del 85% al 89% a las proteínas plasmáticas, respectivamente. La unión a proteínas de desloratadina y 3-hidroxidesloratadina no se vio alterada en sujetos con insuficiencia renal.
Metabolismo
La desloratadina (un metabolito principal de la loratadina) se metaboliza ampliamente a 3-hidroxidesloratadina, un metabolito activo, que posteriormente se glucuroniza. No se han identificado las enzimas responsables de la formación de 3-hidroxidesloratadina. Los datos de los ensayos clínicos indican que un subconjunto de la población general tiene una menor capacidad para formar 3hidroxidesloratadina y son metabolizadores lentos de la desloratadina. En estudios farmacocinéticos (n=3748), aproximadamente el 6 % de los sujetos eran metabolizadores lentos de desloratadina (definidos como sujetos con una relación AUC de 3-hidroxidesloratadina a desloratadina inferior a 0,1, o sujetos con una semivida de desloratadina superior a 50 horas). ). Estos estudios farmacocinéticos incluyeron sujetos entre las edades de 2 y 70 años, incluidos 977 sujetos de 2 a 5 años, 1575 sujetos de 6 a 11 años y 1196 sujetos de 12 a 70 años. No hubo diferencia en la prevalencia de metabolizadores lentos entre los grupos de edad. La frecuencia de metabolizadores lentos fue mayor en los negros (17 %, n=988) en comparación con los caucásicos (2 %, n=1462) y los hispanos (2 %, n=1063). La mediana de exposición (AUC) a desloratadina en los metabolizadores lentos fue aproximadamente 6 veces mayor que en los sujetos que no son metabolizadores lentos. Los sujetos que son metabolizadores lentos de desloratadina no pueden identificarse prospectivamente y estarán expuestos a niveles más altos de desloratadina después de recibir la dosis recomendada de desloratadina. En estudios clínicos de seguridad de dosis múltiples, en los que se identificó el estado del metabolizador, se reclutaron y trataron con CLARINEX Solución oral durante 15 a 35 días un total de 94 metabolizadores lentos y 123 metabolizadores normales. En estos estudios, no se observaron diferencias generales en la seguridad entre los metabolizadores lentos y los metabolizadores normales. Aunque no se observó en estos estudios, no se puede descartar un mayor riesgo de eventos adversos relacionados con la exposición en pacientes que son metabolizadores lentos.
Eliminación
La vida media de eliminación plasmática media de desloratadina fue de aproximadamente 27 horas. Los valores de Cmax y AUC aumentaron de forma proporcional a la dosis después de dosis orales únicas de entre 5 y 20 mg. El grado de acumulación después de 14 días de dosificación fue consistente con la vida media y la frecuencia de dosificación. Un estudio de balance de masa en humanos documentó una recuperación de aproximadamente el 87 % de la dosis de 14C-desloratadina, que se distribuyó por igual en la orina y las heces como productos metabólicos. El análisis de 3hidroxidesloratadina en plasma mostró valores de Tmax y vida media similares en comparación con la desloratadina.
Poblaciones Especiales
Sujetos geriátricos
En sujetos de mayor edad (≥65 años; n=17) luego de la administración de dosis múltiples de tabletas de 5 mg de CLARINEX, los valores medios de Cmax y AUC para desloratadina fueron un 20 % mayores que en sujetos más jóvenes (
Sujetos pediátricos
En sujetos de 6 a 11 años, una dosis única de 5 ml de CLARINEX Solución oral que contenía 2,5 mg de desloratadina resultó en concentraciones plasmáticas de desloratadina similares a las alcanzadas en adultos a los que se les administró una sola tableta de 5 mg de CLARINEX. En sujetos de 2 a 5 años de edad, una dosis única de 2,5 ml de CLARINEX Solución oral que contenía 1,25 mg de desloratadina resultó en concentraciones plasmáticas de desloratadina similares a las alcanzadas en adultos a los que se les administró una sola tableta de 5 mg de CLARINEX. Sin embargo, la Cmax y el AUC del metabolito (3-hidroxidesloratadina) fueron 1,27 y 1,61 veces mayores para la dosis de 5 mg de Solución oral administrada en adultos en comparación con la Cmax y el AUC obtenidas en niños de 2 a 11 años que recibieron 1,25- 2,5 mg de CLARINEX Solución Oral.
Se administró una dosis única de 2,5 ml o 1,25 ml de solución oral de 5 mg de CLARINEX que contenía 1,25 mg o 0,625 mg, respectivamente, de desloratadina a sujetos de 6 a 11 meses de edad y de 12 a 23 meses de edad. Los resultados de un análisis farmacocinético poblacional indicaron que se requiere una dosis de 1 mg para sujetos de 6 a 11 meses de edad y de 1,25 mg para sujetos de 12 a 23 meses de edad para obtener concentraciones plasmáticas de desloratadina similares a las alcanzadas en adultos a los que se les administró una dosis única de 5 meses. mg de dosis de CLARINEX Solución Oral.
La tableta CLARINEX 5 mg RediTabs 2.5 mg no ha sido evaluada en pacientes pediátricos. La bioequivalencia de CLARINEX 5 mg RediTabs Tablet y CLARINEX 5 mg RediTabs Tablets original se estableció en adultos. Junto con los estudios de búsqueda de dosis en pediatría descritos, los datos farmacocinéticos de CLARINEX 5 mg RediTabs Tablets respaldan el uso de la dosis de 2,5 mg en pacientes pediátricos de 6 a 11 años de edad.
Insuficiencia renal
La farmacocinética de desloratadina después de una dosis única de 7,5 mg se caracterizó en pacientes con depuración de creatinina leve (n=7; 51-69 ml/min/1,73 m²), moderada (n=6; depuración de creatinina 34-43 ml/min/1,73 m²). ) y pacientes con insuficiencia renal grave (n=6; aclaramiento de creatinina de 5-29 ml/min/1,73 m²) o dependientes de hemodiálisis (n=6). En pacientes con insuficiencia renal leve y moderada, los valores medianos de Cmax y AUC aumentaron aproximadamente 1,2 y 1,9 veces, respectivamente, en relación con los sujetos con función renal normal. En pacientes con insuficiencia renal grave o que dependían de hemodiálisis, los valores de Cmax y AUC aumentaron aproximadamente 1,7 y 2,5 veces, respectivamente. Se observaron cambios mínimos en las concentraciones de 3-hidroxidesloratadina. La desloratadina y la 3-hidroxidesloratadina se eliminaron pobremente por hemodiálisis. La unión a proteínas plasmáticas de desloratadina y 3-hidroxidesloratadina no se vio alterada por la insuficiencia renal. Se recomienda ajustar la dosis para pacientes con insuficiencia renal [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Insuficiencia Hepática
La farmacocinética de desloratadina se caracterizó después de una dosis oral única en pacientes con insuficiencia hepática leve (n=4), moderada (n=4) y grave (n=4) según lo definido por la clasificación Child-Pugh de la función hepática y 8 sujetos con insuficiencia hepática. función hepática normal. Los pacientes con insuficiencia hepática, independientemente de la gravedad, tuvieron un aumento de aproximadamente 2,4 veces en el AUC en comparación con los sujetos normales. El aclaramiento oral aparente de desloratadina en pacientes con insuficiencia hepática leve, moderada y grave fue del 37 %, 36 % y 28 % del de sujetos normales, respectivamente. Se observó un aumento en la vida media de eliminación media de desloratadina en pacientes con insuficiencia hepática. Para 3-hidroxidesloratadina, los valores medios de Cmax y AUC para pacientes con insuficiencia hepática no fueron significativamente diferentes desde el punto de vista estadístico de los sujetos con función hepática normal. Se recomienda ajustar la dosis para pacientes con insuficiencia hepática [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Género
Las mujeres tratadas durante 14 días con tabletas de 5 mg de CLARINEX tuvieron valores de Cmax y AUC de desloratadina un 10 % y un 3 % más altos, respectivamente, en comparación con los hombres. Los valores de Cmax y AUC de 3-hidroxidesloratadina también aumentaron en un 45 % y un 48 %, respectivamente, en mujeres en comparación con los hombres. Sin embargo, es probable que estas diferencias aparentes no sean clínicamente relevantes y, por lo tanto, no se recomienda un ajuste de dosis.
La raza
Luego de 14 días de tratamiento con tabletas CLARINEX, los valores de Cmax y AUC para desloratadina fueron 18% y 32% más altos, respectivamente, en afroamericanos en comparación con caucásicos. Para la 3-hidroxidesloratadina hubo una reducción correspondiente del 10 % en los valores de Cmax y AUC en los negros en comparación con los caucásicos. No es probable que estas diferencias sean clínicamente relevantes y, por lo tanto, no se recomienda ajustar la dosis.
Interacciones con la drogas
En dos estudios de farmacología clínica cruzados controlados en voluntarios sanos masculinos (n=12 en cada estudio) y femeninos (n=12 en cada estudio), se coadministró desloratadina 7,5 mg (1,5 veces la dosis diaria) una vez al día con eritromicina 500 mg cada 8 horas o ketoconazol 200 mg cada 12 horas durante 10 días. En tres estudios de farmacología clínica de grupos paralelos, controlados por separado, se coadministró desloratadina a la dosis clínica de 5 mg con 500 mg de azitromicina seguidos de 250 mg una vez al día durante 4 días (n = 18) o con fluoxetina 20 mg una vez al día durante 7 días. después de un período de pretratamiento de 23 días con fluoxetina (n=18) o con cimetidina 600 mg cada 12 horas durante 14 días (n=18) en condiciones de estado estacionario a voluntarios masculinos y femeninos sanos normales. Aunque se observaron concentraciones plasmáticas aumentadas (Cmax y AUC0-24 hrs) de desloratadina y 3hidroxidesloratadina (ver Tabla 2), no hubo cambios clínicamente relevantes en el perfil de seguridad de desloratadina, según lo evaluado por parámetros electrocardiográficos (incluido el intervalo QT corregido), pruebas de laboratorio clínico, signos vitales y eventos adversos.
Toxicología Animal Y/o Farmacología Estudios De Toxicología Reproductiva
La desloratadina no fue teratogénica en ratas en dosis de hasta 48 mg/kg/día (las exposiciones estimadas de desloratadina y metabolitos de desloratadina fueron aproximadamente 210 veces el AUC en humanos con la dosis oral diaria recomendada) o en conejos en dosis de hasta 60 mg/kg/ día (las exposiciones estimadas de desloratadina fueron aproximadamente 230 veces el AUC en humanos con la dosis oral diaria recomendada). En un estudio separado, se observó un aumento en la pérdida previa a la implantación y una disminución en el número de implantaciones y fetos en ratas hembra con 24 mg/kg (las exposiciones estimadas de desloratadina y metabolitos de desloratadina fueron aproximadamente 120 veces el AUC en humanos con la dosis oral diaria recomendada). dosis). Se informó reducción del peso corporal y reflejo de enderezamiento lento en cachorros a dosis de 9 mg/kg/día o más (las exposiciones estimadas de desloratadina y metabolitos de desloratadina fueron aproximadamente 50 veces o más que el AUC en humanos con la dosis oral diaria recomendada). La desloratadina no tuvo ningún efecto sobre el desarrollo de las crías a una dosis oral de 3 mg/kg/día (las exposiciones estimadas de desloratadina y metabolitos de desloratadina fueron aproximadamente 7 veces el AUC en humanos con la dosis oral diaria recomendada).
Estudios clínicos
Rinitis alérgica estacional
La eficacia clínica y la seguridad de CLARINEX Tabletas se evaluaron en más de 2300 pacientes de 12 a 75 años de edad con rinitis alérgica estacional. Un total de 1838 pacientes recibieron de 2,5 a 20 mg/día de CLARINEX en 4 ensayos clínicos doble ciego, aleatorizados y controlados con placebo de 2 a 4 semanas de duración realizados en los Estados Unidos. Los resultados de estos estudios demostraron la eficacia y seguridad de CLARINEX 5 mg en el tratamiento de pacientes adultos y adolescentes con rinitis alérgica estacional. En un ensayo de rango de dosis, se estudió CLARINEX de 2,5 a 20 mg/día. Las dosis de 5, 7,5, 10 y 20 mg/día fueron superiores al placebo; y no se observó ningún beneficio adicional con dosis superiores a 5,0 mg. En el mismo estudio se observó un aumento de la incidencia de somnolencia a dosis de 10 mg/día y 20 mg/día (5,2% y 7,6%, respectivamente), frente a placebo (2,3%).
En dos estudios de 4 semanas de 924 pacientes (de 15 a 75 años de edad) con rinitis alérgica estacional y asma concomitante, las tabletas de 5 mg de CLARINEX 5 mg una vez al día mejoraron los síntomas de la rinitis, sin disminuir la función pulmonar. Esto respalda la seguridad de administrar tabletas de 5 mg de CLARINEX a pacientes adultos con rinitis alérgica estacional y asma leve a moderada.
Las tabletas de CLARINEX de 5 mg una vez al día redujeron significativamente la puntuación total de síntomas (la suma de las puntuaciones individuales de los síntomas nasales y no nasales) en pacientes con rinitis alérgica estacional. Consulte la Tabla 3.
No hubo diferencias significativas en la eficacia de las tabletas de 5 mg de CLARINEX 5 mg entre los subgrupos de pacientes definidos por sexo, edad o raza.
Rinitis alérgica perenne
La eficacia clínica y la seguridad de CLARINEX Tabletas de 5 mg se evaluaron en más de 1300 pacientes de 12 a 80 años de edad con rinitis alérgica perenne. Un total de 685 pacientes recibieron 5 mg/día de CLARINEX 5 mg en dos ensayos clínicos doble ciego, aleatorizados y controlados con placebo de 4 semanas de duración realizados en los Estados Unidos e internacionalmente. En uno de estos estudios, las tabletas de 5 mg de CLARINEX 5 mg una vez al día demostraron reducir significativamente la puntuación total de síntomas en pacientes con rinitis alérgica perenne (Tabla 4).
Urticaria idiopática crónica
La eficacia y seguridad de CLARINEX 5 mg Tabletas 5 mg una vez al día se estudió en 416 pacientes con urticaria idiopática crónica de 12 a 84 años de edad, de los cuales 211 recibieron CLARINEX. En dos ensayos clínicos aleatorizados, doble ciego, controlados con placebo, de seis semanas de duración, en el punto de evaluación principal preespecificado de una semana, las tabletas de CLARINEX redujeron significativamente la gravedad del prurito en comparación con el placebo (Tabla 5). También se evaluaron los criterios de valoración secundarios, y durante la primera semana de tratamiento, las tabletas de 5 mg de CLARINEX 5 mg redujeron los criterios de valoración secundarios, "Número de ronchas" y "Tamaño de la urticaria más grande", en comparación con el placebo.
La seguridad clínica de CLARINEX Solución oral se documentó en tres estudios de seguridad de 15 días, doble ciego, controlados con placebo en sujetos pediátricos con antecedentes documentados de rinitis alérgica, urticaria idiopática crónica o sujetos que eran candidatos para la terapia con antihistamínicos. En el primer estudio, se administraron 2,5 mg de CLARINEX Solución oral a 60 sujetos pediátricos de 6 a 11 años de edad. El segundo estudio evaluó 1,25 mg de CLARINEX Solución oral administrados a 55 sujetos pediátricos de 2 a 5 años de edad. En el tercer estudio, se administraron 1,25 mg de CLARINEX 5 mg Solución oral a 65 sujetos pediátricos de 12 a 23 meses de edad y 1,0 mg de CLARINEX Solución oral a 66 sujetos pediátricos de 6 a 11 meses de edad. Los resultados de estos estudios demostraron la seguridad de CLARINEX 5 mg Solución oral en sujetos pediátricos de 6 meses a 11 años de edad.
INFORMACIÓN DEL PACIENTE
CLARINEX® (CLA-RI-NEX) (desloratadina) tabletas, RediTabs® y solución oral
Lea la Información para el paciente que viene con CLARINEX® antes de comenzar a tomarlo y cada vez que renueve su receta. Es posible que haya nueva información. Este prospecto es un resumen de la información para los pacientes. Su médico o farmacéutico puede darle información adicional. Este folleto no reemplaza la conversación con su médico sobre su condición médica o tratamiento.
¿Qué es CLARINEX 5mg?
CLARINEX es un medicamento recetado que contiene el medicamento desloratadina (un antihistamínico).
CLARINEX se usa para ayudar a controlar los síntomas de:
- rinitis alérgica estacional (estornudos, congestión nasal, secreción nasal y picazón en la nariz) en personas de 2 años de edad y mayores.
- rinitis alérgica perenne (estornudos, congestión nasal, secreción nasal y picazón en la nariz) en personas de 6 meses de edad y mayores.
- urticaria idiopática crónica (picazón a largo plazo) y para reducir la cantidad y el tamaño de la urticaria en personas a partir de los 6 meses de edad.
CLARINEX no es para niños menores de 6 meses de edad.
¿Quién no debe tomar CLARINEX?
No tome CLARINEX 5 mg si usted:
- es alérgico a la desloratadina o a cualquiera de los ingredientes de CLARINEX Tabletas, CLARINEX RediTabs® o CLARINEX Solución oral. Consulte el final de este folleto para obtener una lista completa de ingredientes.
- es alérgico a la loratadina (Alavert, Claritin).
Hable con su médico antes de tomar este medicamento si tiene alguna duda sobre si tomar o no este medicamento.
¿Qué debo decirle a mi médico antes de tomar CLARINEX 5 mg?
Antes de tomar CLARINEX 5 mg, informe a su médico si:
- tiene problemas hepáticos o renales.
- tiene otras condiciones médicas.
- está embarazada o planea quedar embarazada. No se sabe si CLARINEX 5mg dañará a su bebé nonato. Hable con su médico si está embarazada o planea quedar embarazada.
- está amamantando o planea amamantar. CLARINEX 5 mg puede pasar a la leche materna. Hable con su médico sobre la mejor manera de alimentar a su bebé si toma CLARINEX.
Informe a su médico sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos herbales. CLARINEX 5 mg puede afectar el funcionamiento de otros medicamentos, y otros medicamentos pueden afectar el funcionamiento de CLARINEX 5 mg. Informe especialmente a su médico si toma:
- ketoconazol (Nizoral)
- eritromicina (Ery-tab, Eryc, PCE)
- azitromicina (Zithromax, Zmax)
- antihistamínicos
- fluoxetina (Prozac)
- cimetidina (Tagamet)
Conozca los medicamentos que toma. Mantenga una lista de sus medicamentos y muéstresela a su médico y farmacéutico cuando obtenga un nuevo medicamento.
¿Cómo debo tomar CLARINEX?
- Tome CLARINEX 5 mg exactamente como le indique su médico.
- No cambie su dosis de CLARINEX 5 mg ni lo tome con más frecuencia de lo recetado.
- CLARINEX 5 mg se puede tomar con o sin alimentos.
- Coloque la tableta CLARINEX RediTabs en la lengua y deje que se disuelva antes de tragarla. CLARINEX 5mg RediTabs se puede tomar con o sin agua. Tome su tableta CLARINEX 5 mg RediTabs inmediatamente después de abrir el blíster.
- Tome la solución oral de CLARINEX con un gotero medidor o una jeringa oral que pueda medir 2 ml o 2,5 ml. Pídale a su farmacéutico un cuentagotas o una jeringa si no tiene uno.
- Si toma demasiado CLARINEX, llame a su médico o busque atención médica de inmediato.
¿Cuáles son los posibles efectos secundarios de las tabletas CLARINEX?
CLARINEX 5 mg puede causar efectos secundarios graves, que incluyen:
- Reacciones alérgicas. Deje de tomar CLARINEX 5 mg y llame a su médico de inmediato o busque ayuda de emergencia si tiene alguno de estos síntomas:
- sarpullido
- Comezón
- urticaria
- hinchazón de los labios, la lengua, la cara y la garganta
- dificultad para respirar o dificultad para respirar
Los efectos secundarios más comunes de CLARINEX en adultos y niños mayores de 12 años con rinitis alérgica incluyen:
- dolor de garganta
- boca seca
- dolor muscular
- cansancio
- somnolencia
- dolor menstrual
Puede aumentar la somnolencia o el cansancio si toma más CLARINEX de lo que le recetó su médico.
Informe a su médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de CLARINEX. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar CLARINEX 5mg?
- Tienda CLARINEX Tabletas entre 59°F a 86°F (15°C a 30°C).
- CLARINEX Tabletas son sensibles al calor. No almacene a más de 86 °F (30 °C).
- Proteger CLARINEX 5mg Comprimidos de la humedad
- Tienda CLARINEX 5mg Solución Oral entre 59°F a 86°F (15°C a 30°C). Proteja CLARINEX 5mg Solución Oral de la luz.
Mantener CLARINEX Tabletas, RediTabs Tabletas , y Solucion Oral y todos los medicamentos fuera del alcance de los niños.
Información general sobre CLARINEX
veces, los medicamentos se prescriben para fines distintos a los enumerados en el prospecto de información para el paciente. No use CLARINEX 5mg para una condición para la cual no fue recetado. No le dé CLARINEX 5 mg a otras personas, incluso si tienen la misma condición que usted. Puede que les haga daño.
Este folleto de información para el paciente resume la información más importante sobre CLARINEX. Si desea obtener más información, hable con su médico. Puede solicitar a su farmacéutico o médico información sobre CLARINEX escrita para profesionales de la salud.
Para obtener más información, vaya a www.CLARINEX.com
¿Cuáles son los ingredientes de CLARINEX 5mg?
Ingrediente activo: desloratadina
Pacientes con Fenilcetonuria: Las tabletas CLARINEX RediTabs contienen fenilalanina.
Ingredientes inactivos en CLARINEX 5mg Comprimidos: fosfato de calcio dibásico dihidrato USP, celulosa microcristalina NF, almidón de maíz NF, talco USP, cera de carnauba NF, cera blanca NF, material de recubrimiento que consiste en lactosa monohidrato, hipromelosa, dióxido de titanio, polietilenglicol y laca de aluminio FD&C Blue #2.
Ingredientes inactivos en CLARINEX 5mg Solución oral: propilenglicol USP, solución de sorbitol USP, ácido cítrico (anhidro) USP, citrato de sodio dihidrato USP, benzoato de sodio NF, edetato disódico USP, agua purificada USP. También contiene azúcar granulada, sabor natural y artificial para chicle y colorante FDC Yellow #6.
