Rhinocort 100mcg Budesonide Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Rhinocort Aqua y cómo se usa?
El aerosol nasal Rhinocort Aqua (budesonida) es un esteroide que se usa para tratar síntomas nasales como congestión, estornudos y secreción nasal causados por alergias estacionales o durante todo el año. El aerosol nasal Rhinocort Aqua también se usa para evitar que los pólipos nasales regresen después de la extirpación quirúrgica.
¿Cuáles son los efectos secundarios de Rhinocort 100mcg Aqua?
Los efectos secundarios comunes del aerosol nasal Rhinocort Aqua incluyen:
- sequedad o irritación de nariz/garganta,
- dolor de garganta,
- tos,
- estornudos,
- hemorragias nasales,
- sabor/olor desagradable,
- llagas o manchas blancas dentro o alrededor de la nariz, o
- dolor, hinchazón, ardor, picazón o irritación alrededor de la nariz.
Informe a su médico si tiene efectos secundarios raros pero graves del aerosol nasal Rhinocort Aqua, que incluyen:
- pérdida del gusto o del olfato, o
- dolor o llagas en la nariz.
DESCRIPCIÓN
La budesonida, el ingrediente activo del aerosol nasal RHINOCORT AQUA (budesonida), es un corticosteroide sintético antiinflamatorio.
Se designa químicamente como (RS)-11-beta, 16-alfa, 17, 21-tetrahidroxipregna-1,4-dieno-3,20-diona cíclica 16, 17-acetal con butiraldehído.
La budesonida se proporciona como una mezcla de dos epímeros (22R y 22S).
La fórmula empírica de la budesonida es C25H34O6 y su peso molecular es 430,5.
Su fórmula estructural es:
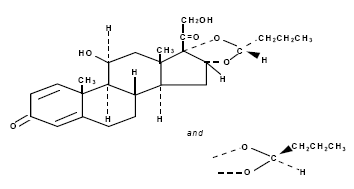
La budesonida es un polvo inodoro de color blanco a blanquecino que es prácticamente insoluble en agua y en heptano, escasamente soluble en etanol y fácilmente soluble en cloroformo.
Su coeficiente de reparto entre octanol y agua a pH 5 es de 1,6 x103.
El aerosol nasal RHINOCORT AQUA (budesonida) es una formulación de aerosol de bomba manual, dosificadora y sin perfume que contiene una suspensión micronizada de budesonida en un medio acuoso. Este medio contiene celulosa microcristalina y carboximetilcelulosa sódica, dextrosa anhidra, polisorbato 80, edetato disódico, sorbato potásico y agua purificada; Se agrega ácido clorhídrico para ajustar el pH a un objetivo de 4.5.
El aerosol nasal RHINOCORT 100mcg AQUA proporciona 32 mcg de budesonida por aplicación.
Cada botella de RHINOCORT 100 mcg AQUA (budesonida) Aerosol nasal 32 mcg contiene 120 aerosoles medidos después del cebado inicial.
Antes del uso inicial, el recipiente debe agitarse suavemente y la bomba debe cebarse activándola ocho veces. Si se usa a diario, no es necesario volver a cebar la bomba. Si no se usa durante dos días consecutivos, vuelva a imprimar con una pulverización o hasta que aparezca una pulverización fina. Si no se usa durante más de 14 días, enjuague el aplicador y vuelva a imprimar con dos rocíos o hasta que aparezca un rocío fino.
INDICACIONES
Tratamiento de la rinitis alérgica estacional o perenne
El aerosol nasal RHINOCORT AQUA (budesonida) está indicado para el tratamiento de los síntomas nasales de la rinitis alérgica estacional o perenne en adultos y niños a partir de los seis años de edad.
DOSIFICACIÓN Y ADMINISTRACIÓN
La dosis inicial recomendada para adultos y niños a partir de los 6 años de edad es de 64 mcg por día administrados como una pulverización por fosa nasal de RHINOCORT AQUA (budesonida) en aerosol nasal de 32 mcg una vez al día. Algunos pacientes que no logran controlar los síntomas con la dosis inicial recomendada pueden beneficiarse de una dosis mayor. La dosis máxima recomendada para adultos (a partir de los 12 años) es de 256 mcg por día administrados en cuatro pulverizaciones por fosa nasal una vez al día de RHINOCORT AQUA (budesonida) en aerosol nasal de 32 mcg y la dosis máxima recomendada para pacientes pediátricos (de 6 a
Siempre es deseable titular a un paciente individual a la dosis mínima efectiva para reducir la posibilidad de efectos secundarios. Se puede notar una mejoría en los síntomas nasales en pacientes dentro de las 10 horas posteriores al primer uso de RHINOCORT 100 mcg AQUA (budesonida) en aerosol nasal; sin embargo, la mejoría clínica generalmente toma de 1 a 2 días con un beneficio máximo en aproximadamente 2 semanas. Cuando se ha logrado el máximo beneficio y se han controlado los síntomas, la reducción de la dosis puede ser eficaz para mantener el control de los síntomas de la rinitis alérgica en pacientes que inicialmente estaban controlados con dosis más altas.
Antes del uso inicial, el recipiente debe agitarse suavemente y la bomba debe cebarse activándola ocho veces. Si se usa a diario, no es necesario volver a cebar la bomba. Si no se usa durante dos días consecutivos, vuelva a imprimar con una pulverización o hasta que aparezca una pulverización fina. Si no se usa durante más de 14 días, enjuague el aplicador y vuelva a imprimar con dos rocíos o hasta que aparezca un rocío fino. Agite el envase suavemente antes de cada uso.
Ilustrado Instrucciones de uso del paciente acompaña cada paquete de RHINOCORT AQUA (budesonida) Aerosol Nasal 32 mcg.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
El aerosol nasal RHINOCORT AQUA (budesonida) es una suspensión de aerosol nasal. Cada spray proporciona 32 mcg de budesonida. Cada botella de RHINOCORT 100 mcg AQUA (budesonida) Aerosol nasal 32 mcg contiene 120 aerosoles medidos después del cebado inicial.
RHINOCORT 100 mcg AQUA (budesonida) Aerosol nasal 32 mcg está disponible en una botella de vidrio ámbar con una bomba de dosificación en aerosol y una tapa de protección verde. RHINOCORT 100 mcg AQUA (budesonida) Aerosol nasal 32 mcg ( CDN 0186-1070-08) proporciona 120 pulverizaciones medidas después del cebado inicial; peso neto de llenado 8,6 g. El frasco de RHINOCORT 100 mcg AQUA (budesonida) en aerosol nasal de 32 mcg se llenó con un exceso para acomodar la actividad de cebado. La botella se debe desechar después de 120 rociadas después del cebado inicial, ya que la cantidad de budesonida administrada por rociado a partir de entonces puede ser sustancialmente menor que la dosis indicada en la etiqueta. Cada spray libera 32 mcg de budesonida al paciente.
El aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) debe almacenarse a temperatura ambiente controlada, de 20 a 25 °C (68 a 77 °F) con la válvula hacia arriba. No congelar. Proteger de la luz. Agitar suavemente antes de usar. No rocíe en los ojos.
Distribuido por: AstraZeneca LP, Wilmington, DE 19850. Revisado: 12/2010EFECTOS SECUNDARIOS
El uso de corticosteroides sistémicos e intranasales puede resultar en lo siguiente:
- Epistaxis, infección por Candida albicans, perforación del tabique nasal y deterioro de la cicatrización de heridas [ver ADVERTENCIAS Y PRECAUCIONES ].
- Hipersensibilidad incluyendo anafilaxia [ver ADVERTENCIAS Y PRECAUCIONES ].
- Inmunosupresión [ver ADVERTENCIAS Y PRECAUCIONES ].
- Hipercorticismo y supresión suprarrenal [ver ADVERTENCIAS Y PRECAUCIONES ].
- Efecto de crecimiento [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
- Glaucoma y Cataratas [ver ADVERTENCIAS Y PRECAUCIONES ].
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
La incidencia de reacciones adversas comunes en la Tabla 1 se basa en dos ensayos clínicos controlados en EE. UU. y cinco fuera de EE. UU. en 1526 pacientes con rinitis estacional o perenne en adultos y niños ≥ 6 años tratados con RHINOCORT AQUA (budesonida) en aerosol nasal en dosis de hasta 400 mcg una vez al día durante 3-6 semanas. Esta población incluía 745 mujeres y 781 hombres con una edad media de 31 años (rango de 6 a 85 años, 349 tenían 6
Se observó un perfil de reacciones adversas similar en el subgrupo de pacientes pediátricos de 6 a 12 años de edad. Estos pacientes se incluyen en la tabla 1.
Del dos al tres por ciento (2-3%) de los pacientes en ensayos clínicos interrumpieron debido a reacciones adversas. No se informaron efectos secundarios sistémicos de los corticosteroides durante los estudios clínicos controlados con el aerosol nasal RHINOCORT AQUA (budesonida).
Si se exceden las dosis recomendadas, o si las personas son particularmente sensibles, pueden presentarse síntomas de hipercorticismo, es decir, síndrome de Gushing y supresión suprarrenal.
Experiencia posterior a la comercialización
Se informaron las siguientes reacciones adversas durante el uso posterior a la aprobación del aerosol nasal RHINOCORT AQUA (budesonida). Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Trastornos del sistema inmunológico: reacciones de hipersensibilidad inmediata y retardada (incluyendo reacción anafiláctica, urticaria, erupción cutánea, dermatitis, angioedema y prurito), [ver ADVERTENCIAS Y PRECAUCIONES y CONTRAINDICACIONES ]
Trastornos oculares: glaucoma, aumento de la presión intraocular, cataratas [ver ADVERTENCIAS Y PRECAUCIONES ]
Trastornos respiratorios, torácicos y mediastínicos: perforación del tabique nasal, anosmia, trastornos de la faringe (irritación de garganta, dolor de garganta, garganta hinchada, ardor de garganta y picazón de garganta) y sibilancias
Trastornos cardíacos: palpitaciones
Trastornos musculoesqueléticos y del tejido conjuntivo: supresión del crecimiento [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ]
INTERACCIONES CON LA DROGAS
Inhibidores del Citocromo P450 3A4
La ruta principal de metabolismo de los corticosteroides, incluida la budesonida, es a través de la isoenzima 3A4 (CYP3A4) del citocromo P450 (CYP). Después de la administración oral de ketoconazol, un inhibidor potente de CYP3A4, aumentó la concentración plasmática media de budesonida administrada por vía oral. La administración concomitante de CYP3A4 puede inhibir el metabolismo y aumentar la exposición sistémica a la budesonida. Se debe tener precaución al considerar la administración conjunta de RHINOCORT AQUA (budesonida) en aerosol nasal con ketoconazol a largo plazo y otros inhibidores potentes conocidos de CYP3A4 (p. ej., ritonavir, atazanavir claritromicina, indinavir itraconazol, nefazodona nelfinavir-saquinavir, telitromicina) [ver ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ].
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Efectos nasales locales
Epistaxis
En estudios clínicos de 3 a 52 semanas de duración, se observó epistaxis con mayor frecuencia en pacientes tratados con RHINOCORT 100 mcg AQUA (budesonida) en aerosol nasal que en aquellos que recibieron placebo [ver REACCIONES ADVERSAS ].
infección por cándida
En estudios clínicos con budesonida administrada por vía intranasal, se ha producido el desarrollo de infecciones localizadas de nariz y faringe por Candida albicans. Cuando se desarrolla una infección de este tipo, puede requerir tratamiento local o sistémico adecuado y la suspensión del tratamiento con el aerosol nasal RHINOCORT AQUA (budesonida). Los pacientes que usen el aerosol nasal RHINOCORT AQUA (budesonida) durante varios meses o más deben ser examinados periódicamente en busca de evidencia de infección por Candida u otros signos de efectos adversos en la mucosa nasal.
Perforación del tabique nasal
Se han informado casos de perforación del tabique nasal después de la aplicación intranasal de corticosteroides, incluida la budesonida [ver REACCIONES ADVERSAS ].
Deterioro de la cicatrización de heridas
Debido al efecto inhibitorio de los corticosteroides sobre la cicatrización de heridas, los pacientes que han experimentado recientemente úlceras del tabique nasal, cirugía nasal o trauma nasal no deben usar corticosteroides nasales hasta que se haya producido la cicatrización.
Reacciones de hipersensibilidad, incluida la anafilaxia
Pueden ocurrir reacciones de hipersensibilidad que incluyen reacción anafiláctica, urticaria, erupción cutánea, dermatitis, angioedema y prurito [ver CONTRAINDICACIONES y REACCIONES ADVERSAS, Experiencia Posterior a la Comercialización ].
Inmunosupresión
Los pacientes que toman medicamentos que suprimen el sistema inmunitario son más susceptibles a las infecciones que las personas sanas. La varicela y el sarampión, por ejemplo, pueden tener un curso más grave o incluso fatal en niños o adultos susceptibles que usan corticosteroides. En tales niños o adultos que no han tenido estas enfermedades o no han sido inmunizados adecuadamente, se debe tener especial cuidado para evitar la exposición. Se desconoce cómo la dosis, la vía y la duración de la administración de corticosteroides afectan el riesgo de desarrollar una infección diseminada. Tampoco se conoce la contribución de la enfermedad subyacente y/o el tratamiento previo con corticosteroides al riesgo. Si se expone a la varicela, puede estar indicada la terapia con inmunoglobulina de varicela zoster (VZIG) o inmunoglobulina intravenosa combinada (WIG), según corresponda. Si se expone al sarampión, puede estar indicada la profilaxis con inmunoglobulina (IG) intramuscular combinada. (Ver los respectivos prospectos para información completa de prescripción de VZIG e IG ). Si se desarrolla varicela, se puede considerar el tratamiento con agentes antivirales.
No se ha estudiado el curso clínico de la infección por varicela o sarampión en pacientes tratados con corticosteroides intranasales o inhalados. Si bien no hay datos con los corticosteroides intranasales, un estudio clínico ha examinado la capacidad de respuesta inmune a la vacuna contra la varicela en pacientes con asma de 12 meses a 8 años de edad que fueron tratados con suspensión para inhalación de budesonida.
Un estudio clínico abierto, no aleatorizado, examinó la capacidad de respuesta inmunitaria a la vacuna contra la varicela en 243 pacientes con asma de 12 meses a 8 años de edad que fueron tratados con budesonida en suspensión para inhalación, 0,25 mg a 1 mg al día (n=151) o terapia para el asma sin corticosteroides (n=92) (es decir, agonistas beta, antagonistas de los receptores de leucotrienos o cromonas). El porcentaje de pacientes que desarrollaron un título de anticuerpos seroprotectores ≥ 5,0 (valor gpELISA) en respuesta a la vacunación fue similar en los pacientes tratados con budesonida en suspensión para inhalación (85 %) en comparación con los pacientes tratados con terapia para el asma sin corticosteroides (90 %). Ningún paciente tratado con la suspensión para inhalación de budesonida desarrolló varicela como resultado de la vacunación.
Los corticosteroides deben usarse con precaución, si es que se usan, en pacientes con infección tuberculosa activa o latente, infecciones fúngicas, bacterianas, sistémicas virales o parasitarias no tratadas; o herpes simple ocular.
Efectos del eje hipotálamo-pituitario-suprarrenal
Hipercorticismo y supresión suprarrenal: Cuando los esteroides intranasales se usan en dosis superiores a las recomendadas o en individuos susceptibles a las dosis recomendadas, pueden aparecer efectos sistémicos de los corticosteroides, como hipercorticismo y supresión suprarrenal. Si tales cambios ocurren, la dosis de RHINOCORT 100 mcg AQUA (budesonida) en aerosol nasal debe suspenderse lentamente, de acuerdo con los procedimientos aceptados para suspender la terapia con corticosteroides orales.
El reemplazo de un corticosteroide sistémico con un corticosteroide tópico puede estar acompañado de signos de insuficiencia suprarrenal y, además, algunos pacientes pueden experimentar síntomas de abstinencia de corticosteroides, por ejemplo, dolor articular y/o muscular, fatiga, debilidad, náuseas, vómitos, hipotensión, lasitud y depresión. Los pacientes tratados previamente durante períodos prolongados con corticosteroides sistémicos deben retirarse lentamente cuando se les transfiera a corticosteroides tópicos y se los debe monitorear cuidadosamente para detectar insuficiencia suprarrenal aguda en respuesta al estrés. En aquellos pacientes que tienen asma u otras condiciones clínicas que requieren tratamiento con corticosteroides sistémicos a largo plazo, una disminución demasiado rápida de los corticosteroides sistémicos puede causar una exacerbación grave de sus síntomas.
Interacciones con inhibidores fuertes del citocromo P450 3A4
Se debe tener precaución al considerar la administración conjunta de RHINOCORT AQUA aerosol nasal con ketoconazol y otros inhibidores potentes de CYP3A4 conocidos (p. ej., ritonavir, atazanavir, claritromicina, indinavir, itraconazol, nefazodona, nelfinavir, saquinavir, telitromicina) porque los efectos adversos relacionados con el aumento puede ocurrir una exposición sistémica a la budesonida [ver INTERACCIONES MEDICAMENTOSAS, FARMACOLOGÍA CLÍNICA ].
Efecto sobre el crecimiento
Los corticosteroides intranasales, incluida la budesonida, pueden causar una reducción en la velocidad de crecimiento cuando se administran a pacientes pediátricos. Supervise el crecimiento de forma rutinaria de los pacientes pediátricos que reciben tratamiento a largo plazo con RHINOCORT 100 mcg AQUA (budesonida) en aerosol nasal. Para minimizar los efectos sistémicos de los corticosteroides intranasales, incluido el aerosol nasal RHINOCORT AQUA (budesonida), ajuste la dosis de cada paciente a la más baja que controle efectivamente sus síntomas [ver Uso en poblaciones específicas, uso pediátrico ].
Glaucoma y Cataratas
Se han notificado glaucoma, aumento de la presión intraocular y cataratas tras la aplicación intranasal de corticosteroides, incluida la budesonida. Por lo tanto, se justifica una estrecha vigilancia en pacientes con un cambio en la visión o con antecedentes de aumento de la presión intraocular, glaucoma y/o cataratas [ver REACCIONES ADVERSAS ].
Información de asesoramiento para pacientes
[Ver Etiquetado para pacientes aprobado por la FDA ]
Los pacientes tratados con el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) deben recibir la siguiente información e instrucciones. Esta información está destinada a ayudar al paciente en el uso seguro y eficaz del medicamento. No es una divulgación de todos los posibles efectos adversos o previstos. Para el uso adecuado del aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) y para lograr la máxima mejora, el paciente debe leer y seguir el etiquetado para el paciente aprobado por la FDA adjunto.
Efectos nasales locales
Se debe advertir a los pacientes que en algunos pacientes se produjeron epistaxis e infecciones localizadas por Candida albicans en la nariz y la faringe. Si se desarrolla candidiasis, debe tratarse con la terapia local o sistémica adecuada y suspender el tratamiento con RHINOCORT 100 mcg AQUA (budesonida) en aerosol nasal. Además, los corticosteroides nasales se asocian con perforación del tabique nasal y cicatrización deficiente de heridas. Los pacientes que han experimentado úlceras nasales recientes, cirugía nasal o traumatismo nasal no deben usar el aerosol nasal RHINOCORT AQUA (budesonida) hasta que se haya curado [ver ADVERTENCIAS Y PRECAUCIONES ].
Hipersensibilidad incluyendo anafilaxia
Se debe advertir a los pacientes que se han informado reacciones de hipersensibilidad que incluyen reacción anafiláctica, urticaria, sarpullido, dermatitis, angioedema y prurito con el uso de RHINOCORT AQUA (budesonida) en aerosol nasal. Discontinuar
RHINOCORT AQUA (budesonida) Aerosol nasal si ocurren tales reacciones [ver CONTRAINDICACIONES, ADVERTENCIAS Y PRECAUCIONES y REACCIONES ADVERSAS ].
Inmunosupresión
Se debe advertir a los pacientes que reciben dosis inmunosupresoras de corticosteroides que eviten la exposición a la varicela o al sarampión y, si se exponen, que consulten a su médico sin demora. Se debe informar a los pacientes sobre el posible empeoramiento de la tuberculosis existente, infección fúngica, bacteriana, viral o parasitaria, o herpes simple ocular [ver ADVERTENCIAS Y PRECAUCIONES ].
Velocidad de crecimiento reducida
Se debe advertir a los pacientes que los corticosteroides intranasales, incluida la budesonida, pueden causar una reducción en la velocidad de crecimiento cuando se administran a pacientes pediátricos. Los médicos deben seguir de cerca el crecimiento de los niños y adolescentes que toman corticosteroides por cualquier vía [ver ADVERTENCIAS Y PRECAUCIONES ].
Glaucoma y Cataratas
Se debe advertir a los pacientes que el uso a largo plazo de corticosteroides intranasales, incluida la budesonida, puede aumentar el riesgo de algunos problemas oculares (cataratas y glaucoma). Los pacientes deben informar a su proveedor de atención médica si observan un cambio en la visión mientras usan el aerosol nasal RHINOCORT AQUA (budesonida) [ver ADVERTENCIAS Y PRECAUCIONES ].
Uso diario
Los pacientes deben usar el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) a intervalos regulares, ya que su eficacia depende de su uso regular. Los pacientes pueden notar una mejoría en los síntomas nasales dentro de las 10 horas posteriores al primer uso del aerosol nasal RHINOCORT AQUA (budesonida). Es posible que no se logre el beneficio máximo hasta aproximadamente 2 semanas después del inicio del tratamiento [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Los pacientes deben tomar el medicamento según las indicaciones y no deben exceder la dosis prescrita. El paciente debe comunicarse con el médico si los síntomas no mejoran después de dos semanas o si la condición empeora. Los pacientes que experimentan episodios recurrentes de epistaxis (hemorragia nasal) o molestias en el tabique nasal mientras toman este medicamento deben comunicarse con su médico. Para el uso adecuado del aerosol nasal RHINOCORT AQUA (budesonida) y para lograr la máxima mejora, el paciente debe leer y seguir atentamente la información para el paciente adjunta. No use el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) después de haber usado la cantidad de aerosoles indicada en la etiqueta (no incluye el cebado) o después de la fecha de vencimiento que se muestra en la etiqueta del envase o la botella.
Cómo usar el aerosol nasal RHINOCORT 100mcg AQUA (budesonida)
Se debe instruir cuidadosamente a los pacientes sobre el uso de este medicamento para asegurar la administración óptima de la dosis [ver INFORMACIÓN DEL PACIENTE ].
Toxicología no clínica
Carcinogénesis, mutagénesis, deterioro de la fertilidad
En un estudio oral de 104 semanas en ratas Sprague-Dawley, se observó un aumento estadísticamente significativo en la incidencia de gliomas en las ratas macho que recibieron una dosis oral de budesonida de 50 mcg/kg/día (aproximadamente el doble de la dosis intranasal diaria máxima recomendada en adultos y niños sobre una base de mcg/m2). No se observó tumorigenicidad en ratas macho con dosis orales de hasta 25 mcg/kg (aproximadamente igual a la dosis intranasal diaria máxima recomendada en adultos y niños sobre una base de mcg/m2, y en ratas hembra con dosis orales de hasta 50 mcg/kg). aproximadamente dos veces la dosis intranasal diaria máxima recomendada en adultos y niños sobre una base de mcg/m2). En dos estudios adicionales de dos años en ratas macho Fischer y Sprague-Dawley, la budesonida no causó gliomas a una dosis oral de 50 mcg/kg (aproximadamente el doble de la dosis intranasal diaria máxima recomendada en adultos y niños sobre una base de mcg/m2). Sin embargo, en ratas macho Sprague-Dawley, la budesonida provocó un aumento estadísticamente significativo en la incidencia de tumores hepatocelulares a una dosis oral de 50 mcg/kg (aproximadamente el doble de la dosis intranasal diaria máxima recomendada en adultos y niños sobre una base de mcg/m2). ). Los corticosteroides de referencia concurrentes (prednisolona y acetónido de triamcinolona) en estos dos estudios mostraron hallazgos similares.
No hubo evidencia de un efecto cancerígeno cuando se administró budesonida por vía oral durante 91 semanas a ratones en dosis de hasta 200 mcg/kg/día (aproximadamente 3 veces la dosis intranasal diaria máxima recomendada en adultos y niños sobre una base de mcg/m2) .
La budesonida no fue mutagénica ni clastogénica en seis sistemas de prueba diferentes: prueba de Ames Salmonella/placa de microsomas, prueba de micronúcleos de ratón, prueba de linfoma de ratón, prueba de aberración cromosómica en linfocitos humanos, prueba letal recesiva ligada al sexo en Drosophila melanogaster y análisis de reparación de ADN en ratas cultivo de hepatocitos.
En ratas, la budesonida no tuvo efecto sobre la fertilidad en dosis subcutáneas de hasta 80 mcg/kg (aproximadamente 3 veces la dosis intranasal diaria máxima recomendada en adultos sobre la base de mcg/m2).
una dosis subcutánea de 20 mcg/kg/día (menor que la dosis intranasal diaria máxima recomendada en adultos sobre una base de mcg/m2), disminuye el aumento de peso corporal materno, la viabilidad prenatal y la viabilidad de las crías al nacer y durante la lactancia fueron observados. No se observaron tales efectos con 5 mcg/kg (menos de la dosis intranasal diaria máxima recomendada en adultos sobre una base de mcg/m2).
Uso en poblaciones específicas
El embarazo
Efectos teratogénicos: Embarazo Categoría B. El impacto de la budesonida en los resultados del embarazo humano se ha evaluado a través de evaluaciones de los registros de nacimiento relacionados con el uso materno de budesonida inhalada (es decir, PULMICORT TURBUHALER) y budesonida administrada por vía intranasal (es decir, RHINOCORT 100 mcg AQUA (budesonida) aerosol nasal). Los resultados de los estudios epidemiológicos de cohortes prospectivos basados en la población que revisan los datos de tres registros suecos que cubren aproximadamente el 99 % de los embarazos entre 1995 y 2001 (es decir, el Registro médico sueco de nacimientos, el Registro de malformaciones congénitas, el Registro de cardiología infantil) no indican un aumento del riesgo de malformaciones congénitas por el uso de budesonida inhalada o intranasal durante el embarazo temprano.
Las malformaciones congénitas se estudiaron en 2014 bebés nacidos de madres que reportaron el uso de budesonida inhalada para el asma al principio del embarazo (generalmente 10 a 12 semanas después del último período menstrual), el período en el que ocurren la mayoría de las malformaciones orgánicas importantes.1 La tasa de malformaciones congénitas en general fue similar en comparación con la tasa de la población general (3,8 % frente a 3,5 %, respectivamente). El número de niños nacidos con hendiduras orofaciales y defectos cardíacos fue similar al número esperado en la población general (4 niños frente a 3,3 y 18 niños frente a 17-18, respectivamente). En un estudio de seguimiento que elevó el número total de bebés a 2534, la tasa de malformaciones congénitas generales entre los bebés cuyas madres estuvieron expuestas a la budesonida inhalada durante el embarazo temprano no fue diferente de la tasa de todos los bebés recién nacidos durante el mismo período (3,6 % ).2 Un tercer estudio del Registro médico sueco de nacimientos de 2968 embarazos expuestos a budesonida inhalada, la mayoría de los cuales fueron exposiciones en el primer trimestre, informó edad gestacional, peso al nacer, longitud al nacer, mortinatos y nacimientos múltiples similares para los bebés expuestos en comparación con infantes no expuestos.3
Se estudiaron malformaciones congénitas en 2113 niños nacidos de madres que informaron el uso de budesonida intranasal al principio del embarazo. La tasa de malformaciones congénitas en general fue similar en comparación con la tasa de la población general (4,5 % frente a 3,5 %, respectivamente). El odds ratio (OR) ajustado fue 1,06 (IC 95% 0,86-1,31). El número de niños nacidos con hendiduras orofaciales fue similar al número esperado en la población general (3 niños vs. 3, respectivamente). El número de niños nacidos con defectos cardíacos superó lo esperado en la población general (28 niños frente a 17,8 respectivamente). La exposición sistémica de la budesonida intranasal es 6 veces menor que la de la budesonida inhalada y no se observó una asociación de defectos cardíacos con exposiciones más altas de budesonida.
pesar de los hallazgos en animales, parecería que la posibilidad de daño fetal es remota si la droga se usa durante el embarazo. Sin embargo, debido a que los estudios en humanos no pueden descartar la posibilidad de daño, el aerosol nasal RHINOCORT AQUA (budesonida) debe usarse durante el embarazo solo si es claramente necesario.
La budesonida produjo pérdida fetal, disminución del peso de las crías y anomalías esqueléticas a una dosis subcutánea en conejos que fue aproximadamente 2 veces la dosis intranasal diaria máxima recomendada en adultos sobre una base de mcg/m2 y a una dosis subcutánea en ratas que fue aproximadamente 16 veces la dosis intranasal diaria máxima recomendada en adultos sobre una base de mcg/m2. No se observaron efectos teratogénicos o embriocidas en ratas cuando se administró budesonida por inhalación en dosis de hasta aproximadamente 8 veces la dosis intranasal diaria máxima recomendada en adultos sobre una base de mcg/m2.
La experiencia con los corticosteroides orales desde su introducción en dosis farmacológicas, a diferencia de las fisiológicas, sugiere que los roedores son más propensos a los efectos teratogénicos de los corticosteroides que los humanos.
Efectos no teratogénicos: El hipoadrenalismo puede ocurrir en bebés nacidos de madres que reciben corticosteroides durante el embarazo. Tales bebés deben ser observados cuidadosamente.
Madres lactantes
La budesonida se secreta en la leche humana. Los datos con budesonida administrada a través de un inhalador de polvo seco indican que la dosis oral diaria total de budesonida disponible en la leche materna para el lactante es aproximadamente del 0,3 % al 1 % de la dosis inhalada por la madre [ver FARMACOLOGÍA CLÍNICA, Farmacocinética, Poblaciones Especiales, Enfermería ]. No se han realizado estudios en mujeres lactantes específicamente con RHINOCORT 100mcg AQUA Aerosol Nasal; sin embargo, se esperaría que la dosis de budesonida disponible para el lactante en la leche materna, como porcentaje de la dosis materna, sea similar. El aerosol nasal RHINOCORT AQUA (budesonida) debe usarse en mujeres lactantes solo si es clínicamente apropiado. Los prescriptores deben sopesar los beneficios conocidos de la lactancia materna para la madre y el bebé frente a los riesgos potenciales de la exposición mínima a la budesonida en el bebé. Las consideraciones de dosificación incluyen la prescripción o la titulación a la dosis clínicamente efectiva más baja y el uso de RHINOCORT 100 mcg AQUA (budesonida) en aerosol nasal inmediatamente después de amamantar para maximizar el intervalo de tiempo entre la dosificación y la lactancia para minimizar la exposición infantil.
Uso pediátrico
No se ha establecido la seguridad y eficacia en pacientes pediátricos menores de 6 años.
Estudios clínicos controlados han demostrado que los corticosteroides intranasales pueden causar una reducción en la velocidad de crecimiento en pacientes pediátricos. Este efecto se ha observado en ausencia de pruebas de laboratorio de supresión del eje hipotálamo-pituitario-suprarrenal (HPA), lo que sugiere que la velocidad de crecimiento es un indicador más sensible de la exposición sistémica a los corticosteroides en pacientes pediátricos que algunas pruebas de uso común de la función del eje HPA. . Se desconocen los efectos a largo plazo de esta reducción en la velocidad de crecimiento asociada con los corticosteroides intranasales, incluido el impacto en la estatura adulta final. No se ha estudiado adecuadamente el potencial de "recuperación" del crecimiento después de la interrupción del tratamiento con corticosteroides intranasales.
El crecimiento de los pacientes pediátricos que reciben corticosteroides intranasales, incluido el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida), debe controlarse de forma rutinaria (p. ej., mediante estadiometría). Los posibles efectos de crecimiento del tratamiento prolongado deben sopesarse frente a los beneficios clínicos obtenidos y los riesgos y beneficios asociados con las terapias alternativas. Para minimizar los efectos sistémicos de los corticosteroides intranasales, incluido el aerosol nasal RHINOCORT AQUA (budesonida), se debe titular a cada paciente a la dosis más baja que controle efectivamente sus síntomas.
Se realizó un estudio de crecimiento clínico controlado con placebo de un año en 229 pacientes pediátricos (de 4 a 8 años de edad) para evaluar el efecto del aerosol nasal RHINOCORT AQUA (budesonida) (dosis única diaria de 64 mcg, la dosis inicial recomendada para niños de 6 años en adelante) sobre la velocidad de crecimiento. De una población de 141 pacientes que recibieron el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) y 67 que recibieron placebo, la estimación puntual de la velocidad de crecimiento con el aerosol nasal RHINOCORT AQUA (budesonida) fue 0,25 cm/año más baja que la observada con placebo (intervalo de confianza del 95 %). desde 0,59 cm/año menos que el placebo hasta 0,08 cm/año más que el placebo).
En un estudio de niños asmáticos de 5 a 12 años de edad, los tratados con budesonida administrada a través de un inhalador de polvo seco de 200 mcg dos veces al día (n=311) tuvieron una reducción de 1,1 centímetros (0,433 pulgadas) en el crecimiento en comparación con los que recibieron placebo ( n=418) al final de un año; la diferencia entre estos dos grupos de tratamiento no aumentó más durante los tres años de tratamiento adicional. Al final de los cuatro años, los niños tratados con inhalador de polvo seco de budesonida y los niños tratados con placebo tenían velocidades de crecimiento similares. Las conclusiones extraídas de este estudio pueden confundirse por el uso desigual de corticosteroides en los grupos de tratamiento y la inclusión de datos de pacientes que alcanzaron la pubertad durante el curso del estudio.
Los efectos sistémicos de los corticosteroides inhalados están relacionados con la exposición sistémica a dichos fármacos. Los estudios farmacocinéticos han demostrado que, tanto en adultos como en niños, se esperaría que la exposición sistémica a la budesonida a las dosis más altas recomendadas de RHINOCORT AQUA (budesonida) en aerosol nasal no sea mayor que la exposición a las dosis más bajas recomendadas a través de un inhalador de polvo seco. Por lo tanto, se esperaría que los efectos sistémicos (eje HPA y crecimiento) de la budesonida administrada por el aerosol nasal RHINOCORT AQUA (budesonida) no sean mayores que los informados para la budesonida inhalada cuando se administra a través del inhalador de polvo seco.
No se puede descartar la posibilidad de que el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) cause supresión del crecimiento en pacientes susceptibles o cuando se administra en dosis superiores a 64 mcg diarios. El rango de dosis recomendado en pacientes de 6 a 11 años de edad es de 64 a 128 mcg por día [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Uso geriátrico
De los 2461 pacientes en estudios clínicos de RHINOCORT 100 mcg AQUA (budesonida) aerosol nasal, el 5 % tenía 60 años de edad o más. No se observaron diferencias generales en la seguridad o la eficacia entre estos sujetos y los sujetos más jóvenes, excepto por una reacción adversa que informó la frecuencia de epistaxis que aumentó con la edad. Además, otra experiencia clínica informada no ha identificado ninguna otra diferencia en las respuestas entre los pacientes ancianos y los más jóvenes, pero no se puede descartar una mayor sensibilidad de algunas personas mayores.
Deterioro hepático
No se han realizado estudios farmacocinéticos formales con el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) en pacientes con insuficiencia hepática. Sin embargo, dado que la budesonida se elimina predominantemente por el metabolismo hepático, el deterioro de la función hepática puede conducir a la acumulación de budesonida en el plasma. Por lo tanto, los pacientes con enfermedad hepática deben ser monitoreados de cerca.
SOBREDOSIS
Es poco probable que se produzca una sobredosis aguda con esta forma de dosificación, ya que una botella de 120 atomizadores de RHINOCORT 100 mcg AQUA (budesonida) en aerosol nasal de 32 mcg solo contiene aproximadamente 5,4 mg de budesonida. La sobredosis crónica puede provocar signos/síntomas de hipercorticismo [ver ADVERTENCIAS Y PRECAUCIONES ].
CONTRAINDICACIONES
El aerosol nasal RHINOCORT AQUA (budesonida) está contraindicado en pacientes con hipersensibilidad a cualquiera de sus ingredientes [ver ADVERTENCIAS Y PRECAUCIONES ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
La budesonida es un corticosteroide antiinflamatorio que muestra una potente actividad glucocorticoide y una débil actividad mineralocorticoide. En modelos in vitro y animales estándar, la budesonida tiene una afinidad aproximadamente 200 veces mayor por el receptor de glucocorticoides y una potencia antiinflamatoria tópica 1000 veces mayor que el cortisol (ensayo de edema de oreja con aceite de crotón en rata). Como medida de la actividad sistémica, la budesonida es 40 veces más potente que el cortisol cuando se administra por vía subcutánea y 25 veces más potente cuando se administra por vía oral en el ensayo de involución del timo en ratas. Se desconoce el significado clínico de esto.
La actividad del aerosol nasal RHINOCORT 100 mcg AQUA se debe al fármaco original, la budesonida. En estudios de afinidad por el receptor de glucocorticoides, la forma 22R fue dos veces más activa que el epímero 22S. Los estudios in vitro indicaron que las dos formas de budesonida no se interconvierten.
El mecanismo preciso de las acciones de los corticosteroides sobre la inflamación en la rinitis alérgica estacional y perenne no se conoce bien. La inflamación es un componente importante en la patogenia de la rinitis alérgica estacional y perenne. Los corticosteroides tienen una amplia gama de actividades inhibidoras contra múltiples tipos de células (p. ej., mastocitos, eosinófilos, neutrófilos, macrófagos y linfocitos) y mediadores (p. ej., histamina, eicosanoides, leucotrienos y citoquinas) involucrados en reacciones alérgicas y no alérgicas. inflamación. Estas acciones antiinflamatorias de los corticosteroides pueden contribuir a su eficacia en la rinitis alérgica estacional y perenne.

Farmacodinámica
Un estudio clínico de 3 semanas en rinitis estacional, que comparó el inhalador nasal RHINOCORT de 100 mcg, la budesonida ingerida por vía oral y el placebo en 98 pacientes con rinitis alérgica debida al polen de abedul, demostró que el efecto terapéutico del inhalador nasal RHINOCORT se puede atribuir a los efectos tópicos de budesonida
Efectos del eje HPA
Los efectos del aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) sobre la función suprarrenal se evaluaron en varios ensayos clínicos. En un ensayo clínico de cuatro semanas, 61 pacientes adultos que recibieron 256 mcg diarios de RHINOCORT AQUA (budesonida) en aerosol nasal no demostraron diferencias significativas con los pacientes que recibieron placebo en los niveles de cortisol en plasma medidos antes y 60 minutos después de 0,25 mg de cosintropina intramuscular. No hubo diferencias consistentes en las mediciones de cortisol en orina de 24 horas en pacientes que recibieron hasta 400 mcg diarios. Se observaron resultados similares en un estudio de 150 niños y adolescentes de 6 a 17 años con rinitis perenne que fueron tratados con 256 mcg diarios hasta por 12 meses.
Después del tratamiento con la dosis diaria máxima recomendada de RHINOCORT AQUA (budesonida) aerosol nasal (256 mcg) durante siete días, hubo una disminución pequeña, pero estadísticamente significativa, en el área bajo la curva de tiempo de cortisol plasmático durante 24 horas (AUC0-24h ) en voluntarios adultos sanos.
Se observó una supresión relacionada con la dosis de la excreción urinaria de cortisol de 24 horas después de la administración de dosis de aerosol nasal de RHINOCORT AQUA (budesonida) que oscilaron entre 100 y 800 mcg diarios durante hasta cuatro días en 78 voluntarios adultos sanos. Se desconoce la relevancia clínica de estos resultados.
Farmacocinética
Absorción
Después de la administración intranasal de una dosis única de RHINOCORT AQUA (budesonida) en aerosol nasal (128 mcg), la concentración plasmática máxima media de aproximadamente 0,3 nmol/l se produce alrededor de 0,5 horas después de la dosis. En comparación con una dosis intravenosa, aproximadamente el 34 % de la dosis intranasal administrada llega a la circulación sistémica, la mayor parte de la cual se absorbe a través de la mucosa nasal. Si bien la budesonida se absorbe bien en el tracto GI, la biodisponibilidad oral de la budesonida es baja (~10 %) principalmente debido al extenso metabolismo de primer paso en el hígado.
Distribución
El volumen de distribución de budesonida fue de aproximadamente 2-3 L/kg. Se unió en un 85-90% a las proteínas plasmáticas. El volumen de distribución del epímero 22R es casi el doble que el del epímero 22S. La unión a proteínas fue constante en un rango de concentración (1-100 nmol/L) logrado con las dosis recomendadas de RHINOCORT 100 mcg AQUA Nasal Spray, y superándolas. La budesonida mostró poca o ninguna unión a la globulina transportadora de corticosteroides. La budesonida se equilibró rápidamente con los glóbulos rojos de una manera independiente de la concentración con una relación sangre/plasma de aproximadamente 0,8.
Metabolismo
Los estudios in vitro con homogeneizados de hígado humano han demostrado que la budesonida se metaboliza rápida y extensamente. Dos metabolitos principales formados a través de la biotransformación catalizada por la isoenzima 3A4 (CYP3A4) del citocromo P450 (CYP) se han aislado e identificado como 16α-hidroxiprednisolona y 6p-hidroxibudesonida. La actividad corticosteroide de cada uno de estos dos metabolitos es menos del 1% de la del compuesto original. No se han detectado diferencias cualitativas entre los patrones metabólicos in vitro e in vivo. Se observó una inactivación metabólica insignificante en preparaciones de suero y pulmón humano.
Excreción/Eliminación
La forma 22R de budesonida fue depurada preferentemente por el hígado con una depuración sistémica de 1,4 l/min frente a 1,0 l/min para la forma 22S. La vida media terminal, de 2 a 3 horas, fue la misma para ambos epímeros y fue independiente de la dosis. La budesonida se excretó en la orina y las heces en forma de metabolitos. Aproximadamente 2/3 de una dosis radiomarcada intranasal se recuperó en la orina y el resto en las heces. No se detectó budesonida sin cambios en la orina.
Poblaciones Específicas
geriátrico
No se ha estudiado específicamente la farmacocinética de RHINOCORT 100 mcg AQUA (budesonida) en aerosol nasal en pacientes geriátricos.
Pediátrico
Después de la administración de RHINOCORT 100 mcg AQUA (budesonida) en aerosol nasal, el tiempo para alcanzar las concentraciones máximas del fármaco y la vida media plasmática fueron similares en niños y adultos. Los niños tenían concentraciones plasmáticas de aproximadamente el doble de las observadas en adultos debido principalmente a las diferencias de peso entre niños y adultos.
Género
No se ha realizado ningún estudio farmacocinético específico para evaluar el efecto del género en la farmacocinética de la budesonida. Sin embargo, luego de la administración de 400 mcg de RHINOCORT 100 mcg AQUA (budesonida) en aerosol nasal a 7 hombres y 8 mujeres voluntarios en un estudio farmacocinético, no se encontraron diferencias importantes de género en los parámetros farmacocinéticos.
La raza
No se ha realizado ningún estudio específico para evaluar el efecto de la raza en la farmacocinética de budesonida.
Madres lactantes
Se estudió la eliminación de budesonida cuando se administra por inhalación oral desde un inhalador de polvo seco en dosis de 200 o 400 mcg dos veces al día durante al menos 3 meses en ocho mujeres lactantes con asma de 1 a 6 meses después del parto. La exposición sistémica a la budesonida en estas mujeres parece ser comparable a la de las mujeres no lactantes con asma de otros estudios. La leche materna obtenida más de ocho horas después de la dosis reveló que la concentración máxima de budesonida para las dosis de 400 y 800 mcg fue de 0,39 y 0,78 nmol/L, respectivamente, y se produjo dentro de los 45 minutos posteriores a la administración de la dosis. La dosis diaria oral estimada de budesonida de la leche materna al lactante fue de aproximadamente 0,007 y 0,014 mcg/kg/día para los dos regímenes de dosis utilizados en este estudio, lo que representa aproximadamente del 0,3 % al 1 % de la dosis inhalada por la madre. Los niveles de budesonida en muestras de plasma obtenidas de cinco lactantes aproximadamente 90 minutos después de amamantar (y aproximadamente 140 minutos después de la administración del fármaco a la madre) estaban por debajo de los niveles cuantificables ( Uso en poblaciones específicas, madres lactantes ].
Insuficiencia renal o hepática
No se ha investigado la farmacocinética de budesonida en pacientes con insuficiencia renal. La función hepática reducida puede afectar la eliminación de los corticosteroides. La farmacocinética de la budesonida se vio afectada por la función hepática comprometida, como lo demuestra una disponibilidad sistémica duplicada después de la ingestión oral. No se ha establecido la relevancia de este hallazgo para la budesonida administrada por vía intranasal.
Interacciones fármaco-fármaco
Inhibidores de las enzimas del citocromo P450
Ketoconazol: El ketoconazol, un potente inhibidor de la isoenzima 3A4 (CYP3A4) del citocromo P450 (CYP), la principal enzima metabólica de los corticosteroides, aumentó los niveles plasmáticos de budesonida ingerida por vía oral [ver ADVERTENCIAS Y PRECAUCIONES y INTERACCIONES CON LA DROGAS ].
Cimetidina: A las dosis recomendadas, la cimetidina, un inhibidor no específico de las enzimas CYP, tuvo un efecto leve pero clínicamente insignificante sobre la farmacocinética de la budesonida oral.
Toxicología y/o Farmacología Animal
La budesonida fue teratogénica y embriocida en conejos y ratas. La budesonida produjo pérdida fetal, disminución del peso de las crías y anomalías esqueléticas a una dosis subcutánea de 25 mcg/kg en conejos (aproximadamente 2 veces la dosis intranasal diaria máxima recomendada en adultos sobre una base de mcg/m2) y a una dosis subcutánea de 500 mcg /kg en ratas (aproximadamente 16 veces la dosis intranasal diaria máxima recomendada en adultos sobre una base de mcg/m2). No se observaron efectos teratogénicos o embriocidas en ratas cuando se administró budesonida por inhalación en dosis de hasta 250 mcg/kg (aproximadamente 8 veces la dosis intranasal diaria máxima recomendada en adultos sobre una base de mcg/m2).
Estudios clínicos
La eficacia terapéutica del aerosol nasal RHINOCORT AQUA (budesonida) se evaluó en ensayos clínicos controlados con placebo de rinitis alérgica estacional y perenne de 3 a 6 semanas de duración.
El número de pacientes tratados con budesonida en estos estudios fue de 90 hombres y 51 mujeres de 6 a 12 años y 691 hombres y 694 mujeres de 12 años o más. Los pacientes eran predominantemente caucásicos.
En general, los resultados de estos ensayos clínicos mostraron que el aerosol nasal RHINOCORT AQUA (budesonida) administrado una vez al día proporciona una reducción estadísticamente significativa en la gravedad de los síntomas nasales de la rinitis alérgica estacional y perenne, que incluyen secreción nasal, estornudos y congestión nasal.
Se puede notar una mejoría en los síntomas nasales en pacientes dentro de las 10 horas posteriores al primer uso del aerosol nasal RHINOCORT 100 mcg AQUA (budesonida). Este tiempo hasta el inicio está respaldado por un estudio de unidad de exposición ambiental en pacientes con rinitis alérgica estacional que demostró que el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) condujo a una mejora estadísticamente significativa en los síntomas nasales en comparación con el placebo en 10 horas. El apoyo adicional proviene de un estudio clínico de pacientes con rinitis alérgica perenne que demostró una mejora estadísticamente significativa en los síntomas nasales tanto para el aerosol nasal RHINOCORT AQUA (budesonida) como para el comparador activo (furoato de mometasona) en comparación con el placebo en 8 horas. El inicio también se evaluó en este estudio con la tasa de flujo inspiratorio nasal máximo y este criterio de valoración no demostró eficacia para ninguno de los tratamientos activos. Aunque se observaron mejoras estadísticamente significativas en los síntomas nasales en comparación con el placebo dentro de las 8 a 10 horas en estos estudios, alrededor de la mitad a dos tercios de la mejoría clínica final con RHINOCORT 100 mcg AQUA (budesonida) en aerosol nasal ocurre durante los primeros 1 a 2 días. y es posible que no se logre el beneficio máximo hasta aproximadamente 2 semanas después del inicio del tratamiento.
REFERENCIAS Kallen B, Rydhstroem H, Aberg A. Malformaciones congénitas después del uso de budesonida inhalada al principio del embarazo. Obstet Gynecol 1999; 93:392-395. @sesenta y cinco Ericson A, Kallen B. Uso de medicamentos durante el embarazo: método de registro sueco único que puede mejorarse. Agencia Sueca de Productos Médicos 1999; 1:8-11. @sesenta y cinco Norjavaara E, Gerhardsson de Verdier M. Resultados normales del embarazo en un estudio poblacional que incluyó a 2968 mujeres embarazadas expuestas a budesonida. J Alergia Clin Immunol 2003;! 11:736-742.INFORMACIÓN DEL PACIENTE
RHINOCORT 100 mcg AQUA (budesonida) ® (RINE-o-cort AH-kwa) (budesonida) Aerosol nasal
Solo para uso en la nariz.
Lea la información para el paciente que viene con el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) antes de comenzar a usarlo y cada vez que renueve su receta. Es posible que haya nueva información. Esta información no reemplaza la conversación con su proveedor de atención médica sobre su condición médica o tratamiento. Si tiene preguntas sobre el aerosol nasal RHINOCORT AQUA (budesonida), consulte a su proveedor de atención médica o farmacéutico.
¿Qué es el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida)?
El aerosol nasal RHINOCORT AQUA (budesonida) es un medicamento recetado que se usa para tratar los síntomas de alergia estacionales y durante todo el año en adultos y niños a partir de los 6 años de edad.
El aerosol nasal RHINOCORT AQUA contiene budesonida, que es un corticoesteroide artificial (sintético). Los corticosteroides intranasales son hormonas naturales que se encuentran en el cuerpo y que reducen la inflamación del revestimiento de la nariz. Cuando se rocía el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) en la nariz, ayuda a reducir los síntomas nasales de la rinitis alérgica (inflamación del revestimiento de la nariz), como congestión nasal, secreción nasal, picazón y estornudos.
No se ha demostrado la seguridad y eficacia del aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) en niños menores de 6 años.
¿Quién no debe usar el aerosol nasal RHINOCORT AQUA (budesonida)?
No use el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida):
- si es alérgico a la budesonida o a cualquiera de los ingredientes del aerosol nasal RHINOCORT AQUA. Consulte el final de este folleto para obtener una lista completa de los ingredientes en el aerosol nasal RHINOCORT AQUA (budesonida).
¿Qué debo decirle a mi proveedor de atención médica antes de usar el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida)?
Antes de usar el aerosol nasal RHINOCORT AQUA (budesonida), informe a su proveedor de atención médica o farmacéutico si usted:
- han estado recientemente cerca de alguien con varicela o sarampión
- tiene problemas hepáticos
- tiene alguna infección no tratada
- ha tenido alguna vez una infección llamada tuberculosis
- tener una infección en los ojos
- ha tenido recientemente una cirugía o una lesión en la nariz
- tiene otras condiciones médicas
- está embarazada o planea quedar embarazada. No se sabe si el aerosol nasal RHINOCORT 100mcg AQUA (budesonide) dañará al bebé nonato. Hable con su médico si está embarazada o planea quedar embarazada.
- están amamantando o planean amamantar. El aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) puede pasar a la leche materna. Hable con su médico acerca de la mejor manera de alimentar a su bebé si toma el aerosol nasal RHINOCORT AQUA (budesonida).
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos herbales.
El aerosol nasal RHINOCORT AQUA (budesonida) puede afectar la forma en que funcionan otros medicamentos, y otros medicamentos pueden afectar el funcionamiento de RHINOCORT 100 mcg AQUA (budesonida) en aerosol nasal.
Conozca los medicamentos que toma. Mantenga una lista de sus medicamentos con usted para mostrársela a su proveedor de atención médica y farmacéutico cuando obtenga un nuevo medicamento.
¿Cómo debo usar el aerosol nasal RHINOCORT 100mcg AQUA (budesonida)?
- El aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) se usa solo en la nariz. No lo rocíe en sus ojos o boca.
- Use el aerosol nasal RHINOCORT AQUA (budesonida) exactamente como se lo indique su proveedor de atención médica.
- Es muy importante que use el aerosol nasal RHINOCORT AQUA (budesonida) con regularidad. No deje de usar el aerosol nasal RHINOCORT AQUA (budesonida) ni cambie su dosis sin hablar con su proveedor de atención médica, incluso si se siente mejor.
- Hable con su proveedor de atención médica si sus síntomas no mejoran después de tomar el aerosol nasal RHINOCORT AQUA (budesonida) durante 2 semanas o si sus síntomas empeoran.
- Un adulto debe ayudar a un niño pequeño a usar este medicamento.
- Consulte las Instrucciones de uso para el paciente al final de este prospecto para obtener información completa sobre cómo usar el aerosol nasal RHINOCORT AQUA (budesonida).
¿Cuáles son los posibles efectos secundarios del aerosol nasal RHINOCORT AQUA (budesonida)?
El aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) puede causar efectos secundarios graves, que incluyen:
- agujero en el cartílago dentro de la nariz (perforación del tabique nasal). Informe a su proveedor de atención médica si tiene un silbido en la nariz cuando respira.
- cicatrización lenta de heridas. No debe usar el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) hasta que su nariz haya sanado si tiene una llaga en la nariz, si se sometió a una cirugía en la nariz o si se lesionó la nariz.
- infección por hongos en la nariz.
- reacciones alérgicas. Informe a su proveedor de atención médica u obtenga ayuda médica de inmediato si tiene:
- erupción cutánea, enrojecimiento o hinchazón
- picazón severa
- hinchazón de la cara, boca y lengua
- problemas del sistema inmunitario que pueden aumentar el riesgo de infecciones. Es más probable que contraiga infecciones si toma medicamentos que debilitan la capacidad de su cuerpo para combatir infecciones. Evite el contacto con personas que tengan enfermedades contagiosas como varicela o sarampión mientras usa el aerosol nasal RHINOCORT AQUA (budesonida). Los síntomas de infección pueden incluir fiebre, dolor, dolores, escalofríos, cansancio, náuseas y vómitos.
- insuficiencia suprarrenal, La insuficiencia suprarrenal es una afección en la que las glándulas suprarrenales no producen suficientes hormonas esteroides. Los síntomas de insuficiencia suprarrenal pueden incluir cansancio, debilidad, náuseas, vómitos y presión arterial baja.
- crecimiento lento o retrasado en los niños. El crecimiento de un niño debe controlarse regularmente mientras usa el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida).
- problemas oculares, como glaucoma y cataratas. Informe a su proveedor de atención médica si tiene un cambio en la visión o tiene antecedentes de aumento de la presión intraocular, glaucoma o cataratas.
Llame a su proveedor de atención médica u obtenga ayuda médica de inmediato si tiene síntomas de cualquiera de los efectos secundarios graves mencionados anteriormente.
Los efectos secundarios más comunes del aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) incluyen:
- hemorragia nasal
- dolor de garganta
- dificultades para respirar, como sibilancias u opresión en el pecho
- tos
- irritación de la nariz
Informe a su proveedor de atención médica si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios del aerosol nasal RHINOCORT 100 mcg AQUA (budesonida). Para obtener más información, consulte a su proveedor de atención médica o farmacéutico.
Llame a su proveedor de atención médica para recibir asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
Puede informar los efectos secundarios a AstraZeneca al 1-800-236-9933.
¿Qué debo saber sobre la rinitis alérgica?
"Rinitis" significa inflamación del revestimiento de la nariz. A veces se le llama "fiebre del heno". La rinitis alérgica puede ser causada por alergias al polen, la caspa de los animales, los ácaros del polvo doméstico y las esporas de moho. Si tiene rinitis alérgica, la nariz se le tapa, moquea y le pica. También puede estornudar mucho. Es posible que tenga los ojos rojos, con picazón y llorosos; picazón en la garganta; u orejas tapadas y con picazón.
El aerosol nasal RHINOCORT AQUA (budesonida) ayuda a aliviar los síntomas nasales.
Si también tiene ojos llorosos y con picazón, debe informar a su proveedor de atención médica. Él o ella puede prescribir medicamentos adicionales para tratar estos síntomas.
¿Cómo debo almacenar el aerosol nasal RHINOCORT AQUA (budesonida)?
- Guarde el aerosol nasal RHINOCORT AQUA (budesonida) entre 20 °C y 25 °C (68 °F y 77 °F).
- No congele el aerosol nasal RHINOCORT AQUA (budesonida).
- Proteja el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) de la luz.
- No use el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) después de haber usado la cantidad de aerosoles indicada en la etiqueta (no incluye el cebado) o después de la fecha de vencimiento que se muestra en la etiqueta del envase o la botella.
- Mantenga la tapa protectora verde del aerosol nasal RHINOCORT AQUA (budesonida) cuando no esté en uso. (Por favor mira Antes de usar en el reverso ).
- Mantenga el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz del aerosol nasal RHINOCORT AQUA (budesonida):
No use el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) para una condición para la cual no fue recetado. No administre el aerosol nasal RHINOCORT AQUA (budesonida) a otras personas, incluso si tienen los mismos síntomas que usted. Puede que les haga daño.
Este folleto de información para el paciente resume la información más importante sobre el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida). Si desea obtener más información, hable con su proveedor de atención médica. Puede pedirle a su farmacéutico o proveedor de atención médica información sobre el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) que está escrito para profesionales de la salud.
Para obtener más información, visite www.astrazeneca-us.com o llame a AstraZeneca al 1-800-236-9933.
¿Cuáles son los ingredientes del aerosol nasal RHINOCORT AQUA (budesonida)?
Ingrediente activo: budesonida
Ingredientes inactivos: Celulosa microcristalina y carboximetilcelulosa sódica, dextrosa anhidra, polisorbato 80, edetato disódico, sorbato potásico, agua purificada y ácido clorhídrico.
Instrucciones de uso para el paciente
Solo para uso en la nariz. No rocíe en sus ojos o boca.
Lea atentamente las Instrucciones de uso para el paciente antes de comenzar a usar el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida). Si tiene alguna pregunta, consulte a su proveedor de atención médica
Figura A 
Cómo preparar su aerosol nasal RHINOCORT AQUA (budesonida)
Antes de usar el aerosol nasal RHINOCORT AQUA (budesonida), la botella debe estar preparada. Para preparar el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida):
1. Tire para quitar la tapa protectora verde de la unidad de pulverización nasal.
2. Agite suavemente la botella durante unos segundos antes de cada uso.
3. Sostenga la botella con firmeza, como se muestra en la Figura B, con los dedos índice y medio a ambos lados de la punta del rociador y el pulgar debajo de la botella.
Figura B 
4. Active la bomba presionando rápida y firmemente el collarín blanco mientras sujeta la base de la botella con el pulgar.
5. Antes de usar por primera vez el aerosol nasal RHINOCORT AQUA (budesonida), agite suavemente la botella. La bomba debe cebarse presionando el collarín blanco 8 veces. La bomba ya está lista para usar. Si se usa a diario, no es necesario volver a cebar la bomba. Si no se usa durante 2 días seguidos, vuelva a imprimar con 1 rociado o hasta que aparezca un rocío fino. Si no se usa durante más de 14 días, enjuague la punta del rociador de la bomba siguiendo los pasos de limpieza que se enumeran al final de este folleto. Después de limpiar, vuelva a imprimar con 2 pulverizaciones o hasta que aparezca una pulverización fina.
Cada botella de aerosol nasal RHINOCORT AQUA (budesonida) contiene suficiente medicamento para que usted rocíe el medicamento de la botella 120 veces después de que la botella esté cebada.
No debe usar el frasco de RHINOCORT 100 mcg AQUA (budesonida) en aerosol nasal después de 120 aplicaciones. Es posible que los aerosoles adicionales después de 120 no contengan la cantidad correcta de medicamento. Debe realizar un seguimiento de la cantidad de aplicaciones que usa de cada botella de RHINOCORT 100 mcg AQUA Aerosol Nasal y desechar cualquier medicamento restante que pueda quedar en la botella. Renueve su receta mensualmente.
Cómo usar el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida)
Siga estas instrucciones para el uso diario del aerosol nasal RHINOCORT AQUA (budesonida):
Figura C 
4. Inserte la punta del rociador en la fosa nasal (la punta no debe llegar demasiado adentro de la nariz). Cierre la otra fosa nasal con un dedo e incline la cabeza ligeramente hacia adelante para que el rocío apunte hacia la parte posterior de la nariz (consulte Figura D ).
Figura D 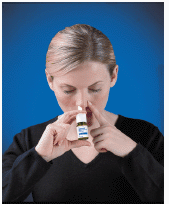
5. Para cada rociado, active la bomba presionando rápida y firmemente el collarín blanco mientras sostiene la base de la botella con el pulgar. Respire suavemente hacia adentro a través de la fosa nasal.
6. Después de rociar en la fosa nasal, incline la cabeza hacia atrás durante unos segundos (consulte Figura E ).
Figura E 
7. Si se necesita una segunda pulverización en la misma fosa nasal, repita los pasos 3 a 6.
8. Repita los pasos 3 a 7 para la otra fosa nasal.
9. Evite sonarse la nariz durante 15 minutos después de usar el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida).
10. Limpie la punta del rociador con un pañuelo limpio (consulte Figura F ), y vuelva a colocar la tapa protectora verde. Guarde la botella en posición vertical.
Figura F 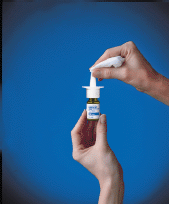
Cómo limpiar su aerosol nasal RHINOCORT 100 mcg AQUA (budesonida)
Figura G 
Enjuague la tapa protectora verde y la punta del rociador con regularidad. Para hacer esto:
Para obtener información adicional sobre el aerosol nasal RHINOCORT 100 mcg AQUA (budesonida) ®, llame al Centro de información de AstraZeneca, de lunes a viernes, de 8 a. 1-800-236-9933.
