Aciphex 10mg, 20mg Rabeprazole Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Aciphex 10 mg y cómo se usa?
Aciphex 10 mg es un medicamento recetado que se usa para tratar los síntomas de la enfermedad por reflujo gastroesofágico (ERGE), Helicobacter Pylori y úlceras intestinales. Aciphex 10 mg se puede usar solo o con otros medicamentos.
Aciphex es un inhibidor de la bomba de protones.
No se sabe si la tableta de liberación retardada de 20 mg de Aciphex es segura y efectiva en niños menores de 12 años. No se sabe si la tableta de liberación retardada de 10 mg de Aciphex (sprinkles) es segura y eficaz en niños menores de 1 año de edad.
¿Cuáles son los posibles efectos secundarios de Aciphex 10 mg?
Aciphex puede causar efectos secundarios graves que incluyen:
- dolor de estómago severo,
- diarrea con sangre,
- dolor repentino o dificultad para mover la cadera, la muñeca o la espalda,
- convulsiones (convulsiones),
- orinar menos de lo normal,
- sangre en tu orina,
- hinchazón,
- rápido aumento de peso,
- dolor en las articulaciones,
- erupción cutánea en las mejillas o los brazos que empeora con la luz solar,
- mareo,
- frecuencia cardíaca rápida o irregular,
- sacudidas o movimientos musculares espasmódicos (temblores),
- sintiéndose nervioso,
- calambres musculares o espasmos en las manos o los pies,
- tos,
- dificultad para tragar o atragantarse,
- dolor de cabeza,
- debilidad,
- hematomas,
- sangrado inusual (sangrado nasal, encías),
- orina roja o rosada,
- flujo menstrual abundante,
- heces con sangre o alquitranadas,
- tos con sangre o vómito que parece café molido,
- sangrado que es difícil de controlar,
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Aciphex incluyen:
- dolor de cabeza,
- náuseas,
- vómitos,
- Diarrea,
- estreñimiento,
- dolor de estómago,
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Aciphex. Para obtener más información, consulte a su médico o farmacéutico.
DESCRIPCIÓN
El ingrediente activo de las tabletas de liberación retardada de 20 mg de ACIPHEX es rabeprazol sódico, que es un inhibidor de la bomba de protones. Es un bencimidazol sustituido conocido químicamente como sal sódica de 2-[[[4-(3metoxipropoxi)-3-metil-2-piridinil]-metil]sulfinil]-1H-bencimidazol. Tiene una fórmula empírica de C18H20N3NaO3S y un peso molecular de 381,42. El rabeprazol sódico es un sólido de color blanco a blanco ligeramente amarillento. Es muy soluble en agua y metanol, libremente soluble en etanol, cloroformo y acetato de etilo e insoluble en éter y n-hexano. La estabilidad del rabeprazol sódico es función del pH; se degrada rápidamente en medios ácidos y es más estable en condiciones alcalinas. La figura estructural es:
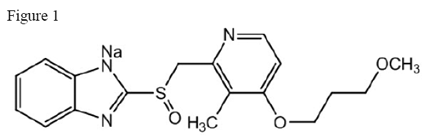
ACIPHEX está disponible para administración oral como comprimidos con cubierta entérica de liberación retardada que contienen 20 mg de rabeprazol sódico.
Los ingredientes inactivos de la tableta de 20 mg son cera de carnauba, crospovidona, monoglicéridos diacetilados, etilcelulosa, hidroxipropilcelulosa, ftalato de hipromelosa, estearato de magnesio, manitol, propilenglicol, hidróxido de sodio, estearilfumarato de sodio, talco y dióxido de titanio. El óxido de hierro amarillo es el agente colorante para el recubrimiento de las tabletas. El óxido de hierro rojo es el pigmento de la tinta.
INDICACIONES
Curación de la ERGE erosiva o ulcerativa en adultos
Los comprimidos de liberación retardada de 20 mg de ACIPHEX están indicados para el tratamiento a corto plazo (4 a 8 semanas) en la curación y el alivio sintomático de la enfermedad por reflujo gastroesofágico (ERGE) erosiva o ulcerosa. Para aquellos pacientes que no hayan sanado después de 8 semanas de tratamiento, se puede considerar un ciclo adicional de ACIPHEX de 8 semanas.
Mantenimiento de la cicatrización de la ERGE erosiva o ulcerativa en adultos
Los comprimidos de liberación retardada de ACIPHEX están indicados para mantener la cicatrización y reducir las tasas de recaída de los síntomas de acidez estomacal en pacientes con enfermedad por reflujo gastroesofágico erosivo o ulcerativo (mantenimiento por ERGE). Los estudios controlados no se extienden más allá de 12 meses.
Tratamiento de la ERGE sintomática en adultos
Los comprimidos de liberación retardada de 20 mg de ACIPHEX están indicados para el tratamiento de la acidez estomacal diurna y nocturna y otros síntomas asociados con la ERGE en adultos hasta por 4 semanas.
Curación de úlceras duodenales en adultos
Los comprimidos de liberación retardada de 20 mg de ACIPHEX están indicados para el tratamiento a corto plazo (hasta cuatro semanas) en la cicatrización y el alivio sintomático de las úlceras duodenales. La mayoría de los pacientes se curan en cuatro semanas.
Erradicación de Helicobacter Pylori para reducir el riesgo de recurrencia de la úlcera duodenal en adultos
Las tabletas de liberación retardada de 10 mg de ACIPHEX, en combinación con amoxicilina y claritromicina como un régimen de tres medicamentos, están indicadas para el tratamiento de pacientes con infección por H. pylori y enfermedad de úlcera duodenal (activa o con antecedentes en los últimos 5 años) para erradicar H. pylori . Se ha demostrado que la erradicación de H. pylori reduce el riesgo de recurrencia de la úlcera duodenal.
En los pacientes en los que fracasa el tratamiento, se deben realizar pruebas de susceptibilidad. Si se demuestra resistencia a la claritromicina o no es posible realizar una prueba de susceptibilidad, se debe instituir una terapia antimicrobiana alternativa [ver FARMACOLOGÍA CLÍNICA y la información de prescripción completa de la claritromicina].
Tratamiento de afecciones hipersecretoras patológicas, incluido el síndrome de Zollinger-Ellison en adultos
Los comprimidos de liberación retardada de ACIPHEX están indicados para el tratamiento a largo plazo de afecciones hipersecretoras patológicas, incluido el síndrome de Zollinger-Ellison.
Tratamiento de la ERGE sintomática en pacientes adolescentes de 12 años de edad y mayores
Los comprimidos de liberación retardada de 20 mg de ACIPHEX están indicados para el tratamiento de la ERGE sintomática en adolescentes a partir de los 12 años durante un máximo de 8 semanas.
DOSIFICACIÓN Y ADMINISTRACIÓN
La Tabla 1 muestra la dosis recomendada de ACIPHEX comprimidos de liberación retardada en pacientes adultos y adolescentes a partir de los 12 años de edad. No se recomienda el uso de tabletas de liberación retardada de ACIPHEX en pacientes pediátricos de 1 año a menos de 12 años porque la concentración más baja disponible de la tableta (20 mg) excede la dosis recomendada para estos pacientes. Use otra formulación de rabeprazol para pacientes pediátricos de 1 año a menos de 12 años.
Instrucciones de administración
- Trague los comprimidos de liberación retardada de 20 mg de ACIPHEX enteros. No mastique, triture ni parta las tabletas.
- Para el tratamiento de las úlceras duodenales, tome los comprimidos de liberación retardada de ACIPHEX después de una comida.
- Para la erradicación de Helicobacter pylori, tome ACIPHEX 20 mg comprimidos de liberación retardada con alimentos.
- Para todas las demás indicaciones, los comprimidos de liberación retardada de ACIPHEX se pueden tomar con o sin alimentos.
- Tome una dosis olvidada tan pronto como sea posible. Si es casi la hora de la próxima dosis, omita la dosis olvidada y vuelva al horario normal. No tome dos dosis al mismo tiempo.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Las tabletas de liberación retardada de 10 mg de ACIPHEX se proporcionan en una concentración de 20 mg. Los comprimidos son redondos, de color amarillo claro, con cubierta entérica, biconvexos. “ACIPHEX 20” está impreso en rojo en un lado de la tableta.
Almacenamiento y manipulación
ACIPHEX 20 mg se suministra en forma de comprimidos con cubierta entérica de color amarillo claro de liberación retardada. El nombre y la concentración, en mg, (ACIPHEX 20) están impresos en un lado.
Botellas de 30 ( CDN 69784-243-30)
Almacenar a 25°C (77°F); excursiones permitidas a 15-30°C (59-86°F) [ver Temperatura ambiente controlada por USP ]. Proteger de la humedad.
Distribuido por Eisai Inc., Woodcliff Lake, NJ 07677. Revisado: marzo de 2022
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas graves se describen a continuación y en otras partes del etiquetado:
- Nefritis tubulointersticial aguda [ver ADVERTENCIAS Y PRECAUCIONES ]
- Diarrea asociada a Clostridium difficile [ver ADVERTENCIAS Y PRECAUCIONES ]
- Fractura ósea [ver ADVERTENCIAS Y PRECAUCIONES ]
- Reacciones adversas cutáneas graves [ver ADVERTENCIAS Y PRECAUCIONES ]
- Lupus eritematoso cutáneo y sistémico [ver ADVERTENCIAS Y PRECAUCIONES ]
- Deficiencia de cianocobalamina (vitamina B-12) [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hipomagnesemia y metabolismo mineral [ver ADVERTENCIAS Y PRECAUCIONES ]
- Pólipos de las glándulas fúndicas [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en estudios clínicos
Debido a que los ensayos clínicos se realizan en condiciones variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Adultos
Los datos que se describen a continuación reflejan la exposición a las tabletas de liberación retardada de ACIPHEX en 1064 pacientes adultos expuestos hasta por 8 semanas. Los estudios fueron principalmente ensayos controlados con placebo y activo en pacientes adultos con enfermedad por reflujo gastroesofágico (ERGE) erosiva o ulcerosa, úlceras duodenales y úlceras gástricas. La población tenía una edad media de 53 años (rango 18-89 años) y tenía una proporción de aproximadamente 60% hombres: 40% mujeres. La distribución racial fue 86% caucásica, 8% afroamericana, 2% asiática y 5% otra. La mayoría de los pacientes recibieron 10 mg, 20 mg o 40 mg al día de comprimidos de liberación retardada de 20 mg de ACIPHEX.
Un análisis de las reacciones adversas que aparecieron en ≥2 % de los pacientes tratados con comprimidos de liberación retardada de 10 mg de ACIPHEX (n=1064) y con mayor frecuencia que con placebo (n=89) en ensayos controlados de tratamiento agudo en América del Norte y Europa, reveló lo siguiente reacciones adversas: dolor (3 % frente a 1 %), faringitis (3 % frente a 2 %), flatulencia (3 % frente a 1 %), infección (2 % frente a 1 %) y estreñimiento (2 % frente a 1 %). 1%).
Tres estudios de mantenimiento a largo plazo consistieron en un total de 740 pacientes adultos; al menos el 54 % de los pacientes adultos estuvo expuesto a ACIPHEX 20 mg comprimidos de liberación retardada durante 6 meses y al menos el 33 % estuvo expuesto durante 12 meses. De los 740 pacientes adultos, 247 (33 %) y 241 (33 %) pacientes recibieron 10 mg y 20 mg de ACIPHEX 20 mg comprimidos de liberación retardada, respectivamente, mientras que 169 (23 %) pacientes recibieron placebo y 83 (11 %) recibieron omeprazol.
El perfil de seguridad de rabeprazol en los estudios de mantenimiento en adultos fue consistente con lo observado en los estudios agudos.
Las reacciones adversas menos frecuentes observadas en ensayos clínicos controlados (
Tratamiento combinado con amoxicilina y claritromicina
En los ensayos clínicos que utilizaron la terapia de combinación con rabeprazol más amoxicilina y claritromicina (RAC), no se observaron reacciones adversas exclusivas de esta combinación de medicamentos. En el estudio multicéntrico de EE. UU., las reacciones adversas relacionadas con el fármaco notificadas con mayor frecuencia en pacientes que recibieron tratamiento con RAC durante 7 o 10 días fueron diarrea (8 % y 7 %) y alteración del gusto (6 % y 10 %), respectivamente.
No se observaron anomalías de laboratorio clínicamente significativas particulares de las combinaciones de fármacos.
Para obtener más información sobre reacciones adversas o cambios de laboratorio con amoxicilina o claritromicina, consulte la información de prescripción respectiva, sección Reacciones adversas.
Pediatría
En un estudio abierto multicéntrico de pacientes adolescentes de 12 a 16 años de edad con un diagnóstico clínico de ERGE sintomática o ERGE comprobada por endoscopia, el perfil de eventos adversos fue similar al de los adultos. Las reacciones adversas notificadas sin tener en cuenta la relación con los comprimidos de liberación retardada de 20 mg de ACIPHEX que ocurrieron en ≥2 % de 111 pacientes fueron dolor de cabeza (9,9 %), diarrea (4,5 %), náuseas (4,5 %), vómitos (3,6 %) y dolor abdominal (3,6%). Las reacciones adversas notificadas relacionadas que ocurrieron en ≥2 % de los pacientes fueron dolor de cabeza (5,4 %) y náuseas (1,8 %). No se informaron reacciones adversas en este estudio que no se hayan observado previamente en adultos.
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de rabeprazol. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco:
Trastornos de la sangre y del sistema linfático: agranulocitosis, anemia hemolítica, leucopenia, pancitopenia, trombocitopenia
Trastornos del oído y del laberinto: vértigo
Trastornos oculares: visión borrosa
Desórdenes gastrointestinales: pólipos de las glándulas fúndicas
Desordenes generales y condiciones administrativas del sitio: la muerte súbita
Trastornos hepatobiliares: ictericia
Trastornos del sistema inmunológico: anafilaxia, angioedema, lupus eritematoso sistémico, síndrome de Stevens-Johnson, necrólisis epidérmica tóxica (algunas fatales), DRESS, AGEP
Infecciones e infestaciones: Diarrea asociada a Clostridium difficile
Investigaciones: Aumentos en el tiempo de protrombina/INR (en pacientes tratados con warfarina concomitante), elevaciones de TSH
Trastornos del metabolismo y la nutrición: hiperamonemia, hipomagnesemia, hipocalcemia, hipopotasemia [Advertencias y precauciones 5.8], hiponatremia
Trastornos del sistema musculoesquelético: fractura ósea, rabdomiolisis
Trastornos del sistema nervioso: coma
Desórdenes psiquiátricos: delirio, desorientación
Trastornos renales y urinarios: nefritis intersticial
Trastornos respiratorios, torácicos y mediastínicos: neumonía intersticial
Trastornos de la piel y del tejido subcutáneo: reacciones dermatológicas graves que incluyen ampollas y otras erupciones medicamentosas de la piel, lupus eritematoso cutáneo, eritema multiforme
INTERACCIONES CON LA DROGAS
La Tabla 2 incluye medicamentos con interacciones medicamentosas clínicamente importantes e interacción con diagnósticos cuando se administran concomitantemente con ACIPHEX 10 mg tabletas de liberación retardada e instrucciones para prevenirlas o manejarlas.
Consulte la etiqueta de los medicamentos utilizados de forma concomitante para obtener más información sobre las interacciones con los IBP.
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Presencia de malignidad gástrica
En adultos, la respuesta sintomática al tratamiento con ACIPHEX 10 mg no excluye la presencia de cáncer gástrico. Considere un seguimiento adicional y pruebas de diagnóstico en pacientes adultos que tienen una respuesta subóptima o una recaída sintomática temprana después de completar el tratamiento con un IBP.
Interacción con warfarina
Las interacciones en estado estacionario de rabeprazol y warfarina no se han evaluado adecuadamente en pacientes. Ha habido informes de aumento del INR y del tiempo de protrombina en pacientes que reciben un inhibidor de la bomba de protones y warfarina de forma concomitante. Los aumentos en el INR y el tiempo de protrombina pueden provocar sangrado anormal e incluso la muerte. Los pacientes tratados con comprimidos de liberación retardada de 10 mg de ACIPHEX y warfarina de manera concomitante pueden necesitar ser monitoreados para detectar aumentos en el INR y el tiempo de protrombina [ver INTERACCIONES CON LA DROGAS ].
Nefritis tubulointersticial aguda
Se ha observado nefritis tubulointersticial aguda (TIN) en pacientes que toman IBP y puede ocurrir en cualquier momento durante la terapia con IBP. Los pacientes pueden presentar diversos signos y síntomas, desde reacciones de hipersensibilidad sintomática hasta síntomas no específicos de disminución de la función renal (p. ej., malestar general, náuseas, anorexia). En las series de casos notificadas, algunos pacientes fueron diagnosticados mediante biopsia y en ausencia de manifestaciones extrarrenales (p. ej., fiebre, exantema o artralgia).
Suspender ACIPHEX y evaluar a los pacientes con sospecha de TIN aguda [ver CONTRAINDICACIÓN ].
Diarrea asociada a Clostridium difficile
Los estudios observacionales publicados sugieren que la terapia con PPI como ACIPHEX puede estar asociada con un mayor riesgo de diarrea asociada con Clostridium difficile, especialmente en pacientes hospitalizados. Este diagnóstico debe considerarse para la diarrea que no mejora [ver REACCIONES ADVERSAS ].
Los pacientes deben usar la dosis más baja y la duración más corta de la terapia con IBP apropiada para la afección que se está tratando.
Se ha informado diarrea asociada a Clostridium difficile (CDAD) con el uso de casi todos los agentes antibacterianos. Para obtener más información específica sobre los agentes antibacterianos (claritromicina y amoxicilina) indicados para usar en combinación con ACIPHEX, consulte las secciones de Advertencias y Precauciones de la información de prescripción correspondiente.
Fractura de hueso
Varios estudios observacionales publicados en adultos sugieren que la terapia con IBP puede estar asociada con un mayor riesgo de fracturas de cadera, muñeca o columna relacionadas con la osteoporosis. El riesgo de fractura aumentó en pacientes que recibieron dosis altas, definidas como múltiples dosis diarias, y terapia con IBP a largo plazo (un año o más). Los pacientes deben usar la dosis más baja y la duración más corta de la terapia con IBP apropiada para la afección que se está tratando. Los pacientes con riesgo de fracturas relacionadas con la osteoporosis deben ser tratados de acuerdo con las pautas de tratamiento establecidas [ver DOSIFICACIÓN Y ADMINISTRACIÓN , REACCIONES ADVERSAS ].
Reacciones adversas cutáneas graves
Se han notificado reacciones adversas cutáneas graves, como el síndrome de Stevens-Johnson (SJS) y la necrólisis epidérmica tóxica (TEN), la reacción al fármaco con eosinofilia y síntomas sistémicos (DRESS) y la pustulosis exantemática aguda generalizada (PEGA) en asociación con el uso de IBP. [ver REACCIONES ADVERSAS ]. Suspenda ACIPHEX ante los primeros signos o síntomas de reacciones adversas cutáneas graves u otros signos de hipersensibilidad y considere una evaluación adicional.
Lupus Eritematoso Cutáneo Y Sistémico
Se han notificado casos de lupus eritematoso cutáneo (CLE) y lupus eritematoso sistémico (LES) en pacientes que toman IBP, incluido rabeprazol. Estos eventos han ocurrido como un nuevo inicio y una exacerbación de la enfermedad autoinmune existente. La mayoría de los casos de lupus eritematoso inducido por PPI fueron LEC.
La forma más común de LEC notificada en pacientes tratados con IBP fue la LEC subaguda (SCLE) y se produjo semanas o años después de la terapia farmacológica continua en pacientes que iban desde bebés hasta ancianos. En general, los hallazgos histológicos se observaron sin afectación de órganos.
El lupus eritematoso sistémico (LES) se notifica con menos frecuencia que el LEC en pacientes que reciben IBP. El LES asociado con IBP suele ser más leve que el LES no inducido por fármacos. El inicio del LES generalmente ocurre dentro de los días o años después de iniciar el tratamiento, principalmente en pacientes que van desde adultos jóvenes hasta ancianos. La mayoría de los pacientes presentaron erupción cutánea; sin embargo, también se informaron artralgia y citopenia.
Evitar la administración de IBP por más tiempo del indicado médicamente. Si se observan signos o síntomas compatibles con CLE o SLE en pacientes que reciben ACIPHEX, suspenda el medicamento y remita al paciente al especialista adecuado para su evaluación. La mayoría de los pacientes mejoran con la interrupción del PPI solo en 4 a 12 semanas. Las pruebas serológicas (p. ej., ANA) pueden ser positivas y los resultados elevados de las pruebas serológicas pueden tardar más en resolverse que las manifestaciones clínicas.
Deficiencia de cianocobalamina (vitamina B-12)
El tratamiento diario con medicamentos supresores de ácido durante un período prolongado (p. ej., más de 3 años) puede conducir a una malabsorción de cianocobalamina (vitamina B-12) causada por hipoclorhidria o aclorhidria. Se han informado en la literatura informes raros de deficiencia de cianocobalamina que ocurren con la terapia supresora de ácido. Se debe considerar este diagnóstico si se observan síntomas clínicos compatibles con la deficiencia de cianocobalamina en pacientes tratados con ACIPHEX.
Hipomagnesemia y metabolismo mineral
Raramente se ha informado hipomagnesemia, sintomática y asintomática, en pacientes tratados con IBP durante al menos tres meses, en la mayoría de los casos después de un año de terapia. Los eventos adversos graves incluyen tetania, arritmias y convulsiones. La hipomagnesemia puede provocar hipocalcemia y/o hipopotasemia y puede exacerbar la hipocalcemia subyacente en pacientes de riesgo. En la mayoría de los pacientes, el tratamiento de la hipomagnesemia requirió la reposición de magnesio y la interrupción del PPI.
Para los pacientes que se espera que reciban un tratamiento prolongado o que toman IBP con medicamentos como digoxina o medicamentos que pueden causar hipomagnesemia (p. ej., diuréticos), los profesionales de la salud pueden considerar monitorear los niveles de magnesio antes de iniciar el tratamiento con IBP y periódicamente [ver REACCIONES ADVERSAS ].
Considere monitorear los niveles de magnesio y calcio antes de iniciar ACIPHEX y periódicamente durante el tratamiento en pacientes con un riesgo preexistente de hipocalcemia (p. ej., hipoparatiroidismo). Suplementar con magnesio y/o calcio según sea necesario. Si la hipocalcemia es refractaria al tratamiento, considere suspender el IBP.
Interacción con metotrexato
La literatura sugiere que el uso concomitante de PPI con metotrexato (principalmente en dosis altas; consulte la información de prescripción de metotrexato) puede elevar y prolongar las concentraciones séricas de metotrexato y/o su metabolito, lo que posiblemente provoque toxicidad por metotrexato. En la administración de dosis altas de metotrexato, en algunos pacientes se puede considerar la suspensión temporal del IBP [ver INTERACCIONES CON LA DROGAS ].
Pólipos de las glándulas fúndicas
El uso de PPI se asocia con un mayor riesgo de pólipos en las glándulas fúndicas que aumenta con el uso a largo plazo, especialmente más allá de un año. La mayoría de los usuarios de PPI que desarrollaron pólipos en las glándulas fúndicas eran asintomáticos y los pólipos en las glándulas fúndicas se identificaron incidentalmente en la endoscopia. Use la duración más corta de la terapia con PPI apropiada para la afección que se está tratando.
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( Guía de medicamentos ).
Nefritis tubulointersticial aguda
Aconseje al paciente o cuidador que llame al proveedor de atención médica del paciente de inmediato si experimenta signos y/o síntomas asociados con la nefritis tubulointersticial aguda [ver ADVERTENCIAS Y PRECAUCIONES ].
Diarrea asociada a Clostridium difficile
Aconseje al paciente o cuidador que llame inmediatamente al proveedor de atención médica del paciente si experimenta diarrea que no mejora [ver ADVERTENCIAS Y PRECAUCIONES ].
Fractura de hueso
Aconseje al paciente o cuidador que notifique cualquier fractura, especialmente de cadera, muñeca o columna, al proveedor de atención médica del paciente [ver ADVERTENCIAS Y PRECAUCIONES ].
Reacciones adversas cutáneas graves
Aconseje al paciente o cuidador que suspenda ACIPHEX 20 mg e informe cualquier signo y síntoma de una reacción adversa cutánea grave u otro signo de hipersensibilidad al proveedor de atención médica [ver ADVERTENCIAS Y PRECAUCIONES ].
Lupus Eritematoso Cutáneo Y Sistémico
Aconseje al paciente o cuidador que llame de inmediato al proveedor de atención médica del paciente ante cualquier síntoma nuevo o empeoramiento de los síntomas asociados con el lupus eritematoso cutáneo o sistémico [ver ADVERTENCIAS Y PRECAUCIONES ].
Deficiencia de cianocobalamina (vitamina B-12)
Aconseje al paciente o cuidador que informe al proveedor de atención médica del paciente sobre cualquier síntoma clínico que pueda estar asociado con la deficiencia de cianocobalamina si ha estado recibiendo ACIPHEX 20 mg durante más de 3 años [ver ADVERTENCIAS Y PRECAUCIONES ].
Hipomagnesemia y metabolismo mineral
Aconseje al paciente o cuidador que informe al proveedor de atención médica del paciente sobre cualquier síntoma clínico que pueda estar asociado con hipomagnesemia, hipocalcemia, hipopotasemia e hiponatremia, si ha estado recibiendo ACIPHEX durante al menos 3 meses [ver ADVERTENCIAS Y PRECAUCIONES ].
Interacciones con la drogas
Aconseje a los pacientes que informen a su proveedor de atención médica si están tomando productos que contienen rilpivirina [ver CONTRAINDICACIONES ], warfarina, digoxina o metotrexato en dosis altas [ver ADVERTENCIAS Y PRECAUCIONES ].
Administración
- Trague los comprimidos de liberación retardada de 10 mg de ACIPHEX enteros. No mastique, triture ni parta los comprimidos.
- Para el tratamiento de las úlceras duodenales, tome los comprimidos de liberación retardada de ACIPHEX después de una comida.
- Para la erradicación de Helicobacter pylori, tome ACIPHEX 20 mg comprimidos de liberación retardada con alimentos.
- Para todas las demás indicaciones, ACIPHEX 10 mg comprimidos de liberación retardada se puede tomar con o sin alimentos.
- Tome una dosis olvidada tan pronto como sea posible. Si es casi la hora de la próxima dosis, omita la dosis olvidada y vuelva al horario normal. No tome dos dosis al mismo tiempo.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
En un estudio de carcinogenicidad de 88/104 semanas en ratones CD-1, el rabeprazol en dosis orales de hasta 100 mg/kg/día no produjo ningún aumento en la aparición de tumores. La dosis más alta probada produjo una exposición sistémica a rabeprazol (AUC) de 1,40 μg•hr/mL, que es 1,6 veces la exposición humana (plasma AUC0-∞ = 0,88 μg•hr/mL) a la dosis recomendada para GERD (20 mg/ día). En un estudio de carcinogenicidad de 28 semanas en ratones transgénicos p53+/-, el rabeprazol en dosis orales de 20, 60 y 200 mg/kg/día no provocó un aumento en las tasas de incidencia de tumores pero produjo hiperplasia de la mucosa gástrica en todas las dosis. La exposición sistémica al rabeprazol en dosis de 200 mg/kg/día es de aproximadamente 17 a 24 veces la exposición humana a la dosis recomendada para la ERGE. En un estudio de carcinogenicidad de 104 semanas en ratas Sprague-Dawley, los machos fueron tratados con dosis orales de 5, 15, 30 y 60 mg/kg/día y las hembras con 5, 15, 30, 60 y 120 mg/kg/día. . Rabeprazol produjo hiperplasia gástrica de células tipo enterocromafines (ECL) en ratas macho y hembra y tumores carcinoides de células ECL en ratas hembra en todas las dosis, incluida la dosis más baja probada. La dosis más baja (5 mg/kg/día) produjo una exposición sistémica al rabeprazol (AUC) de aproximadamente 0,1 μg•hr/mL, que es aproximadamente 0,1 veces la exposición humana a la dosis recomendada para la ERGE. En ratas macho, no se observaron tumores relacionados con el tratamiento a dosis de hasta 60 mg/kg/día que produjeron una exposición plasmática (AUC) de rabeprazol de aproximadamente 0,2 μg•h/mL (0,2 veces la exposición humana a la dosis recomendada para la ERGE).
El rabeprazol fue positivo en la prueba de Ames, la prueba de mutación genética directa de células de ovario de hámster chino (CHO/HGPRT) y la prueba de mutación genética directa de células de linfoma de ratón (L5178Y/TK+/–). Su metabolito desmetilado también resultó positivo en la prueba de Ames. El rabeprazol fue negativo en la prueba de aberración cromosómica de células pulmonares de hámster chino in vitro, la prueba de micronúcleos de ratón in vivo y las pruebas de síntesis de ADN no programada (UDS) de hepatocitos de rata in vivo y ex vivo.
Se encontró que el rabeprazol en dosis intravenosas de hasta 30 mg/kg/día (AUC plasmática de 8.8 μg•hr/mL, aproximadamente 10 veces la exposición humana a la dosis recomendada para la ERGE) no tiene efecto sobre la fertilidad y el rendimiento reproductivo de machos y hembras. ratas hembras
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
No hay datos disponibles en humanos sobre el uso de 10 mg de ACIPHEX en mujeres embarazadas para informar el riesgo asociado con el fármaco. Se desconoce el riesgo de fondo de defectos congénitos importantes y abortos espontáneos para las poblaciones indicadas. Sin embargo, el riesgo de antecedentes en la población general de EE. UU. de defectos congénitos importantes es del 2 al 4% y de aborto espontáneo es del 15 al 20% de los embarazos clínicamente reconocidos. No se observó evidencia de efectos adversos en el desarrollo en estudios de reproducción animal con rabeprazol administrado durante la organogénesis a 13 y 8 veces el área humana bajo la curva de concentración plasmática-tiempo (AUC) a la dosis recomendada para GERD, en ratas y conejos, respectivamente [ver Datos ].
Se observaron cambios en la morfología ósea en crías de ratas tratadas con dosis orales de un PPI diferente durante la mayor parte del embarazo y la lactancia. Cuando la administración materna se limitó únicamente a la gestación, no hubo efectos sobre la morfología fisaria ósea en la descendencia a ninguna edad [ver Datos ].
Datos
Datos de animales
Se han realizado estudios de desarrollo embriofetal en ratas durante la organogénesis con dosis intravenosas de rabeprazol de hasta 50 mg/kg/día (AUC plasmática de 11,8 μg•hr/mL, aproximadamente 13 veces la exposición humana a la dosis oral recomendada para la ERGE) y conejos en dosis intravenosas de hasta 30 mg/kg/día (AUC plasmática de 7.3 μg•hr/mL, aproximadamente 8 veces la exposición humana a la dosis oral recomendada para GERD) y no han revelado evidencia de daño al feto debido a rabeprazol.
La administración de rabeprazol a ratas al final de la gestación y durante la lactancia en una dosis oral de 400 mg/kg/día (alrededor de 195 veces la dosis oral humana basada en mg/m²) resultó en una disminución del aumento de peso corporal de las crías.
Se realizó un estudio de toxicidad en el desarrollo pre y posnatal en ratas con criterios de valoración adicionales para evaluar el desarrollo óseo con un IBP diferente de aproximadamente 3,4 a 57 veces la dosis humana oral sobre la base del área de superficie corporal. Se observó una disminución de la longitud del fémur, el ancho y el grosor del hueso cortical, una disminución del grosor de la placa de crecimiento tibial y una hipocelularidad de mínima a leve de la médula ósea con dosis de este IBP iguales o superiores a 3,4 veces una dosis humana oral en base al área de superficie corporal. . También se observó displasia fisaria en el fémur en la descendencia después de la exposición intrauterina y durante la lactancia al PPI en dosis iguales o superiores a 33,6 veces la dosis humana oral sobre la base del área de superficie corporal. Se observaron efectos sobre los huesos maternos en ratas preñadas y lactantes en un estudio de toxicidad pre y posnatal cuando se administró el PPI en dosis orales de 3,4 a 57 veces la dosis oral humana en base al área de superficie corporal. Cuando se administró la dosis a las ratas desde el día 7 de gestación hasta el destete el día 21 postnatal, se observó una disminución estadísticamente significativa en el peso del fémur materno de hasta un 14 % (en comparación con el tratamiento con placebo) en dosis iguales o superiores a 33,6 veces la dosis humana oral sobre la base de la superficie corporal.
Se realizó un estudio de toxicidad del desarrollo de seguimiento en ratas con puntos de tiempo adicionales para evaluar el desarrollo óseo de las crías desde el día 2 postnatal hasta la edad adulta con un IBP diferente en dosis orales de 280 mg/kg/día (alrededor de 68 veces una dosis humana oral en un base del área de superficie corporal) donde la administración del fármaco fue desde el día 7 de gestación o el día 16 de gestación hasta el parto. Cuando la administración materna se limitó únicamente a la gestación, no hubo efectos sobre la morfología fisaria ósea en la descendencia a ninguna edad.
Lactancia
Resumen de riesgos
No se han realizado estudios de lactancia para evaluar la presencia de rabeprazol en la leche humana, los efectos de rabeprazol en el lactante o los efectos de rabeprazol en la producción de leche. El rabeprazol está presente en la leche de rata. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de ACIPHEX de la madre y cualquier efecto adverso potencial en el lactante a causa de ACIPHEX o de la afección materna subyacente.
Uso pediátrico
La seguridad y eficacia de ACIPHEX 20 mg comprimidos de liberación retardada se han establecido en pacientes pediátricos para pacientes adolescentes de 12 años de edad y mayores para el tratamiento de la ERGE sintomática. El uso de comprimidos de liberación retardada de 20 mg de ACIPHEX en este grupo de edad está respaldado por estudios adecuados y bien controlados en adultos y un estudio multicéntrico, aleatorizado, abierto, de grupos paralelos en 111 pacientes adolescentes de 12 a 16 años de edad. Los pacientes tenían un diagnóstico clínico de ERGE sintomática, o ERGE sospechada o comprobada por endoscopia y se aleatorizaron para recibir 10 mg o 20 mg una vez al día durante un máximo de 8 semanas para la evaluación de la seguridad y la eficacia. El perfil de reacciones adversas en pacientes adolescentes fue similar al de los adultos. Las reacciones adversas notificadas relacionadas que ocurrieron en ≥2 % de los pacientes fueron dolor de cabeza (5 %) y náuseas (2 %). No se informaron reacciones adversas en estos estudios que no se observaron previamente en adultos.
No se ha establecido la seguridad y eficacia de los comprimidos de liberación retardada de 10 mg de ACIPHEX en pacientes pediátricos para:
- Curación de la ERGE erosiva o ulcerosa
- Mantenimiento de la cicatrización de la ERGE erosiva o ulcerosa
- Tratamiento de la ERGE sintomática
- Curación de Ulceras Duodenales
- Erradicación de Helicobacter pylori para reducir el riesgo de recurrencia de la úlcera duodenal
- Tratamiento de afecciones hipersecretoras patológicas, incluido el síndrome de Zollinger-Ellison
No se recomienda el uso de tabletas de 20 mg de liberación retardada de ACIPHEX en pacientes pediátricos menores de 12 años porque la concentración de la tableta excede la dosis recomendada para estos pacientes [ver DOSIFICACIÓN Y ADMINISTRACIÓN ]. Para pacientes pediátricos de 1 año a menos de 12 años, considere otra formulación de rabeprazol. Se ha establecido la seguridad y eficacia de una forma de dosificación y una concentración de dosificación diferentes de rabeprazol en pacientes pediátricos de 1 a 11 años para el tratamiento de la ERGE.
Datos de animales juveniles
Se realizaron estudios en ratas y perros jóvenes y adultos jóvenes. En estudios con animales jóvenes, se administró rabeprazol sódico por vía oral a ratas durante un máximo de 5 semanas y a perros durante un máximo de 13 semanas, cada uno comenzando el día 7 después del parto y seguido de un período de recuperación de 13 semanas. Las ratas recibieron dosis de 5, 25 o 150 mg/kg/día y los perros recibieron dosis de 3, 10 o 30 mg/kg/día. Los datos de estos estudios fueron comparables a los informados para animales adultos jóvenes. Se observaron cambios mediados farmacológicamente, incluidos niveles elevados de gastrina sérica y cambios estomacales, en todos los niveles de dosis tanto en ratas como en perros. Estas observaciones fueron reversibles durante los períodos de recuperación de 13 semanas. Aunque los pesos corporales y/o las longitudes corona-rabadilla se redujeron mínimamente durante la dosificación, no se observaron efectos sobre los parámetros de desarrollo ni en ratas jóvenes ni en perros.
Cuando los animales jóvenes fueron tratados durante 28 días con un IBP diferente en dosis iguales o superiores a 34 veces la dosis humana oral diaria en función del área de superficie corporal, el crecimiento general se vio afectado y las disminuciones relacionadas con el tratamiento en el peso corporal (aproximadamente 14 %). y aumento de peso corporal, y se observaron disminuciones en el peso y la longitud del fémur.
Uso geriátrico
Del número total de sujetos (n=2009) en estudios clínicos de ACIPHEX 20 mg comprimidos de liberación retardada, el 19 % tenía 65 años o más, mientras que el 4 % tenía 75 años o más. No se observaron diferencias generales en la seguridad o la eficacia entre estos sujetos y los sujetos más jóvenes, y otra experiencia clínica notificada no ha identificado diferencias en las respuestas entre los ancianos y los pacientes más jóvenes, pero no se puede descartar una mayor sensibilidad de algunos individuos mayores.
Deterioro hepático
La administración de tabletas de liberación retardada de ACIPHEX a pacientes con insuficiencia hepática de leve a moderada (Child-Pugh Clase A y B, respectivamente) resultó en una mayor exposición y una menor eliminación [ver FARMACOLOGÍA CLÍNICA ]. No es necesario ajustar la dosis en pacientes con insuficiencia hepática de leve a moderada. No hay información en pacientes con insuficiencia hepática grave (Child-Pugh Clase C). Evite el uso de tabletas de liberación retardada de ACIPHEX en pacientes con insuficiencia hepática grave; sin embargo, si el tratamiento es necesario, controle a los pacientes para detectar reacciones adversas [ver ADVERTENCIAS Y PRECAUCIONES , REACCIONES ADVERSAS ].
SOBREDOSIS
Se han recibido siete informes de sobredosis accidental con rabeprazol. La sobredosis máxima notificada fue de 80 mg. No hubo signos o síntomas clínicos asociados con ninguna sobredosis informada. Los pacientes con síndrome de Zollinger-Ellison han sido tratados con hasta 120 mg de rabeprazol una vez al día. No se conoce un antídoto específico para el rabeprazol. El rabeprazol se une ampliamente a las proteínas y no es fácilmente dializable.
En caso de sobredosis, el tratamiento debe ser sintomático y de soporte.
Si ocurre una sobreexposición, llame a su Centro de control de envenenamiento al 1-800-222-1222 para obtener información actualizada sobre el manejo del envenenamiento o la sobredosis.
CONTRAINDICACIONES
- ACIPHEX 10 mg está contraindicado en pacientes con hipersensibilidad conocida al rabeprazol, a los benzimidazoles sustituidos o a cualquier componente de la formulación. Las reacciones de hipersensibilidad pueden incluir anafilaxia, shock anafiláctico, angioedema, broncoespasmo, nefritis tubulointersticial aguda y urticaria [ver ADVERTENCIAS Y PRECAUCIONES , REACCIONES ADVERSAS ].
- Los IBP, incluido ACIPHEX, están contraindicados con productos que contienen rilpivirina [ver INTERACCIONES CON LA DROGAS ].
- Para obtener información sobre las contraindicaciones de los agentes antibacterianos (claritromicina y amoxicilina) indicados en combinación con ACIPHEX 20 mg comprimidos de liberación retardada, consulte la sección Contraindicaciones de sus prospectos.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
El rabeprazol pertenece a una clase de compuestos antisecretores (inhibidores de la bomba de protones de bencimidazol sustituidos) que no muestran propiedades anticolinérgicas o antagonistas de los receptores de histamina H2, pero suprimen la secreción de ácido gástrico al inhibir la H+, K+ATPasa gástrica en la superficie secretora del estómago. célula parietal. Debido a que esta enzima se considera la bomba de ácido (protones) dentro de la célula parietal, el rabeprazol se ha caracterizado como un inhibidor de la bomba de protones gástrica. El rabeprazol bloquea el paso final de la secreción de ácido gástrico.
En las células parietales gástricas, el rabeprazol se protona, se acumula y se transforma en una sulfenamida activa. Cuando se estudió in vitro, el rabeprazol se activa químicamente a pH 1,2 con una vida media de 78 segundos. Inhibe el transporte de ácido en vesículas gástricas porcinas con una vida media de 90 segundos.
Farmacodinámica
Actividad antisecretora
El efecto antisecretor comienza dentro de una hora después de la administración oral de 20 mg de ACIPHEX 20 mg comprimidos de liberación retardada. La mediana del efecto inhibitorio del rabeprazol sobre la acidez gástrica de 24 horas es del 88 % del máximo después de la primera dosis. Una dosis de 20 mg de ACIPHEX en tabletas de liberación retardada inhibe la secreción de ácido basal y estimulada por la comida de peptona en comparación con el placebo en un 86 % y un 95 %, respectivamente, y aumenta el porcentaje de un período de 24 horas en que el pH gástrico >3 del 10 % al 65% (ver tabla a continuación). Esta acción farmacodinámica relativamente prolongada en comparación con la vida media farmacocinética corta (1 a 2 horas) refleja la inactivación sostenida de la H+, K+ATPasa.
En comparación con el placebo, 10 mg, 20 mg y 40 mg de comprimidos de liberación retardada de ACIPHEX, administrados una vez al día durante 7 días, redujeron significativamente la acidez intragástrica con todas las dosis para cada uno de los cuatro intervalos relacionados con las comidas y el período de 24 horas en general. En este estudio, no hubo diferencias estadísticamente significativas entre las dosis; sin embargo, hubo una disminución significativa relacionada con la dosis en la acidez intragástrica. A continuación se ilustra la capacidad del rabeprazol para causar una disminución relacionada con la dosis en la acidez intragástrica media.

Después de la administración de 20 mg de ACIPHEX 20 mg comprimidos de liberación retardada una vez al día durante ocho días, el porcentaje medio de tiempo en que el pH gástrico fue superior a 3 o pH gástrico superior a 4 después de una dosis única (Día 1) y dosis múltiples (Día 8) fue significativamente mayor que el placebo (consulte la tabla a continuación). La disminución de la acidez gástrica y el aumento del pH gástrico observados con 20 mg de ACIPHEX 10 mg comprimidos de liberación retardada administrados una vez al día durante ocho días se compararon con los mismos parámetros para el placebo, como se ilustra a continuación:
Efectos sobre la exposición al ácido esofágico
En pacientes con ERGE y exposición al ácido esofágico de moderada a grave, una dosis de 20 mg y 40 mg por día de ACIPHEX 20 mg comprimidos de liberación retardada disminuyó la exposición al ácido esofágico durante 24 horas. Después de siete días de tratamiento, el porcentaje de tiempo que el pH esofágico fue inferior a 4 disminuyó desde los valores iniciales de 24,7 % para 20 mg y 23,7 % para 40 mg, a 5,1 % y 2,0 %, respectivamente. La normalización de la exposición al ácido intraesofágico durante 24 horas se correlacionó con un pH gástrico superior a 4 durante al menos el 35 % del período de 24 horas; este nivel se logró en el 90 % de los sujetos que recibieron ACIPHEX 20 mg y en el 100 % de los sujetos que recibieron ACIPHEX 40 mg. Con ACIPHEX 20 mg y 40 mg por día, se observaron efectos significativos en el pH gástrico y esofágico después de un día de tratamiento y más pronunciados después de siete días de tratamiento.
Efectos sobre la gastrina sérica
La mediana del nivel de gastrina en ayunas aumentó de manera relacionada con la dosis en pacientes tratados una vez al día con comprimidos de liberación retardada de 10 mg de ACIPHEX durante un máximo de ocho semanas para la esofagitis ulcerosa o erosiva y en pacientes tratados durante un máximo de 52 semanas para prevenir la recurrencia de la enfermedad. Los valores de la mediana del grupo se mantuvieron dentro del rango normal.
En un grupo de sujetos tratados con 20 mg de ACIPHEX comprimidos de liberación retardada durante 4 semanas, se observó una duplicación de las concentraciones séricas medias de gastrina. Aproximadamente el 35% de estos sujetos tratados desarrollaron concentraciones séricas de gastrina por encima del límite superior normal.
Efectos sobre las células tipo enterocromafines (ECL)
El aumento de la gastrina sérica secundario a los agentes antisecretores estimula la proliferación de células ECL gástricas que, con el tiempo, puede provocar hiperplasia de células ECL en ratas y ratones y carcinoides gástricos en ratas, especialmente en hembras [ver Toxicología no clínica ].
En más de 400 pacientes tratados con comprimidos de liberación retardada de ACIPHEX (10 o 20 mg) una vez al día durante un máximo de un año, la incidencia de hiperplasia de células ECL aumentó con el tiempo y la dosis, lo que concuerda con la acción farmacológica del inhibidor de la bomba de protones. Ningún paciente desarrolló los cambios adenomatoide, displásico o neoplásico de las células ECL en la mucosa gástrica. Ningún paciente desarrolló los tumores carcinoides observados en ratas.
Efectos endocrinos
Los estudios en humanos de hasta un año no han revelado efectos clínicamente significativos en el sistema endocrino. En sujetos varones sanos tratados con comprimidos de liberación retardada de ACIPHEX durante 13 días, no se han detectado cambios clínicamente relevantes en los siguientes parámetros endocrinos examinados: 17 β-estradiol, hormona estimulante de la tiroides, triyodotironina, tiroxina, proteína fijadora de tiroxina, paratiroides hormona, insulina, glucagón, renina, aldosterona, hormona estimulante del folículo, hormona luteotrófica, prolactina, hormona somatotrófica, dehidroepiandrosterona, globulina transportadora de cortisol y 6β-hidroxicortisol urinario, testosterona sérica y perfil de cortisol circadiano.
Otros efectos
En humanos tratados con comprimidos de liberación retardada de 10 mg de ACIPHEX durante hasta un año, no se han observado efectos sistémicos en los sistemas nervioso central, linfoide, hematopoyético, renal, hepático, cardiovascular o respiratorio. No hay datos disponibles sobre el tratamiento a largo plazo con ACIPHEX 10 mg comprimidos de liberación retardada y efectos oculares.
Farmacocinética
Después de la administración oral de 20 mg de ACIPHEX 10 mg comprimidos de liberación retardada, las concentraciones plasmáticas máximas (Cmax) de rabeprazol ocurren en un rango de 2 a 5 horas (Tmax). La Cmax y el AUC de rabeprazol son lineales en un rango de dosis oral de 10 mg a 40 mg. No hay acumulación apreciable cuando se administran dosis de 10 mg a 40 mg cada 24 horas; la farmacocinética de rabeprazol no se ve alterada por dosis múltiples.
Absorción
La biodisponibilidad absoluta de un comprimido oral de 20 mg de rabeprazol (en comparación con la administración intravenosa) es de aproximadamente el 52 %. Cuando se administran comprimidos de liberación retardada de 10 mg de ACIPHEX con una comida rica en grasas, la Tmax es variable; cuya ingesta concomitante de alimentos puede retrasar la absorción hasta 4 horas o más. Sin embargo, la Cmax y el grado de absorción de rabeprazol (AUC) no se modifican significativamente. Por lo tanto, las tabletas de liberación retardada de ACIPHEX se pueden tomar sin tener en cuenta el horario de las comidas.
Distribución
El rabeprazol se une en un 96,3 % a las proteínas plasmáticas humanas.
Eliminación
Metabolismo
El rabeprazol se metaboliza ampliamente. Una porción significativa de rabeprazol se metaboliza a través de una reducción sistémica no enzimática a un compuesto de tioéter. El rabeprazol también se metaboliza a compuestos de sulfona y desmetilo a través del citocromo P450 en el hígado. El tioéter y la sulfona son los principales metabolitos medidos en el plasma humano. No se observó que estos metabolitos tuvieran actividad antisecretora significativa. Los estudios in vitro han demostrado que el rabeprazol se metaboliza en el hígado principalmente por los citocromos P450 3A (CYP3A) a un metabolito de sulfona y el citocromo P450 2C19 (CYP2C19) a desmetil rabeprazol. CYP2C19 presenta un polimorfismo genético conocido debido a su deficiencia en algunas subpoblaciones (p. ej., del 3 al 5 % de los caucásicos y del 17 al 20 % de los asiáticos). El metabolismo del rabeprazol es lento en estas subpoblaciones, por lo que se les conoce como metabolizadores lentos del fármaco.
Excreción
Después de una dosis oral única de 20 mg de rabeprazol marcado con 14C, aproximadamente el 90 % del fármaco se eliminó en la orina, principalmente como ácido tioéter carboxílico; sus metabolitos glucurónido y ácido mercaptúrico. El resto de la dosis se recuperó en las heces. La recuperación total de radiactividad fue del 99,8%. No se recuperó rabeprazol sin cambios en la orina ni en las heces.
Poblaciones Específicas
Pacientes geriátricos
En 20 sujetos sanos de edad avanzada a los que se les administró 20 mg de ACIPHEX comprimidos de liberación retardada una vez al día durante siete días, los valores de AUC se duplicaron aproximadamente y la Cmax aumentó en un 60 % en comparación con los valores en un grupo de control paralelo más joven. No hubo evidencia de acumulación del fármaco después de la administración una vez al día [ver Uso en población específica ].
Pacientes pediátricos
La farmacocinética de rabeprazol se estudió en 12 pacientes adolescentes con ERGE de 12 a 16 años de edad, en un estudio multicéntrico. Los pacientes recibieron comprimidos de liberación retardada de ACIPHEX de 20 mg una vez al día durante cinco o siete días. Se observó un aumento aproximado del 40 % en la exposición a rabeprazol después de 5 a 7 días de dosificación en comparación con la exposición después de 1 día de dosificación. Los parámetros farmacocinéticos en pacientes adolescentes con ERGE de 12 a 16 años de edad estuvieron dentro del rango observado en sujetos adultos sanos.
Pacientes masculinos y femeninos y grupos raciales o étnicos
En análisis ajustados por masa corporal y altura, la farmacocinética de rabeprazol no mostró diferencias clínicamente significativas entre sujetos masculinos y femeninos. En estudios que utilizaron diferentes formulaciones de rabeprazol, los valores de AUC0-∞ para hombres japoneses sanos fueron aproximadamente entre un 50 y un 60 % mayores que los valores derivados de datos agrupados de hombres sanos en los Estados Unidos.
Pacientes con insuficiencia renal
En 10 pacientes con enfermedad renal terminal estable que requerían hemodiálisis de mantenimiento (aclaramiento de creatinina ≤5 ml/min/1,73 m²), no se observaron diferencias clínicamente significativas en la farmacocinética de rabeprazol después de una dosis única de 20 mg de ACIPHEX 20 mg comprimidos de liberación retardada en comparación con 10 sujetos sanos.
Pacientes con insuficiencia hepática
En un estudio de dosis única de 10 pacientes con insuficiencia hepática de leve a moderada (Child-Pugh Clase A y B, respectivamente) a quienes se les administró una dosis única de 20 mg de ACIPHEX 10 mg comprimidos de liberación retardada, el AUC0-24 se duplicó aproximadamente, la eliminación la vida media fue de 2 a 3 veces mayor y el aclaramiento corporal total se redujo a menos de la mitad en comparación con los valores en hombres sanos.
En un estudio de dosis múltiples de 12 pacientes con insuficiencia hepática de leve a moderada a los que se les administró 20 mg de ACIPHEX 10 mg comprimidos de liberación retardada una vez al día durante ocho días, los valores de AUC0-∞ y Cmax aumentaron aproximadamente un 20 % en comparación con los valores en pacientes sanos de la misma edad y sexo. asignaturas. Estos aumentos no fueron estadísticamente significativos.
No existe información sobre la disposición de rabeprazol en pacientes con insuficiencia hepática grave (Child-Pugh Clase C) [ver Uso en poblaciones específicas ].
Estudios de interacción farmacológica
Administración combinada con antimicrobianos
Dieciséis sujetos sanos genotipados como metabolizadores rápidos con respecto a CYP2C19 recibieron tabletas de liberación retardada de 20 mg de ACIPHEX, 1000 mg de amoxicilina, 500 mg de claritromicina o los 3 medicamentos en un estudio cruzado de cuatro vías. Cada uno de los cuatro regímenes se administró dos veces al día durante 6 días. El AUC y la Cmax de claritromicina y amoxicilina no fueron diferentes después de la administración combinada en comparación con los valores después de la administración única. Sin embargo, el AUC y la Cmax de rabeprazol aumentaron un 11 % y un 34 %, respectivamente, tras la administración combinada. El AUC y la Cmax de 14-hidroxiclaritromicina (metabolito activo de la claritromicina) también aumentaron un 42 % y un 46 %, respectivamente. No se espera que este aumento en la exposición a rabeprazol y 14-hidroxiclaritromicina genere problemas de seguridad.
Efectos de otras drogas sobre el rabeprazol
antiácidos
La administración conjunta de ACIPHEX 20 mg comprimidos de liberación retardada y antiácidos no produjo cambios clínicamente relevantes en las concentraciones plasmáticas de rabeprazol.
Efectos del rabeprazol sobre otras drogas
Los estudios en sujetos sanos han demostrado que el rabeprazol no tiene interacciones clínicamente significativas con otros fármacos metabolizados por el sistema CYP450, como la teofilina (CYP1A2) administrada en dosis únicas orales, el diazepam (CYP2C9 y CYP3A4) en dosis única intravenosa y la fenitoína ( CYP2C9 y CYP2C19) administrados como una dosis intravenosa única (con dosificación oral suplementaria). No se han estudiado en pacientes las interacciones en estado estacionario de rabeprazol y otros fármacos metabolizados por este sistema enzimático.
clopidogrel
Clopidogrel se metaboliza a su metabolito activo en parte por CYP2C19. Se realizó un estudio de sujetos sanos que incluían metabolizadores rápidos e intermedios de CYP2C19 que recibieron una administración una vez al día de clopidogrel 75 mg concomitantemente con placebo o con 20 mg de ACIPHEX 20 mg comprimidos de liberación retardada (n=36), durante 7 días. El AUC medio del metabolito activo de clopidogrel se redujo en aproximadamente un 12 % (la relación AUC media fue del 88 %, con un IC del 90 % de 81,7 a 95,5 %) cuando se coadministraron comprimidos de liberación retardada de ACIPHEX en comparación con la administración de clopidogrel con placebo [ver INTERACCIONES CON LA DROGAS ].
Digoxina
En sujetos adultos sanos (n=16), la coadministración de comprimidos de liberación retardada de 20 mg de rabeprazol sódico con dosis de digoxina de 2,5 mg una vez al día en el estado estacionario produjo un aumento de aproximadamente el 29 % y el 19 % en la Cmax media y el AUC(0- 24) de digoxina [ver INTERACCIONES CON LA DROGAS ].
ketoconazol
En sujetos adultos sanos (n=19), la coadministración de 20 mg de rabeprazol sódico en comprimidos de liberación retardada en estado estacionario con una dosis oral única de 400 mg de ketoconazol resultó en una reducción promedio de aproximadamente el 31 % tanto en la Cmax como en el AUC(0- inf) de ketoconazol [ver INTERACCIONES CON LA DROGAS ].
ciclosporina
Las incubaciones in vitro empleando microsomas hepáticos humanos indicaron que el rabeprazol inhibía el metabolismo de la ciclosporina con una IC50 de 62 micromolar, una concentración que es más de 50 veces mayor que la Cmax en voluntarios sanos después de 14 días de administración de 20 mg de ACIPHEX 10 mg comprimidos de liberación retardada. Este grado de inhibición es similar al del omeprazol en concentraciones equivalentes.
Microbiología
Los siguientes datos in vitro están disponibles pero se desconoce el significado clínico.
Se ha demostrado que el rabeprazol sódico, la amoxicilina y la claritromicina como régimen de tres fármacos son activos contra la mayoría de las cepas de Helicobacter pylori in vitro y en infecciones clínicas [ver INDICACIONES Y USO , Estudios clínicos ].
Helicobacter pylori
Se realizaron pruebas de susceptibilidad de aislados de H. pylori para amoxicilina y claritromicina utilizando la metodología de dilución en agar1 y se determinaron las concentraciones inhibitorias mínimas (MIC).
Los procedimientos de prueba de susceptibilidad estandarizados requieren el uso de microorganismos de control de laboratorio para controlar los aspectos técnicos de los procedimientos de laboratorio.
Incidencia de organismos resistentes a antibióticos entre aislados clínicos
Resistencia al pretratamiento
La tasa de resistencia previa al tratamiento con claritromicina (MIC ≥1 mcg/mL) a H. pylori fue del 9 % (51/560) al inicio del estudio en todos los grupos de tratamiento combinados. Más del 99 % (558/560) de los pacientes tenían aislamientos de H. pylori que se consideraban susceptibles (MIC ≤0,25 mcg/mL) a la amoxicilina al inicio del estudio. Dos pacientes tenían aislamientos iniciales de H. pylori con una CIM de amoxicilina de 0,5 mcg/mL.
Para obtener información sobre las pruebas de susceptibilidad sobre Helicobacter pylori, consulte la sección de Microbiología en la información de prescripción de claritromicina y amoxicilina.
Los pacientes con infección persistente por H. pylori después de la terapia con rabeprazol, amoxicilina y claritromicina probablemente tendrán aislamientos clínicos resistentes a la claritromicina. Por lo tanto, se deben realizar pruebas de susceptibilidad a la claritromicina cuando sea posible. Si se demuestra resistencia a la claritromicina o no es posible realizar pruebas de susceptibilidad, se debe instituir una terapia antimicrobiana alternativa.
Resultados de la prueba de susceptibilidad a la amoxicilina y resultados clínicos/bacteriológicos
En el estudio multicéntrico de EE. UU., más del 99 % (558/560) de los pacientes tenían aislamientos de H. pylori que se consideraban susceptibles (MIC ≤0,25 mcg/mL) a la amoxicilina al inicio del estudio. Los otros 2 pacientes tenían aislamientos iniciales de H. pylori con una CIM de amoxicilina de 0,5 mcg/mL, y ambos aislamientos eran resistentes a la claritromicina al inicio del estudio; en un caso se erradicó el H. pylori. En los grupos de tratamiento de 7 y 10 días, el 75 % (107/145) y el 79 % (112/142), respectivamente, de los pacientes que tenían CIM sensibles a la amoxicilina antes del tratamiento (≤0,25 mcg/mL) fueron erradicados de H. pylori . Ningún paciente desarrolló H. pylori resistente a la amoxicilina durante el tratamiento.
farmacogenómica
En un estudio clínico para evaluar las tabletas de liberación retardada de ACIPHEX en pacientes adultos japoneses categorizados por genotipo CYP2C19 (n = 6 por categoría de genotipo), la supresión del ácido gástrico fue mayor en los metabolizadores lentos en comparación con los metabolizadores rápidos. Esto podría deberse a niveles plasmáticos más altos de rabeprazol en metabolizadores lentos. Se desconoce la relevancia clínica de esto. No se ha estudiado si las interacciones de rabeprazol sódico con otros fármacos metabolizados por CYP2C19 serían diferentes entre los metabolizadores rápidos y los metabolizadores lentos.
Estudios clínicos
Curación de la ERGE erosiva o ulcerativa en adultos
En un estudio estadounidense, multicéntrico, aleatorizado, doble ciego, controlado con placebo, 103 pacientes fueron tratados durante un máximo de ocho semanas con placebo, 10 mg, 20 mg o 40 mg de ACIPHEX comprimidos de liberación retardada una vez al día. Para este y todos los estudios de curación de ERGE, solo los pacientes con síntomas de ERGE y al menos esofagitis de grado 2 (escala de calificación modificada de Hetzel-Dent) fueron elegibles para ingresar. La curación endoscópica se definió como grado 0 o 1. Cada dosis de rabeprazol fue significativamente superior al placebo en la producción de curación endoscópica después de cuatro y ocho semanas de tratamiento. El porcentaje de pacientes que demostraron curación endoscópica fue el siguiente:
Además, hubo una diferencia estadísticamente significativa a favor de las dosis de 10 mg, 20 mg y 40 mg de ACIPHEX en comparación con el placebo en las semanas 4 y 8 con respecto a la resolución completa de la frecuencia de acidez estomacal por ERGE (p≤0,026). Todos los grupos de ACIPHEX informaron tasas significativamente mayores de resolución completa de la gravedad de la acidez estomacal diurna por ERGE en comparación con el placebo en las semanas 4 y 8 (p≤0,036). Las reducciones medias desde el inicio en la dosis diaria de antiácido fueron estadísticamente significativas para todos los grupos de ACIPHEX en comparación con el placebo en las semanas 4 y 8 (p≤0,007).
En un estudio multicéntrico norteamericano, aleatorizado, doble ciego, con control activo de 336 pacientes, el porcentaje de pacientes curados por endoscopia después de cuatro y ocho semanas de tratamiento fue estadísticamente superior en los pacientes tratados con ACIPHEX tabletas de liberación retardada en comparación con ranitidina :
Una dosis de 20 mg una vez al día de ACIPHEX comprimidos de liberación retardada fue significativamente más eficaz que 150 mg de ranitidina cuatro veces al día en el porcentaje de pacientes con resolución completa de la acidez estomacal en las Semanas 4 y 8 (p
La dosis recomendada de comprimidos de liberación retardada de 10 mg de ACIPHEX es de 20 mg una vez al día durante 4 a 8 semanas.
Mantenimiento a largo plazo de la curación de la ERGE erosiva o ulcerosa en adultos
El mantenimiento a largo plazo de la cicatrización en pacientes con ERGE erosiva o ulcerosa previamente curados con terapia antisecretora gástrica se evaluó en dos estudios estadounidenses, multicéntricos, aleatorizados, doble ciego, controlados con placebo de diseño idéntico de 52 semanas de duración. Los dos estudios aleatorizaron a 209 y 285 pacientes, respectivamente, para recibir 10 mg o 20 mg de comprimidos de liberación retardada de ACIPHEX una vez al día o placebo. Como se demuestra en las Tablas 10 y 11 a continuación, los pacientes tratados con tabletas de liberación retardada de ACIPHEX fueron significativamente superiores al placebo en ambos estudios con respecto al mantenimiento de la curación de la ERGE y las proporciones de pacientes que permanecieron sin síntomas de acidez estomacal a las 52 semanas. La dosis recomendada de comprimidos de liberación retardada de 20 mg de ACIPHEX es de 20 mg una vez al día.
Tratamiento de la ERGE sintomática en adultos
Se realizaron dos estudios estadounidenses, multicéntricos, doble ciego, controlados con placebo en 316 pacientes adultos con acidez estomacal diurna y nocturna. Los pacientes informaron 5 o más períodos de acidez estomacal de moderada a muy grave durante la fase de tratamiento con placebo la semana anterior a la aleatorización. Los pacientes fueron confirmados por endoscopia para no tener erosiones esofágicas.
El porcentaje de períodos diurnos y/o nocturnos sin acidez estomacal fue mayor con 20 mg de ACIPHEX 20 mg comprimidos de liberación retardada en comparación con el placebo durante las 4 semanas del estudio en el estudio RABUSA-2 (47 % frente al 23 %) y el estudio RAB-USA- 3 (52% frente a 28%). Las disminuciones medias desde el valor inicial en las puntuaciones medias de acidez estomacal durante el día y la noche fueron significativamente mayores para ACIPHEX 20 mg en comparación con el placebo en la semana 4. En las Figuras 2 a 5 se proporcionan representaciones gráficas que representan las puntuaciones medias diarias durante el día y la noche.
Figura 2: Puntuaciones medias de acidez estomacal diurna RAB-USA-2
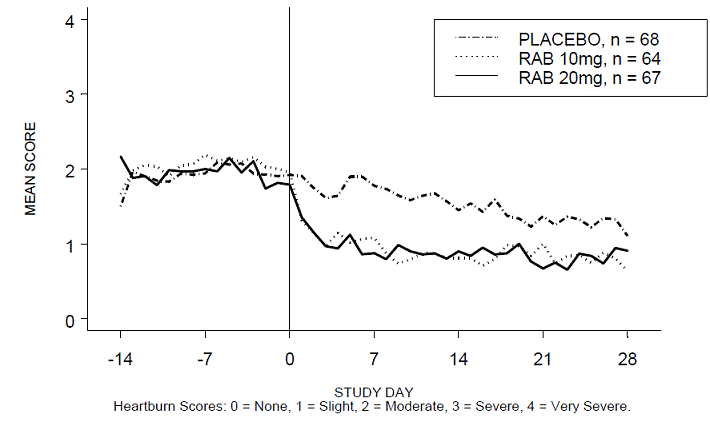
Figura 3: Puntuaciones medias de acidez estomacal nocturna RAB-USA-2
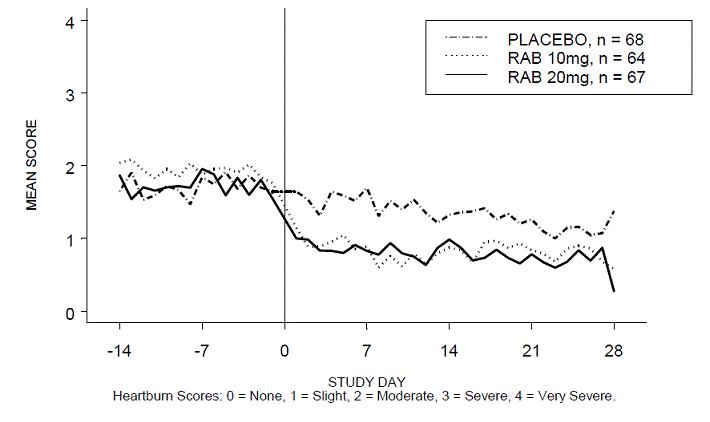
Figura 4: Puntuaciones medias de acidez estomacal diurna RAB-USA-3 Figura 3: Puntuaciones medias de acidez estomacal diurna RAB - EE.UU. –3
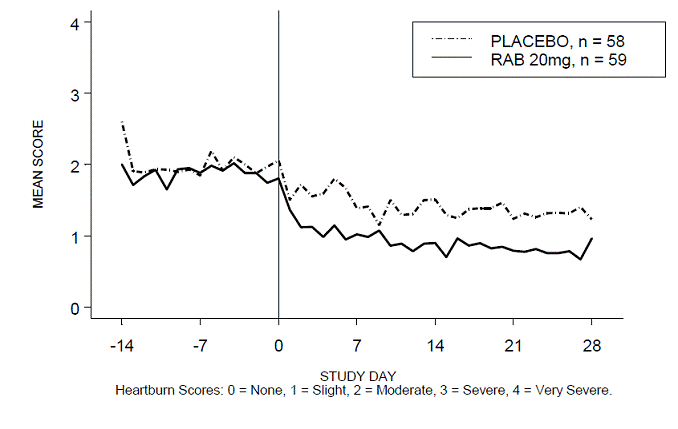
Figura 5: Puntuaciones medias de acidez estomacal nocturna RAB-USA-3
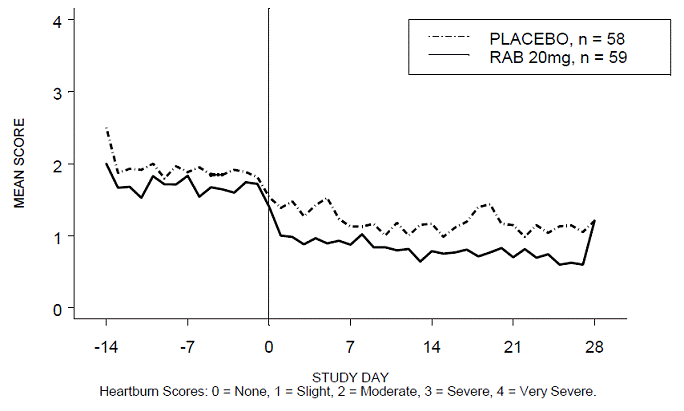
Además, el análisis combinado de estos dos estudios mostró que 20 mg de ACIPHEX 10 mg comprimidos de liberación retardada mejoraron significativamente otros síntomas asociados con la ERGE (regurgitación, eructos y saciedad temprana) en la semana 4 en comparación con el placebo (todos los valores de p
Una dosis de 20 mg de ACIPHEX 20 mg comprimidos de liberación retardada también redujo significativamente el consumo diario de antiácidos frente al placebo durante 4 semanas (p
La dosis recomendada de comprimidos de liberación retardada de ACIPHEX es de 20 mg una vez al día durante 4 semanas.
Curación de úlceras duodenales en adultos
En un estudio multicéntrico, aleatorizado, doble ciego, en los EE. UU. que evaluó la eficacia de 20 mg y 40 mg de ACIPHEX 10 mg comprimidos de liberación retardada una vez al día frente a placebo para la curación de las úlceras duodenales definidas endoscópicamente, se trató a 100 pacientes durante un máximo de cuatro semanas. ACIPHEX fue significativamente superior al placebo en la curación de las úlceras duodenales. Los porcentajes de pacientes con curación endoscópica se presentan a continuación:
En las Semanas 2 y 4, significativamente más pacientes en los grupos de ACIPHEX 20 y 40 mg informaron una resolución completa de la frecuencia del dolor de la úlcera (p≤0.018), la intensidad del dolor diurno (p≤0.023) y la intensidad del dolor nocturno (p≤0.035) en comparación con pacientes con placebo. La única excepción fue el grupo de 40 mg versus placebo en la Semana 2 para la frecuencia del dolor de la úlcera duodenal (p=0,094). Se observaron diferencias significativas en la resolución del dolor diurno y nocturno en ambos grupos de ACIPHEX en relación con el placebo al final de la primera semana del estudio. También se observaron reducciones significativas en el uso diario de antiácidos en ambos grupos de ACIPHEX en comparación con el placebo en las semanas 2 y 4 (p
Se realizó un ensayo internacional aleatorizado, doble ciego, con control activo en 205 pacientes que comparó 20 mg de ACIPHEX en tabletas de liberación retardada una vez al día con 20 mg de omeprazol una vez al día. El estudio se diseñó para proporcionar al menos un 80 % de potencia para excluir una diferencia de al menos un 10 % entre ACIPHEX 10 mg y omeprazol, suponiendo tasas de respuesta de curación a las cuatro semanas del 93 % para ambos grupos. En pacientes con úlceras duodenales definidas endoscópicamente tratados durante un máximo de cuatro semanas, ACIPHEX fue comparable al omeprazol en la curación de las úlceras duodenales. Los porcentajes de pacientes con curación endoscópica a las dos y cuatro semanas se presentan a continuación:
ACIPHEX 20 mg y omeprazol fueron comparables en la resolución completa de los síntomas.
La dosis recomendada de comprimidos de liberación retardada de 20 mg de ACIPHEX es de 20 mg una vez al día durante 4 semanas.
Erradicación de Helicobacter pylori en pacientes con enfermedad ulcerosa péptica o enfermedad sintomática no ulcerosa en adultos
El estudio multicéntrico de EE. UU. fue una comparación doble ciego de grupos paralelos de tabletas de liberación retardada de ACIPHEX, amoxicilina y claritromicina durante 3, 7 o 10 días frente a omeprazol, amoxicilina y claritromicina durante 10 días. La terapia consistió en rabeprazol 20 mg dos veces al día, amoxicilina 1000 mg dos veces al día y claritromicina 500 mg dos veces al día (RAC) u omeprazol 20 mg dos veces al día, amoxicilina 1000 mg dos veces al día y claritromicina 500 mg dos veces al día (OAC). Los pacientes con infección por H. pylori se estratificaron en una proporción de 1:1 para aquellos con enfermedad de úlcera péptica (activa o antecedentes de úlcera en los últimos cinco años) [PUD] y aquellos que eran sintomáticos pero sin enfermedad de úlcera péptica [NPUD], determinado por endoscopia digestiva alta. Las tasas generales de erradicación de H. pylori, definidas como 13C-UBT negativas para H. pylori ≥6 semanas desde el final del tratamiento, se muestran en la siguiente tabla. Se encontró que las tasas de erradicación en los regímenes RAC de 7 y 10 días eran similares a las del régimen OAC de 10 días usando las poblaciones por intención de tratar (ITT) o por protocolo (PP). Las tasas de erradicación en el régimen RAC de 3 días fueron inferiores a los otros regímenes.
La dosis recomendada de comprimidos de liberación retardada de 20 mg de ACIPHEX es de 20 mg dos veces al día con amoxicilina y claritromicina durante 7 días.
Condiciones hipersecretoras patológicas, incluido el síndrome de Zollinger-Ellison en adultos
Doce pacientes con hipersecreción gástrica idiopática o síndrome de Zollinger-Ellison han sido tratados con éxito con comprimidos de liberación retardada de 10 mg de ACIPHEX en dosis de 20 a 120 mg durante un máximo de 12 meses. ACIPHEX 10 mg produjo una inhibición satisfactoria de la secreción de ácido gástrico en todos los pacientes y una resolución completa de los signos y síntomas de la enfermedad ácido-péptica cuando estuvo presente. ACIPHEX 20 mg también previno la recurrencia de la hipersecreción gástrica y las manifestaciones de la enfermedad ácido-péptica en todos los pacientes. Las altas dosis de ACIPHEX utilizadas para tratar esta pequeña cohorte de pacientes con hipersecreción gástrica fueron bien toleradas.
La dosis inicial recomendada de comprimidos de liberación retardada de ACIPHEX es de 60 mg una vez al día.
REFERENCIAS
1. Instituto de Normas Clínicas y de Laboratorio (CLSI). Métodos para pruebas de susceptibilidad antimicrobiana por dilución para bacterias que crecen aeróbicamente; Norma aprobada: décima edición. Documento CLSI M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania, 19087, EE. UU. 2015.
INFORMACIÓN DEL PACIENTE
ACIPHEX® (a-se-feks) (rabeprazol sódico) tabletas de liberación retardada
¿Cuál es la información más importante que debo saber sobre ACIPHEX 10mg?
Debe tomar ACIPHEX 20 mg exactamente como se le recetó, en la dosis más baja posible y durante el menor tiempo necesario.
ACIPHEX 20mg puede ayudar con los síntomas relacionados con el ácido, pero aún podría tener problemas estomacales graves. Hable con su médico.
ACIPHEX 20 mg puede causar efectos secundarios graves, que incluyen:
- Un tipo de problema renal (nefritis tubulointersticial aguda). Algunas personas que toman medicamentos inhibidores de la bomba de protones (IBP), incluido ACIPHEX, pueden desarrollar un problema renal llamado nefritis tubulointersticial aguda que puede ocurrir en cualquier momento durante el tratamiento con ACIPHEX. Llame a su médico de inmediato si tiene una disminución en la cantidad que orina o si tiene sangre en la orina.
- Diarrea causada por una infección (Clostridium difficile) en sus intestinos. Llame a su médico de inmediato si tiene heces acuosas o dolor de estómago que no desaparece. Puede o no tener fiebre.
- Fracturas óseas (cadera, muñeca o columna). Las fracturas de huesos en la cadera, la muñeca o la columna vertebral pueden ocurrir en personas que toman múltiples dosis diarias de medicamentos PPI y durante un período prolongado (un año o más). Informe a su médico si tiene una fractura de hueso, especialmente en la cadera, la muñeca o la columna.
- Ciertos tipos de lupus eritematoso. El lupus eritematoso es un trastorno autoinmune (las células inmunitarias del cuerpo atacan a otras células u órganos del cuerpo). Algunas personas que toman medicamentos PPI, incluido ACIPHEX, pueden desarrollar ciertos tipos de lupus eritematoso o empeorar el lupus que ya tienen. Llame a su médico de inmediato si tiene un dolor en las articulaciones nuevo o que empeora, o una erupción en las mejillas o los brazos que empeora con el sol.
Hable con su médico acerca de su riesgo de sufrir estos efectos secundarios graves.
ACIPHEX 10mg puede tener otros efectos secundarios graves. Consulte "¿Cuáles son los posibles efectos secundarios de ACIPHEX 10 mg?"
¿Qué es ACIPHEX 20 mg?
ACIPHEX 10 mg es un medicamento recetado llamado inhibidor de la bomba de protones (IBP).
ACIPHEX 20mg reduce la cantidad de ácido en el estómago.
En adultos, ACIPHEX se utiliza para:
- 8 semanas hasta 16 semanas para curar el daño relacionado con el ácido en el revestimiento del esófago (llamado esofagitis erosiva o EE) y para aliviar los síntomas, como el dolor de acidez estomacal.
- manteniendo la cicatrización del esófago y el alivio de los síntomas relacionados con EE. No se sabe si ACIPHEX 20 mg es seguro y efectivo si se usa por más de 12 meses (1 año).
- hasta 4 semanas para tratar la acidez estomacal diurna y nocturna y otros síntomas que ocurren con la enfermedad por reflujo gastroesofágico (ERGE).
- hasta 4 semanas para la cicatrización y alivio de los síntomas de las úlceras duodenales.
- 7 días con ciertos antibióticos para tratar una infección y úlceras estomacales (duodenales) causadas por una bacteria llamada H. pylori.
- el tratamiento a largo plazo de condiciones en las que su estómago produce demasiado ácido. Esto incluye una condición rara llamada síndrome de Zollinger-Ellison.
En adolescentes de 12 años de edad y mayores, ACIPHEX 10mg se usa hasta por 8 semanas para tratar los síntomas de la ERGE.
No se sabe si ACIPHEX es seguro y efectivo en niños menores de 12 años para otros usos.
Las tabletas de liberación retardada de ACIPHEX no deben usarse en niños menores de 12 años.
No tome ACIPHEX 10 mg si usted es:
- alérgico al rabeprazol, a cualquier otro medicamento PPI o a cualquiera de los ingredientes de ACIPHEX. Consulte el final de esta Guía del medicamento para obtener una lista completa de ingredientes.
- tomando un medicamento que contiene rilpivirina (EDURANT, COMPLERA, ODEFSEY) utilizado para tratar el VIH-1 (virus de inmunodeficiencia humana).
Antes de tomar ACIPHEX, infórmele a su médico acerca de todas sus condiciones médicas, incluso si usted:
- tiene niveles bajos de magnesio, niveles bajos de calcio y niveles bajos de potasio en la sangre.
- tiene problemas hepáticos.
- está embarazada o planea quedar embarazada. No se sabe si ACIPHEX 20mg puede dañar a su bebé nonato.
- están amamantando o planean amamantar. No se sabe si ACIPHEX 10 mg pasa a la leche materna. Hable con su médico sobre la mejor manera de alimentar a su bebé si toma ACIPHEX.
Informe a su médico sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos a base de hierbas. Especialmente dígale a su médico si toma un antibiótico que contiene claritromicina o amoxicilina o si toma warfarina (COUMADIN, JANTOVEN), metotrexato (OTREXUP, RASUVO, TREXALL, XATMEP), digoxina (LANOXIN) o un diurético.
¿Cómo debo tomar ACIPHEX?
- Tome ACIPHEX exactamente según lo prescrito.
- ACIPHEX generalmente se toma 1 vez al día. Su médico le indicará la hora del día en que debe tomar ACIPHEX, según su estado de salud.
- ACIPHEX 10 mg se puede tomar con o sin alimentos. Su médico le dirá si debe tomar este medicamento con o sin alimentos según su condición médica.
- Trague cada comprimido de ACIPHEX 20 mg entero. No mastique, triture ni parta las tabletas de ACIPHEX de 10 mg. Informe a su médico si no puede tragar las tabletas enteras.
- Si olvida una dosis de ACIPHEX 10 mg, tómela lo antes posible. Si es casi la hora de su próxima dosis, no debe tomar la dosis olvidada. Debe tomar su siguiente dosis a la hora habitual. No tome 2 dosis al mismo tiempo.
- Si toma demasiado ACIPHEX 20 mg, llame a su médico o al centro de toxicología al 1-800-222-1222 de inmediato, o vaya a la sala de emergencias más cercana.
- Si su médico le receta antibióticos con ACIPHEX, lea la información para el paciente que viene con los antibióticos antes de tomarlos.
¿Cuáles son los posibles efectos secundarios de ACIPHEX 20mg?
ACIPHEX 10 mg puede causar efectos secundarios graves, que incluyen:
- Consulte "¿Cuál es la información más importante que debo saber sobre ACIPHEX 20 mg?"
- Interacción con warfarina. Tomar warfarina con un medicamento PPI puede aumentar el riesgo de hemorragia y muerte. Si toma warfarina, su médico puede analizar su sangre para ver si tiene un mayor riesgo de sangrado. Si toma warfarina durante el tratamiento con ACIPHEX 20 mg, informe a su médico de inmediato si tiene signos o síntomas de sangrado, incluidos:
- dolor, hinchazón o malestar
- dolores de cabeza, mareos o debilidad
- moretones inusuales (moretones que ocurren sin causa conocida o que aumentan de tamaño)
- hemorragias nasales
- sangrado de las encías
- el sangrado de los cortes tarda mucho en detenerse
- sangrado menstrual más abundante de lo normal
- orina de color rosa o marrón
- heces rojas o negras
- tosiendo sangre
- vomitar sangre o vómito que parece café molido
- Bajos niveles de vitamina B-12 en el cuerpo puede ocurrir en personas que han tomado ACIPHEX 10 mg durante mucho tiempo (más de 3 años). Informe a su médico si tiene síntomas de niveles bajos de vitamina B-12, que incluyen dificultad para respirar, mareos, latidos cardíacos irregulares, debilidad muscular, piel pálida, sensación de cansancio, cambios de humor y hormigueo o entumecimiento en los brazos y las piernas.
- Niveles bajos de magnesio en el cuerpo. puede ocurrir en personas que han tomado ACIPHEX 20 mg durante al menos 3 meses. Informe a su médico si tiene síntomas de niveles bajos de magnesio, como convulsiones, mareos, latidos cardíacos irregulares, nerviosismo, dolores musculares o debilidad y espasmos en las manos, los pies o la voz.
- Crecimientos estomacales (pólipos de glándulas fúndicas). Las personas que toman medicamentos PPI durante mucho tiempo tienen un mayor riesgo de desarrollar cierto tipo de crecimientos estomacales llamados pólipos de las glándulas fúndicas, especialmente después de tomar medicamentos PPI durante más de 1 año.
- Reacciones cutáneas graves. ACIPHEX puede causar reacciones cutáneas raras pero graves que pueden afectar cualquier parte de su cuerpo. Estas reacciones cutáneas graves pueden necesitar tratamiento en un hospital y pueden poner en peligro la vida:
- Erupción cutánea que puede tener ampollas, descamación o sangrado en cualquier parte de la piel (incluidos los labios, los ojos, la boca, la nariz, los genitales, las manos o los pies).
- También puede tener fiebre, escalofríos, dolores en el cuerpo, dificultad para respirar o ganglios linfáticos agrandados.
Deje de tomar ACIPHEX 20 mg y llame a su médico de inmediato. Estos síntomas pueden ser el primer signo de una reacción cutánea grave.
Los efectos secundarios más comunes de ACIPHEX 20 mg en adultos incluyen: dolor, dolor de garganta, gas, infección y estreñimiento.
Los efectos secundarios más comunes de ACIPHEX en adolescentes de 12 años de edad y mayores incluyen: dolor de cabeza, diarrea, náuseas, vómitos y dolor en el área del estómago (abdomen).
Estos no son todos los posibles efectos secundarios de ACIPHEX. Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar ACIPHEX?
Guarde las tabletas de ACIPHEX en un lugar seco a temperatura ambiente entre 68 °F y 77 °F (20 °C y 25 °C).
Mantenga ACIPHEX 20 mg y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de ACIPHEX.
A veces, los medicamentos se recetan para fines distintos a los enumerados en la Guía del medicamento. No use ACIPHEX para una condición para la cual no fue recetado. No le dé ACIPHEX a otras personas, incluso si tienen los mismos síntomas que usted tiene. Puede que les haga daño.
Puede pedirle a su médico o farmacéutico información sobre ACIPHEX escrita para profesionales de la salud.
¿Cuáles son los ingredientes de ACIPHEX 10 mg?
Ingrediente activo: rabeprazol sódico
Ingredientes inactivos: cera de carnauba, crospovidona, monoglicéridos diacetilados, etilcelulosa, hidroxipropilcelulosa, ftalato de hipromelosa, estearato de magnesio, manitol, hidróxido de sodio, estearilfumarato de sodio, talco y dióxido de titanio. El óxido de hierro amarillo es el agente colorante para el recubrimiento de las tabletas. El óxido de hierro rojo es el pigmento de la tinta.
Esta Guía del medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de EE. UU. Revisado: 03/2022
