Pepcid 20mg, 40mg Famotidine Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Pepcid y cómo se usa?
Pepcid (famotidina) se usa para tratar la acidez estomacal, la ERGE y el síndrome de Zollinger-Ellison. Está disponible sin receta. Pepcid 20mg está disponible como genérico.
¿Cuáles son los posibles efectos secundarios del uso de Pepcid?
Los efectos secundarios son poco comunes, pero pueden incluir:
- fatiga,
- vómitos,
- náuseas,
- malestar abdominal,
- anorexia,
- boca seca,
- sarpullido, y
- calambres musculares
DESCRIPCIÓN
El ingrediente activo de PEPCID® (famotidina) es un antagonista del receptor H2 de histamina. La famotidina es N'(aminosulfonil)-3-[[[2-[(diaminometileno)amino]-4-tiazolil]metil]tio]propanimidamida. La fórmula empírica de la famotidina es C8H15N7O2S3 y su peso molecular es 337,43. Su fórmula estructural es:
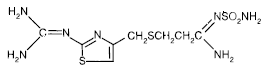
La famotidina es un compuesto cristalino de color blanco a amarillo pálido que es libremente soluble en ácido acético glacial, ligeramente soluble en metanol, muy poco soluble en agua y prácticamente insoluble en etanol.
Cada tableta para administración oral contiene 20 mg o 40 mg de famotidina y los siguientes ingredientes inactivos: hidroxipropilcelulosa, hipromelosa, óxidos de hierro, estearato de magnesio, celulosa microcristalina, almidón de maíz, talco, dióxido de titanio y cera de carnauba.
INDICACIONES
PEPCID 40mg está indicado en:
DOSIFICACIÓN Y ADMINISTRACIÓN
Úlcera duodenal
Terapia aguda: La dosis oral recomendada en adultos para la úlcera duodenal activa es de 40 mg una vez al día a la hora de acostarse. La mayoría de los pacientes sanan en 4 semanas; rara vez hay razón para usar PEPCID en dosis completa durante más de 6 a 8 semanas. Un régimen de 20 mg dos veces al día también es eficaz.
Terapia de mantenimiento: La dosis oral recomendada para adultos es de 20 mg una vez al día a la hora de acostarse.
Úlcera gástrica benigna
Terapia aguda: La dosis oral recomendada en adultos para la úlcera gástrica benigna activa es de 40 mg una vez al día a la hora de acostarse.
Enfermedad por reflujo gastroesofágico (ERGE)
La dosis oral recomendada para el tratamiento de pacientes adultos con síntomas de ERGE es de 20 mg dos veces al día durante un máximo de 6 semanas. La dosis oral recomendada para el tratamiento de pacientes adultos con esofagitis, incluidas erosiones y ulceraciones y síntomas acompañantes debido a ERGE, es de 20 o 40 mg dos veces al día durante un máximo de 12 semanas (ver FARMACOLOGÍA CLÍNICA en adultos , Estudios clínicos ).
Dosis para pacientes pediátricos
Ver PRECAUCIONES , Pacientes pediátricos
Los estudios descritos en PRECAUCIONES, Pacientes pediátricos
Dosis para pacientes pediátricos de 1 a 16 años de edad
Ver PRECAUCIONES , Pacientes pediátricos de 1 a 16 años de edad.
Los estudios descritos en PRECAUCIONES, Pacientes pediátricos de 1 a 16 años sugieren las siguientes dosis iniciales en pacientes pediátricos de 1 a 16 años:
Úlcera péptica - 0,5 mg/kg/día por vía oral a la hora de acostarse o dividido hasta 40 mg/día.
Enfermedad por reflujo gastroesofágico con o sin esofagitis, incluidas erosiones y ulceraciones - 1,0 mg/kg/día po dividido bid hasta 40 mg bid
Si bien los estudios no controlados publicados sugieren la eficacia de la famotidina en el tratamiento de la enfermedad por reflujo gastroesofágico y la úlcera péptica, los datos en pacientes pediátricos son insuficientes para establecer el porcentaje de respuesta con la dosis y la duración de la terapia. Por lo tanto, la duración del tratamiento (inicialmente basada en las recomendaciones de duración para adultos) y la dosis deben individualizarse según la respuesta clínica y/o la determinación del pH (gástrico o esofágico) y la endoscopia. Los estudios clínicos no controlados publicados en pacientes pediátricos de 1 a 16 años de edad han empleado dosis de hasta 1 mg/kg/día para úlcera péptica y 2 mg/kg/día para ERGE con o sin esofagitis, incluidas erosiones y ulceraciones.
Condiciones hipersecretoras patológicas (p. ej., síndrome de Zollinger-Ellison, adenomas endocrinos múltiples)
La dosificación de PEPCID en pacientes con condiciones hipersecretoras patológicas varía según el paciente individual. La dosis inicial oral recomendada para adultos en condiciones hipersecretoras patológicas es de 20 mg cada 6 h. En algunos pacientes, puede ser necesaria una dosis inicial más alta. Las dosis deben ajustarse a las necesidades individuales del paciente y deben continuar durante el tiempo que esté clínicamente indicado. Se han administrado dosis de hasta 160 mg cada 6 h a algunos pacientes adultos con síndrome de Zollinger-Ellison grave.
Uso concomitante de antiácidos
Los antiácidos pueden administrarse concomitantemente si es necesario.
Ajuste de dosis para pacientes con insuficiencia renal moderada o grave
En pacientes adultos con insuficiencia renal moderada (aclaramiento de creatinina
Sobre la base de la comparación de los parámetros farmacocinéticos de PEPCID en pacientes adultos y pediátricos, se debe considerar el ajuste de la dosis en pacientes pediátricos con insuficiencia renal moderada o grave.
CÓMO SUMINISTRADO
PEPCID 40mg Comprimidos 20 mg, son comprimidos recubiertos con película de color beige, de forma cuadrada redondeada, codificados MSD por una cara y lisos por la otra. Se suministran de la siguiente manera:
CDN 42998-639-09 unidad de uso botellas de 30 CDN 42998-639-98 unidad de uso botellas de 100.
Los comprimidos de PEPCID de 40 mg, 40 mg, son comprimidos recubiertos con película de color canela, de forma cuadrada redondeada, codificados MSD por un lado y lisos por el otro. Se suministran de la siguiente manera:
CDN 42998-649-09 unidad de uso botellas de 30 CDN 42998-649-98 unidad de uso botellas de 100. Almacenamiento
Conservar a temperatura ambiente controlada.
Las tabletas de 20 mg y las tabletas de 40 mg de PEPCID® (famotidina) se fabrican para: Marathon Pharmaceuticals, LLC, Northbrook, IL 60062, EE. UU. Publicado en febrero de 2014.EFECTOS SECUNDARIOS
Las reacciones adversas enumeradas a continuación se informaron durante ensayos clínicos nacionales e internacionales en aproximadamente 2500 pacientes. En los ensayos clínicos controlados en los que se compararon las tabletas de PEPCID de 40 mg con el placebo, la incidencia de experiencias adversas en el grupo que recibió las tabletas de PEPCID, 40 mg a la hora de acostarse, fue similar a la del grupo de placebo.
Se ha informado que las siguientes reacciones adversas ocurren en más del 1 % de los pacientes en tratamiento con PEPCID en ensayos clínicos controlados y pueden estar relacionadas causalmente con el fármaco: dolor de cabeza (4,7 %), mareos (1,3 %), estreñimiento (1,2 % ) y diarrea (1,7%).
Las siguientes reacciones adversas se han informado con poca frecuencia en ensayos clínicos o desde que se comercializó el medicamento. La relación con la terapia con PEPCID 20 mg no ha sido clara en muchos casos. Dentro de cada categoría, las reacciones adversas se enumeran en orden de gravedad decreciente:
Cuerpo como un todo: fiebre, astenia, fatiga
Cardiovascular: arritmia, bloqueo AV, palpitaciones. Muy raramente se ha notificado prolongación del intervalo QT en pacientes con función renal alterada.
Gastrointestinal: ictericia colestática, hepatitis, anomalías de las enzimas hepáticas, vómitos, náuseas, molestias abdominales, anorexia, sequedad de boca
hematológico: casos raros de agranulocitosis, pancitopenia, leucopenia, trombocitopenia
Hipersensibilidad: anafilaxia, angioedema, edema orbitario o facial, urticaria, erupción cutánea, inyección conjuntival
Musculoesquelético: rabdomiólisis, dolor musculoesquelético incluyendo calambres musculares, artralgia
Sistema Nervioso/Psiquiátrico: ataque de epilepsia; trastornos psíquicos, que fueron reversibles en los casos para los que se obtuvo seguimiento, incluyendo alucinaciones, confusión, agitación, depresión, ansiedad, disminución de la libido; parestesia; insomnio; somnolencia. Muy raramente se han notificado convulsiones en pacientes con función renal alterada.
Respiratorio: broncoespasmo, neumonía intersticial
Piel: necrólisis epidérmica tóxica/síndrome de Stevens-Johnson (muy raro), alopecia, acné, prurito, piel seca, enrojecimiento
Sentidos especiales: tinnitus, trastorno del gusto
Otro: se han informado casos raros de impotencia y casos raros de ginecomastia; sin embargo, en ensayos clínicos controlados, las incidencias no fueron mayores que las observadas con placebo.
Las reacciones adversas informadas para las tabletas de PEPCID también pueden ocurrir con PEPCID 20 mg para suspensión oral.
Pacientes pediátricos
En un estudio clínico en 35 pacientes pediátricos
INTERACCIONES CON LA DROGAS
No se han identificado interacciones medicamentosas. Los estudios con famotidina en humanos, en modelos animales e in vitro no han mostrado interferencia significativa con la disposición de los compuestos metabolizados por las enzimas microsomales hepáticas, por ejemplo, el sistema citocromo P450. Los compuestos probados en humanos incluyen warfarina, teofilina, fenitoína, diazepam, aminopirina y antipirina. Se ha probado el verde de indocianina como índice de extracción hepática de fármacos y no se han encontrado efectos significativos.
ADVERTENCIAS
No se proporcionó información
PRECAUCIONES
General
La respuesta sintomática a la terapia con PEPCID no excluye la presencia de cáncer gástrico.
Pacientes con Insuficiencia Renal Moderada o Severa
Dado que se han notificado efectos adversos sobre el SNC en pacientes con insuficiencia renal moderada y grave, es posible que sea necesario utilizar intervalos más largos entre dosis o dosis más bajas en pacientes con insuficiencia renal moderada (aclaramiento de creatinina FARMACOLOGÍA CLÍNICA en adultos y DOSIFICACIÓN Y ADMINISTRACIÓN ). Muy raramente se ha informado prolongación del intervalo QT en pacientes con insuficiencia renal cuya dosis/intervalo de dosificación de famotidina puede no haberse ajustado adecuadamente.
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
En un estudio de 106 semanas en ratas y un estudio de 92 semanas en ratones que recibieron dosis orales de hasta 2000 mg/kg/día (aproximadamente 2500 veces la dosis humana recomendada para la úlcera duodenal activa), no hubo evidencia de potencial carcinogénico para PEPCID.
La famotidina resultó negativa en la prueba de mutágeno microbiano (prueba de Ames) utilizando Salmonella typhimurium y Escherichia coli con o sin activación de enzimas hepáticas de rata en concentraciones de hasta 10 000 mcg/placa. En estudios in vivo en ratones, con una prueba de micronúcleos y una prueba de aberración cromosómica, no se observó evidencia de un efecto mutagénico.
En estudios con ratas que recibieron dosis orales de hasta 2000 mg/kg/día o dosis intravenosas de hasta 200 mg/kg/día, la fertilidad y el rendimiento reproductivo no se vieron afectados.

El embarazo
Embarazo Categoría B
Se han realizado estudios reproductivos en ratas y conejos a dosis orales de hasta 2000 y 500 mg/kg/día, respectivamente, y en ambas especies a dosis IV de hasta 200 mg/kg/día, y no han revelado evidencia significativa de alteración de la fertilidad o daño al feto debido a PEPCID. Si bien no se han observado efectos fetotóxicos directos, se observaron abortos esporádicos que ocurrieron solo en madres que mostraban una marcada disminución en la ingesta de alimentos en algunos conejos con dosis orales de 200 mg/kg/día (250 veces la dosis humana habitual) o más altas. Sin embargo, no existen estudios adecuados o bien controlados en mujeres embarazadas. Debido a que los estudios reproductivos en animales no siempre predicen la respuesta humana, este medicamento debe usarse durante el embarazo solo si es claramente necesario.
Madres lactantes
Los estudios realizados en ratas lactantes han demostrado que la famotidina se secreta en la leche materna. Se observó una depresión transitoria del crecimiento en ratas jóvenes lactantes de madres tratadas con dosis maternotóxicas de al menos 600 veces la dosis humana habitual. La famotidina es detectable en la leche humana. Debido al potencial de reacciones adversas graves de PEPCID en lactantes, se debe tomar la decisión de suspender la lactancia o suspender el fármaco, teniendo en cuenta la importancia del fármaco para la madre.
Pacientes pediátricos
El uso de PEPCID 20 mg en pacientes pediátricos
Dos estudios farmacocinéticos en pacientes pediátricos 3 meses a 1 año de edad es similar a la observada en pacientes pediátricos mayores (1-15 años de edad) y adultos . Por el contrario, los pacientes pediátricos de 0 a 3 meses de edad tenían valores de depuración de famotidina que eran de 2 a 4 veces menores que los de los pacientes pediátricos mayores y adultos. Estos estudios también muestran que la biodisponibilidad media en pacientes pediátricos FARMACOLOGÍA CLÍNICA En pacientes pediátricos , Farmacocinética y Farmacodinamia .)
En un estudio de retiro del tratamiento, aleatorizado, doble ciego, 35 pacientes pediátricos REACCIONES ADVERSAS , Pacientes pediátricos ).
Estos estudios sugieren que una dosis inicial de 0,5 mg/kg/dosis de suspensión oral de famotidina puede ser beneficiosa para el tratamiento de la ERGE durante un máximo de 4 semanas una vez al día en pacientes
Pacientes pediátricos de 1 a 16 años de edad
El uso de 40 mg de PEPCID en pacientes pediátricos de 1 a 16 años de edad está respaldado por la evidencia de estudios adecuados y bien controlados de PEPCID en adultos y por los siguientes estudios en pacientes pediátricos: En estudios publicados en un pequeño número de pacientes pediátricos 1-15 años de edad, la depuración de famotidina fue similar a la observada en adultos. En pacientes pediátricos de 11 a 15 años de edad, las dosis orales de 0,5 mg/kg se asociaron con un área media bajo la curva (AUC) similar a la observada en adultos tratados con 40 mg por vía oral. De manera similar, en pacientes pediátricos de 1 a 15 años de edad, las dosis intravenosas de 0,5 mg/kg se asociaron con un AUC medio similar al observado en adultos tratados por vía intravenosa con 40 mg. Los estudios publicados limitados también sugieren que la relación entre la concentración sérica y la supresión de ácido es similar en pacientes pediátricos de 1 a 15 años de edad en comparación con los adultos. Estos estudios sugieren una dosis inicial para pacientes pediátricos de 1 a 16 años de la siguiente manera:
Úlcera péptica: 0,5 mg/kg/día por vía oral a la hora de acostarse o una oferta dividida hasta 40 mg/día.
Enfermedad por reflujo gastroesofágico con o sin esofagitis, incluidas erosiones y ulceraciones - 1,0 mg/kg/día po dividido bid hasta 40 mg bid
Si bien los estudios no controlados publicados sugieren la eficacia de la famotidina en el tratamiento de la enfermedad por reflujo gastroesofágico y la úlcera péptica, los datos en pacientes pediátricos son insuficientes para establecer el porcentaje de respuesta con la dosis y la duración de la terapia. Por lo tanto, la duración del tratamiento (inicialmente basada en las recomendaciones de duración para adultos) y la dosis deben individualizarse según la respuesta clínica y/o la determinación del pH (gástrico o esofágico) y la endoscopia. Los estudios clínicos no controlados publicados en pacientes pediátricos han empleado dosis de hasta 1 mg/kg/día para la úlcera péptica y 2 mg/kg/día para la ERGE con o sin esofagitis, incluidas erosiones y ulceraciones.
Uso geriátrico
De los 4.966 sujetos en estudios clínicos que fueron tratados con famotidina, 488 sujetos (9,8 %) tenían 65 años o más y 88 sujetos (1,7 %) tenían más de 75 años. No se observaron diferencias generales en seguridad o eficacia entre estos sujetos y sujetos más jóvenes. Sin embargo, no se puede descartar una mayor sensibilidad de algunos individuos mayores.
No es necesario ajustar la dosis en función de la edad (ver FARMACOLOGÍA CLÍNICA en adultos , Farmacocinética ). Se sabe que este fármaco se excreta sustancialmente por vía renal, y el riesgo de reacciones tóxicas a este fármaco puede ser mayor en pacientes con insuficiencia renal. Debido a que es más probable que los pacientes de edad avanzada tengan una función renal disminuida, se debe tener cuidado en la selección de la dosis y puede ser útil monitorear la función renal. Es necesario ajustar la dosis en caso de insuficiencia renal moderada o grave (ver PRECAUCIONES , Pacientes con Insuficiencia Renal Moderada o Severa y DOSIFICACIÓN Y ADMINISTRACIÓN , Ajuste de dosis para pacientes con insuficiencia renal moderada o grave ).
SOBREDOSIS
Las reacciones adversas en casos de sobredosis son similares a las reacciones adversas encontradas en la experiencia clínica normal (ver REACCIONES ADVERSAS ). Se han administrado dosis orales de hasta 640 mg/día a pacientes adultos con condiciones hipersecretoras patológicas sin efectos adversos graves. En caso de sobredosis, el tratamiento debe ser sintomático y de soporte. El material no absorbido se debe eliminar del tracto gastrointestinal, se debe monitorear al paciente y se debe emplear una terapia de apoyo.
La DL50 oral de famotidina en ratas y ratones machos y hembras fue superior a 3000 mg/kg y la dosis oral aguda letal mínima en perros superó los 2000 mg/kg. La famotidina no produjo efectos evidentes en dosis orales altas en ratones, ratas, gatos y perros, pero indujo anorexia significativa y depresión del crecimiento en conejos a partir de 200 mg/kg/día por vía oral. La LD50 intravenosa de famotidina para ratones y ratas osciló entre 254 y 563 mg/kg y la dosis única IV letal mínima en perros fue de aproximadamente 300 mg/kg. Los signos de intoxicación aguda en perros tratados por vía intravenosa fueron emesis, inquietud, palidez de las membranas mucosas o enrojecimiento de la boca y las orejas, hipotensión, taquicardia y colapso.
CONTRAINDICACIONES
Hipersensibilidad a cualquiera de los componentes de estos productos. Se ha observado sensibilidad cruzada en esta clase de compuestos. Por lo tanto, PEPCID 40 mg no debe administrarse a pacientes con antecedentes de hipersensibilidad a otros antagonistas de los receptores H2.
FARMACOLOGÍA CLÍNICA
Farmacología clínica en adultos
Efectos gastrointestinales
PEPCID es un inhibidor competitivo de los receptores H2 de histamina. La principal actividad farmacológica clínicamente importante de PEPCID 40 mg es la inhibición de la secreción gástrica. Tanto la concentración de ácido como el volumen de secreción gástrica son suprimidos por PEPCID, mientras que los cambios en la secreción de pepsina son proporcionales al volumen de salida.
En voluntarios normales e hipersecretores, PEPCID 20 mg inhibió la secreción gástrica basal y nocturna, así como la secreción estimulada por alimentos y pentagastrina. Después de la administración oral, el inicio del efecto antisecretor ocurrió dentro de una hora; el efecto máximo fue dependiente de la dosis, ocurriendo dentro de una a tres horas. La duración de la inhibición de la secreción por dosis de 20 y 40 mg fue de 10 a 12 horas.
Las dosis orales únicas vespertinas de 20 y 40 mg inhibieron la secreción ácida basal y nocturna en todos los sujetos; La secreción ácida gástrica nocturna media se inhibió en un 86 % y un 94 %, respectivamente, durante un período de al menos 10 horas. Las mismas dosis administradas por la mañana suprimieron la secreción de ácido estimulada por los alimentos en todos los sujetos. La supresión media fue del 76 % y el 84 %, respectivamente, de 3 a 5 horas después de la administración, y del 25 % y el 30 %, respectivamente, de 8 a 10 horas después de la administración. Sin embargo, en algunos sujetos que recibieron la dosis de 20 mg, el efecto antisecretor se disipó en 6 a 8 horas. No hubo efecto acumulativo con dosis repetidas. El pH intragástrico nocturno aumentó con las dosis vespertinas de 20 y 40 mg de PEPCID a valores medios de 5,0 y 6,4, respectivamente. Cuando se administró PEPCID 40 mg después del desayuno, el pH interdigestivo diurno basal a las 3 y 8 horas después de 20 o 40 mg de PEPCID 40 mg se elevó a aproximadamente 5.
PEPCID 40 mg tuvo poco o ningún efecto sobre los niveles de gastrina sérica en ayunas o posprandiales. El vaciamiento gástrico y la función pancreática exocrina no se vieron afectados por PEPCID.
Otros efectos
Los efectos sistémicos de PEPCID en el sistema nervioso central, cardiovascular, respiratorio o endocrino no se observaron en los estudios de farmacología clínica. Además, no se observaron efectos antiandrogénicos. (Ver REACCIONES ADVERSAS .) Los niveles de hormonas séricas, incluidos prolactina, cortisol, tiroxina (T4) y testosterona, no se alteraron después del tratamiento con PEPCID.
Farmacocinética
PEPCID 20 mg se absorbe de forma incompleta. La biodisponibilidad de las dosis orales es del 40-45%. La biodisponibilidad puede aumentar ligeramente con los alimentos o disminuir ligeramente con los antiácidos; sin embargo, estos efectos no tienen consecuencias clínicas. PEPCID sufre un metabolismo mínimo de primer paso. Después de las dosis orales, los niveles plasmáticos máximos ocurren en 1 a 3 horas. Los niveles plasmáticos después de dosis múltiples son similares a los de dosis únicas. Entre el 15 y el 20 % de PEPCID 20 mg en plasma se une a proteínas. PEPCID tiene una vida media de eliminación de 2,5 a 3,5 horas. PEPCID se elimina por vía renal (65-70%) y metabólica (30-35%). El aclaramiento renal es de 250 a 450 ml/min, lo que indica cierta excreción tubular. Del 25 al 30 % de una dosis oral y del 65 al 70 % de una dosis intravenosa se recuperan en la orina como compuesto inalterado. El único metabolito identificado en el hombre es el S-óxido.
Existe una estrecha relación entre los valores de aclaramiento de creatinina y la vida media de eliminación de PEPCID. En pacientes con insuficiencia renal grave, es decir, aclaramiento de creatinina inferior a 10 ml/min, la vida media de eliminación de PEPCID puede exceder las 20 horas y puede ser necesario ajustar la dosis o los intervalos de dosificación en insuficiencia renal moderada y grave (ver PRECAUCIONES , DOSIFICACIÓN Y ADMINISTRACIÓN ).
En pacientes de edad avanzada, no hay cambios clínicamente significativos relacionados con la edad en la farmacocinética de PEPCID. Sin embargo, en pacientes de edad avanzada con función renal disminuida, la depuración del fármaco puede disminuir (ver PRECAUCIONES , Uso geriátrico ).
Estudios clínicos
Úlcera duodenal
En un estudio doble ciego multicéntrico de EE. UU. en pacientes ambulatorios con úlcera duodenal confirmada por endoscopia, se comparó PEPCID administrado por vía oral con placebo. Como se muestra en la Tabla 1, el 70 % de los pacientes tratados con PEPCID 40 mg hs se curaron en la semana 4.
Los pacientes que no se curaron en la semana 4 continuaron en el estudio. Para la semana 8, el 83 % de los pacientes tratados con PEPCID se había curado frente al 45 % de los pacientes tratados con placebo. La incidencia de curación de úlceras con PEPCID fue significativamente mayor que con placebo en cada punto de tiempo según la proporción de úlceras curadas confirmadas por endoscopia.
En este estudio, el tiempo hasta el alivio del dolor diurno y nocturno fue significativamente más corto para los pacientes que recibieron PEPCID que para los pacientes que recibieron placebo; los pacientes que recibieron PEPCID también tomaron menos antiácido que los pacientes que recibieron placebo.
Tratamiento de mantenimiento a largo plazo de las úlceras duodenales
PEPCID 40 mg, 20 mg pohs, se comparó con placebo hs como terapia de mantenimiento en dos estudios multicéntricos doble ciego de pacientes con úlceras duodenales curadas confirmadas endoscópicamente. En el estudio de EE. UU., la incidencia de úlceras observada dentro de los 12 meses en pacientes tratados con placebo fue 2,4 veces mayor que en los pacientes tratados con PEPCID. Los 89 pacientes tratados con PEPCID tuvieron una incidencia acumulada de úlceras observada del 23,4 % en comparación con una incidencia de úlceras observada del 56,6 % en los 89 pacientes que recibieron placebo (p
Úlcera gástrica
En un estudio multicéntrico internacional y de EE. UU., doble ciego, en pacientes con úlcera gástrica benigna activa confirmada por endoscopia, se comparó PEPCID 20 mg, 40 mg hs administrado por vía oral con placebo hs Se permitieron los antiácidos durante los estudios, pero el consumo no fue significativamente diferente entre los grupos PEPCID y placebo. Como se muestra en la Tabla 2, la incidencia de curación de úlceras (abandonos contados como no curados) con PEPCID 20 mg fue estadísticamente significativamente mejor que el placebo en las semanas 6 y 8 en el estudio de EE. UU., y en las semanas 4, 6 y 8 en el estudio internacional, según sobre el número de úlceras que curaron, confirmado por endoscopia.
El tiempo para el alivio completo del dolor diurno y nocturno fue estadísticamente significativamente más corto para los pacientes que recibieron 20 mg de PEPCID que para los pacientes que recibieron placebo; sin embargo, en ninguno de los estudios hubo una diferencia estadísticamente significativa en la proporción de pacientes cuyo dolor se alivió al final del estudio (semana 8).
Enfermedad por reflujo gastroesofágico (ERGE)
La PEPCID administrada por vía oral se comparó con un placebo en un estudio estadounidense que inscribió a pacientes con síntomas de ERGE y sin evidencia endoscópica de erosión o ulceración del esófago. PEPCID 20 mg bid fue estadísticamente significativamente superior a 40 mg hs y al placebo para proporcionar un resultado sintomático exitoso, definido como una mejora moderada o excelente de los síntomas (Tabla 3).
A las dos semanas de tratamiento, se observó éxito sintomático en un mayor porcentaje de pacientes que tomaban PEPCID 20 mg dos veces al día en comparación con el placebo (p ≤ 0,01).
En dos ensayos adicionales se estudiaron la mejoría sintomática y la curación de la erosión y la ulceración verificadas endoscópicamente. La curación se definió como la resolución completa de todas las erosiones o ulceraciones visibles con endoscopia. El estudio de EE. UU. que comparó PEPCID 40 mg pobid con placebo y PEPCID 20 mg pobid mostró un porcentaje significativamente mayor de curación para PEPCID 40 mg dos veces al día en las semanas 6 y 12 (Tabla 4).
En comparación con el placebo, los pacientes que recibieron PEPCID experimentaron un alivio más rápido de la acidez estomacal diurna y nocturna y un mayor porcentaje de pacientes experimentó un alivio completo de la acidez estomacal nocturna. Estas diferencias fueron estadísticamente significativas.
En el estudio internacional, cuando se comparó PEPCID 40 mg dos veces al día con ranitidina 150 mg dos veces al día, se observó un porcentaje de curación significativamente mayor desde el punto de vista estadístico con PEPCID 40 mg dos veces al día en la semana 12 (Tabla 5). Sin embargo, no hubo diferencias significativas entre los tratamientos en el alivio de los síntomas.
Condiciones hipersecretoras patológicas (p. ej., síndrome de Zollinger-Ellison, adenomas endocrinos múltiples)
En estudios de pacientes con afecciones hipersecretoras patológicas como el síndrome de Zollinger-Ellison con o sin adenomas endocrinos múltiples, PEPCID inhibió significativamente la secreción de ácido gástrico y controló los síntomas asociados. Las dosis administradas por vía oral de 20 a 160 mg cada 6 h mantuvieron la secreción de ácido basal por debajo de 10 mEq/h; las dosis iniciales se titularon según las necesidades individuales del paciente y en algunos pacientes fueron necesarios ajustes posteriores con el tiempo. PEPCID 40 mg fue bien tolerado en estos altos niveles de dosis durante períodos prolongados (más de 12 meses) en ocho pacientes, y no se informaron casos de ginecomastia, aumento de los niveles de prolactina o impotencia que se consideraron debidos al fármaco.
Farmacología clínica en pacientes pediátricos
Farmacocinética
La Tabla 6 presenta datos farmacocinéticos de ensayos clínicos y un estudio publicado en pacientes pediátricos (
El aclaramiento plasmático se reduce y la vida media de eliminación se prolonga en pacientes pediátricos de 0 a 3 meses de edad en comparación con pacientes pediátricos mayores. Los parámetros farmacocinéticos para pacientes pediátricos, edades > 3 meses-15 años, son comparables a los obtenidos para adultos.
Los estudios de biodisponibilidad de 8 pacientes pediátricos (11-15 años de edad) mostraron una biodisponibilidad oral media de 0,5 en comparación con los valores de adultos de 0,42 a 0,49. Las dosis orales de 0,5 mg/kg lograron AUC de 645 ± 249 ng-hr/mL y 580 ± 60 ng-hr/mL en pacientes pediátricos
Farmacodinámica
Se evaluó la farmacodinámica de la famotidina en 5 pacientes pediátricos de 2 a 13 años de edad utilizando el modelo sigmoide Emax. Estos datos sugieren que la relación entre la concentración sérica de famotidina y la supresión del ácido gástrico es similar a la observada en un estudio de adultos (Tabla 7).
Cinco estudios publicados (Tabla 8) examinaron el efecto de la famotidina sobre el pH gástrico y la duración de la supresión ácida en pacientes pediátricos. Si bien cada estudio tuvo un diseño diferente, los datos de supresión de ácido a lo largo del tiempo se resumen de la siguiente manera:
En un estudio, se demostró que la duración del efecto de 0,5 mg/kg de famotidina IV sobre el pH gástrico y la supresión del ácido es más prolongada en pacientes pediátricos
INFORMACIÓN DEL PACIENTE
No se proporcionó información. por favor refiérase a PRECAUCIONES sección.
