Prevacid 15mg, 30mg Lansoprazole Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Prevacid y cómo se usa?
Prevacid 15 mg es un medicamento recetado que se usa para tratar los síntomas de las úlceras estomacales e intestinales y para disminuir la cantidad de ácido producido en el estómago. Prevacid 15 mg se puede usar solo o con otros medicamentos.
- Prevacid 15 mg es un inhibidor de la bomba de protones.
¿Cuáles son los posibles efectos secundarios de Prevacid 30 mg?
Prevacid 30 mg puede causar efectos secundarios graves, que incluyen:
- dolor de estómago severo,
- diarrea que contiene sangre,
- convulsiones (convulsiones,
- dificultad para orinar,
- sangre en tu orina,
- hinchazón,
- rápido aumento de peso,
- mareo,
- frecuencia cardíaca rápida o irregular,
- sacudida,
- movimientos musculares espasmódicos,
- sintiéndose nervioso,
- calambres musculares o espasmos en las manos o los pies,
- tos,
- sintiendo que te estás ahogando,
- dolor en las articulaciones, y
- erupción cutánea en las mejillas o los brazos que empeora con la luz del sol
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Prevacid 15 mg incluyen:
- náuseas,
- dolor de estómago,
- Diarrea,
- estreñimiento, y
- dolor de cabeza
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Prevacid. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
PREVACIDO (lansoprazol) tabletas de disolución oral de liberación retardada
DESCRIPCIÓN
El ingrediente activo de PREVACID 30 mg en cápsulas de liberación retardada y PREVACID de 15 mg SoluTab en tabletas de desintegración oral de liberación retardada es lansoprazol, un bencimidazol sustituido, 2-[[[3-metil-4-(2,2,2trifluoroetoxi)-2-piridilo] metil] sulfinil] bencimidazol, un compuesto que inhibe la secreción de ácido gástrico. Su fórmula empírica es C16H14F3N3O2S con un peso molecular de 369,37. Lansoprazol tiene la siguiente estructura:
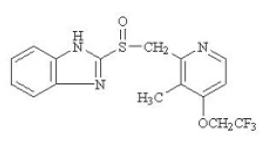
El lansoprazol es un polvo cristalino inodoro de color blanco a blanco pardusco que se funde con la descomposición a aproximadamente 166 °C. Lansoprazol es libremente soluble en dimetilformamida; soluble en metanol; escasamente soluble en etanol; ligeramente soluble en acetato de etilo, diclorometano y acetonitrilo; muy poco soluble en éter y prácticamente insoluble en hexano y agua.
Lansoprazol es estable cuando se expone a la luz hasta por dos meses. La tasa de degradación del compuesto en una solución acuosa aumenta al disminuir el pH. La vida media de degradación del fármaco en una solución acuosa a 25°C es de aproximadamente 0,5 horas a pH 5,0 y de aproximadamente 18 horas a pH 7,0.
PREVACID se suministra en cápsulas de liberación retardada y PREVACID 15 mg SoluTab se suministra en tabletas de disolución oral de liberación retardada (SoluTab) para administración oral.
PREVACID está disponible en dos dosis: 15 y 30 mg de lansoprazol por cápsula. Cada cápsula de liberación retardada contiene gránulos con cubierta entérica que consisten en 15 o 30 mg de lansoprazol (ingrediente activo) y los siguientes ingredientes inactivos: esfera de azúcar, sacarosa, copolímero de ácido metacrílico, hidroxipropilcelulosa de baja sustitución, almidón, carbonato de magnesio, talco, polietileno. glicol, dióxido de titanio, polisorbato 80, hidroxipropilcelulosa, dióxido de silicio coloidal, D&C Red No. 28, FD&C Blue No. 1, FD&C Green No. 31 y FD&C Red No. 40.
PREVACID 30 mg SoluTab está disponible en dos dosis: 15 y 30 mg de lansoprazol por tableta. Cada comprimido de disolución oral de liberación retardada contiene microgránulos con cubierta entérica que consisten en 15 o 30 mg de lansoprazol (ingrediente activo) y los siguientes ingredientes inactivos: manitol, ácido metacrílico, hidroxipropilcelulosa, lactosa monohidrato-esfera de celulosa microcristalina, citrato de trietilo, crospovidona, poliacrilato, carbonato de magnesio, aspartamo2, monoestearato de glicerilo, hipromelosa, estearato de magnesio, ácido cítrico, dióxido de titanio, talco, sabor a fresa artificial, polietilenglicol, polisorbato 80 y óxido férrico.
1Cápsulas de 15 mg de PREVACID únicamente. 2Fenilcetonúricos: PREVACID SoluTab contiene 2,5 mg de fenilalanina por comprimido de 15 mg y 5,1 mg por comprimido de 30 mg.
INDICACIONES
Tratamiento de la úlcera duodenal activa
PREVACID y PREVACID SoluTab están indicados en adultos para el tratamiento a corto plazo (durante cuatro semanas) para la curación y el alivio de los síntomas de la úlcera duodenal activa [ver Estudios clínicos ].
Erradicación de H. pylori para reducir el riesgo de recurrencia de la úlcera duodenal
Triple Terapia: PREVACID o PREVACID SoluTab/amoxicilina/claritromicina
PREVACID o PREVACID 30 mg SoluTab en combinación con amoxicilina más claritromicina como terapia triple está indicado en adultos para el tratamiento de pacientes con infección por H. pylori y enfermedad de úlcera duodenal (activa o con un año de evolución de una úlcera duodenal) para erradicar H. pylori. Se ha demostrado que la erradicación de H. pylori reduce el riesgo de recurrencia de la úlcera duodenal [ver Estudios clínicos ].
Consulte la información de prescripción completa de amoxicilina y claritromicina.
Terapia dual: PREVACID o PREVACID SoluTab/amoxicilina
PREVACID o PREVACID 15 mg SoluTab en combinación con amoxicilina como terapia dual está indicado en adultos para el tratamiento de pacientes con infección por H. pylori y úlcera duodenal (úlcera duodenal activa o con un año de evolución) que son alérgicos o intolerantes a la claritromicina o en quienes se conoce o se sospecha resistencia a la claritromicina (consulte la información de prescripción de claritromicina, sección Microbiología). Se ha demostrado que la erradicación de H. pylori reduce el riesgo de recurrencia de la úlcera duodenal [ver Estudios clínicos ].
Consulte la información de prescripción completa de amoxicilina.
Mantenimiento de úlceras duodenales curadas
PREVACID y PREVACID SoluTab están indicados en adultos para mantener la cicatrización de las úlceras duodenales. Los estudios controlados no se extienden más allá de 12 meses [ver Estudios clínicos ].
Tratamiento de la úlcera gástrica benigna activa
PREVACID y PREVACID 30 mg SoluTab están indicados en adultos para el tratamiento a corto plazo (hasta ocho semanas) para la curación y el alivio de los síntomas de la úlcera gástrica benigna activa [ver Estudios clínicos ].
Curación de úlcera gástrica asociada a AINE
PREVACID 30 mg y PREVACID SoluTab están indicados en adultos para el tratamiento de la úlcera gástrica asociada a AINE en pacientes que continúan tomando AINE. Los estudios controlados no se extendieron más allá de ocho semanas [ver Estudios clínicos ].
Reducción del riesgo de úlcera gástrica asociada a AINE
PREVACID 15 mg y PREVACID SoluTab están indicados en adultos para reducir el riesgo de úlceras gástricas asociadas a AINE en pacientes con antecedentes de úlcera gástrica documentada que requieren el uso de un AINE. Los estudios controlados no se extendieron más allá de las 12 semanas [ver Estudios clínicos ].
Tratamiento de la enfermedad por reflujo gastroesofágico sintomático (ERGE)
PREVACID 15 mg y PREVACID 30 mg SoluTab están indicados para el tratamiento a corto plazo en adultos y pacientes pediátricos de 12 a 17 años (hasta ocho semanas) y pacientes pediátricos de uno a 11 años (hasta 12 semanas) para el tratamiento de la acidez estomacal. y otros síntomas asociados con la ERGE [ver Estudios clínicos ].
Tratamiento de la esofagitis erosiva (EE)
PREVACID 15 mg y PREVACID 30 mg SoluTab están indicados para el tratamiento a corto plazo en adultos y pacientes pediátricos de 12 a 17 años (hasta ocho semanas) y pacientes pediátricos de uno a 11 años (hasta 12 semanas) para la curación y el alivio de los síntomas. de todos los grados de EE.
Para los adultos que no sanan con PREVACID 30 mg o PREVACID 15 mg SoluTab durante ocho semanas (5 a 10 %), puede ser útil administrar ocho semanas adicionales de tratamiento. Si hay una recurrencia de la esofagitis erosiva, se puede considerar un curso adicional de ocho semanas de PREVACID 30 mg o PREVACID SoluTab [ver Estudios clínicos ].
Mantenimiento De La Curación De EE
PREVACID y PREVACID SoluTab están indicados en adultos para mantener la cicatrización del EE. Los estudios controlados no se extendieron más allá de 12 meses [ver Estudios clínicos ].
Condiciones hipersecretoras patológicas, incluido el síndrome de Zollinger-Ellison (ZES)
PREVACID 15 mg y PREVACID SoluTab están indicados en adultos para el tratamiento a largo plazo de condiciones hipersecretoras patológicas, incluido el síndrome de Zollinger-Ellison [ver Estudios clínicos ].
DOSIFICACIÓN Y ADMINISTRACIÓN
Dosis recomendada para adultos por indicación
Dosis pediátrica recomendada por indicación
Pacientes pediátricos de 1 a 11 años de edad
En estudios clínicos, PREVACID no se administró más allá de las 12 semanas en niños de 1 a 11 años. No se sabe si PREVACID es seguro y efectivo si se usa por más tiempo del recomendado. No exceda la dosis recomendada y la duración del uso en pacientes pediátricos como se describe a continuación [ver Uso en poblaciones específicas ].
Deterioro hepático
La dosis recomendada es de 15 mg por vía oral al día en pacientes con insuficiencia hepática grave (Child-Pugh C) [ver Uso en poblaciones específicas ].
Información importante de administración
- Tome PREVACID o PREVACID 30 mg SoluTab antes de las comidas.
- No triture ni mastique PREVACID 15 mg cápsula o PREVACID 30 mg SoluTab.
- Tome PREVACID o PREVACID 30 mg SoluTab al menos 30 minutos antes del sucralfato [ver INTERACCIONES CON LA DROGAS ].
- Los antiácidos pueden usarse concomitantemente con PREVACID o PREVACID SoluTab.
- Dosis olvidadas: Si se olvida una dosis, administre lo antes posible. Sin embargo, si le toca la próxima dosis programada, no tome la dosis olvidada y tome la siguiente dosis a tiempo. No tome dos dosis a la vez para compensar la dosis olvidada.
Cápsulas PREVACID
- Trágalo todo; no masticar
- Para los pacientes que tienen dificultad para tragar las cápsulas, las cápsulas de PREVACID se pueden abrir y administrar por vía oral o mediante una sonda nasogástrica en los alimentos blandos o líquidos que se especifican a continuación.
- La administración de PREVACID en alimentos o líquidos distintos de los que se analizan a continuación no se ha estudiado clínicamente y, por lo tanto, no se recomienda.
Administración en Alimentos blandos (puré de manzana, pudín ENSURE, requesón, yogur o peras coladas):
Administración en Líquidos (jugo de manzana, jugo de naranja o jugo de tomate):
Administración con jugo de manzana a través de una sonda nasogástrica (≥16 French)
PREVACID 15 mg SoluTab
- No rompa ni corte.
- Coloque la tableta en la lengua, deje que se desintegre, con o sin agua, hasta que se puedan tragar los microgránulos. No mastique los microgránulos.
- La tableta generalmente se desintegra en menos de un minuto.
- Alternativamente, para niños u otros pacientes que tienen dificultad para tragar tabletas, PREVACID SoluTab puede administrarse con agua a través de una jeringa oral o una sonda NG de la siguiente manera:
Administración Con Agua En Una Jeringa Oral
Administración con agua a través de un tubo NG (≥8 French)
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
PREVACID 15 mg Cápsulas de liberación retardada
- La concentración de 15 mg es una cápsula opaca, de color rosa y verde, impresa con "TAP" y "PREVACID 15".
- La concentración de 30 mg es una cápsula opaca, de color rosa y negro, impresa con "TAP" y "PREVACID 30".
PREVACID 30 mg SoluTab Comprimidos de disolución oral de liberación retardada
- La concentración de 15 mg es un comprimido redondo sin recubrir de color blanco a blanco amarillento que contiene motas de color naranja a marrón oscuro con un "15" grabado en un lado.
- La concentración de 30 mg es un comprimido redondo sin recubrir de color blanco a blanco amarillento que contiene motas de color naranja a marrón oscuro con "30" grabado en un lado.
Almacenamiento y manipulación
PREVACID cápsulas de liberación retardada , 15 mg, son opacos, de color rosa y verde con "TAP" y "PREVACID 15" impresos en las cápsulas. Las cápsulas de liberación retardada de 30 mg son opacas, rosadas y negras con "TAP" y "PREVACID 30" impresos en las cápsulas. Están disponibles de la siguiente manera:
PREVACID 30 mg SoluTab tabletas de disolución oral de liberación retardada , 15 mg, son comprimidos redondos sin recubrir de color blanco a blanco amarillento que contienen motas de color naranja a marrón oscuro, con "15" grabado en una cara del comprimido. Los comprimidos de 30 mg son de color blanco a blanco amarillento, redondos, sin recubrimiento, que contienen motas de color naranja a marrón oscuro, con "30" grabado en una cara del comprimido. Las tabletas están disponibles de la siguiente manera:
Almacenar a 25°C (77°F); excursiones permitidas a 15-30°C (59-86°F) [ver Temperatura ambiente controlada por USP ].
Distribuido por: Takeda Pharmaceuticals America, Inc., Deerfield, IL 60015. Revisado: junio de 2018
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas graves se describen a continuación y en otras partes del etiquetado:
- Nefritis tubulointersticial aguda [ver ADVERTENCIAS Y PRECAUCIONES ]
- Diarrea asociada a Clostridium difficile [ver ADVERTENCIAS Y PRECAUCIONES ]
- Fractura ósea [ver ADVERTENCIAS Y PRECAUCIONES ]
- Reacciones adversas cutáneas graves [ver ADVERTENCIAS Y PRECAUCIONES ]
- Lupus eritematoso cutáneo y sistémico [ver ADVERTENCIAS Y PRECAUCIONES ]
- Deficiencia de cianocobalamina (vitamina B12) [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hipomagnesemia y metabolismo mineral [ver ADVERTENCIAS Y PRECAUCIONES ]
- Pólipos de las glándulas fúndicas [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica clínica.
En todo el mundo, más de 10 000 pacientes han sido tratados con PREVACID 30 mg en ensayos clínicos de Fase 2 o Fase 3 que involucran varias dosis y duraciones de tratamiento. En general, el tratamiento con PREVACID 30 mg ha sido bien tolerado en ensayos a corto y largo plazo.
El médico tratante informó que las siguientes reacciones adversas tienen una relación posible o probable con el fármaco en el 1 % o más de los pacientes tratados con PREVACID y ocurrieron a una tasa mayor en los pacientes tratados con PREVACID que en los pacientes tratados con placebo en la Tabla 1.
El dolor de cabeza también se observó con una incidencia superior al 1%, pero fue más común con el placebo. La incidencia de diarrea fue similar entre los pacientes que recibieron placebo y los pacientes que recibieron 15 y 30 mg de PREVACID, pero mayor en los pacientes que recibieron 60 mg de PREVACID (2,9, 1,4, 4,2 y 7,4 %, respectivamente).
El acontecimiento adverso posiblemente o probablemente relacionado con el tratamiento notificado con mayor frecuencia durante la terapia de mantenimiento fue la diarrea.
En el estudio de reducción de riesgo de PREVACID para úlceras gástricas asociadas a AINE, la incidencia de diarrea en pacientes tratados con PREVACID 30 mg, misoprostol y placebo fue del 5, 22 y 3 %, respectivamente.
Otro estudio para la misma indicación, en el que los pacientes tomaron un inhibidor de la COX-2 o lansoprazol y naproxeno, demostró que el perfil de seguridad era similar al del estudio anterior. Las reacciones adicionales de este estudio que no se observaron previamente en otros ensayos clínicos con PREVACID 30 mg incluyeron contusión, duodenitis, malestar epigástrico, trastorno esofágico, fatiga, hambre, hernia de hiato, ronquera, alteración del vaciado gástrico, metaplasia e insuficiencia renal.
Las experiencias adversas adicionales que ocurrieron en menos del 1 % de los pacientes o sujetos que recibieron PREVACID 15 mg en ensayos nacionales se muestran a continuación:
Cuerpo como un Todo - abdomen agrandado, reacción alérgica, astenia, dolor de espalda, candidiasis, carcinoma, dolor torácico (no especificado), escalofríos, edema, fiebre, síndrome gripal, halitosis, infección (no especificada), malestar general, dolor de cuello, rigidez del cuello, dolor , dolor pélvico
Sistema cardiovascular - angina de pecho, arritmia, bradicardia, accidente cerebrovascular/infarto cerebral, hipertensión/hipotensión, migraña, infarto de miocardio, palpitaciones, shock (insuficiencia circulatoria), síncope, taquicardia, vasodilatación
Sistema digestivo - heces anormales, anorexia, bezoar, cardioespasmo, colelitiasis, colitis, boca seca, dispepsia, disfagia, enteritis, eructos, estenosis esofágica, úlcera esofágica, esofagitis, decoloración fecal, flatulencia, nódulos gástricos/pólipos de glándulas fúndicas, gastritis, gastroenteritis, anomalía gastrointestinal , trastorno gastrointestinal, hemorragia gastrointestinal, glositis, hemorragia de las encías, hematemesis, aumento del apetito, aumento de la salivación, melena, úlceras en la boca, náuseas y vómitos, náuseas, vómitos y diarrea, moniliasis gastrointestinal, trastorno rectal, hemorragia rectal, estomatitis, tenesmo, sed, trastorno de la lengua, colitis ulcerosa, estomatitis ulcerosa
Sistema endocrino - diabetes mellitus, bocio, hipotiroidismo Sistema hemático y linfático - anemia, hemólisis, linfadenopatía
Trastornos del Metabolismo y la Nutrición - avitaminosis, gota, deshidratación, hiperglucemia/hipoglucemia, edema periférico, aumento/pérdida de peso
Sistema musculoesquelético - artralgia, artritis, trastorno óseo, trastorno articular, calambres en las piernas, dolor musculoesquelético, mialgia, miastenia, ptosis, sinovitis
Sistema nervioso - sueños anormales, agitación, amnesia, ansiedad, apatía, confusión, convulsiones, demencia, despersonalización, depresión, diplopía, mareos, labilidad emocional, alucinaciones, hemiplejía, hostilidad agravada, hipercinesia, hipertonía, hipoestesia, insomnio, disminución/aumento de la libido, nerviosismo, neurosis, parestesia, trastorno del sueño, somnolencia, pensamiento anormal, temblor, vértigo
Sistema respiratorio - asma, bronquitis, aumento de la tos, disnea, epistaxis, hemoptisis, hipo, neoplasia laríngea, fibrosis pulmonar, faringitis, trastorno pleural, neumonía, trastorno respiratorio, inflamación/infección de las vías respiratorias superiores, rinitis, sinusitis, estridor
Piel y Anexos - acné, alopecia, dermatitis de contacto, piel seca, erupción fija, trastorno del cabello, erupción maculopapular, trastorno de las uñas, prurito, erupción, carcinoma de piel, trastorno de la piel, sudoración, urticaria
Sentidos especiales - visión anormal, ambliopía, blefaritis, visión borrosa, cataratas, conjuntivitis, sordera, ojos secos, trastorno del oído/ojo, dolor ocular, glaucoma, otitis media, parosmia, fotofobia, degeneración/trastorno de la retina, pérdida del gusto, perversión del gusto, tinnitus, visual defecto de campo
Sistema Urogenital - menstruaciones anormales, agrandamiento de los senos, dolor en los senos, sensibilidad en los senos, dismenorrea, disuria, ginecomastia, impotencia, cálculos renales, dolor en los riñones, leucorrea, menorragia, trastorno menstrual, trastorno del pene, poliuria, trastorno testicular, dolor uretral, polaquiuria, retención urinaria, infección del tracto urinario, urgencia urinaria, dificultad para orinar, vaginitis
Experiencia posterior a la comercialización
Se han informado experiencias adversas adicionales desde que se comercializaron PREVACID y PREVACID 30 mg SoluTab. La mayoría de estos casos son de origen extranjero y no se ha establecido una relación con PREVACID 15 mg o PREVACID SoluTab. Debido a que estas reacciones fueron informadas voluntariamente por una población de tamaño desconocido, no se pueden hacer estimaciones de frecuencia. Estos eventos se enumeran a continuación por sistema corporal COSTART.
Cuerpo como un Todo - reacciones anafilácticas/anafilactoides, lupus eritematoso sistémico;
Sistema digestivo - hepatotoxicidad, pancreatitis, vómitos;
Sistema Hemático y Linfático - agranulocitosis, anemia aplásica, anemia hemolítica, leucopenia, neutropenia, pancitopenia, trombocitopenia y púrpura trombocitopénica trombótica;
Infecciones e Infestaciones - Diarrea asociada a Clostridium difficile;
Trastornos del Metabolismo y la Nutrición - hipomagnesemia, hipocalcemia, hipopotasemia, hiponatremia;
Sistema musculoesquelético - fractura ósea, miositis;
Piel y Anexos - reacciones dermatológicas graves que incluyen eritema multiforme, SJS/TEN (algunos fatales), DRESS, AGEP, lupus eritematoso cutáneo;
Sentidos especiales - desorden del habla;
Sistema Urogenital - nefritis intersticial, retención urinaria.
Terapia combinada con amoxicilina y claritromicina
En los ensayos clínicos que utilizaron la terapia combinada con PREVACID más amoxicilina y claritromicina, y PREVACID 30 mg más amoxicilina, no se observaron reacciones adversas propias de estas combinaciones de medicamentos. Las reacciones adversas que han ocurrido se han limitado a las que se habían informado previamente con PREVACID 15 mg, amoxicilina o claritromicina.
Triple Terapia: PREVACID/amoxicilina/claritromicina
Las reacciones adversas notificadas con mayor frecuencia en los pacientes que recibieron la terapia triple durante 14 días fueron diarrea (7 %), dolor de cabeza (6 %) y alteración del gusto (5 %). No hubo diferencias estadísticamente significativas en la frecuencia de las reacciones adversas notificadas entre los regímenes de terapia triple de 10 y 14 días. No se observaron reacciones adversas emergentes del tratamiento a tasas significativamente más altas con la terapia triple que con cualquier régimen de terapia dual.
Terapia dual: PREVACID/amoxicilina
Las reacciones adversas notificadas con mayor frecuencia por los pacientes que recibieron PREVACID 30 mg tres veces al día más amoxicilina tres veces al día en terapia dual fueron diarrea (8 %) y dolor de cabeza (7 %). No se observaron reacciones adversas emergentes del tratamiento a tasas significativamente más altas con PREVACID 30 mg tres veces al día más amoxicilina tres veces al día en terapia dual que con PREVACID 15 mg solo.
Para obtener información sobre reacciones adversas con agentes antibacterianos (amoxicilina y claritromicina) indicados en combinación con PREVACID o PREVACID SoluTab, consulte la sección de Reacciones adversas de su información de prescripción.
Valores de laboratorio
Los siguientes cambios en los parámetros de laboratorio en pacientes que recibieron PREVACID 30 mg se informaron como reacciones adversas:
Pruebas de función hepática anormales, aumento de SGOT (AST), aumento de SGPT (ALT), aumento de creatinina, aumento de fosfatasa alcalina, aumento de globulinas, aumento de GGTP, aumento/disminución/anomalía de glóbulos blancos, proporción de AG anormal, glóbulos rojos anormales, bilirrubinemia, aumento de potasio en sangre, aumento de urea en sangre, presencia de cristales en orina, eosinofilia, disminución de hemoglobina, hiperlipemia, aumento/disminución de electrolitos, aumento/disminución de colesterol, aumento de glucocorticoides, aumento de LDH, aumento/disminución/anormalidad de plaquetas, aumento de los niveles de gastrina y sangre oculta en heces positiva. También se informaron anomalías en la orina como albuminuria, glucosuria y hematuria. Se informaron anomalías de laboratorio aisladas adicionales.
En los estudios controlados con placebo, cuando se evaluaron SGOT (AST) y SGPT (ALT), el 0,4 % (4/978) y el 0,4 % (11/2677) de los pacientes que recibieron placebo y PREVACID, respectivamente, tuvieron elevaciones enzimáticas superiores a tres veces el límite superior del rango normal en la última visita de tratamiento. Ninguno de estos pacientes que recibieron PREVACID 30 mg informó ictericia en ningún momento durante el estudio.
En los ensayos clínicos que utilizaron la terapia combinada con PREVACID 15 mg más amoxicilina y claritromicina, y PREVACID más amoxicilina, no se observó un aumento de las anomalías de laboratorio particulares de estas combinaciones de medicamentos.
Para obtener información sobre cambios en los valores de laboratorio con agentes antibacterianos (amoxicilina y claritromicina) indicados en combinación con PREVACID o PREVACID 30 mg SoluTab, consulte la sección de Reacciones adversas de su información de prescripción.
INTERACCIONES CON LA DROGAS
Las tablas 2 y 3 incluyen medicamentos con interacciones farmacológicas clínicamente importantes e interacción con diagnósticos cuando se administran concomitantemente con PREVACID 15 mg o PREVACID SoluTab e instrucciones para prevenirlas o manejarlas.
Consulte la etiqueta de los medicamentos utilizados de forma concomitante para obtener más información sobre las interacciones con los IBP.
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Presencia de malignidad gástrica
En adultos, la respuesta sintomática al tratamiento con PREVACID 15 mg o PREVACID SoluTab no excluye la presencia de cáncer gástrico. Considere un seguimiento adicional y pruebas de diagnóstico en pacientes adultos que tienen una respuesta subóptima o una recaída sintomática temprana después de completar el tratamiento con un IBP. En pacientes mayores, también considere una endoscopia.
Nefritis tubulointersticial aguda
Se ha observado nefritis tubulointersticial aguda (TIN) en pacientes que toman IBP y puede ocurrir en cualquier momento durante la terapia con IBP. Los pacientes pueden presentar diversos signos y síntomas, desde reacciones de hipersensibilidad sintomática hasta síntomas no específicos de disminución de la función renal (p. ej., malestar general, náuseas, anorexia). En las series de casos notificadas, algunos pacientes fueron diagnosticados mediante biopsia y en ausencia de manifestaciones extrarrenales (p. ej., fiebre, exantema o artralgia). Suspender PREVACID o PREVACID 15 mg SoluTab y evaluar a los pacientes con sospecha de TIN aguda [ver CONTRAINDICACIONES ].
Diarrea asociada a Clostridium difficile
Los estudios observacionales publicados sugieren que la terapia con IBP como PREVACID 30 mg y PREVACID 30 mg SoluTab puede estar asociada con un mayor riesgo de diarrea asociada a Clostridium difficile (CDAD), especialmente en pacientes hospitalizados. Este diagnóstico debe considerarse para la diarrea que no mejora [ver REACCIONES ADVERSAS ].
Los pacientes deben usar la dosis más baja y la duración más corta de la terapia con IBP apropiada para la afección que se está tratando.
Se ha informado CDAD con el uso de casi todos los agentes antibacterianos. Para obtener más información específica sobre los agentes antibacterianos (claritromicina y amoxicilina) indicados para usar en combinación con PREVACID 15 mg o PREVACID 15 mg SoluTab, consulte la sección de Advertencias y precauciones de su información de prescripción.
Fractura de hueso
Varios estudios observacionales publicados sugieren que la terapia con IBP puede estar asociada con un mayor riesgo de fracturas de cadera, muñeca o columna relacionadas con la osteoporosis. El riesgo de fractura aumentó en pacientes que recibieron dosis altas, definidas como múltiples dosis diarias, y terapia con IBP a largo plazo (un año o más). Los pacientes deben usar la dosis más baja y la duración más corta de la terapia con IBP apropiada para la afección que se está tratando. Los pacientes con riesgo de fracturas relacionadas con la osteoporosis deben ser tratados de acuerdo con las pautas de tratamiento establecidas [ver DOSIFICACIÓN Y ADMINISTRACIÓN , REACCIONES ADVERSAS ].
Reacciones adversas cutáneas graves
Se han notificado reacciones adversas cutáneas graves, como el síndrome de Stevens-Johnson (SJS) y la necrólisis epidérmica tóxica (TEN), la reacción al fármaco con eosinofilia y síntomas sistémicos (DRESS) y la pustulosis exantemática aguda generalizada (PEGA) en asociación con el uso de IBP. [ver REACCIONES ADVERSAS ]. Interrumpa PREVACID 30 mg o PREVACID SoluTab ante los primeros signos o síntomas de reacciones adversas cutáneas graves u otros signos de hipersensibilidad y considere una evaluación adicional.
Lupus Eritematoso Cutáneo Y Sistémico
Se han notificado casos de lupus eritematoso cutáneo (CLE) y lupus eritematoso sistémico (LES) en pacientes que toman IBP, incluido lansoprazol. Estos eventos han ocurrido como un nuevo inicio y una exacerbación de la enfermedad autoinmune existente. La mayoría de los casos de lupus eritematoso inducido por PPI fueron LEC.
La forma más común de LEC notificada en pacientes tratados con IBP fue la LEC subaguda (SCLE) y se produjo semanas o años después de la terapia farmacológica continua en pacientes que iban desde bebés hasta ancianos. En general, los hallazgos histológicos se observaron sin afectación de órganos.
El lupus eritematoso sistémico (LES) se notifica con menos frecuencia que el LEC en pacientes que reciben IBP. El LES asociado con IBP suele ser más leve que el LES no inducido por fármacos. El inicio del LES generalmente ocurre dentro de los días o años después de iniciar el tratamiento, principalmente en pacientes que van desde adultos jóvenes hasta ancianos. La mayoría de los pacientes presentaron erupción cutánea; sin embargo, también se informaron artralgia y citopenia.
Evitar la administración de IBP por más tiempo del indicado médicamente. Si se observan signos o síntomas compatibles con CLE o SLE en pacientes que reciben PREVACID 15 mg o PREVACID SoluTab, suspenda el medicamento y remita al paciente al especialista adecuado para que lo evalúe. La mayoría de los pacientes mejoran con la interrupción del PPI solo en cuatro a 12 semanas. Las pruebas serológicas (p. ej., ANA) pueden ser positivas y los resultados elevados de las pruebas serológicas pueden tardar más en resolverse que las manifestaciones clínicas.
Deficiencia de cianocobalamina (vitamina B12)
El tratamiento diario con medicamentos supresores de ácido durante un período prolongado (p. ej., más de tres años) puede provocar una malabsorción de cianocobalamina (vitamina B12) causada por hipoclorhidria o aclorhidria. Se han informado en la literatura informes raros de deficiencia de cianocobalamina que ocurren con la terapia supresora de ácido. Se debe considerar este diagnóstico si se observan síntomas clínicos compatibles con la deficiencia de cianocobalamina en pacientes tratados con PREVACID o PREVACID SoluTab.
Hipomagnesemia y metabolismo mineral
Raramente se ha informado hipomagnesemia, sintomática y asintomática, en pacientes tratados con IBP durante al menos tres meses, en la mayoría de los casos después de un año de terapia. Los eventos adversos graves incluyen tetania, arritmias y convulsiones. La hipomagnesemia puede provocar hipocalcemia y/o hipopotasemia y puede exacerbar la hipocalcemia subyacente en pacientes de riesgo. En la mayoría de los pacientes, el tratamiento de la hipomagnesemia requirió la reposición de magnesio y la interrupción del PPI.
Para los pacientes que se espera que reciban un tratamiento prolongado o que toman IBP con medicamentos como digoxina o medicamentos que pueden causar hipomagnesemia (p. ej., diuréticos), los profesionales de la salud pueden considerar monitorear los niveles de magnesio antes de iniciar el tratamiento con IBP y periódicamente [ver REACCIONES ADVERSAS ].
Considere monitorear los niveles de magnesio y calcio antes de iniciar PREVACID 30 mg o PREVACID SoluTab y periódicamente durante el tratamiento en pacientes con un riesgo preexistente de hipocalcemia (p. ej., hipoparatiroidismo). Suplementar con magnesio y/o calcio, según sea necesario. Si la hipocalcemia es refractaria al tratamiento, considere suspender el IBP.
Interacciones con investigaciones de tumores neuroendocrinos
Los niveles séricos de cromogranina A (CgA) aumentan como consecuencia de la disminución de la acidez gástrica inducida por fármacos. El aumento del nivel de CgA puede causar resultados falsos positivos en las investigaciones de diagnóstico de tumores neuroendocrinos. Los proveedores de atención médica deben suspender temporalmente el tratamiento con lansoprazol al menos 14 días antes de evaluar los niveles de CgA y considerar repetir la prueba si los niveles iniciales de CgA son altos. Si se realizan pruebas en serie (p. ej., para el control), se debe usar el mismo laboratorio comercial para las pruebas, ya que los rangos de referencia entre las pruebas pueden variar [ver INTERACCIONES CON LA DROGAS , FARMACOLOGÍA CLÍNICA ].
Interacción con metotrexato
La literatura sugiere que el uso concomitante de PPI con metotrexato (principalmente en dosis altas) puede elevar y prolongar los niveles séricos de metotrexato y/o su metabolito, lo que posiblemente provoque toxicidad por metotrexato. En la administración de dosis altas de metotrexato, en algunos pacientes se puede considerar la suspensión temporal del IBP [ver INTERACCIONES CON LA DROGAS , FARMACOLOGÍA CLÍNICA ].
Pacientes con Fenilcetonuria
La fenilalanina puede ser dañina para los pacientes con fenilcetonuria (PKU). PREVACID 30 mg SoluTab contiene fenilalanina, un componente del aspartamo. Cada comprimido de 15 mg contiene 2,5 mg y cada comprimido de 30 mg contiene 5,1 mg de fenilalanina. Antes de recetar PREVACID SoluTab a un paciente con PKU, considere la cantidad diaria combinada de fenilalanina de todas las fuentes, incluido PREVACID 30 mg SoluTab.
Pólipos de las glándulas fúndicas
El uso de PPI se asocia con un mayor riesgo de pólipos en las glándulas fúndicas que aumenta con el uso a largo plazo, especialmente más allá de un año. La mayoría de los usuarios de PPI que desarrollaron pólipos en las glándulas fúndicas eran asintomáticos y los pólipos en las glándulas fúndicas se identificaron incidentalmente en la endoscopia. Use la duración más corta de la terapia con PPI apropiada para la afección que se está tratando.
Riesgo de engrosamiento de las válvulas cardíacas en pacientes pediátricos menores de un año de edad
PREVACID 30mg y PREVACID SoluTab no están aprobados en pacientes pediátricos menores de un año de edad. Los estudios no clínicos en ratas jóvenes con lansoprazol han demostrado un efecto adverso de engrosamiento de las válvulas cardíacas. El riesgo de lesión de la válvula cardíaca no parece ser relevante para los pacientes de un año de edad y mayores [ver Uso en poblaciones específicas ].
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( Guía de medicamentos y Instrucciones de uso ).
Aconseje a los pacientes que:
Nefritis tubulointersticial aguda
Llamar a su proveedor de atención médica si experimentan signos y/o síntomas asociados con la nefritis tubulointersticial aguda [ver ADVERTENCIAS Y PRECAUCIONES ].
Diarrea asociada a Clostridium difficile
Llamar inmediatamente a su proveedor de atención médica si experimentan diarrea que no mejora [ver ADVERTENCIAS Y PRECAUCIONES ].
Fractura de hueso
Informar cualquier fractura, especialmente de cadera, muñeca o columna, a su proveedor de atención médica [ver ADVERTENCIAS Y PRECAUCIONES ].
Reacciones adversas cutáneas graves
Suspender PREVACID o PREVACID 30 mg SoluTab y llamar inmediatamente a su proveedor de atención médica para una evaluación adicional [ver ADVERTENCIAS Y PRECAUCIONES ].
Lupus Eritematoso Cutáneo Y Sistémico
Llamar de inmediato a su proveedor de atención médica ante cualquier síntoma nuevo o empeoramiento de los síntomas asociados con el lupus eritematoso cutáneo o sistémico [ver ADVERTENCIAS Y PRECAUCIONES ].
Deficiencia de cianocobalamina (vitamina B12)
 Informar cualquier síntoma clínico que pueda estar asociado con la deficiencia de cianocobalamina a su proveedor de atención médica, si han estado recibiendo PREVACID o PREVACID SoluTab durante más de tres años [ver ADVERTENCIAS Y PRECAUCIONES ].
Hipomagnesemia Y Mineral
Metabolismo Informar cualquier síntoma clínico que pueda estar asociado con hipomagnesemia, hipocalcemia y/o hipopotasemia a su proveedor de atención médica, si han estado recibiendo PREVACID o PREVACID 15 mg SoluTab durante al menos tres meses [ver ADVERTENCIAS Y PRECAUCIONES ].
Interacciones con la drogas
Aconseje a los pacientes que informen a su proveedor de atención médica si están tomando productos que contienen rilpivirina [ver CONTRAINDICACIONES ] o dosis altas de metotrexato [ver ADVERTENCIAS Y PRECAUCIONES ].
El embarazo
Aconseje a una mujer embarazada sobre el riesgo potencial para el feto. Aconseje a las mujeres con potencial reproductivo que informen a su proveedor de atención médica sobre un embarazo conocido o sospechado [ver Uso en poblaciones específicas ].
Administración
- Dosis olvidadas: Si se olvida una dosis, administre lo antes posible. Sin embargo, si le toca la próxima dosis programada, no tome la dosis olvidada y tome la siguiente dosis a tiempo. No tome dos dosis a la vez para compensar la dosis olvidada.
- PREVACID o PREVACID 30 mg SoluTab deben tomarse antes de comer.
- No triture ni mastique la cápsula de PREVACID de 15 mg ni PREVACID SoluTab.
- Tome PREVACID o PREVACID 30 mg SoluTab al menos 30 minutos antes del sucralfato.
- Fenilcetonúricos: contiene 2,5 mg de fenilalanina por comprimido de 30 mg de PREVACID SoluTab de 15 mg y 5,1 mg por comprimido de PREVACID SoluTab de 30 mg.
Cápsulas PREVACIDAS
- Trágalo todo; no masticar
- Para pacientes que tienen dificultad para tragar cápsulas:
- Las cápsulas de PREVACID de 15 mg se pueden abrir y espolvorear sobre puré de manzana, pudín ENSURE, requesón, yogur o peras coladas.
- Las cápsulas de PREVACID de 15 mg también se pueden vaciar en un pequeño volumen de jugo de manzana, jugo de naranja o jugo de tomate.
- Alternativamente, las cápsulas de PREVACID se pueden administrar con jugo de manzana a través de una sonda nasogástrica.
- Consulte las Instrucciones de uso para obtener una descripción de todas las instrucciones de preparación y administración.
PREVACID SoluTab®
- No rompa ni corte.
- Coloque la tableta en la lengua; permita que se desintegre, con o sin agua, hasta que las partículas puedan tragarse. No mastique las partículas.
- La tableta generalmente se desintegra en menos de un minuto.
- Alternativamente, para niños u otros pacientes que tienen dificultad para tragar comprimidos, PREVACID 30 mg SoluTab puede administrarse con agua a través de una jeringa oral o una sonda NG, como se describe en las Instrucciones de uso.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
En dos estudios de carcinogenicidad de 24 meses, se trató a ratas Sprague-Dawley con dosis orales de lansoprazol de 5 a 150 mg/kg/día, aproximadamente de una a 40 veces la exposición en la superficie corporal (mg/m²) de una persona de 50 kg. de estatura media [1,46 m² de superficie corporal (BSA)] dada la dosis humana recomendada de 30 mg/día. Lansoprazol produjo hiperplasia gástrica de células tipo enterocromafines (ECL) relacionada con la dosis y carcinoides de células ECL en ratas macho y hembra. También aumentó la incidencia de metaplasia intestinal del epitelio gástrico en ambos sexos. En ratas macho, lansoprazol produjo un aumento relacionado con la dosis de adenomas de células intersticiales testiculares. La incidencia de estos adenomas en ratas que recibieron dosis de 15 a 150 mg/kg/día (cuatro a 40 veces la dosis humana recomendada según el BSA) superó la incidencia de fondo baja (rango = 1,4 a 10%) para esta cepa de rata.
En un estudio de carcinogenicidad de 24 meses, los ratones CD-1 fueron tratados con dosis orales de lansoprazol de 15 a 600 mg/kg/día, de dos a 80 veces la dosis humana recomendada según el BSA. Lansoprazol produjo un aumento de la incidencia de hiperplasia de células ECL gástricas relacionada con la dosis. También produjo un aumento de la incidencia de tumores hepáticos (adenoma hepatocelular más carcinoma). Las incidencias de tumores en ratones machos tratados con 300 y 600 mg/kg/día (40 a 80 veces la dosis humana recomendada según el BSA) y ratones hembra tratados con 150 a 600 mg/kg/día (20 a 80 veces la dosis humana recomendada). dosis basada en BSA) superó los rangos de incidencias de fondo en los controles históricos para esta cepa de ratones. El tratamiento con lansoprazol produjo adenoma de la red testicular en ratones macho que recibieron de 75 a 600 mg/kg/día (de 10 a 80 veces la dosis recomendada en humanos según el BSA).
Un estudio de carcinogenicidad en ratones transgénicos p53 (+/-) de 26 semanas no fue positivo.
Lansoprazol fue positivo en la prueba de Ames y en el ensayo de aberraciones cromosómicas de linfocitos humanos in vitro. Lansoprazol no fue genotóxico en la prueba de síntesis de ADN no programada (UDS) de hepatocitos de rata ex vivo, la prueba de micronúcleos de ratón in vivo o la prueba de aberración cromosómica de células de médula ósea de rata.
Se encontró que el lansoprazol en dosis orales de hasta 150 mg/kg/día (40 veces la dosis humana recomendada según el BSA) no tiene efecto sobre la fertilidad y el rendimiento reproductivo de ratas macho y hembra.
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
Los datos disponibles de los estudios observacionales publicados en general no indican una asociación de resultados adversos del embarazo con el tratamiento con lansoprazol (ver Datos ).
En estudios de reproducción animal, la administración oral de lansoprazol a ratas durante la organogénesis hasta la lactancia a 6,4 veces la dosis máxima recomendada en humanos produjo reducciones en la descendencia en el peso del fémur, la longitud del fémur, la longitud de la coronilla y el grosor de la placa de crecimiento (solo machos) en el día posnatal 21 (ver Datos ). Estos efectos se asociaron con una reducción en el aumento de peso corporal. Informar a las mujeres embarazadas sobre el riesgo potencial para el feto.
Se desconoce el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo para las poblaciones indicadas. Todos los embarazos tienen un riesgo de fondo de defecto congénito, pérdida u otros resultados adversos. En la población general de los EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 al 4 % y del 15 al 20 %, respectivamente.
Si se administra PREVACID 15 mg o PREVACID 15 mg SoluTab con claritromicina, la información sobre el embarazo para claritromicina también se aplica al régimen combinado. Consulte la información de prescripción de claritromicina para obtener más información sobre el uso durante el embarazo.
Datos
Datos humanos
Los datos disponibles de los estudios observacionales publicados no lograron demostrar una asociación de resultados adversos relacionados con el embarazo y el uso de lansoprazol. Las limitaciones metodológicas de estos estudios observacionales no pueden establecer o excluir definitivamente ningún riesgo asociado con el fármaco durante el embarazo. En un estudio prospectivo realizado por la Red Europea de Servicios de Información sobre Teratología, se compararon los resultados de un grupo de 62 mujeres embarazadas a las que se administró una dosis diaria mediana de 30 mg de lansoprazol con un grupo de control de 868 mujeres embarazadas que no tomaron ningún IBP. No hubo diferencia en la tasa de malformaciones mayores entre las mujeres expuestas a IBP y el grupo control, correspondiente a un Riesgo Relativo (RR)=1,04, [95% Intervalo de Confianza (IC) 0,25-4,21]. En un estudio de cohortes retrospectivo basado en la población que abarcó todos los nacidos vivos en Dinamarca desde 1996 hasta 2008, no hubo un aumento significativo de defectos congénitos importantes durante el análisis de la exposición a lansoprazol en el primer trimestre en 794 nacidos vivos. Un metanálisis que comparó 1530 mujeres embarazadas expuestas a PPI en al menos el primer trimestre con 133 410 mujeres embarazadas no expuestas no mostró aumentos significativos en el riesgo de malformaciones congénitas o aborto espontáneo con la exposición a PPI (para malformaciones mayores Odds Ratio (OR) = 1.12 , [IC 95% 0,86-1,45] y para abortos espontáneos OR=1,29, [IC 95% 0,841,97]).
Datos de animales
No se produjeron efectos adversos sobre el desarrollo embriofetal en estudios realizados en ratas preñadas a dosis orales de lansoprazol de hasta 150 mg/kg/día (40 veces la dosis humana recomendada [30 mg/día] según el área de superficie corporal) administradas durante la organogénesis y conejas preñadas en dosis orales de lansoprazol de hasta 30 mg/kg/día (16 veces la dosis humana recomendada según el área de superficie corporal) administradas durante la organogénesis.
Se realizó un estudio de toxicidad en el desarrollo pre y posnatal en ratas con criterios de valoración adicionales para evaluar el desarrollo óseo con lansoprazol en dosis orales de 10 a 100 mg/kg/día (0,7 a 6,4 veces la dosis máxima recomendada de lansoprazol en humanos de 30 mg según el AUC [área bajo la curva de concentración plasmática-tiempo]) administrado durante la organogénesis hasta la lactancia. Los efectos maternos observados con 100 mg/kg/día (6,4 veces la dosis máxima recomendada de lansoprazol en humanos de 30 mg en función del AUC) incluyeron un mayor período de gestación, una disminución del aumento de peso corporal durante la gestación y una disminución del consumo de alimentos. El número de mortinatos aumentó con esta dosis, lo que puede haber sido secundario a la toxicidad materna. El peso corporal de las crías se redujo a 100 mg/kg/día a partir del día 11 postnatal. El peso del fémur, la longitud del fémur y la longitud de la rabadilla se redujeron a 100 mg/kg/día el día 21 postnatal. el grupo de 100 mg/kg/día a la edad de 17 a 18 semanas. El espesor de la placa de crecimiento disminuyó en los machos que recibieron 100 mg/kg/día el día 21 posnatal, y aumentó en los machos que recibieron 30 y 100 mg/kg/día entre las 17 y 18 semanas de edad. Los efectos sobre los parámetros óseos se asociaron con una reducción del aumento de peso corporal.
Lactancia
Resumen de riesgos
No hay información sobre la presencia de lansoprazol en la leche humana, los efectos en el lactante o los efectos en la producción de leche. Sin embargo, el lansoprazol y sus metabolitos están presentes en la leche de rata. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de la madre de PREVACID 30 mg o PREVACID 30 mg SoluTab y cualquier posible efecto adverso en el niño amamantado por PREVACID 30 mg o PREVACID SoluTab o por la afección materna subyacente.
Uso pediátrico
La seguridad y la eficacia de PREVACID 15 mg y PREVACID 30 mg SoluTab se han establecido en pacientes pediátricos de un año a 17 años de edad para el tratamiento a corto plazo de la ERGE sintomática y la esofagitis erosiva.
En estudios clínicos de ERGE sintomática y esofagitis erosiva, PREVACID 30 mg no se administró más allá de las 12 semanas en pacientes de un año a 11 años de edad. No se sabe si PREVACID 30 mg y PREVACID SoluTab son seguros y efectivos si se usan por más tiempo del recomendado. No exceda la dosis recomendada y la duración del uso en pacientes pediátricos (ver Datos de toxicidad en animales juveniles ).
PREVACID no fue eficaz en pacientes pediátricos con ERGE sintomática de un mes a menos de un año de edad en un estudio multicéntrico, doble ciego, controlado con placebo. Por lo tanto, no se ha establecido la seguridad y eficacia en pacientes menores de un año de edad. Los estudios no clínicos en ratas jóvenes han demostrado un efecto adverso de engrosamiento de las válvulas cardíacas y cambios óseos en dosis de lansoprazol superiores a la dosis equivalente máxima recomendada en humanos.
Neonato a menos de un año de edad
La farmacocinética de lansoprazol se estudió en pacientes pediátricos con ERGE de menos de 28 días y de uno a 11 meses. En comparación con los adultos sanos que recibieron 30 mg, los recién nacidos tuvieron una mayor exposición (valores medios de AUC normalizados basados en el peso 2,04 y 1,88 veces más altos con dosis de 0,5 y 1 mg/kg/día, respectivamente). Los lactantes de ≤10 semanas de edad tuvieron valores de eliminación y exposición similares a los de los recién nacidos. Los lactantes mayores de 10 semanas que recibieron 1 mg/kg/día tuvieron valores medios de AUC similares a los de los adultos que recibieron una dosis de 30 mg.
No se encontró que el lansoprazol fuera efectivo en un estudio de cuatro semanas, multicéntrico, doble ciego, controlado con placebo, de grupos paralelos en EE. UU. y Polonia de 162 pacientes de entre un mes y menos de 12 meses de edad con ERGE sintomática según un historial médico. de llanto/inquietud/irritabilidad asociada con la alimentación que no habían respondido al tratamiento conservador de la ERGE (es decir, intervención no farmacológica) durante siete a 14 días. Pacientes recibidos
lansoprazol como suspensión diaria (0,2 a 0,3 mg/kg/día en lactantes ≤10 semanas de edad o 1,0 a 1,5 mg/kg/día en lactantes mayores de 10 semanas o placebo) durante un máximo de cuatro semanas de tratamiento doble ciego.
El criterio principal de valoración de la eficacia se evaluó mediante una reducción superior al 50 % con respecto al valor inicial en el porcentaje de alimentaciones con un episodio de llanto/inquietud/irritabilidad o la duración (minutos) de un episodio de llanto/inquietud/irritabilidad dentro de una hora después de la alimentación.
No hubo diferencia en el porcentaje de respondedores entre el grupo de suspensión pediátrica de lansoprazol y el grupo de placebo (54% en ambos grupos).
No se informaron eventos adversos en estudios clínicos pediátricos (de un mes a menos de 12 meses de edad) que no se observaron previamente en adultos.
En base a los resultados del estudio de eficacia de Fase 3, no se demostró que lansoprazol sea eficaz. Por lo tanto, estos resultados no respaldan el uso de lansoprazol en el tratamiento de la ERGE sintomática en lactantes.
Un año a 11 años de edad
En un estudio multicéntrico de EE. UU., abierto y no controlado, se asignó a 66 pacientes pediátricos (de un año a 11 años de edad) con ERGE, en función del peso corporal, a recibir una dosis inicial de PREVACID de 15 mg diarios si ≤30 kg o PREVACID 30 mg diarios si se administran más de 30 kg durante ocho a 12 semanas. Se aumentó la dosis de PREVACID (hasta 30 mg dos veces al día) en 24 de 66 pacientes pediátricos después de dos o más semanas de tratamiento si permanecían sintomáticos. Al inicio del estudio, el 85 % de los pacientes tenían síntomas generales de ERGE de leves a moderados (evaluados mediante una entrevista con el investigador), el 58 % tenían ERGE no erosiva y el 42 % tenían esofagitis erosiva (evaluada mediante endoscopia).
Después de ocho a 12 semanas de tratamiento con PREVACID de 15 mg, el análisis por intención de tratar demostró una reducción aproximada del 50 % en la frecuencia y gravedad de los síntomas de la ERGE.
Veintiuno de 27 pacientes con esofagitis erosiva se curaron a las ocho semanas y el 100% de los pacientes se curaron a las 12 semanas mediante endoscopia (Tabla 4).
En un estudio de 66 pacientes pediátricos en el grupo de edad de un año a 11 años después del tratamiento con 15 mg de PREVACID administrados por vía oral en dosis de 15 mg diarios a 30 mg dos veces al día, los aumentos en los niveles séricos de gastrina fueron similares a los observados en estudios con adultos. La mediana de los niveles séricos de gastrina en ayunas aumentó un 89 % desde 51 pg/ml al inicio hasta 97 pg/ml [rango intercuartílico (percentil 25 a 75) de 71 a 130 pg/ml] en la visita final.
La seguridad pediátrica de PREVACID 30 mg cápsulas se evaluó en 66 pacientes pediátricos de uno a 11 años de edad. De los 66 pacientes con ERGE, el 85 % (56/66) tomó PREVACID 30 mg durante ocho semanas y el 15 % (10/66) lo tomó durante 12 semanas.
Las reacciones adversas relacionadas con el tratamiento notificadas con mayor frecuencia (dos o más pacientes) en pacientes de uno a 11 años de edad (N=66) fueron estreñimiento (5 %) y dolor de cabeza (3 %).
Doce años a 17 años de edad
En un estudio multicéntrico, abierto y no controlado en los EE. UU., 87 pacientes adolescentes (de 12 a 17 años de edad) con ERGE sintomática fueron tratados con PREVACID durante ocho a 12 semanas. Las endoscopias digestivas basales clasificaron a estos pacientes en dos grupos: 64 (74%) ERGE no erosiva y 23 (26%) esofagitis erosiva (EE). Los pacientes con ERGE no erosiva recibieron PREVACID 15 mg al día durante ocho semanas y los pacientes con EE recibieron PREVACID 30 mg al día durante ocho a 12 semanas. Al inicio del estudio, el 89 % de estos pacientes tenían síntomas generales de ERGE de leves a moderados (evaluados mediante entrevistas con el investigador). Durante ocho semanas de tratamiento con PREVACID 15 mg, los pacientes adolescentes experimentaron una reducción del 63 % en la frecuencia y una reducción del 69 % en la gravedad de los síntomas de ERGE según los resultados del diario.
Veintiuno de 22 (95,5 %) pacientes adolescentes con esofagitis erosiva se curaron después de ocho semanas de tratamiento con PREVACID 15 mg. Un paciente permaneció sin curar después de 12 semanas de tratamiento (Tabla 5).
En estos 87 pacientes adolescentes, los aumentos en los niveles séricos de gastrina fueron similares a los observados en estudios con adultos, la mediana de los niveles séricos de gastrina en ayunas aumentó un 42 % de 45 pg/mL al inicio a 64 pg/mL [rango intercuartílico (percentil 25 a 75) de 44 a 88 pg/mL] en la visita final. (Los niveles normales de gastrina sérica son de 25 a 111 pg/mL).
La seguridad de las cápsulas de PREVACID ha sido evaluada en estos 87 pacientes adolescentes. De los 87 pacientes adolescentes con ERGE, el 6 % (5/87) tomó PREVACID 15 mg durante menos de seis semanas, el 93 % (81/87) durante seis a 10 semanas y el 1 % (1/87) durante más de 10 semanas .
Las reacciones adversas relacionadas con el tratamiento notificadas con mayor frecuencia (al menos el 3 %) en estos pacientes fueron dolor de cabeza (7 %), dolor abdominal (5 %), náuseas (3 %) y mareos (3 %). En este estudio, tres pacientes adolescentes con ERGE no erosiva informaron mareos relacionados con el tratamiento, informados en esta información de prescripción como que ocurren en menos del 1 % de los pacientes adultos, que tenían mareos junto con otras reacciones (como migraña, disnea, y vómitos).
Datos de toxicidad en animales juveniles
Engrosamiento de la válvula cardíaca
En dos estudios de toxicidad oral, se produjo engrosamiento de la válvula cardíaca mitral en ratas jóvenes tratadas con lansoprazol. El engrosamiento de la válvula cardíaca se observó principalmente con la dosificación oral iniciada el día 7 posnatal (equivalente a la edad de los humanos recién nacidos) y el día 14 posnatal (equivalente a la edad humana de aproximadamente un año) a dosis de 250 mg/kg/día y superiores (el día 7 posnatal). y el día 14 posnatal, respectivamente, 6,2 veces y 4,2 veces la dosis pediátrica diaria de 15 mg en pacientes pediátricos de uno a 11 años que pesen 30 kg o menos, según el AUC). La duración del tratamiento asociado con el engrosamiento de la válvula cardíaca osciló entre 5 días y 8 semanas. Los hallazgos se revirtieron o tendieron hacia la reversibilidad después de un período de recuperación sin drogas de 4 semanas. La incidencia de engrosamiento de la válvula cardíaca después del inicio de la dosificación en el día 21 posnatal (equivalente a la edad humana de aproximadamente dos años) se limitó a una sola rata (1/24) en grupos que recibieron 500 mg/kg/día durante 4 u 8 semanas (aproximadamente 5,2 veces la dosis pediátrica diaria de 15 mg en pacientes pediátricos de 1 a 11 años que pesan 30 kg o menos, según el AUC). Con base en los márgenes de exposición, el riesgo de lesión de la válvula cardíaca no parece ser relevante para los pacientes de un año de edad y mayores.
Cambios óseos
En un estudio de toxicidad oral de ocho semanas en ratas jóvenes con dosificación iniciada el día 7 posnatal, dosis iguales o superiores a 100 mg/kg/día (2,5 veces la dosis pediátrica diaria de 15 mg en niños de uno a 11 años de edad que pesan 30 kg o menos, según el AUC) produjo un retraso en el crecimiento, observándose un deterioro del aumento de peso desde el día 10 postnatal (edad equivalente a los humanos recién nacidos). Al final del tratamiento, los signos de deterioro del crecimiento con 100 mg/kg/día y mayores incluyeron reducciones en el peso corporal (14 a 44 % en comparación con los controles), peso absoluto de múltiples órganos, peso del fémur, longitud del fémur y reducción de la corona. longitud de la grupa. El espesor de la placa de crecimiento femoral se redujo solo en machos y solo con la dosis de 500 mg/kg/día. Los efectos relacionados con el retraso en el crecimiento persistieron hasta el final del período de recuperación de cuatro semanas. No se recopilaron datos a más largo plazo.
Uso geriátrico
Del número total de pacientes (n=21 486) en estudios clínicos de PREVACID, el 16 % de los pacientes tenían 65 años o más, mientras que el 4 % tenían 75 años o más. No se observaron diferencias generales en seguridad o eficacia entre estos pacientes y pacientes más jóvenes y otra experiencia clínica informada no ha identificado diferencias significativas en las respuestas entre pacientes geriátricos y más jóvenes, pero no se puede descartar una mayor sensibilidad de algunas personas mayores [ver FARMACOLOGÍA CLÍNICA ].

Deterioro hepático
En pacientes con diversos grados de insuficiencia hepática crónica, la exposición a lansoprazol aumentó en comparación con sujetos sanos con función hepática normal [ver FARMACOLOGÍA CLÍNICA ]. No es necesario ajustar la dosis de PREVACID o PREVACID SoluTab en pacientes con insuficiencia hepática leve (Child-Pugh Clase A) o moderada (Child-Pugh Clase B). La dosis recomendada es de 15 mg por vía oral al día en pacientes con insuficiencia hepática grave (Child-Pugh Clase C) [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
SOBREDOSIS
Lansoprazol no se elimina de la circulación por hemodiálisis. En una sobredosis informada, un paciente consumió 600 mg de PREVACID 15 mg sin ninguna reacción adversa. Las dosis orales de lansoprazol de hasta 5000 mg/kg en ratas [aproximadamente 1300 veces la dosis humana de 30 mg según el área de superficie corporal (BSA)] y en ratones (alrededor de 675,7 veces la dosis humana de 30 mg según el BSA) no produjeron muertes ni cualquier signo clínico.
En caso de sobreexposición, el tratamiento debe ser sintomático y de apoyo.
Si ocurre una sobreexposición, llame a su centro de control de envenenamiento al 1-800-222-1222 para obtener información actualizada sobre el manejo del envenenamiento o la sobreexposición.
CONTRAINDICACIONES
- PREVACID 15 mg y PREVACID 15 mg SoluTab están contraindicados en pacientes con hipersensibilidad conocida a cualquiera de los componentes de la formulación. Las reacciones de hipersensibilidad pueden incluir anafilaxia, shock anafiláctico, angioedema, broncoespasmo, nefritis tubulointersticial aguda y urticaria [ver ADVERTENCIAS Y PRECAUCIONES , REACCIONES ADVERSAS ].
- Los inhibidores de la bomba de protones (IBP), incluidos PREVACID y PREVACID SoluTab, están contraindicados con productos que contienen rilpivirina [ver INTERACCIONES CON LA DROGAS ].
- Para obtener información sobre las contraindicaciones de los agentes antibacterianos (claritromicina y amoxicilina) indicados en combinación con PREVACID o PREVACID 30 mg SoluTab, consulte la sección Contraindicaciones de su información de prescripción.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
El lansoprazol pertenece a una clase de compuestos antisecretores, los benzimidazoles sustituidos, que suprimen la secreción de ácido gástrico mediante la inhibición específica del sistema enzimático (H+, K+)-ATPasa en la superficie secretora de la célula parietal gástrica. Debido a que este sistema enzimático se considera la bomba de ácido (protones) dentro de la célula parietal, el lansoprazol se ha caracterizado como un inhibidor de la bomba de ácido gástrico, ya que bloquea el paso final de la producción de ácido. Este efecto está relacionado con la dosis y conduce a la inhibición de la secreción de ácido gástrico tanto basal como estimulada, independientemente del estímulo. Lansoprazol no muestra actividad anticolinérgica o antagonista de la histamina tipo 2.
Farmacodinámica
Actividad antisecretora
Después de la administración oral, se demostró que lansoprazol reduce significativamente la producción de ácido basal y aumenta significativamente el pH gástrico medio y el porcentaje de tiempo en que el pH gástrico fue superior a tres y superior a cuatro. El lansoprazol también redujo significativamente la producción de ácido gástrico estimulado por las comidas y el volumen de secreción, así como la producción de ácido estimulada por pentagastrina. En pacientes con hipersecreción de ácido, lansoprazol redujo significativamente la secreción de ácido gástrico basal y estimulada por pentagastrina. Lansoprazol inhibió los aumentos normales en el volumen de secreción, la acidez y la producción de ácido inducidos por la insulina.
Los resultados del pH intragástrico de un estudio farmacodinámico cruzado de cinco días de 15 y 30 mg de lansoprazol una vez al día se presentan en la Tabla 6:
Después de la dosis inicial en este estudio, se observó un aumento del pH gástrico dentro de una a dos horas con 30 mg de lansoprazol y de dos a tres horas con 15 mg de lansoprazol. Después de múltiples dosis diarias, se observó un aumento del pH gástrico dentro de la primera hora posterior a la administración de 30 mg de lansoprazol y dentro de una a dos horas posteriores a la administración de 15 mg de lansoprazol.
La supresión de ácido puede mejorar el efecto de los antimicrobianos en la erradicación de Helicobacter pylori (H. pylori). El porcentaje de tiempo que el pH gástrico se elevó por encima de cinco y seis se evaluó en un estudio cruzado de PREVACID administrado diariamente, dos veces al día y tres veces al día (Tabla 7).
La inhibición de la secreción de ácido gástrico medida por el pH intragástrico volvió gradualmente a la normalidad durante dos a cuatro días después de múltiples dosis. No hubo indicios de acidez gástrica de rebote.
Efectos de las células similares a las enterocromafines (ECL)
Durante la exposición de por vida de ratas con hasta 150 mg/kg/día de lansoprazol dosificado siete días a la semana, se observó hipergastrinemia marcada seguida de proliferación de células ECL y formación de tumores carcinoides, especialmente en ratas hembra. Las muestras de biopsias gástricas del cuerpo del estómago de aproximadamente 150 pacientes tratados continuamente con lansoprazol durante al menos un año no mostraron evidencia de efectos en las células ECL similares a los observados en estudios con ratas. Se necesitan datos a más largo plazo para descartar la posibilidad de un mayor riesgo de desarrollar tumores gástricos en pacientes que reciben terapia a largo plazo con lansoprazol [ver Toxicología no clínica ].
Otros efectos gástricos en humanos
Lansoprazol no afectó significativamente el flujo sanguíneo de la mucosa en el fondo del estómago. Debido al efecto fisiológico normal causado por la inhibición de la secreción de ácido gástrico, se observó una disminución de alrededor del 17 % en el flujo sanguíneo en el antro, el píloro y el bulbo duodenal. Lansoprazol redujo significativamente el vaciado gástrico de sólidos digeribles. Lansoprazol aumentó los niveles séricos de pepsinógeno y disminuyó la actividad de la pepsina en condiciones basales y en respuesta a la estimulación con comidas o la inyección de insulina. Al igual que con otros agentes que elevan el pH intragástrico, los aumentos en el pH gástrico se asociaron con aumentos en las bacterias reductoras de nitrato y elevación de la concentración de nitrito en el jugo gástrico en pacientes con úlcera gástrica. No se observó un aumento significativo en las concentraciones de nitrosamina.
Efectos de la gastrina sérica
En más de 2100 pacientes, la mediana de los niveles séricos de gastrina en ayunas aumentó entre un 50 y un 100 % desde el inicio, pero se mantuvo dentro del rango normal después del tratamiento con 15 a 60 mg de lansoprazol oral. Estas elevaciones alcanzaron una meseta dentro de los dos meses de terapia y regresaron a los niveles previos al tratamiento dentro de las cuatro semanas posteriores a la interrupción de la terapia.
El aumento de gastrina causa hiperplasia de células tipo enterocromafines y aumenta los niveles de CgA en suero. Los niveles elevados de CgA pueden causar resultados falsos positivos en las investigaciones diagnósticas de tumores neuroendocrinos [ver ADVERTENCIAS Y PRECAUCIONES ].
Efectos endocrinos
Los estudios en humanos de hasta un año no han detectado ningún efecto clínicamente significativo en el sistema endocrino. Las hormonas estudiadas incluyen testosterona, hormona luteinizante (LH), hormona estimulante del folículo (FSH), globulina transportadora de hormonas sexuales (SHBG), sulfato de dehidroepiandrosterona (DHEA-S), prolactina, cortisol, estradiol, insulina, aldosterona, parathormona, glucagón, estimulante de la tiroides (TSH), triyodotironina (T3), tiroxina (T4) y hormona somatotrópica (STH). Lansoprazol en dosis orales de 15 a 60 mg durante un máximo de un año no tuvo un efecto clínicamente significativo sobre la función sexual. Además, lansoprazol en dosis orales de 15 a 60 mg durante dos a ocho semanas no tuvo un efecto clínicamente significativo sobre la función tiroidea. En estudios de carcinogenicidad de 24 meses en ratas Sprague-Dawley con dosis diarias de lansoprazol de hasta 150 mg/kg, los cambios proliferativos en las células de Leydig de los testículos, incluida la neoplasia benigna, aumentaron en comparación con las ratas de control.
Otros efectos
No se han encontrado efectos sistémicos de lansoprazol en el sistema nervioso central, linfoide, hematopoyético, renal, hepático, cardiovascular o respiratorio en humanos. Entre 56 pacientes que se sometieron a extensas evaluaciones oculares iniciales, no se observó toxicidad visual después del tratamiento con lansoprazol (hasta 180 mg/día) hasta por 58 meses. Después de la exposición de por vida a lansoprazol en ratas, se observaron atrofia pancreática focal, hiperplasia linfoide difusa en el timo y atrofia retiniana espontánea.
Farmacocinética
Absorción
PREVACID 15 mg y PREVACID SoluTab contienen una formulación de gránulos con recubrimiento entérico de lansoprazol (porque el lansoprazol es lábil en medio ácido), de modo que la absorción de lansoprazol comienza solo después de que los gránulos abandonan el estómago. Los niveles plasmáticos máximos medios de lansoprazol se alcanzan aproximadamente a las 1,7 horas. Después de la administración de una dosis única de 15 a 60 mg de lansoprazol oral, las concentraciones plasmáticas máximas (Cmax) de lansoprazol y el área bajo las curvas de concentración plasmática (AUC) de lansoprazol fueron aproximadamente proporcionales a la dosis administrada. Lansoprazol no se acumula y su farmacocinética no se ve alterada por dosis múltiples. La biodisponibilidad absoluta es superior al 80%. En sujetos sanos, la semivida plasmática media (±DE) fue de 1,5 (±1,0) horas. Tanto la Cmax como el AUC disminuyen entre un 50 y un 70 % si lansoprazol se administra 30 minutos después de las comidas, en comparación con la condición de ayuno. No hay un efecto significativo de los alimentos si se administra lansoprazol antes de las comidas.
Distribución
Lansoprazol se une en un 97% a las proteínas plasmáticas. La unión a proteínas plasmáticas es constante en el rango de concentración de 0,05 a 5 mcg/mL.
Eliminación
Metabolismo
Lansoprazol se metaboliza ampliamente en el hígado. Se han identificado dos metabolitos en cantidades mensurables en plasma (los derivados sulfinilo y sulfona hidroxilados de lansoprazol). Estos metabolitos tienen muy poca o ninguna actividad antisecretora. Se cree que el lansoprazol se transforma en dos especies activas que inhiben la secreción de ácido al bloquear la bomba de protones [sistema enzimático (H+, K+)-ATPasa] en la superficie secretora de la célula parietal gástrica. Las dos especies activas no están presentes en la circulación sistémica. La vida media de eliminación plasmática de lansoprazol es de menos de dos horas, mientras que el efecto inhibidor de ácido dura más de 24 horas. Por lo tanto, la vida media de eliminación plasmática de lansoprazol no refleja la duración de la supresión de la secreción de ácido gástrico.
Excreción
Después de la administración oral de una dosis única de PREVACID, prácticamente no se excretó lansoprazol inalterado en la orina. En un estudio, después de una dosis oral única de 14Clansoprazole, aproximadamente un tercio de la radiación administrada se excretó en la orina y dos tercios se recuperaron en las heces. Esto implica una excreción biliar significativa de los metabolitos de lansoprazol.
Poblaciones Específicas
Pacientes pediátricos
Uno a 17 años de edad
La farmacocinética de lansoprazol se estudió en pacientes pediátricos con ERGE de uno a 11 años y de 12 a 17 años en dos estudios clínicos separados. En niños de uno a 11 años, lansoprazol se dosificó en dosis de 15 mg diarios para sujetos que pesaban ≤30 kg y 30 mg diarios para sujetos que pesaban más de 30 kg. Los valores medios de Cmax y AUC observados en el Día 5 de dosificación fueron similares entre los dos grupos de dosis y no se vieron afectados por el peso o la edad dentro de cada grupo de dosis ajustada por peso utilizado en el estudio. En sujetos adolescentes de 12 a 17 años, los sujetos fueron aleatorizados para recibir lansoprazol en dosis de 15 o 30 mg al día. Los valores medios de Cmax y AUC de lansoprazol no se vieron afectados por el peso corporal o la edad; y se observaron aumentos casi proporcionales a la dosis en los valores medios de Cmax y AUC entre los dos grupos de dosis en el estudio. En general, la farmacocinética de lansoprazol en pacientes pediátricos de 1 a 17 años fue similar a la observada en sujetos adultos sanos.
Pacientes geriátricos
El aclaramiento de lansoprazol disminuye en los ancianos, con un aumento de la vida media de eliminación de aproximadamente 50 a 100%. Debido a que la vida media promedio en los ancianos se mantiene entre 1,9 y 2,9 horas, la dosificación repetida una vez al día no da como resultado la acumulación de lansoprazol. Los niveles plasmáticos máximos no aumentaron en los ancianos [ver Uso en poblaciones específicas ].
Pacientes masculinos y femeninos
En un estudio que comparó a 12 sujetos humanos masculinos y seis femeninos que recibieron lansoprazol, no se encontraron diferencias relacionadas con el sexo en la farmacocinética y los resultados del pH intragástrico.
Grupos raciales o étnicos
Los parámetros farmacocinéticos medios combinados de PREVACID de doce estudios estadounidenses (N=513) se compararon con los parámetros farmacocinéticos medios de dos estudios asiáticos (N=20). Las AUC medias de PREVACID 30 mg en sujetos asiáticos fueron aproximadamente el doble de las observadas en los datos combinados de EE. UU.; sin embargo, la variabilidad interindividual fue alta. Los valores de Cmax fueron comparables.
Pacientes con insuficiencia renal
En pacientes con insuficiencia renal grave, la unión a proteínas plasmáticas disminuyó entre un 1 y un 1,5 % tras la administración de 60 mg de lansoprazol. Los pacientes con insuficiencia renal tuvieron una vida media de eliminación más corta y un AUC total (libre y unida) disminuido. Sin embargo, el AUC de lansoprazol libre en plasma no estuvo relacionado con el grado de insuficiencia renal; y la Cmax y Tmax (tiempo para alcanzar la concentración máxima) no fueron diferentes de la Cmax y Tmax de sujetos con función renal normal. Por lo tanto, la farmacocinética de lansoprazol no fue clínicamente diferente en pacientes con insuficiencia renal leve, moderada o grave en comparación con sujetos sanos con función renal normal.
Pacientes con insuficiencia hepática
En pacientes con insuficiencia hepática leve (Child-Pugh Clase A) o moderada (Child-Pugh Clase B), hubo un aumento de aproximadamente 3 veces en el AUC medio en comparación con sujetos sanos con función hepática normal después de múltiples dosis orales de 30 mg de PREVACID 30 mg. durante siete días. La semivida plasmática media correspondiente de lansoprazol se prolongó de 1,5 a cuatro horas (Child-Pugh A) o cinco horas (Child-Pugh B).
En pacientes con cirrosis compensada y descompensada, hubo un aumento de aproximadamente 6 y 5 veces en el AUC, respectivamente, en comparación con sujetos sanos con función hepática normal luego de una dosis oral única de 30 mg de PREVACID [ver DOSIFICACIÓN Y ADMINISTRACIÓN , Uso en poblaciones específicas ].
Estudios de interacción farmacológica
Efecto de lansoprazol en otras drogas
Interacciones del citocromo P450
Lansoprazol se metaboliza a través del sistema del citocromo P450, específicamente a través de las isoenzimas CYP3A y CYP2C19. Los estudios han demostrado que PREVACID 15 mg no tiene interacciones clínicamente significativas con otros medicamentos metabolizados por el sistema del citocromo P450, como warfarina, antipirina, indometacina, ibuprofeno, fenitoína, propranolol, prednisona, diazepam o claritromicina en sujetos sanos. Estos compuestos se metabolizan a través de varias isoenzimas del citocromo P450, incluidas CYP1A2, CYP2C9, CYP2C19, CYP2D6 y CYP3A.
teofilina
Cuando se administró PREVACID 30 mg concomitantemente con teofilina (CYP1A2, CYP3A), se observó un aumento menor (10 %) en el aclaramiento de teofilina. Debido a la pequeña magnitud y la dirección del efecto sobre el aclaramiento de teofilina, es poco probable que esta interacción sea de interés clínico [ver INTERACCIONES CON LA DROGAS ].
Metotrexato y 7-hidroximetotrexato
En un estudio farmacocinético abierto, de un solo grupo, de ocho días, de 28 pacientes adultos con artritis reumatoide (que requerían el uso crónico de 7,5 a 15 mg de metotrexato semanalmente), la administración de siete días de naproxeno 500 mg dos veces al día y PREVACID 30 mg diarios no tuvieron efecto sobre la farmacocinética de metotrexato y 7-hidroximetotrexato. Si bien este estudio no fue diseñado para evaluar la seguridad de esta combinación de medicamentos, no se observaron reacciones adversas importantes. Sin embargo, este estudio se realizó con dosis bajas de metotrexato. No se ha realizado un estudio de interacción farmacológica con dosis altas de metotrexato [ver ADVERTENCIAS Y PRECAUCIONES ].
amoxicilina
También se ha demostrado que PREVACID 30 mg no tiene una interacción clínicamente significativa con la amoxicilina.
sucralfato
En un estudio cruzado de dosis única que examinó PREVACID 30 mg administrado solo y concomitantemente con 1 gramo de sucralfato, la absorción de lansoprazol se retrasó y la biodisponibilidad se redujo en un 17 % cuando se administró concomitantemente con sucralfato [ver DOSIFICACIÓN Y ADMINISTRACIÓN , INTERACCIONES CON LA DROGAS ].
antiácidos
En ensayos clínicos, los antiácidos se administraron concomitantemente con PREVACID 15 mg y no hubo evidencia de un cambio en la eficacia de PREVACID.
clopidogrel
Clopidogrel se metaboliza a su metabolito activo en parte por CYP2C19. Se llevó a cabo un estudio de sujetos sanos que eran metabolizadores rápidos de CYP2C19, que recibieron la administración una vez al día de clopidogrel 75 mg solo o concomitantemente con PREVACID 30 mg (n=40), durante nueve días. El AUC medio del metabolito activo de clopidogrel se redujo en aproximadamente un 14 % (la relación AUC media fue del 86 %, con un IC del 90 % de 80 a 92 %) cuando se coadministró PREVACID en comparación con la administración de clopidogrel solo.
También se midieron los parámetros farmacodinámicos y se demostró que el cambio en la inhibición de la agregación plaquetaria (inducida por ADP 5 mcM) estaba relacionado con el cambio en la exposición al metabolito activo de clopidogrel. El efecto sobre la exposición al metabolito activo de clopidogrel y sobre la inhibición plaquetaria inducida por clopidogrel no se considera clínicamente importante.
Efecto de otras drogas sobre lansoprazol
Debido a que lansoprazol es metabolizado por CYP2C19 y CYP3A4, los inductores e inhibidores de estas enzimas pueden potencialmente alterar la exposición a lansoprazol.
Microbiología
Microbiología
Se ha demostrado que el lansoprazol, la claritromicina y/o la amoxicilina son activos contra la mayoría de las cepas de Helicobacter pylori in vitro y en infecciones clínicas [ver INDICACIONES Y USO ].
Resistencia al pretratamiento de Helicobacter Pylori
La resistencia previa al tratamiento con claritromicina (≥2,0 mcg/ml) fue del 9,5 % (91/960) mediante la prueba E y del 11,3 % (12/106) mediante la dilución en agar en los ensayos clínicos de terapia dual y triple (M93-125, M93-130, M93131, M95-392 y M95-399).
Se produjeron aislamientos susceptibles al pretratamiento con amoxicilina (≤0,25 mcg/mL) en el 97,8 % (936/957) y el 98,0 % (98/100) de los pacientes en los ensayos clínicos de terapia doble y triple mediante prueba E y dilución en agar, respectivamente. Veintiuno de 957 pacientes (2,2 %) según la prueba E y dos de 100 pacientes (2,0 %) mediante dilución en agar, tenían CIM antes del tratamiento con amoxicilina superiores a 0,25 mcg/ml. Un paciente en el régimen de terapia triple de 14 días tuvo una concentración inhibitoria mínima (MIC) de amoxicilina antes del tratamiento no confirmada de más de 256 mcg/mL por prueba E y el paciente fue erradicado de H. pylori (Tabla 8).
Los pacientes que no han sido erradicados de H. pylori después de la terapia triple con lansoprazol/amoxicilina/claritromicina probablemente tendrán H. pylori resistente a la claritromicina. Por lo tanto, para aquellos pacientes que fallan en la terapia, se deben realizar pruebas de susceptibilidad a la claritromicina cuando sea posible. Los pacientes con H. pylori resistente a la claritromicina no deben ser tratados con terapia triple con lansoprazol/amoxicilina/claritromicina o con regímenes que incluyan claritromicina como único agente antimicrobiano.
Resultados de la prueba de susceptibilidad a la amoxicilina y resultados clínicos/bacteriológicos
En los ensayos clínicos de terapia doble y triple, el 82,6 % (195/236) de los pacientes que tenían CMI sensibles a la amoxicilina antes del tratamiento (≤0,25 mcg/mL) fueron erradicados de H. pylori. De aquellos con CIM de amoxicilina antes del tratamiento de más de 0,25 mcg/mL, tres de seis tenían la H. pylori erradicada. Un total del 30 % (21/70) de los pacientes fracasó con lansoprazol 30 mg tres veces al día/amoxicilina 1 g tres veces al día con la terapia dual y un total del 12,8 % (22/172) de los pacientes fracasó con la terapia triple de 10 y 14 días. regímenes de terapia. No se obtuvieron resultados de susceptibilidad posteriores al tratamiento en 11 de los pacientes en los que fracasó la terapia. Nueve de los 11 pacientes con CMI después del tratamiento con amoxicilina que fallaron en el régimen de terapia triple también tenían aislamientos de H. pylori resistentes a la claritromicina.
Prueba de susceptibilidad para Helicobacter pylori
Para obtener información sobre las pruebas de susceptibilidad de Helicobacter pylori, consulte Sección de microbiología en la información de prescripción de claritromicina y amoxicilina .
Estudios clínicos
Úlcera duodenal
En un estudio multicéntrico, doble ciego, controlado con placebo, de respuesta a la dosis (15, 30 y 60 mg de PREVACID una vez al día) de 284 pacientes con úlcera duodenal documentada por endoscopia, el porcentaje de pacientes curados después de dos y cuatro semanas fue significativamente mayor con todas las dosis de PREVACID que con placebo. No hubo evidencia de una respuesta mayor o más temprana con las dos dosis más altas en comparación con PREVACID 15 mg. Con base en este estudio y el segundo estudio descrito a continuación, la dosis recomendada de PREVACID 15 mg en úlcera duodenal es de 15 mg por día (Tabla 9).
PREVACID 15 mg fue significativamente más efectivo que el placebo para aliviar el dolor abdominal diurno y nocturno y para disminuir la cantidad de antiácido que se toma por día.
En un segundo estudio multicéntrico estadounidense, también doble ciego, controlado con placebo, de comparación de dosis (15 y 30 mg de PREVACID 15 mg una vez al día), e incluyendo una comparación con ranitidina, en 280 pacientes con úlcera duodenal documentada endoscópicamente, el porcentaje de pacientes curados después de cuatro semanas fue significativamente mayor con ambas dosis de PREVACID 15 mg que con placebo. No hubo evidencia de una respuesta mayor o más temprana con la dosis más alta de PREVACID. Aunque la dosis de 15 mg de PREVACID fue superior a la ranitidina a las cuatro semanas, la falta de una diferencia significativa a las dos semanas y la ausencia de una diferencia entre 30 mg de PREVACID y ranitidina deja sin determinar la efectividad comparativa de los dos agentes (Tabla 10) [ ver INDICACIONES Y USO ].
Erradicación de H. pylori para reducir el riesgo de recurrencia de la úlcera duodenal
Los estudios clínicos aleatorizados, doble ciego realizados en los EE. UU. en pacientes con H. pylori y enfermedad de úlcera duodenal (definida como una úlcera activa o antecedentes de una úlcera dentro de un año) evaluaron la eficacia de PREVACID en combinación con amoxicilina y claritromicina como triple 14 terapia de día o en combinación con amoxicilina como terapia dual de 14 días para la erradicación de H. pylori. Con base en los resultados de estos estudios, se estableció la seguridad y eficacia de dos regímenes de erradicación diferentes:
Triple terapia : PREVACID 30 mg dos veces al día/amoxicilina 1 g dos veces al día/claritromicina 500 mg dos veces al día
Terapia dual : PREVACID 30 mg tres veces al día/amoxicilina 1 g tres veces al día
Todos los tratamientos fueron de 14 días. La erradicación de H. pylori se definió como dos pruebas negativas (cultivo e histología) entre cuatro y seis semanas después del final del tratamiento.
Se demostró que la terapia triple es más eficaz que todas las combinaciones posibles de terapia dual. Se demostró que la terapia dual es más eficaz que ambas monoterapias. Se ha demostrado que la erradicación de H. pylori reduce el riesgo de recurrencia de la úlcera duodenal.
Un estudio clínico aleatorizado, doble ciego realizado en los EE. UU. en pacientes con H. pylori y enfermedad de úlcera duodenal (definida como una úlcera activa o antecedentes de una úlcera dentro de un año) comparó la eficacia de la terapia triple PREVACID durante 10 y 14 días. Este estudio estableció que la terapia triple de 10 días fue equivalente a la terapia triple de 14 días en la erradicación de H. pylori (Tablas 11 y 12) [ver INDICACIONES Y USO ].
Mantenimiento de úlceras duodenales curadas
Se ha demostrado que PREVACID previene la recurrencia de las úlceras duodenales. Se realizaron dos ensayos independientes, doble ciego, multicéntricos y controlados en pacientes con úlceras duodenales curadas confirmadas por endoscopia. Los pacientes permanecieron curados significativamente más tiempo y el número de recurrencias de úlceras duodenales fue significativamente menor en pacientes tratados con PREVACID 15 mg que en pacientes tratados con placebo durante un período de 12 meses (Tabla 13) [ver INDICACIONES Y USO ].
En el ensayo n.° 2, no se observaron diferencias significativas entre PREVACID 15 y 30 mg en el mantenimiento de la remisión.
Úlcera gástrica
En un estudio multicéntrico, doble ciego, controlado con placebo de 253 pacientes con úlcera gástrica documentada por endoscopia, el porcentaje de pacientes curados a las cuatro y ocho semanas fue significativamente mayor con PREVACID 15 y 30 mg una vez al día que con placebo (Tabla 14). ) [ver INDICACIONES Y USO ].
Los pacientes tratados con cualquier dosis de PREVACID informaron significativamente menos dolor abdominal diurno y nocturno junto con menos días de uso de antiácidos y menos tabletas de antiácidos por día que el grupo de placebo.
Un metanálisis de datos publicados y no publicados proporcionó una justificación independiente de la eficacia de PREVACID 30 mg.
Curación de úlcera gástrica asociada a AINE
En dos estudios con control activo, doble ciego, multicéntricos de EE. UU. y Canadá en pacientes con úlcera gástrica asociada a AINE confirmada por endoscopia que continuaron con su uso de AINE, el porcentaje de pacientes curados después de ocho semanas fue significativamente mayor desde el punto de vista estadístico con 30 mg de PREVACID que con el mando activo. Un total de 711 pacientes se inscribieron en el estudio y 701 pacientes fueron tratados. Los pacientes tenían edades comprendidas entre 18 y 88 años (mediana de edad 59 años), con un 67 % de mujeres y un 33 % de hombres. La raza se distribuyó de la siguiente manera: 87% caucásicos, 8% negros, 5% otros. No hubo una diferencia estadísticamente significativa entre PREVACID 30 mg diarios y el control activo en el alivio de los síntomas (es decir, dolor abdominal) (Tabla 15) [ver INDICACIONES Y USO ].
Reducción del riesgo de úlcera gástrica asociada a AINE
En un gran estudio estadounidense, multicéntrico, doble ciego, controlado con placebo y misoprostol (misoprostol cegado solo para el endoscopista) en pacientes que requerían el uso crónico de un AINE y que tenían antecedentes de una úlcera gástrica documentada endoscópicamente, la proporción de pacientes que permanecieron libres de úlcera gástrica a las cuatro, ocho y 12 semanas fue significativamente mayor con 15 o 30 mg de PREVACID 15 mg que con placebo. Un total de 537 pacientes se inscribieron en el estudio y 535 pacientes fueron tratados. Los pacientes tenían entre 23 y 89 años de edad (mediana de edad de 60 años), con un 65 % de mujeres y un 35 % de hombres. La raza se distribuyó de la siguiente manera: 90% caucásicos, 6% negros, 4% otros. La dosis de 30 mg de PREVACID no demostró un beneficio adicional en la reducción del riesgo de úlcera gástrica asociada a AINE que la dosis de 15 mg (Tabla 16) [ver INDICACIONES Y USO ].
Enfermedad por reflujo gastroesofágico sintomática (ERGE)
ERGE sintomática
En un estudio multicéntrico, doble ciego, controlado con placebo en los EE. UU. de 214 pacientes con síntomas frecuentes de ERGE, pero sin erosiones esofágicas por endoscopia, se observó un alivio significativamente mayor de la acidez estomacal asociada con la ERGE con la administración de 15 mg de lansoprazol una vez al día hasta ocho semanas que con placebo. No se observó ningún beneficio adicional significativo con lansoprazol 30 mg una vez al día.
Los análisis por intención de tratar demostraron una reducción significativa en la frecuencia y la gravedad de la acidez estomacal diurna y nocturna. Los datos de frecuencia y gravedad para el período de tratamiento de ocho semanas se presentan en la Tabla 17 y en las Figuras 1 y 2:
Figura 1: Gravedad media de la acidez estomacal diurna por día de estudio para pacientes evaluables (3=grave, 2=moderada, 1=leve, 0=ninguna)
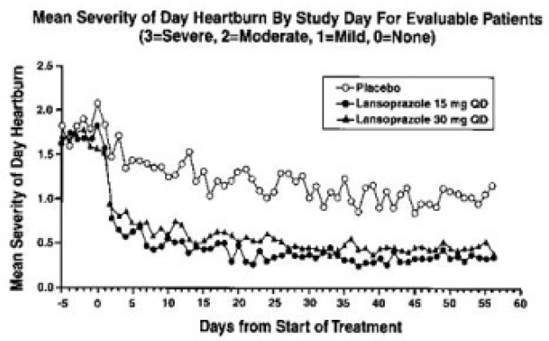
Figura 2: Gravedad media de la acidez estomacal nocturna por día de estudio para pacientes evaluables (3=grave, 2=moderada, 1=leve, 0=ninguna)
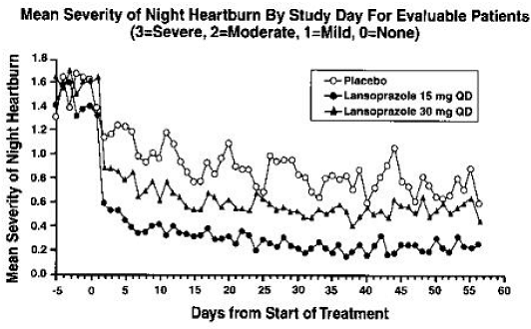
En dos estudios estadounidenses, multicéntricos, doble ciego, controlados con ranitidina de 925 pacientes en total con síntomas frecuentes de ERGE, pero sin erosiones esofágicas por endoscopia, lansoprazol 15 mg fue superior a la ranitidina 150 mg (dos veces al día) en la disminución de la frecuencia y la gravedad de los días. y acidez estomacal nocturna asociada con GERD durante el período de tratamiento de ocho semanas. No se observó ningún beneficio adicional significativo con lansoprazol 30 mg una vez al día [ver INDICACIONES Y USO ].
Esofagitis erosiva
En un estudio estadounidense, multicéntrico, doble ciego, controlado con placebo de 269 pacientes que ingresaron con un diagnóstico endoscópico de esofagitis con clasificación de la mucosa de dos o más y grados tres y cuatro que significan enfermedad erosiva, los porcentajes de pacientes con curación se presentan en la Tabla 18:
En este estudio, todos los grupos de PREVACID informaron un alivio significativamente mayor de la acidez estomacal y menos dolor abdominal diurno y nocturno junto con menos días de uso de antiácidos y menos tabletas de antiácidos por día que el grupo de placebo. Aunque todas las dosis fueron efectivas, la cicatrización más temprana en las dos dosis más altas sugiere 30 mg diarios como la dosis recomendada.
PREVACID también se comparó en un estudio doble ciego multicéntrico de los EE. UU. con una dosis baja de ranitidina en 242 pacientes con esofagitis por reflujo erosiva. PREVACID en una dosis de 30 mg fue significativamente más eficaz que la ranitidina 150 mg dos veces al día, como se muestra a continuación (Tabla 19).
Además, los pacientes tratados con PREVACID 30 mg informaron menos acidez estomacal diurna y nocturna y tomaron menos tabletas antiácidas durante menos días que los pacientes que tomaron ranitidina 150 mg dos veces al día.
Aunque este estudio demuestra la eficacia de PREVACID 15 mg en la curación de la esofagitis erosiva, no representa una comparación adecuada con la ranitidina porque la dosis de ranitidina recomendada para la esofagitis es de 150 mg cuatro veces al día, el doble de la dosis utilizada en este estudio.
En los dos ensayos descritos y en varios estudios más pequeños en los que participaron pacientes con esofagitis erosiva de moderada a grave, PREVACID produjo tasas de curación similares a las que se muestran arriba.
En un estudio estadounidense, multicéntrico, doble ciego, con control activo, se compararon 30 mg de PREVACID 30 mg con ranitidina 150 mg dos veces al día en 151 pacientes con esofagitis erosiva por reflujo que respondieron mal a un mínimo de 12 semanas de tratamiento con al menos un antagonista del receptor H2 administrado a la dosis indicada para el alivio de los síntomas o mayor, a saber, cimetidina 800 mg/día, ranitidina 300 mg/día, famotidina 40 mg/día o nizatidina 300 mg/día. PREVACID 30 mg fue más efectivo que ranitidina 150 mg dos veces al día en la curación de la esofagitis por reflujo, y el porcentaje de pacientes con curación fue el siguiente. Este estudio no constituye una comparación de la eficacia de los antagonistas del receptor H2 de la histamina con PREVACID 30 mg, ya que todos los pacientes no respondieron al modo de tratamiento del antagonista del receptor H2 de la histamina. Sin embargo, sí indica que PREVACID 30 mg puede ser útil en pacientes que fallan con un antagonista del receptor H2 de histamina (Tabla 20) [ver INDICACIONES Y USO ].
Mantenimiento de la curación de la esofagitis erosiva
Se realizaron dos ensayos independientes, doble ciego, multicéntricos y controlados en pacientes con esofagitis curada confirmada por endoscopia. Los pacientes permanecieron en remisión significativamente más tiempo y el número de recurrencias de esofagitis erosiva fue significativamente menor en pacientes tratados con PREVACID 30 mg que en pacientes tratados con placebo durante un período de 12 meses (Tabla 21).
Independientemente del grado inicial de esofagitis erosiva, PREVACID 15 y 30 mg fueron similares en el mantenimiento de la remisión.
En un estudio aleatorizado, doble ciego, en los EE. UU., se comparó PREVACID 15 mg al día (n=100) con ranitidina 150 mg dos veces al día (n=106), a la dosis recomendada, en pacientes con esofagitis erosiva curada demostrada por endoscopia durante un período de 12 meses. El tratamiento con PREVACID 15 mg dio como resultado que los pacientes permanecieran curados (lesiones de grado 0) de esofagitis erosiva durante períodos de tiempo significativamente más largos que los tratados con ranitidina (p INDICACIONES Y USO ].
Condiciones hipersecretoras patológicas, incluido el síndrome de Zollinger-Ellison
En estudios abiertos de 57 pacientes con condiciones hipersecretoras patológicas, como el síndrome de Zollinger-Ellison (ZES) con o sin adenomas endocrinos múltiples, PREVACID 15 mg inhibió significativamente la secreción de ácido gástrico y controló los síntomas asociados de diarrea, anorexia y dolor. Las dosis que oscilaron entre 15 mg en días alternos y 180 mg por día mantuvieron la secreción de ácido basal por debajo de 10 mEq/h en pacientes sin cirugía gástrica previa y por debajo de 5 mEq/h en pacientes con cirugía gástrica previa.
Las dosis iniciales se titularon según las necesidades individuales del paciente, y en algunos pacientes fueron necesarios ajustes con el tiempo [ver DOSIFICACIÓN Y ADMINISTRACIÓN ]. PREVACID fue bien tolerado en estos niveles de dosis alta durante períodos prolongados (más de cuatro años en algunos pacientes). En la mayoría de los pacientes con ZES, PREVACID no modificó los niveles séricos de gastrina. Sin embargo, en algunos pacientes, la gastrina sérica aumentó a niveles mayores que los presentes antes del inicio de la terapia con lansoprazol [ver INDICACIONES Y USO ].
INFORMACIÓN DEL PACIENTE
PREVACIDO (prev-a-sid) (lansoprazol) cápsulas de liberación retardada, para uso oral y
PREVACID SoluTab® (prev-a-sid sol-u-tab) (lansoprazol) comprimidos de liberación retardada que se desintegran por vía oral
¿Cuál es la información más importante que debo saber sobre PREVACID y PREVACID 15mg SoluTab?
Debe tomar PREVACID y PREVACID 15 mg SoluTab exactamente como se lo recetaron, en la dosis más baja posible y durante el menor tiempo necesario.
PREVACID y PREVACID SoluTab pueden ayudar con los síntomas relacionados con el ácido, pero aún podría tener problemas estomacales graves.
Hable con su médico. PREVACID 30 mg y PREVACID 30 mg SoluTab pueden causar efectos secundarios graves, que incluyen:
- Un tipo de problema renal (nefritis tubulointersticial aguda). Algunas personas que toman medicamentos inhibidores de la bomba de protones (IBP), incluidos PREVACID 30 mg y PREVACID 15 mg SoluTab, pueden desarrollar un problema renal llamado nefritis tubulointersticial aguda que puede ocurrir en cualquier momento durante el tratamiento con medicamentos IBP, incluidos PREVACID y PREVACID SoluTab. Llame a su médico de inmediato si tiene una disminución en la cantidad que orina o si tiene sangre en la orina.
- Diarrea causada por una infección (Clostridium difficile) en sus intestinos. Llame a su médico de inmediato si tiene heces acuosas o dolor de estómago que no desaparece. Puede o no tener fiebre.
- Fracturas óseas (cadera, muñeca o columna). Las fracturas de huesos en la cadera, la muñeca o la columna vertebral pueden ocurrir en personas que toman múltiples dosis diarias de medicamentos PPI y durante un período prolongado (un año o más). Informe a su médico si tiene una fractura de hueso, especialmente en la cadera, la muñeca o la columna.
- Ciertos tipos de lupus eritematoso. El lupus eritematoso es un trastorno autoinmune (las células inmunitarias del cuerpo atacan a otras células u órganos del cuerpo). Algunas personas que toman medicamentos PPI, incluidos PREVACID 15 mg y PREVACID 30 mg SoluTab, pueden desarrollar ciertos tipos de lupus eritematoso o empeorar el lupus que ya tienen. Llame a su médico de inmediato si tiene un dolor en las articulaciones nuevo o que empeora, o una erupción en las mejillas o los brazos que empeora con el sol.
Hable con su médico acerca de su riesgo de sufrir estos efectos secundarios graves.
PREVACID 15mg y PREVACID SoluTab pueden tener otros efectos secundarios graves. Ver “¿Cuáles son los posibles efectos secundarios de PREVACID y PREVACID SoluTab?”.
¿Qué son PREVACID y PREVACID 30mg SoluTab?
Un medicamento recetado llamado inhibidor de la bomba de protones (IBP) que se usa para reducir la cantidad de ácido en el estómago.
En adultos, PREVACID 15 mg y PREVACID SoluTab se utilizan para:
- 4 semanas para la cicatrización y alivio de los síntomas de las úlceras duodenales.
- 10 a 14 días con ciertos antibióticos para tratar una infección causada por una bacteria llamada H. pylori.
- mantener la cicatrización de las úlceras duodenales. PREVACID 30 mg no se ha estudiado más allá de 12 meses para este fin.
- hasta 8 semanas para la curación y el alivio de los síntomas de las úlceras estomacales.
- hasta 8 semanas para la curación de las úlceras de estómago en personas que toman analgésicos denominados antiinflamatorios no esteroideos (AINE). PREVACID 30 mg no se ha estudiado más allá de 8 semanas para este fin.
- reducir el riesgo de úlceras estomacales en personas que están en riesgo de desarrollar úlceras estomacales con AINE. PREVACID no se ha estudiado más allá de las 12 semanas para este propósito.
- hasta 8 semanas para tratar la acidez estomacal y otros síntomas que ocurren con la enfermedad por reflujo gastroesofágico (ERGE). La ERGE ocurre cuando el ácido del estómago regresa al tubo (esófago) que conecta la boca con el estómago. Esto puede causar una sensación de ardor en el pecho o la garganta, sabor amargo o eructos.
- hasta 8 semanas para la curación y el alivio de los síntomas del daño relacionado con el ácido en el revestimiento del esófago (llamado esofagitis erosiva o EE). Su médico puede recetar otras 8 a 16 semanas de PREVACID o PREVACID 15 mg SoluTab para pacientes cuya EE no mejora o cuyos síntomas regresan.
- manteniendo la cicatrización de EE. PREVACID no se ha estudiado más allá de los 12 meses para este fin.
- el tratamiento a largo plazo de condiciones en las que su estómago produce demasiado ácido. Esto incluye una condición rara llamada síndrome de Zollinger-Ellison.
Niños: Administre PREVACID 30 mg y PREVACID 30 mg SoluTab exactamente como lo recetó el médico de su hijo. No aumente la dosis de PREVACID y PREVACID SoluTab ni le dé a su hijo PREVACID 15 mg y PREVACID 15 mg SoluTab por más tiempo que el indicado por su médico.
En niños de 1 a 11 años de edad, PREVACID 15 mg y PREVACID 15 mg SoluTab se utilizan para:
- hasta 12 semanas para tratar la acidez estomacal y otros síntomas que pueden presentarse con la ERGE.
- hasta 12 semanas para la curación y el alivio de los síntomas de EE.
En niños de 12 a 17 años de edad, PREVACID y PREVACID SoluTab se utilizan para:
- hasta 8 semanas para tratar la acidez estomacal y otros síntomas que pueden ocurrir con la ERGE.
- hasta 8 semanas para la curación y el alivio de los síntomas de la EE.
PREVACID 30 mg y PREVACID SoluTab no se recomiendan para tratar los síntomas de la ERGE en niños menores de 1 año y pueden dañarlos.
No tome PREVACID o PREVACID 15 mg SoluTab si:
- alérgico al lansoprazol, a cualquier otro medicamento PPI o a cualquiera de los ingredientes de PREVACID 15 mg o PREVACID 30 mg SoluTab. Consulte el final de esta Guía del medicamento para obtener una lista completa de los ingredientes de PREVACID y PREVACID 30mg SoluTab.
- tomando un medicamento que contiene rilpivirina (EDURANT, COMPLERA, ODEFSEY, JULUCA) utilizado para tratar el VIH-1 (virus de inmunodeficiencia humana).
Antes de tomar PREVACID 15 mg o PREVACID SoluTab, informe a su médico sobre todas sus afecciones médicas, incluso si:
- tiene niveles bajos de magnesio, calcio, potasio o sodio en la sangre o está tomando un diurético.
- tiene problemas hepáticos.
- tiene fenilcetonuria. PREVACID SoluTab contiene aspartamo.
- está embarazada, cree que podría estar embarazada o planea quedarse embarazada. PREVACID o PREVACID SoluTab pueden dañar a su bebé por nacer. Hable con su médico acerca de los posibles riesgos para el feto si se toma PREVACID 30 mg o PREVACID 15 mg SoluTab durante el embarazo.
- están amamantando o planean amamantar. No se sabe si PREVACID o PREVACID 30 mg SoluTab pasa a la leche materna. Hable con su médico sobre la mejor manera de alimentar a su bebé si toma PREVACID o PREVACID SoluTab.
Informe a su médico sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos a base de hierbas. Especialmente informe a su médico si toma metotrexato (OTREXUP, RASUVO, TREXALL, REDITREX, XATMEP).
¿Cómo debo tomar PREVACID 15 mg y PREVACID 30 mg SoluTab?
- Tome PREVACID 30 mg o PREVACID SoluTab exactamente como se lo indique su médico.
- No cambie su dosis ni deje de tomar PREVACID 30 mg o PREVACID SoluTab sin consultar a su médico.
- Tome PREVACID 30 mg o PREVACID 15 mg SoluTab antes de las comidas.
PREVACID 15 mg cápsulas:
-
- Trague las cápsulas de PREVACID 30 mg enteras.
- No triture ni mastique las cápsulas de PREVACID.
- Si tiene problemas para tragar una cápsula entera, puede abrir la cápsula y tomar el contenido con ciertos alimentos o jugos. Consulte las "Instrucciones de uso" al final de esta Guía del medicamento para obtener instrucciones sobre cómo tomar las cápsulas de PREVACID de 30 mg con ciertos alimentos o jugos.
- Consulte las "Instrucciones de uso" al final de esta Guía del medicamento para obtener instrucciones sobre cómo mezclar y administrar las cápsulas de PREVACID de 30 mg a través de una sonda nasogástrica (sonda NG).
PREVACID SoluTab:
-
- PREVACID 30mg SoluTab es una tableta que se derrite en la boca con o sin agua.
- No rompa, corte, triture ni mastique las tabletas.
- Consulte las "Instrucciones de uso" al final de esta Guía del medicamento para obtener instrucciones sobre cómo mezclar y administrar PREVACID SoluTab a través de una jeringa y una sonda NG.
- Si olvida una dosis de PREVACID o PREVACID 30 mg SoluTab, tómela tan pronto como lo recuerde. Si es casi la hora de su próxima dosis, no tome la dosis olvidada. Tome su siguiente dosis a la hora habitual. No tome 2 dosis al mismo tiempo.
- Si toma demasiado PREVACID o PREVACID 30 mg SoluTab, llame a su médico o al centro de control de envenenamiento al 1-800-222-1222 de inmediato o vaya a la sala de emergencias del hospital más cercano.
¿Cuáles son los posibles efectos secundarios de PREVACID y PREVACID SoluTab?
PREVACID y PREVACID SoluTab pueden causar efectos secundarios graves, que incluyen:
- Ver “¿Cuál es la información más importante que debo saber sobre PREVACID 30mg y PREVACID SoluTab?”.
- Bajos niveles de vitamina B12 en el cuerpo puede ocurrir en personas que han tomado PREVACID 30 mg o PREVACID SoluTab durante mucho tiempo (más de 3 años). Informe a su médico si tiene síntomas de niveles bajos de vitamina B12, como dificultad para respirar, mareos, latidos cardíacos irregulares, debilidad muscular, piel pálida, sensación de cansancio, cambios de humor y hormigueo o entumecimiento en los brazos y las piernas.
- Crecimientos estomacales (pólipos de glándulas fúndicas). Las personas que toman medicamentos PPI durante mucho tiempo tienen un mayor riesgo de desarrollar cierto tipo de crecimiento estomacal llamado pólipos de las glándulas fúndicas, especialmente después de tomar medicamentos PPI durante más de 1 año.
- Niveles bajos de magnesio en el cuerpo. puede ocurrir en personas que han tomado PREVACID durante al menos 3 meses. Informe a su médico de inmediato si tiene síntomas de niveles bajos de magnesio, como convulsiones, mareos, latidos cardíacos irregulares, nerviosismo, dolores musculares o debilidad y espasmos en las manos, los pies o la voz.
- Reacciones cutáneas graves. PREVACID 15 mg puede causar reacciones cutáneas raras pero graves que pueden afectar cualquier parte de su cuerpo. Estas reacciones cutáneas graves pueden necesitar tratamiento en un hospital y pueden poner en peligro la vida:
- Erupción cutánea que puede tener ampollas, descamación o sangrado en cualquier parte de la piel (incluidos los labios, los ojos, la boca, la nariz, los genitales, las manos o los pies).
- También puede tener fiebre, escalofríos, dolores en el cuerpo, dificultad para respirar o ganglios linfáticos agrandados.
Deje de tomar PREVACID y llame a su médico de inmediato. Estos síntomas pueden ser el primer signo de una reacción cutánea grave.
Los efectos secundarios más comunes de PREVACID y PREVACID SoluTab incluyen: diarrea, dolor en el área del estómago (abdomen), náuseas y estreñimiento.
Estos no son todos los posibles efectos secundarios de PREVACID 30 mg y PREVACID 30 mg SoluTab.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios.
Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar PREVACID y PREVACID 30mg SoluTab?
Guarde PREVACID a temperatura ambiente, entre 68 °F y 77 °F (20 °C y 25 °C).
Mantenga PREVACID 15 mg y PREVACID SoluTab y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de PREVACID 15 mg y PREVACID SoluTab.
A veces, los medicamentos se recetan para fines distintos a los enumerados en la Guía del medicamento. No use PREVACID o PREVACID 30mg SoluTab para condiciones para las cuales no fue recetado. No administre PREVACID 30 mg o PREVACID SoluTab a otras personas, incluso si tienen los mismos síntomas que usted. Puede que les haga daño. Puede pedirle a su médico o farmacéutico información sobre PREVACID 30 mg y PREVACID 15 mg SoluTab que está escrita para profesionales de la salud.
¿Cuáles son los ingredientes de PREVACID y PREVACID SoluTab?
Ingrediente activo: lansoprazol.
Ingredientes inactivos en las cápsulas de PREVACID 30 mg: esfera de azúcar, sacarosa, copolímero de ácido metacrílico, hidroxipropilcelulosa de baja sustitución, almidón, carbonato de magnesio, talco, polietilenglicol, dióxido de titanio, polisorbato 80, hidroxipropilcelulosa, dióxido de silicio coloidal, D&C Red No. 28, FD&C Blue No. 1 y FD&C Rojo No. 40.
PREVACID 15 mg cápsula solamente: FD&C Verde No. 3.
Ingredientes inactivos en PREVACID 15mg SoluTab: manitol, ácido metacrílico, hidroxipropilcelulosa, lactosa monohidrato-esfera de celulosa microcristalina, citrato de trietilo, crospovidona, poliacrilato, carbonato de magnesio, aspartamo, monoestearato de glicerilo, hipromelosa, estearato de magnesio, ácido cítrico, dióxido de titanio, talco, saborizante artificial de fresa, polietilenglicol, polisorbato 80 y óxido férrico.
PREVACID SoluTab contiene 2,5 mg de fenilalanina en cada comprimido de 15 mg y 5,1 mg de fenilalanina en cada comprimido de 30 mg.
INSTRUCCIONES DE USO
PREVACIDO (prev-a-sid) (lansoprazol) cápsulas de liberación retardada, para uso oral y
PREVACID SoluTab® (prev-a-sid sol-u-tab) (lansoprazol) comprimidos de liberación retardada que se desintegran por vía oral
Importante:
- Tome PREVACID 15 mg o PREVACID 15 mg SoluTab antes de las comidas.
- No triture ni mastique PREVACID 15 mg cápsulas o PREVACID 30 mg SoluTab.
- PREVACID o PREVACID 15mg SoluTab solo debe usarse con los alimentos y jugos que se enumeran a continuación.
PREVACID cápsulas de liberación retardada (PREVACID cápsulas de 30 mg)
Tomar PREVACID 15 mg cápsulas con ciertos alimentos:
Solo puede usar puré de manzana, pudín ENSURE, requesón, yogur o peras coladas.
Tomar cápsulas de PREVACID con ciertos jugos:
Solo puedes usar jugo de manzana, jugo de naranja o jugo de tomate.
Administración de cápsulas de PREVACID a través de una sonda nasogástrica (sonda NG) tamaño 16 French o más grande:
Solo puedes usar jugo de manzana.
PREVACID 15 mg SoluTab Tabletas de disolución oral de liberación retardada (PREVACID SoluTab)
Para pacientes que tienen problemas para tragar tabletas, PREVACID SoluTab se puede administrar de la siguiente manera:
Administración de PREVACID SoluTab con agua usando una jeringa oral:
Administración de PREVACID 15 mg SoluTab con agua a través de una sonda nasogástrica (sonda NG) de tamaño 8 French o más grande:
¿Cómo debo almacenar PREVACID y PREVACID 30mg SoluTab?
- Guarde las cápsulas de PREVACID y PREVACID 15 mg SoluTab a temperatura ambiente, entre 20 °C y 25 °C (68 °F y 77 °F).
Mantenga PREVACID y PREVACID 30 mg SoluTab y todos los medicamentos fuera del alcance de los niños.
Esta Instrucción de uso ha sido aprobada por la Administración de Drogas y Alimentos de los Estados Unidos.
