Pentasa 400mg Mesalamine Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Pentasa y cómo se usa?
Pentasa es un medicamento recetado que se usa para tratar los síntomas de la colitis ulcerosa. Pentasa 400 mg puede usarse solo o con otros medicamentos.
Pentasa pertenece a una clase de medicamentos llamados derivados del ácido 5-aminosalicílico.
No se sabe si Pentasa es seguro y eficaz en niños mayores de 5 años.
¿Cuáles son los posibles efectos secundarios de Pentasa?
Pentasa puede causar efectos secundarios graves que incluyen:
- dolor de estómago severo,
- calambres estomacales,
- diarrea con sangre,
- fiebre,
- dolor de cabeza,
- erupción cutanea,
- heces con sangre o alquitranadas,
- tosiendo sangre,
- vómito que parece café molido,
- orinar poco o nada,
- micción dolorosa o difícil,
- hinchazón en los pies o los tobillos,
- sentirse cansado o sin aliento,
- pérdida de apetito,
- dolor de estómago superior,
- cansancio,
- moretones o sangrado fácil,
- orina oscura,
- heces de color arcilla, y
- coloración amarillenta de la piel o los ojos
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Pentasa 400 mg incluyen:
- náuseas,
- vómitos,
- dolor de estómago,
- Diarrea,
- indigestión,
- gas,
- dolor de cabeza,
- sarpullido, y
- pruebas de función hepática anormales
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Pentasa. Para obtener más información, consulte a su médico o farmacéutico.
DESCRIPCIÓN
PENTASA (mesalamina) para administración oral es una formulación de mesalamina de liberación controlada, un agente antiinflamatorio aminosalicilato para uso gastrointestinal.
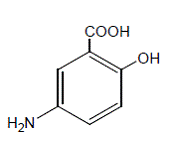
Químicamente, la mesalamina es ácido 5-amino-2-hidroxibenzoico. Tiene un peso molecular de 153,14.
La fórmula estructural es:
Cada cápsula de 250 mg contiene 250 mg de mesalamina. También contiene los siguientes ingredientes inactivos: monoglicérido acetilado, aceite de ricino, dióxido de silicio coloidal, etilcelulosa, hidroxipropilmetilcelulosa, almidón, ácido esteárico, azúcar, talco y cera blanca. La cubierta de la cápsula contiene D&C Yellow #10, FD&C Blue #1, FD&C Green #3, gelatina, dióxido de titanio y otros ingredientes.
Cada cápsula de 500 mg contiene 500 mg de mesalamina. También contiene los siguientes ingredientes inactivos: monoglicérido acetilado, aceite de ricino, dióxido de silicio coloidal, etilcelulosa, hidroxipropilmetilcelulosa, almidón, ácido esteárico, azúcar, talco y cera blanca. La cubierta de la cápsula contiene FD&C Blue #1, gelatina, dióxido de titanio y otros ingredientes.
INDICACIONES
PENTASA 400 mg está indicado para la inducción de la remisión y para el tratamiento de pacientes adultos con colitis ulcerosa activa de leve a moderada.
DOSIFICACIÓN Y ADMINISTRACIÓN
La dosis recomendada para la inducción de la remisión y el tratamiento sintomático de la colitis ulcerosa activa de leve a moderada en adultos es de 1 g (4 cápsulas de PENTASA de 250 mg o 2 cápsulas de PENTASA de 500 mg) 4 veces al día para una dosis diaria total de 4 gramo. La duración del tratamiento en los ensayos controlados fue de hasta 8 semanas.
Las cápsulas de PENTASA se pueden tragar enteras o, como alternativa, se puede abrir la cápsula y espolvorear todo el contenido sobre puré de manzana o yogur. Todo el contenido debe consumirse inmediatamente. Las cápsulas y el contenido de las cápsulas no deben triturarse ni masticarse.
Beba una cantidad adecuada de líquidos.
No se ha establecido la seguridad y eficacia de PENTASA 400 mg en pacientes pediátricos.
CÓMO SUMINISTRADO
PENTASA de liberación prolongada de 250 mg cápsulas se suministran en frascos de 240 cápsulas ( CDN 54092-189-81). Cada cápsula verde y azul contiene 250 mg de mesalamina en perlas de liberación prolongada. Las cápsulas de liberación prolongada de PENTASA se identifican con un logotipo de estrella pentagonal y el número 2010 en la parte verde y S429 250 mg en la parte azul de las cápsulas.
PENTASA de liberación prolongada de 500 mg cápsulas se suministran en frascos de 120 cápsulas ( CDN 54092-191-12). Cada cápsula azul contiene 500 mg de mesalamina en perlas de liberación prolongada. Las cápsulas de liberación prolongada de 400 mg de PENTASA se identifican con un logotipo de estrella pentagonal y S429 500 mg en las cápsulas.
Almacenar a 25°C (77°F); se permiten excursiones de 15 °C a 30 °C (59 °F a 86 °F) [consulte Temperatura ambiente controlada por USP].
Para informar SOSPECHAS DE REACCIONES ADVERSAS, comuníquese con Takeda Pharmaceuticals al 1-800-828-2088 o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
Distribuido por: Takeda Pharmaceuticals America, Inc. Lexington, MA 02421, EE. UU. Revisado: noviembre de 2021
EFECTOS SECUNDARIOS
En ensayos clínicos combinados nacionales y extranjeros, más de 2100 pacientes con colitis ulcerosa o enfermedad de Crohn recibieron terapia con PENTASA. En general, la terapia con PENTASA fue bien tolerada. Los eventos más comunes (es decir, mayores o iguales al 1 %) fueron diarrea (3,4 %), dolor de cabeza (2,0 %), náuseas (1,8 %), dolor abdominal (1,7 %), dispepsia (1,6 %), vómitos (1,5 %). %), y erupción (1,0%).
En dos ensayos nacionales controlados con placebo en los que participaron más de 600 pacientes con colitis ulcerosa, los eventos adversos fueron menores en los pacientes tratados con PENTASA (mesalamina) que en el grupo de placebo (14 % de PENTASA frente a 18 % de placebo) y no estuvieron relacionados con la dosis. Los eventos que ocurren en más del 1% se muestran en la siguiente tabla. De estos, solo las náuseas y los vómitos fueron más frecuentes en el grupo PENTASA. El abandono del tratamiento debido a eventos adversos fue más común con placebo que con PENTASA (7 % frente a 4 %).
Las mediciones de laboratorio clínico no mostraron tendencias anormales significativas para ninguna prueba, incluida la medición de la función hematológica, hepática y renal.
Los siguientes eventos adversos, presentados por sistema corporal, se informaron con poca frecuencia (es decir, menos del 1 %) durante los ensayos de colitis ulcerosa doméstica y enfermedad de Crohn. En muchos casos no se ha establecido la relación con PENTASA.
Gastrointestinal: distensión abdominal, anorexia, estreñimiento, úlcera duodenal, disfagia, eructos, úlcera esofágica, incontinencia fecal, aumento de GGTP, sangrado GI, aumento de fosfatasa alcalina, aumento de LDH, úlcera bucal, moniliasis oral, pancreatitis, sangrado rectal, aumento de SGOT, aumento de SGPT, anomalías en las heces (cambio de color o textura), sed
Dermatológico: acné, alopecia, piel seca, eccema, eritema nodoso, trastorno de las uñas, fotosensibilidad, prurito, sudoración, urticaria
Sistema nervioso: depresión, mareos, insomnio, somnolencia, parestesia
Cardiovascular: palpitaciones, pericarditis, vasodilatación
Otro: albuminuria, amenorrea, aumento de amilasa, artralgia, astenia, dolor mamario, conjuntivitis, equimosis, edema, fiebre, hematuria, hipomenorrea, síndrome de Kawasaki, calambres en las piernas, liquen plano, aumento de lipasa, malestar general, menorragia, metrorragia, mialgia, infiltrados pulmonares , trombocitemia, trombocitopenia, polaquiuria
Una semana después de completar un estudio de colitis ulcerosa de 8 semanas, un hombre de 72 años, sin antecedentes de problemas pulmonares, desarrolló disnea. Posteriormente, el paciente fue diagnosticado con fibrosis pulmonar intersticial sin eosinofilia por un médico y bronquiolitis obliterante con neumonitis organizada por un segundo médico. No se ha establecido una relación causal entre este evento y la terapia con mesalamina.
Los informes de casos publicados y/o la vigilancia espontánea posterior a la comercialización han descrito casos poco frecuentes de pericarditis, miocarditis mortal, dolor torácico y anomalías de la onda T, neumonitis por hipersensibilidad, pancreatitis, síndrome nefrótico, nefritis intersticial, hepatitis, anemia aplásica, pancitopenia, leucopenia, agranulocitosis o anemia durante el tratamiento con mesalamina. La anemia puede ser parte de la presentación clínica de la enfermedad inflamatoria intestinal. Se pueden observar reacciones alérgicas, que podrían implicar eosinofilia, en relación con la terapia con PENTASA 400 mg.
Informes posteriores a la comercialización
Se han identificado los siguientes eventos durante el uso posterior a la aprobación de la marca PENTASA de mesalamina en la práctica clínica. Debido a que son reportados voluntariamente por una población de tamaño desconocido, no se pueden hacer estimaciones de frecuencia. Estos eventos se eligieron para su inclusión debido a una combinación de gravedad, frecuencia de notificación o posible conexión causal con la mesalamina:
Gastrointestinal: Informes de hepatotoxicidad, incluidas enzimas hepáticas elevadas (SGOT/AST, SGPT/ALT, GGT, LDH, fosfatasa alcalina, bilirrubina), hepatitis, ictericia, ictericia colestática, cirrosis y posible daño hepatocelular, incluida necrosis hepática e insuficiencia hepática. Algunos de estos casos fueron fatales. También se notificó un caso de síndrome similar a Kawasaki que incluía cambios en la función hepática.
Otro: reacción anafiláctica, SJS/TEN, DRESS, AGEP, pleuresía/pleuritis, neumonitis, granulocitopenia, lupus eritematoso sistémico, síndrome similar al lupus, insuficiencia renal aguda, enfermedad pulmonar intersticial, neumonitis por hipersensibilidad (incluyendo neumonitis intersticial, alveolitis alérgica, neumonitis eosinofílica), insuficiencia renal crónica, diabetes insípida nefrogénica, nefrolitiasis, hipertensión intracraneal, angioedema y oligospermia (reversible).
INTERACCIONES CON LA DROGAS
No se han realizado investigaciones de interacciones entre PENTASA 400 mg y otros medicamentos; sin embargo, se han informado las siguientes interacciones farmacológicas para productos que contienen mesalamina:
Agentes nefrotóxicos, incluidos los fármacos antiinflamatorios no esteroideos
El uso concomitante de mesalamina con agentes nefrotóxicos conocidos, incluidos los medicamentos antiinflamatorios no esteroideos (AINE), puede aumentar el riesgo de nefrotoxicidad. Supervise a los pacientes que toman medicamentos nefrotóxicos para detectar cambios en la función renal y reacciones adversas relacionadas con la mesalamina.

Azatioprina o 6-mercaptopurina
El uso concomitante de mesalamina con azatioprina o 6-mercaptopurina y/o cualquier otro fármaco que se sabe que causa mielotoxicidad puede aumentar el riesgo de trastornos sanguíneos, insuficiencia de la médula ósea y complicaciones asociadas. Si no se puede evitar el uso concomitante de PENTASA y azatioprina o 6-mercaptopurina, controle los análisis de sangre, incluidos los hemogramas completos y los recuentos de plaquetas.
ADVERTENCIAS
No se proporcionó información
PRECAUCIONES
Insuficiencia renal
Se ha informado insuficiencia renal, incluida la enfermedad de cambios mínimos, nefritis intersticial aguda y crónica e insuficiencia renal en pacientes que recibieron PENTASA u otros productos que contienen mesalamina o se convierten en mesalamina.
Se sabe que la mesalamina se excreta sustancialmente por vía renal, y el riesgo de reacciones adversas puede ser mayor en pacientes con insuficiencia renal. Evalúe la función renal en todos los pacientes antes del inicio y periódicamente durante el tratamiento con PENTASA. Evaluar los riesgos y beneficios del uso de PENTASA en pacientes con insuficiencia renal conocida o antecedentes de enfermedad renal o que toman medicamentos nefrotóxicos concomitantes.
Síndrome de intolerancia aguda inducido por mesalamina
La mesalamina se ha asociado con un síndrome de intolerancia aguda que puede ser difícil de distinguir de un brote de enfermedad inflamatoria intestinal. Los síntomas incluyen calambres, dolor abdominal agudo, diarrea sanguinolenta y, a veces, fiebre, dolor de cabeza y sarpullido. Supervise a los pacientes para detectar un empeoramiento de estos síntomas durante el tratamiento. Si se sospecha síndrome de intolerancia aguda, suspenda de inmediato el tratamiento con PENTASA.
Reacciones hipersensibles
Se han informado reacciones de hipersensibilidad en pacientes que toman sulfasalazina. Algunos pacientes pueden tener una reacción similar a PENTASA oa otros compuestos que contienen o se convierten en mesalamina.
Al igual que con la sulfasalazina, las reacciones de hipersensibilidad inducidas por la mesalamina pueden presentarse como afectación de órganos internos, incluidas miocarditis, pericarditis, nefritis, hepatitis, neumonitis y anomalías hematológicas. Evalúe a los pacientes inmediatamente si se presentan signos o síntomas de una reacción de hipersensibilidad. Suspender PENTASA si no se puede establecer una etiología alternativa para los signos y síntomas.
Falla hepática
Ha habido informes de insuficiencia hepática en pacientes con enfermedad hepática preexistente a los que se les ha administrado otros productos que contienen mesalamina. Evaluar los riesgos y beneficios del uso de PENTASA 400 mg en pacientes con insuficiencia hepática conocida.
Reacciones adversas cutáneas graves
Se han notificado reacciones adversas cutáneas graves, como el síndrome de Stevens-Johnson (SJS) y la necrólisis epidérmica tóxica (TEN), reacción al fármaco con eosinofilia y síntomas sistémicos (DRESS) y pustulosis exantemática aguda generalizada (PEGA) con el uso de mesalamina. (ver REACCIONES ADVERSAS ). Interrumpa PENTASA ante los primeros signos o síntomas de reacciones adversas cutáneas graves u otros signos de hipersensibilidad y considere una evaluación adicional.
fotosensibilidad
Los pacientes con afecciones cutáneas preexistentes, como dermatitis atópica y eccema atópico, han notificado reacciones de fotosensibilidad más graves. Aconseje a los pacientes que eviten la exposición al sol, usen ropa protectora y usen protector solar de amplio espectro cuando estén al aire libre.
Nefrolitiasis
Se han notificado casos de nefrolitiasis con el uso de mesalamina, incluidos cálculos con un contenido de mesalamina del 100 %. Los cálculos que contienen mesalamina son radiotransparentes e indetectables mediante radiografía estándar o tomografía computarizada (TC). Asegurar una hidratación adecuada durante el tratamiento.
Interferencia con pruebas de laboratorio
El uso de mesalamina puede dar lugar a resultados falsos elevados cuando se mide la normetanefrina urinaria mediante cromatografía líquida con detección electroquímica debido a la similitud de los cromatogramas de la normetanefrina y el principal metabolito de la mesalamina, el ácido N-acetil-5-aminosalicílico (N-Ac-5-ASA ). Considere un ensayo selectivo alternativo para la normetanefrina.
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
En un estudio de carcinogenicidad dietética de mesalamina de 104 semanas, los ratones CD-1 fueron tratados con dosis de hasta 2500 mg/kg/día y no fue tumorigénico. Para una persona de 50 kg de estatura media (1,46 m2 de superficie corporal), esto representa 2,5 veces la dosis humana recomendada sobre la base de la superficie corporal (2960 mg/m2/día). En un estudio de carcinogenicidad dietética de 104 semanas en ratas Wistar, la mesalamina hasta una dosis de 800 mg/kg/día no fue tumorigénica. Esta dosis representa 1,5 veces la dosis humana recomendada en base al área de superficie corporal.
No se observó evidencia de mutagenicidad en una prueba de Ames in vitro y en una prueba de micronúcleo de ratón in vivo.
No se observaron efectos sobre la fertilidad o el rendimiento reproductivo en ratas macho o hembra con dosis orales de mesalamina de hasta 400 mg/kg/día (0,8 veces la dosis humana recomendada según el área de superficie corporal).
Las anomalías del semen y la infertilidad en los hombres, que se informaron en asociación con la sulfasalazina, no se observaron con las cápsulas de 400 mg de PENTASA durante los ensayos clínicos controlados.
El embarazo
Efectos teratogénicos
Los datos publicados de metanálisis, estudios de cohortes y series de casos sobre el uso de mesalamina durante el embarazo no han informado de manera confiable una asociación con mesalamina y defectos congénitos importantes, aborto espontáneo o resultados maternos o fetales adversos. No hay pruebas claras de que la exposición a la mesalamina al principio del embarazo se asocie con un mayor riesgo de malformaciones congénitas importantes, incluidas las malformaciones cardíacas. Los estudios epidemiológicos publicados tienen importantes limitaciones metodológicas que dificultan la interpretación de los datos, incluida la incapacidad para controlar los factores de confusión, como la enfermedad materna subyacente, el uso materno de medicamentos concomitantes y la falta de información sobre la dosis y la duración del uso de los productos de mesalamina. PENTASA solo debe usarse durante el embarazo si los beneficios superan los riesgos.
En estudios de reproducción animal, la administración oral de mesalamina durante la organogénesis a ratas preñadas en dosis de hasta 1000 mg/kg/día (5900 mg/m²) y conejos en dosis de 800 mg/kg/día (6856 mg/m²) no reveló evidencia de efectos teratogénicos o daño al feto debido a la mesalamina.
Se desconoce el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo para las poblaciones indicadas. Todos los embarazos tienen un riesgo de fondo de defecto congénito, pérdida u otros resultados adversos. En la población general de los EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y abortos espontáneos en embarazos reconocidos clínicamente es del 2 % al 4 % y del 15 % al 20 %, respectivamente.
Efectos no teratogénicos
Los datos publicados sugieren que el aumento de la actividad de la enfermedad está asociado con el riesgo de desarrollar resultados adversos en el embarazo en mujeres con colitis ulcerosa. Los resultados adversos del embarazo incluyen parto prematuro (antes de las 37 semanas de gestación), recién nacidos de bajo peso al nacer (menos de 2500 g) y pequeños para la edad gestacional al nacer.
Madres lactantes
Los datos de la literatura publicada informan la presencia de mesalamina y su metabolito, ácido N-acetil-5-aminosalicílico en la leche humana en pequeñas cantidades con dosis infantiles relativas (RID) de 0,1% o menos para la mesalamina. No se ha determinado la importancia clínica de esto y existe una experiencia limitada de mujeres lactantes que usan mesalamina.
Hay informes de diarrea observada en lactantes expuestos a mesalamina. Se desconoce el efecto de PENTASA 400 mg sobre la producción de leche. Tenga cuidado si se administra PENTASA 400 mg a una mujer lactante y controle la presencia de diarrea en los lactantes.
En estudios de lactancia publicados, las dosis maternas de mesalamina de varias formulaciones y productos orales y rectales oscilaron entre 500 mg y 4,8 g diarios. La concentración promedio de mesalamina en la leche varió de no detectable a 0,5 mg/L. La concentración promedio de ácido N-acetil-5-aminosalicílico en la leche osciló entre 0,2 y 9,3 mg/L. En base a estas concentraciones, las dosis diarias estimadas para un lactante alimentado exclusivamente con leche materna son de 0 a 0,075 mg/kg/día de mesalamina (RID 0 % a 0,1 %) y de 0,03 a 1,4 mg/kg/día de N-acetil-5-aminosalicílico. ácido.
Uso pediátrico
No se ha establecido la seguridad y eficacia de PENTASA en pacientes pediátricos.
Uso geriátrico
Los ensayos clínicos de PENTASA 400 mg no incluyeron un número suficiente de pacientes de 65 años o más para determinar si responden de manera diferente a los pacientes más jóvenes. Los informes de estudios clínicos no controlados y los sistemas de informes posteriores a la comercialización sugirieron una mayor incidencia de discrasias sanguíneas (es decir, agranulocitosis, neutropenia y pancitopenia) en pacientes que recibieron productos que contienen mesalamina como PENTASA 400 mg que tenían 65 años o más en comparación con pacientes más jóvenes. Controle los recuentos completos de células sanguíneas y de plaquetas en pacientes de edad avanzada durante el tratamiento con PENTASA.
En general, considere la mayor frecuencia de disminución de la función hepática, renal o cardíaca, y de enfermedades concurrentes u otra terapia con medicamentos en pacientes de edad avanzada cuando prescriba PENTASA.
SOBREDOSIS
PENTASA 400 mg es un aminosalicilato, y pueden presentarse síntomas de toxicidad por salicilatos, como náuseas, vómitos, dolor abdominal, taquipnea, hiperpnea, tinnitus y síntomas neurológicos (dolor de cabeza, mareos, confusión, convulsiones). La intoxicación grave con salicilatos puede conducir a un desequilibrio de electrolitos y pH sanguíneo y potencialmente a otros daños en los órganos (p. ej., riñones e hígado).
Tratamiento de sobredosis
No existe un antídoto específico para la sobredosis de mesalamina; sin embargo, la terapia convencional para la toxicidad por salicilatos puede ser beneficiosa en caso de sobredosis aguda y puede incluir la descontaminación del tracto gastrointestinal para evitar una mayor absorción. Corregir el desequilibrio de líquidos y electrolitos mediante la administración de una terapia intravenosa adecuada y mantener una función renal adecuada.
CONTRAINDICACIONES
PENTASA está contraindicado en pacientes con hipersensibilidad conocida o sospechada a los salicilatos, aminosalicilatos o cualquiera de los componentes de este medicamento.
FARMACOLOGÍA CLÍNICA
La sulfasalazina se divide por acción bacteriana en el colon en sulfapiridina (SP) y mesalamina (5-ASA). La dosis oral habitual de sulfasalazina para la colitis ulcerosa activa en adultos es de 2 a 4 g por día en dosis divididas. Cuatro gramos de sulfasalazina proporcionan 1,6 g de mesalamina libre al colon.
El mecanismo de acción de la mesalamina (y la sulfasalazina) no se comprende por completo, pero parece ser un efecto antiinflamatorio tópico sobre las células epiteliales del colon. La producción de metabolitos del ácido araquidónico (AA) en la mucosa, tanto a través de las vías de la ciclooxigenasa (es decir, prostanoides) como a través de las vías de la lipoxigenasa (es decir, leucotrienos (LT) y ácidos hidroxieicosatetraenoicos (HETE), aumenta en pacientes con colitis ulcerosa, y es posible que la mesalamina reduzca la inflamación al bloquear la ciclooxigenasa e inhibir la producción de prostaglandinas (PG) en el colon.
Farmacocinética y Metabolismo Humano
Absorción
PENTASA es una formulación de mesalamina de liberación prolongada recubierta de etilcelulosa diseñada para liberar cantidades terapéuticas de mesalamina a través del tracto gastrointestinal. Según los datos de excreción urinaria, se absorbe del 20% al 30% de la mesalamina en PENTASA. Por el contrario, cuando la mesalamina se administra por vía oral como una suspensión acuosa no formulada de 1 g, la mesalamina se absorbe aproximadamente en un 80 %.
La concentración plasmática de mesalamina alcanzó un máximo de aproximadamente 1 mcg/mL 3 horas después de una dosis de 1 g de PENTASA y disminuyó de manera bifásica. La bibliografía describe una semivida terminal media de 42 minutos para la mesalamina tras la administración intravenosa. Debido a la continua liberación y absorción de mesalamina de PENTASA a través del tracto gastrointestinal, no se puede determinar la verdadera vida media de eliminación después de la administración oral. El ácido N-acetil-5-aminosalicílico, el principal metabolito de la mesalamina (ácido 5-aminosalicílico), alcanzó su punto máximo aproximadamente a las 3 horas a 1,8 mcg/mL, y su concentración siguió una disminución bifásica. Se desconocen las actividades farmacológicas del ácido N-acetil-5-aminosalicílico y no se han identificado otros metabolitos.
La farmacocinética oral de mesalamina fue no lineal cuando las cápsulas de PENTASA se administraron en dosis de 250 mg a 1 g cuatro veces al día, con concentraciones plasmáticas de mesalamina en estado estacionario que aumentaron unas nueve veces, de 0,14 mcg/mL a 1,21 mcg/mL, lo que sugiere un metabolismo de primer paso saturable. La farmacocinética del ácido N-acetil-5-aminosalicílico fue lineal.
Eliminación
Se recuperaron alrededor de 130 mg de mesalamina libre en las heces después de una dosis única de 400 mg de PENTASA de 1 g, que fue comparable a los 140 mg de mesalamina recuperados de la dosis equivalente molar de sulfasalazina en comprimidos de 2,5 g. La eliminación de mesalamina libre y salicilatos en las heces aumentó proporcionalmente con la dosis de PENTASA. El ácido N-acetil-5-aminosalicílico fue el principal compuesto excretado en la orina (19 % a 30 %) después de la administración de 400 mg de PENTASA.
Ensayos clínicos
En dos ensayos aleatorizados, doble ciego, controlados con placebo, de respuesta a la dosis (UC-1 y UC-2) de 625 pacientes con colitis ulcerosa activa de leve a moderada, PENTASA 400 mg, a una dosis oral de 4 g/día administrada 1 g cuatro veces al día, produjo una mejora constante en los parámetros primarios de eficacia identificados prospectivamente, PGA, Tx F y SI, como se muestra en la siguiente tabla.
La dosis de 4 g de PENTASA también proporcionó una mejora constante en los parámetros secundarios de eficacia, a saber, la frecuencia de idas al baño, la consistencia de las heces, el sangrado rectal, el dolor abdominal/rectal y la urgencia. La dosis de 4 g de PENTASA indujo la remisión según lo evaluado por criterios de valoración endoscópicos y sintomáticos.
En algunos pacientes, se observó que la dosis de 2 g de PENTASA 400 mg mejoraba los parámetros de eficacia medidos. Sin embargo, la dosis de 2 g arrojó resultados inconsistentes en los parámetros primarios de eficacia en los dos ensayos adecuados y bien controlados.
INFORMACIÓN DEL PACIENTE
No se proporcionó información. por favor refiérase a PRECAUCIONES sección.
