Micardis 20mg, 40mg, 80mg Telmisartan Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Micardis 40mg y cómo se usa?
Micardis es un medicamento recetado que se usa para tratar los síntomas de la presión arterial alta (hipertensión) y para reducir el riesgo de enfermedades cardiovasculares, como accidentes cerebrovasculares y ataques al corazón. Micardis 20 mg se puede usar solo o con otros medicamentos.
Micardis 80 mg pertenece a una clase de medicamentos llamados BRA.
No se sabe si Micardis es seguro y efectivo en niños menores de 18 años.
¿Cuáles son los posibles efectos secundarios de Micardis?
Micardis 80 mg puede causar efectos secundarios graves, que incluyen:
- aturdimiento,
- hinchazón,
- rápido aumento de peso,
- náuseas,
- debilidad,
- sensación de hormigueo,
- Dolor de pecho,
- latidos cardíacos irregulares, y
- pérdida de movimiento
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Micardis incluyen:
- congestión nasal,
- dolor de sinusitis,
- dolor de espalda, y
- Diarrea
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Micardis. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
ADVERTENCIA
TOXICIDAD FETAL
- Cuando se detecte un embarazo, suspenda MICARDIS 40 mg lo antes posible [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
- Los medicamentos que actúan directamente sobre el sistema renina-angiotensina pueden causar lesiones y la muerte del feto en desarrollo [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
DESCRIPCIÓN
MICARDIS 40 mg es un antagonista no peptídico del receptor de angiotensina II (tipo AT1).
El telmisartán se describe químicamente como 4'-[(1,4'-dimetil-2'-propil [2,6'-bi-1H-bencimidazol]-1'-il)metil Ácido ]-[1,1'-bifenil]-2-carboxílico. Su fórmula empírica es C33H30N4O2, su peso molecular es 514,63 y su fórmula estructural es:
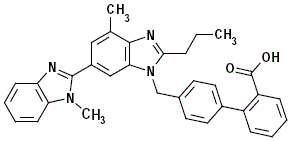
El telmisartán es un sólido de color blanco a ligeramente amarillento. Es prácticamente insoluble en agua y en el rango de pH de 3 a 9, escasamente soluble en ácido fuerte (excepto insoluble en ácido clorhídrico) y soluble en base fuerte.
MICARDIS 20 mg está disponible en comprimidos para administración oral que contienen 20 mg, 40 mg u 80 mg de telmisartán. Las tabletas contienen los siguientes ingredientes inactivos: hidróxido de sodio, meglumina, povidona, sorbitol y estearato de magnesio. Los comprimidos de MICARDIS son higroscópicos y requieren protección contra la humedad.
INDICACIONES
MICARDIS HCT (telmisartán e hidroclorotiazida) está indicado para el tratamiento de la hipertensión, para disminuir la presión arterial. La reducción de la presión arterial reduce el riesgo de eventos cardiovasculares fatales y no fatales, principalmente accidentes cerebrovasculares e infartos de miocardio. Estos beneficios se han observado en ensayos controlados de fármacos antihipertensivos de una amplia variedad de clases farmacológicas, incluidas las clases a las que pertenece principalmente este fármaco. No existen ensayos controlados que demuestren la reducción del riesgo con MICARDIS HCT.
El control de la presión arterial alta debe ser parte del manejo integral del riesgo cardiovascular, incluido, según corresponda, el control de los lípidos, el manejo de la diabetes, la terapia antitrombótica, el abandono del hábito de fumar, el ejercicio y la ingesta limitada de sodio. Muchos pacientes requerirán más de un fármaco para lograr los objetivos de presión arterial. Para obtener consejos específicos sobre objetivos y manejo, consulte las pautas publicadas, como las del Comité Nacional Conjunto sobre Prevención, Detección, Evaluación y Tratamiento de la Presión Arterial Alta (JNC) del Programa Nacional de Educación sobre la Presión Arterial Alta.
Numerosos fármacos antihipertensivos, de una variedad de clases farmacológicas y con diferentes mecanismos de acción, han demostrado en ensayos controlados aleatorios que reducen la morbilidad y mortalidad cardiovascular, y se puede concluir que es la reducción de la presión arterial, y no alguna otra propiedad farmacológica de las drogas, que es en gran parte responsable de esos beneficios. El beneficio de resultado cardiovascular más grande y consistente ha sido una reducción en el riesgo de accidente cerebrovascular, pero también se han observado regularmente reducciones en el infarto de miocardio y la mortalidad cardiovascular.
La presión sistólica o diastólica elevada provoca un aumento del riesgo cardiovascular, y el aumento del riesgo absoluto por mmHg es mayor con presiones arteriales más altas, de modo que incluso reducciones modestas de la hipertensión grave pueden proporcionar un beneficio sustancial. La reducción del riesgo relativo de la reducción de la presión arterial es similar en poblaciones con riesgo absoluto variable, por lo que el beneficio absoluto es mayor en pacientes que tienen un riesgo más alto independientemente de su hipertensión (por ejemplo, pacientes con diabetes o hiperlipidemia), y se esperaría que tales pacientes beneficiarse de un tratamiento más agresivo para lograr un objetivo de presión arterial más bajo.
Algunos medicamentos antihipertensivos tienen efectos menores sobre la presión arterial (como monoterapia) en pacientes de raza negra, y muchos medicamentos antihipertensivos tienen indicaciones y efectos adicionales aprobados (p. ej., angina, insuficiencia cardíaca o nefropatía diabética). Estas consideraciones pueden guiar la selección de la terapia [ver Estudios clínicos ].
MICARDIS 40 mg HCT no está indicado como terapia inicial para el tratamiento de la hipertensión [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
MICARDIS HCT puede usarse solo o en combinación con otros agentes antihipertensivos.
DOSIFICACIÓN Y ADMINISTRACIÓN
Información de dosificación
Iniciar un paciente cuya presión arterial no se controle adecuadamente con la monoterapia de 80 mg de telmisartán en MICARDIS 40 mg HCT, 80 mg/12,5 mg una vez al día. La dosis se puede ajustar hasta 160 mg/25 mg después de 2 a 4 semanas, si es necesario.
Inicie un paciente cuya presión arterial no se controle adecuadamente con 25 mg una vez al día de hidroclorotiazida, o que esté controlada pero experimente hipopotasemia con este régimen en MICARDIS HCT 80 mg/12,5 mg una vez al día. La dosis se puede ajustar hasta 160 mg/25 mg después de 2 a 4 semanas, si es necesario.
Los pacientes con la titulación de los componentes individuales (telmisartán e hidroclorotiazida) pueden recibir en su lugar la dosis correspondiente de 20 mg de MICARDIS HCT.
MICARDIS 20 mg HCT puede administrarse con otros medicamentos antihipertensivos.
Ajuste de dosis para insuficiencia hepática
Iniciar a los pacientes con trastornos biliares obstructivos o insuficiencia hepática bajo estrecha supervisión médica utilizando la combinación de 40 mg/12,5 mg. Los comprimidos de 40 mg de MICARDIS HCT no se recomiendan para pacientes con insuficiencia hepática grave [ver Uso en poblaciones específicas y FARMACOLOGÍA CLÍNICA ].
Instrucciones de administración importantes
Los comprimidos de MICARDIS HCT no deben retirarse de los blísteres hasta inmediatamente antes de la administración.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
- Comprimidos rojos y blancos de 40 mg/12,5 mg marcados con el logotipo de Boehringer Ingelheim y H4
- Comprimidos rojos y blancos de 80 mg/12,5 mg marcados con el logotipo de Boehringer Ingelheim y H8
- Comprimidos amarillos y blancos de 80 mg/25 mg marcados con el logotipo de Boehringer Ingelheim y H9
Almacenamiento y manipulación
MICARDIS 20 mg HCT está disponible en tres concentraciones como comprimidos biconvexos de dos capas, oblongos y sin recubrimiento que contienen telmisartán e hidroclorotiazida:
- Comprimido de 40 mg/12,5 mg: rojo y blanco (puede contener puntos rojos) marcados con el símbolo de la empresa Boehringer Ingelheim y H4; blíster sellado individualmente en cajas de 30 comprimidos como tarjetas de 3 x 10 ( CDN 0597-0043-37)
- Comprimido de 80 mg/12,5 mg: rojo y blanco (puede contener puntos rojos) marcados con el símbolo de la empresa Boehringer Ingelheim y H8; blíster sellado individualmente en cajas de 30 comprimidos como tarjetas de 3 x 10 ( CDN 0597-0044-37)
- Comprimido de 80 mg/25 mg: amarillo y blanco (puede contener motas amarillas) marcados con el símbolo de la empresa Boehringer Ingelheim y H9; blíster sellado individualmente en cajas de 30 comprimidos como tarjetas de 3 x 10 ( CDN 0597-0042-37)
Almacenamiento
Almacenar a 25°C (77°F); excursiones permitidas a 15°C-30°C (59°F-86°F) [consulte Temperatura ambiente controlada por la USP]. Los comprimidos no deben retirarse de los blísteres hasta inmediatamente antes de la administración.
Distribuido por: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 EE. UU. Revisado: octubre de 2018
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas se analizan en otra parte del etiquetado:
- Hipotensión [ver ADVERTENCIAS Y PRECAUCIONES ]
- Insuficiencia renal [ver ADVERTENCIAS Y PRECAUCIONES ]
- Electrolitos y trastornos metabólicos [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en ensayos clínicos
Debido a que los estudios clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los estudios clínicos de un fármaco no pueden compararse directamente con las tasas de los estudios clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Se ha evaluado la seguridad de MICARDIS HCT en más de 1700 pacientes, incluidos 716 tratados por hipertensión durante más de 6 meses y 420 durante más de 1 año. Las reacciones adversas se han limitado a las que se han informado previamente con telmisartán y/o hidroclorotiazida.
Las reacciones adversas que ocurrieron con una incidencia de ≥2% en pacientes tratados con telmisartán/hidroclorotiazida y en una tasa mayor que en pacientes tratados con placebo, se presentan en la Tabla 1 [ver Estudios clínicos ].
Otras reacciones adversas observadas con telmisartán/hidroclorotiazida fueron: dolor (incluyendo de espalda y abdominal), dispepsia, eritema, vómitos, bronquitis y faringitis.
Las reacciones adversas ocurrieron aproximadamente a las mismas tasas en hombres y mujeres, pacientes mayores y jóvenes, y pacientes negros y no negros.
Telmisartán
Otros eventos adversos que se han informado con telmisartán se enumeran a continuación:
Sistema nervioso autónomo: impotencia, aumento de la sudoración, sofocos
Cuerpo como un todo: alergia, fiebre, dolor en las piernas, dolor en el pecho
Cardiovascular: palpitaciones, angina de pecho, ECG anormal, hipertensión, edema periférico
Sistema nervioso central: insomnio, somnolencia, migraña, parestesia, contracciones musculares involuntarias, hipoestesia
Gastrointestinal: flatulencia, estreñimiento, gastritis, boca seca, hemorroides, reflujo gastroesofágico, dolor de muelas
hepatobiliar: elevaciones de las enzimas hepáticas o la bilirrubina sérica
Metabólico: gota, hipercolesterolemia, diabetes mellitus
Musculoesquelético: artritis, artralgia, calambres en las piernas, mialgia
Psiquiátrico: ansiedad, depresión, nerviosismo
Mecanismo de resistencia: infección, absceso, otitis media
Respiratorio: asma, rinitis, disnea, epistaxis
Piel: dermatitis, eccema, prurito
Urinario: frecuencia miccional, cistitis
Vascular: trastorno cerebrovascular
Sentidos especiales: visión anormal, conjuntivitis, tinnitus, dolor de oído
hidroclorotiazida
Otros eventos adversos que se han informado con hidroclorotiazida se enumeran a continuación:
Cuerpo como un todo: debilidad
Digestivo: pancreatitis, ictericia (ictericia colestática intrahepática), sialoadenitis, calambres, irritación gástrica
hematológico: anemia aplásica, agranulocitosis, leucopenia, anemia hemolítica, trombocitopenia
Hipersensibilidad: púrpura, fotosensibilidad, urticaria, angeítis necrosante (vasculitis y vasculitis cutánea), fiebre, dificultad respiratoria incluyendo neumonitis y edema pulmonar, reacciones anafilácticas
Metabólico: hiperglucemia, glucosuria
Musculoesquelético: espasmo muscular
Sistema Nervioso/Psiquiátrico: inquietud
Renal: nefritis intersticial
Piel: eritema multiforme, incluido el síndrome de Stevens-Johnson, dermatitis exfoliativa, incluida la necrólisis epidérmica tóxica
Sentidos especiales: visión borrosa transitoria, xantopsia
Hallazgos de laboratorio clínico
Creatinina, nitrógeno ureico en sangre (BUN)
Se observaron aumentos en el BUN (≥11,2 mg/dl) y la creatinina sérica (≥0,5 mg/dl) en el 2,8 % y el 1,4 %, respectivamente, de los pacientes con hipertensión esencial tratados con MICARDIS 80 mg HCT comprimidos en ensayos controlados. Ningún paciente interrumpió el tratamiento con MICARDIS 80 mg HCT comprimidos debido a un aumento en BUN o creatinina [ver ADVERTENCIAS Y PRECAUCIONES ].
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de MICARDIS HCT. Debido a que estas reacciones son reportadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Trastornos de la sangre y del sistema linfático: eosinofilia
Trastornos cardíacos: fibrilación auricular, insuficiencia cardíaca congestiva, infarto de miocardio, taquicardia, bradicardia
Trastornos del oído y del laberinto: vértigo
Desordenes generales y condiciones administrativas del sitio: astenia, edema
hepatobiliar: Función hepática anormal/trastorno hepático
Trastornos del sistema inmunológico: reaccion anafiláctica
Infecciones e infestaciones: infección del tracto urinario
Investigaciones: aumento de CPK
Trastornos del metabolismo y la nutrición: hipoglucemia (en pacientes diabéticos)
Trastornos musculoesqueléticos y del tejido conjuntivo: dolor en los tendones (incluyendo tendinitis, tenosinovitis), rabdomiolisis
Trastornos del sistema nervioso: síncope, dolor de cabeza
Trastornos renales y urinarios: insuficiencia renal, insuficiencia renal incluida la insuficiencia renal aguda
Trastornos del sistema reproductivo y de la mama: disfuncion erectil
Trastornos respiratorios, torácicos y mediastínicos: tos
Trastornos de la piel y del tejido subcutáneo: erupción por fármacos (erupción cutánea tóxica notificada principalmente como toxicodermia, erupción cutánea y urticaria), angioedema (con desenlace fatal)
Trastorno vascular: hipotensión ortostática
INTERACCIONES CON LA DROGAS
Agentes que aumentan el potasio sérico
La administración conjunta de telmisartán con otros medicamentos que elevan los niveles séricos de potasio puede provocar hiperpotasemia. Controle el potasio sérico en tales pacientes.
Litio
Se han informado aumentos en las concentraciones séricas de litio y toxicidad por litio con el uso concomitante de diuréticos tiazídicos o antagonistas de los receptores de la angiotensina II, incluido telmisartán. Controle los niveles de litio en pacientes que reciben MICARDIS 80 mg HCT y litio.
Agentes antiinflamatorios no esteroideos, incluidos los inhibidores selectivos de las ciclooxigenasas E-2
Telmisartán
Agentes antiinflamatorios no esteroideos, incluidos los inhibidores selectivos de la ciclooxigenasa-2 (inhibidores de la COX-2): en pacientes de edad avanzada, con depleción de volumen (incluidos los que reciben tratamiento con diuréticos) o con función renal comprometida, la administración concomitante de AINE, incluidos los inhibidores selectivos de la COX-2, con ARB, incluido telmisartán, pueden provocar el deterioro de la función renal, incluida la posible insuficiencia renal aguda. Estos efectos suelen ser reversibles. El efecto antihipertensivo de los BRA puede verse atenuado por los AINE. Por lo tanto, controle la función renal y la presión arterial periódicamente en pacientes que reciben 40 mg de MICARDIS HCT y AINE.
hidroclorotiazida
La administración de un agente antiinflamatorio no esteroideo, incluido un inhibidor selectivo de la COX2, puede reducir los efectos diuréticos, natriuréticos y antihipertensivos de los diuréticos. Por lo tanto, cuando se utilicen concomitantemente MICARDIS HCT y agentes antiinflamatorios no esteroideos, incluidos los inhibidores selectivos de la COX2, observe atentamente para determinar si se obtiene el efecto deseado del diurético.
Bloqueo dual del sistema renina-angiotens en-aldosterona y cambios en la función renal
El bloqueo dual del sistema renina-angiotensina-aldosterona (RAS) con bloqueadores de angiotensina, inhibidores de la ECA o aliskiren se asocia con un mayor riesgo de hipotensión, hiperpotasemia e insuficiencia renal. El ensayo ONTARGET reclutó a 25 620 pacientes ≥ 55 años con enfermedad aterosclerótica o diabetes con daño de órgano blanco, asignándolos al azar a telmisartán (ARB) solo, ramipril (inhibidor de la ECA) solo o la combinación, y los siguió durante una mediana de 56 meses . Los pacientes que recibieron la combinación de ARB e inhibidor de la ECA no obtuvieron ningún beneficio adicional (sin reducción adicional del riesgo de muerte cardiovascular, infarto de miocardio, accidente cerebrovascular u hospitalización por insuficiencia cardíaca) en comparación con la monoterapia con ARB o la monoterapia con inhibidor de la ECA, pero experimentaron un aumento incidencia de disfunción renal (p. ej., insuficiencia renal aguda) en comparación con los grupos de monoterapia.
En general, evite el uso combinado de inhibidores de RAS. Controle de cerca la presión arterial, la función renal y los electrolitos en pacientes que toman MICARDIS 40 mg HCT y otros agentes que afectan el RAS.
No coadministre aliskiren con MICARDIS HCT en pacientes con diabetes. Evite el uso concomitante de aliskiren con MICARDIS HCT en pacientes con insuficiencia renal (TFG
Digoxina
Cuando se coadministró telmisartán con digoxina, se observaron aumentos medios en la concentración plasmática máxima de digoxina (49 %) y en la concentración mínima (20 %). Monitoree los niveles de digoxina en pacientes que toman MICARDIS 40 mg HCT concomitantemente y digoxina.
Fármacos antidiabéticos (agentes orales e insulina)
Puede ser necesario ajustar la dosis de los medicamentos antidiabéticos cuando se administran conjuntamente con hidroclorotiazida.
Resinas de colestiramina y colestipol
La absorción de hidroclorotiazida se ve afectada en presencia de resinas de intercambio aniónico. Escalonar la dosificación de hidroclorotiazida y la resina de modo que la hidroclorotiazida se administre al menos 4 horas antes o de 4 a 6 horas después de la administración de la resina.
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Toxicidad Fetal
Telmisartán
El uso de fármacos que actúan sobre el sistema renina-angiotensina durante el segundo y tercer trimestre del embarazo reduce la función renal fetal y aumenta la morbilidad y muerte fetal y neonatal. El oligohidramnios resultante puede asociarse con hipoplasia pulmonar fetal y deformaciones esqueléticas. Los posibles efectos adversos neonatales incluyen hipoplasia craneal, anuria, hipotensión, insuficiencia renal y muerte. Cuando se detecte un embarazo, suspenda MICARDIS HCT lo antes posible.
hidroclorotiazida
Las tiazidas atraviesan la barrera placentaria y aparecen en la sangre del cordón umbilical. Las reacciones adversas incluyen ictericia fetal o neonatal y trombocitopenia [ver Uso en poblaciones específicas ].
Hipotensión en pacientes con depleción de volumen o sal
En pacientes con un sistema renina-angiotensina activado, como los pacientes con depleción de volumen o sal (p. ej., aquellos que están siendo tratados con altas dosis de diuréticos), puede ocurrir hipotensión sintomática después de iniciar el tratamiento con MICARDIS HCT. Corrija el volumen o la depleción de sal antes de la administración de MICARDIS 80 mg HCT.
Insuficiencia renal
Los cambios en la función renal, incluida la insuficiencia renal aguda, pueden ser causados por fármacos que inhiben el sistema renina-angiotensina y por diuréticos. Los pacientes cuya función renal puede depender en parte de la actividad del sistema renina-angiotensina (p. ej., pacientes con estenosis de la arteria renal, enfermedad renal crónica, insuficiencia cardíaca congestiva grave o depleción de volumen) pueden tener un riesgo particular de desarrollar oliguria, azotemia progresiva , o insuficiencia renal aguda en MICARDIS HCT. Vigilar la función renal periódicamente en estos pacientes. Considere suspender o interrumpir el tratamiento en pacientes que desarrollen una disminución clínicamente significativa de la función renal con MICARDIS HCT.
Electrolitos y trastornos metabólicos
Los medicamentos, incluido telmisartán, que inhiben el sistema renina-angiotensina pueden causar hiperpotasemia, particularmente en pacientes con insuficiencia renal, diabetes o el uso combinado con otros bloqueadores de los receptores de angiotensina o inhibidores de la ECA y el uso concomitante de otros medicamentos que elevan los niveles séricos de potasio [ver INTERACCIONES CON LA DROGAS ].
La hidroclorotiazida puede causar hipopotasemia e hiponatremia. Se ha demostrado que las tiazidas aumentan la excreción urinaria de magnesio; esto puede resultar en hipomagnesemia. La hipomagnesemia puede provocar hipopotasemia, que puede ser difícil de tratar a pesar de la reposición de potasio. Monitoree los electrolitos séricos periódicamente.
En ensayos controlados que utilizaron el tratamiento combinado de telmisartán/hidroclorotiazida, ningún paciente al que se le administró 40 mg/12,5 mg, 80 mg/12,5 mg o 80 mg/25 mg experimentó una disminución del potasio ≥1,4 mEq/l, y ningún paciente experimentó hiperpotasemia.
La hidroclorotiazida disminuye la excreción urinaria de calcio y puede causar elevaciones del calcio sérico.
La hidroclorotiazida puede alterar la tolerancia a la glucosa y elevar los niveles séricos de colesterol y triglicéridos.
Puede ocurrir hiperuricemia o se puede precipitar una gota franca en ciertos pacientes que reciben terapia con tiazidas. Debido a que telmisartán disminuye el ácido úrico, telmisartán en combinación con hidroclorotiazida atenúa la hiperuricemia inducida por diuréticos.
Reacción de hipersensibilidad
hidroclorotiazida
Las reacciones de hipersensibilidad a la hidroclorotiazida pueden ocurrir en pacientes con o sin antecedentes de alergia o asma bronquial, pero son más probables en pacientes con tales antecedentes [ver CONTRAINDICACIONES ].
Miopía aguda y glaucoma de ángulo cerrado secundario
La hidroclorotiazida, una sulfonamida, puede causar una reacción idiosincrásica que da como resultado miopía transitoria aguda y glaucoma de ángulo cerrado agudo. Los síntomas incluyen el inicio agudo de disminución de la agudeza visual o dolor ocular y, por lo general, ocurren dentro de las horas o semanas posteriores al inicio del fármaco. El glaucoma de ángulo cerrado agudo no tratado puede conducir a la pérdida permanente de la visión. El tratamiento primario es suspender la hidroclorotiazida lo antes posible. Es posible que sea necesario considerar tratamientos médicos o quirúrgicos inmediatos si la presión intraocular permanece sin controlar. Los factores de riesgo para desarrollar glaucoma de ángulo cerrado agudo pueden incluir antecedentes de alergia a las sulfonamidas o a la penicilina.
Lupus eritematoso sistémico
Se ha informado que los diuréticos tiazídicos causan exacerbación o activación del lupus eritematoso sistémico.
Pacientes possimpatectomía
Los efectos antihipertensivos de la hidroclorotiazida pueden aumentar en el paciente possimpatectomía.
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( INFORMACIÓN DEL PACIENTE ).
El embarazo
Asesorar a las pacientes en edad fértil sobre las consecuencias de la exposición a MICARDIS 40 mg HCT durante el embarazo. Analice las opciones de tratamiento con las mujeres que planean quedar embarazadas. Dígales a los pacientes que informen los embarazos a sus médicos lo antes posible [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
Lactancia
Aconseje a las mujeres lactantes que no amamanten durante el tratamiento con MICARDIS HCT [ver Uso en poblaciones específicas ].
Hipotensión sintomática y síncope
Advierta a los pacientes que pueden presentarse mareos, especialmente durante los primeros días de terapia, y que informen a su proveedor de atención médica. Informar a los pacientes que la ingesta inadecuada de líquidos, la transpiración excesiva, la diarrea o los vómitos pueden provocar una caída excesiva de la presión arterial, con las mismas consecuencias de mareo y posible síncope. Aconseje a los pacientes que se comuniquen con su proveedor de atención médica si se produce un síncope [ver ADVERTENCIAS Y PRECAUCIONES ].
Suplementos de potasio
Aconseje a los pacientes que no usen suplementos de potasio o sustitutos de la sal que contengan potasio sin consultar al proveedor de atención médica que los recetó [ver ADVERTENCIAS Y PRECAUCIONES y INTERACCIONES CON LA DROGAS ].
Miopía aguda y glaucoma de ángulo cerrado secundario
Aconseje a los pacientes que descontinúen MICARDIS 80 mg HCT y busquen atención médica inmediata si experimentan síntomas de miopía aguda o glaucoma de ángulo cerrado secundario [ver ADVERTENCIAS Y PRECAUCIONES ].
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Telmisartán e hidroclorotiazida
No se han realizado estudios de carcinogenicidad, mutagenicidad o fertilidad con la combinación de telmisartán e hidroclorotiazida.
Telmisartán
No hubo evidencia de carcinogenicidad cuando se administró telmisartán en la dieta de ratones y ratas hasta por 2 años. Las dosis más altas administradas a ratones (1000 mg/kg/día) y ratas (100 mg/kg/día) son, en mg/m2, aproximadamente 59 y 13 veces, respectivamente, la dosis máxima recomendada en humanos (MRHD) de telmisartán. Se ha demostrado que estas mismas dosis proporcionan exposiciones sistémicas promedio a telmisartán >100 veces y >25 veces, respectivamente, la exposición sistémica en humanos que reciben la MRHD de telmisartán (80 mg/día).
Los ensayos de genotoxicidad no revelaron ningún efecto relacionado con telmisartán a nivel genético o cromosómico. Estos ensayos incluyeron pruebas de mutagenicidad bacteriana con Salmonella y E. coli (Ames), una prueba de mutación genética con células V79 de hámster chino, una prueba citogenética con linfocitos humanos y una prueba de micronúcleo de ratón.
No se observaron efectos relacionados con el fármaco en el rendimiento reproductivo de ratas macho y hembra con 100 mg/kg/día (la dosis más alta administrada), aproximadamente 13 veces, sobre una base de mg/m2, la MRHD de telmisartán. Esta dosis en la rata resultó en una exposición sistémica promedio (AUC de telmisartán determinada el día 6 del embarazo) al menos 50 veces la exposición sistémica promedio en humanos en la MRHD (80 mg/día).
hidroclorotiazida
Los estudios de alimentación de dos años en ratones y ratas realizados bajo los auspicios del Programa Nacional de Toxicología (NTP) no revelaron evidencia de un potencial carcinogénico de hidroclorotiazida en ratones hembra (en dosis de hasta aproximadamente 600 mg/kg/día) o en machos. y ratas hembra (a dosis de hasta aproximadamente 100 mg/kg/día). El NTP, sin embargo, encontró evidencia equívoca de hepatocarcinogenicidad en ratones macho.
La hidroclorotiazida no fue genotóxica in vitro en el ensayo de mutagenicidad de Ames de las cepas TA 98, TA 100, TA 1535, TA 1537 y TA 1538 de Salmonella typhimurium y en la prueba de ovario de hámster chino (CHO) para aberraciones cromosómicas, ni en ensayos in vivo utilizando cromosomas de células germinales de ratón, cromosomas de médula ósea de hámster chino y el gen de rasgo letal recesivo ligado al sexo de Drosophila. Se obtuvieron resultados positivos en el ensayo de intercambio de cromátidas hermanas CHO in vitro (clastogenicidad), en el ensayo de células de linfoma de ratón (mutagenicidad) y en el ensayo de no disyunción de Aspergillus nidulans.
La hidroclorotiazida no tuvo efectos adversos sobre la fertilidad de ratones y ratas de ambos sexos en estudios en los que estas especies fueron expuestas, a través de su dieta, a dosis de hasta 100 y 4 mg/kg, respectivamente, antes del apareamiento y durante la gestación.
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
MICARDIS HCT puede causar daño fetal cuando se administra a una mujer embarazada. El uso de fármacos que actúan sobre el sistema renina-angiotensina durante el segundo y tercer trimestre del embarazo reduce la función renal fetal y aumenta la morbilidad y muerte fetal y neonatal (ver Consideraciones clínicas ). La mayoría de los estudios epidemiológicos que examinan las anomalías fetales después de la exposición al uso de antihipertensivos en el primer trimestre no han distinguido los fármacos que afectan al sistema renina-angiotensina de otros agentes antihipertensivos. Los estudios en ratas y conejos con telmisartán mostraron fetotoxicidad solo a dosis tóxicas para la madre (ver Datos ). Cuando se detecte un embarazo, suspenda MICARDIS HCT lo antes posible.
Se desconoce el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo para la población indicada. Todos los embarazos tienen un riesgo de fondo de defecto congénito, pérdida u otros resultados adversos. En la población general de EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 % al 4 % y del 15 % al 20 %, respectivamente.
Consideraciones clínicas
Riesgo materno y/o embrionario/fetal asociado a la enfermedad
La hipertensión en el embarazo aumenta el riesgo materno de preeclampsia, diabetes gestacional, parto prematuro y complicaciones del parto (p. ej., necesidad de cesárea y hemorragia posparto). La hipertensión aumenta el riesgo fetal de restricción del crecimiento intrauterino y muerte intrauterina. Las mujeres embarazadas con hipertensión deben ser monitoreadas cuidadosamente y tratadas en consecuencia.
Reacciones adversas fetales/neonatales
Telmisartán
El uso de medicamentos que actúan sobre el SRA en el segundo y tercer trimestre del embarazo puede provocar lo siguiente: oligohidramnios, reducción de la función renal fetal que conduce a anuria e insuficiencia renal, hipoplasia pulmonar fetal, deformaciones esqueléticas, incluida la hipoplasia del cráneo, hipotensión y muerte . En el caso inusual de que no exista una alternativa adecuada a la terapia con medicamentos que afectan el sistema renina-angiotensina para un paciente en particular, informe a la madre del riesgo potencial para el feto.
En pacientes que toman MICARDIS HCT durante el embarazo, realice ecografías en serie para evaluar el entorno intraamniótico. Las pruebas fetales pueden ser apropiadas, según la semana de gestación. Si se observa oligohidramnios, suspenda MICARDIS HCT, a menos que se considere que salva la vida de la madre. Sin embargo, los pacientes y los médicos deben ser conscientes de que es posible que el oligohidramnios no aparezca hasta después de que el feto haya sufrido una lesión irreversible.
Observe de cerca a los bebés con antecedentes de exposición en el útero a MICARDIS 20 mg HCT para detectar hipotensión, oliguria e hiperpotasemia. Si ocurre oliguria o hipotensión, mantener la presión arterial y la perfusión renal. Es posible que se requieran exanguinotransfusiones o diálisis como un medio para revertir la hipotensión y reemplazar la función renal [ver Uso en poblaciones específicas ].
hidroclorotiazida
Las tiazidas atraviesan la placenta, y el uso de tiazidas durante el embarazo está asociado con un riesgo de ictericia fetal o neonatal, trombocitopenia y otras posibles reacciones adversas que han ocurrido en adultos.
Datos
Datos de animales
MICARDIS 40 mg HCT
Se realizó un estudio de toxicidad del desarrollo en ratas con dosis de telmisartán/hidroclorotiazida de 3,2/1,0, 15/4,7, 50/15,6 y 0/15,6 mg/kg/día. Aunque las dos combinaciones de dosis más altas parecían ser más tóxicas (disminución significativa en el aumento de peso corporal) para las madres que cualquiera de los dos fármacos por separado, no pareció haber un aumento de la toxicidad para los embriones en desarrollo.
Telmisartán
No se observaron efectos teratogénicos cuando se administró telmisartán a ratas preñadas en dosis orales de hasta 50 mg/kg/día ya conejas preñadas en dosis orales de hasta 45 mg/kg/día. En conejos, se observó letalidad embrionaria asociada con toxicidad materna (ganancia de peso corporal y consumo de alimentos reducidos) con 45 mg/kg/día (aproximadamente 12 veces la dosis humana máxima recomendada [DMRH] de 80 mg sobre una base de mg/m2). En ratas, se observó que dosis de telmisartán de 15 mg/kg/día (aproximadamente 1,9 veces la MRHD sobre una base de mg/m2) tóxicas para la madre (reducción del aumento de peso corporal y del consumo de alimentos), administradas durante la última etapa de la gestación y la lactancia, produjeron efectos adversos en recién nacidos, incluyendo viabilidad reducida, bajo peso al nacer, maduración retrasada y disminución del aumento de peso. Las dosis sin efectos observados para la toxicidad del desarrollo en ratas y conejos, 5 y 15 mg/kg/día, respectivamente, son aproximadamente 0,64 y 3,7 veces, respectivamente, sobre una base de mg/m2, la MRHD de telmisartán (80 mg/día ).
hidroclorotiazida
Los estudios en los que se administró hidroclorotiazida a ratones y ratas preñadas durante sus respectivos períodos de mayor organogénesis en dosis de hasta 3000 y 1000 mg/kg/día, respectivamente (alrededor de 600 y 400 veces la MRHD), no proporcionaron evidencia de daño al feto .
Las tiazidas pueden atravesar la placenta y las concentraciones alcanzadas en la vena umbilical se aproximan a las del plasma materno. La hidroclorotiazida, al igual que otros diuréticos, puede causar hipoperfusión placentaria. Se acumula en el líquido amniótico, con concentraciones reportadas hasta 19 veces mayores que en el plasma de la vena umbilical. El uso de tiazidas durante el embarazo está asociado con un riesgo de ictericia o trombocitopenia fetal o neonatal. Dado que no previenen ni alteran el curso de la gestosis (preeclampsia) de EPH (edema, proteinuria, hipertensión), estos medicamentos no deben usarse para tratar la hipertensión en mujeres embarazadas. Debe evitarse el uso de hidroclorotiazida para otras indicaciones (p. ej., enfermedad cardiaca) en el embarazo.
Lactancia
Resumen de riesgos
No hay información sobre la presencia de MICARDIS 20 mg HCT o telmisartán en la leche humana, los efectos sobre el lactante o los efectos sobre la producción de leche. Los estudios publicados limitados informan que la hidroclorotiazida está presente en la leche humana. Sin embargo, no hay información suficiente para determinar los efectos de la hidroclorotiazida en el lactante o los efectos de la hidroclorotiazida en la producción de leche. Telmisartán está presente en la leche de ratas lactantes. (ver Datos ). Debido a la posibilidad de que se produzcan reacciones adversas graves en el lactante, como hipotensión, hiperpotasemia e insuficiencia renal, aconseje a la mujer lactante que no amamante durante el tratamiento con MICARDIS HCT.
Datos
Telmisartán estuvo presente en la leche de ratas lactantes en concentraciones de 1,5 a 2 veces las encontradas en el plasma de 4 a 8 horas después de la administración.
Uso pediátrico
No se ha establecido la seguridad y eficacia de MICARDIS HCT en pacientes pediátricos.
Recién nacidos con antecedentes de exposición en el útero a MICARDIS HCT
Si ocurre oliguria o hipotensión, mantener la presión arterial y la perfusión renal. Es posible que se requieran exanguinotransfusiones o diálisis como medios para revertir la hipotensión y/o sustituir la función renal alterada.
Uso geriátrico
En los ensayos clínicos controlados (n=1017), aproximadamente el 20 % de los pacientes tratados con telmisartán/hidroclorotiazida tenían 65 años o más, y el 5 % tenían 75 años o más. No se observaron diferencias generales en la eficacia y seguridad de telmisartán/hidroclorotiazida en estos pacientes en comparación con pacientes más jóvenes. Otra experiencia clínica informada no ha identificado diferencias en las respuestas entre los ancianos y los pacientes más jóvenes, pero no se puede descartar una mayor sensibilidad de algunas personas mayores. En general, la selección de la dosis para un paciente anciano debe ser cautelosa, generalmente comenzando en el extremo inferior del rango de dosificación, lo que refleja la mayor frecuencia de disminución de la función hepática, renal o cardíaca y de enfermedades concomitantes u otra terapia con medicamentos.
Uso en pacientes con insuficiencia hepática
Los pacientes con trastornos obstructivos biliares o insuficiencia hepática deben iniciar el tratamiento bajo estrecha supervisión médica utilizando la combinación de 40 mg/12,5 mg.
Telmisartán
Como la mayor parte de telmisartán se elimina por excreción biliar, se puede esperar que los pacientes con trastornos obstructivos biliares o insuficiencia hepática tengan un aclaramiento reducido y niveles sanguíneos más altos.
hidroclorotiazida
Las alteraciones menores del equilibrio de líquidos y electrolitos pueden precipitar un coma hepático en pacientes con insuficiencia hepática o enfermedad hepática progresiva.
Uso en pacientes con insuficiencia renal
No se ha establecido la seguridad y eficacia de MICARDIS 40 mg HCT en pacientes con insuficiencia renal grave (CrCl ≤30 ml/min). En pacientes con insuficiencia renal grave, no se recomiendan los comprimidos de 80 mg de MICARDIS HCT. No es necesario ajustar la dosis en pacientes con insuficiencia renal leve (CrCl de 60 a 90 ml/min) o moderada (CrCl de 30 a 60 ml/min).
SOBREDOSIS
Telmisartán
Hay datos limitados disponibles con respecto a la sobredosis de telmisartán en humanos. Las manifestaciones más probables de una sobredosis de telmisartán son hipotensión, mareos y taquicardia; bradicardia podría ocurrir por estimulación parasimpática (vagal). Si ocurriera hipotensión sintomática, se debe instituir un tratamiento de soporte. Telmisartán no se elimina por hemodiálisis.
hidroclorotiazida
Los signos y síntomas más comunes observados en pacientes con sobredosis de hidroclorotiazida son los causados por la depleción de electrolitos (hipopotasemia, hipocloremia, hiponatremia) y la deshidratación resultante de una diuresis excesiva. Si también se ha administrado digitálicos, la hipopotasemia puede acentuar las arritmias cardíacas. No se ha establecido el grado en que la hidroclorotiazida se elimina por hemodiálisis. La LD oral de hidroclorotiazida es superior a 10 g/kg tanto en ratones como en ratas.
CONTRAINDICACIONES
MICARDIS HCT está contraindicado:
- En pacientes hipersensibles a cualquiera de los componentes de este producto [ver ADVERTENCIAS Y PRECAUCIONES ].
- En pacientes con anuria.
- Para la coadministración con aliskiren en pacientes con diabetes [ver INTERACCIONES CON LA DROGAS ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
MICARDIS 40 mg HCT
MICARDIS 20 mg HCT es una combinación de dos fármacos con propiedades antihipertensivas: un diurético tiazídico, hidroclorotiazida, y un bloqueador del receptor de angiotensina II (ARB), telmisartán.
Telmisartán
La angiotensina II se forma a partir de la angiotensina I en una reacción catalizada por la enzima convertidora de angiotensina (ACE, cininasa II). La angiotensina II es el principal agente presor del sistema renina-angiotensina, con efectos que incluyen vasoconstricción, estimulación de la síntesis y liberación de aldosterona, estimulación cardíaca y reabsorción renal de sodio. Telmisartán bloquea los efectos vasoconstrictor y secretor de aldosterona de la angiotensina II mediante el bloqueo selectivo de la unión de la angiotensina II al receptor AT1 en muchos tejidos, como el músculo liso vascular y la glándula suprarrenal. Por tanto, su acción es independiente de las vías de síntesis de la angiotensina II.
También se encuentra un receptor AT2 en muchos tejidos, pero no se sabe que AT2 esté asociado con la homeostasis cardiovascular. Telmisartán tiene una afinidad mucho mayor (>3.000 veces) por el receptor AT1 que por el receptor AT2.
Telmisartán no inhibe la ECA (cininasa II) ni se une o bloquea otros receptores hormonales o canales iónicos que se sabe que son importantes en la regulación cardiovascular.
El bloqueo del receptor de angiotensina II inhibe la retroalimentación reguladora negativa de la angiotensina II sobre la secreción de renina, pero el aumento resultante de la actividad de la renina plasmática y los niveles circulantes de angiotensina II no superan el efecto de telmisartán sobre la presión arterial.
hidroclorotiazida
La hidroclorotiazida es un diurético tiazídico. Las tiazidas afectan los mecanismos tubulares renales de reabsorción de electrolitos, aumentando directamente la excreción de sal y cloruro de sodio en cantidades aproximadamente equivalentes. Indirectamente, la acción diurética de la hidroclorotiazida reduce el volumen plasmático, con el consiguiente aumento de la actividad de la renina plasmática, aumento de la secreción de aldosterona, aumento de la pérdida urinaria de potasio y disminución del potasio sérico. El enlace renina-aldosterona está mediado por la angiotensina II, por lo que la coadministración de un ARB tiende a revertir la pérdida de potasio asociada con estos diuréticos. El mecanismo del efecto antihipertensivo de las tiazidas no se comprende completamente.
Farmacodinámica
Telmisartán
En voluntarios normales, una dosis de 80 mg de telmisartán inhibió la respuesta presora a una infusión intravenosa de angiotensina II en aproximadamente un 90 % a las concentraciones plasmáticas máximas, con una inhibición persistente de aproximadamente un 40 % durante 24 horas.
La concentración plasmática de angiotensina II y la actividad de la renina plasmática aumentaron de forma dependiente de la dosis después de la administración única de telmisartán a sujetos sanos y la administración repetida a pacientes hipertensos. La administración una vez al día de hasta 80 mg de telmisartán a sujetos sanos no influyó en las concentraciones plasmáticas de aldosterona. En estudios de dosis múltiples con pacientes hipertensos, no hubo cambios clínicamente significativos en los electrolitos (potasio o sodio sérico) o en la función metabólica (incluidos los niveles séricos de colesterol, triglicéridos, HDL, LDL, glucosa o ácido úrico).
Los efectos antihipertensivos de telmisartán se han estudiado en seis ensayos clínicos controlados con placebo que incluyeron un total de 1773 pacientes con hipertensión leve a moderada (presión arterial diastólica de 95 a 114 mmHg), 1031 de los cuales fueron tratados con telmisartán. Después de la administración una vez al día de telmisartán, la magnitud de la reducción de la presión arterial desde el inicio después de la sustracción del placebo fue de aproximadamente (PAS/PAD) 6-8/6 mmHg para 20 mg, 9-13/6-8 mmHg para 40 mg y 12 -13/7-8 mmHg por 80 mg. Las dosis mayores (hasta 160 mg) no parecieron causar una mayor disminución de la presión arterial.
El inicio de la actividad antihipertensiva ocurre dentro de las 3 horas, con una reducción máxima de aproximadamente 4 semanas. A dosis de 20, 40 y 80 mg, el efecto antihipertensivo de la administración de telmisartán una vez al día se mantuvo durante todo el intervalo de dosis de 24 horas.
En 30 pacientes hipertensos con función renal normal tratados durante 8 semanas con 80 mg de telmisartán o 80 mg de telmisartán en combinación con 12,5 mg de hidroclorotiazida, no hubo cambios clínicamente significativos desde el inicio en el flujo sanguíneo renal, tasa de filtración glomerular, fracción de filtración, resistencia renovascular, o aclaramiento de creatinina.
hidroclorotiazida
Después de la administración oral de hidroclorotiazida, la diuresis comienza dentro de las 2 horas, alcanza su punto máximo en aproximadamente 4 horas y dura aproximadamente de 6 a 12 horas.
Interacciones con la drogas
hidroclorotiazida
Alcohol, barbitúricos o narcóticos
Puede producirse una potenciación de la hipotensión ortostática.
Relajantes del músculo esquelético
Posible aumento de la capacidad de respuesta a los relajantes musculares, como los derivados del curare.
Corticoides, ACTH
Depleción intensificada de electrolitos, particularmente hipopotasemia.
Aminas presoras (p. ej., norepinefrina)
Posible disminución de la respuesta a las aminas presoras, pero no suficiente para descartar su uso.
Farmacocinética
Telmisartán
Absorción:
Tras la administración oral, las concentraciones máximas (Cmax) de telmisartán se alcanzan entre 0,5 y 1 hora después de la administración. Los alimentos reducen ligeramente la biodisponibilidad de telmisartán, con una reducción del área bajo la curva de concentración plasmática-tiempo (AUC) de aproximadamente un 6 % con 40 mg y de aproximadamente un 20 % después de una dosis de 160 mg. MICARDIS 20 mg HCT puede administrarse con o sin alimentos. La biodisponibilidad absoluta de telmisartán depende de la dosis. A 40 y 160 mg, la biodisponibilidad fue del 42 % y el 58 %, respectivamente. La farmacocinética de telmisartán con MICARDIS 20 mg administrado por vía oral no es lineal en el rango de dosis de 20 a 160 mg, con aumentos mayores que proporcionales de las concentraciones plasmáticas (Cmax y AUC) con dosis crecientes. Telmisartán muestra una cinética de descomposición biexponencial con una vida media de eliminación terminal de aproximadamente 24 horas. Las concentraciones plasmáticas mínimas de telmisartán con dosis una vez al día son aproximadamente del 10% al 25% de las concentraciones plasmáticas máximas. Telmisartán tiene un índice de acumulación en plasma de 1,5 a 2,0 tras la administración repetida una vez al día.
Distribución:
Telmisartán se une en gran medida a las proteínas plasmáticas (>99,5%), principalmente a la albúmina y a la glucoproteína ácida α1. La unión a proteínas plasmáticas es constante en el rango de concentración alcanzado con las dosis recomendadas. El volumen de distribución de telmisartán es de aproximadamente 500 litros, lo que indica una unión tisular adicional.
Metabolismo:
Telmisartán se metaboliza por conjugación para formar un acilo glucurónido farmacológicamente inactivo; el glucurónido del compuesto original es el único metabolito que se ha identificado en el plasma y la orina humanos. Después de una sola dosis, el glucurónido representa aproximadamente el 11 % de la radiactividad medida en el plasma. Las isoenzimas del citocromo P450 no están implicadas en el metabolismo de telmisartán.
Eliminación:
Después de la administración intravenosa u oral de telmisartán marcado con 14C, la mayor parte de la dosis administrada (>97%) se eliminó sin cambios en las heces a través de la excreción biliar; solo se encontraron cantidades diminutas en la orina (0,91 % y 0,49 % de la radiactividad total, respectivamente).
El aclaramiento plasmático total de telmisartán es >800 ml/min. La semivida terminal y el aclaramiento total parecen ser independientes de la dosis.
hidroclorotiazida
La hidroclorotiazida no se metaboliza pero se elimina rápidamente por vía renal. Cuando se han seguido los niveles plasmáticos durante al menos 24 horas, se ha observado que la vida media plasmática varía entre 5,6 y 14,8 horas. Al menos el 61% de la dosis oral se elimina sin cambios dentro de las 24 horas.
La hidroclorotiazida atraviesa la barrera placentaria pero no la hematoencefálica y se excreta en la leche materna.
Poblaciones Específicas
Telmisartán
Insuficiencia renal
Telmisartán no se elimina de la sangre por hemofiltración [ver ADVERTENCIAS Y PRECAUCIONES , y Uso en poblaciones específicas ].
insuficiencia hepática
En pacientes con insuficiencia hepática, las concentraciones plasmáticas de telmisartán aumentan y la biodisponibilidad absoluta se aproxima al 100% [ver Uso en poblaciones específicas ].
Género
Las concentraciones plasmáticas de telmisartán son generalmente de 2 a 3 veces más altas en mujeres que en hombres. En ensayos clínicos, sin embargo, no se encontraron aumentos significativos en la respuesta de la presión arterial o en la incidencia de hipotensión ortostática en mujeres. No es necesario ajustar la dosis.
Pacientes geriátricos
La farmacocinética de telmisartán no difiere entre los ancianos y los menores de 65 años.
Estudios de interacción farmacológica
Telmisartán
Ramipril
La administración concomitante de 80 mg de telmisartán una vez al día y 10 mg de ramipril una vez al día a sujetos sanos aumenta la Cmax y el AUC de ramipril en estado estacionario en 2,3 y 2,1 veces, respectivamente, y la Cmax y el AUC de ramiprilato en 2,4 y 1,5 veces, respectivamente. . Por el contrario, la Cmax y el AUC de telmisartán disminuyen un 31 % y un 16 %, respectivamente. Cuando se coadministran telmisartán y ramipril, la respuesta puede ser mayor debido a los posibles efectos farmacodinámicos aditivos de los fármacos combinados y también a la mayor exposición a ramipril y ramiprilato en presencia de telmisartán.
Otras drogas
La coadministración de telmisartán no resultó en una interacción clínicamente significativa con paracetamol, amlodipina, gliburida, simvastatina, hidroclorotiazida, warfarina o ibuprofeno. Telmisartan no es metabolizado por el sistema del citocromo P450 y no tiene efectos in vitro sobre las enzimas del citocromo P450, excepto por alguna inhibición de CYP2C19. No se espera que telmisartan interactúe con medicamentos que inhiben las enzimas del citocromo P450; tampoco se espera que interactúe con fármacos metabolizados por las enzimas del citocromo P450, excepto por la posible inhibición del metabolismo de los fármacos metabolizados por CYP2C19.
Estudios clínicos
Telmisartán e hidroclorotiazida
En ensayos clínicos controlados con más de 2500 pacientes hipertensos, 1017 pacientes fueron expuestos a telmisartán (20 mg a 160 mg) e hidroclorotiazida concomitante (6,25 mg a 25 mg). Estos ensayos incluyeron un ensayo factorial (Estudio 1) con combinaciones de telmisartán (20 mg, 40 mg, 80 mg, 160 mg o placebo) e hidroclorotiazida (6,25 mg, 12,5 mg, 25 mg y placebo). El ensayo factorial asignó al azar a 818 pacientes, incluidos 493 (60 %) hombres; 596 (73%) no negros y 222 (27%) negros; y 143 (18%) ≥65 años (la mediana de edad fue 53 años). La presión arterial media en posición supina al inicio del estudio para la población total fue de 154/101 mmHg.
La combinación de telmisartán e hidroclorotiazida resultó en reducciones aditivas ajustadas con placebo en la presión arterial sistólica y diastólica en el punto mínimo de 16-21/9-11 mmHg para dosis entre 40 mg/12,5 mg y 80 mg/25 mg, en comparación con 9-13 /7-8 mmHg para telmisartán 40 mg a 80 mg en monoterapia y 4/4 mmHg para hidroclorotiazida 12,5 mg en monoterapia. El efecto antihipertensivo fue independiente de la edad o el género. Esencialmente, no hubo cambios en la frecuencia cardíaca en los pacientes tratados con la combinación de telmisartán e hidroclorotiazida en el ensayo controlado con placebo.
Otros cuatro estudios de pacientes hipertensos de al menos seis meses de duración permitieron agregar hidroclorotiazida a los pacientes que no estaban adecuadamente controlados con la dosis aleatoria de monoterapia de telmisartán o que no habían logrado una respuesta adecuada de la presión arterial después de completar la titulación ascendente de telmisartán. En estudios con control activo, la adición de 12,5 mg de hidroclorotiazida a dosis tituladas de telmisartán en pacientes que no alcanzaron o mantuvieron una respuesta adecuada con la monoterapia con telmisartán redujo aún más la presión arterial sistólica y diastólica.
INFORMACIÓN DEL PACIENTE
MICARDIS® HCT (my-CAR-dis HCT) (telmis artan e hidroclorotiazida) Comprimidos
Lea esta información para el paciente antes de comenzar a tomar las tabletas de MICARDIS HCT y cada vez que renueve su receta. Es posible que haya nueva información. Esta información no reemplaza la conversación con su médico sobre su condición médica o su tratamiento.
¿Cuál es la información más importante que debo saber sobre MICARDIS 20 mg HCT comprimidos?
MICARDIS HCT puede causar daño o la muerte al bebé nonato. Hable con su médico acerca de otras formas de reducir su presión arterial si planea quedar embarazada. Si queda embarazada mientras toma MICARDIS 20 mg HCT, informe a su médico de inmediato.
¿Qué es MICARDIS HCT?
MICARDIS 40 mg HCT es un medicamento recetado que se usa para tratar la presión arterial alta (hipertensión).
MICARDIS 40 mg HCT contiene:
- telmisartán, un bloqueador del receptor de angiotensina (ARB)
- hidroclorotiazida, una pastilla de agua o diurético
Su médico puede recetarle otros medicamentos para que los tome junto con MICARDIS 80 mg HCT para tratar su presión arterial alta.
No se sabe si MICARDIS 40 mg HCT es seguro y eficaz en niños.
No tome comprimidos de MICARDIS 20 mg HCT si:
- tiene poca o ninguna producción de orina
- es alérgico (hipersensible) a los principios activos (telmisartán o hidroclorotiazida) o a cualquiera de los demás componentes enumerados al final de este prospecto
¿Qué debo decirle a mi médico antes de usar MICARDIS 40 mg HCT comprimidos?
Antes de tomar comprimidos de MICARDIS 20 mg HCT, informe a su médico si:
- está embarazada o planea quedar embarazada. Ver “¿Cuál es la información más importante que debo saber sobre MICARDIS 20 mg HCT tabletas?”
- está amamantando o planea amamantar. MICARDIS 80 mg HCT puede pasar a la leche materna y dañar a su bebé. Usted y su médico deben decidir si tomará MICARDIS HCT o amamantará. Usted no debe hacer las dos cosas. Hable con su médico sobre la mejor forma de alimentar a su bebé si toma MICARDIS HCT comprimidos.
- le han dicho que tiene niveles anormales de sal corporal (electrolitos) en la sangre
- tiene problemas hepáticos
- tiene asma o antecedentes de asma
- tener lupus
- tener diabetes
- tiene problemas renales
- tiene otras condiciones médicas
Informe a su médico sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos herbales. Además, informe a su médico si bebe alcohol.
MICARDIS 20 mg HCT puede afectar la forma en que funcionan otros medicamentos, y otros medicamentos pueden afectar la forma en que funciona MICARDIS 20 mg HCT. Informe especialmente a su médico si toma:
- aliskirén
- digoxina (Lanoxin®)
- litio (Lithobid®, carbonato de litio, citrato de litio)
- otros medicamentos utilizados para tratar su presión arterial alta o un problema cardíaco
- pastillas de agua (diurético)
- aspirina u otros medicamentos antiinflamatorios no esteroideos (AINE)
- suplementos de potasio o un sustituto de la sal que contenga potasio
- medicamentos utilizados para tratar la diabetes, incluida la insulina
- analgésicos narcóticos
- pastillas para dormir
- medicamento esteroide u hormona adrenocorticotrófica (ACTH)
- barbitúricos
- ciertos medicamentos para reducir el colesterol (resinas que se usan para reducir el colesterol, por ejemplo, resinas de colestiramina y colestipol)
Pregúntele a su médico si no está seguro de si está tomando alguno de los medicamentos mencionados anteriormente.
Conozca los medicamentos que toma. Mantenga una lista de ellos y muéstresela a su médico o farmacéutico cuando obtenga un medicamento nuevo.
¿Cómo debo tomar los comprimidos de MICARDIS HCT?
- Tome los comprimidos de MICARDIS 40 mg HCT exactamente como le indique su médico.
- Su médico le dirá cuánto MICARDIS HCT debe tomar y cuándo tomarlo.
- No cambie su dosis a menos que su médico se lo indique.
- Tome MICARDIS HCT una vez al día.
- Tome los comprimidos de MICARDIS 20 mg HCT con o sin alimentos.
- Si toma demasiado MICARDIS HCT, llame a su médico o acuda de inmediato a la sala de emergencias del hospital más cercano.
- Leer el “Cómo abrir el blister” al final de este prospecto antes de usar MICARDIS 20 mg HCT. Hable con su médico si no entiende las instrucciones.
¿Cuáles son los posibles efectos secundarios de los comprimidos de MICARDIS 80 mg HCT?
Los comprimidos de 20 mg de MICARDIS HCT pueden causar efectos secundarios graves, que incluyen:
- Lesión o muerte de su bebé por nacer. Ver “¿Cuál es la información más importante que debo saber sobre las tabletas MICARDIS HCT?”
- Presión arterial baja (hipotensión) es más probable que suceda si usted también:
- tomar pastillas de agua (diuréticos)
- están en una dieta baja en sal
- obtener tratamientos de diálisis
- tener problemas del corazón
- enfermarse con vómitos o diarrea
- no bebe suficientes líquidos
- sudar mucho
- Problemas de riñon , que puede empeorar si ya tiene una enfermedad renal. Es posible que tenga cambios en los resultados de sus pruebas renales y que necesite una dosis más baja de tabletas de 40 mg de MICARDIS HCT. Llame a su médico si tiene:
- hinchazón en los pies, los tobillos o las manos
- aumento de peso inexplicable
- Problemas hepáticos, que puede empeorar en personas que ya tienen problemas hepáticos y toman MICARDIS 40 mg HCT.
- Problemas oculares. Uno de los medicamentos de MICARDIS HCT puede causar problemas oculares que pueden conducir a la pérdida de la visión. Los síntomas de los problemas oculares pueden ocurrir en cuestión de horas o semanas después de comenzar con MICARDIS.
HCT. Informe a su médico de inmediato si tiene:
- disminución de la visión
- dolor de ojo
- Reacciones alérgicas . Informe a su médico de inmediato si presenta alguno de estos síntomas:
- hinchazón de la cara, lengua, garganta
- respiración dificultosa
- Empeoramiento del lupus. Informe a su médico si su lupus empeora o se activa mientras toma MICARDIS 20 mg HCT.
- Cambio en el nivel de sales corporales (electrolitos) en la sangre y problemas con los líquidos. Su médico puede hacer pruebas para controlar su sangre. Llame a su médico de inmediato si tiene:
- boca seca
- sed
- cansancio
- somnolencia
- inquietud
- confusión
- convulsiones
- latidos rápidos
- debilidad
- dolor muscular o calambres
- diuresis muy baja
- náuseas o vómitos
Si se siente débil o mareado, acuéstese y llame a su médico de inmediato.
Llame a su médico de inmediato si presenta alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de los comprimidos de MICARDIS 80 mg HCT incluyen:
- infecciones del tracto respiratorio superior, incluyendo dolor/congestión de los senos paranasales y dolor de garganta
- mareo
- sensación de cansancio
- síntomas similares a la gripe
- dolor de espalda
- Diarrea
- náuseas
Estos no son todos los posibles efectos secundarios de los comprimidos de 20 mg de MICARDIS HCT. Informe a su médico si tiene algún efecto secundario que le moleste o que no desaparezca. Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo conservar los comprimidos de MICARDIS 80 mg HCT?
- Guarde las tabletas de MICARDIS HCT a temperatura ambiente de 68 °F a 77 °F (20 °C a 25 °C).
- No saque los comprimidos de MICARDIS 40 mg HCT de los blísteres hasta justo antes de tomarlos.
Mantenga los comprimidos de MICARDIS 80 mg HCT y todos los medicamentos fuera del alcance de los niños.
Información general sobre MICARDIS 40 mg HCT comprimidos:
A veces, los medicamentos se recetan para fines distintos a los enumerados en el folleto de información para el paciente. No use las tabletas de MICARDIS HCT para una condición para la cual no fue recetado. No le dé MICARDIS 20 mg comprimidos HCT a otras personas, incluso si tienen la misma afección que usted. Puede que les haga daño.
Este folleto de información para el paciente resume la información más importante sobre los comprimidos de MICARDIS HCT. Si desea obtener más información, hable con su médico. Puede pedirle a su farmacéutico o médico información sobre MICARDIS 20 mg HCT comprimidos que está escrito para profesionales de la salud.
Para obtener información de prescripción actual, escanee el código a continuación o llame a Boehringer Ingelheim Pharmaceuticals, Inc. al 1-800-542-6257 o (TTY) 1-800-459-9906.
¿Cuáles son los ingredientes de los comprimidos de MICARDIS 20 mg HCT?
Principios activos: telmisartán e hidroclorotiazida
Ingredientes inactivos: hidróxido de sodio, meglumina, povidona, sorbitol, estearato de magnesio, lactosa monohidrato, celulosa microcristalina, almidón de maíz y glicolato de almidón de sodio
Los comprimidos de 40 mg/12,5 mg y 80 mg/12,5 mg también contienen: óxido férrico rojo.
Los comprimidos de 80 mg/25 mg también contienen: óxido férrico amarillo.
¿Qué es la presión arterial alta (hipertensión)?
La presión arterial es la fuerza en sus vasos sanguíneos cuando su corazón late y cuando su corazón descansa. Tiene presión arterial alta cuando la fuerza es demasiado. Los medicamentos que reducen la presión arterial reducen la posibilidad de sufrir un accidente cerebrovascular o un ataque al corazón.
La presión arterial alta hace que el corazón trabaje más para bombear sangre a través del cuerpo y daña los vasos sanguíneos. Los comprimidos de MICARDIS 80 mg HCT pueden ayudar a que sus vasos sanguíneos se relajen para que su presión arterial sea más baja.
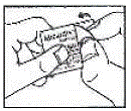
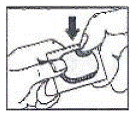
Cómo abrir el blíster:
Esta información para el paciente ha sido aprobada por la Administración de Drogas y Alimentos de los Estados Unidos.
