Nimotop 30mg Nimodipine Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Nimotop 30 mg y cómo se usa?
Nimotop es un medicamento recetado que se usa para tratar los síntomas del aneurisma (hemorragia subaracnoidea). Nimotop se puede usar solo o con otros medicamentos.
Nimotop pertenece a una clase de medicamentos llamados bloqueadores de los canales de calcio; Neurológicos, Otros; Bloqueadores de canales de calcio, dihidropiridina.
No se sabe si Nimotop 30 mg es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Nimotop?
Nimotop puede causar efectos secundarios graves que incluyen:
- urticaria,
- respiración dificultosa,
- hinchazón de la cara, los labios, la lengua o la garganta,
- aturdimiento,
- frecuencia cardíaca rápida o lenta, y
- hinchazón o sus tobillos o pies
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Nimotop incluyen:
- presión arterial baja (sentirse mareado),
- náuseas,
- dolor de barriga,
- latidos del corazón lentos, y
- dolor muscular
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Nimotop. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
NO ADMINISTRE NIMOTOP (nimodipino) POR VÍA INTRAVENOSA NI POR OTRAS VÍAS PARENTERALES. HAN OCURRIDO MUERTES Y EVENTOS ADVERSOS GRAVES QUE PONEN EN PELIGRO LA VIDA CUANDO EL CONTENIDO DE LAS CÁPSULAS DE NIMOTOP (nimodipino) SE HA INYECTADO POR VÍA PARENTERAL (consulte ADVERTENCIAS y DOSIS Y ADMINISTRACIÓN).
DESCRIPCIÓN
Nimotop® (nimodipina) pertenece a la clase de agentes farmacológicos conocidos como bloqueadores de los canales de calcio. La nimodipina es 2 - metoxietilo 1, 4 - dihidro - 2, 6 - dimetil - 4 - (m-nitrofenil) - 3, 5 - piridindicarboxilato de isopropilo. Tiene un peso molecular de 418,5 y una fórmula molecular de C21H26N2O7. La fórmula estructural es:
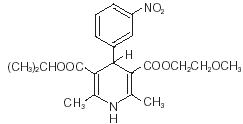
La nimodipina es una sustancia cristalina amarilla, prácticamente insoluble en agua.
Las cápsulas de NIMOTOP® (nimodipino) están formuladas como cápsulas de gelatina blanda para administración oral. Cada cápsula llena de líquido contiene 30 mg de nimodipino en un vehículo de glicerina, aceite de menta, agua purificada y polietilenglicol 400. La cubierta de la cápsula de gelatina blanda contiene gelatina, glicerina, agua purificada y dióxido de titanio.
INDICACIONES
Nimotop® (nimodipino) está indicado para mejorar el resultado neurológico al reducir la incidencia y la gravedad de los déficits isquémicos en pacientes con hemorragia subaracnoidea por rotura de aneurismas de bayas intracraneales, independientemente de su condición neurológica posterior al ictus (es decir, Grados IV de Hunt y Hess).
DOSIFICACIÓN Y ADMINISTRACIÓN
NO ADMINISTRA LAS CÁPSULAS DE NIMOTOP (nimodipina) POR VÍA INTRAVENOSA NI POR OTRAS VÍAS PARENTERALES (ver ADVERTENCIAS). Si Nimotop (nimodipina) se administra por vía intravenosa sin darse cuenta, la hipotensión clínicamente significativa puede requerir soporte cardiovascular con agentes presores. También se deben administrar de inmediato tratamientos específicos para la sobredosis de bloqueadores de los canales de calcio.
Nimotop (nimodipina) se administra por vía oral en forma de cápsulas de gelatina blanda de color marfil de 30 mg para la hemorragia subaracnoidea.
La dosis oral es de 60 mg (dos cápsulas de 30 mg) cada 4 horas durante 21 días consecutivos, preferiblemente no menos de una hora antes o dos horas después de las comidas. La terapia oral con Nimotop® (nimodipina) debe comenzar dentro de las 96 horas posteriores a la hemorragia subaracnoidea.
Si la cápsula no se puede tragar, por ejemplo, en el momento de la cirugía, o si el paciente está inconsciente, se debe perforar ambos extremos de la cápsula con una aguja de calibre 18 y extraer el contenido de la cápsula con una jeringa. Se puede utilizar una jeringa parenteral para extraer el líquido del interior de la cápsula, pero el líquido siempre debe transferirse a una jeringa que no admita una aguja y que esté diseñada para la administración por vía oral o mediante sonda nasogástrica o PEG. Para ayudar a minimizar los errores de administración, se recomienda que la jeringa utilizada para la administración esté etiquetada como "No para uso intravenoso". Luego, el contenido debe vaciarse en la sonda gástrica in situ del paciente y lavarse por la sonda con 30 ml de solución salina normal (0,9 %). La eficacia y seguridad de este método de administración no ha sido demostrada en ensayos clínicos.
Los pacientes con cirrosis hepática tienen un aclaramiento sustancialmente reducido y aproximadamente el doble de Cmax. La dosis debe reducirse a 30 mg cada 4 horas, con un control estricto de la presión arterial y la frecuencia cardíaca.
CÓMO SUMINISTRADO
Cada cápsula de gelatina blanda de NIMOTOP® (nimodipina) de color marfil tiene impresa la palabra Nimotop 30 mg y contiene 30 mg de nimodipina. Las cápsulas de 30 mg se envasan en bolsas de aluminio de dosis unitaria y se suministran en cajas que contienen 100 cápsulas. El producto también está disponible en bolsas de aluminio con paquete de seguridad de dosis unitaria a prueba de niños que contienen 30 cápsulas por caja. Las cápsulas deben almacenarse en el paquete de aluminio original del fabricante a 25 °C (77 °F), con variaciones permitidas de 15 a 30 °C (59 a 86 °F) [consulte Temperatura ambiente controlada por USP].
Las cápsulas deben protegerse de la luz y la congelación.
Distribuido por: Bayer Pharmaceuticals Corporation, 400 Morgan Lane, West Haven, CT 06516. Fabricado por: Catalent Pharma Solutions St. Petersburg, FL 33716. Fecha de revisión de la FDA: 20/1/2006EFECTOS SECUNDARIOS
Se informaron experiencias adversas en 92 de 823 pacientes con hemorragia subaracnoidea (11,2 %) que recibieron nimodipino. La experiencia adversa notificada con mayor frecuencia fue la disminución de la presión arterial en el 4,4 % de estos pacientes. Veintinueve de 479 (6,1%) pacientes tratados con placebo también informaron experiencias adversas. Los eventos informados con una frecuencia superior al 1% se muestran a continuación por dosis.
DOSIS q4h Número de pacientes (%) Nimodipino
No hubo otras experiencias adversas informadas por los pacientes que recibieron 0,35 mg/kg q4h, 30 mg q4h o 120 mg q4h. Las experiencias adversas con una tasa de incidencia de menos del 1% en el grupo de dosis de 60 mg q4h fueron: hepatitis; Comezón; hemorragia gastrointestinal; trombocitopenia; anemia; palpitaciones; vómitos; enrojecimiento; diaforesis; sibilancias; toxicidad por fenitoína; aturdimiento; mareo; vasoespasmo de rebote; ictericia; hipertensión; hematoma.
Las experiencias adversas con una tasa de incidencia inferior al 1% en el grupo de dosis de 90 mg q4h fueron: picazón, hemorragia gastrointestinal; trombocitopenia; deterioro neurológico; vómitos; diaforesis; insuficiencia cardíaca congestiva; hiponatremia; disminución del recuento de plaquetas; coagulación intravascular diseminada; La trombosis venosa profunda.
Como se puede ver en la tabla, los efectos secundarios que parecen estar relacionados con el uso de nimodipino en función de una mayor incidencia con dosis más altas o una tasa más alta en comparación con el control con placebo, incluyeron disminución de la presión arterial, edema y dolores de cabeza, que son acciones farmacológicas conocidas de los bloqueadores de los canales de calcio. Debe señalarse, sin embargo, que la HSA se acompaña frecuentemente de alteraciones de la conciencia que conducen a una infranotificación de experiencias adversas. Los pacientes que recibieron nimodipino en ensayos clínicos para otras indicaciones informaron sofocos (2,1 %), dolor de cabeza (4,1 %) y retención de líquidos (0,3 %), respuestas típicas a los bloqueadores de los canales de calcio. Como bloqueador de los canales de calcio, la nimodipina puede tener el potencial de exacerbar la insuficiencia cardíaca en pacientes susceptibles o de interferir con la conducción AV, pero estos eventos no se observaron.
No se han asociado causalmente efectos clínicamente significativos sobre los factores hematológicos, la función renal o hepática o el metabolismo de los carbohidratos con la nimodipina oral. Se han notificado casos aislados de niveles elevados de glucosa sérica sin ayunar (0,8 %), niveles elevados de LDH (0,4 %), recuentos reducidos de plaquetas (0,3 %), niveles elevados de fosfatasa alcalina (0,2 %) y niveles elevados de SGPT (0,2 %). poco frecuentemente.

Abuso y dependencia de drogas
No se han informado casos de abuso o dependencia de drogas con Nimotop® (nimodipino) .
INTERACCIONES CON LA DROGAS
Es posible que la acción cardiovascular de otros bloqueadores de los canales de calcio se mejore con la adición de Nimotop® (nimodipino) .
En Europa, se observó que Nimotop® (nimodipino) intensificaba ocasionalmente el efecto de los compuestos antihipertensivos tomados concomitantemente por pacientes que padecían hipertensión; este fenómeno no se observó en los ensayos clínicos norteamericanos.
Un estudio en ocho voluntarios sanos mostró un aumento del 50 % en las concentraciones plasmáticas máximas medias de nimodipina y un aumento del 90 % en el área media bajo la curva, después de un curso de una semana de cimetidina a 1000 mg/día y nimodipina a 90 mg/día. . Este efecto puede estar mediado por la inhibición conocida del citocromo P-450 hepático por parte de la cimetidina, que podría disminuir el metabolismo de primer paso de la nimodipina.
ADVERTENCIAS
MUERTE DEBIDO A LA ADMINISTRACIÓN INTRAVENOSA INADVERTIDA: NO ADMINISTRAR NIMOTOP (nimodipino) POR VÍA INTRAVENOSA NI POR OTRAS VÍAS PARENTERALES. SE HAN OCURRIDO MUERTES Y EVENTOS ADVERSOS GRAVES QUE AMENAZAN LA VIDA, INCLUYENDO PARO CARDÍACO, COLAPSO CARDIOVASCULAR, HIPOTENSIÓN Y BRADICARDIA, CUANDO EL CONTENIDO DE LAS CÁPSULAS DE NIMOTOP (nimodipino) SE HA INYECTADO POR VÍA PARENTERAL (VER DOSIS Y ADMINISTRACIÓN).
PRECAUCIONES
General: Presión arterial: La nimodipina tiene los efectos hemodinámicos esperados de un bloqueador de los canales de calcio, aunque generalmente no son marcados. Sin embargo, la administración intravenosa del contenido de las cápsulas de Nimotop (nimodipino) ha tenido consecuencias adversas graves, como muerte, paro cardíaco, colapso cardiovascular, hipotensión y bradicardia. En pacientes con hemorragia subaracnoidea que recibieron Nimotop® (nimodipina) en estudios clínicos, se informó que alrededor del 5 % tuvo una disminución de la presión arterial y alrededor del 1 % abandonó el estudio debido a esto (no todos pueden atribuirse a la nimodipina). Sin embargo, la presión arterial debe controlarse cuidadosamente durante el tratamiento con Nimotop® (nimodipino) en base a su farmacología conocida y los efectos conocidos de los bloqueadores de los canales de calcio. (ver ADVERTENCIAS y DOSIFICACIÓN Y ADMINISTRACIÓN )
Enfermedad hepática: El metabolismo de Nimotop® (nimodipino) está disminuido en pacientes con insuficiencia hepática. A estos pacientes se les debe controlar de cerca la presión arterial y el pulso y se les debe administrar una dosis más baja (ver DOSIFICACIÓN Y ADMINISTRACIÓN ).
Rara vez se han notificado seudoobstrucción intestinal e íleo en pacientes tratados con nimodipina. Una relación casual no ha sido establecida. La condición ha respondido al manejo conservador.
Interacciones de pruebas de laboratorio: Ninguno conocido.
Carcinogénesis, mutagénesis, deterioro de la fertilidad: En un estudio de dos años, se observaron mayores incidencias de adenocarcinoma de útero y adenoma de células de Leydig de los testículos en ratas que recibieron una dieta que contenía 1800 ppm de nimodipina (equivalente a 91 a 121 mg/kg/día de nimodipina) que en los controles con placebo. . Sin embargo, las diferencias no fueron estadísticamente significativas y las tasas más altas estuvieron dentro del rango de control histórico para estos tumores en la cepa Wistar.
Se encontró que la nimodipina no es cancerígena en un estudio con ratones de 91 semanas, pero la dosis alta de 1800 ppm de nimodipina en el alimento (546 a 774 mg/kg/día) acortó la esperanza de vida de los animales. Los estudios de mutagenicidad, incluidas las pruebas de Ames, micronúcleo y letalidad dominante, fueron negativos. La nimodipina no afectó la fertilidad y el rendimiento reproductivo general de ratas Wistar macho y hembra después de dosis orales de hasta 30 mg/kg/día cuando se administró diariamente durante más de 10 semanas en los machos y 3 semanas en las hembras antes del apareamiento y continuó al día 7 de embarazo. Esta dosis en una rata es aproximadamente 4 veces la dosis clínica equivalente de 60 mg q4h en un paciente de 50 kg.
El embarazo: Embarazo Categoría C. Se ha demostrado que la nimodipina tiene un efecto teratogénico en conejos del Himalaya. La incidencia de malformaciones y fetos atrofiados aumentó con dosis orales de 1 y 10 mg/kg/día administradas (por sonda) desde el día 6 hasta el día 18 del embarazo, pero no con 3,0 mg/kg/día en uno de dos estudios idénticos en conejos. En el segundo estudio se observó una mayor incidencia de fetos atrofiados con 1,0 mg/kg/día, pero no con dosis más altas. La nimodipina fue embriotóxica, causando reabsorción y retraso en el crecimiento de los fetos, en ratas Long Evans a 100 mg/kg/día administrados por sonda desde el día 6 hasta el día 15 del embarazo. En otros dos estudios con ratas, las dosis de 30 mg/kg/día de nimodipino administradas por sonda desde el día 16 de gestación y continuadas hasta el sacrificio (día 20 de embarazo o día 21 posparto) se asociaron con mayores incidencias de variación esquelética, fetos atrofiados y mortinatos pero sin malformaciones. No existen estudios adecuados y bien controlados en mujeres embarazadas para evaluar directamente el efecto en los fetos humanos. La nimodipina debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto.
Madres lactantes: Se ha demostrado que la nimodipina y/o sus metabolitos aparecen en la leche de rata en concentraciones mucho más altas que en el plasma materno. No se sabe si el fármaco se excreta en la leche humana. Debido a que muchas drogas se excretan en la leche humana, se recomienda a las madres lactantes que no amamanten a sus bebés mientras toman la droga.
Uso pediátrico: No se ha establecido la seguridad y eficacia en niños.
Uso geriátrico: Los estudios clínicos de nimodipina no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes. Otra experiencia clínica informada no ha identificado diferencias en las respuestas entre los ancianos y los pacientes más jóvenes. En general, la dosificación en pacientes de edad avanzada debe ser cautelosa, reflejando la mayor frecuencia de disminución de la función hepática, renal o cardíaca, y de enfermedades concomitantes u otra terapia con medicamentos.
SOBREDOSIS
No ha habido informes de sobredosis por la administración oral de Nimotop® (nimodipina). Se esperaría que los síntomas de sobredosis estuvieran relacionados con efectos cardiovasculares tales como vasodilatación periférica excesiva con hipotensión sistémica marcada. La hipotensión clínicamente significativa debida a una sobredosis de Nimotop® (nimodipina) puede requerir soporte cardiovascular activo con agentes presores. También se deben administrar de inmediato tratamientos específicos para la sobredosis de bloqueadores de los canales de calcio. Dado que Nimotop® (nimodipina) se une en gran medida a las proteínas, es poco probable que la diálisis sea beneficiosa.
CONTRAINDICACIONES
Ninguno conocido.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción: La nimodipina es un bloqueador de los canales de calcio. Los procesos contráctiles de las células del músculo liso dependen de los iones de calcio, que entran en estas células durante la despolarización como corrientes transmembrana iónicas lentas. La nimodipina inhibe la transferencia de iones de calcio a estas células y, por lo tanto, inhibe las contracciones del músculo liso vascular. En experimentos con animales, la nimodipina tuvo un efecto mayor en las arterias cerebrales que en las arterias de otras partes del cuerpo, quizás porque es altamente lipofílica, lo que le permite cruzar la barrera hematoencefálica; Se han detectado concentraciones de nimodipino de hasta 12,5 ng/ml en el líquido cefalorraquídeo de pacientes con hemorragia subaracnoidea (HSA) tratados con nimodipino. Se desconoce el mecanismo preciso de acción de la nimodipina en humanos. Aunque los estudios clínicos que se describen a continuación demuestran un efecto favorable de la nimodipina sobre la gravedad de los déficits neurológicos causados por el vasoespasmo cerebral después de la HSA, no hay evidencia arteriográfica de que el fármaco prevenga o alivie el espasmo de estas arterias. Sin embargo, se desconoce si la metodología arteriográfica utilizada fue adecuada para detectar un efecto clínicamente significativo, si lo hubo, sobre el vasoespasmo.
Farmacocinética y Metabolismo: En el hombre, la nimodipina se absorbe rápidamente después de la administración oral y las concentraciones máximas generalmente se alcanzan en una hora. La vida media de eliminación terminal es de aproximadamente 8 a 9 horas, pero las tasas de eliminación más tempranas son mucho más rápidas, equivalentes a una vida media de 1 a 2 horas; una consecuencia es la necesidad de dosificación frecuente (cada 4 horas). No hubo signos de acumulación cuando se administró nimodipino tres veces al día durante siete días. Más del 95% de la nimodipina se une a las proteínas plasmáticas. La unión fue independiente de la concentración en el rango de 10 ng/mL a 10 µg/mL. La nimodipina se elimina casi exclusivamente en forma de metabolitos y menos del 1% se recupera en la orina como fármaco inalterado. Se han identificado numerosos metabolitos, todos los cuales son inactivos o considerablemente menos activos que el compuesto original. Debido a un alto metabolismo de primer paso, la biodisponibilidad de la nimodipina promedia el 13 % después de la administración oral. La biodisponibilidad aumenta significativamente en pacientes con cirrosis hepática, con una Cmax de aproximadamente el doble que en pacientes normales, lo que obliga a reducir la dosis en este grupo de pacientes (ver DOSIFICACIÓN Y ADMINISTRACIÓN ). En un estudio de 24 voluntarios varones sanos, la administración de cápsulas de nimodipina después de un desayuno estándar dio como resultado una concentración plasmática máxima un 68 % más baja y una biodisponibilidad un 38 % más baja en relación con la dosificación en ayunas.
En un único estudio de grupos paralelos en el que participaron 24 sujetos de edad avanzada (de 59 a 79 años de edad) y 24 sujetos más jóvenes (de 22 a 40 años de edad), el AUC y la Cmax de nimodipino observados fueron aproximadamente 2 veces mayores en la población de edad avanzada en comparación con el estudio más joven. sujetos después de la administración oral (administrada como una dosis única de 30 mg y dosificada al estado estacionario con 30 mg tres veces al día durante 6 días). Sin embargo, la respuesta clínica a estas diferencias farmacocinéticas relacionadas con la edad no se consideró significativa. (Ver PRECAUCIONES : Uso geriátrico.)
Ensayos clínicos: Se ha demostrado que la nimodipina, en 4 ensayos aleatorizados, doble ciego, controlados con placebo, reduce la gravedad de los déficits neurológicos resultantes del vasoespasmo en pacientes que han tenido una hemorragia subaracnoidea (HSA) reciente. Los ensayos utilizaron dosis que oscilaron entre 20 y 30 mg y 90 mg cada 4 horas, con el fármaco administrado durante 21 días en 3 estudios y durante al menos 18 días en el otro. Tres de los cuatro ensayos siguieron a los pacientes durante 3 a 6 meses. Tres de los ensayos estudiaron pacientes relativamente bien, con todos o la mayoría de los pacientes en Grados I - III de Hunt y Hess (esencialmente libres de déficits focales después del sangrado inicial) el cuarto estudió pacientes mucho más enfermos, Grados III - V de Hunt y Hess. Dos estudios , uno estadounidense, uno francés, tenían un diseño similar, con pacientes con HSA relativamente intactos asignados al azar a nimodipina o placebo. En cada uno, se juzgó si algún déficit de desarrollo tardío se debía a espasmos u otras causas, y se calificaron los déficits. Ambos estudios mostraron significativamente menos déficit severos debido a espasmos en el grupo de nimodipino; el segundo estudio (francés) mostró menos déficits relacionados con espasmos de todos los grados. No se observó ningún efecto sobre los déficits no relacionados con el espasmo.
Un tercer estudio grande se realizó en el Reino Unido en pacientes con HSA de todos los grados de gravedad (pero el 89 % estaban en los grados I-III). La nimodipina se dosificó en dosis de 60 mg cada 4 horas. Los resultados no se definieron como relacionados con espasmos o no, pero hubo una reducción significativa en la tasa general de infarto y resultado neurológico severamente incapacitante a los 3 meses:
Un estudio canadiense ingresó a pacientes mucho más enfermos (grados III-V de Hunt y Hess), que tenían una alta tasa de muerte y discapacidad, y usó una dosis de 90 mg cada 4 horas, pero por lo demás fue similar a los dos primeros estudios. El análisis de los déficits isquémicos tardíos, muchos de los cuales resultan de espasmos, mostró una reducción significativa en los déficits relacionados con espasmos. Entre los pacientes analizados (72 nimodipino, 82 placebo), hubo los siguientes resultados.
Cuando se combinaron los datos de los estudios de Canadá y el Reino Unido, la diferencia del tratamiento en la tasa de éxito (es decir, buena recuperación) en la escala de resultados de Glasgow fue del 25,3 % (nimodipino) frente al 10,9 % (placebo) para los grados IV o V de Hunt y Hess. La siguiente tabla demuestra que la nimodipina tiende a mejorar la buena recuperación de los pacientes con HSA con un estado neurológico deficiente después del ictus, al tiempo que disminuye los números con discapacidad grave y supervivencia vegetativa.
Un estudio de rango de dosis que comparó dosis de 30, 60 y 90 mg encontró una tasa generalmente baja de déficits neurológicos relacionados con espasmos, pero no una relación dosis-respuesta.
INFORMACIÓN DEL PACIENTE
No se proporcionó información. por favor refiérase a ADVERTENCIAS y PRECAUCIONES secciones.
