Plavix 75mg Clopidogrel Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Plavix 75 mg y cómo se usa?
Plavix 75 mg es un medicamento recetado que se usa para tratar los síntomas del síndrome coronario agudo, como un derrame cerebral, un coágulo de sangre o un problema cardíaco grave después de un ataque cardíaco, dolor torácico intenso o problemas de circulación. Plavix 75mg puede usarse solo o con otros medicamentos.
Plavix 75mg pertenece a una clase de medicamentos llamados agentes antiplaquetarios, cardiovasculares, agentes antiplaquetarios, hematológicos.
No se sabe si Plavix es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Plavix 75 mg?
Plavix 75mg puede causar efectos secundarios graves, que incluyen:
- piel pálida,
- moretones con facilidad,
- manchas moradas debajo de la piel o en la boca,
- coloración amarillenta de la piel o los ojos (ictericia),
- latidos rápidos del corazón,
- dificultad para respirar,
- dolor de cabeza,
- fiebre,
- debilidad,
- sensación de cansancio,
- orinar poco o nada,
- convulsiones (convulsiones),
- entumecimiento o debilidad repentina,
- confusión, y
- problemas con la visión o el habla
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Plavix incluyen:
- aumento del sangrado,
- hemorragias nasales,
- dolores de cabeza,
- picazón, y
- hematomas
ADVERTENCIA
EFECTO ANTIPLAQUETARIO DISMINUIDO EN PACIENTES CON DOS ALELOS DE PÉRDIDA DE FUNCIÓN DEL GEN CYP2C19
La eficacia de Plavix 75 mg resulta de su actividad antiplaquetaria, que depende de su conversión en un metabolito activo por el sistema del citocromo P450 (CYP), principalmente CYP2C19 [ver ADVERTENCIAS Y PRECAUCIONES , FARMACOLOGÍA CLÍNICA ]. Plavix a las dosis recomendadas forma menos metabolito activo y, por lo tanto, tiene un efecto reducido sobre la actividad plaquetaria en pacientes que son homocigotos para los alelos no funcionales del gen CYP2C19 (denominados "metabolizadores lentos de CYP2C19"). Hay pruebas disponibles para identificar a los pacientes que son metabolizadores lentos de CYP2C19 [ver FARMACOLOGÍA CLÍNICA ]. Considere el uso de otro inhibidor de plaquetas P2Y12 en pacientes identificados como metabolizadores lentos de CYP2C19.
DESCRIPCIÓN
Plavix (bisulfato de clopidogrel) es un inhibidor de la clase de las tienopiridinas de los receptores plaquetarios P2Y12 ADP. Químicamente es sulfato de metilo (+)-(S)-α-(2-clorofenil)-6,7-dihidrotieno[3,2-c]piridin-5(4H)-acetato (1:1). La fórmula empírica del bisulfato de clopidogrel es C16H16ClNO2S•H2SO4 y su peso molecular es 419,9. La fórmula estructural es la siguiente:

El bisulfato de clopidogrel es un polvo de color blanco a blanquecino. Es prácticamente insoluble en agua a pH neutro pero fácilmente soluble a pH 1. También se disuelve libremente en metanol, se disuelve moderadamente en cloruro de metileno y es prácticamente insoluble en éter etílico. Tiene una rotación óptica específica de alrededor de +56°.
Plavix para administración oral se presenta en forma de comprimidos recubiertos con película grabados, redondos, biconvexos, rosados, que contienen 97,875 mg de bisulfato de clopidogrel, que es el equivalente molar de 75 mg de clopidogrel base, o comprimidos recubiertos con película grabados, oblongos, rosados, que contienen 391,5 mg. de bisulfato de clopidogrel que es el equivalente molar de 300 mg de clopidogrel base.
Cada tableta contiene aceite de ricino hidrogenado, hidroxipropilcelulosa, manitol, celulosa microcristalina y polietilenglicol 6000 como ingredientes inactivos. El recubrimiento de película rosa contiene óxido férrico, hipromelosa 2910, monohidrato de lactosa, dióxido de titanio y triacetina. Las tabletas están pulidas con cera de Carnauba.
INDICACIONES
Síndrome Coronario Agudo (SCA)
- Plavix 75 mg está indicado para reducir la tasa de infarto de miocardio (IM) y accidente cerebrovascular en pacientes con SCA sin elevación del segmento ST (angina inestable [AI]/infarto de miocardio sin elevación del ST [NSTEMI]), incluidos pacientes que van a ser manejados médicamente y aquellos que van a ser manejados con revascularización coronaria. Plavix 75 mg debe administrarse junto con aspirina.
- Plavix está indicado para reducir la tasa de infarto de miocardio y accidente cerebrovascular en pacientes con infarto agudo de miocardio con elevación del segmento ST (IAMCEST) que deben recibir tratamiento médico. Plavix 75 mg debe administrarse junto con aspirina.
IM reciente, accidente cerebrovascular reciente o enfermedad arterial periférica establecida
En pacientes con enfermedad arterial periférica establecida o con antecedentes de infarto de miocardio (IM) reciente o accidente cerebrovascular reciente, Plavix 75 mg está indicado para reducir la tasa de infarto de miocardio y accidente cerebrovascular.
DOSIFICACIÓN Y ADMINISTRACIÓN
El síndrome coronario agudo
En pacientes que necesitan un efecto antiplaquetario en cuestión de horas, inicie Plavix con una dosis de carga oral única de 300 mg y luego continúe con 75 mg una vez al día. Iniciar Plavix 75 mg sin una dosis de carga retrasará varios días el establecimiento de un efecto antiplaquetario [ver FARMACOLOGÍA CLÍNICA y Estudios clínicos ].
IM reciente, accidente cerebrovascular reciente o enfermedad arterial periférica establecida
75 mg una vez al día por vía oral sin una dosis de carga [ver FARMACOLOGÍA CLÍNICA y Estudios clínicos ].
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
- Comprimidos de 75 mg: Comprimidos recubiertos con película de color rosa, redondos, biconvexos, grabados con “75” en una cara y “1171” en la otra.
- Comprimidos de 300 mg: Comprimidos recubiertos con película, oblongos, de color rosa, grabados con “300” en una cara y “1332” en la otra.
Almacenamiento y manipulación
Plavix (bisulfato de clopidogrel) 75 mg Los comprimidos están disponibles en forma de comprimidos recubiertos con película de color rosa, redondos, biconvexos, grabados con “75” en una cara y “1171” en la otra. Las tabletas se proporcionan de la siguiente manera:
CDN 63653-1171-6 Botellas de 30 CDN 63653-1171-1 Botellas de 90 CDN 63653-1171-5 Botellas de 500 CDN 63653-1171-3 Blísteres de 100
Plavix (bisulfato de clopidogrel) 300 mg Los comprimidos están disponibles en forma de comprimidos recubiertos con película de color rosa, oblongos, grabados con “300” en una cara y “1332” en la otra. Las tabletas se proporcionan de la siguiente manera:
CDN 63653-1332-2 Envases monodosis de 30
Almacenar a 25°C (77°F); excursiones permitidas a 15°C-30°C (59°F-86°F) [ver Temperatura ambiente controlada por USP ].
Distribuido por: Bristol-Myers Squibb/Sanofi Pharmaceuticals Partnership, Bridgewater, NJ 08807. Revisado: marzo de 2021
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas graves se analizan a continuación y en otras partes de la etiqueta:
- Sangrado [ver ADVERTENCIAS Y PRECAUCIONES ]
- Púrpura trombocitopénica trombótica [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo bajo condiciones y duraciones de seguimiento muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Se evaluó la seguridad de Plavix en más de 54 000 pacientes, incluidos más de 21 000 pacientes tratados durante un año o más. Las reacciones adversas clínicamente importantes observadas en los ensayos que compararon Plavix 75 mg más aspirina con placebo más aspirina y los ensayos que compararon Plavix solo con aspirina sola se analizan a continuación.
Sangrado
CURAR
En CURE, el uso de Plavix con aspirina se asoció con un aumento del sangrado mayor (principalmente gastrointestinal y en los sitios de punción) en comparación con el placebo con aspirina (consulte la Tabla 1). La incidencia de hemorragia intracraneal (0,1%) y hemorragia fatal (0,2%) fue la misma en ambos grupos. Otros eventos hemorrágicos que se informaron con mayor frecuencia en el grupo de clopidogrel fueron epistaxis, hematuria y hematomas.
La incidencia global de hemorragia se describe en la Tabla 1.
COMPROMETERSE
En COMMIT, se observaron tasas similares de sangrado mayor en los grupos de Plavix de 75 mg y de placebo, los cuales también recibieron aspirina (consulte la Tabla 2).
CAPRIE (Plavix vs Aspirina)
En CAPRIE, la hemorragia gastrointestinal ocurrió a una tasa del 2,0 % en los que tomaron Plavix 75 mg frente al 2,7 % en los que tomaron aspirina; el sangrado que requirió hospitalización ocurrió en 0,7% y 1,1%, respectivamente. La incidencia de hemorragia intracraneal fue del 0,4 % para Plavix en comparación con el 0,5 % para la aspirina.
Otros eventos hemorrágicos que se informaron con mayor frecuencia en el grupo de Plavix 75 mg fueron epistaxis y hematoma.
Otros eventos adversos
En CURE y CHARISMA, que compararon Plavix más aspirina con aspirina sola, no hubo diferencia en la tasa de eventos adversos (aparte del sangrado) entre Plavix y el placebo.
En CAPRIE, que comparó Plavix 75 mg con aspirina, se notificó prurito con mayor frecuencia en quienes tomaban Plavix. No se informaron otras diferencias en la tasa de eventos adversos (aparte de la hemorragia).
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de Plavix. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño desconocido, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Se han informado hemorragias, incluidas aquellas con desenlace fatal, en pacientes tratados con Plavix.
- Trastornos de la sangre y del sistema linfático: Agranulocitosis, anemia aplásica/pancitopenia, púrpura trombocitopénica trombótica (PTT), hemofilia A adquirida
- Desórdenes gastrointestinales: Colitis (incluyendo colitis ulcerosa o linfocítica), pancreatitis, estomatitis, úlcera gástrica/duodenal, diarrea
- Trastornos generales y condiciones en el lugar de administración: Fiebre
- Trastornos hepatobiliares: Insuficiencia hepática aguda, hepatitis (no infecciosa), prueba de función hepática anormal
- Trastornos del sistema inmunológico: Reacciones de hipersensibilidad, reacciones anafilactoides, enfermedad del suero, síndrome autoinmune a la insulina, que puede provocar hipoglucemia grave
- Trastornos musculoesqueléticos, del tejido conjuntivo y óseos: Mialgia, artralgia, artritis
- Trastornos del sistema nervioso: Trastornos del gusto, cefalea, ageusia
- Desórdenes psiquiátricos: Confusión, alucinaciones.
- Trastornos respiratorios, torácicos y mediastínicos: Broncoespasmo, neumonitis intersticial, neumonía eosinofílica
- Trastornos renales y urinarios: Aumento de los niveles de creatinina
- Trastornos de la piel y del tejido subcutáneo: Erupción maculopapular, eritematosa o exfoliativa, urticaria, dermatitis ampollosa, eccema, necrólisis epidérmica tóxica, síndrome de Stevens-Johnson, pustulosis exantemática aguda generalizada (PEAG), angioedema, síndrome de hipersensibilidad inducida por fármacos, erupción por fármacos con eosinofilia y síntomas sistémicos (DRESS), eritema multiforme, liquen plano, prurito generalizado
- Trastornos vasculares: Vasculitis, hipotensión
INTERACCIONES CON LA DROGAS
Inductores CYP2C19
Dado que el clopidogrel se metaboliza a su metabolito activo en parte por CYP2C19, se esperaría que el uso de fármacos que inducen la actividad de esta enzima produzca un aumento de los niveles del metabolito activo de clopidogrel.
La rifampicina induce fuertemente al CYP2C19, lo que resulta tanto en un aumento del nivel del metabolito activo de clopidogrel como en la inhibición plaquetaria, lo que en particular podría potenciar el riesgo de hemorragia. Como precaución, evite el uso concomitante de inductores potentes de CYP2C19 [ver ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ].
Inhibidores de CYP2C19
Clopidogrel se metaboliza a su metabolito activo en parte por CYP2C19. El uso concomitante de fármacos que inhiben la actividad de esta enzima produce una reducción de las concentraciones plasmáticas del metabolito activo de clopidogrel y una reducción de la inhibición plaquetaria [ver ADVERTENCIAS Y PRECAUCIONES ].
Omeprazol O Esomeprazol
Evite el uso concomitante de Plavix 75 mg con omeprazol o esomeprazol. En estudios clínicos, se demostró que el omeprazol reduce significativamente la actividad antiplaquetaria de Plavix 75 mg cuando se administra de forma concomitante o con 12 horas de diferencia. Se observó una reducción similar en la actividad antiplaquetaria con esomeprazol cuando se administró concomitantemente con Plavix. El dexlansoprazol, lansoprazol y pantoprazol tuvieron menos efecto sobre la actividad antiplaquetaria de Plavix que el omeprazol o el esomeprazol [ver ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ].
opioides
Al igual que con otros inhibidores orales de P2Y12, la coadministración de agonistas opioides retrasa y reduce la absorción de clopidogrel, presumiblemente debido a la lentitud del vaciamiento gástrico, lo que reduce la exposición a sus metabolitos [ver FARMACOLOGÍA CLÍNICA ]. Considere el uso de un agente antiplaquetario parenteral en pacientes con síndrome coronario agudo que requieran la administración conjunta de morfina u otros agonistas opioides.
Medicamentos antiinflamatorios no esteroideos (AINE)
La coadministración de Plavix 75 mg y AINE aumenta el riesgo de hemorragia gastrointestinal.
Warfarina (sustratos CYP2C9)
Aunque la administración de 75 mg de clopidogrel por día no modificó la farmacocinética de la S-warfarina (un sustrato de CYP2C9) o el INR en pacientes que reciben tratamiento prolongado con warfarina, la administración concomitante de Plavix 75 mg con warfarina aumenta el riesgo de hemorragia debido a efectos independientes sobre hemostasia
Sin embargo, a altas concentraciones in vitro, el clopidogrel inhibe el CYP2C9.
ISRS y IRSN
Dado que los inhibidores selectivos de la recaptación de serotonina (ISRS) y los inhibidores de la recaptación de serotonina y norepinefrina (IRSN) afectan la activación plaquetaria, la administración concomitante de ISRS e IRSN con clopidogrel puede aumentar el riesgo de hemorragia.
Repaglinida (sustratos CYP2C8)
El metabolito acil-β-glucurónido de clopidogrel es un potente inhibidor de CYP2C8. Plavix 75 mg puede aumentar la exposición sistémica a fármacos que son eliminados principalmente por CYP2C8, por lo que es necesario ajustar la dosis y controlar adecuadamente.
Plavix aumentó la exposición a repaglinida entre 3,9 y 5,1 veces [ver FARMACOLOGÍA CLÍNICA ]. Evite el uso concomitante de repaglinida con Plavix. Si no se puede evitar el uso concomitante, inicie repaglinida a 0,5 mg antes de cada comida y no exceda la dosis diaria total de 4 mg. Puede ser necesaria una mayor frecuencia de control de la glucosa durante el uso concomitante.
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Actividad antiplaquetaria disminuida en pacientes con función alterada de CYP2C19
El clopidogrel es un profármaco. La inhibición de la agregación plaquetaria por clopidogrel se logra a través de un metabolito activo. El metabolismo de clopidogrel a su metabolito activo puede verse afectado por variaciones genéticas en CYP2C19 [ver ADVERTENCIA EN CAJA ].
El metabolismo de clopidogrel también puede verse afectado por fármacos que inhiben CYP2C19, como omeprazol o esomeprazol. Evite el uso concomitante de Plavix con omeprazol o esomeprazol porque ambos reducen significativamente la actividad antiplaquetaria de Plavix [ver INTERACCIONES CON LA DROGAS ].
Riesgo general de sangrado
Los inhibidores de P2Y12 (tienopiridinas), incluido Plavix, aumentan el riesgo de hemorragia.
Los inhibidores de P2Y12 (tienopiridinas) inhiben la agregación plaquetaria durante la vida útil de la plaqueta (7-10 días). Debido a que la vida media del metabolito activo de clopidogrel es corta, es posible restaurar la hemostasia mediante la administración de plaquetas exógenas; sin embargo, las transfusiones de plaquetas dentro de las 4 horas de la dosis de carga o 2 horas de la dosis de mantenimiento pueden ser menos efectivas.
Se esperaría que el uso de fármacos que inducen la actividad de CYP2C19 produzca un aumento de los niveles del metabolito activo de clopidogrel y podría potenciar el riesgo de hemorragia. Como precaución, evite el uso concomitante de inductores potentes de CYP2C19 [ver INTERACCIONES CON LA DROGAS y FARMACOLOGÍA CLÍNICA ].
Suspensión de Plavix
La interrupción de Plavix aumenta el riesgo de eventos cardiovasculares. Si Plavix debe interrumpirse temporalmente (p. ej., para tratar una hemorragia o para una cirugía con un riesgo importante de hemorragia), reinícielo lo antes posible. Cuando sea posible, interrumpa la terapia con Plavix durante cinco días antes de dicha cirugía. Reanude Plavix 75 mg tan pronto como se logre la hemostasia.
Púrpura trombocitopénica trombótica (PTT)
Se ha informado TTP, a veces fatal, después del uso de Plavix 75 mg, a veces después de una exposición corta ( REACCIONES ADVERSAS ].
Reactividad cruzada entre tienopiridinas
Se ha informado hipersensibilidad que incluye erupción cutánea, angioedema o reacción hematológica en pacientes que reciben Plavix 75 mg, incluidos pacientes con antecedentes de hipersensibilidad o reacción hematológica a otras tienopiridinas [ver CONTRAINDICACIONES y REACCIONES ADVERSAS ].
Información de asesoramiento para pacientes
Aconseje a los pacientes que lean las etiquetas para pacientes aprobadas por la FDA ( Guía de medicamentos ).
Discontinuación
Aconseje a los pacientes que no descontinúen Plavix sin consultarlo primero con el proveedor de atención médica que lo recetó [ver ADVERTENCIAS Y PRECAUCIONES ].
Sangrado
Aconseje a los pacientes que ellos:
- tendrá moretones y sangrará más fácilmente
- tomará más tiempo de lo normal para detener el sangrado
- debe informar cualquier sangrado imprevisto, prolongado o excesivo, o sangre en sus heces u orina [ver ADVERTENCIAS Y PRECAUCIONES ]
Púrpura trombocitopénica trombótica
Indique a los pacientes que obtengan atención médica inmediata si experimentan síntomas de PTT que no pueden explicarse de otro modo [ver ADVERTENCIAS Y PRECAUCIONES ].
Procedimientos invasivos
Aconseje a los pacientes que informen a los médicos y dentistas que están tomando Plavix antes de cualquier cirugía o procedimiento dental [ver ADVERTENCIAS Y PRECAUCIONES ].
Inhibidores de la bomba de protones
Aconseje a los pacientes que no tomen omeprazol o esomeprazol mientras toman Plavix. El dexlansoprazol, lansoprazol y pantoprazol tuvieron efectos menos pronunciados sobre la actividad antiplaquetaria de Plavix 75 mg que el omeprazol o el esomeprazol [ver INTERACCIONES CON LA DROGAS ].
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
No hubo evidencia de tumorigenicidad cuando se administró clopidogrel durante 78 semanas a ratones y 104 semanas a ratas en dosis de hasta 77 mg/kg por día, lo que produjo exposiciones plasmáticas >25 veces mayores que en humanos con la dosis diaria recomendada de 75 mg.
Clopidogrel no fue genotóxico en cuatro pruebas in vitro (prueba de Ames, prueba de reparación de ADN en hepatocitos de rata, ensayo de mutación genética en fibroblastos de hámster chino y análisis cromosómico en metafase de linfocitos humanos) y en una prueba in vivo (prueba de micronúcleos por vía oral en ratones).
Se encontró que el clopidogrel no tiene efecto sobre la fertilidad de ratas macho y hembra tratadas antes del apareamiento y durante la gestación en dosis orales de hasta 400 mg/kg por día (52 veces la dosis humana recomendada en mg/m²).
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
Los datos disponibles de los casos informados en la literatura publicada y la vigilancia posterior a la comercialización con el uso de clopidogrel en mujeres embarazadas no han identificado ningún riesgo asociado con el fármaco de defectos congénitos importantes o abortos espontáneos [ver Datos ].Existen riesgos para la mujer embarazada y el feto asociados con el infarto de miocardio y el accidente cerebrovascular [ver Consideraciones clínicas ]. No se observó evidencia de fetotoxicidad cuando se administró clopidogrel a ratas y conejas preñadas durante la organogénesis en dosis correspondientes a 65 y 78 veces la dosis diaria recomendada en humanos [ver Datos ].
Se desconoce el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo para las poblaciones indicadas. Todos los embarazos tienen un riesgo de fondo de defectos congénitos, pérdidas u otros resultados adversos. En la población general de EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 % al 4 % y del 15 % al 20 %, respectivamente.
Consideraciones clínicas
Riesgo materno y/o embrionario/fetal asociado a la enfermedad
El infarto de miocardio y el accidente cerebrovascular son emergencias médicas. La terapia para la mujer embarazada no debe suspenderse debido a posibles preocupaciones sobre los efectos del clopidogrel en el feto.
trabajo de parto o parto
El uso de clopidogrel durante el parto aumentará el riesgo de sangrado y hemorragia materna. Evite el bloqueo neuroaxial durante el uso de clopidogrel debido al riesgo de hematoma espinal. Cuando sea posible, suspenda el clopidogrel de 5 a 7 días antes del trabajo de parto, parto o bloqueo neuroaxial.
Datos
Datos humanos
Los datos disponibles de los informes de casos publicados durante dos décadas de uso posterior a la comercialización no han identificado una asociación con el uso de clopidogrel en el embarazo y defectos de nacimiento importantes, aborto espontáneo o resultados fetales adversos.
Datos de animales
Se realizaron estudios de toxicología del desarrollo embriofetal en ratas y conejas preñadas con dosis de hasta 500 y 300 mg/kg/día, respectivamente, administradas durante la organogénesis. Estas dosis, que corresponden a 65 y 78 veces la dosis diaria recomendada en humanos, respectivamente, en mg/m², no revelaron evidencia de alteración de la fertilidad o fetotoxicidad debido al clopidogrel.
Lactancia
Resumen de riesgos
No hay datos sobre la presencia de clopidogrel en la leche humana o los efectos sobre la producción de leche. No se han observado efectos adversos en lactantes con el uso materno de clopidogrel durante la lactancia en un pequeño número de casos posteriores a la comercialización. Los estudios en ratas han demostrado que el clopidogrel y/o sus metabolitos están presentes en la leche. Cuando una droga está presente en la leche animal, es probable que la droga esté presente en la leche humana. Los beneficios para el desarrollo y la salud de la lactancia materna se deben considerar junto con la necesidad clínica de PLAVIX de la madre y cualquier efecto adverso potencial en el lactante a causa de PLAVIX 75 mg o de una afección materna subyacente.
Uso pediátrico
No se ha establecido la seguridad y eficacia en poblaciones pediátricas.
Un ensayo aleatorizado controlado con placebo (CLARINET) no demostró un beneficio clínico del clopidogrel en recién nacidos y lactantes con cardiopatía congénita cianótica paliada con una derivación arterial sistémica a pulmonar. Los posibles factores que contribuyeron a este resultado fueron la dosis de clopidogrel, la administración concomitante de aspirina y el inicio tardío de la terapia después de la paliación de la derivación. No se puede descartar que un ensayo con un diseño diferente demuestre un beneficio clínico en esta población de pacientes.
Uso geriátrico
Del número total de sujetos en los estudios clínicos controlados CAPRIE y CURE, aproximadamente el 50 % de los pacientes tratados con Plavix tenían 65 años o más, y el 15 % tenían 75 años o más. En COMMIT, aproximadamente el 58 % de los pacientes tratados con Plavix 75 mg tenían 60 años o más, el 26 % de los cuales tenían 70 años o más.
El riesgo observado de eventos hemorrágicos con Plavix 75 mg más aspirina versus placebo más aspirina por categoría de edad se proporciona en la Tabla 1 y la Tabla 2 para los ensayos CURE y COMMIT, respectivamente [ver REACCIONES ADVERSAS ]. No es necesario ajustar la dosis en pacientes de edad avanzada.
Insuficiencia renal
La experiencia es limitada en pacientes con insuficiencia renal grave y moderada [ver FARMACOLOGÍA CLÍNICA ].
Deterioro hepático
No es necesario ajustar la dosis en pacientes con insuficiencia hepática [ver FARMACOLOGÍA CLÍNICA ].
SOBREDOSIS
La inhibición plaquetaria por Plavix es irreversible y durará toda la vida de la plaqueta. La sobredosis posterior a la administración de clopidogrel puede provocar complicaciones hemorrágicas. Una dosis oral única de clopidogrel de 1500 o 2000 mg/kg fue letal para ratones y ratas y de 3000 mg/kg para babuinos. Los síntomas de toxicidad aguda fueron vómitos, postración, dificultad para respirar y hemorragia gastrointestinal en animales.
Según la plausibilidad biológica, la transfusión de plaquetas puede restaurar la capacidad de coagulación.
CONTRAINDICACIONES
Sangrado activo
Plavix está contraindicado en pacientes con hemorragia patológica activa, como úlcera péptica o hemorragia intracraneal.
Hipersensibilidad
Plavix 75 mg está contraindicado en pacientes con hipersensibilidad (p. ej., anafilaxia) al clopidogrel o a cualquier componente del producto [ver REACCIONES ADVERSAS ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
Clopidogrel es un inhibidor de la activación y agregación plaquetaria a través de la unión irreversible de su metabolito activo a la clase P2Y12 de receptores ADP en las plaquetas.
Farmacodinámica
El clopidogrel debe ser metabolizado por las enzimas CYP450 para producir el metabolito activo que inhibe la agregación plaquetaria. El metabolito activo de clopidogrel inhibe selectivamente la unión del difosfato de adenosina (ADP) a su receptor plaquetario P2Y12 y la subsiguiente activación mediada por ADP del complejo glicoproteico GPIIb/IIIa, inhibiendo así la agregación plaquetaria. Esta acción es irreversible. En consecuencia, las plaquetas expuestas al metabolito activo de clopidogrel se ven afectadas por el resto de su vida útil (alrededor de 7 a 10 días). La agregación plaquetaria inducida por agonistas distintos del ADP también se inhibe bloqueando la amplificación de la activación plaquetaria por el ADP liberado.
La inhibición de la agregación plaquetaria dependiente de la dosis se puede observar 2 horas después de dosis orales únicas de Plavix. Las dosis repetidas de 75 mg de Plavix al día inhiben la agregación plaquetaria inducida por ADP el primer día y la inhibición alcanza el estado estacionario entre el día 3 y el día 7. En el estado estacionario, el nivel de inhibición promedio observado con una dosis de 75 mg de Plavix al día fue entre el 40% y el 60%. La agregación plaquetaria y el tiempo de hemorragia vuelven gradualmente a los valores iniciales después de interrumpir el tratamiento, generalmente en unos 5 días.
Pacientes geriátricos
Los ancianos (≥75 años) y los sujetos jóvenes sanos tuvieron efectos similares sobre la agregación plaquetaria.
Pacientes con insuficiencia renal
Después de dosis repetidas de 75 mg de Plavix 75 mg por día, los pacientes con insuficiencia renal grave (aclaramiento de creatinina de 5 a 15 ml/min) e insuficiencia renal moderada (aclaramiento de creatinina de 30 a 60 ml/min) mostraron una inhibición baja (25 %) de Agregación plaquetaria inducida por ADP.
Pacientes con insuficiencia hepática
Después de dosis repetidas de 75 mg de Plavix por día durante 10 días en pacientes con insuficiencia hepática grave, la inhibición de la agregación plaquetaria inducida por ADP fue similar a la observada en sujetos sanos.
Género
En un pequeño estudio que comparó a hombres y mujeres, se observó menos inhibición de la agregación plaquetaria inducida por ADP en las mujeres.
Farmacocinética
Clopidogrel es un profármaco y se metaboliza a un metabolito farmacológicamente activo y metabolitos inactivos.
Absorción
Después de dosis orales únicas y repetidas de 75 mg por día, el clopidogrel se absorbe rápidamente. La absorción es de al menos el 50%, según la excreción urinaria de los metabolitos de clopidogrel.
efecto de la comida
Plavix se puede administrar con o sin alimentos. En un estudio en sujetos masculinos sanos cuando se administró Plavix 75 mg por día con un desayuno estándar, la inhibición media de la agregación plaquetaria inducida por ADP se redujo en menos del 9 %. El metabolito activo AUC0-24 no cambió en presencia de alimentos, mientras que hubo una disminución del 57 % en la Cmax del metabolito activo. Se observaron resultados similares cuando se administró una dosis de carga de 300 mg de Plavix con un desayuno rico en grasas.
Metabolismo
El clopidogrel se metaboliza ampliamente por dos vías metabólicas principales: una mediada por esterasas y que conduce a la hidrólisis en un derivado de ácido carboxílico inactivo (85% de los metabolitos circulantes) y otra mediada por múltiples enzimas del citocromo P450. Los citocromos primero oxidan el clopidogrel a un metabolito intermedio 2-oxo-clopidogrel. El metabolismo posterior del metabolito intermedio 2-oxoclopidogrel da como resultado la formación del metabolito activo, un tiol derivado del clopidogrel. El metabolito activo está formado principalmente por CYP2C19 con contribuciones de varias otras enzimas CYP, incluidas CYP1A2, CYP2B6 y CYP3A. El metabolito tiol activo se une rápida e irreversiblemente a los receptores plaquetarios, lo que inhibe la agregación plaquetaria durante la vida útil de la plaqueta.
La Cmax del metabolito activo es el doble después de una dosis de carga única de 300 mg de clopidogrel que después de cuatro días de una dosis de mantenimiento de 75 mg. La Cmax ocurre aproximadamente de 30 a 60 minutos después de la dosificación. En el rango de dosis de 75 a 300 mg, la farmacocinética del metabolito activo se desvía de la proporcionalidad de la dosis: 4 veces la dosis da como resultado 2,0 veces y 2,7 veces la Cmax y el AUC, respectivamente.
Eliminación
Luego de una dosis oral de clopidogrel marcado con 14C en humanos, aproximadamente el 50 % de la radiactividad total se excretó en la orina y aproximadamente el 46 % en las heces durante los 5 días posteriores a la administración. Después de una dosis oral única de 75 mg, el clopidogrel tiene una vida media de aproximadamente 6 horas. La vida media del metabolito activo es de unos 30 minutos.
Interacciones con la drogas
Efecto de otras drogas en Plavix
Clopidogrel se metaboliza a su metabolito activo en parte por CYP2C19.
Inductores CYP2C19
El uso concomitante de inductores potentes de CYP2C19 produce un aumento de la concentración plasmática del metabolito activo de clopidogrel y un aumento de la inhibición plaquetaria.
Rifampina: La coadministración de 300 mg de rifampicina dos veces al día durante 7 días con una dosis de carga de 600 mg de clopidogrel en adultos sanos aumentó el AUC y la Cmax medias de los metabolitos tiol de clopidogrel en 3,8 veces. La inhibición media de la agregación plaquetaria a las 4 horas después de la dosis fue un 34 % mayor en presencia de rifampicina en comparación con la administración de clopidogrel solo.
Inhibidores de CYP2C19
El uso concomitante de ciertos inhibidores de esta enzima da como resultado una reducción de las concentraciones plasmáticas del metabolito activo de clopidogrel y una reducción de la inhibición plaquetaria.
Inhibidores de la bomba de protones (PPI)
En la Figura 1 se presenta el efecto de los inhibidores de la bomba de protones (IBP) sobre la exposición sistémica al metabolito activo de clopidogrel luego de dosis múltiples de Plavix 75 mg evaluados en estudios de interacción farmacológica específicos.
Figura 1: Exposición al metabolito activo de clopidogrel luego de múltiples dosis de Plavix 75 mg solo o con inhibidores de la bomba de protones (IBP)
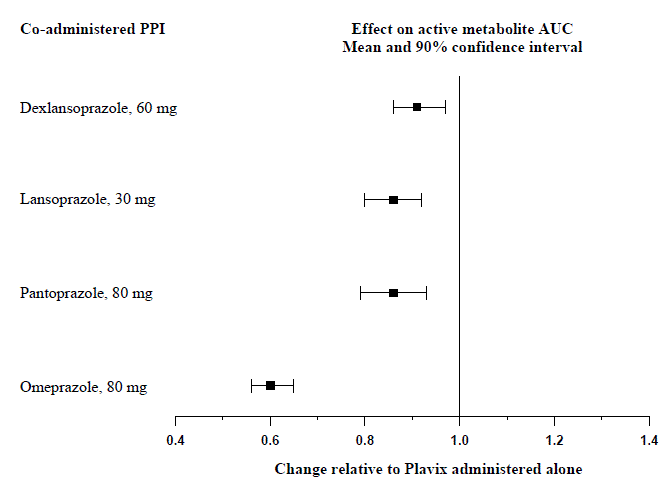
Los parámetros farmacodinámicos y farmacocinéticos medidos en estos estudios mostraron que la interacción fue mayor con omeprazol y menor con dexlansoprazol.
opioides
La coadministración de 5 mg de morfina intravenosa con una dosis de carga de 600 mg de clopidogrel en adultos sanos disminuyó el AUC y la Cmax de los metabolitos tiol de clopidogrel en un 34 %. La agregación plaquetaria media fue mayor hasta las 2 a 4 horas con la coadministración de morfina.
Efecto de Plavix 75 mg en otras drogas
Los estudios in vitro han demostrado que el metabolito glucurónido de clopidogrel es un potente inhibidor de CYP2C8. La administración concomitante de repaglinida con Plavix aumentó la exposición sistémica a repaglinida (AUC0-∞) 5,1 veces después de la dosis de carga (300 mg) y 3,9 veces el día 3 de la dosis de mantenimiento (75 mg) de Plavix [ver INTERACCIONES CON LA DROGAS ].
farmacogenómica
CYP2C19 participa en la formación tanto del metabolito activo como del metabolito intermedio 2-oxo-clopidogrel. La farmacocinética del metabolito activo de clopidogrel y los efectos antiplaquetarios, medidos mediante ensayos de agregación plaquetaria ex vivo, difieren según el genotipo CYP2C19. Los pacientes que son homocigotos para alelos no funcionales del gen CYP2C19 se denominan “metabolizadores lentos de CYP2C19”. Aproximadamente el 2% de los pacientes blancos y el 4% de los negros son metabolizadores lentos; la prevalencia de metabolismo deficiente es mayor en pacientes asiáticos (p. ej., 14% de los chinos). Hay pruebas disponibles para identificar a los pacientes que son metabolizadores lentos de CYP2C19.
Un estudio cruzado en 40 sujetos sanos, 10 de cada uno de los cuatro grupos metabolizadores CYP2C19, evaluó las respuestas farmacocinéticas y antiplaquetarias usando 300 mg seguidos de 75 mg por día y 600 mg seguidos de 150 mg por día, cada uno durante un total de 5 días. Se observó una menor exposición al metabolito activo y una menor inhibición de la agregación plaquetaria en los metabolizadores lentos en comparación con los otros grupos.
Estudios clínicos
El síndrome coronario agudo
CURAR
El estudio CURE incluyó a 12 562 pacientes con SCA sin elevación del segmento ST (AU o NSTEMI) y que se presentaron dentro de las 24 horas posteriores al inicio del episodio más reciente de dolor torácico o síntomas compatibles con isquemia. Se requirió que los pacientes tuvieran cambios en el ECG compatibles con una nueva isquemia (sin elevación del ST) o enzimas cardíacas o troponina I o T elevadas al menos al doble del límite superior de lo normal.
Los pacientes fueron aleatorizados para recibir Plavix (dosis de carga de 300 mg seguida de 75 mg una vez al día) o placebo, y fueron tratados hasta por un año. Los pacientes también recibieron aspirina (75-325 mg una vez al día) y otras terapias estándar como heparina. No se permitió el uso de inhibidores de GPIIb/IIIa durante los tres días previos a la aleatorización.
La población de pacientes era mayoritariamente blanca (82 %) e incluía un 38 % de mujeres y un 52 % de edad ≥65 años. Solo alrededor del 20% de los pacientes se sometieron a revascularización durante la hospitalización inicial y pocos se sometieron a revascularización emergente o urgente.
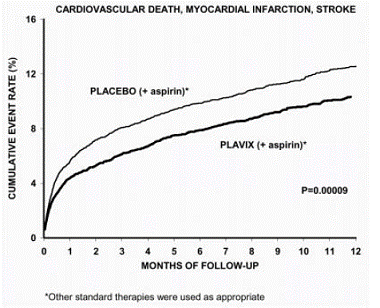
El número de pacientes que experimentaron el resultado primario (muerte CV, infarto de miocardio o accidente cerebrovascular) fue de 582 (9,3 %) en el grupo tratado con Plavix y de 719 (11,4 %) en el grupo tratado con placebo, una reducción del riesgo relativo del 20 % (95 % IC de 10%-28%; p
La mayor parte del beneficio de Plavix ocurrió en los primeros dos meses, pero la diferencia con el placebo se mantuvo a lo largo del ensayo (hasta 12 meses) (consulte la Figura 2).
Figura 2: Muerte cardiovascular, infarto de miocardio y accidente cerebrovascular en el estudio CURE
El efecto de Plavix 75 mg no difirió significativamente en varios subgrupos, como se muestra en la Figura 3. Los beneficios asociados con Plavix 75 mg fueron independientes del uso de otras terapias cardiovasculares agudas y a largo plazo, que incluyen heparina/HBPM, glicoproteína intravenosa IIb/IIIa (GPIIb/IIIa), fármacos hipolipemiantes, bloqueadores beta e inhibidores de la ECA. La eficacia de Plavix se observó independientemente de la dosis de aspirina (75-325 mg una vez al día). En CURE no se permitió el uso de anticoagulantes orales, fármacos antiplaquetarios que no pertenecen al estudio y AINE crónicos.
Figura 3: Cociente de riesgos instantáneos para las características iniciales del paciente y los medicamentos/intervenciones concomitantes en el estudio para el estudio CURE
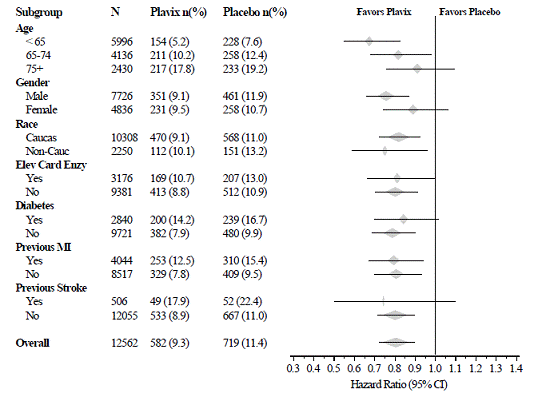
Figura 3: Cociente de riesgos instantáneos para las características iniciales del paciente y los medicamentos/intervenciones concomitantes en el estudio para el estudio CURE (continuación)
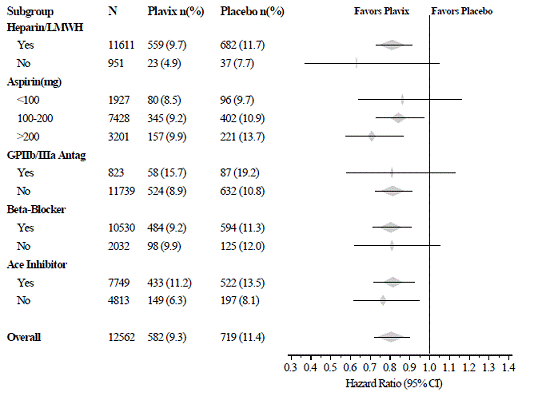
El uso de Plavix en CURE se asoció con una disminución en el uso de la terapia trombolítica (71 pacientes [1,1 %] en el grupo de Plavix de 75 mg, 126 pacientes [2,0 %] en el grupo de placebo; reducción del riesgo relativo del 43 %) y Inhibidores de GPIIb/IIIa (369 pacientes [5,9 %] en el grupo de Plavix 75 mg, 454 pacientes [7,2 %] en el grupo de placebo, reducción del riesgo relativo del 18 %). El uso de Plavix 75 mg en CURE no afectó el número de pacientes tratados con CABG o PCI (con o sin colocación de stent) (2253 pacientes [36,0 %] en el grupo de Plavix 75 mg, 2324 pacientes [36,9 %] en el grupo de placebo; relativo reducción del riesgo del 4,0%).
COMPROMETERSE
En pacientes con STEMI, la seguridad y la eficacia de Plavix se evaluaron en el estudio aleatorizado, controlado con placebo, doble ciego, COMMIT. COMMIT incluyó a 45.852 pacientes que se presentaron dentro de las 24 horas posteriores al inicio de los síntomas de infarto de miocardio con anomalías en el ECG de apoyo (es decir, elevación del ST, depresión del ST o bloqueo de rama izquierda). Los pacientes fueron aleatorizados para recibir Plavix (75 mg una vez al día) o placebo, en combinación con aspirina (162 mg al día), durante 28 días o hasta el alta hospitalaria, lo que sucediera primero.
Los criterios de valoración primarios fueron la muerte por cualquier causa y la primera aparición de reinfarto, accidente cerebrovascular o muerte.
La población de pacientes era 28% mujeres y 58% edad ≥60 años (26% edad ≥70 años). El cincuenta y cinco por ciento (55%) de los pacientes recibió trombolíticos y solo el 3% se sometió a ICP.
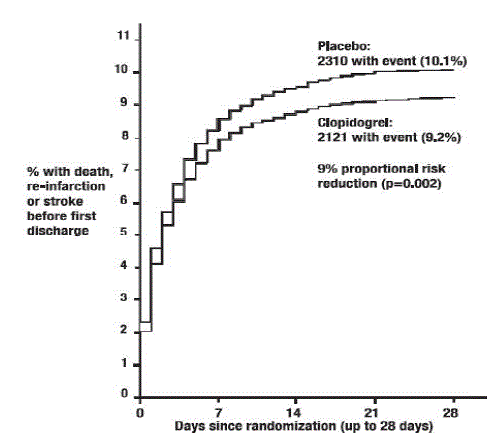
Como se muestra en la Tabla 5 y la Figura 4 y la Figura 5 a continuación, Plavix redujo significativamente el riesgo relativo de muerte por cualquier causa en un 7 % (p = 0,029), y el riesgo relativo de la combinación de reinfarto, accidente cerebrovascular o muerte en un 9 % ( p=0,002).
Figura 4: Tasas acumuladas de eventos de muerte en el estudio COMMIT*
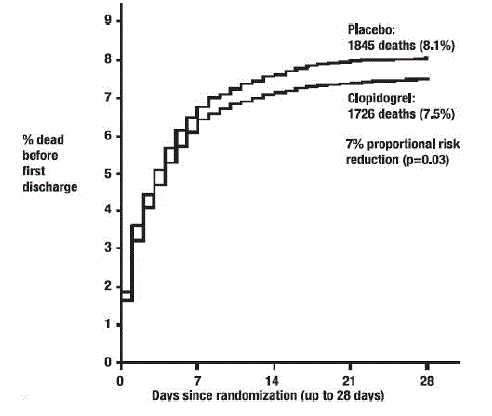
Figura 5: Tasas acumuladas de eventos para el punto final combinado de reinfarto, accidente cerebrovascular o muerte en el estudio COMMIT*
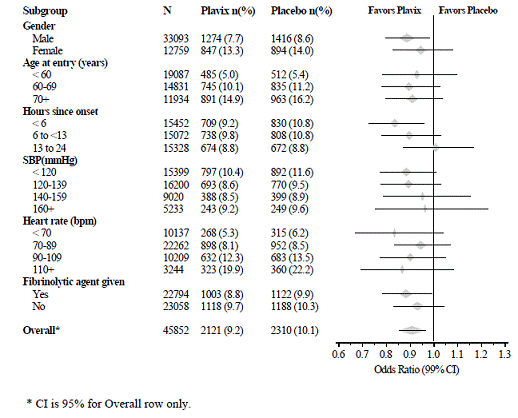
El efecto de Plavix 75 mg no difirió significativamente en varios subgrupos preespecificados, como se muestra en la Figura 6. El efecto también fue similar en los subgrupos no preespecificados, incluidos los que se basan en la ubicación del infarto, la clase Killip o antecedentes de infarto de miocardio. Dichos análisis de subgrupos deben interpretarse con cautela.
Figura 6: Efectos de agregar Plavix 75 mg a la aspirina en el criterio principal de valoración combinado en los subgrupos de medicación inicial y concomitante para el estudio COMMIT
Infarto de miocardio reciente, accidente cerebrovascular reciente o enfermedad arterial periférica establecida
CAPRIE
El ensayo CAPRIE fue un estudio internacional, aleatorizado, doble ciego, de grupos paralelos, de 19 185 pacientes, 304 centros, que comparó Plavix (75 mg diarios) con aspirina (325 mg diarios). Para ser elegible para inscribirse, los pacientes debían tener: 1) antecedentes recientes de infarto de miocardio (en los últimos 35 días); 2) antecedentes recientes de accidente cerebrovascular isquémico (dentro de los 6 meses) con al menos una semana de signos neurológicos residuales; y/o 3) enfermedad arterial periférica (EAP) establecida. Los pacientes recibieron tratamiento aleatorizado durante una media de 1,6 años (máximo de 3 años).
El resultado primario del ensayo fue el tiempo transcurrido hasta la primera aparición de un nuevo accidente cerebrovascular isquémico (mortal o no), un nuevo infarto de miocardio (mortal o no) u otra muerte vascular. Todas las muertes que no se pueden atribuir fácilmente a causas no vasculares se clasificaron como vasculares.
Como se muestra en la Tabla 6, Plavix se asoció con una menor incidencia de eventos de resultado, principalmente IM. La reducción general del riesgo relativo (9,8 % frente a 10,6 %) fue del 8,7 %, p=0,045. Se obtuvieron resultados similares cuando se contaron la mortalidad por todas las causas y los accidentes cerebrovasculares por todas las causas en lugar de la mortalidad vascular y los accidentes cerebrovasculares isquémicos (reducción del riesgo del 6,9%). En los pacientes que sobrevivieron a un accidente cerebrovascular o infarto de miocardio durante el estudio, la incidencia de eventos posteriores fue menor en el grupo de 75 mg de Plavix.
Las curvas que muestran la tasa general de eventos se muestran en la Figura 7. Las curvas de eventos se separaron temprano y continuaron divergiendo durante el período de seguimiento de 3 años.
Figura 7: Eventos vasculares fatales o no fatales en el estudio CAPRIE
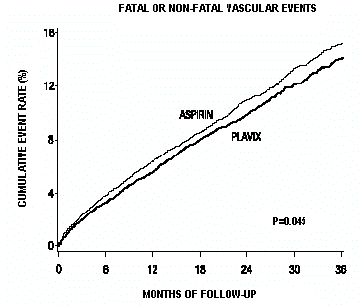
La significación estadística a favor de Plavix 75 mg sobre la aspirina fue marginal (p = 0,045). Sin embargo, debido a que la aspirina en sí misma es eficaz para reducir los eventos cardiovasculares en pacientes con infarto de miocardio o accidente cerebrovascular recientes, el efecto de Plavix 75 mg es sustancial.
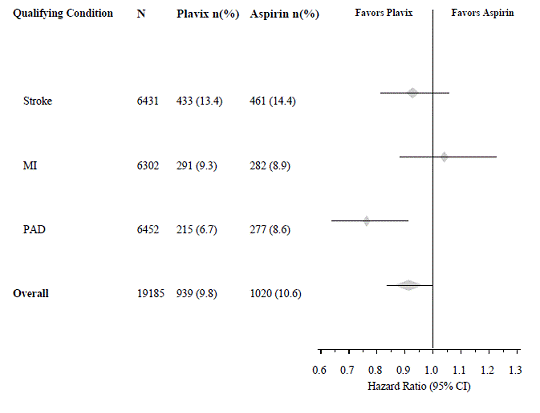
El ensayo CAPRIE inscribió a una población que tenía IM reciente, accidente cerebrovascular reciente o PAD. La eficacia de Plavix 75 mg en relación con la aspirina fue heterogénea en estos subgrupos (p=0,043) (consulte la Figura 8). No obstante, esta diferencia puede ser una ocurrencia fortuita porque el ensayo CAPRIE no fue diseñado para evaluar el beneficio relativo de Plavix 75 mg sobre la aspirina en los subgrupos de pacientes individuales. El beneficio fue más evidente en los pacientes que se inscribieron debido a la enfermedad arterial periférica y menos evidente en los pacientes con accidente cerebrovascular. En pacientes que se inscribieron en el ensayo sobre la única base de un infarto de miocardio reciente, Plavix 75 mg no fue numéricamente superior a la aspirina.
Figura 8: Cociente de riesgos instantáneos e IC del 95 % por subgrupos iniciales en el estudio CAPRIE
Ningún beneficio demostrado de Plavix 75 mg más aspirina en pacientes con múltiples factores de riesgo o enfermedad vascular establecida
CARISMA
El ensayo CHARISMA fue un estudio de 15 603 sujetos, aleatorizado, doble ciego, de grupos paralelos que comparó Plavix (75 mg diarios) con un placebo para la prevención de eventos isquémicos en pacientes con enfermedad vascular o múltiples factores de riesgo de aterosclerosis. Todos los sujetos fueron tratados con aspirina 75-162 mg al día. La duración media del tratamiento fue de 23 meses. El estudio no logró demostrar una reducción en la ocurrencia del criterio principal de valoración, un compuesto de muerte CV, infarto de miocardio o accidente cerebrovascular. Un total de 534 (6,9 %) pacientes en el grupo de Plavix frente a 573 (7,4 %) pacientes en el grupo de placebo experimentaron un evento de resultado primario (p = 0,22). El sangrado de todos los grados fue más común en los sujetos asignados al azar a Plavix.
INFORMACIÓN DEL PACIENTE
Plavix® (PLAV-iks) (bisulfato de clopidogrel) tabletas
Lea esta Guía del medicamento antes de comenzar a tomar Plavix y cada vez que renueve su receta. Es posible que haya nueva información. Esta Guía del medicamento no reemplaza la conversación con su médico sobre su condición médica o su tratamiento.
¿Cuál es la información más importante que debo saber sobre Plavix 75mg?
1. Es posible que Plavix no funcione tan bien en personas que:
- tienen ciertos factores genéticos que afectan la forma en que el cuerpo descompone Plavix. Su médico puede realizar pruebas genéticas para asegurarse de que Plavix sea adecuado para usted.
- toma ciertos medicamentos, especialmente omeprazol (Prilosec®) o esomeprazol (Nexium®). Su médico puede cambiar el medicamento que toma para los problemas de acidez estomacal mientras toma Plavix.
2. Plavix 75 mg puede causar sangrado que puede ser grave y, en ocasiones, puede provocar la muerte. Plavix es un medicamento anticoagulante que reduce la posibilidad de que se formen coágulos de sangre en su cuerpo. Mientras toma Plavix:
- puede tener moretones y sangrar más fácilmente
- es más probable que tenga hemorragias nasales
- tomará más tiempo para que se detenga cualquier sangrado
Llame a su médico de inmediato si tiene alguno de estos signos o síntomas de sangrado:
- sangrado inesperado o sangrado que dura mucho tiempo
- sangre en la orina (orina rosada, roja o marrón)
- heces rojas o negras (parecen alquitrán)
- moretones que ocurren sin una causa conocida o se hacen más grandes
- toser sangre o coágulos de sangre
- vomita sangre o su vómito parece café molido
No deje de tomar Plavix 75 mg sin consultar con el médico que se lo recete. Las personas que dejan de tomar Plavix 75 mg demasiado pronto tienen un mayor riesgo de sufrir un ataque al corazón o morir. Si debe dejar de tomar Plavix debido a una hemorragia, su riesgo de sufrir un ataque al corazón puede ser mayor.
¿Qué es Plavix 75 mg?
Plavix es un medicamento recetado que se usa para tratar a las personas que tienen cualquiera de los siguientes:
- dolor en el pecho debido a problemas del corazón
- mala circulación en las piernas (enfermedad arterial periférica)
- un infarto
- un golpe
Plavix se usa solo o con aspirina para reducir la posibilidad de tener otro problema grave con el corazón o los vasos sanguíneos, como un ataque cardíaco, un accidente cerebrovascular o un coágulo de sangre que puede provocar la muerte.
Las plaquetas son células sanguíneas que ayudan a que la sangre se coagule normalmente. Plavix 75 mg ayuda a evitar que las plaquetas se peguen y formen un coágulo que puede bloquear una arteria.
No se sabe si Plavix 75 mg es seguro y efectivo en niños.
¿Quién no debe tomar Plavix 75 mg?
No tome Plavix si usted:
- actualmente tiene una afección que causa sangrado, como una úlcera estomacal
- es alérgico al clopidogrel o a otros ingredientes de Plavix. Consulte el final de este folleto para obtener una lista completa de los ingredientes de Plavix.
¿Qué debo decirle a mi médico antes de tomar Plavix 75 mg?
Antes de tomar Plavix, informe a su médico si:
- tiene antecedentes de úlceras intestinales (gastrointestinales) o estomacales
- tiene antecedentes de problemas de sangrado
- planea someterse a una cirugía o a un procedimiento dental. Ver “¿Cómo debo tomar Plavix?”
- está embarazada o planea quedar embarazada. No se sabe si Plavix 75mg dañará a su bebé nonato
- están amamantando o planean amamantar. No se sabe si Plavix 75 mg pasa a la leche materna. Se debe tomar una decisión con su proveedor de atención médica para evitar o interrumpir la lactancia cuando se necesite continuar con Plavix.
- ha tenido una alergia o reacción a algún medicamento utilizado para tratar su enfermedad.
Informe a todos sus médicos y dentistas que está tomando Plavix. Deben hablar con el médico que le recetó Plavix 75 mg antes de someterse a una cirugía o procedimiento invasivo.
Informe a su médico sobre todos los medicamentos que toma, incluyendo medicamentos recetados, sin receta, vitaminas y suplementos herbales.
Plavix 75 mg puede afectar la forma en que funcionan otros medicamentos, y otros medicamentos pueden afectar la forma en que funciona Plavix. Ver “¿Cuál es la información más importante que debo saber sobre Plavix 75mg?”
Plavix 75mg puede aumentar los niveles en sangre de otros medicamentos como repaglinida (Prandin®).
Tomar Plavix con ciertos otros medicamentos puede aumentar su riesgo de sangrado.
Informe especialmente a su médico si toma:
- aspirina, especialmente si ha tenido un derrame cerebral. Siempre hable con su médico acerca de si debe tomar aspirina junto con Plavix 75 mg para tratar su condición.
- Medicamentos antiinflamatorios no esteroideos (AINE). Pídale a su médico o farmacéutico una lista de medicamentos AINE si no está seguro.
- warfarina (Coumadin®, Jantoven®).
- inhibidores selectivos de la recaptación de serotonina (ISRS) e inhibidores de la recaptación de serotonina y norepinefrina (IRSN). Pídale a su médico o farmacéutico una lista de medicamentos ISRS o IRSN si no está seguro.
- rifampicina (utilizada para tratar infecciones graves)
Conozca los medicamentos que toma. Mantenga una lista de ellos para mostrársela a su médico o farmacéutico cuando obtenga un medicamento nuevo.
¿Cómo debo tomar Plavix?
- Tome Plavix exactamente como le indique su médico.
- No cambie su dosis ni deje de tomar Plavix 75 mg sin hablar primero con su médico. Dejar de tomar Plavix puede aumentar su riesgo de ataque cardíaco o accidente cerebrovascular.
- Tome Plavix 75 mg con aspirina según las instrucciones de su médico.
- Si olvida una dosis, tome Plavix tan pronto como lo recuerde. Si es casi la hora de su próxima dosis, omita la dosis olvidada. Tome la siguiente dosis a la hora habitual. No tome 2 dosis de Plavix 75 mg al mismo tiempo a menos que su médico se lo indique.
- Si toma demasiado Plavix, llame a su médico o vaya a la sala de emergencias más cercana de inmediato.
- Hable con su médico acerca de dejar de tomar Plavix 75 mg antes de someterse a una cirugía. Es posible que su médico le indique que deje de tomar Plavix 75 mg al menos 5 días antes de la cirugía para evitar un sangrado excesivo durante la cirugía.
¿Cuáles son los posibles efectos secundarios de Plavix?
Plavix 75mg puede causar efectos secundarios graves que incluyen:
- Consulte "¿Cuál es la información más importante que debo saber sobre Plavix?"
- Un problema de coagulación de la sangre llamado púrpura trombocitopénica trombótica (PTT). La PTT puede ocurrir con Plavix 75 mg, a veces después de poco tiempo (menos de 2 semanas). La PTT es un problema de coagulación de la sangre en el que se forman coágulos de sangre en los vasos sanguíneos; y puede ocurrir en cualquier parte del cuerpo. La TTP debe tratarse en un hospital de inmediato, ya que puede causar la muerte. Obtenga ayuda médica de inmediato si tiene alguno de estos síntomas y no se pueden explicar por otra afección médica:
- manchas violáceas (llamadas púrpura) en la piel o en la boca (membranas mucosas) debido a sangrado debajo de la piel
- su piel o el blanco de sus ojos son amarillos (ictericia)
- te sientes cansado o débil
- tu piel se ve muy pálida
- fiebre
- frecuencia cardíaca rápida o sensación de falta de aire
- dolor de cabeza
- cambios en el habla
- confusión
- coma
- carrera
- embargo
- poca cantidad de orina, u orina rosada o con sangre
- dolor en el área del estómago (abdominal)
- náuseas, vómitos o diarrea
- cambios en la visión
- síntomas persistentes de niveles bajos de azúcar en la sangre
Informe a su médico si tiene algún efecto secundario que le moleste o que no desaparezca. Informe a su médico si desarrolla una reacción alérgica, incluidas reacciones cutáneas, mientras toma Plavix.
Estos no son todos los posibles efectos secundarios de Plavix. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar Plavix 75 mg?
- Guarde Plavix 75 mg a 59 °F a 86 °F (15 °C a 30 °C).
Mantenga Plavix y todos los medicamentos fuera del alcance de los niños.
Información general sobre Plavix
A veces, los medicamentos se usan para fines distintos a los que se enumeran en la Guía del medicamento. No tome Plavix 75 mg para una condición para la cual no fue recetado. No le dé Plavix a otras personas, incluso si tienen los mismos síntomas que usted tiene. Puede que les haga daño.
Esta Guía del medicamento resume la información más importante sobre Plavix. Si desea obtener más información, hable con su médico. Pídale a su médico o farmacéutico información sobre Plavix escrita para profesionales de la salud.
Para obtener más información, visite www.sanofi-aventis.us o www.bms.com o llame al 1-800-321-1335.
¿Cuáles son los ingredientes de Plavix 75 mg?
Ingrediente activo: bisulfato de clopidogrel
Ingredientes inactivos:
Comprimido: aceite de ricino hidrogenado, hidroxipropilcelulosa, manitol, celulosa microcristalina, polietilenglicol 6000
Recubrimiento pelicular: óxido férrico, hipromelosa 2910, lactosa monohidrato, dióxido de titanio, triacetina, cera carnauba
Esta Guía del medicamento ha sido aprobada por el Departamento de Alimentos y Medicamentos de EE. UU.
