Tratamiento de la Enfermedad Inflamatoria Intestinal: Nexium 20mg, 40mg Esomeprazole Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Nexium y cómo se usa?
Nexium es un medicamento recetado que se usa para tratar los síntomas de la enfermedad por reflujo gastroesofágico (ERGE) y otras afecciones en las que hay un exceso de ácido estomacal, como el síndrome de Zollinger-Ellison. Nexium se puede usar solo o con otros medicamentos.
Nexium 20 mg es un inhibidor de la bomba de protones.
No se sabe si Nexium 20 mg es seguro y efectivo en niños menores de 1 mes para medicación intravenosa y 1 año para medicación oral.
¿Cuáles son los efectos secundarios de Nexium 40mg?
Nexium puede causar efectos secundarios graves que incluyen:
- dolor de estómago severo,
- diarrea acuosa o con sangre,
- convulsiones (convulsiones),
- orinar poco o nada,
- sangre en la orina,
- hinchazón,
- rápido aumento de peso,
- mareo,
- frecuencia cardíaca rápida o irregular,
- temblores o movimientos musculares espasmódicos,
- sintiéndose nervioso,
- calambres musculares,
- espasmos musculares en las manos y los pies,
- tos o sensación de asfixia,
- dolor en las articulaciones, y
- erupción cutánea en las mejillas o los brazos que empeora con el sol
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Nexium 40 mg incluyen:
- dolor de cabeza,
- somnolencia,
- diarrea leve,
- náuseas,
- dolor de estómago,
- gas,
- estreñimiento, y
- boca seca
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Nexium. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
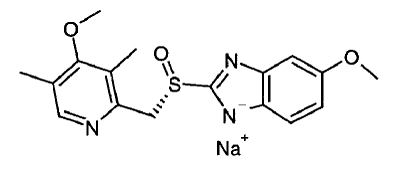
El ingrediente activo de NEXIUM® IV (esomeprazol sódico) para inyección es (S)-5-metoxi-2[[(4-metoxi-3,5-dimetil-2-piridinil)-metil]sulfinil]-1H-bencimidazol sodio, un inhibidor de la bomba de protones que inhibe la secreción de ácido gástrico. El esomeprazol es el isómero S del omeprazol, que es una mezcla de los isómeros S y R. Su fórmula empírica es C17H18N3O3SNa con peso molecular de 367,4 g/mol (sal de sodio) y 345,4 g/mol (compuesto de origen).
El esomeprazol sódico es muy soluble en agua y fácilmente soluble en etanol (95%). La fórmula estructural es:
NEXIUM 20 mg IV para inyección se suministra como una torta o polvo poroso estéril, liofilizado, de color blanco a blanquecino, en un vial de 5 ml, destinado a la administración intravenosa después de la reconstitución con inyección de cloruro de sodio al 0,9 %, USP; Inyección de Ringer Lactato, USP o Inyección de Dextrosa al 5%, USP. NEXIUM IV para inyección contiene esomeprazol sódico 21,3 mg o 42,5 mg equivalente a esomeprazol 20 mg o 40 mg, edetato disódico 1,5 mg e hidróxido de sodio qs para ajuste de pH. El pH de la solución reconstituida de NEXIUM IV para inyección depende del volumen de reconstitución y está en el rango de pH de 9 a 11. La estabilidad de esomeprazol sódico en solución acuosa depende en gran medida del pH. La tasa de degradación aumenta con la disminución del pH.
INDICACIONES
Tratamiento de la enfermedad por reflujo gastroesofágico (ERGE) con esofagitis erosiva (EE)
NEXIUM IV está indicado para el tratamiento a corto plazo de la ERGE con EE en pacientes adultos y pediátricos de 1 mes a 17 años, incluso como una alternativa a la terapia oral cuando NEXIUM 40 mg por vía oral no es posible o apropiado.
Reducción del riesgo de resangrado de úlceras gástricas o duodenales después de una endoscopia terapéutica en adultos
NEXIUM 40 mg IV está indicado para la reducción del riesgo de resangrado de úlceras gástricas o duodenales después de una endoscopia terapéutica para úlceras gástricas o duodenales sangrantes agudas en adultos.
DOSIFICACIÓN Y ADMINISTRACIÓN
Dosis para GERD con EE
Pacientes adultos
La dosis recomendada para adultos es de 20 mg o 40 mg de NEXIUM 40 mg IV administrados una vez al día mediante inyección intravenosa (durante al menos 3 minutos) o infusión intravenosa (10 minutos a 30 minutos) durante un máximo de 10 días [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Pacientes pediátricos
La dosis recomendada para pacientes pediátricos se basa en la edad y el peso corporal, como se muestra en la Tabla 1 a continuación. Administrar como infusión intravenosa durante 10 a 30 minutos una vez al día hasta por 10 días [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Finalización del tratamiento
- No se ha demostrado la seguridad y eficacia de NEXIUM 20 mg IV durante más de 10 días.
- Tan pronto como la terapia oral sea posible o apropiada, suspenda la terapia intravenosa con NEXIUM 40 mg IV y continúe con la terapia oral con NEXIUM 20 mg.
Dosis para la reducción del riesgo de resangrado de úlceras gástricas o duodenales después de una endoscopia terapéutica en adultos
La dosis recomendada para adultos es de 80 mg de NEXIUM IV administrados como una infusión intravenosa durante 30 minutos seguida de una infusión continua de 8 mg/hora para una duración total del tratamiento de 72 horas (es decir, incluye la dosis de carga inicial de 30 minutos más 71,5 horas de infusión continua). infusión) [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
La terapia intravenosa está dirigida únicamente al tratamiento inicial agudo de las úlceras gástricas o duodenales sangrantes y no constituye un tratamiento completo. Administre terapia supresora de ácido por vía oral después de la terapia intravenosa durante un curso completo de tratamiento.
Ajuste de dosis para insuficiencia hepática
ERGE con EE
Para pacientes con insuficiencia hepática grave (Child-Pugh Clase C), la dosis máxima es de 20 mg una vez al día [ver Uso en poblaciones específicas ].
Reducción del riesgo de resangrado de úlceras gástricas o duodenales después de una endoscopia terapéutica en adultos
Para pacientes con insuficiencia hepática de leve a moderada (Child-Pugh Clases A y B, respectivamente), administrar 80 mg como infusión intravenosa durante 30 minutos, seguido de una infusión continua de 6 mg/hora durante 71,5 horas.
Para pacientes con insuficiencia hepática grave (Child-Pugh Clase C), se administran 80 mg como infusión intravenosa durante 30 minutos, seguida de una infusión continua de 4 mg/hora durante 71,5 horas [ver Uso en poblaciones específicas ].
Instrucciones de preparación y administración para GERD con EE
No administre NEXIUM 40 mg IV concomitantemente con otros medicamentos a través del mismo sitio y/o tubo intravenoso.
Se pueden usar antiácidos orales durante el tratamiento con NEXIUM 20 mg IV
Inyección intravenosa durante al menos 3 minutos en pacientes adultos
Infusión intravenosa durante 10 minutos a 30 minutos en pacientes adultos y pediátricos
Almacenamiento
Guarde la solución NEXIUM IV final (diluida) a temperatura ambiente hasta 30 °C (86 °F) y administre dentro del período de tiempo designado que se indica en la Tabla 2 a continuación.
Instrucciones de preparación y administración para la reducción del riesgo de resangrado de úlceras gástricas o duodenales en adultos
No administre NEXIUM 40 mg IV concomitantemente con otros medicamentos a través del mismo sitio y/o tubo intravenoso.
Se pueden usar antiácidos orales durante el tratamiento con NEXIUM IV
Dosis de carga (80 mg)
Infusión continua
Almacenamiento
- Guarde la solución NEXIUM IV final (diluida) a temperatura ambiente hasta 30 °C (86 °F) y administre dentro de las 12 horas.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Para inyección: 40 mg de esomeprazol como un polvo liofilizado de color blanco a blanquecino en un vial de dosis única para reconstitución.
Almacenamiento y manipulación
NEXIUM 20 mg IV se suministra en un vial de dosis única como un polvo liofilizado de color blanco a blanquecino para reconstitución que contiene 40 mg de esomeprazol.
NEXIUM 40 mg IV . está disponible de la siguiente manera:
Almacenamiento
Almacenar a 25°C (77°F); excursiones permitidas a 15° a 30°C (59° a 86°F). [Ver Temperatura ambiente controlada por USP .] Proteger de la luz. Conservar en caja de cartón hasta el momento de su uso.
Después de la reconstitución y administración, deseche cualquier porción no utilizada de la solución de esomeprazol [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Fabricado para: AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. Revisado: marzo de 2022
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas graves se describen a continuación y en otras partes del etiquetado:
- Nefritis tubulointersticial aguda [ver ADVERTENCIAS Y PRECAUCIONES ]
- Diarrea asociada a Clostridium difficile [ver ADVERTENCIAS Y PRECAUCIONES ]
- Fractura ósea [ver ADVERTENCIAS Y PRECAUCIONES ]
- Reacciones adversas cutáneas graves [ver ADVERTENCIAS Y PRECAUCIONES ]
- Lupus eritematoso cutáneo y sistémico [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hipomagnesemia y metabolismo mineral [ver ADVERTENCIAS Y PRECAUCIONES ]
- Pólipos de las glándulas fúndicas [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
ERGE y EE sintomáticos
Adultos
La seguridad de NEXIUM IV se basa en los resultados de ensayos clínicos realizados en cuatro poblaciones diferentes, incluidos sujetos sanos (n=204) y pacientes con úlceras gástricas o duodenales sangrantes (n=375). Los datos que se describen a continuación reflejan la exposición a NEXIUM 20 mg IV en 359 pacientes en ensayos controlados activamente: ERGE sintomática con o sin antecedentes de EE (n=199) y pacientes con EE (n=160). La población fue de 18 a 77 años de edad; 45 % masculino, 52 % caucásico, 17 % negro, 3 % asiático y 28 % de otras razas. La mayoría de los pacientes recibieron dosis de 20 o 40 mg en infusión o inyección. Las reacciones adversas que ocurren en al menos el 1% de los pacientes se enumeran a continuación en la Tabla 3:
Se encontró que el tratamiento intravenoso con NEXIUM 20 mg IV 20 y 40 mg administrado como inyección o infusión tiene un perfil de seguridad similar al del esomeprazol oral.
Pediatría
Se realizó un estudio aleatorizado, abierto y multinacional para evaluar la farmacocinética de dosis intravenosas repetidas de NEXIUM IV una vez al día en pacientes pediátricos de 1 mes a 17 años, inclusive [ver FARMACOLOGÍA CLÍNICA ]. Los resultados de seguridad son consistentes con el perfil de seguridad conocido de esomeprazol y no se identificaron señales de seguridad inesperadas.
Reducción del riesgo de resangrado de úlceras gástricas o duodenales en adultos
Los datos descritos en la Tabla 4 a continuación reflejan la exposición a NEXIUM 20 mg IV en 375 pacientes que presentaron hemorragia por úlcera gástrica o duodenal confirmada por endoscopia en un ensayo controlado con placebo. La población fue de 18 a 98 años; 68 % masculino, 87 % caucásico, 1 % negro, 7 % asiático y 4 % de otras razas. Después de la hemostasia endoscópica, los pacientes recibieron placebo o 80 mg de NEXIUM IV como infusión intravenosa durante 30 minutos, seguida de una infusión continua de 8 mg/hora durante una duración total del tratamiento de 72 horas. Después del período inicial de 72 horas, todos los pacientes recibieron un IBP oral durante 27 días.
Con la excepción de las reacciones en el lugar de la inyección descritas anteriormente, se encontró que el tratamiento intravenoso con NEXIUM 20 mg IV administrado como inyección o infusión tiene un perfil de seguridad similar al del esomeprazol oral.
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de esomeprazol. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Trastornos de la sangre y del sistema linfático: agranulocitosis, pancitopenia;
Trastornos oculares: visión borrosa;
Desórdenes gastrointestinales: pancreatitis; estomatitis; colitis microscópica; pólipos de glándulas fúndicas;
Trastornos hepatobiliares: insuficiencia hepática, hepatitis con o sin ictericia;
Trastornos del sistema inmunológico: reacción/shock anafiláctico; lupus eritematoso sistémico;
Infecciones e infestaciones: candidiasis GI;
Trastornos del metabolismo y nutricionales: hipomagnesemia (puede provocar hipocalcemia y/o hipopotasemia) [ver ADVERTENCIAS Y PRECAUCIONES ], hiponatremia;
Trastornos musculoesqueléticos y del tejido conjuntivo: debilidad muscular, mialgia, fractura ósea;
Trastornos del sistema nervioso: encefalopatía hepática, alteración del gusto;
Desórdenes psiquiátricos: agresión, agitación, depresión, alucinación;
Trastornos renales y urinarios: nefritis intersticial;
Trastornos del sistema reproductivo y de la mama: ginecomastia;
Trastornos respiratorios, torácicos y mediastínicos: broncoespasmo;
Trastornos de la piel y del tejido subcutáneo: alopecia, eritema multiforme, hiperhidrosis, fotosensibilidad, síndrome de Stevens-Johnson, necrólisis epidérmica tóxica (NET, algunas fatales), reacción a medicamentos con eosinofilia y síntomas sistémicos (DRESS) y pustulosis exantemática generalizada aguda (AGEP), lupus eritematoso cutáneo.
También se puede esperar que ocurran reacciones adversas asociadas con el omeprazol con NEXIUM IV Consulte la información de prescripción completa del omeprazol oral para obtener información de seguridad completa.
INTERACCIONES CON LA DROGAS
Las tablas 5 y 6 incluyen medicamentos con interacciones medicamentosas clínicamente importantes e interacciones con diagnósticos cuando se administran concomitantemente con esomeprazol e instrucciones para prevenirlas o manejarlas.
Consulte la etiqueta de los medicamentos utilizados de forma concomitante para obtener más información sobre las interacciones con los IBP.
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Presencia de malignidad gástrica
En adultos, la respuesta sintomática al tratamiento con NEXIUM IV no excluye la presencia de cáncer gástrico. Considere un seguimiento adicional y pruebas de diagnóstico en pacientes adultos que tienen una respuesta subóptima o una recaída sintomática temprana después de completar el tratamiento con un IBP. En pacientes mayores también considere una endoscopia.
Nefritis tubulointersticial aguda
Se ha observado nefritis tubulointersticial aguda (TIN) en pacientes que toman IBP y puede ocurrir en cualquier momento durante la terapia con IBP. Los pacientes pueden presentar diversos signos y síntomas, desde reacciones de hipersensibilidad sintomática hasta síntomas inespecíficos de disminución de la función renal (p. ej., malestar general, náuseas, anorexia). En las series de casos notificadas, algunos pacientes fueron diagnosticados mediante biopsia y en ausencia de manifestaciones extrarrenales (p. ej., fiebre, exantema o artralgia). Suspender NEXIUM 20 mg IV y evaluar a los pacientes con sospecha de TIN aguda [ver CONTRAINDICACIONES ].
Diarrea asociada a Clostridium difficile
Los estudios observacionales publicados sugieren que la terapia con IBP como NEXIUM 20 mg IV puede estar asociada con un mayor riesgo de diarrea asociada a Clostridium difficile, especialmente en pacientes hospitalizados. Este diagnóstico debe considerarse para la diarrea que no mejora [ver REACCIONES ADVERSAS ].
Los pacientes deben usar la dosis más baja y la duración más corta de la terapia con IBP apropiada para la afección que se está tratando.
Fractura de hueso
Varios estudios observacionales publicados sugieren que la terapia con inhibidores de la bomba de protones (IBP) puede estar asociada con un mayor riesgo de fracturas de cadera, muñeca o columna vertebral relacionadas con la osteoporosis. El riesgo de fractura aumentó en pacientes que recibieron dosis altas, definidas como múltiples dosis diarias, y terapia con IBP a largo plazo (un año o más). Los pacientes deben usar la dosis más baja y la duración más corta de la terapia con IBP apropiada para la afección que se está tratando. Los pacientes con riesgo de fracturas relacionadas con la osteoporosis deben ser tratados de acuerdo con las pautas de tratamiento establecidas [ver DOSIFICACIÓN Y ADMINISTRACIÓN , REACCIONES ADVERSAS ].
Reacciones adversas cutáneas graves
Se han notificado reacciones adversas cutáneas graves, como el síndrome de Stevens-Johnson (SJS) y la necrólisis epidérmica tóxica (TEN), la reacción al fármaco con eosinofilia y síntomas sistémicos (DRESS) y la pustulosis exantemática aguda generalizada (PEGA) en asociación con el uso de IBP. [ver REACCIONES ADVERSAS ]. Interrumpa NEXIUM IV ante los primeros signos o síntomas de reacciones adversas cutáneas graves u otros signos de hipersensibilidad y considere una evaluación adicional.
Lupus Eritematoso Cutáneo Y Sistémico
Se han notificado casos de lupus eritematoso cutáneo (CLE) y lupus eritematoso sistémico (LES) en pacientes que toman IBP, incluido esomeprazol. Estos eventos han ocurrido como un nuevo inicio y una exacerbación de la enfermedad autoinmune existente. La mayoría de los casos de lupus eritematoso inducido por PPI fueron LEC.
La forma más común de LEC notificada en pacientes tratados con IBP fue la LEC subaguda (SCLE) y se produjo semanas o años después de la terapia farmacológica continua en pacientes que iban desde bebés hasta ancianos. En general, los hallazgos histológicos se observaron sin afectación de órganos.
El lupus eritematoso sistémico (LES) se notifica con menos frecuencia que el LEC en pacientes que reciben IBP. El LES asociado con IBP suele ser más leve que el LES no inducido por fármacos. El inicio del LES generalmente ocurre dentro de los días o años después de iniciar el tratamiento, principalmente en pacientes que van desde adultos jóvenes hasta ancianos. La mayoría de los pacientes presentaron erupción cutánea; sin embargo, también se informaron artralgia y citopenia.
Evitar la administración de IBP por más tiempo del indicado médicamente. Si se observan signos o síntomas compatibles con CLE o SLE en pacientes que reciben NEXIUM 20 mg IV, suspenda el medicamento y remita al paciente al especialista adecuado para su evaluación. La mayoría de los pacientes mejoran con la interrupción del PPI solo en 4 a 12 semanas. Las pruebas serológicas (p. ej., ANA) pueden ser positivas y los resultados elevados de las pruebas serológicas pueden tardar más en resolverse que las manifestaciones clínicas.
Interacción con clopidogrel
Evite el uso concomitante de NEXIUM IV con clopidogrel. El clopidogrel es un profármaco. La inhibición de la agregación plaquetaria por clopidogrel se debe enteramente a un metabolito activo. El metabolismo de clopidogrel a su metabolito activo puede verse afectado por el uso con medicamentos concomitantes, como esomeprazol, que inhiben la actividad de CYP2C19. El uso concomitante de clopidogrel con 40 mg de esomeprazol reduce la actividad farmacológica de clopidogrel. Cuando use NEXIUM IV, considere una terapia antiplaquetaria alternativa [ver INTERACCIONES CON LA DROGAS ].
Hipomagnesemia y metabolismo mineral
Raramente se ha informado hipomagnesemia, sintomática y asintomática, en pacientes tratados con IBP durante al menos tres meses, en la mayoría de los casos después de un año de terapia. Los eventos adversos graves incluyen tetania, arritmias y convulsiones. La hipomagnesemia puede provocar hipocalcemia y/o hipopotasemia y puede exacerbar la hipocalcemia subyacente en pacientes de riesgo. En la mayoría de los pacientes, el tratamiento de la hipomagnesemia requirió la reposición de magnesio y la interrupción del PPI.
Para los pacientes que se espera que reciban un tratamiento prolongado o que toman IBP con medicamentos como digoxina o medicamentos que pueden causar hipomagnesemia (p. ej., diuréticos), los profesionales de la salud pueden considerar monitorear los niveles de magnesio antes de iniciar el tratamiento con IBP y periódicamente [ver REACCIONES ADVERSAS ].
Considere monitorear los niveles de magnesio y calcio antes de iniciar NEXIUM IV y periódicamente durante el tratamiento en pacientes con un riesgo preexistente de hipocalcemia (p. ej., hipoparatiroidismo). Suplementar con magnesio y/o calcio, según sea necesario. Si la hipocalcemia es refractaria al tratamiento, considere suspender el IBP.
Interacción con hierba de San Juan o rifampicina
Los medicamentos que inducen CYP2C19 o CYP3A4 (como la hierba de San Juan o la rifampicina) pueden disminuir sustancialmente las concentraciones de esomeprazol [ver INTERACCIONES CON LA DROGAS ]. Evite el uso concomitante de NEXIUM 40 mg IV con hierba de San Juan o rifampicina.
Interacciones con investigaciones diagnósticas de tumores neuroendocrinos
Los niveles séricos de cromogranina A (CgA) aumentan como consecuencia de la disminución de la acidez gástrica inducida por fármacos. El aumento del nivel de CgA puede causar resultados falsos positivos en las investigaciones de diagnóstico de tumores neuroendocrinos. Los proveedores de atención médica deben suspender temporalmente el tratamiento con esomeprazol al menos 14 días antes de evaluar los niveles de CgA y considerar repetir la prueba si los niveles iniciales de CgA son altos. Si se realizan pruebas en serie (p. ej., para el control), se debe usar el mismo laboratorio comercial para las pruebas, ya que los rangos de referencia entre las pruebas pueden variar [ver INTERACCIONES CON LA DROGAS ].
Interacción con metotrexato
La literatura sugiere que el uso concomitante de PPI con metotrexato (principalmente en dosis altas; consulte la información de prescripción de metotrexato) puede elevar y prolongar los niveles séricos de metotrexato y/o su metabolito, lo que posiblemente provoque toxicidad por metotrexato. En la administración de dosis altas de metotrexato, en algunos pacientes se puede considerar la suspensión temporal del IBP [ver INTERACCIONES CON LA DROGAS ].
Pólipos de las glándulas fúndicas
El uso de PPI se asocia con un mayor riesgo de pólipos en las glándulas fúndicas que aumenta con el uso a largo plazo, especialmente más allá de un año. La mayoría de los usuarios de PPI que desarrollaron pólipos en las glándulas fúndicas eran asintomáticos y los pólipos en las glándulas fúndicas se identificaron incidentalmente en la endoscopia. Use la duración más corta de la terapia con PPI apropiada para la afección que se está tratando.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
El potencial carcinogénico de esomeprazol se evaluó mediante estudios de omeprazol. En dos estudios de carcinogenicidad oral de 24 meses en ratas, omeprazol en dosis diarias de 1,7, 3,4, 13,8, 44,0 y 140,8 mg/kg/día (alrededor de 0,4 a 34 veces la dosis humana de 40 mg/día expresada en una superficie corporal). base de área) produjo carcinoides de células ECL gástricas de una manera relacionada con la dosis en ratas macho y hembra; la incidencia de este efecto fue notablemente mayor en las ratas hembra, que tenían niveles sanguíneos más altos de omeprazol. Los carcinoides gástricos rara vez ocurren en ratas no tratadas. Además, la hiperplasia de células ECL estuvo presente en todos los grupos tratados de ambos sexos. En uno de estos estudios, se trató a ratas hembra con 13,8 mg de omeprazol/kg/día (alrededor de 3,4 veces la dosis humana de 40 mg/día sobre la base del área de superficie corporal) durante 1 año, luego se les dio seguimiento durante un año adicional sin el fármaco. . No se observaron carcinoides en estas ratas. Se observó una mayor incidencia de hiperplasia de células ECL relacionada con el tratamiento al final de 1 año (94 % de los tratados frente al 10 % de los controles). Al segundo año, la diferencia entre las ratas tratadas y las de control era mucho menor (46 % frente a 26 %), pero aún mostraba más hiperplasia en el grupo tratado. Se observó adenocarcinoma gástrico en una rata (2%). No se observó un tumor similar en ratas macho o hembra tratadas durante 2 años. Históricamente, para esta cepa de rata no se ha observado un tumor similar, pero un hallazgo que involucre un solo tumor es difícil de interpretar. Un estudio de carcinogenicidad oral en ratones de 78 semanas de omeprazol no mostró una mayor aparición de tumores, pero el estudio no fue concluyente.
El esomeprazol fue negativo en la prueba de mutación de Ames, en la prueba de aberración cromosómica de células de médula ósea de rata in vivo y en la prueba de micronúcleo de ratón in vivo. Esomeprazol, sin embargo, dio positivo en la prueba de aberraciones cromosómicas de linfocitos humanos in vitro. El omeprazol fue positivo en la prueba de aberración cromosómica de linfocitos humanos in vitro, la prueba de aberración cromosómica de células de médula ósea de ratón in vivo y la prueba de micronúcleo de ratón in vivo.
Los efectos potenciales de esomeprazol sobre la fertilidad y el rendimiento reproductivo se evaluaron mediante estudios de omeprazol. Se encontró que el omeprazol en dosis orales de hasta 138 mg/kg/día en ratas (alrededor de 34 veces la dosis humana de 40 mg/día sobre la base del área de superficie corporal) no tiene efecto sobre el desempeño reproductivo de los animales parentales.
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
No existen estudios adecuados y bien controlados con esomeprazol en mujeres embarazadas. El esomeprazol es el isómero s del omeprazol. Los datos epidemiológicos disponibles no demuestran un mayor riesgo de malformaciones congénitas mayores u otros resultados adversos del embarazo con el uso de omeprazol en el primer trimestre. Los estudios de reproducción en ratas y conejos dieron como resultado embriones letales dependientes de la dosis a dosis de omeprazol que eran aproximadamente 3,4 a 34 veces la dosis humana oral de 40 mg (basada en el área de superficie corporal para una persona de 60 kg).
No se observó teratogenicidad en estudios de reproducción animal con la administración oral de esomeprazol magnésico en ratas y conejos con dosis de aproximadamente 68 veces y 42 veces, respectivamente, una dosis humana oral de 40 mg (basado en el área de superficie corporal para una persona de 60 kg) . Se observaron cambios en la morfología ósea en crías de ratas que recibieron dosis durante la mayor parte del embarazo y la lactancia en dosis iguales o superiores a aproximadamente 34 veces la dosis humana oral de 40 mg. Cuando la administración materna se limitó únicamente a la gestación, no hubo efectos sobre la morfología fisaria ósea en la descendencia a ninguna edad (ver Datos ).
Se desconocen los riesgos de fondo estimados de defectos congénitos importantes y abortos espontáneos para la población indicada. Todos los embarazos tienen un riesgo de fondo de defecto congénito, pérdida u otros resultados adversos. En la población general de EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 % al 4 % y del 15 % al 20 %, respectivamente.
Datos
Datos humanos
El esomeprazol es el isómero S del omeprazol. Cuatro estudios epidemiológicos compararon la frecuencia de anomalías congénitas en bebés nacidos de mujeres que usaron omeprazol durante el embarazo con la frecuencia de anomalías en bebés de mujeres expuestas a antagonistas de los receptores H2 u otros controles.
Un estudio epidemiológico de cohorte retrospectivo basado en la población del Registro Médico Sueco de Nacimientos, que cubrió aproximadamente el 99% de los embarazos, de 1995 a 1999, informó sobre 955 bebés (824 expuestos durante el primer trimestre con 39 de estos expuestos más allá del primer trimestre y 131 expuestos después del primer trimestre). el primer trimestre) cuyas madres usaron omeprazol durante el embarazo. El número de lactantes expuestos en el útero al omeprazol que tuvieron alguna malformación, bajo peso al nacer, bajo puntaje de Apgar u hospitalización fue similar al número observado en esta población. El número de bebés que nacieron con defectos del tabique ventricular y el número de bebés que nacieron muertos fue ligeramente mayor en los bebés expuestos al omeprazol que el número esperado en esta población.

Un estudio de cohorte retrospectivo basado en la población que abarcó todos los nacidos vivos en Dinamarca desde 1996 hasta 2009, informó sobre 1800 nacidos vivos cuyas madres usaron omeprazol durante el primer trimestre del embarazo y 837 317 nacidos vivos cuyas madres no usaron ningún inhibidor de la bomba de protones. La tasa general de defectos de nacimiento en bebés nacidos de madres expuestas al omeprazol en el primer trimestre fue del 2,9 % y del 2,6 % en bebés nacidos de madres que no estuvieron expuestas a ningún inhibidor de la bomba de protones durante el primer trimestre.
Un estudio de cohorte retrospectivo informó sobre 689 mujeres embarazadas expuestas a bloqueadores H2 u omeprazol en el primer trimestre (134 expuestas a omeprazol) y 1572 mujeres embarazadas no expuestas a ninguno de los dos durante el primer trimestre. La tasa general de malformaciones en los hijos de madres expuestas en el primer trimestre al omeprazol, un bloqueador H2, o no expuestas, fue del 3,6 %, 5,5 % y 4,1 %, respectivamente.
Un pequeño estudio prospectivo observacional de cohortes siguió a 113 mujeres expuestas a omeprazol durante el embarazo (89 % con exposiciones en el primer trimestre). La tasa notificada de malformaciones congénitas importantes fue del 4 % en el grupo de omeprazol, del 2 % en los controles expuestos a no teratógenos y del 2,8 % en los controles pareados de enfermedades. Las tasas de abortos espontáneos y electivos, partos prematuros, edad gestacional al momento del parto y peso medio al nacer fueron similares entre los grupos.
Varios estudios no informaron efectos adversos aparentes a corto plazo en el lactante cuando se administró una dosis única de omeprazol por vía oral o intravenosa a más de 200 mujeres embarazadas como premedicación para la cesárea bajo anestesia general.
Datos de animales
omeprazol
Estudios reproductivos realizados con omeprazol en ratas en dosis orales de hasta 138 mg/kg/día (alrededor de 34 veces una dosis humana oral de 40 mg sobre la base del área de superficie corporal) y en conejos en dosis de hasta 69,1 mg/kg/día ( aproximadamente 34 veces una dosis humana oral de 40 mg sobre la base del área de superficie corporal) durante la organogénesis no reveló ninguna evidencia de un potencial teratogénico de omeprazol. En conejos, el omeprazol en un rango de dosis de 6,9 a 69,1 mg/kg/día (alrededor de 3,4 a 34 veces una dosis humana oral de 40 mg sobre la base del área de superficie corporal) administrado durante la organogénesis produjo aumentos relacionados con la dosis en la letalidad embrionaria, reabsorciones fetales e interrupciones del embarazo. En ratas, se observó toxicidad embrionaria/fetal relacionada con la dosis y toxicidad del desarrollo posnatal en las crías de padres tratados con omeprazol a 13,8 a 138,0 mg/kg/día (alrededor de 3,4 a 34 veces la dosis humana oral de 40 mg en una superficie corporal). base de área), administrado antes del apareamiento durante el período de lactancia.
esomeprazol
No se observaron efectos sobre el desarrollo embriofetal en estudios de reproducción con esomeprazol magnésico en ratas a dosis orales de hasta 280 mg/kg/día (alrededor de 68 veces la dosis humana oral de 40 mg sobre la base del área de superficie corporal) o en conejos a dosis orales de hasta 280 mg/kg/día. dosis orales de hasta 86 mg/kg/día (alrededor de 41 veces la dosis humana en base al área de superficie corporal) administradas durante la organogénesis.
Se realizó un estudio de toxicidad en el desarrollo pre y posnatal en ratas con criterios de valoración adicionales para evaluar el desarrollo óseo con esomeprazol magnésico en dosis orales de 14 a 280 mg/kg/día (alrededor de 3,4 a 68 veces una dosis humana oral de 40 mg en un organismo). base de la superficie). La supervivencia neonatal/posnatal temprana (desde el nacimiento hasta el destete) disminuyó con dosis iguales o superiores a 138 mg/kg/día (alrededor de 34 veces una dosis humana oral de 40 mg sobre la base del área de superficie corporal). El peso corporal y la ganancia de peso corporal se redujeron y los retrasos neuroconductuales o del desarrollo general en el período de tiempo inmediatamente posterior al destete fueron evidentes con dosis iguales o superiores a 69 mg/kg/día (alrededor de 17 veces una dosis humana oral de 40 mg en un cuerpo). base de la superficie). Además, se observaron disminución de la longitud del fémur, del ancho y del grosor del hueso cortical, disminución del grosor de la placa de crecimiento tibial e hipocelularidad de mínima a leve de la médula ósea a dosis iguales o superiores a 14 mg/kg/día (alrededor de 3,4 veces una dosis humana oral). dosis de 40 mg sobre la base del área de superficie corporal). Se observó displasia fisaria en el fémur en crías de ratas tratadas con dosis orales de esomeprazol magnésico en dosis iguales o superiores a 138 mg/kg/día (alrededor de 34 veces una dosis humana oral de 40 mg sobre la base del área de superficie corporal).
Se observaron efectos sobre los huesos maternos en ratas preñadas y lactantes en un estudio de toxicidad pre y posnatal cuando se administró esomeprazol magnésico en dosis orales de 14 a 280 mg/kg/día (alrededor de 3,4 a 68 veces una dosis humana oral de 40 mg en una base de área de superficie corporal). Cuando se administró la dosis a las ratas desde el día 7 de gestación hasta el destete el día 21 posnatal, se observó una disminución estadísticamente significativa en el peso del fémur materno de hasta un 14 % (en comparación con el tratamiento con placebo) con dosis iguales o superiores a 138 mg/kg/día. (alrededor de 34 veces una dosis humana oral de 40 mg en base al área de superficie corporal).
Un estudio de desarrollo pre y posnatal en ratas con esomeprazol estroncio (utilizando dosis equimolares en comparación con el estudio de esomeprazol magnésico) produjo resultados similares en madres y cachorros como se describe anteriormente.
Se realizó un estudio de toxicidad del desarrollo de seguimiento en ratas con puntos de tiempo adicionales para evaluar el desarrollo óseo de las crías desde el día 2 postnatal hasta la edad adulta con esomeprazol magnésico en dosis orales de 280 mg/kg/día (alrededor de 68 veces una dosis humana oral de 40 mg al día). una base de área de superficie corporal) donde la administración de esomeprazol fue desde el día 7 de gestación o el día 16 de gestación hasta el parto. Cuando la administración materna se limitó únicamente a la gestación, no hubo efectos sobre la morfología fisaria ósea en la descendencia a ninguna edad.
Lactancia
Resumen de riesgos
El esomeprazol es el isómero S del omeprazol y los datos limitados sugieren que el omeprazol puede estar presente en la leche humana. No existen datos clínicos sobre los efectos de esomeprazol en el lactante o en la producción de leche. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de la madre de NEXIUM 20 mg y cualquier posible efecto adverso en el bebé amamantado debido a NEXIUM oa la afección materna subyacente.
Uso pediátrico
Se ha establecido la seguridad y eficacia de NEXIUM 20 mg IV en pacientes pediátricos de 1 mes a 17 años de edad para el tratamiento a corto plazo de la ERGE con EE, como alternativa a la terapia oral cuando NEXIUM 40 mg oral no es posible o apropiado.
El uso de NEXIUM 40 mg IV en este grupo de edad se basa en la extrapolación de la eficacia de los adultos a los niños y la selección de la dosis se basa en la comparación de la exposición de los pediátricos con los adultos respaldada por la siguiente evidencia: a) los resultados observados en un estudio farmacocinético (PK) en NEXIUM 20 mg IV para inyección en pacientes pediátricos, b) predicciones de un modelo farmacocinético poblacional que compara datos farmacocinéticos intravenosos entre pacientes adultos y pediátricos, y c) relación entre la exposición y los resultados farmacodinámicos obtenidos a partir de datos orales pediátricos e intravenosos de adultos y d) resultados farmacocinéticos de estudios adecuados y bien controlados que apoyaron la aprobación de NEXIUM 40 mg IV en adultos [ver REACCIONES ADVERSAS , FARMACOLOGÍA CLÍNICA , Estudios clínicos ].
No se ha establecido la seguridad y eficacia de NEXIUM IV en pacientes menores de 1 mes de edad para el tratamiento de la ERGE con EE o para la reducción del riesgo de resangrado de úlcera gástrica o duodenal después de una endoscopia terapéutica.
Datos de animales juveniles
En un estudio de toxicidad en ratas jóvenes, se administró esomeprazol con sales de magnesio y estroncio en dosis orales de aproximadamente 34 a 68 veces la dosis humana diaria de 40 mg según el área de superficie corporal. Se observaron aumentos en la muerte con la dosis alta, y en todas las dosis de esomeprazol, hubo disminuciones en el peso corporal, aumento de peso corporal, peso y longitud del fémur, y disminuciones en el crecimiento general [ver Toxicología no clínica ].
Uso geriátrico
En un ensayo clínico de pacientes con úlceras gástricas o duodenales sangrantes, el 52 % de los 375 pacientes asignados al azar a NEXIUM IV tenían 65 años o más. No se observaron diferencias generales en la seguridad y la eficacia entre los ancianos y las personas más jóvenes, y otra experiencia clínica informada con NEXIUM 40 mg IV y esomeprazol oral no ha identificado diferencias en las respuestas entre los ancianos y los pacientes más jóvenes, pero no se puede determinar una mayor sensibilidad de algunas personas mayores. descartado
Deterioro hepático
ERGE con EE
La exposición a esomeprazol aumentó sustancialmente en pacientes con insuficiencia hepática grave (Child-Pugh Clase C), pero no en pacientes con insuficiencia hepática de leve a moderada (Child-Pugh Clases A y B) en comparación con pacientes con función hepática normal [ver FARMACOLOGÍA CLÍNICA ].
Para pacientes adultos, no es necesario ajustar la dosis para insuficiencia hepática de leve a moderada. Para pacientes con insuficiencia hepática grave, la dosis máxima recomendada es de 20 mg una vez al día [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Reducción del riesgo de resangrado de úlceras gástricas o duodenales después de una endoscopia terapéutica
No hay datos farmacocinéticos disponibles para NEXIUM 20 mg IV administrado como administración intravenosa continua en pacientes con insuficiencia hepática. La exposición al omeprazol intravenoso, del cual esomeprazol es un enantiómero, aumentó en pacientes con todos los grados de insuficiencia hepática en comparación con sujetos con función hepática normal [ver FARMACOLOGÍA CLÍNICA ].
Para pacientes adultos, no es necesario ajustar la dosis de carga inicial de NEXIUM IV 80 mg para pacientes con cualquier grado de insuficiencia hepática. Reduzca la velocidad de la infusión continua a 6 mg/hora para pacientes con insuficiencia hepática de leve a moderada (Child-Pugh Clases A y B) y a 4 mg/hora para pacientes con insuficiencia hepática grave (Child-Pugh Clase C) [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
SOBREDOSIS
Los síntomas descritos en relación con la sobredosis deliberada de NEXIUM 40 mg (experiencia limitada de dosis superiores a 240 mg/día) son transitorios. Los informes de sobredosis con omeprazol en humanos también pueden ser relevantes. Las dosis variaron hasta 2400 mg (120 veces la dosis clínica habitual recomendada). Las manifestaciones fueron variables, pero incluyeron confusión, somnolencia, visión borrosa, taquicardia, náuseas, diaforesis, sofocos, dolor de cabeza, sequedad de boca y otras reacciones adversas similares a las observadas con las dosis recomendadas. Consulte la información de prescripción completa del omeprazol oral para obtener información de seguridad completa. No se conoce un antídoto específico para esomeprazol. Dado que el esomeprazol se une ampliamente a las proteínas, no se espera que se elimine mediante diálisis. En caso de sobredosis, el tratamiento debe ser sintomático y de soporte.
Si ocurre una sobreexposición, llame a su Centro de control de envenenamiento al 1-800-222-1222 para obtener información actualizada sobre el manejo del envenenamiento o la sobredosis.
CONTRAINDICACIONES
- NEXIUM 20 mg IV está contraindicado en pacientes con hipersensibilidad conocida a los benzimidazoles sustituidos o a cualquier componente de la formulación. Las reacciones de hipersensibilidad pueden incluir anafilaxia, shock anafiláctico, angioedema, broncoespasmo, nefritis tubulointersticial aguda y urticaria [ver ADVERTENCIAS Y PRECAUCIONES , REACCIONES ADVERSAS ].
- Los inhibidores de la bomba de protones (IBP), incluido NEXIUM 20 mg IV, están contraindicados en pacientes que reciben productos que contienen rilpivirina [ver INTERACCIONES CON LA DROGAS ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
El esomeprazol pertenece a una clase de compuestos antisecretores, los benzimidazoles sustituidos, que suprimen la secreción de ácido gástrico mediante la inhibición específica del sistema enzimático H+/K+ ATPasa en la superficie secretora de la célula parietal gástrica. El esomeprazol es protonado y convertido en el compartimento ácido de la célula parietal formando el inhibidor activo, la sulfenamida aquiral. Debido a que este sistema enzimático se considera la bomba de ácido (protones) dentro de la mucosa gástrica, el esomeprazol se ha caracterizado como un inhibidor de la bomba de ácido gástrico, ya que bloquea el paso final de la producción de ácido. Este efecto está relacionado con la dosis y conduce a la inhibición de la secreción de ácido tanto basal como estimulada, independientemente del estímulo.
Farmacodinámica
Actividad antisecretora
El efecto de esomeprazol en el pH intragástrico de 24 horas en sujetos sanos se evaluó en dos estudios de 20 mg y 40 mg de NEXIUM 20 mg IV infundidos por vía intravenosa una vez al día durante 30 minutos durante 5 días, como se muestra en la Tabla 7.
Los efectos de esomeprazol en el pH intragástrico de 24 horas después de la administración de una infusión intravenosa de 80 mg de NEXIUM.IV durante 30 minutos seguida de una infusión continua de 8 mg/hora durante 23,5 horas se evaluaron en dos estudios.
En sujetos caucásicos sanos negativos para H. pylori (n = 24), el % de tiempo durante 24 horas (IC del 95 %) cuando el pH intragástrico era > 6 y > 7 fue del 52,3 % (40,3, 64,4) y del 4,8 % (1,8, 7.8), respectivamente.
En sujetos chinos sanos positivos para H. pylori (n = 8) y negativos para H. pylori (n = 11), el % de tiempo durante 24 horas (IC del 95 %) cuando el pH intragástrico fue > 6 y > 7 fue del 53 % ( 45,6, 60,3) y 15,1% (9,5, 20,7). El porcentaje de tiempo con pH intragástrico > 6 [59 % frente a 47 %] y con pH > 7 [17 % frente a 11 %] tendió a ser mayor en los sujetos positivos para H. pylori en comparación con los sujetos negativos para H. pylori.
Efectos de la gastrina sérica
El efecto de esomeprazol sobre las concentraciones séricas de gastrina se evaluó en aproximadamente 2700 pacientes en ensayos clínicos de esomeprazol oral durante un máximo de 8 semanas y en más de 1300 pacientes tratados durante un máximo de 12 meses. El nivel medio de gastrina en ayunas aumentó de forma relacionada con la dosis. El aumento en las concentraciones séricas de gastrina alcanzó una meseta dentro de los dos o tres meses posteriores a la terapia y volvió a los niveles iniciales dentro de las cuatro semanas posteriores a la interrupción de la terapia.
El aumento de la gastrina causa hiperplasia de células similares a las enterocromafines y aumenta los niveles séricos de cromogranina A (CgA). Los niveles elevados de CgA pueden causar resultados falsos positivos en las investigaciones diagnósticas de tumores neuroendocrinos [ver ADVERTENCIAS Y PRECAUCIONES ].
Efectos de las células similares a las enterocromafines (ECL)
No hay datos disponibles sobre los efectos del esomeprazol intravenoso en las células ECL.
Se han obtenido muestras de biopsias gástricas humanas de más de 3000 pacientes (tanto niños como adultos) tratados por vía oral con omeprazol en ensayos clínicos a largo plazo. La incidencia de hiperplasia de células ECL en estos estudios aumentó con el tiempo; sin embargo, no se ha encontrado ningún caso de carcinoides, displasia o neoplasia de células ECL en estos pacientes [ver Toxicología no clínica ].
En más de 1000 pacientes tratados con esomeprazol oral (10 mg, 20 mg o 40 mg/día) durante un máximo de 12 meses, la prevalencia de hiperplasia de células ECL aumentó con el tiempo y la dosis. Ningún paciente desarrolló carcinoides de células ECL, displasia o neoplasia en la mucosa gástrica.
Efectos endocrinos
El esomeprazol no tuvo efecto sobre la función tiroidea cuando se administró en dosis orales de 20 mg o 40 mg durante 4 semanas. Se evaluaron otros efectos del esomeprazol en el sistema endocrino en estudios de omeprazol. Las dosis orales de omeprazol de 30 mg o 40 mg por día durante 2 a 4 semanas no tuvieron efecto sobre el metabolismo de los carbohidratos, los niveles circulantes de hormona paratiroidea, cortisol, estradiol, testosterona, prolactina, colecistoquinina o secretina.
Farmacocinética
Absorción
La farmacocinética de esomeprazol en sujetos sanos luego de la administración de NEXIUM IV 20 mg y 40 mg una vez al día como infusión intravenosa durante 30 minutos durante 5 días se muestra en la Tabla 8.
Luego de la administración intravenosa de NEXIUM 40 mg IV en 24 sujetos sanos como una dosis de carga de 80 mg durante 30 minutos seguida de una infusión continua de 8 mg/hora durante 23,5 horas (para un total de 24 horas), los parámetros farmacocinéticos de esomeprazol [valor medio geométrico (IC del 95 %)] fueron los siguientes: AUCt 111,1 micromol*h/L (100,5, 122,7 micromol*h/L), Cmax 15,0 micromol/L (13,5, 16,6 micromol/L) y concentración plasmática en estado estacionario (Css) 3,9 micromol/L (3,5, 4,5 micromol/L). En otro estudio de sujetos caucásicos sanos se administró el mismo régimen de tratamiento.
El esomeprazol es un inhibidor dependiente del tiempo de CYP2C19, lo que da como resultado una autoinhibición y una farmacocinética no lineal. La exposición sistémica aumenta de manera más que proporcional a la dosis después de múltiples dosis orales de esomeprazol. En comparación con la primera dosis, la exposición sistémica (Cmax y AUC0-24h) en el estado estacionario después de la administración una vez al día aumentó un 43 % y un 90 %, respectivamente, en comparación con la primera dosis de 20 mg y aumentó un 95 % y 159%, respectivamente, para la dosis de 40 mg.
Distribución
El esomeprazol se une en un 97% a las proteínas plasmáticas. La unión a proteínas plasmáticas es constante en el rango de concentración de 2 a 20 micromol/L. El volumen aparente de distribución en estado estacionario en sujetos sanos es de aproximadamente 16 L.
Eliminación
Metabolismo
El esomeprazol se metaboliza ampliamente en el hígado por el sistema enzimático del citocromo P450 (CYP). Los metabolitos de esomeprazol carecen de actividad antisecretora. La mayor parte del metabolismo de esomeprazol depende de la isoenzima CYP2C19, que forma los metabolitos hidroxi y desmetilado. La cantidad restante depende de CYP3A4 que forma el metabolito sulfona.
Excreción
El esomeprazol se excreta como metabolitos principalmente en la orina pero también en las heces. Menos del 1% del fármaco original se excreta en la orina. El esomeprazol se elimina completamente del plasma y no se acumula durante la administración una vez al día. La vida media de eliminación plasmática de esomeprazol después de la administración intravenosa de NEXIUM IV es de aproximadamente 1,1 a 1,4 horas y se prolonga con dosis crecientes.
El aclaramiento plasmático (CL) es de aproximadamente 5,9 a 7,2 L/h durante la administración de NEXIUM 40 mg IV como una infusión intravenosa de 80 mg durante 30 minutos seguida de una infusión continua de 8 mg/hora durante 23,5 horas.
Poblaciones Específicas
Pacientes geriátricos
Los valores de AUC y Cmax de esomeprazol fueron ligeramente superiores (25 % y 18 %, respectivamente) en los ancianos en comparación con los sujetos más jóvenes en estado estacionario. Este aumento en la exposición no se considera clínicamente relevante.
Pacientes pediátricos
La farmacocinética de esomeprazol se evaluó en 50 pacientes pediátricos desde el nacimiento hasta los 17 años de edad inclusive (de los cuales 44 pacientes pediátricos tenían entre 1 mes y 17 años) en un estudio aleatorizado, abierto, multinacional y de dosis múltiples de 20 mg de NEXIUM 40 mg IV administrados como una inyección intravenosa de 3 minutos una vez al día. Los valores de AUC de esomeprazol en plasma fueron un 183 % y un 60 % más altos en pacientes pediátricos de 6 a 11 años y de 12 a 17 años, respectivamente, en comparación con los adultos.
Los análisis farmacocinéticos posteriores predijeron que los siguientes regímenes de dosificación lograrían exposiciones plasmáticas en estado estacionario comparables (AUC0-24) a las observadas en pacientes adultos que recibieron 20 mg de NEXIUM IV una vez al día: 0,5 mg/kg una vez al día para pacientes pediátricos de 1 mes a 11 meses de edad, 10 mg una vez al día para pacientes pediátricos de 1 año a 17 años con peso corporal inferior a 55 kg, y 20 mg una vez al día para pacientes pediátricos de 1 año a 17 años con peso corporal de 55 kg o más. Se predijo que el aumento de la duración de la infusión de 3 minutos a 10 minutos o 30 minutos produciría valores de Cmax en estado estacionario comparables a los observados en pacientes adultos con las dosis de 40 mg y 20 mg de NEXIUM IV, respectivamente [ver Uso en poblaciones específicas ].
Pacientes masculinos y femeninos
Los valores de AUC y Cmax de esomeprazol fueron ligeramente superiores (13 %) en mujeres que en hombres en estado estacionario cuando se administró por vía oral. Se han observado diferencias similares para la administración intravenosa de esomeprazol. Este aumento en la exposición no se considera clínicamente relevante.
Pacientes con insuficiencia renal
No se espera que la farmacocinética de esomeprazol en pacientes con insuficiencia renal se altere en relación con los sujetos sanos, ya que menos del 1 % de esomeprazol se excreta sin cambios en la orina.
Pacientes con insuficiencia hepática
La farmacocinética en estado estacionario de esomeprazol obtenida después de la administración de 40 mg por vía oral una vez al día a 4 pacientes con insuficiencia hepática leve (Child-Pugh Clase A), moderada (Child-Pugh Clase B) y grave (Child-Pugh Clase C) fue en comparación con los obtenidos en 36 pacientes con ERGE masculinos y femeninos con función hepática normal. En pacientes con insuficiencia hepática leve y moderada, las AUC estuvieron dentro del rango que podría esperarse en pacientes con función hepática normal. En pacientes con insuficiencia hepática grave, las AUC fueron de 2 a 3 veces más altas que en los pacientes con función hepática normal. [ver Uso en poblaciones específicas ].
No hay datos farmacocinéticos disponibles para esomeprazol administrado como administración intravenosa continua en pacientes con insuficiencia hepática. La farmacocinética de 80 mg de omeprazol intravenoso infundidos durante 30 minutos, seguidos de 8 mg/hora durante 47,5 horas en pacientes con enfermedad leve (Child-Pugh Clase A; n=5), moderada (Child-Pugh Clase B; n=4) y insuficiencia hepática grave (Child-Pugh Clase C; n=3) se compararon con las obtenidas en 24 sujetos sanos masculinos y femeninos. En pacientes con insuficiencia hepática leve y moderada, el aclaramiento de omeprazol y la concentración plasmática en estado estacionario fueron aproximadamente un 35 % más bajos y un 50 % más altos, respectivamente, que en sujetos sanos. En pacientes con insuficiencia hepática grave, la depuración de omeprazol fue del 50% de la de sujetos sanos y la concentración plasmática en estado estacionario fue el doble que en sujetos sanos [ver Uso en poblaciones específicas ].
Estudios de interacción farmacológica
Efecto de esomeprazol/omeprazol sobre otras drogas
Los estudios in vitro e in vivo han demostrado que no es probable que esomeprazol inhiba los CYP 1A2, 2A6, 2C9, 2D6, 2E1 y 3A4.
Antirretrovirales
Para algunos fármacos antirretrovirales, como rilpivirina, atazanavir y nelfinavir, se han notificado concentraciones séricas reducidas cuando se administran junto con omeprazol [ver INTERACCIONES CON LA DROGAS ].
rilpivirina
Después de dosis múltiples de rilpivirina (150 mg, diarios) y omeprazol (20 mg, diarios), el AUC se redujo en un 40 %, la Cmax en un 40 % y la Cmin en un 33 % para rilpivirina [ver CONTRAINDICACIONES ].
nelfinavir
Después de dosis múltiples de nelfinavir (1250 mg, dos veces al día) y omeprazol (40 mg al día), el AUC disminuyó en un 36 % y un 92 %, la Cmax en un 37 % y un 89 % y la Cmin en un 39 % y un 75 % respectivamente para nelfinavir y M8 .
Atazanavir
Luego de múltiples dosis de atazanavir (400 mg diarios) y omeprazol (40 mg diarios, 2 horas antes de atazanavir), el AUC disminuyó en un 94 %, la Cmax en un 96 % y la Cmin en un 95 %.
Saquinavir
Después de dosis múltiples de saquinavir/ritonavir (1000/100 mg) dos veces al día durante 15 días con omeprazol 40 mg diarios coadministrados los días 11 a 15. El AUC aumentó en un 82 %, la Cmax en un 75 % y la Cmin en un 106 %. El mecanismo detrás de esta interacción no está completamente dilucidado.
clopidogrel
En un estudio cruzado, a sujetos sanos se les administró clopidogrel (dosis de carga de 300 mg seguida de 75 mg por día como dosis de mantenimiento durante 28 días) solo y con esomeprazol (40 mg por vía oral una vez al día al mismo tiempo que clopidogrel) durante 29 días. La exposición al metabolito activo de clopidogrel se redujo entre un 35 % y un 40 % durante este período cuando se administraron juntos clopidogrel y esomeprazol. También se midieron los parámetros farmacodinámicos y se demostró que el cambio en la inhibición de la agregación plaquetaria estaba relacionado con el cambio en la exposición al metabolito activo de clopidogrel [ver ADVERTENCIAS Y PRECAUCIONES , INTERACCIONES CON LA DROGAS ].
Micofenolato de mofetilo
La administración de 20 mg de omeprazol dos veces al día durante 4 días y una dosis única de 1000 mg de MMF aproximadamente una hora después de la última dosis de omeprazol a 12 sujetos sanos en un estudio cruzado dio como resultado una reducción del 52 % en la Cmax y una reducción del 23 % en el AUC de MPA [ver INTERACCIONES CON LA DROGAS ].
Cilostazol
El omeprazol actúa como un inhibidor de CYP2C19. El omeprazol, administrado en dosis de 40 mg al día durante una semana a 20 sujetos sanos en un estudio cruzado, aumentó la Cmáx y el AUC de cilostazol en un 18 % y un 26 %, respectivamente. La Cmax y el AUC de uno de los metabolitos activos, 3,4-dihidro-cilostazol, que tiene de 4 a 7 veces la actividad del cilostazol, aumentaron en un 29 % y un 69 %, respectivamente. Se espera que la coadministración de cilostazol con omeprazol aumente las concentraciones de cilostazol y del metabolito activo mencionado anteriormente [ver INTERACCIONES CON LA DROGAS ].
diazepam
La coadministración de 30 mg de esomeprazol y diazepam, un sustrato de CYP2C19, resultó en una disminución del 45 % en el aclaramiento de diazepam. Se observaron niveles plasmáticos elevados de diazepam 12 horas después de la dosificación y en adelante. Sin embargo, en ese momento, los niveles plasmáticos de diazepam estaban por debajo del intervalo terapéutico y, por lo tanto, es poco probable que esta interacción tenga relevancia clínica.
Digoxina
La administración concomitante de omeprazol 20 mg una vez al día y digoxina en sujetos sanos aumentó la biodisponibilidad de digoxina en un 10 % (30 % en dos sujetos) [ver INTERACCIONES CON LA DROGAS ].
Otras drogas
La administración concomitante de esomeprazol y naproxeno (AINE no selectivo) no identificó ningún cambio clínicamente relevante en los perfiles farmacocinéticos de estos AINE.
Efecto de otras drogas sobre esomeprazol/omeprazol
Hierba de San Juan
En un estudio cruzado en 12 sujetos masculinos sanos, la hierba de San Juan (300 mg tres veces al día durante 14 días) disminuyó significativamente la exposición sistémica de omeprazol en los metabolizadores lentos de CYP2C19 (Cmax y AUC disminuyeron en un 37,5 % y 37,9 %, respectivamente) y metabolizadores rápidos (la Cmax y el AUC disminuyeron un 49,6 % y un 43,9 %, respectivamente) [ver INTERACCIONES CON LA DROGAS ].
Voriconazol
La administración concomitante de omeprazol y voriconazol (un inhibidor combinado de CYP2C19 y CYP3A4) resultó en más del doble de la exposición de omeprazol. Cuando se administró voriconazol (400 mg cada 12 horas durante un día, seguido de 200 mg una vez al día durante 6 días) con omeprazol (40 mg una vez al día durante 7 días) a sujetos sanos, la Cmax y el AUC0-24 en estado estacionario de omeprazol aumentó significativamente: un promedio de 2 veces (IC del 90 %: 1,8, 2,6) y 4 veces (IC del 90 %: 3,3, 4,4), respectivamente, en comparación con cuando se administró omeprazol sin voriconazol [ver INTERACCIONES CON LA DROGAS ].
Otras drogas
La coadministración de esomeprazol con anticonceptivos orales, diazepam, fenitoína, quinidina, naproxeno (AINE no selectivo) no pareció cambiar el perfil farmacocinético de esomeprazol.
Microbiología
Efectos sobre la ecología microbiana gastrointestinal
La disminución de la acidez gástrica debido a cualquier medio, incluidos los inhibidores de la bomba de protones, aumenta los recuentos gástricos de bacterias normalmente presentes en el tracto gastrointestinal. El tratamiento con inhibidores de la bomba de protones puede aumentar ligeramente el riesgo de infecciones gastrointestinales como Salmonella y Campylobacter y, en pacientes hospitalizados, posiblemente también Clostridium difficile.
farmacogenómica
CYP2C19, una enzima polimórfica, participa en el metabolismo de esomeprazol. El alelo CYP2C19*1 es completamente funcional mientras que los alelos CYP2C19*2 y *3 no son funcionales. Hay otros alelos asociados con una función enzimática nula o reducida. Los pacientes que portan dos alelos completamente funcionales son metabolizadores rápidos y los que portan dos alelos con pérdida de función son metabolizadores lentos. La exposición sistémica a esomeprazol varía según el estado metabólico del paciente: metabolizadores lentos > metabolizadores intermedios > metabolizadores rápidos. Aproximadamente el 3% de los caucásicos y del 15 al 20% de los asiáticos son metabolizadores lentos de CYP2C19.
Las exposiciones sistémicas a esomeprazol fueron moderadamente más altas (aproximadamente 17 %) en los metabolizadores intermedios de CYP2C19 (IM; n=6) en comparación con los metabolizadores rápidos (EM; n=17) de CYP2C19. Se observaron diferencias farmacocinéticas similares entre estos genotipos en un estudio de sujetos chinos sanos que incluía 7 EM y 11 IM. Hay información farmacocinética muy limitada para los metabolizadores lentos (PM) de estos estudios.
En estado estacionario luego de la administración una vez al día de NEXIUM 40 mg IV 40 mg, la relación entre el AUC en los metabolizadores lentos y el AUC en el resto de la población (EM) es de aproximadamente 1,5. Este cambio en la exposición no se considera clínicamente significativo.
Toxicología Animal Y/o Farmacología
Estudios de Reproducción
Se han realizado estudios de reproducción en ratas con dosis orales de hasta 280 mg/kg/día (alrededor de 68 veces una dosis humana oral de 40 mg sobre la base del área de superficie corporal) y en conejos con dosis orales de hasta 86 mg/kg/día. (alrededor de 42 veces una dosis humana oral de 40 mg en base al área de superficie corporal) y no han revelado evidencia de alteración de la fertilidad o daño al feto debido al esomeprazol [ver Uso en poblaciones específicas ].
Estudio de animales juveniles
Se realizó un estudio de toxicidad de 28 días con una fase de recuperación de 14 días en ratas jóvenes con esomeprazol magnésico en dosis de 70 a 280 mg/kg/día (alrededor de 17 a 68 veces una dosis humana oral diaria de 40 mg en una superficie corporal). base de área). Se observó un aumento en el número de muertes con la dosis alta de 280 mg/kg/día cuando se administró esomeprazol magnésico a ratas jóvenes desde el día 7 posnatal hasta el día 35 posnatal. Además, las dosis iguales o superiores a 140 mg/kg/ día (alrededor de 34 veces una dosis humana oral diaria de 40 mg sobre la base del área de superficie corporal), produjo disminuciones relacionadas con el tratamiento en el peso corporal (aproximadamente 14 %) y el aumento de peso corporal, disminuciones en el peso y la longitud del fémur, y afectó en general crecimiento. En este estudio también se observaron resultados comparables a los descritos anteriormente con otra sal de esomeprazol, esomeprazol estroncio, en dosis equimolares de esomeprazol.
Estudios clínicos
Supresión de ácido en GERD
Se realizaron cuatro estudios cruzados de dos períodos, abiertos y multicéntricos para comparar los efectos farmacodinámicos de esomeprazol luego de la administración intravenosa u oral sobre la supresión ácida en 206 pacientes con síntomas de ERGE con o sin esofagitis erosiva. Los pacientes fueron aleatorizados para recibir 20 o 40 mg de NEXIUM 40 mg IV o esomeprazol oral una vez al día durante 10 días (Período 1), y luego se cambiaron en el Período 2 a la otra formulación durante 10 días, igualando su dosis respectiva del Período 1. NEXIUM 40 mg IV 20 mg y 40 mg se administró como una inyección de 3 minutos en dos de los estudios y como una infusión de 15 minutos en los otros dos estudios.
La población de pacientes osciló entre 18 y 72 años; 54% eran mujeres; 53% caucásico, 24% negro, 5% asiático y 17% de otra raza. La producción de ácido basal (BAO) y la producción de ácido máxima (MAO) se determinaron 22 a 24 horas después de la dosis en el Período 1, Día 11; en el Período 2, Día 3; y en el Período 2, Día 11. BAO y MAO se estimaron a partir de colecciones continuas de contenido gástrico de 1 hora antes y después (respectivamente) de la inyección subcutánea de 6,0 mcg/kg de pentagastrina.
En estos estudios, después de 10 días de administración una vez al día, NEXIUM IV 20 mg y 40 mg fueron similares a la dosis oral correspondiente de esomeprazol en su capacidad para suprimir la BAO y la MAO en estos pacientes con ERGE (consulte la Tabla 9 a continuación).
No hubo cambios importantes en la supresión de ácido al cambiar entre las formas de dosificación intravenosa y oral.
Úlceras gástricas o duodenales sangrantes
Se realizó un estudio clínico aleatorizado, doble ciego, controlado con placebo en 764 pacientes que presentaban hemorragia por úlcera gástrica o duodenal confirmada por endoscopia. La población fue de 18 a 98 años; El 68 % eran hombres, el 87 % caucásicos, el 1 % negros, el 7 % asiáticos y el 4 % de otras razas. Después de la hemostasia endoscópica, los pacientes fueron aleatorizados para recibir placebo o NEXIUM IV 80 mg como una infusión intravenosa durante 30 minutos seguida de una infusión continua de 8 mg/hora durante un total de 72 horas. Después del período inicial de 72 horas, todos los pacientes recibieron un IBP oral durante 27 días. La aparición de nuevas hemorragias dentro de los 3 días posteriores a la aleatorización fue del 5,9 % en el grupo tratado con NEXIUM 20 mg IV en comparación con el 10,3 % en el grupo de placebo (diferencia de tratamiento -4,4 %; intervalo de confianza del 95 %: -8,3 %, -0,6 %; p=0,03 ). Esta diferencia de tratamiento fue similar a la observada en el día 7 y el día 30, durante los cuales todos los pacientes recibieron un IBP oral.
Un estudio aleatorizado, doble ciego, controlado con placebo en un solo centro realizado en Hong Kong también demostró una reducción en comparación con el placebo en el riesgo de nuevas hemorragias dentro de las 72 horas en pacientes con úlceras gástricas o duodenales sangrantes que recibieron omeprazol racémico, el 50 % del cual es el enantiómero S esomeprazol.
INFORMACIÓN DEL PACIENTE
Reacciones adversas
Aconseje a los pacientes que informen a su proveedor de atención médica si experimentan signos o síntomas consistentes con:
- Reacciones de hipersensibilidad [ver CONTRAINDICACIONES ]
- Nefritis tubulointersticial aguda [ver ADVERTENCIAS Y PRECAUCIONES ]
- Diarrea asociada a Clostridium difficile [ver ADVERTENCIAS Y PRECAUCIONES ]
- Fractura ósea [ver ADVERTENCIAS Y PRECAUCIONES ]
- Reacciones adversas cutáneas graves [ver ADVERTENCIAS Y PRECAUCIONES ].
- Lupus eritematoso cutáneo y sistémico [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hipomagnesemia y metabolismo mineral [ver ADVERTENCIAS Y PRECAUCIONES ]
Interacciones con la drogas
Aconseje a los pacientes que informen a su proveedor de atención médica antes de comenzar el tratamiento con cualquiera de los siguientes:
- Productos que contienen rilpivirina [ver CONTRAINDICACIONES ]
- Clopidogrel [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hierba de San Juan o rifampicina [ver ADVERTENCIAS Y PRECAUCIONES ]
- Metotrexato en dosis altas [ver ADVERTENCIAS Y PRECAUCIONES ]
Administración
- Informe a los pacientes que se pueden usar antiácidos mientras toman NEXIUM 40 mg IV
