Proventil 100mcg Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
SOLO PARA INHALACIÓN ORAL
¿Qué es Proventil y cómo se usa?
Proventil es un medicamento recetado que se usa para tratar los síntomas del asma aguda o inducida por el ejercicio (broncoespasmo). Proventil 100mcg se puede usar solo o con otros medicamentos.
Proventil 100mcg pertenece a una clase de medicamentos llamados agonistas beta2.
No se sabe si Proventil es seguro y efectivo en niños menores de 4 años.
¿Cuáles son los posibles efectos secundarios de Proventil?
Proventil puede causar efectos secundarios graves, que incluyen:
- urticaria,
- respiración dificultosa,
- hinchazón de la cara, los labios, la lengua o la garganta,
- sibilancias,
- asfixia
- ,
- otros problemas respiratorios,
- Dolor de pecho,
- frecuencia cardíaca rápida,
- latidos del corazón palpitantes,
- revoloteando en tu pecho,
- dolor de cabeza intenso,
- latidos en el cuello o las orejas,
- dolor o ardor al orinar,
- aumento de la sed,
- aumento de la micción,
- boca seca,
- aliento con olor afrutado,
- calambres en las piernas,
- estreñimiento,
- latidos irregulares del corazón,
- aumento de la sed o la micción,
- entumecimiento u hormigueo, y
- debilidad muscular o sensación de cojera
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Proventil incluyen:
- Dolor de pecho,
- latidos del corazón rápidos o fuertes,
- mareo,
- sentirse tembloroso o nervioso,
- dolor de cabeza,
- dolor de espalda,
- dolor de cuerpo,
- dolor de barriga,
- dolor de garganta,
- dolor en los senos paranasales y
- nariz mocosa o congestionada
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Proventil. Para obtener más información, consulte a su médico o farmacéutico.
DESCRIPCIÓN
El componente activo de PROVENTIL® HFA (sulfato de albuterol) en aerosol para inhalación es sulfato de albuterol, USP racémico α1 [(terc-butilamino)metil]-4-hidroxi-w-xileno-α, α '-diol sulfato (2: l)(sal), un broncodilatador beta2-adrenérgico relativamente selectivo que tiene la siguiente estructura química:
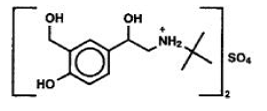
El sulfato de albuterol es el nombre genérico oficial en los Estados Unidos. El nombre recomendado por la Organización Mundial de la Salud para el medicamento es sulfato de salbutamol. El peso molecular del sulfato de albuterol es 576,7 y la fórmula empírica es (C13H21NO3)2*H2SO4. El sulfato de albuterol es un sólido cristalino de color blanco a blanquecino. Es soluble en agua y ligeramente soluble en etanol. PROVENTIL HFA Inhalation Aerosol es una unidad de aerosol de dosis medida presurizada para inhalación oral. Contiene una suspensión microcristalina de sulfato de albuterol en propelente HFA-134a (1,1,1,2-tetrafluoroetano), etanol y ácido oleico.
Cada actuación libera 120 mcg de sulfato de albuterol, USP de la válvula y 108 mcg de sulfato de albuterol, USP de la boquilla (equivalente a 90 mcg de base de albuterol de la boquilla). Cada bote proporciona 200 inhalaciones. Se recomienda cebar el inhalador antes de usarlo por primera vez y en los casos en que el inhalador no se haya usado durante más de 2 semanas, liberando cuatro "pulverizaciones de prueba" en el aire, lejos de la cara.
Este producto no contiene clorofluorocarbonos (CFC) como propelente.
INDICACIONES
PROVENTIL 100mcg HFA Inhalation Aerosol está indicado en adultos y niños a partir de los 4 años de edad para el tratamiento o la prevención del broncoespasmo con enfermedad obstructiva reversible de las vías respiratorias y para la prevención del broncoespasmo inducido por el ejercicio.
DOSIFICACIÓN Y ADMINISTRACIÓN
Para el tratamiento de episodios agudos de broncoespasmo o prevención de síntomas asmáticos, la dosis habitual para adultos y niños mayores de 4 años es de dos inhalaciones repetidas cada 4 a 6 horas. No se recomienda una administración más frecuente ni un mayor número de inhalaciones. En algunos pacientes, una inhalación cada 4 horas puede ser suficiente. Cada actuación de PROVENTIL 100mcg HFA Inhalation Aerosol libera 108 mcg de sulfato de albuterol (equivalente a 90 mcg de base de albuterol) de la boquilla. Se recomienda cebar el inhalador antes de usarlo por primera vez y en los casos en que el inhalador no se haya usado durante más de 2 semanas, liberando cuatro "pulverizaciones de prueba" en el aire, lejos de la cara.
PROVENTIL 100mcg HFA Inhalation Aerosol contiene 200 inhalaciones por bote. El recipiente tiene un indicador de dosis adjunto, que indica cuántas inhalaciones quedan. La pantalla del indicador de dosis se moverá después de cada décima actuación. Cuando se acerca el final de las inhalaciones utilizables, el fondo detrás del número en la ventana de visualización del indicador de dosis cambia a rojo a las 20 activaciones o menos. El aerosol para inhalación PROVENTIL HFA debe desecharse cuando la ventana de visualización del indicador de dosis muestre cero.
Prevención del broncoespasmo inducido por el ejercicio
La dosis habitual para adultos y niños mayores de 4 años es de dos inhalaciones de 15 a 30 minutos antes del ejercicio.
Para mantener un uso adecuado de este producto, es importante que la boquilla se lave y seque minuciosamente al menos una vez a la semana. El inhalador puede dejar de administrar medicamento si no se limpia y seca correctamente (ver INFORMACIÓN DEL PACIENTE ). Mantener la boquilla de plástico limpia es muy importante para evitar la acumulación y el bloqueo del medicamento. El inhalador puede dejar de administrar el medicamento si no se limpia correctamente y se seca completamente al aire. Si la boquilla se bloquea, lavar la boquilla eliminará la obstrucción.
Si un régimen de dosificación previamente eficaz no proporciona la respuesta habitual, esto puede ser un marcador de desestabilización del asma y requiere una reevaluación del paciente y del régimen de tratamiento, prestando especial atención a la posible necesidad de tratamiento antiinflamatorio, por ejemplo, corticosteroides.
CÓMO SUMINISTRADO
PROVENTIL 100 mcg HFA (sulfato de albuterol) Aerosol para inhalación se suministra como un bote de aluminio presurizado con un indicador de dosis adjunto, un actuador de plástico amarillo y una tapa antipolvo naranja, cada uno en cajas de uno. Cada actuación libera 120 mcg de sulfato de albuterol de la válvula y 108 mcg de sulfato de albuterol de la boquilla (equivalente a 90 mcg de base de albuterol). Los botes con un peso neto etiquetado de 6,7 g contienen 200 inhalaciones ( CDN 0085-1132-04).
Almacenar entre 15° - 25°C (59° - 77°F). Guarde el inhalador con la boquilla hacia abajo. Para obtener los mejores resultados, el recipiente debe estar a temperatura ambiente antes de su uso.
AGITAR BIEN ANTES DE USAR.
El actuador amarillo suministrado con el aerosol para inhalación PROVENTIL 100 mcg HFA no debe usarse con ningún otro recipiente de producto, y el actuador de otros productos no debe usarse con un recipiente de aerosol para inhalación PROVENTIL HFA. No se puede garantizar la cantidad correcta de medicamento en cada recipiente después de 200 pulsaciones y cuando la ventana de visualización del indicador de dosis muestra cero, aunque el recipiente no esté completamente vacío. El recipiente debe desecharse cuando se haya utilizado el número de actuaciones indicado en la etiqueta.
ADVERTENCIA: Evite rociar en los ojos. Contenido bajo presión. No perforar ni incinerar. La exposición a temperaturas superiores a los 120 °F puede causar una explosión. Mantener fuera del alcance de los niños.
El aerosol para inhalación PROVENTIL HFA no contiene clorofluorocarbonos (CFC) como propelente.
Fabricado para: Merck Sharp & Dohme Corp, una subsidiaria de MERCK & CO., INC., Whitehouse Station, NJ 08889, EE. UU. Desarrollado y fabricado por: 3M Health Care Limited Loughborough Reino Unido o 3M Drug Delivery Systems Northridge, CA 91324, EE. UU. Revisado: septiembre de 2017
EFECTOS SECUNDARIOS
La información sobre las reacciones adversas relacionadas con PROVENTIL HFA en aerosol para inhalación se deriva de un estudio doble ciego de simulación doble de 12 semanas que comparó PROVENTIL HFA en aerosol para inhalación, un inhalador de albuterol propulsado con CFC 11/12 y un inhalador de placebo HFA-134a en 565 pacientes asmáticos. pacientes La siguiente tabla enumera la incidencia de todos los eventos adversos (ya sea que el investigador los considere relacionados o no con el fármaco) de este estudio que ocurrieron a una tasa del 3 % o más en el grupo de tratamiento con PROVENTIL 100 mcg HFA en aerosol para inhalación y con mayor frecuencia en el PROVENTIL 100 mcg HFA Aerosol de inhalación en el grupo de tratamiento que en el grupo de placebo. En general, la incidencia y la naturaleza de las reacciones adversas notificadas para PROVENTIL 100 mcg HFA Inhalation Aerosol y un inhalador de albuterol propulsado con CFC 11/12 fueron comparables.
Incidencias de experiencias adversas (% de pacientes) en un ensayo clínico grande de 12 semanas*
Los eventos adversos informados por menos del 3 % de los pacientes que recibieron PROVENTIL HFA en aerosol para inhalación, y por una mayor proporción de pacientes con PROVENTIL 100 mcg en aerosol para inhalación HFA que en los pacientes que recibieron placebo, que tienen el potencial de estar relacionados con PROVENTIL 100 mcg en aerosol para inhalación HFA incluyen: disfonía, aumento de la sudoración, sequedad de boca, dolor torácico, edema, escalofríos, ataxia, calambres en las piernas, hipercinesia, eructos, flatulencia, tinnitus, diabetes mellitus, ansiedad, depresión, somnolencia, erupción cutánea. También se han observado palpitaciones y mareos con el aerosol para inhalación PROVENTIL HFA.
Los eventos adversos informados en un ensayo clínico pediátrico de 4 semanas que comparó PROVENTIL 100 mcg HFA Inhalation Aerosol y un inhalador de albuterol propulsado con CFC 11/12 ocurrieron con una tasa de incidencia baja y fueron similares a los observados en los ensayos con adultos.
En pequeños estudios de dosis acumulativa, el temblor, el nerviosismo y el dolor de cabeza parecían estar relacionados con la dosis.
Se han informado casos raros de urticaria, angioedema, erupción cutánea, broncoespasmo y edema orofaríngeo después del uso de albuterol inhalado. Además, el albuterol, al igual que otros agentes simpaticomiméticos, puede causar reacciones adversas como hipertensión, angina, vértigo, estimulación del sistema nervioso central, insomnio, dolor de cabeza, acidosis metabólica y sequedad o irritación de la orofaringe.
INTERACCIONES CON LA DROGAS
Bloqueadores beta
Los bloqueadores de los receptores beta-adrenérgicos no solo bloquean el efecto pulmonar de los beta-agonistas, como PROVENTIL 100 mcg HFA Inhalation Aerosol, sino que también pueden producir broncoespasmo grave en pacientes asmáticos. Por lo tanto, los pacientes con asma normalmente no deben ser tratados con betabloqueantes. Sin embargo, bajo ciertas circunstancias, por ejemplo, como profilaxis después de un infarto de miocardio, puede que no existan alternativas aceptables al uso de agentes bloqueadores beta-adrenérgicos en pacientes con asma. En este contexto, se deben considerar los bloqueadores beta cardioselectivos, aunque deben administrarse con precaución.
diuréticos
Los cambios en el ECG y/o la hipopotasemia que pueden resultar de la administración de diuréticos no ahorradores de potasio (como los diuréticos de asa o tiazídicos) pueden empeorar agudamente con los beta-agonistas, especialmente cuando se excede la dosis recomendada del beta-agonista. Aunque se desconoce la importancia clínica de estos efectos, se recomienda precaución en la coadministración de beta-agonistas con diuréticos no ahorradores de potasio.
Albuterol-Digoxina
Se demostraron disminuciones medias del 16 % y el 22 % en los niveles séricos de digoxina después de la administración intravenosa y oral de dosis única de albuterol, respectivamente, a voluntarios normales que habían recibido digoxina durante 10 días. No está claro el significado clínico de estos hallazgos para los pacientes con enfermedad obstructiva de las vías respiratorias que reciben albuterol y digoxina de forma crónica; sin embargo, sería prudente evaluar cuidadosamente los niveles séricos de digoxina en pacientes que actualmente reciben digoxina y albuterol.
Inhibidores De La Monoamino Oxidasa O Antidepresivos Tricíclicos
El aerosol para inhalación PROVENTIL HFA debe administrarse con extrema precaución a los pacientes que reciben tratamiento con inhibidores de la monoaminooxidasa o antidepresivos tricíclicos, o dentro de las 2 semanas posteriores a la interrupción de dichos agentes, ya que la acción del albuterol en el sistema cardiovascular puede verse potenciada.
ADVERTENCIAS
Broncoespasmo paradójico
El sulfato de albuterol inhalado puede producir broncoespasmo paradójico que puede poner en peligro la vida. Si se produce un broncoespasmo paradójico, se debe interrumpir inmediatamente el uso de PROVENTIL HFA en aerosol para inhalación e instaurar una terapia alternativa. Debe reconocerse que el broncoespasmo paradójico, cuando se asocia con formulaciones inhaladas, ocurre con frecuencia con el primer uso de un recipiente nuevo.
Deterioro del asma
El asma puede empeorar de forma aguda durante un período de horas o de forma crónica durante varios días o más. Si el paciente necesita más dosis de PROVENTIL HFA en aerosol para inhalación de lo habitual, esto puede ser un marcador de desestabilización del asma y requiere una nueva evaluación del paciente y del régimen de tratamiento, prestando especial atención a la posible necesidad de un tratamiento antiinflamatorio, p. corticosteroides
Uso de agentes antiinflamatorios
El uso de broncodilatadores agonistas beta-adrenérgicos solos puede no ser adecuado para controlar el asma en muchos pacientes. Se debe considerar desde el principio la adición de agentes antiinflamatorios, por ejemplo, corticosteroides, al régimen terapéutico.
Efectos cardiovasculares
PROVENTIL 100mcg HFA Inhalation Aerosol, al igual que otros agonistas beta-adrenérgicos, puede producir efectos cardiovasculares clínicamente significativos en algunos pacientes, medidos por la frecuencia del pulso, la presión arterial y/o los síntomas. Aunque tales efectos son poco comunes después de la administración de PROVENTIL 100 mcg HFA Aerosol para inhalación a las dosis recomendadas, si ocurren, es posible que sea necesario suspender el medicamento. Además, se ha informado que los beta-agonistas producen cambios en el ECG, como aplanamiento de la onda T, prolongación del intervalo QTc y depresión del segmento ST. Se desconoce el significado clínico de estos hallazgos. Por lo tanto, el aerosol para inhalación PROVENTIL HFA, como todas las aminas simpaticomiméticas, debe usarse con precaución en pacientes con trastornos cardiovasculares, especialmente insuficiencia coronaria, arritmias cardíacas e hipertensión.
No exceda la dosis recomendada
Se han informado muertes en asociación con el uso excesivo de fármacos simpaticomiméticos inhalados en pacientes con asma. Se desconoce la causa exacta de la muerte, pero se sospecha un paro cardíaco después de un desarrollo inesperado de una crisis asmática aguda grave y la hipoxia subsiguiente.
Reacciones de hipersensibilidad inmediata
Pueden ocurrir reacciones de hipersensibilidad inmediata después de la administración de sulfato de albuterol, como se demuestra en casos raros de urticaria, angioedema, erupción cutánea, broncoespasmo, anafilaxia y edema orofaríngeo.
PRECAUCIONES
General
El sulfato de albuterol, como todas las aminas simpaticomiméticas, debe usarse con precaución en pacientes con trastornos cardiovasculares, especialmente insuficiencia coronaria, arritmias cardíacas e hipertensión; en pacientes con trastornos convulsivos, hipertiroidismo o diabetes mellitus; y en pacientes que responden inusualmente a las aminas simpaticomiméticas. Se han observado cambios clínicamente significativos en la presión arterial sistólica y diastólica en pacientes individuales y podría esperarse que ocurran en algunos pacientes después del uso de cualquier broncodilatador beta-adrenérgico.
Se ha informado que grandes dosis de albuterol intravenoso agravan la diabetes mellitus y la cetoacidosis preexistentes. Al igual que con otros beta-agonistas, el albuterol puede producir una hipopotasemia significativa en algunos pacientes, posiblemente a través de una derivación intracelular, que tiene el potencial de producir efectos cardiovasculares adversos. La disminución suele ser transitoria, no requiriendo suplementación.
Información para pacientes
Ver ilustrado Instrucciones de uso del paciente AGITAR BIEN ANTES DE USAR. Los pacientes deben recibir la siguiente información:
Se recomienda cebar el inhalador antes de usarlo por primera vez y en los casos en que el inhalador no se haya usado durante más de 2 semanas, liberando cuatro "pulverizaciones de prueba" en el aire, lejos de la cara.
MANTENER LA BOQUILLA DE PLÁSTICO LIMPIA ES MUY IMPORTANTE PARA EVITAR LA ACUMULACIÓN Y EL BLOQUEO DEL MEDICAMENTO. LA BOQUILLA DEBE LAVARSE, AGITARSE PARA ELIMINAR EL EXCESO DE AGUA Y SECAR AL AIRE COMPLETAMENTE AL MENOS UNA VEZ A LA SEMANA. EL INHALADOR PUEDE DEJAR DE ENTREGAR MEDICAMENTOS SI NO SE LIMPIA CORRECTAMENTE.
La boquilla debe limpiarse (sin el recipiente) dejando correr agua tibia por la parte superior e inferior durante 30 segundos al menos una vez a la semana. La boquilla debe agitarse para eliminar el exceso de agua y luego secarse completamente al aire (por ejemplo, durante la noche). El bloqueo debido a la acumulación de medicamentos o la administración incorrecta de medicamentos puede ser el resultado de no secar bien la boquilla con aire.
Si la boquilla se obstruye (sale poco o nada de medicamento de la boquilla), la obstrucción puede eliminarse lavándola como se describe anteriormente.
Si es necesario usar el inhalador antes de que esté completamente seco, sacuda el exceso de agua, reemplace el recipiente, pruebe el aerosol dos veces lejos de la cara y tome la dosis prescrita. Después de dicho uso, la boquilla debe volver a lavarse y dejar que se seque completamente al aire.
La acción de PROVENTIL HFA Inhalation Aerosol debe durar de 4 a 6 horas. El aerosol de inhalación PROVENTIL HFA no debe usarse con más frecuencia de lo recomendado. No aumente la dosis o la frecuencia de las dosis de PROVENTIL HFA en aerosol para inhalación sin consultar a su médico. Si encuentra que el tratamiento con PROVENTIL 100 mcg HFA Inhalation Aerosol se vuelve menos efectivo para el alivio sintomático, sus síntomas empeoran y/o necesita usar el producto con más frecuencia de lo habitual, debe buscar atención médica de inmediato. Mientras esté tomando PROVENTIL 100 mcg HFA Inhalation Aerosol, otros medicamentos inhalados y medicamentos para el asma deben tomarse solo según las indicaciones de su médico.
Los efectos adversos comunes del tratamiento con albuterol inhalado incluyen palpitaciones, dolor de pecho, frecuencia cardíaca rápida, temblor o nerviosismo. Si está embarazada o amamantando, comuníquese con su médico acerca del uso de PROVENTIL 100 mcg HFA Aerosol para inhalación. El uso efectivo y seguro de PROVENTIL 100mcg HFA Inhalation Aerosol incluye una comprensión de la forma en que debe administrarse. Utilice el aerosol de inhalación PROVENTIL HFA solo con el actuador suministrado con el producto. Deseche el bote después de que se hayan utilizado 200 pulverizaciones.
En general, la técnica para administrar PROVENTIL HFA en aerosol para inhalación a niños es similar a la de los adultos. Los niños deben usar el aerosol de inhalación PROVENTIL HFA bajo la supervisión de un adulto, según las instrucciones del médico del paciente. (Consulte las Instrucciones de uso para el paciente).
Carcinogénesis, mutagénesis y deterioro de la fertilidad
En un estudio de 2 años en ratas SPRAGUE-DAWLEY®, el sulfato de albuterol provocó un aumento relacionado con la dosis en la incidencia de leiomiomas benignos del mesovario a las dosis dietéticas anteriores de 2 mg/kg (aproximadamente 15 veces la dosis diaria máxima recomendada por inhalación). para adultos en mg/m² y aproximadamente 6 veces la dosis de inhalación diaria máxima recomendada para niños en mg/m²). En otro estudio, este efecto fue bloqueado por la coadministración de propranolol, un antagonista beta-adrenérgico no selectivo. En un estudio de 18 meses en ratones CD-1, el sulfato de albuterol no mostró evidencia de tumorigenicidad en dosis dietéticas de hasta 500 mg/kg (aproximadamente 1700 veces la dosis de inhalación diaria máxima recomendada para adultos sobre una base de mg/m² y aproximadamente 800 veces la dosis de inhalación diaria máxima recomendada para niños en mg/m²). En un estudio de 22 meses en hámsteres dorados, el sulfato de albuterol no mostró evidencia de tumorigenicidad en dosis dietéticas de hasta 50 mg/kg (aproximadamente 225 veces la dosis máxima diaria recomendada para inhalación para adultos en mg/m² y aproximadamente 110 veces la dosis de inhalación diaria máxima recomendada para niños en base a mg/m²).
El sulfato de albuterol no fue mutagénico en la prueba de Ames ni en una prueba de mutación en levadura. El sulfato de albuterol no fue clastogénico en un ensayo de linfocitos periféricos humanos o en un ensayo de micronúcleo de ratón de la cepa AH1.
Los estudios de reproducción en ratas no demostraron evidencia de alteración de la fertilidad a dosis orales de hasta 50 mg/kg (aproximadamente 340 veces la dosis de inhalación diaria máxima recomendada para adultos sobre una base de mg/m²).
El embarazo
Efectos teratogénicos
Embarazo Categoría C
Se ha demostrado que el sulfato de albuterol es teratogénico en ratones. Un estudio en ratones CD-1 que recibieron sulfato de albuterol por vía subcutánea mostró formación de paladar hendido en 5 de 111 (4,5 %) fetos a 0,25 mg/kg (menos de la dosis de inhalación diaria máxima recomendada para adultos en mg/m²) y en 10 de 108 (9,3 %) fetos a 2,5 mg/kg (aproximadamente 8 veces la dosis de inhalación diaria máxima recomendada para adultos en mg/m²). El fármaco no indujo la formación de paladar hendido a una dosis de 0,025 mg/kg (menor que la dosis de inhalación diaria máxima recomendada para adultos sobre una base de mg/m²). El paladar hendido también ocurrió en 22 de 72 (30,5%) fetos de mujeres tratadas por vía subcutánea con 2,5 mg/kg de isoproterenol (control positivo).
Un estudio de reproducción en conejos Stride Dutch reveló craneosquisis en 7 de 19 (37 %) fetos cuando se administró sulfato de albuterol por vía oral a una dosis de 50 mg/kg (aproximadamente 680 veces la dosis de inhalación diaria máxima recomendada para adultos en mg/m²).
En un estudio de reproducción por inhalación en ratas SPRAGUE-DAWLEY, la formulación de sulfato de albuterol/HFA-134a no mostró ningún efecto teratogénico a 10,5 mg/kg (aproximadamente 70 veces la dosis de inhalación diaria máxima recomendada para adultos en mg/m²).
Un estudio en el que se administró sulfato de albuterol radiomarcado a ratas preñadas demostró que el material relacionado con el fármaco se transfiere de la circulación materna al feto.
No existen estudios adecuados y bien controlados de PROVENTIL 100 mcg HFA Aerosol para inhalación o sulfato de albuterol en mujeres embarazadas. PROVENTIL 100mcg HFA Inhalation Aerosol debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto.
Durante la experiencia de comercialización a nivel mundial, se han informado diversas anomalías congénitas, que incluyen paladar hendido y defectos en las extremidades, en los hijos de pacientes tratados con albuterol. Algunas de las madres estaban tomando múltiples medicamentos durante sus embarazos. Debido a que no se puede discernir un patrón consistente de defectos, no se ha establecido una relación entre el uso de albuterol y las anomalías congénitas.
Uso en trabajo de parto y parto
Debido al potencial de interferencia de los beta-agonistas con la contractilidad uterina, el uso de PROVENTIL HFA en aerosol para inhalación para el alivio del broncoespasmo durante el trabajo de parto debe restringirse a aquellas pacientes en las que los beneficios claramente superan los riesgos.
tocólisis
El albuterol no ha sido aprobado para el manejo del trabajo de parto prematuro. No se ha establecido la relación beneficio:riesgo cuando se administra albuterol para la tocólisis. Se han notificado reacciones adversas graves, incluido el edema pulmonar, durante o después del tratamiento del trabajo de parto prematuro con agonistas beta2, incluido el albuterol.
Madres lactantes
Los niveles plasmáticos de sulfato de albuterol y HFA-134a después de dosis terapéuticas inhaladas son muy bajos en humanos, pero no se sabe si los componentes de PROVENTIL 100 mcg HFA Aerosol para inhalación se excretan en la leche humana.
Debido al potencial de tumorigenicidad mostrado para el albuterol en estudios con animales y la falta de experiencia con el uso de PROVENTIL HFA en aerosol para inhalación por parte de madres lactantes, se debe tomar la decisión de suspender la lactancia o suspender el fármaco, teniendo en cuenta la importancia de la droga a la madre. Se debe tener precaución cuando se administra sulfato de albuterol a una mujer lactante.
Pediatría
No se ha establecido la seguridad y eficacia del aerosol para inhalación PROVENTIL HFA en pacientes pediátricos menores de 4 años.
Geriatría
El aerosol de inhalación PROVENTIL HFA no se ha estudiado en una población geriátrica. Al igual que con otros agonistas beta2, se debe tener especial precaución al usar PROVENTIL HFA en aerosol para inhalación en pacientes de edad avanzada que tienen una enfermedad cardiovascular concomitante que podría verse afectada negativamente por esta clase de medicamento.
SOBREDOSIS
Los síntomas esperados con sobredosis son aquellos de estimulación beta-adrenérgica excesiva y/o aparición o exageración de cualquiera de los síntomas enumerados en REACCIONES ADVERSAS, p. ej., convulsiones, angina, hipertensión o hipotensión, taquicardia con frecuencias de hasta 200 latidos por minuto, arritmias , nerviosismo, dolor de cabeza, temblor, sequedad de boca, palpitaciones, náuseas, mareos, fatiga, malestar general e insomnio.
También puede ocurrir hipopotasemia. Al igual que con todos los medicamentos simpaticomiméticos, el paro cardíaco e incluso la muerte pueden estar asociados con el abuso de PROVENTIL 100 mcg HFA Aerosol para inhalación. El tratamiento consiste en la interrupción del aerosol de inhalación PROVENTIL HFA junto con la terapia sintomática adecuada. Se puede considerar el uso juicioso de un bloqueador beta-receptor cardioselectivo, teniendo en cuenta que dicha medicación puede producir broncoespasmo. No hay evidencia suficiente para determinar si la diálisis es beneficiosa para la sobredosis de PROVENTIL HFA Aerosol para inhalación.
La dosis letal media oral de sulfato de albuterol en ratones es superior a 2000 mg/kg (aproximadamente 6800 veces la dosis diaria máxima recomendada para inhalación para adultos en mg/m² y aproximadamente 3200 veces la dosis máxima diaria recomendada para inhalación para niños en mg/m²). /m² base). En ratas maduras, la dosis letal media subcutánea de sulfato de albuterol es de aproximadamente 450 mg/kg (aproximadamente 3000 veces la dosis máxima diaria recomendada para inhalación en adultos en mg/m² y aproximadamente 1400 veces la dosis máxima diaria recomendada para inhalación en niños). base mg/m²). En ratas jóvenes, la dosis letal mediana por vía subcutánea es de aproximadamente 2000 mg/kg (aproximadamente 14 000 veces la dosis de inhalación diaria máxima recomendada para adultos en mg/m² y aproximadamente 6400 veces la dosis de inhalación diaria máxima recomendada para niños en mg/m²). base). No se ha determinado la dosis letal media por inhalación en animales.
CONTRAINDICACIONES
PROVENTIL 100mcg HFA Inhalation Aerosol está contraindicado en pacientes con antecedentes de hipersensibilidad al albuterol o a cualquier otro componente de PROVENTIL HFA.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
Los estudios in vitro y los estudios farmacológicos in vivo han demostrado que el albuterol tiene un efecto preferencial sobre los receptores beta2-adrenérgicos en comparación con el isoproterenol. Si bien se reconoce que los receptores adrenérgicos beta2 son los receptores predominantes en el músculo liso bronquial, los datos indican que existe una población de receptores adrenérgicos beta2 en el corazón humano que existe en una concentración entre el 10 % y el 50 % de los receptores adrenérgicos beta cardíacos. No se ha establecido la función precisa de estos receptores. (Ver ADVERTENCIAS , Efectos cardiovasculares sección.)
La activación de los receptores beta2-adrenérgicos en el músculo liso de las vías respiratorias conduce a la activación de la adenilciclasa ya un aumento de la concentración intracelular de monofosfato de adenosina cíclico-3',5' (AMP cíclico). Este aumento de AMP cíclico conduce a la activación de la proteína cinasa A, que inhibe la fosforilación de la miosina y reduce las concentraciones de calcio iónico intracelular, lo que produce relajación. El albuterol relaja los músculos lisos de todas las vías respiratorias, desde la tráquea hasta los bronquiolos terminales. El albuterol actúa como un antagonista funcional para relajar las vías respiratorias independientemente del espasmógeno involucrado, protegiendo así contra todos los desafíos broncoconstrictores. Las concentraciones aumentadas de AMP cíclico también están asociadas con la inhibición de la liberación de mediadores de los mastocitos en las vías respiratorias.
En la mayoría de los ensayos clínicos, se ha demostrado que el albuterol tiene más efecto sobre las vías respiratorias, en forma de relajación del músculo liso bronquial, que el isoproterenol en dosis comparables y produce menos efectos cardiovasculares. Los estudios clínicos controlados y otra experiencia clínica han demostrado que el albuterol inhalado, al igual que otros fármacos agonistas beta-adrenérgicos, puede producir un efecto cardiovascular significativo en algunos pacientes, medido por la frecuencia del pulso, la presión arterial, los síntomas y/o los cambios electrocardiográficos.
preclínico
Los estudios intravenosos en ratas con sulfato de albuterol han demostrado que el albuterol atraviesa la barrera hematoencefálica y alcanza concentraciones cerebrales de aproximadamente el 5% de las concentraciones plasmáticas. En estructuras fuera de la barrera hematoencefálica (glándulas pineal y pituitaria), se encontró que las concentraciones de albuterol eran 100 veces mayores que en todo el cerebro.
Los estudios en animales de laboratorio (minipigs, roedores y perros) han demostrado la aparición de arritmias cardíacas y muerte súbita (con evidencia histológica de necrosis miocárdica) cuando se administran simultáneamente agonistas beta2 y metilxantinas. Se desconoce el significado clínico de estos hallazgos.
El propulsor HFA-134a carece de actividad farmacológica excepto en dosis muy altas en animales (380-1300 veces la exposición humana máxima según las comparaciones de los valores de AUC), lo que produce principalmente ataxia, temblores, disnea o salivación. Estos son similares a los efectos producidos por los clorofluorocarbonos (CFC) estructuralmente relacionados, que se han utilizado ampliamente en inhaladores de dosis medida.
En animales y humanos, se encontró que el propulsor HFA-134a se absorbía y eliminaba rápidamente, con una vida media de eliminación de 3 a 27 minutos en animales y de 5 a 7 minutos en humanos. El tiempo hasta la concentración plasmática máxima (Tmax) y el tiempo medio de residencia son extremadamente cortos, lo que da lugar a una aparición transitoria de HFA-134a en la sangre sin evidencia de acumulación.
Farmacocinética
En un estudio de biodisponibilidad de dosis única en el que participaron seis voluntarios varones sanos, se observaron niveles bajos transitorios de albuterol (cerca del límite inferior de cuantificación) después de la administración de dos inhalaciones de PROVENTIL HFA Inhalation Aerosol y un inhalador de albuterol propulsado con CFC 11/12 . No fue posible realizar análisis farmacocinéticos formales para ninguno de los tratamientos, pero los niveles sistémicos de albuterol parecían similares.
Ensayos clínicos
En un ensayo de 12 semanas, aleatorizado, doble ciego, doble simulación, controlado con placebo y activo, se evaluó la eficacia broncodilatadora de PROVENTIL 100 mcg HFA en aerosol para inhalación en 565 pacientes con asma (193 pacientes) en comparación con un CFC 11 /12 inhalador de albuterol propulsado (186 pacientes) y un inhalador de placebo HFA-134a (186 pacientes).
Las mediciones seriales de FEV1 (que se muestran a continuación como cambio porcentual desde el inicio del día de la prueba) demostraron que dos inhalaciones de PROVENTIL HFA Inhalation Aerosol produjeron una mejora significativamente mayor en la función pulmonar que el placebo y produjeron resultados que fueron clínicamente comparables a un inhalador de albuterol propulsado por CFC 11/12.
El tiempo medio hasta el inicio de un aumento del 15 % en el FEV1 fue de 6 minutos y el tiempo medio hasta el efecto máximo fue de 50 a 55 minutos. La duración media del efecto medida por un aumento del 15 % en FEV1 fue de 3 horas. En algunos pacientes, la duración del efecto fue de hasta 6 horas.
En otro estudio clínico en adultos, dos inhalaciones de PROVENTIL HFA Inhalation Aerosol tomadas 30 minutos antes del ejercicio previnieron el broncoespasmo inducido por el ejercicio, como lo demuestra el mantenimiento del FEV1 dentro del 80 % de los valores iniciales en la mayoría de los pacientes.
En un ensayo abierto, aleatorizado y de 4 semanas de duración, se evaluó la eficacia broncodilatadora de PROVENTIL HFA en aerosol para inhalación en 63 niños de 4 a 11 años de edad con asma (33 pacientes pediátricos) en comparación con un CFC 11/12 propulsado. inhalador de albuterol (30 pacientes pediátricos).
FEV1 como cambio porcentual de la predosis en un ensayo clínico grande de 12 semanas
INFORMACIÓN DEL PACIENTE
INSTRUCCIONES DE USO
PROVENTIL® HFA (pro-vent-il) (sulfato de albuterol) Aerosol para inhalación con indicador de dosis
Lea estas Instrucciones de uso antes de comenzar a usar PROVENTIL 100 mcg HFA y cada vez que renueve su receta. Es posible que haya nueva información. Esta información no reemplaza la conversación con su médico acerca de su condición médica o tratamiento. Su médico debe mostrarle cómo su hijo debe usar PROVENTIL 100 mcg HFA.
Información importante:
- PROVENTIL 100mcg HFA es solo para inhalación oral.
- Tome PROVENTIL HFA exactamente como se lo indique su médico.
El aerosol para inhalación PROVENTIL® HFA viene en un bote con un indicador de dosis. El indicador de dosis está ubicado en la parte superior del recipiente que encaja en un actuador (Ver Figura A). La ventana de visualización del indicador de dosis le mostrará cuántas bocanadas de medicamento le quedan. Se libera una bocanada de medicamento cada vez que presiona el centro del indicador de dosis.
- No haga utilice el actuador PROVENTIL HFA con un bote de medicamento de cualquier otro inhalador.
- No haga use el recipiente de PROVENTIL HFA con un actuador de cualquier otro inhalador.
Figura A 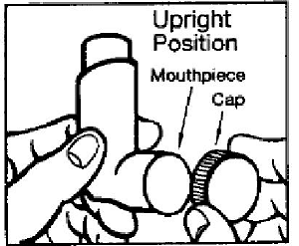
Antes de usar PROVENTIL HFA por primera vez asegúrese de que el puntero del indicador de dosis apunte a la derecha de la marca de inhalación “200” en la ventana de visualización del indicador de dosis (vea la figura A).
Cada bote de PROVENTIL HFA contiene 200 inhalaciones de medicamento. Esto no incluye los aerosoles de medicamentos utilizados para cebar su inhalador.
- La ventana de visualización del indicador de dosis continuará moviéndose después de cada 10 inhalaciones.
- El número en la ventana de visualización del indicador de dosis continuará cambiando después de cada 20 inhalaciones.
- El color en la ventana de visualización del indicador de dosis cambiará a rojo, como se muestra en el área sombreada, cuando solo queden 20 inhalaciones de medicamento en su inhalador (vea la Figura B). Aquí es cuando necesita volver a surtir su receta o preguntarle a su médico si necesita otra receta para PROVENTIL 100mcg HFA.
Figura B 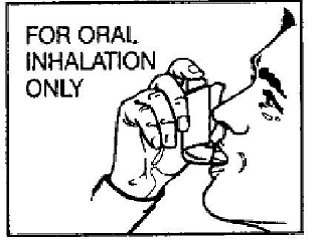
Cebado de su inhalador PROVENTIL HFA:
Antes de usar PROVENTIL HFA por primera vez, debe preparar su inhalador. Si no usa su PROVENTIL HFA durante más de 2 semanas, debe volver a cebarlo antes de usarlo.
- Quite la tapa de la boquilla (Ver Figura C). Revise el interior de la boquilla en busca de objetos antes de usarla.
- Asegúrese de que el recipiente esté completamente insertado en el actuador.
- Sostenga el inhalador en posición vertical lejos de su cara y agítelo bien.
- Presione completamente hacia abajo en el centro del indicador de dosis para liberar un spray de medicamento. Es posible que escuche un clic suave del indicador de dosis a medida que avanza la cuenta regresiva durante el uso.
- Repita el paso de cebado 3 veces más para liberar un total de 4 pulverizaciones de medicamento. Agite bien el inhalador antes de cada aplicación de cebado.
- Después de las 4 aplicaciones de cebado, el indicador de dosis debe señalar 200. Ahora quedan aplicaciones de medicamento en el recipiente.
- Su inhalador ya está listo para usar.
Usando su inhalador PROVENTIL 100mcg HFA:
Paso 1: Agite bien el inhalador antes de cada uso. Quite la tapa de la boquilla (Ver Figura C). Revise el interior de la boquilla en busca de objetos antes de usarla. Asegúrese de que el recipiente esté completamente insertado en el actuador.
Figura C 
Paso 2: Exhale lo más profundamente que pueda cómodamente a través de la boca. Sostenga el inhalador en posición vertical con la boquilla apuntando hacia usted y coloque la boquilla completamente en la boca (vea la Figura D). Cierra los labios alrededor de la boquilla.
Figura D 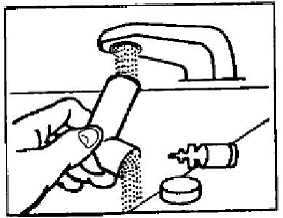
Paso 3: Mientras inhala profunda y lentamente, presione el centro del indicador de dosis con el dedo índice hasta que el recipiente deje de moverse en el actuador y se libere una bocanada de medicamento (vea la figura D). Luego deje de presionar el indicador de dosis.
Paso 4: Aguante la respiración todo el tiempo que pueda cómodamente, hasta 10 segundos. Quítese el inhalador de la boca y luego exhale.
Paso 5: Si su médico le ha recetado inhalaciones adicionales de PROVENTIL 100 mcg HFA, espere 1 minuto y luego agite bien el inhalador. Repita los pasos 3 a 5 de la sección “Uso de su inhalador PROVENTIL HFA”.
Paso 6: Vuelva a colocar la tapa inmediatamente después de su uso.
Limpieza de su inhalador PROVENTIL HFA:
Es muy importante que mantenga la boquilla limpia para que el medicamento no se acumule y bloquee el rocío a través de la boquilla. Limpie la boquilla 1 vez por semana o si la boquilla se bloquea. (ver figura F)
Paso 1 : Retire el recipiente del actuador y quite la tapa de la boquilla. No limpie el recipiente de metal ni deje que se moje.
Paso 2: Lave la boquilla por arriba y por abajo con agua corriente tibia durante 30 segundos (vea la figura E).
Figura E 
Paso 3: Sacuda toda el agua que pueda de la boquilla.
Paso 4: Mire en la boquilla para asegurarse de que se haya eliminado por completo cualquier acumulación de medicamento. Si la boquilla está bloqueada con acumulación, poco o nada de medicamento saldrá de la boquilla (vea la figura F). Si hay alguna acumulación, repita los pasos 2 a 4 en la sección "Limpieza de su inhalador PROVENTIL 100mcg HFA".
Figura F 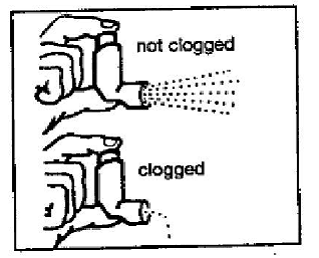
Paso 5: Deje que la boquilla se seque al aire durante la noche (vea la Figura G). No vuelva a colocar el recipiente en el actuador si aún está húmedo.
Figura G 
Paso 6: Cuando la boquilla esté seca, vuelva a colocar el recipiente en el actuador y coloque la tapa en la boquilla.
Nota: Si necesita usar su inhalador PROVENTIL 100mcg HFA antes de que esté completamente seco, Vuelva a colocar el recipiente en el actuador y agite bien el inhalador. Presione hacia abajo el centro del indicador de dosis 2 veces para liberar un total de 2 pulverizaciones en el aire, lejos de su cara. Tome su dosis según lo prescrito, luego limpie y seque al aire su inhalador como se describe en la sección “Limpieza de su inhalador PROVENTIL HFA”.
¿Cómo debo almacenar PROVENTIL HFA?
- Guarde PROVENTIL HFA a temperatura ambiente entre 59 °F y 77 °F (15 °C y 25 °C).
- Guárdelo con la boquilla hacia abajo.
- Evite exponer PROVENTIL 100mcg HFA al calor y al frío extremos.
- No perfore ni queme el recipiente.
- Mantenga su inhalador PROVENTIL 100mcg HFA y todos los medicamentos fuera del alcance de los niños.
Estas Instrucciones de uso han sido aprobadas por la Administración de Drogas y Alimentos de EE. UU.
