Spiriva 9mcg Tiotropium Bromide Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Spiriva 9mcg HandiHaler y cómo se usa?
El polvo para inhalación Spiriva HandiHaler (bromuro de tiotropio) es un fármaco anticolinérgico que se usa para prevenir el broncoespasmo (estrechamiento de las vías respiratorias en los pulmones) en personas con bronquitis, enfisema o EPOC (enfermedad pulmonar obstructiva crónica).
¿Cuáles son los efectos secundarios de Spiriva 9mcg HandiHaler?
Los efectos secundarios comunes de Spiriva 9mcg HandiHaler incluyen:
- boca seca,
- estreñimiento,
- dolor de barriga,
- vómitos,
- síntomas de resfriado (nariz tapada, estornudos, dolor de garganta),
- hemorragia nasal, o
- dolor muscular.
Informe a su médico si tiene efectos secundarios graves de Spiriva 9mcg HandiHaler, incluidos:
- micción difícil o dolorosa, o
- latidos cardíacos acelerados.
DESCRIPCIÓN
SPIRIVA 9mcg HANDIHALER consta de cápsulas de SPIRIVA y un dispositivo HANDIHALER. Cada cápsula de gelatina dura de color verde claro de SPIRIVA de 9 mcg contiene un polvo seco que consta de 18 mcg de tiotropio (equivalente a 22,5 mcg de monohidrato de bromuro de tiotropio) mezclado con lactosa monohidrato (que puede contener proteínas de leche).
El contenido de las cápsulas de SPIRIVA está destinado únicamente a la inhalación oral y está destinado a la administración únicamente con el dispositivo HANDIHALER.
El componente activo de SPIRIVA HANDIHALER es el tiotropio. El principio activo, bromuro de tiotropio monohidrato, es un anticolinérgico con especificidad por los receptores muscarínicos. Se describe químicamente como (1α, 2β, 4β, 5α, 7β)-7-[(Hydroxydi-2-tienylacetyl)oxy]-9,9-dimethyl-3-oxa-9-azoniatricyclo[3.3.1.02,4] monohidrato de bromuro de nonano. Es un compuesto de amonio cuaternario sintético, no quiral. El bromuro de tiotropio es un polvo blanco o blanco amarillento. Es escasamente soluble en agua y soluble en metanol.
La fórmula estructural es:
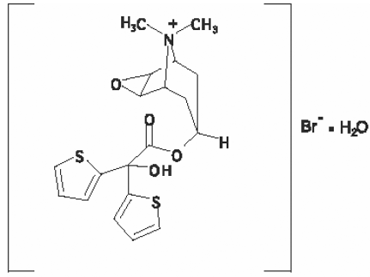
El bromuro de tiotropio (monohidrato) tiene una masa molecular de 490,4 y una fórmula molecular de C19H22NO4S2Br • H2O.
El dispositivo HANDIHALER es un dispositivo de inhalación que se utiliza para inhalar el polvo seco contenido en la cápsula de SPIRIVA 9mcg. El polvo seco se entrega desde el dispositivo HANDIHALER a velocidades de flujo tan bajas como 20 L/min. Según las pruebas in vitro estandarizadas, el dispositivo HANDIHALER administra una media de 10,4 mcg de tiotropio cuando se prueba a una velocidad de flujo de 39 l/min durante 3,1 segundos (2 l en total). En un estudio de 26 pacientes adultos con EPOC y función pulmonar gravemente comprometida [FEV1 medio 1,02 L (rango 0,45 a 2,24 L); 37,6 % del previsto (rango 16 % a 65 %)], la mediana del flujo inspiratorio máximo (PIF) a través del dispositivo HANDIHALER fue de 30,0 l/min (rango 20,4 a 45,6 l/min). La cantidad de fármaco administrado a los pulmones variará según los factores del paciente, como el flujo inspiratorio y el flujo inspiratorio máximo a través del dispositivo HANDIHALER, que puede variar de un paciente a otro y puede variar con el tiempo de exposición de la cápsula SPIRIVA de 9 mcg fuera del blíster. paquete.
INDICACIONES
SPIRIVA HANDIHALER (polvo para inhalación de bromuro de tiotropio) está indicado para el tratamiento de mantenimiento a largo plazo, una vez al día, del broncoespasmo asociado con la enfermedad pulmonar obstructiva crónica (EPOC), incluida la bronquitis crónica y el enfisema. SPIRIVA 9mcg HANDIHALER está indicado para reducir las exacerbaciones en pacientes con EPOC.
DOSIFICACIÓN Y ADMINISTRACIÓN
Solo para inhalación oral. No trague las cápsulas de SPIRIVA 9mcg, ya que no se obtendrán los efectos deseados en los pulmones. El contenido de las cápsulas de SPIRIVA solo debe usarse con el dispositivo HANDIHALER [ver SOBREDOSIS ].
La dosis recomendada de SPIRIVA HANDIHALER es de dos inhalaciones del contenido de polvo de una cápsula de SPIRIVA, una vez al día, con el dispositivo HANDIHALER [ver INFORMACIÓN DEL PACIENTE ]. No tome más de una dosis en 24 horas.
Para la administración de SPIRIVA HANDIHALER, se coloca una cápsula de SPIRIVA de 9 mcg en la cámara central del dispositivo HANDIHALER. La cápsula de SPIRIVA 9mcg se perfora presionando y soltando el botón perforador verde en el costado del dispositivo HANDIHALER. La formulación de tiotropio se dispersa en la corriente de aire cuando el paciente inhala a través de la boquilla [ver INFORMACIÓN DEL PACIENTE ].
No se requiere ajuste de dosis para pacientes geriátricos, con insuficiencia hepática o renal. Sin embargo, los pacientes con insuficiencia renal de moderada a grave que reciben SPIRIVA 9mcg HANDIHALER deben ser monitoreados de cerca para detectar efectos anticolinérgicos [ver ADVERTENCIAS Y PRECAUCIONES , Uso en poblaciones específicas , y FARMACOLOGÍA CLÍNICA ].
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Polvo de inhalación
SPIRIVA 9mcg HANDIHALER consta de cápsulas de SPIRIVA que contienen polvo de tiotropio para inhalación oral y un dispositivo HANDIHALER. Las cápsulas de SPIRIVA de 9 mcg contienen 18 mcg de tiotropio en una cápsula de gelatina dura de color verde claro con TI 01 impreso en un lado y el logotipo de la empresa Boehringer Ingelheim en el otro lado. El dispositivo HANDIHALER solo está diseñado para usarse con las cápsulas SPIRIVA.
Almacenamiento y manipulación
SPIRIVA HANDIHALER consta de cápsulas de SPIRIVA 9mcg y el dispositivo HANDIHALER. Las cápsulas de SPIRIVA de 9 mcg contienen 18 mcg de tiotropio y son de color verde claro, con el logotipo de la empresa Boehringer Ingelheim en la tapa de la cápsula de SPIRIVA y TI 01 en el cuerpo de la cápsula de SPIRIVA, o viceversa.
El dispositivo HANDIHALER es de color gris con un botón de perforación verde. Lleva impreso SPIRIVA HANDIHALER (polvo para inhalación de bromuro de tiotropio), el logotipo de la empresa Boehringer Ingelheim. También está impreso para indicar que las cápsulas de SPIRIVA no deben almacenarse en el dispositivo HANDIHALER y que el dispositivo HANDIHALER solo debe usarse con cápsulas de SPIRIVA de 9 mcg.
Las cápsulas de SPIRIVA de 9 mcg se envasan en un blíster de aluminio/aluminio y se unen a lo largo de una línea de corte perforado. Las cápsulas de SPIRIVA 9mcg siempre deben almacenarse en el blíster y solo deben retirarse inmediatamente antes de su uso. El medicamento debe usarse inmediatamente después de abrir el envase de una cápsula individual de SPIRIVA.
Los siguientes paquetes están disponibles:
- caja que contiene 5 cápsulas de SPIRIVA 9mcg (1 blíster de dosis unitaria) y 1 dispositivo de inhalación HANDIHALER ( CDN 0597-0075-75) (paquete institucional)
- caja que contiene 30 cápsulas de SPIRIVA de 9 mcg (3 blísteres de dosis unitarias) y 1 dispositivo de inhalación HANDIHALER ( CDN 0597-0075-41)
- caja que contiene 90 cápsulas de SPIRIVA (9 tarjetas de blíster de dosis unitaria) y 1 dispositivo de inhalación HANDIHALER ( CDN 0597-0075-47)
Mantener fuera del alcance de los niños. No permita que el polvo entre en los ojos.
Almacenamiento
Almacenar a 25°C (77°F); se permiten excursiones de 15° a 30°C (59° a 86°F) [consulte Temperatura ambiente controlada por USP].
Las cápsulas de SPIRIVA no deben exponerse a temperaturas o humedad extremas. No guarde las cápsulas de SPIRIVA de 9 mcg en el dispositivo HANDIHALER.
Distribuido por: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 EE. UU. Revisado: febrero de 2018
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas se describen, o se describen con mayor detalle, en otras secciones:
- Reacciones de hipersensibilidad inmediata [ver ADVERTENCIAS Y PRECAUCIONES ]
- Broncoespasmo paradójico [ver ADVERTENCIAS Y PRECAUCIONES ]
- Empeoramiento del glaucoma de ángulo estrecho [ver ADVERTENCIAS Y PRECAUCIONES ]
- Empeoramiento de la retención urinaria [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, la incidencia de reacciones adversas observadas en los ensayos clínicos de un fármaco no se puede comparar directamente con la incidencia en los ensayos clínicos de otro fármaco y es posible que no refleje la incidencia observada en la práctica.
Pruebas de 6 meses a 1 año
Los datos que se describen a continuación reflejan la exposición a SPIRIVA 9mcg HANDIHALER en 2663 pacientes. SPIRIVA 9mcg HANDIHALER se estudió en dos ensayos controlados con placebo de 1 año, dos ensayos controlados con activo de 1 año y dos ensayos controlados con placebo de 6 meses en pacientes con EPOC. En estos ensayos, 1308 pacientes fueron tratados con SPIRIVA HANDIHALER a la dosis recomendada de 18 mcg una vez al día. La población tenía una edad que oscilaba entre los 39 y los 87 años, con un 65 % a un 85 % de hombres, un 95 % de raza caucásica, y presentaba EPOC con un porcentaje predicho de volumen espiratorio forzado en un segundo (FEV1) medio previo al broncodilatador de un 39 % a un 43 %. Los pacientes con glaucoma de ángulo estrecho, hipertrofia prostática sintomática u obstrucción de la salida de la vejiga fueron excluidos de estos ensayos. En esta base de datos de seguridad no se incluye un ensayo adicional de 6 meses realizado en un entorno de Asuntos de Veteranos porque solo se recopilaron eventos adversos graves.
La reacción adversa al fármaco notificada con mayor frecuencia fue sequedad de boca. La boca seca fue generalmente leve y, a menudo, se resolvió durante el tratamiento continuo. Otras reacciones informadas en pacientes individuales y consistentes con posibles efectos anticolinérgicos incluyeron estreñimiento, taquicardia, visión borrosa, glaucoma (nueva aparición o empeoramiento), disuria y retención urinaria.
Cuatro ensayos multicéntricos, de 1 año, controlados con placebo y con control activo evaluaron SPIRIVA HANDIHALER en pacientes con EPOC. La Tabla 1 muestra todas las reacciones adversas que ocurrieron con una frecuencia de ≥3 % en el grupo de SPIRIVA HANDIHALER de 9 mcg en los ensayos controlados con placebo de 1 año en los que las tasas en el grupo de SPIRIVA HANDIHALER superaron al placebo en ≥1 %. La frecuencia de las reacciones correspondientes en los ensayos controlados con ipratropio se incluye para comparación.
La artritis, la tos y los síntomas similares a los de la influenza ocurrieron a una tasa de ≥3 % en el grupo de tratamiento con SPIRIVA 9 mcg HANDIHALER, pero fueron
Otras reacciones que ocurrieron en el grupo de SPIRIVA HANDIHALER con una frecuencia de 1% a 3% en los ensayos controlados con placebo donde las tasas excedieron las del grupo de placebo incluyen:
Cuerpo como un todo: reacción alérgica, dolor en las piernas;
Sistema Nervioso Central y Periférico: disfonía, parestesia;
Trastornos del sistema gastrointestinal: trastorno gastrointestinal no especificado (NOS), reflujo gastroesofágico, estomatitis (incluyendo estomatitis ulcerosa);
Trastornos metabólicos y nutricionales: hipercolesterolemia, hiperglucemia;
Trastornos del sistema musculoesquelético: dolor esquelético;
Eventos cardíacos: angina de pecho (incluyendo angina de pecho agravada);
Desorden psiquiátrico: depresión; Infecciones: herpes zóster;
Trastorno del sistema respiratorio (superior): laringitis;
Trastorno de la visión: catarata.
Además, entre las reacciones adversas observadas en los ensayos clínicos con una incidencia
En los ensayos de 1 año, la incidencia de boca seca, estreñimiento e infección del tracto urinario aumentó con la edad [ver Uso en poblaciones específicas ].
Dos estudios controlados multicéntricos de 6 meses evaluaron SPIRIVA 9mcg HANDIHALER en pacientes con EPOC. Las reacciones adversas y las tasas de incidencia fueron similares a las observadas en los ensayos controlados de 1 año.
Prueba de 4 años
Los datos que se describen a continuación reflejan la exposición a SPIRIVA 9mcg HANDIHALER en 5992 pacientes con EPOC en un ensayo controlado con placebo de 4 años. En este ensayo, 2986 pacientes fueron tratados con SPIRIVA 9mcg HANDIHALER a la dosis recomendada de 18 mcg una vez al día. La población tenía un rango de edad de 40 a 88 años, era 75 % de hombres, 90 % de raza caucásica y tenía EPOC con un porcentaje predicha de FEV1 promedio del 40 % antes del broncodilatador. Los pacientes con glaucoma de ángulo estrecho, hipertrofia prostática sintomática u obstrucción de la salida de la vejiga fueron excluidos de estos ensayos. Cuando las reacciones adversas se analizaron con una frecuencia de ≥3% en el grupo de SPIRIVA 9mcg HANDIHALER donde las tasas en el grupo de SPIRIVA 9mcg HANDIHALER excedieron al placebo en ≥1%, las reacciones adversas incluyeron (SPIRIVA 9mcg HANDIHALER, placebo): faringitis (12,5% , 10,8 %), sinusitis (6,5 %, 5,3 %), dolor de cabeza (5,7 %, 4,5 %), estreñimiento (5,1 %, 3,7 %), boca seca (5,1 %, 2,7 %), depresión (4,4 %, 3,3 %) , insomnio (4,4%, 3,0%) y artralgia (4,2%, 3,1%).
Reacciones adversas adicionales
Otras reacciones adversas no enumeradas anteriormente que se informaron con mayor frecuencia en pacientes con EPOC tratados con SPIRIVA 9mcg HANDIHALER que con placebo incluyen: deshidratación, úlcera cutánea, estomatitis, gingivitis, candidiasis orofaríngea, piel seca, infección cutánea e inflamación de las articulaciones.
Experiencia posterior a la comercialización
Se han identificado reacciones adversas durante el uso mundial posterior a la aprobación de SPIRIVA HANDIHALER. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco. Estas reacciones adversas son: irritación del sitio de aplicación (glositis, ulceración bucal y dolor faringolaríngeo), mareos, disfagia, ronquera, obstrucción intestinal incluyendo íleo paralítico, aumento de la presión intraocular, candidiasis oral, palpitaciones, prurito, taquicardia, irritación de garganta y urticaria.
INTERACCIONES CON LA DROGAS
Simpaticomiméticos, Metilxantinas, Esteroides
SPIRIVA 9mcg HANDIHALER se ha utilizado concomitantemente con broncodilatadores simpaticomiméticos (beta-agonistas) de acción corta y prolongada, metilxantinas y esteroides orales e inhalados sin aumento de las reacciones adversas.
anticolinérgicos
Existe la posibilidad de una interacción aditiva con medicamentos anticolinérgicos utilizados de forma concomitante. Por lo tanto, evite la coadministración de SPIRIVA 9mcg HANDIHALER con otros medicamentos que contengan anticolinérgicos, ya que esto puede conducir a un aumento de los efectos adversos anticolinérgicos [ver ADVERTENCIAS Y PRECAUCIONES y REACCIONES ADVERSAS ].
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
No para uso agudo
SPIRIVA 9mcg HANDIHALER está diseñado como tratamiento de mantenimiento una vez al día para la EPOC y no debe usarse para el alivio de los síntomas agudos, es decir, como terapia de rescate para el tratamiento de episodios agudos de broncoespasmo.
Reacciones de hipersensibilidad inmediata
Después de la administración de SPIRIVA 9mcg HANDIHALER, pueden ocurrir reacciones de hipersensibilidad inmediata, que incluyen urticaria, angioedema (que incluye hinchazón de los labios, la lengua o la garganta), sarpullido, broncoespasmo, anafilaxia o picazón. Si ocurre tal reacción, la terapia con SPIRIVA 9mcg HANDIHALER debe suspenderse de inmediato y deben considerarse tratamientos alternativos. Dada la fórmula estructural similar de la atropina al tiotropio, los pacientes con antecedentes de reacciones de hipersensibilidad a la atropina o sus derivados deben ser monitoreados de cerca por reacciones de hipersensibilidad similares a SPIRIVA HANDIHALER. Además, SPIRIVA HANDIHALER debe utilizarse con precaución en pacientes con hipersensibilidad grave a las proteínas de la leche.
Broncoespasmo paradójico
Los medicamentos inhalados, incluido SPIRIVA HANDIHALER, pueden causar broncoespasmo paradójico. Si esto ocurre, debe tratarse inmediatamente con un agonista beta2 de acción corta inhalado, como el albuterol. Se debe suspender el tratamiento con SPIRIVA HANDIHALER y considerar otros tratamientos.
Empeoramiento del glaucoma de ángulo estrecho
SPIRIVA 9mcg HANDIHALER debe usarse con precaución en pacientes con glaucoma de ángulo estrecho. Los prescriptores y los pacientes deben estar atentos a los signos y síntomas del glaucoma agudo de ángulo estrecho (p. ej., dolor o malestar ocular, visión borrosa, halos visuales o imágenes coloreadas en asociación con ojos rojos por congestión conjuntival y edema corneal). Indique a los pacientes que consulten a un médico de inmediato si se presenta alguno de estos signos o síntomas.
Empeoramiento de la retención urinaria
SPIRIVA HANDIHALER debe usarse con precaución en pacientes con retención urinaria. Los prescriptores y los pacientes deben estar atentos a los signos y síntomas de retención urinaria (p. ej., dificultad para orinar, dolor al orinar), especialmente en pacientes con hiperplasia prostática u obstrucción del cuello de la vejiga. Indique a los pacientes que consulten a un médico de inmediato si se presenta alguno de estos signos o síntomas.
Insuficiencia renal
Como fármaco que se excreta predominantemente por vía renal, los pacientes con insuficiencia renal de moderada a grave (aclaramiento de creatinina FARMACOLOGÍA CLÍNICA ].
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( INFORMACIÓN DEL PACIENTE e Instrucciones de uso ).
No para uso agudo
Indique a los pacientes que SPIRIVA HANDIHALER es un broncodilatador de mantenimiento que se administra una vez al día y que no debe usarse para el alivio inmediato de los problemas respiratorios (es decir, como medicamento de rescate).
Reacciones de hipersensibilidad inmediata
Informe a los pacientes que después de la administración de SPIRIVA 9mcg HANDIHALER pueden ocurrir anafilaxia, angioedema (incluida la hinchazón de los labios, la lengua o la garganta), urticaria, sarpullido, broncoespasmo o picazón. Aconseje al paciente que interrumpa inmediatamente el tratamiento y consulte a un médico si presenta alguno de estos signos o síntomas.
Broncoespasmo paradójico
Informar a los pacientes que SPIRIVA HANDIHALER puede producir broncoespasmo paradójico. Aconseje a los pacientes que si se produce un broncoespasmo paradójico, los pacientes deben interrumpir SPIRIVA HANDIHALER.
Empeoramiento del glaucoma de ángulo estrecho
Indique a los pacientes que estén atentos a los signos y síntomas del glaucoma de ángulo estrecho (p. ej., dolor o malestar ocular, visión borrosa, halos visuales o imágenes coloreadas en asociación con ojos rojos por congestión conjuntival y edema corneal). Indique a los pacientes que consulten a un médico de inmediato si se presenta alguno de estos signos y síntomas.
Informe a los pacientes que se debe tener cuidado de no permitir que el polvo entre en los ojos, ya que esto puede causar visión borrosa y dilatación de las pupilas.
Debido a que pueden ocurrir mareos y visión borrosa con el uso de SPIRIVA HANDIHALER, advierta a los pacientes acerca de participar en actividades como conducir un vehículo u operar aparatos o maquinaria.
Empeoramiento de la retención urinaria
Indique a los pacientes que estén atentos a los signos y síntomas de retención urinaria (p. ej., dificultad para orinar, dolor al orinar). Indique a los pacientes que consulten a un médico de inmediato si se presenta alguno de estos signos o síntomas.
Instrucciones para administrar SPIRIVA HANDIHALER
Instruir a los pacientes sobre cómo administrar correctamente las cápsulas de SPIRIVA de 9 mcg con el dispositivo HANDIHALER [ver INFORMACIÓN DEL PACIENTE ]. Indique a los pacientes que las cápsulas de SPIRIVA de 9 mcg solo deben administrarse a través del dispositivo HANDIHALER y que el dispositivo HANDIHALER no debe usarse para administrar otros medicamentos. Recuerde a los pacientes que el contenido de las cápsulas de SPIRIVA 9mcg es solo para inhalación oral y no debe tragarse.
Indique a los pacientes que siempre almacenen las cápsulas de SPIRIVA de 9 mcg en blísters sellados y que retiren solo una cápsula de SPIRIVA inmediatamente antes de usarla o su eficacia puede verse reducida. Indique a los pacientes que desechen las cápsulas de SPIRIVA adicionales no utilizadas que estén expuestas al aire (es decir, no destinadas para uso inmediato).
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
No se observó evidencia de tumorigenicidad en un estudio de inhalación de 104 semanas en ratas con dosis de tiotropio de hasta 59 mcg/kg/día, en un estudio de inhalación de 83 semanas en ratones hembra con dosis de hasta 145 mcg/kg/día y en un estudio de inhalación de 101 semanas en ratones macho a dosis de hasta 2 mcg/kg/día. Estas dosis corresponden a aproximadamente 30, 40 y 0,5 veces la dosis de inhalación diaria recomendada en humanos (MRHDID) en base a mcg/m2, respectivamente.
El bromuro de tiotropio no demostró evidencia de mutagenicidad o clastogenicidad en los siguientes ensayos: el ensayo de mutación genética bacteriana, el ensayo de mutagénesis de células de hámster chino V79, los ensayos de aberración cromosómica en linfocitos humanos in vitro y formación de micronúcleos de ratón in vivo, y la síntesis de ADN no programada en Ensayo in vitro de hepatocitos primarios de rata.
En ratas, se observaron disminuciones en la cantidad de cuerpos lúteos y el porcentaje de implantes con dosis de tiotropio de inhalación de 78 mcg/kg/día o más (aproximadamente 40 veces la MRHDID sobre una base de mcg/m2). No se observaron tales efectos con 9 mcg/kg/día (aproximadamente 5 veces la MRHDID sobre una base de mcg/m2). Sin embargo, el índice de fertilidad no se vio afectado con dosis de inhalación de hasta 1689 mcg/kg/día (aproximadamente 910 veces la MRHDID en base a mcg/m2).
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
Los datos limitados en humanos con el uso de SPIRIVA 9mcg HANDIHALER durante el embarazo son insuficientes para informar un riesgo asociado con el fármaco de resultados adversos relacionados con el embarazo. Según los estudios de reproducción en animales, no se observaron anomalías estructurales cuando se administró tiotropio por inhalación a ratas y conejas preñadas durante el período de organogénesis en dosis de 790 y 8 veces, respectivamente, la dosis de inhalación diaria máxima recomendada en humanos (MRHDID). Se observó un aumento de la pérdida posterior a la implantación en ratas y conejos a los que se administró tiotropio en dosis tóxicas para la madre 430 veces y 40 veces la MRHDID, respectivamente [ver Datos ].
Se desconoce el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo para la población indicada. Todos los embarazos tienen un riesgo de fondo de defecto congénito, pérdida u otros resultados adversos. En la población general de EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 % al 4 % y del 15 % al 20 %, respectivamente.
Datos
Datos de animales
En 2 estudios separados de desarrollo embriofetal, ratas y conejas preñadas recibieron tiotropio durante el período de organogénesis en dosis de hasta aproximadamente 790 y 8 veces la MRHDID, respectivamente (sobre una base de mcg/m2 en dosis de inhalación de 1471 y 7 mcg/kg /día en ratas y conejos, respectivamente). No se observó evidencia de anormalidades estructurales en ratas o conejos. Sin embargo, en ratas, el tiotropio causó reabsorción fetal, pérdida de camadas, disminuciones en el número de crías vivas al nacer y en el peso medio de las crías, y un retraso en la maduración sexual de las crías con dosis de tiotropio de aproximadamente 40 veces la MRHDID (en mcg/m2). base a una dosis de inhalación materna de 78 mcg/kg/día). En conejos, el tiotropio provocó un aumento en la pérdida posterior a la implantación con una dosis de tiotropio de aproximadamente 430 veces la MRHDID (sobre una base de mcg/m2 con una dosis de inhalación materna de 400 mcg/kg/día). Dichos efectos no se observaron con aproximadamente 5 y 95 veces la MRHDID, respectivamente (sobre una base de mcg/m2 en dosis de inhalación de 9 y 88 mcg/kg/día en ratas y conejos, respectivamente).
Lactancia
Resumen de riesgos
No hay datos sobre la presencia de tiotropio en la leche humana, los efectos sobre el lactante o los efectos sobre la producción de leche. El tiotropio está presente en la leche de ratas lactantes; sin embargo, debido a las diferencias específicas de especie en la fisiología de la lactancia, la relevancia clínica de estos datos no está clara [ver Datos ]. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de la madre de SPIRIVA HANDIHALER de 9 mcg y cualquier posible efecto adverso en el niño amamantado de SPIRIVA HANDIHALER o de la afección materna subyacente.
Datos
Se investigó la distribución de bromuro de tiotropio en la leche después de una administración intravenosa única de 10 mg/kg a ratas lactantes. El tiotropio y/o sus metabolitos están presentes en la leche de ratas lactantes en concentraciones superiores a las del plasma.
Uso pediátrico
SPIRIVA HANDIHALER no está indicado para uso en niños. No se ha establecido la seguridad y eficacia de SPIRIVA 9mcg HANDIHALER en pacientes pediátricos.
Uso geriátrico
Según los datos disponibles, no se justifica ningún ajuste de la dosis de SPIRIVA HANDIHALER en pacientes geriátricos [ver FARMACOLOGÍA CLÍNICA ].
Del número total de pacientes que recibieron SPIRIVA 9mcg HANDIHALER en los ensayos clínicos de 1 año, 426 tenían
Insuficiencia renal
Los pacientes con insuficiencia renal de moderada a grave (aclaramiento de creatinina DOSIFICACIÓN Y ADMINISTRACIÓN , ADVERTENCIAS Y PRECAUCIONES , y FARMACOLOGÍA CLÍNICA ].
Deterioro hepático
No se estudiaron los efectos de la insuficiencia hepática sobre la farmacocinética del tiotropio.
SOBREDOSIS
Las dosis altas de tiotropio pueden provocar signos y síntomas anticolinérgicos. Sin embargo, no hubo efectos adversos anticolinérgicos sistémicos después de una dosis única inhalada de hasta 282 mcg de tiotropio en 6 voluntarios sanos. En un estudio de 12 voluntarios sanos, se observó conjuntivitis bilateral y sequedad de boca después de la inhalación repetida una vez al día de 141 mcg de tiotropio.
El tratamiento de la sobredosis consiste en la suspensión de SPIRIVA HANDIHALER junto con el establecimiento de una terapia sintomática y/o de apoyo adecuada.
Ingestión Accidental
La intoxicación aguda por ingestión oral inadvertida de cápsulas de SPIRIVA es poco probable ya que no se absorbe bien sistémicamente.
Se ha notificado un caso de sobredosis a partir de la experiencia posterior a la comercialización. Se informó que una paciente inhaló 30 cápsulas durante un período de 2,5 días y desarrolló un estado mental alterado, temblores, dolor abdominal y estreñimiento severo. El paciente fue hospitalizado, se suspendió el SPIRIVA HANDIHALER y se trató el estreñimiento con un enema. El paciente se recuperó y fue dado de alta el mismo día.
CONTRAINDICACIONES
SPIRIVA 9mcg HANDIHALER está contraindicado en pacientes con hipersensibilidad al tiotropio, ipratropio o cualquiera de los componentes de este producto [ver ADVERTENCIAS Y PRECAUCIONES ]. En ensayos clínicos y experiencia posterior a la comercialización con SPIRIVA 9mcg HANDIHALER, se informaron reacciones de hipersensibilidad inmediata, incluido angioedema (que incluye hinchazón de los labios, la lengua o la garganta), picazón o erupción cutánea [ver ADVERTENCIAS Y PRECAUCIONES ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
El tiotropio es un agente antimuscarínico de acción prolongada, que a menudo se denomina anticolinérgico. Tiene una afinidad similar a los subtipos de receptores muscarínicos, M1 a M5. En las vías respiratorias, exhibe efectos farmacológicos a través de la inhibición de los receptores M3 en el músculo liso que conduce a la broncodilatación. Se demostró la naturaleza competitiva y reversible del antagonismo con receptores de origen humano y animal y preparados de órganos aislados. En estudios preclínicos in vitro e in vivo, la prevención de los efectos de broncoconstricción inducidos por la metacolina dependió de la dosis y duró más de 24 horas. La broncodilatación que sigue a la inhalación de tiotropio es predominantemente un efecto específico del sitio.
Farmacodinámica
Electrofisiología cardíaca
En un ensayo multicéntrico, aleatorizado, doble ciego que usó polvo seco de tiotropio para inhalación que inscribió a 198 pacientes con EPOC, el número de sujetos con cambios desde el intervalo QT corregido al inicio de 30 a 60 mseg fue mayor en el grupo de SPIRIVA 9mcg HANDIHALER en comparación con placebo Esta diferencia fue evidente usando las correcciones de Bazett (QTcB) [20 (20 %) pacientes frente a 12 (12 %) pacientes] y Fredericia (QTcF) [16 (16 %) pacientes frente a 1 (1 %) paciente] de QT para la frecuencia cardíaca. Ningún paciente en ninguno de los grupos tuvo QTcB o QTcF de >500 mseg. Otros estudios clínicos con SPIRIVA HANDIHALER no detectaron un efecto del fármaco en los intervalos QTc.
El efecto del polvo seco de tiotropio para inhalación en el intervalo QT también se evaluó en un estudio cruzado aleatorizado, controlado con placebo y positivo en 53 voluntarios sanos. Los sujetos recibieron polvo seco de tiotropio para inhalación de 18 mcg, 54 mcg (3 veces la dosis recomendada) o placebo durante 12 días. Las evaluaciones de ECG se realizaron al inicio del estudio y durante todo el intervalo de dosificación después de la primera y la última dosis del medicamento del estudio. En relación con el placebo, el cambio medio máximo desde el inicio en el intervalo QTc específico del estudio fue de 3,2 ms y 0,8 ms para el polvo seco de tiotropio para inhalación de 18 mcg y 54 mcg, respectivamente. Ningún sujeto mostró una nueva aparición de QTc> 500 ms o cambios de QTc desde el inicio de ≥ 60 ms.
Farmacocinética
El tiotropio se administra por inhalación de polvo seco. Algunos de los datos farmacocinéticos que se describen a continuación se obtuvieron con dosis más altas que las recomendadas para la terapia. Un estudio farmacocinético específico en pacientes con EPOC que evaluó el tiotropio administrado una vez al día por el inhalador RESPIMAT (5 mcg) y como polvo para inhalación (18 mcg) por el dispositivo HANDIHALER dio como resultado una exposición sistémica similar entre los dos productos.
Absorción
Tras la inhalación de polvo seco por parte de voluntarios jóvenes sanos, la biodisponibilidad absoluta del 19,5 % sugiere que la fracción que llega a los pulmones es altamente biodisponible. Las soluciones orales de tiotropio tienen una biodisponibilidad absoluta del 2-3%. No se espera que los alimentos influyan en la absorción de tiotropio. Las concentraciones plasmáticas máximas de tiotropio se observaron 7 minutos después de la inhalación.
Distribución
El tiotropio se une en un 72 % a las proteínas plasmáticas y tiene un volumen de distribución de 32 l/kg después de la administración intravenosa a voluntarios jóvenes sanos. Se desconocen las concentraciones locales en el pulmón, pero el modo de administración sugiere concentraciones sustancialmente más altas en el pulmón. Los estudios en ratas han demostrado que el tiotropio no penetra fácilmente la barrera hematoencefálica.
Eliminación
La semivida terminal del tiotropio en pacientes con EPOC tras la inhalación una vez al día de 5 mcg de tiotropio fue de aproximadamente 25 horas. El aclaramiento total fue de 880 ml/min después de la administración intravenosa en voluntarios jóvenes sanos. Después de la inhalación crónica de polvo seco una vez al día por parte de pacientes con EPOC, el estado de equilibrio farmacocinético se alcanzó el día 7 sin acumulación posterior.
Metabolismo
La extensión del metabolismo es pequeña. Esto es evidente a partir de una excreción urinaria del 74 % de la sustancia inalterada después de una dosis intravenosa a voluntarios jóvenes sanos. El tiotropio, un éster, se escinde de manera no enzimática al alcohol N-metilscopina y al ácido ditienilglicólico, ninguno de los cuales se une a los receptores muscarínicos.
Los experimentos in vitro con microsomas hepáticos humanos y hepatocitos humanos sugieren que una fracción de la dosis administrada (el 74 % de una dosis intravenosa se excreta sin cambios en la orina, dejando un 25 % para el metabolismo) se metaboliza mediante oxidación dependiente del citocromo P450 y posterior conjugación con glutatión. a una variedad de metabolitos de fase II. Esta vía enzimática puede ser inhibida por inhibidores de CYP450 2D6 y 3A4, como quinidina, ketoconazol y gestodeno. Así, CYP450 2D6 y 3A4 están implicados en la vía metabólica responsable de la eliminación de una pequeña parte de la dosis administrada. Los estudios in vitro con microsomas hepáticos humanos mostraron que el tiotropio en concentraciones supraterapéuticas no inhibió CYP450 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 o 3A4.
Excreción
El bromuro de tiotropio administrado por vía intravenosa se excreta principalmente sin cambios en la orina (74%). Después de la inhalación de polvo seco en pacientes con EPOC en estado estacionario, la excreción urinaria fue del 7 % (1,3 mcg) de la dosis sin cambios durante 24 horas. El aclaramiento renal de tiotropio excede el aclaramiento de creatinina, lo que indica secreción en la orina.
Poblaciones Específicas
Pacientes geriátricos
Como se esperaba para todos los fármacos excretados predominantemente por vía renal, la edad avanzada se asoció con una disminución del aclaramiento renal de tiotropio (365 ml/min en pacientes con EPOC
Insuficiencia renal
Después de 4 semanas de SPIRIVA 9 mcg HANDIHALER o SPIRIVA 9 mcg RESPIMAT una vez al día en pacientes con EPOC, la insuficiencia renal leve (depuración de creatinina 60-
Deterioro hepático
No se estudiaron los efectos de la insuficiencia hepática sobre la farmacocinética del tiotropio.
Interacciones con la drogas
Se realizó un estudio de interacción con tiotropio (14,4 mcg en infusión intravenosa durante 15 minutos) y cimetidina 400 mg tres veces al día o ranitidina 300 mg una vez al día. La administración concomitante de cimetidina con tiotropio resultó en un aumento del 20 % en el AUC0-4h, una disminución del 28 % en el aclaramiento renal de tiotropio y ningún cambio significativo en la Cmax y la cantidad excretada en la orina durante 96 horas. La coadministración de tiotropio con ranitidina no afectó la farmacocinética de tiotropio.
No se encontró que los medicamentos concomitantes comunes (agonistas beta2-adrenérgicos de acción prolongada (LABA), corticosteroides inhalados (ICS)) utilizados por pacientes con EPOC alteren la exposición al tiotropio.
Estudios clínicos
El programa de desarrollo clínico de SPIRIVA 9mcg HANDIHALER (polvo para inhalación de bromuro de tiotropio) consistió en seis estudios de fase 3 en 2663 pacientes con EPOC (1308 recibieron SPIRIVA 9mcg HANDIHALER): dos estudios de 1 año controlados con placebo, dos estudios de 6 meses controlados con placebo y dos estudios controlados con ipratropio de 1 año. Estos estudios reclutaron pacientes que tenían un diagnóstico clínico de EPOC, tenían 40 años de edad o más, tenían antecedentes de tabaquismo de más de 10 paquetes-año, tenían un volumen espiratorio forzado en un segundo (FEV1) inferior o igual al 60 %. o 65% del predicho, y una razón de FEV1/FVC menor o igual a 0.7.
En estos estudios, SPIRIVA HANDIHALER, administrado una vez al día por la mañana, mejoró la función pulmonar (FEV1), con un efecto máximo dentro de las 3 horas posteriores a la primera dosis.
Dos ensayos adicionales evaluaron las exacerbaciones: un ensayo clínico multicéntrico, aleatorizado, doble ciego, controlado con placebo, de 6 meses de duración de 1829 pacientes con EPOC en un entorno de Asuntos de Veteranos de EE. UU. y un ensayo clínico aleatorizado, doble ciego, controlado con placebo, de 4 años ensayo clínico multicéntrico de 5992 pacientes con EPOC. Los efectos a largo plazo sobre la función pulmonar y otros resultados también se evaluaron en el ensayo multicéntrico de 4 años.
Efectos de 6 meses a 1 año sobre la función pulmonar
En los ensayos controlados con placebo de 1 año, la mejora media del FEV1 a los 30 minutos fue de 0,13 litros (13 %) con una mejora máxima de 0,24 litros (24 %) en relación con el valor inicial después de la primera dosis (Día 1). Se observaron mejoras adicionales en el FEV1 y la capacidad vital forzada (FVC) con el estado estacionario farmacodinámico alcanzado el día 8 con el tratamiento una vez al día. La mejora máxima media en FEV1, en relación con el valor inicial, fue de 0,28 a 0,31 litros (28 % a 31 %), después de 1 semana (Día 8) de tratamiento una vez al día. La mejora de la función pulmonar se mantuvo durante 24 horas después de una dosis única y se mantuvo constantemente durante el período de tratamiento de 1 año sin evidencia de tolerancia.
En los dos ensayos controlados con placebo de 6 meses, las evaluaciones espirométricas en serie se realizaron durante las horas del día en el Ensayo A (12 horas) y se limitaron a 3 horas en el Ensayo B. Los valores seriales de FEV1 durante 12 horas (Ensayo A) se muestran en Figura 1. Estos ensayos respaldan aún más la mejora en la función pulmonar (FEV1) con SPIRIVA 9mcg HANDIHALER, que persistió durante el período de observación espirométrica. La eficacia se mantuvo durante 24 horas después de la administración durante el período de tratamiento de 6 meses.
Figura 1: FEV1 medio a lo largo del tiempo (antes y después de la administración del fármaco del estudio) en los días 1 y 169 para el ensayo A (un estudio controlado con placebo de seis meses)* 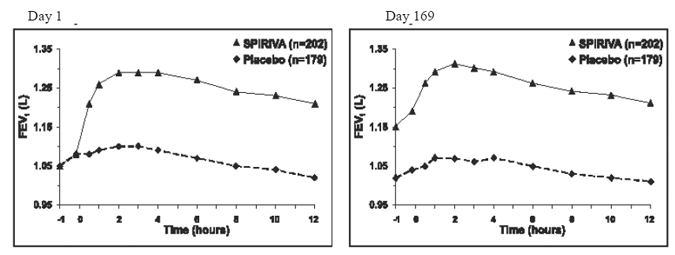
*Medias ajustadas por efecto de centro, tratamiento y línea base. El día 169, un total de 183 y 149 pacientes en los grupos de SPIRIVA HANDIHALER y placebo, respectivamente, completaron el ensayo. Los datos de los pacientes restantes se imputaron utilizando la última observación o la observación menos favorable llevada adelante.
Los resultados de cada uno de los ensayos controlados con ipratropio de 1 año fueron similares a los resultados de los ensayos controlados con placebo de 1 año. Los resultados de uno de estos ensayos se muestran en la Figura 2.
Figura 2: FEV1 medio a lo largo del tiempo (0 a 6 horas después de la dosis) en los días 1 y 92, respectivamente para uno de los dos estudios controlados con ipratropio* 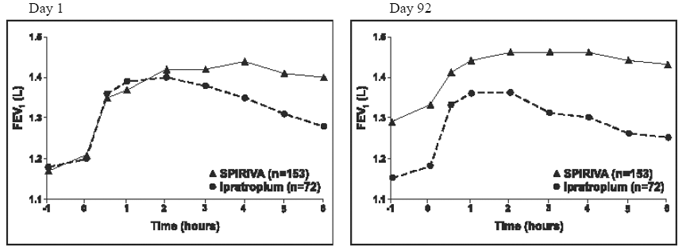
*Medias ajustadas por efecto de centro, tratamiento y línea base. El día 92 (variable principal), un total de 151 y 69 pacientes en los grupos de SPIRIVA HANDIHALER e ipratropio, respectivamente, completaron los 3 meses de observación. Los datos de los pacientes restantes se imputaron utilizando la última observación o la observación menos favorable llevada adelante.
Un estudio clínico aleatorizado, controlado con placebo en 105 pacientes con EPOC demostró que la broncodilatación se mantuvo durante el intervalo de dosificación de 24 horas en comparación con el placebo, independientemente de si SPIRIVA 9mcg HANDIHALER se administró por la mañana o por la noche.
lo largo de cada semana del período de tratamiento de 1 año en los dos ensayos controlados con placebo, los pacientes que tomaron SPIRIVA 9 mcg HANDIHALER tuvieron un requerimiento reducido para el uso de agonistas beta2 de acción corta de rescate. En uno de los dos estudios de 6 meses se demostró una reducción en el uso de agonistas beta2 de acción corta de rescate, en comparación con el placebo.
Efectos de 4 años sobre la función pulmonar
Se realizó un ensayo clínico multicéntrico, aleatorizado, doble ciego, controlado con placebo y de 4 años de duración en el que participaron 5992 pacientes con EPOC para evaluar los efectos a largo plazo de SPIRIVA HANDIHALER en la progresión de la enfermedad (tasa de disminución del FEV1). A los pacientes se les permitió usar todos los medicamentos respiratorios (incluidos los agonistas beta de acción corta y de acción prolongada, los esteroides sistémicos e inhalados y las teofilinas) distintos de los anticolinérgicos inhalados. Los pacientes tenían entre 40 y 88 años de edad, el 75 % eran hombres y el 90 % eran caucásicos con un diagnóstico de EPOC y un VEF1 medio previo al broncodilatador del 39 % previsto (rango = 9 % a 76 %) al ingresar al estudio. No hubo diferencias entre los grupos en ninguno de los criterios de valoración coprimarios de eficacia, la tasa anual de disminución del FEV1 antes y después del broncodilatador, como lo demuestran las pendientes similares de disminución del FEV1 a lo largo del tiempo (Figura 3).
SPIRIVA HANDIHALER mantuvo las mejoras en el FEV1 mínimo (antes de la dosis) (medias ajustadas a lo largo del tiempo: 87 a 103 ml) a lo largo de los 4 años del estudio (Figura 3).
Figura 3: Valores medios de FEV1 valle (antes de la dosis) en cada punto de tiempo 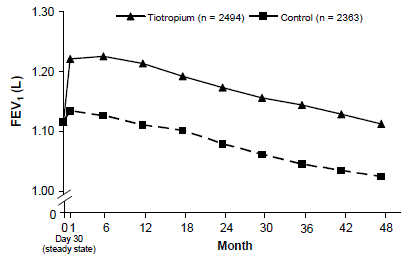
Se utilizó ANOVA de medidas repetidas para estimar las medias. Las medias se ajustan para las mediciones de referencia. FEV1 mínimo basal (media observada) = 1,12. Se incluyeron en el análisis los pacientes con ≥3 pruebas de función pulmonar aceptables después del día 30 y un valor inicial sin perder.
exacerbaciones
El efecto de SPIRIVA 9mcg HANDIHALER en las exacerbaciones de la EPOC se evaluó en dos ensayos clínicos: un ensayo clínico de 4 años descrito anteriormente y un ensayo clínico de 6 meses de 1829 pacientes con EPOC en un entorno de Asuntos de Veteranos. En el ensayo de 6 meses, las exacerbaciones de la EPOC se definieron como un conjunto de síntomas respiratorios (aumento o nueva aparición) de más de uno de los siguientes: tos, esputo, sibilancias, disnea u opresión en el pecho con una duración de al menos 3 días que requiere tratamiento con antibióticos, esteroides sistémicos u hospitalización. La población tenía una edad que oscilaba entre los 40 y los 90 años, con un 99 % de hombres, un 91 % de raza caucásica, y tenía EPOC con un porcentaje predicho de VEF1 medio prebroncodilatador del 36 % (rango = 8 % a 93 %). A los pacientes se les permitió usar medicamentos respiratorios (incluidos los agonistas beta de acción corta y de acción prolongada, los esteroides sistémicos e inhalados y las teofilinas) distintos de los anticolinérgicos inhalados. En el ensayo de 6 meses, los criterios de valoración coprimarios fueron la proporción de pacientes con exacerbación de la EPOC y la proporción de pacientes hospitalizados debido a la exacerbación de la EPOC. SPIRIVA 9mcg HANDIHALER redujo significativamente la proporción de pacientes con EPOC que experimentaron exacerbaciones en comparación con el placebo (27,9 % frente a 32,3 %, respectivamente; Odds Ratio (OR) (tiotropio/placebo) = 0,81; IC del 95 % = 0,66, 0,99; p = 0,037 ). La proporción de pacientes con hospitalización debido a exacerbaciones de la EPOC en pacientes que usaron SPIRIVA 9mcg HANDIHALER en comparación con el placebo fue del 7,0 % frente al 9,5 %, respectivamente; OR = 0,72; IC del 95 % = 0,51; 1,01; p = 0,056.
Las exacerbaciones se evaluaron como resultado secundario en el ensayo multicéntrico de 4 años. En este ensayo, las exacerbaciones de la EPOC se definieron como un aumento o nueva aparición de más de uno de los siguientes síntomas respiratorios (tos, esputo, esputo purulento, sibilancias, disnea) con una duración de tres o más días que requieren tratamiento con antibióticos y/o esteroides sistémicos (orales, intramusculares o intravenosos). SPIRIVA HANDIHALER redujo significativamente el riesgo de una exacerbación en un 14 % (Hazard Ratio (HR) = 0,86; IC del 95 % = 0,81, 0,91; p
Mortalidad por cualquier causa
En el ensayo de función pulmonar controlado con placebo de 4 años descrito anteriormente, se evaluó la mortalidad por todas las causas en comparación con el placebo. No hubo diferencias significativas en las tasas de mortalidad por todas las causas entre SPIRIVA 9mcg HANDIHALER y el placebo.
La mortalidad por todas las causas de SPIRIVA HANDIHALER también se comparó con el aerosol de inhalación de tiotropio de 5 mcg (SPIRIVA RESPIMAT 5 mcg) en un estudio adicional a largo plazo, aleatorizado, doble ciego, con doble simulación y control activo con un período de observación de hasta 3 años. La mortalidad por todas las causas fue similar entre SPIRIVA 9mcg HANDIHALER y SPIRIVA RESPIMAT.
INFORMACIÓN DEL PACIENTE
ESPIRIVA 9mcgR® (habla REE vah) HANDIHALER® (bromuro de tiotropio) Polvo para inhalación, para uso por inhalación oral
NO trague las cápsulas de SPIRIVA.
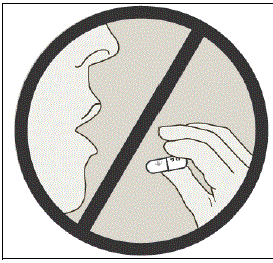
Información importante: No trague las cápsulas de SPIRIVA. Las cápsulas de SPIRIVA de 9 mcg solo deben usarse con el dispositivo HANDIHALER e inhalarse por la boca (inhalación oral).
Lea la información que viene con su SPIRIVA HANDIHALER antes de comenzar a usarlo y cada vez que renueve su receta. Es posible que haya nueva información. Este prospecto no reemplaza la conversación con su médico sobre su condición médica o su tratamiento.
¿Qué es SPIRIVA HANDIHALER?
- SPIRIVA HANDIHALER es un medicamento recetado que se usa todos los días (un medicamento de mantenimiento) para controlar los síntomas de la enfermedad pulmonar obstructiva crónica (EPOC), incluidos la bronquitis crónica y el enfisema.
- SPIRIVA HANDIHALER ayuda a que tus pulmones funcionen mejor durante 24 horas. SPIRIVA 9mcg HANDIHALER relaja las vías respiratorias y ayuda a mantenerlas abiertas. Puede comenzar a sentir que es más fácil respirar el primer día, pero puede llevar más tiempo sentir los efectos completos del medicamento. SPIRIVA HANDIHALER funciona mejor y puede ayudar a que sea más fácil respirar cuando lo usa todos los días.
- SPIRIVA 9mcg HANDIHALER reduce la probabilidad de brotes y empeoramiento de los síntomas de la EPOC (exacerbaciones de la EPOC). Una exacerbación de la EPOC se define como un aumento o una nueva aparición de más de un síntoma de la EPOC, como tos, mucosidad, dificultad para respirar y sibilancias, que requiere medicamentos más allá de su medicamento de rescate.
SPIRIVA 9mcg HANDIHALER no es un medicamento de rescate y no debe usarse para tratar problemas respiratorios repentinos. Es posible que su médico le dé otros medicamentos para que los use en caso de problemas respiratorios repentinos.
No se sabe si SPIRIVA 9mcg HANDIHALER es seguro y efectivo en niños.
¿Quién no debe tomar SPIRIVA 9mcg HANDIHALER?
No use SPIRIVA 9mcg HANDIHALER si usted:
- es alérgico al tiotropio, al ipratropio (Atrovent®) oa cualquiera de los ingredientes de SPIRIVA 9mcg HANDIHALER. Consulte el final de este prospecto para obtener una lista completa de los ingredientes de SPIRIVA 9mcg HANDIHALER.
Los síntomas de una reacción alérgica grave a SPIRIVA 9mcg HANDIHALER pueden incluir:
- manchas rojas elevadas en la piel (urticaria)
- Comezón
- sarpullido
- hinchazón de la cara, labios, lengua y garganta que puede causar dificultad para respirar o tragar
Si tiene estos síntomas de una reacción alérgica, deje de tomar SPIRIVA HANDIHALER y llame a su médico de inmediato o acuda a la sala de emergencias del hospital más cercano.
¿Qué debo decirle a mi médico antes de usar SPIRIVA HANDIHALER?
Antes de tomar SPIRIVA HANDIHALER, informe a su médico acerca de todas sus condiciones médicas, incluso si usted:
- tiene problemas renales.
- tener glaucoma. SPIRIVA HANDIHALER puede empeorar su glaucoma.
- tiene agrandamiento de la próstata, problemas para orinar o una obstrucción en la vejiga. SPIRIVA 9mcg HANDIHALER puede empeorar estos problemas.
- está embarazada o planea quedar embarazada. No se sabe si SPIRIVA HANDIHALER podría dañar a su bebé nonato.
- está amamantando o planea amamantar. No se sabe si SPIRIVA HANDIHALER pasa a la leche materna. Usted y su médico decidirán si SPIRIVA 9mcg HANDIHALER es adecuado para usted mientras amamanta.
- tiene una alergia severa a las proteínas de la leche. Pregúntele a su médico si no está seguro.
Informe a su médico sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre y gotas para los ojos, vitaminas y suplementos herbales. Algunos de sus otros medicamentos o suplementos pueden afectar la forma en que actúa SPIRIVA HANDIHALER. SPIRIVA 9mcg HANDIHALER es un medicamento anticolinérgico. No debe tomar otros medicamentos anticolinérgicos mientras usa SPIRIVA 9mcg HANDIHALER, incluido el ipratropio. Pregúntele a su médico o farmacéutico si no está seguro de si uno de sus medicamentos es un anticolinérgico.
Conozca los medicamentos que toma. Mantenga una lista de sus medicamentos con usted para mostrársela a su médico y farmacéutico cuando obtenga un nuevo medicamento.
¿Cómo debo tomar SPIRIVA 9mcg HANDIHALER?
- Use SPIRIVA 9mcg HANDIHALER exactamente según lo prescrito. Use SPIRIVA HANDIHALER una vez al día.
- Lea las “Instrucciones de uso” al final de este prospecto antes de usar SPIRIVA HANDIHALER. Hable con su médico si no entiende las instrucciones.
- No trague las cápsulas de SPIRIVA 9mcg.
- Utilice únicamente cápsulas de SPIRIVA de 9 mcg con el dispositivo HANDIHALER.
- No utilice el dispositivo HANDIHALER para tomar ningún otro medicamento.
- SPIRIVA 9mcg HANDIHALER viene en forma de polvo en una cápsula de SPIRIVA 9mcg que se adapta al dispositivo HANDIHALER. Cada cápsula de SPIRIVA, que contiene solo una pequeña cantidad de polvo de SPIRIVA, es una dosis completa de medicamento.
- Separe un blíster de la tarjeta blíster. Luego, saque una de las cápsulas de SPIRIVA de 9 mcg del blíster justo antes de usarla.
- Después de perforar la cápsula, tome una dosis completa de SPIRIVA HANDIHALER inhalando el polvo por la boca dos veces, usando el dispositivo HANDIHALER (tome 2 inhalaciones de una cápsula de SPIRIVA). Ver el "Instrucciones de uso" al final de este folleto.
- Deseche cualquier cápsula de SPIRIVA que no se use inmediatamente después de sacarla del blíster. No deje las cápsulas de SPIRIVA abiertas al aire; es posible que no funcionen tan bien.
- Si olvida una dosis, tómela tan pronto como lo recuerde. No use SPIRIVA HANDIHALER más de una vez cada 24 horas. ? Si usa más de la dosis prescrita de SPIRIVA HANDIHALER, llame a su médico oa un centro de control de envenenamiento.
¿Qué debo evitar mientras uso SPIRIVA 9mcg HANDIHALER?
- No permita que el polvo de la cápsula de SPIRIVA entre en contacto con sus ojos. Su visión puede volverse borrosa y la pupila de su ojo puede agrandarse (dilatarse). Si esto sucede, llame a su médico.
- SPIRIVA 9mcg HANDIHALER puede causar mareos y visión borrosa. Si experimenta estos síntomas, debe tener cuidado al participar en actividades como conducir un automóvil u operar electrodomésticos u otras máquinas.
¿Cuáles son los posibles efectos secundarios de SPIRIVA HANDIHALER?
SPIRIVA 9mcg HANDIHALER puede causar efectos secundarios graves, que incluyen: Reacción alérgica. Los síntomas pueden incluir:
- manchas rojas elevadas en la piel (urticaria)
- Comezón
- sarpullido
- hinchazón de los labios, la lengua o la garganta que puede causar dificultad para respirar o tragar
Si tiene estos síntomas de una reacción alérgica, deje de tomar SPIRIVA HANDIHALER y llame a su médico de inmediato o acuda a la sala de emergencias del hospital más cercano.
- Estrechamiento y bloqueo repentinos de las vías respiratorias hacia los pulmones (broncoespasmo) . Su respiración de repente empeora.
Si tiene estos síntomas de broncoespasmo, deje de tomar SPIRIVA 9mcg HANDIHALER y llame a su médico de inmediato o acuda a la sala de emergencias del hospital más cercano.
- Aumento de la presión en los ojos nuevo o que ha empeorado (glaucoma agudo de ángulo estrecho). Los síntomas del glaucoma agudo de ángulo estrecho pueden incluir:
- dolor de ojo
- visión borrosa
- ver halos (halos visuales) o imágenes en color junto con ojos rojos
Usar solo gotas para los ojos para tratar estos síntomas puede no funcionar. Si tiene estos síntomas, deje de tomar SPIRIVA HANDIHALER y llame a su médico de inmediato.
- Retención urinaria nueva o empeorada. Los síntomas de obstrucción en la vejiga y/o agrandamiento de la próstata pueden incluir: dificultad para orinar, dolor al orinar.
Si tiene estos síntomas de retención urinaria, deje de tomar SPIRIVA HANDIHALER y llame a su médico de inmediato.
Otros efectos secundarios con SPIRIVA 9mcg HANDIHALER incluyen:
- infección del tracto respiratorio superior
- boca seca
- Infección sinusal
- dolor de garganta
- dolor torácico inespecífico
- infección del tracto urinario
- indigestión
- nariz que moquea
- estreñimiento
- aumento del ritmo cardíaco
- visión borrosa
Estos no son todos los efectos secundarios posibles con SPIRIVA HANDIHALER. Informe a su médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo guardo SPIRIVA HANDIHALER?
- No guarde las cápsulas de SPIRIVA en el dispositivo HANDIHALER.
- Guarde las cápsulas de SPIRIVA en el blíster sellado a temperatura ambiente de 68 °F a 77 °F (20 °C a 25 °C).
- Mantenga las cápsulas de SPIRIVA alejadas del calor y el frío (no las congele).
- Guarde las cápsulas de SPIRIVA 9mcg en un lugar seco. Deseche las cápsulas de SPIRIVA de 9 mcg que no haya utilizado y que hayan estado expuestas al aire.
Pregúntele a su médico o farmacéutico si tiene alguna pregunta sobre el almacenamiento de sus cápsulas de SPIRIVA 9mcg.
Mantenga SPIRIVA HANDIHALER, SPIRIVA 9mcg en cápsulas y todos los medicamentos fuera del alcance de los niños.
Información general sobre SPIRIVA HANDIHALER
A veces, los medicamentos se prescriben para fines distintos a los que se enumeran en los folletos de información para el paciente. No use SPIRIVA 9mcg HANDIHALER para un propósito para el cual no ha sido recetado. No administre SPIRIVA HANDIHALER a otras personas, incluso si tienen los mismos síntomas que usted. Puede que les haga daño.
Para obtener más información sobre SPIRIVA HANDIHALER, hable con su médico. Puede pedirle a su médico o farmacéutico información sobre SPIRIVA 9mcg HANDIHALER que está escrita para profesionales de la salud.
Para obtener más información sobre SPIRIVA 9mcg HANDIHALER, visite www.SPIRIVA.com, o escanee el código a continuación, o llame a Boehringer Ingelheim Pharmaceuticals, Inc. al 1-800-542-6257 o (TTY) 1-800-459-9906.
¿Cuáles son los ingredientes de SPIRIVA 9mcg HANDIHALER?
Ingrediente activo: tiotropio
Ingrediente inactivo: Lactosa monohidrato
¿Qué es la EPOC (Enfermedad Pulmonar Obstructiva Crónica)?
La EPOC es una enfermedad pulmonar grave que incluye bronquitis crónica, enfisema o ambos. La mayoría de las EPOC son causadas por fumar. Cuando tiene EPOC, sus vías respiratorias se estrechan. Entonces, el aire sale de sus pulmones más lentamente. Esto hace que sea difícil respirar.
Esta información para el paciente ha sido aprobada por la Administración de Drogas y Alimentos de los Estados Unidos.
INSTRUCCIONES DE USOSPIRIVA® (habla REE vah) HANDIHALER® (bromuro de tiotropio) polvo para inhalación, para inhalación oral
No trague las cápsulas de SPIRIVA.
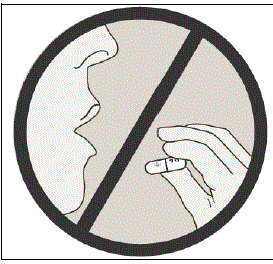
Información importante sobre el uso de su SPIRIVA HANDIHALER
- No trague las cápsulas de SPIRIVA 9mcg.
- Las cápsulas de SPIRIVA solo deben usarse con el dispositivo HANDIHALER e inhalarse por la boca (inhalación oral).
- No utilice su dispositivo HANDIHALER para tomar ningún otro medicamento.
Primero lea la Información para el paciente, luego lea estas Instrucciones de uso antes de comenzar a usar SPIRIVA HANDIHALER y cada vez que renueve su receta. Es posible que haya nueva información.
Familiarizarse con su dispositivo HANDIHALER y las cápsulas SPIRIVA:
Su SPIRIVA HANDIHALER viene con cápsulas de SPIRIVA 9mcg en blíster y un dispositivo HANDIHALER. Utilice el nuevo dispositivo HANDIHALER proporcionado con su medicamento.
Las partes de su dispositivo HANDIHALER incluyen:
(Ver Figura A)
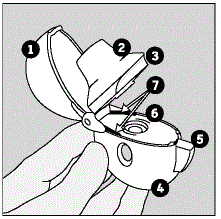
Figura A
Cada cápsula de SPIRIVA 9mcg está envasada en un blíster. (Ver Figura B)
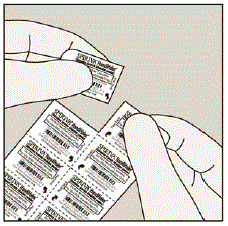
Figura B
- Cada cápsula de SPIRIVA contiene solo una pequeña cantidad de polvo. (Vea la Figura C) Esta es 1 dosis completa.
- No abra la cápsula de SPIRIVA 9mcg o puede que no funcione.

Figura C
Tomar su dosis diaria completa de medicamento requiere 4 pasos principales.
Paso 1. Apertura de su dispositivo HANDIHALER:
Después de sacar su dispositivo HANDIHALER de la bolsa:
- Abra la tapa antipolvo (tapa) presionando el botón perforador verde. (Ver Figura D)
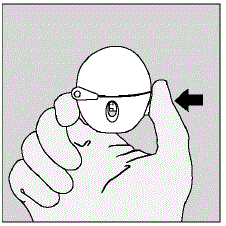
Figura D
- Tire de la tapa antipolvo (tapa) hacia arriba alejándola de la base para exponer la boquilla. (Ver Figura E)
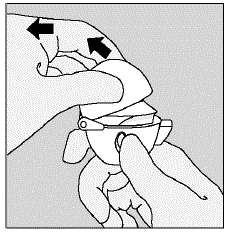
Figura E
- Abra la boquilla tirando del borde de la boquilla hacia arriba y hacia afuera de la base para que se vea la cámara central. (Ver Figura F)

Figura F
Paso 2. Inserción de la cápsula de SPIRIVA 9mcg en su dispositivo HANDIHALER:
Cada día, separe solo 1 de los blísteres de la tarjeta de blíster rasgando a lo largo de la línea perforada. (Ver Figura G)
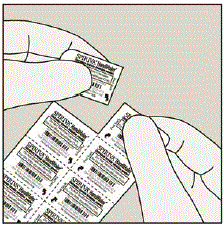
Figura G
Retire la cápsula de SPIRIVA del blíster:
- No haga corte la lámina o utilice instrumentos afilados para sacar la cápsula de SPIRIVA del blíster.
- Doble una de las esquinas del blíster con una flecha y separe las capas de papel de aluminio.
- Despegue la lámina impresa hasta que vea toda la cápsula de SPIRIVA. (Ver Figura H)
- Si ha abierto más de 1 blíster al aire, la cápsula extra de SPIRIVA 9mcg no debe usarse y debe desecharse.
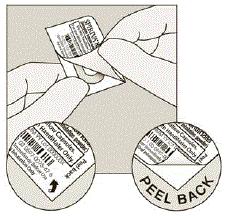
Figura H
Coloque la cápsula de SPIRIVA de 9 mcg en la cámara central de su dispositivo HANDIHALER. (Ver Figura I)
figura yo
Cierre la boquilla firmemente contra la base gris hasta que escuche un clic. Deje la tapa antipolvo (tapa) abierta. (Ver Figura J)
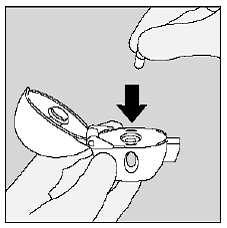
Figura J
Paso 3. Perforación de la cápsula de SPIRIVA 9mcg:
- Sostenga su dispositivo HANDIHALER con la boquilla apuntando hacia arriba. (Ver Figura K)
- Presione el botón perforador verde una vez hasta que quede plano (al ras) contra la base, luego suéltelo. Así es como hace agujeros en la cápsula de SPIRIVA para que reciba su medicamento cuando inhale.
- No haga presione el botón verde más de una vez.
- No haga agite su dispositivo HANDIHALER.
- La perforación de la cápsula de SPIRIVA 9mcg puede producir pequeñas trozos de gelatina. Algunas de estas piezas pequeñas pueden pasar a través de la pantalla de su dispositivo HANDIHALER hacia su boca o garganta cuando inhala su medicamento. Esto es normal. Los pequeños trozos de gelatina no deberían hacerte daño.
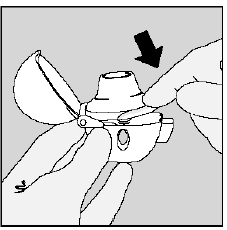
Figura K
Paso 4. Tomando su dosis diaria completa (2 inhalaciones de la misma cápsula de SPIRIVA 9mcg):
Exhala completamente en 1 respiración, vaciando sus pulmones de cualquier aire. (Ver Figura L)
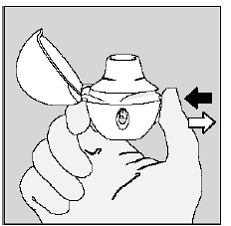
Figura L
Importante: No respire en su dispositivo HANDIHALER.
Con su próxima respiración, tome su medicamento:
- Mantenga la cabeza en posición vertical mientras mira al frente. (Ver Figura M)
- Lleve su dispositivo HANDIHALER a su boca en posición horizontal. No haga bloquee las rejillas de entrada de aire.
- Cierra los labios con fuerza alrededor de la boquilla.
- respira profundamente hasta que sus pulmones estén llenos. Debería escuchar o sentir la cápsula SPIRIVA vibrar (traqueteo). (Ver Figura M)
- Aguante la respiración durante unos segundos y, al mismo tiempo, quítese el dispositivo HANDIHALER de la boca.
- Vuelva a respirar normalmente.
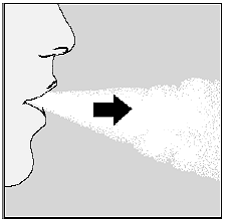
Figura M
El sonajero te dice que has inhalado correctamente. Si no escucha ni siente un traqueteo, consulte la sección “Si no escucha ni siente el traqueteo de la cápsula de SPIRIVA al inhalar su medicamento”.
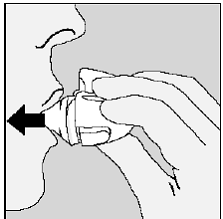
Figura N
Para obtener su dosis diaria completa, debe volver a exhalar por completo (consulte la Figura N) y, por segunda vez, inhale (consulte la Figura O) de la misma cápsula de SPIRIVA.
Importante: No presione el botón de perforación verde nuevamente.
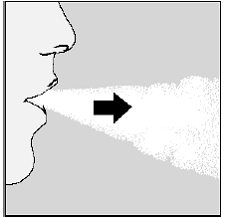
Figura O
Recuerda: Para obtener su dosis completa de medicamento cada día, debe inhalar 2 veces de la misma cápsula de SPIRIVA de 9 mcg. Asegúrese de exhalar completamente cada vez antes de inhalar desde su dispositivo HANDIHALER.
Cuidado y almacenamiento de su SPIRIVA HANDIHALER:
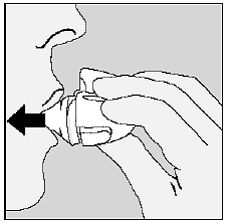
Figura P
- Después de tomar su dosis diaria, abra la boquilla y arroje la cápsula SPIRIVA 9mcg usada a la basura, sin tocarla.
- Elimine cualquier fragmento de cápsula de SPIRIVA 9 mcg o acumulación de polvo de SPIRIVA 9 mcg volteando el dispositivo HANDIHALER y golpeándolo suavemente, pero con firmeza. (Vea la Figura P) Luego, cierre la boquilla y la tapa antipolvo para guardarlos.
- No haga guarde su dispositivo HANDIHALER y las cápsulas (ampollas) de SPIRIVA 9mcg en un lugar húmedo. Guarde siempre las cápsulas de SPIRIVA en los blísteres sellados.
Si no escucha ni siente el traqueteo de la cápsula de SPIRIVA de 9 mcg al inhalar su medicamento:
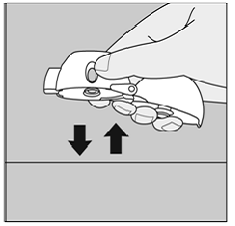
Figura Q
No haga presione el botón de perforación verde nuevamente.
Sostenga su dispositivo HANDIHALER con la boquilla apuntando hacia arriba y golpee suavemente su dispositivo HANDIHALER sobre una mesa. (Ver Figura Q)
Verifique que la boquilla esté completamente cerrada. Exhale completamente antes de volver a inspirar profundamente con la boquilla en la boca. (Ver Figura O)
Si aún no escucha ni siente el traqueteo de la cápsula SPIRIVA después de repetir los pasos anteriores:
- Deseche la cápsula de SPIRIVA.
- Abra la base levantando el botón de perforación verde y verifique que no haya piezas de la cápsula de SPIRIVA 9mcg en la cámara central. Las piezas de la cápsula de SPIRIVA 9mcg en la cámara central pueden hacer que la cápsula de SPIRIVA 9mcg no vibre.
- Dé la vuelta a su dispositivo HANDIHALER y golpee suavemente, pero con firmeza, para retirar las piezas de la cápsula de SPIRIVA. Llame a su médico para recibir instrucciones.
Limpieza de su dispositivo HANDIHALER:
Limpie su dispositivo HANDIHALER según sea necesario. (Ver Figura R)
- Se tarda 24 horas en secar al aire su dispositivo HANDIHALER después de limpiarlo.
- No haga utilice agentes de limpieza o detergentes.
- No haga coloque su dispositivo HANDIHALER en el lavavajillas para limpiarlo.
Pasos de limpieza:
- Abra la tapa antipolvo y la boquilla.
- Abra la base levantando el botón perforador verde.
- Busque en la cámara central fragmentos de cápsulas de SPIRIVA de 9 mcg o acumulación de polvo. Si se ve, toque hacia fuera.
- Enjuague su dispositivo HANDIHALER con agua tibia, presionando el botón de perforación verde varias veces para que la cámara central y la aguja de perforación queden bajo el agua corriente. Verifique que se elimine cualquier acumulación de polvo o fragmentos de cápsulas de SPIRIVA.
- Seque bien su dispositivo HANDIHALER tirando el exceso de agua sobre una toalla de papel. Seque al aire después, dejando abierta la tapa antipolvo, la boquilla y la base extendiéndola completamente para que se seque por completo.
- No haga utilice un secador de pelo para secar su dispositivo HANDIHALER.
- No haga use su dispositivo HANDIHALER cuando esté mojado. Si es necesario, puede limpiar el exterior de la boquilla con un paño limpio y húmedo.
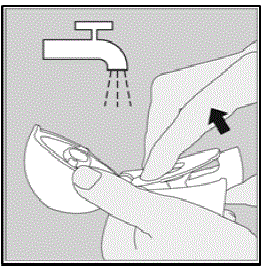
Figura R
Sugerencias útiles para asegurarse de que está tomando correctamente su dosis diaria completa de SPIRIVA 9mcg HANDIHALER:
- Prensa el botón de perforación verde vez; Inhala 2 veces; exhala por completo antes de cada una de las 2 inhalaciones.
- Utilice siempre el nuevo dispositivo HANDIHALER proporcionado con su medicamento.
- Mantenga su dispositivo HANDIHALER con la boquilla apuntando hacia arriba cuando presione el botón perforador verde.
- Presione el botón de perforación verde 1 vez para perforar la cápsula de SPIRIVA.
- No exhale en su dispositivo HANDIHALER.
- Mantenga su dispositivo HANDIHALER en posición horizontal y mantenga la cabeza erguida, mirando al frente, cuando inhale.
- Revise la cámara central de su dispositivo HANDIHALER en busca de fragmentos de cápsulas de SPIRIVA 9mcg o acumulación de polvo. Si se ven pedazos o polvo, golpee antes de usar.
- Limpie su HANDIHALER según sea necesario y séquelo completamente.
Para obtener más información, consulte a su médico o farmacéutico, visite www.spiriva.com, escanee el código a continuación o llame al 1-800-542-6257 o (TTY) 1-800-459-9906.
Estas Instrucciones de uso han sido aprobadas por la Administración de Drogas y Alimentos de EE. UU.
