Singulair 10mg, 4mg, 5mg Montelukast Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Singulair y cómo se utiliza?
Singulair 5 mg es un medicamento recetado que se usa para tratar los síntomas del asma, el broncoespasmo inducido por el ejercicio y la rinitis alérgica o permanente (perenne). Singulair se puede usar solo o con otros medicamentos.
- Singulair pertenece a una clase de medicamentos llamados antagonistas de los receptores de leucotrienos.
- No se sabe si Singulair es seguro y eficaz en niños menores de 1 año.
¿Cuáles son los posibles efectos secundarios de Singulair?
Singulair puede causar efectos secundarios graves que incluyen:
- cambios inusuales en el estado de ánimo o el comportamiento,
- erupción cutanea,
- hematomas,
- hormigueo severo,
- entumecimiento,
- dolor,
- debilidad muscular,
- dolor de oído,
- hinchazón,
- calor,
- fiebre,
- dolor de garganta,
- hinchazón en la cara o la lengua,
- ardiendo en tus ojos, y
- dolor en la piel, seguido de una erupción roja o morada que se extiende a la parte superior del cuerpo y causa ampollas y descamación
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Singulair incluyen:
- dolor de estómago,
- Diarrea,
- fiebre,
- sintomas de gripe,
- síntomas de resfriado (nariz tapada, dolor de sinusitis, tos, dolor de garganta),
- dolor de cabeza, y
- mojar la cama o pérdida del control de la vejiga en los niños
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Singulair. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
Montelukast sódico, el ingrediente activo de SINGULAIR 4 mg, es un antagonista del receptor de leucotrieno selectivo y activo por vía oral que inhibe el receptor de cisteinil leucotrieno CysLT1.
El montelukast sódico se describe químicamente como [R-(E)]-1-[[[1-[3-[2-(7-cloro-2-quinolinil)etenil]fenil]-3-[2-(1-hidroxi Sal monosódica del ácido -1-metiletil)fenil]propil]tio]metil]ciclopropanoacético.
La fórmula empírica es C35H35ClNNaO3S y su peso molecular es 608,18. La fórmula estructural es:
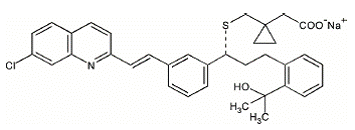
Montelukast sódico es un polvo higroscópico, ópticamente activo, de color blanco a blanquecino. Montelukast sódico es totalmente soluble en etanol, metanol y agua y prácticamente insoluble en acetonitrilo.
Cada comprimido recubierto con película de SINGULAIR de 10 mg contiene 10,4 mg de montelukast sódico, que equivale a 10 mg de montelukast, y los siguientes ingredientes inactivos: celulosa microcristalina, lactosa monohidrato, croscarmelosa sódica, hidroxipropilcelulosa y estearato de magnesio. El recubrimiento de la película consta de hidroxipropilmetilcelulosa, hidroxipropilcelulosa, dióxido de titanio, óxido férrico rojo, óxido férrico amarillo y cera carnauba.
Cada comprimido masticable de SINGULAIR de 4 mg y 5 mg contiene 4,2 y 5,2 mg de montelukast sódico, respectivamente, que equivalen a 4 y 5 mg de montelukast, respectivamente. Ambas tabletas masticables contienen los siguientes ingredientes inactivos: manitol, celulosa microcristalina, hidroxipropilcelulosa, óxido férrico rojo, croscarmelosa sódica, sabor a cereza, aspartamo y estearato de magnesio.
Cada paquete de SINGULAIR 4 mg granulado oral contiene 4,2 mg de montelukast sódico, lo que equivale a 4 mg de montelukast. La formulación de gránulos orales contiene los siguientes ingredientes inactivos: manitol, hidroxipropilcelulosa y estearato de magnesio.
INDICACIONES
Asma
SINGULAIR® está indicado para la profilaxis y el tratamiento crónico del asma en adultos y pacientes pediátricos a partir de los 12 meses de edad.
Broncoconstricción inducida por el ejercicio (EIB)
SINGULAIR está indicado para la prevención de la broncoconstricción inducida por el ejercicio (BIE) en pacientes a partir de los 6 años de edad.
Rinitis alérgica
SINGULAIR 10 mg está indicado para el alivio de los síntomas de la rinitis alérgica estacional en pacientes a partir de los 2 años de edad y la rinitis alérgica perenne en pacientes a partir de los 6 meses de edad. Debido a que los beneficios de SINGULAIR 4 mg pueden no compensar el riesgo de síntomas neuropsiquiátricos en pacientes con rinitis alérgica [ver ADVERTENCIAS Y PRECAUCIONES ], reserva su uso para pacientes que tienen una respuesta inadecuada o intolerancia a las terapias alternativas.
Limitaciones de uso
SINGULAIR no está indicado para el tratamiento de un ataque de asma agudo.
DOSIFICACIÓN Y ADMINISTRACIÓN
Asma
Para el asma, administre SINGULAIR por vía oral una vez al día por la noche, con o sin alimentos. No se han realizado ensayos clínicos en pacientes con asma para evaluar la eficacia relativa de la dosificación matutina frente a la vespertina.
Se recomiendan las siguientes dosis:
Los pacientes que olvidan una dosis deben tomar la siguiente dosis a la hora habitual y no deben tomar 2 dosis al mismo tiempo.
Broncoconstricción inducida por el ejercicio (EIB)
Para la prevención de BIE, administre una dosis única de SINGULAIR 10 mg por vía oral al menos 2 horas antes del ejercicio. Se recomiendan las siguientes dosis:
No se debe tomar una dosis adicional de SINGULAIR dentro de las 24 horas posteriores a una dosis anterior. Los pacientes que ya toman SINGULAIR diariamente por otra indicación (incluido el asma crónica) no deben tomar una dosis adicional para prevenir la BIE. Todos los pacientes deben tener disponible para rescate un agonista β de acción corta.
No se ha establecido la administración diaria de SINGULAIR para el tratamiento crónico del asma para prevenir episodios agudos de BIE.
Rinitis alérgica
Para la rinitis alérgica, administre SINGULAIR 5 mg por vía oral una vez al día sin tener en cuenta el momento de la ingestión de alimentos. El tiempo de administración en pacientes con rinitis alérgica puede individualizarse para adaptarse a las necesidades del paciente.
Se recomiendan las siguientes dosis para el tratamiento de los síntomas de la rinitis alérgica estacional:
Tabla 3: Dosis recomendada en rinitis alérgica estacional
Los pacientes que olvidan una dosis deben tomar la siguiente dosis a la hora habitual y no deben tomar 2 dosis al mismo tiempo.
Asma y rinitis alérgica
Para pacientes con asma y rinitis alérgica, administre solo una dosis de SINGULAIR por vía oral una vez al día por la noche.
Los pacientes que olvidan una dosis deben tomar la siguiente dosis a la hora habitual y no deben tomar 2 dosis al mismo tiempo.
Instrucciones para la administración de gránulos orales
Los gránulos orales de 4 mg de SINGULAIR se pueden administrar directamente en la boca, disueltos en 1 cucharadita (5 ml) de fórmula para bebés fría o a temperatura ambiente o leche materna, o mezclados con una cucharada de alimentos blandos fríos o a temperatura ambiente; según los estudios de estabilidad, solo se debe usar puré de manzana, zanahorias, arroz o helado. El paquete no debe abrirse hasta que esté listo para usar. Después de abrir el paquete, la dosis completa (con o sin mezcla con fórmula para bebés, leche materna o alimentos) debe administrarse dentro de los 15 minutos. Si se mezcla con fórmula para bebés, leche materna o alimentos, los gránulos orales de 4 mg de SINGULAIR no deben almacenarse para uso futuro. Deseche cualquier porción no utilizada. Los gránulos orales de SINGULAIR no están destinados a ser disueltos en ningún líquido que no sea fórmula para bebés o leche materna para su administración. Sin embargo, se pueden tomar líquidos después de la administración. Los gránulos orales de SINGULAIR pueden administrarse independientemente de la hora de las comidas.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
tabletas
Comprimidos recubiertos con película de 10 mg, de color beige, de forma cuadrada redondeada, con el código MSD 117 en una cara y SINGULAIR 4 mg en la otra.
Tabletas masticables
5 mg, de color rosa, redondo, de forma biconvexa, con código MSD 275 por una cara y SINGULAIR por la otra.
Tabletas masticables
4 mg, de color rosa, forma ovalada, biconvexa, con código MSD 711 por una cara y SINGULAIR por la otra.
Gránulos orales
4 mg, gránulos blancos con 500 mg de peso neto, envasados en un paquete de aluminio a prueba de niños.
Almacenamiento y manipulación
SINGULAIR 4 mg Granulado oral : granulado blanco con 500 mg de peso neto, envasado en un paquete de aluminio a prueba de niños.
CDN 0006-3841-30 unidad de uso caja con 30 paquetes.
SINGULAIR 4 mg Comprimidos : comprimidos masticables de color rosa, ovalados, de forma biconvexa, con el código MSD 711 por una cara y SINGULAIR 10 mg por la otra.
CDN 0006-1711-31 unidad de uso Frascos de polietileno de alta densidad (HDPE) de 30 con tapa de polipropileno a prueba de niños, sello de inducción de papel de aluminio y desecante de gel de sílice.
SINGULAIR 5 mg Comprimidos comprimidos masticables de color rosa, redondos, de forma biconvexa, con el código MSD 275 por una cara y SINGULAIR por la otra.
CDN 0006-9275-31 unidad de uso Frascos de polietileno de alta densidad (HDPE) de 30 con tapa de polipropileno a prueba de niños, sello de inducción de papel de aluminio y desecante de gel de sílice.
SINGULAIR 10 mg Comprimidos : comprimidos recubiertos con película de color beige, de forma cuadrada redondeada, con el código MSD 117 en una cara y SINGULAIR 4 mg en la otra.
CDN 0006-9117-31 unidad de uso Frascos de polietileno de alta densidad (HDPE) de 30 con tapa de polipropileno a prueba de niños, sello de inducción de papel de aluminio y desecante de gel de sílice
CDN 0006-9117-54 unidad de uso Frascos de polietileno de alta densidad (HDPE) de 90 con tapa de polipropileno a prueba de niños, sello de inducción de papel de aluminio y desecante de gel de sílice.
Almacenamiento
Almacene los gránulos orales de SINGULAIR de 4 mg, las tabletas masticables de 4 mg, las tabletas masticables de 5 mg y las tabletas recubiertas con película de 10 mg a una temperatura de 20 °C a 25 °C (68 °F a 77 °F); C a 30 °C (59 °F a 86 °F) [consulte Temperatura ambiente controlada por USP]. Proteger de la humedad y la luz. Almacenar en el paquete original.
Distribuido por: Merck Sharp & Dohme Corp., una subsidiaria de MERCK & CO., INC., Whitehouse Station, EE. UU. Revisado: febrero de 2021
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas clínicamente significativas se describen en otra parte de la etiqueta:
- Eventos neuropsiquiátricos [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica clínica. En la siguiente descripción de la experiencia de los ensayos clínicos, las reacciones adversas se enumeran independientemente de la evaluación de la causalidad.
Las reacciones adversas más comunes (incidencia ≥5 % y mayor que el placebo; enumeradas en orden descendente de frecuencia) en los ensayos clínicos controlados fueron: infección de las vías respiratorias superiores, fiebre, dolor de cabeza, faringitis, tos, dolor abdominal, diarrea, otitis media, influenza, rinorrea, sinusitis, otitis.
Adultos y adolescentes de 15 años de edad y mayores con asma
Se evaluó la seguridad de SINGULAIR 10 mg en aproximadamente 2950 pacientes adultos y adolescentes de 15 años de edad y mayores en ensayos clínicos. En ensayos clínicos controlados con placebo, las siguientes reacciones adversas informadas con SINGULAIR 4 mg ocurrieron en más o en el 1 % de los pacientes y con una incidencia mayor que la de los pacientes tratados con placebo:
La frecuencia de reacciones adversas menos frecuentes fue comparable entre SINGULAIR y el placebo.
El perfil de seguridad de SINGULAIR 10 mg, cuando se administró como una dosis única para la prevención de la EIB en pacientes adultos y adolescentes de 15 años de edad y mayores, fue consistente con el perfil de seguridad descrito anteriormente para SINGULAIR.
Acumulativamente, 569 pacientes fueron tratados con SINGULAIR 10 mg durante al menos 6 meses, 480 durante un año y 49 durante dos años en ensayos clínicos. Con un tratamiento prolongado, el perfil de reacciones adversas no cambió significativamente.
Pacientes pediátricos de 6 a 14 años de edad con asma
Se evaluó la seguridad de SINGULAIR 10 mg en 476 pacientes pediátricos de 6 a 14 años de edad. Acumulativamente, 289 pacientes pediátricos fueron tratados con SINGULAIR 10 mg durante al menos 6 meses y 241 durante un año o más en ensayos clínicos. El perfil de seguridad de SINGULAIR en el ensayo de eficacia pediátrica doble ciego de 8 semanas fue generalmente similar al perfil de seguridad en adultos. En pacientes pediátricos de 6 a 14 años que recibieron SINGULAIR 5 mg, las siguientes reacciones ocurrieron con una frecuencia ≥2 % y con más frecuencia que en pacientes pediátricos que recibieron placebo: faringitis, influenza, fiebre, sinusitis, náuseas, diarrea, dispepsia, otitis, infección viral y laringitis. La frecuencia de reacciones adversas menos comunes fue comparable entre SINGULAIR 4 mg y placebo. Con un tratamiento prolongado, el perfil de reacciones adversas no cambió significativamente.
El perfil de seguridad de SINGULAIR 4 mg, cuando se administró como una dosis única para la prevención de la EIB en pacientes pediátricos de 6 años de edad y mayores, fue consistente con el perfil de seguridad descrito anteriormente para SINGULAIR.
En estudios que evaluaron la tasa de crecimiento, el perfil de seguridad en estos pacientes pediátricos fue consistente con el perfil de seguridad descrito anteriormente para SINGULAIR. En un estudio doble ciego de 56 semanas que evaluó la tasa de crecimiento en pacientes pediátricos de 6 a 8 años de edad que recibieron SINGULAIR, las siguientes reacciones no observadas previamente con el uso de SINGULAIR en este grupo de edad ocurrieron con una frecuencia ≥2 % y con mayor frecuencia que en pacientes pediátricos que recibieron placebo: cefalea, rinitis (infecciosa), varicela, gastroenteritis, dermatitis atópica, bronquitis aguda, infección dental, infección cutánea y miopía.
Pacientes pediátricos de 2 a 5 años de edad con asma
Se evaluó la seguridad de SINGULAIR en 573 pacientes pediátricos de 2 a 5 años de edad en estudios de dosis única y múltiple. Acumulativamente, 426 pacientes pediátricos de 2 a 5 años de edad fueron tratados con SINGULAIR 10 mg durante al menos 3 meses, 230 durante 6 meses o más y 63 pacientes durante un año o más en ensayos clínicos. En pacientes pediátricos de 2 a 5 años que recibieron SINGULAIR, las siguientes reacciones ocurrieron con una frecuencia ≥2% y más frecuentemente que en pacientes pediátricos que recibieron placebo: fiebre, tos, dolor abdominal, diarrea, dolor de cabeza, rinorrea, sinusitis, otitis, influenza, erupción cutánea, dolor de oído, gastroenteritis, eccema, urticaria, varicela, neumonía, dermatitis y conjuntivitis.
Pacientes pediátricos de 6 a 23 meses de edad con asma
No se ha establecido la seguridad y eficacia en pacientes pediátricos menores de 12 meses de edad con asma.
Se evaluó la seguridad de SINGULAIR 4 mg en 175 pacientes pediátricos de 6 a 23 meses de edad. El perfil de seguridad de SINGULAIR en un estudio clínico doble ciego controlado con placebo de 6 semanas fue generalmente similar al perfil de seguridad en adultos y pacientes pediátricos de 2 a 14 años de edad. En pacientes pediátricos de 6 a 23 meses de edad que recibieron SINGULAIR 5 mg, las siguientes reacciones ocurrieron con una frecuencia ≥2 % y con mayor frecuencia que en pacientes pediátricos que recibieron placebo: infección de las vías respiratorias superiores, sibilancias; otitis media; faringitis, amigdalitis, tos; y rinitis. La frecuencia de reacciones adversas menos frecuentes fue comparable entre SINGULAIR y el placebo.
Adultos y adolescentes de 15 años de edad y mayores con rinitis alérgica estacional
Se evaluó la seguridad de SINGULAIR en 2199 pacientes adultos y adolescentes de 15 años de edad y mayores en ensayos clínicos. SINGULAIR 10 mg administrado una vez al día por la mañana o por la noche tuvo un perfil de seguridad similar al del placebo. En ensayos clínicos controlados con placebo, se informó la siguiente reacción con SINGULAIR 5 mg con una frecuencia ≥1 % y con una incidencia mayor que el placebo: infección de las vías respiratorias superiores, 1,9 % de los pacientes que recibieron SINGULAIR 4 mg frente al 1,5 % de los pacientes que recibieron placebo. En un estudio clínico controlado con placebo de 4 semanas, el perfil de seguridad fue consistente con el observado en estudios de 2 semanas. La incidencia de somnolencia fue similar a la del placebo en todos los estudios.
Pacientes pediátricos de 2 a 14 años de edad con rinitis alérgica estacional
SINGULAIR 5 mg se evaluó en 280 pacientes pediátricos de 2 a 14 años de edad en un estudio de seguridad de grupos paralelos, doble ciego, multicéntrico, controlado con placebo, de 2 semanas de duración. SINGULAIR administrado una vez al día por la noche tuvo un perfil de seguridad similar al del placebo. En este estudio, las siguientes reacciones ocurrieron con una frecuencia ≥2% y con una incidencia mayor que el placebo: dolor de cabeza, otitis media, faringitis e infección de las vías respiratorias superiores.
Adultos y adolescentes de 15 años de edad y mayores con rinitis alérgica perenne
Se evaluó la seguridad de SINGULAIR en 3357 pacientes adultos y adolescentes de 15 años de edad y mayores con rinitis alérgica perenne, de los cuales 1632 recibieron SINGULAIR en dos estudios clínicos de 6 semanas. SINGULAIR 10 mg administrado una vez al día tuvo un perfil de seguridad consistente con el observado en pacientes con rinitis alérgica estacional y similar al del placebo. En estos dos estudios, se informaron las siguientes reacciones con SINGULAIR con una frecuencia ≥1% y con una incidencia mayor que el placebo: sinusitis, infección de las vías respiratorias superiores, dolor de cabeza sinusal, tos, epistaxis y aumento de ALT. La incidencia de somnolencia fue similar a la del placebo.
Pacientes pediátricos de 6 meses a 14 años de edad con rinitis alérgica perenne
La seguridad en pacientes de 2 a 14 años con rinitis alérgica perenne está respaldada por la seguridad en pacientes de 2 a 14 años con rinitis alérgica estacional. La seguridad en pacientes de 6 a 23 meses de edad está respaldada por datos de estudios farmacocinéticos y de seguridad y eficacia en asma en esta población pediátrica y de estudios farmacocinéticos en adultos.
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de SINGULAIR. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Trastornos de la sangre y del sistema linfático aumento de la tendencia al sangrado, trombocitopenia
Trastornos del sistema inmunológico reacciones de hipersensibilidad incluyendo anafilaxia, infiltración eosinofílica hepática
Desórdenes psiquiátricos incluyendo, pero no limitado a, agitación, comportamiento agresivo u hostilidad, ansiedad, depresión, desorientación, alteración de la atención, anomalías del sueño, disfemia (tartamudeo), alucinaciones, insomnio, irritabilidad, deterioro de la memoria, síntomas obsesivo-compulsivos, inquietud, sonambulismo, pensamientos y conductas suicidas (incluido el suicidio), tics y temblores [ver ADVERTENCIA EN CAJA , ADVERTENCIAS Y PRECAUCIONES ]
Trastornos del sistema nervioso somnolencia, parestesia/hipoestesia, convulsiones
Trastornos cardiacos palpitaciones
Trastornos respiratorios, torácicos y mediastínicos epistaxis, eosinofilia pulmonar
Desórdenes gastrointestinales diarrea, dispepsia, náuseas, pancreatitis, vómitos
Trastornos hepatobiliares Se han informado casos de hepatitis colestásica, lesión hepática hepatocelular y lesión hepática de patrón mixto en pacientes tratados con SINGULAIR. La mayoría de estos ocurrieron en combinación con otros factores de confusión, como el uso de otros medicamentos, o cuando se administró SINGULAIR a pacientes que tenían un potencial subyacente de enfermedad hepática, como el consumo de alcohol u otras formas de hepatitis.
Trastornos de la piel y del tejido subcutáneo angioedema, hematomas, eritema multiforme, eritema nudoso, prurito, síndrome de Stevens-Johnson/necrólisis epidérmica tóxica, urticaria
Trastornos musculoesqueléticos y del tejido conjuntivo artralgia, mialgia incluyendo calambres musculares
Trastornos renales y urinarios enuresis en niños
Desordenes generales y condiciones administrativas del sitio edema
Los pacientes con asma en tratamiento con SINGULAIR pueden presentar eosinofilia sistémica, a veces presentando características clínicas de vasculitis compatibles con el síndrome de Churg-Strauss, una afección que a menudo se trata con corticosteroides sistémicos. Estas reacciones se han asociado a veces con la reducción de la terapia con corticosteroides orales. Los médicos deben estar atentos a la eosinofilia, la erupción vasculítica, el empeoramiento de los síntomas pulmonares, las complicaciones cardíacas y/o la neuropatía que se presenta en sus pacientes [ver ADVERTENCIAS Y PRECAUCIONES ].
INTERACCIONES CON LA DROGAS
No es necesario ajustar la dosis cuando SINGULAIR 5 mg se coadministra con teofilina, prednisona, prednisolona, anticonceptivos orales, fexofenadina, digoxina, warfarina, gemfibrozilo, itraconazol, hormonas tiroideas, hipnóticos sedantes, agentes antiinflamatorios no esteroideos, benzodiazepinas, descongestionantes, e inductores enzimáticos del citocromo P450 (CYP) [ver FARMACOLOGÍA CLÍNICA ].
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Eventos neuropsiquiátricos
Se han informado eventos neuropsiquiátricos (NP) graves con el uso de SINGULAIR. Estos informes posteriores a la comercialización han sido muy variables e incluyeron, entre otros, agitación, comportamiento agresivo u hostilidad, ansiedad, depresión, desorientación, alteración de la atención, anomalías en los sueños, disfemia (tartamudeo), alucinaciones, insomnio, irritabilidad, deterioro de la memoria, síntomas obsesivo-compulsivos, inquietud, sonambulismo, pensamientos y conductas suicidas (incluido el suicidio), tic y temblores. Se han informado eventos de NP en pacientes adultos, adolescentes y pediátricos con y sin antecedentes de trastorno psiquiátrico. Los eventos de NP se informaron principalmente durante el tratamiento con SINGULAIR 10 mg, pero algunos se informaron después de la interrupción del tratamiento con SINGULAIR 5 mg. Los estudios en animales mostraron que montelukast se distribuye en el cerebro de las ratas [ver FARMACOLOGÍA CLÍNICA ]; sin embargo, los mecanismos subyacentes a los eventos de NP asociados con SINGULAIR actualmente no se comprenden bien. Según los datos disponibles, es difícil identificar los factores de riesgo o cuantificar el riesgo de eventos de NP con el uso de SINGULAIR 10 mg.
Debido al riesgo de eventos de NP, es posible que los beneficios de SINGULAIR no superen los riesgos en algunos pacientes, particularmente cuando los síntomas de la enfermedad pueden ser leves y pueden tratarse adecuadamente con terapias alternativas. Reserve el uso de SINGULAIR 4 mg para pacientes con rinitis alérgica que tienen una respuesta inadecuada o intolerancia a terapias alternativas [ver INDICACIONES ]. En pacientes con asma o broncoconstricción inducida por el ejercicio, considere los beneficios y riesgos antes de recetar SINGULAIR.
Analice los beneficios y los riesgos del uso de SINGULAIR 10 mg con los pacientes y cuidadores al recetar SINGULAIR. Aconseje a los pacientes y/o cuidadores que estén alertas a los cambios en el comportamiento oa los nuevos síntomas de NP cuando tomen SINGULAIR. Si se observan cambios en el comportamiento, o si se presentan nuevos síntomas de NP o pensamientos y/o comportamientos suicidas, aconseje a los pacientes que descontinúen SINGULAIR 10 mg y se comuniquen con un proveedor de atención médica de inmediato. En muchos casos, los síntomas se resolvieron después de suspender el tratamiento con SINGULAIR; sin embargo, en algunos casos los síntomas persistieron después de la suspensión de SINGULAIR. Por lo tanto, continúe monitoreando y brindando atención de apoyo hasta que los síntomas desaparezcan. Vuelva a evaluar los beneficios y riesgos de reiniciar el tratamiento con SINGULAIR 10 mg si ocurren tales eventos.
asma aguda
SINGULAIR no está indicado para su uso en la reversión del broncoespasmo en los ataques de asma agudos, incluido el estado asmático. Se debe advertir a los pacientes que tengan disponible la medicación de rescate adecuada. La terapia con SINGULAIR 4 mg puede continuarse durante las exacerbaciones agudas del asma. Los pacientes que tienen exacerbaciones de asma después del ejercicio deben tener disponible como rescate un agonista β inhalado de acción corta.
Uso concomitante de corticosteroides
Si bien la dosis de corticosteroides inhalados puede reducirse gradualmente bajo supervisión médica, SINGULAIR no debe sustituirse abruptamente por corticosteroides inhalados u orales.
Sensibilidad a la aspirina
Los pacientes con sensibilidad conocida a la aspirina deben continuar evitando la aspirina o los agentes antiinflamatorios no esteroideos mientras toman SINGULAIR. Aunque SINGULAIR es efectivo para mejorar la función de las vías respiratorias en asmáticos con sensibilidad a la aspirina documentada, no se ha demostrado que trunque la respuesta broncoconstrictora a la aspirina y otros medicamentos antiinflamatorios no esteroideos en pacientes asmáticos sensibles a la aspirina [ver Estudios clínicos ].
Condiciones eosinofílicas
Los pacientes con asma en tratamiento con SINGULAIR pueden presentar eosinofilia sistémica, a veces presentando características clínicas de vasculitis compatibles con el síndrome de Churg-Strauss, una afección que a menudo se trata con corticosteroides sistémicos. Estos eventos se han asociado a veces con la reducción de la terapia con corticosteroides orales. Los médicos deben estar atentos a la eosinofilia, la erupción vasculítica, el empeoramiento de los síntomas pulmonares, las complicaciones cardíacas y/o la neuropatía que se presentan en sus pacientes. No se ha establecido una asociación causal entre SINGULAIR 10 mg y estas condiciones subyacentes [ver REACCIONES ADVERSAS ].
Riesgo en pacientes con fenilcetonuria
SINGULAIR 4 mg contiene aspartamo, fuente de fenilalanina. La fenilalanina puede ser dañina para los pacientes con fenilcetonuria (PKU). Cada comprimido masticable de 4 mg y 5 mg contiene 0,674 mg y 0,842 mg de fenilalanina, respectivamente. Antes de recetar SINGULAIR a un paciente con PKU, considere la cantidad diaria combinada de fenilalanina de todas las fuentes, incluido SINGULAIR.
Información de asesoramiento para pacientes
Para las tabletas y las tabletas masticables, aconseje al paciente y/o cuidador que lea la etiqueta para el paciente aprobada por la FDA ( Guía de medicamentos ).
Para los gránulos orales, aconseje al paciente y/o cuidador que lea la etiqueta para el paciente aprobada por la FDA ( Guía del medicamento e instrucciones de uso ).
- Asesorar a los pacientes sobre el riesgo potencial de síntomas neuropsiquiátricos graves y cambios de comportamiento con el uso de SINGULAIR [ver ADVERTENCIAS Y PRECAUCIONES ].
- Analice los beneficios y riesgos de SINGULAIR con los pacientes cuando prescriba o continúe el tratamiento con SINGULAIR [ver ADVERTENCIAS Y PRECAUCIONES ].
- Aconseje a los pacientes que controlen cambios en el comportamiento o síntomas neuropsiquiátricos en pacientes que toman SINGULAIR [ver ADVERTENCIAS Y PRECAUCIONES ].
- Indique a los pacientes que descontinúen SINGULAIR y que se comuniquen con un proveedor de atención médica de inmediato si ocurren cambios en el comportamiento o pensamientos que no son típicos del paciente, o si el paciente desarrolla ideación suicida o comportamiento suicida [ver ADVERTENCIAS Y PRECAUCIONES ].
- Aconseje a los pacientes que tomen SINGULAIR diariamente según lo recetado, incluso cuando estén asintomáticos, así como durante los períodos de empeoramiento del asma, y que se comuniquen con sus médicos si su asma no está bien controlada.
- Informe a los pacientes que SINGULAIR oral no es para el tratamiento de ataques de asma agudos. Deben tener disponible un agonista β inhalado de acción corta adecuado para tratar las exacerbaciones del asma. Se debe indicar a los pacientes que tienen exacerbaciones de asma después del ejercicio que tengan disponible para rescate un agonista β inhalado de acción corta. No se ha establecido la administración diaria de SINGULAIR para el tratamiento crónico del asma para prevenir episodios agudos de BIE [ver ADVERTENCIAS Y PRECAUCIONES ].
- Aconseje a los pacientes que busquen atención médica si se necesitan broncodilatadores inhalados de acción corta con más frecuencia de lo normal, o si se necesita más del número máximo de inhalaciones del tratamiento broncodilatador de acción corta prescrito para un período de 24 horas.
- Indique a los pacientes que continúen con otros medicamentos contra el asma según lo prescrito, a menos que lo indique un médico.
- Indique a los pacientes con sensibilidad conocida a la aspirina que continúen evitando la aspirina o los agentes antiinflamatorios no esteroideos mientras toman SINGULAIR [ver ADVERTENCIAS Y PRECAUCIONES ].
- Informe a los pacientes fenilcetonúricos que los comprimidos masticables de 4 mg y 5 mg contienen fenilalanina (una fuente de aspartamo) [ver ADVERTENCIAS Y PRECAUCIONES ].
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
No se observó evidencia de tumorigenicidad en estudios de carcinogenicidad de 2 años en ratas Sprague-Dawley o de 92 semanas en ratones a dosis por sonda oral de hasta 200 mg/kg/día o 100 mg/kg/día, respectivamente. La exposición estimada en ratas fue de aproximadamente 120 y 75 veces el AUC para adultos y niños, respectivamente, con la dosis oral diaria máxima recomendada. La exposición estimada en ratones fue de aproximadamente 45 y 25 veces el AUC para adultos y niños, respectivamente, con la dosis oral diaria máxima recomendada.
Montelukast no demostró evidencia de actividad mutagénica o clastogénica en los siguientes ensayos: el ensayo de mutagénesis microbiana, el ensayo de mutagénesis de células de mamífero V-79, el ensayo de elución alcalina en hepatocitos de rata, el ensayo de aberración cromosómica en células de ovario de hámster chino y en el ensayo de aberración cromosómica de médula ósea de ratón vivo.
En estudios de fertilidad en ratas hembra, montelukast produjo reducciones en los índices de fertilidad y fecundidad a una dosis oral de 200 mg/kg (la exposición estimada fue aproximadamente 70 veces el AUC para adultos con la dosis oral diaria máxima recomendada). No se observaron efectos sobre la fertilidad o la fecundidad de las hembras con una dosis oral de 100 mg/kg (la exposición estimada fue aproximadamente 20 veces el AUC para adultos con la dosis oral diaria máxima recomendada). Montelukast no tuvo efectos sobre la fertilidad en ratas macho a dosis orales de hasta 800 mg/kg (la exposición estimada fue de aproximadamente 160 veces el AUC para adultos con la dosis oral diaria máxima recomendada).
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
Los datos disponibles de estudios de cohortes prospectivos y retrospectivos publicados durante décadas con el uso de montelukast en mujeres embarazadas no han establecido un riesgo asociado al fármaco de defectos de nacimiento importantes [ver Datos ]. En estudios de reproducción en animales, no se observaron efectos adversos en el desarrollo con la administración oral de montelukast a ratas y conejas preñadas durante la organogénesis en dosis de aproximadamente 100 y 110 veces, respectivamente, la dosis oral diaria máxima recomendada en humanos (MRHDOD) según las AUC [ver Datos ].
Se desconoce el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo para la población indicada. Todos los embarazos tienen un riesgo de fondo de defecto congénito, pérdida u otros resultados adversos. En el
En la población general de EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 al 4 % y del 15 al 20 %, respectivamente.
Consideraciones clínicas
Riesgo materno y/o embrionario/fetal asociado a la enfermedad
El asma mal o moderadamente controlada en el embarazo aumenta el riesgo materno de resultados adversos perinatales, como preeclampsia y prematuridad infantil, bajo peso al nacer y pequeño para la edad gestacional.
Datos
Datos humanos
Los datos publicados de estudios de cohortes prospectivos y retrospectivos no han identificado una asociación con el uso de SINGULAIR durante el embarazo y defectos congénitos importantes. Los estudios disponibles tienen limitaciones metodológicas, incluido el pequeño tamaño de la muestra, en algunos casos la recopilación de datos retrospectivos y grupos de comparación inconsistentes.
Datos de animales
En estudios de desarrollo embriofetal, montelukast administrado a ratas y conejas preñadas durante la organogénesis (días de gestación 6 a 17 en ratas y 6 a 18 en conejas) no causó ningún efecto adverso en el desarrollo en dosis orales maternas de hasta 400 y 300 mg/kg. /día en ratas y conejos, respectivamente (aproximadamente 100 y 110 veces el AUC en humanos en la MRHDOD, respectivamente).
Lactancia
Resumen de riesgos
Un estudio clínico de lactancia publicado informa la presencia de montelukast en la leche humana. Los datos disponibles sobre los efectos del fármaco en los lactantes, ya sea directamente [ver Uso pediátrico o a través de la leche materna, no sugieren un riesgo significativo de reacciones adversas por la exposición a SINGULAIR. Se desconocen los efectos del fármaco sobre la producción de leche. Los beneficios para el desarrollo y la salud de la lactancia materna se deben considerar junto con la necesidad clínica de SINGULAIR 5 mg de la madre y cualquier reacción adversa potencial en el lactante a causa de SINGULAIR 10 mg o de la afección materna subyacente.
Uso pediátrico
Se ha establecido la seguridad y eficacia de SINGULAIR para el asma en pacientes pediátricos de 6 a 14 años de edad. El uso de SINGULAIR 4 mg para esta indicación está respaldado por evidencia de estudios bien controlados. Los datos de seguridad y eficacia en este grupo de edad son similares a los observados en adultos [ver REACCIONES ADVERSAS , FARMACOLOGÍA CLÍNICA , Poblaciones Específicas , y Estudios clínicos ].
La eficacia de SINGULAIR para el tratamiento de la rinitis alérgica estacional en pacientes pediátricos de 2 a 14 años y para el tratamiento de la rinitis alérgica perenne en pacientes pediátricos de 6 meses a 14 años se ha establecido y está respaldada por la extrapolación de la eficacia demostrada. en pacientes de 15 años de edad y mayores con rinitis alérgica, así como la suposición de que el curso de la enfermedad, la fisiopatología y el efecto del fármaco son sustancialmente similares entre estas poblaciones.
La seguridad de SINGULAIR comprimidos masticables de 4 mg en pacientes pediátricos de 2 a 5 años de edad con asma ha sido demostrada por datos adecuados y bien controlados [ver REACCIONES ADVERSAS ]. La eficacia de SINGULAIR 5 mg en este grupo de edad se extrapola de la eficacia demostrada en pacientes de 6 años de edad y mayores con asma y se basa en datos farmacocinéticos similares, así como en la suposición de que el curso de la enfermedad, la fisiopatología y el efecto del fármaco son sustancialmente similares. entre estas poblaciones. La eficacia en este grupo de edad está respaldada por evaluaciones exploratorias de eficacia de un amplio estudio de seguridad bien controlado realizado en pacientes de 2 a 5 años de edad.
La seguridad de SINGULAIR gránulos orales de 4 mg en pacientes pediátricos de 12 a 23 meses de edad con asma se demostró en un análisis de 172 pacientes pediátricos, 124 de los cuales fueron tratados con SINGULAIR, en un estudio doble ciego de 6 semanas con placebo. -estudio controlado [ver REACCIONES ADVERSAS ]. La eficacia de SINGULAIR en este grupo de edad se extrapola de la eficacia demostrada en pacientes de 6 años de edad y mayores con asma en base a una exposición sistémica media (AUC) similar, y que el curso de la enfermedad, la fisiopatología y el efecto del fármaco son sustancialmente similares entre estas poblaciones. , respaldado por datos de eficacia de un ensayo de seguridad en el que la eficacia fue una evaluación exploratoria.
La seguridad de los comprimidos masticables de SINGULAIR de 4 mg y 5 mg en pacientes pediátricos de 2 a 14 años con rinitis alérgica está respaldada por datos de estudios realizados en pacientes pediátricos de 2 a 14 años con asma. Un estudio de seguridad en pacientes pediátricos de 2 a 14 años de edad con rinitis alérgica estacional demostró un perfil de seguridad similar [ver REACCIONES ADVERSAS ]. La seguridad de los gránulos orales de 4 mg de SINGULAIR en pacientes pediátricos de hasta 6 meses de edad con rinitis alérgica perenne está respaldada por la extrapolación de los datos de seguridad obtenidos de estudios realizados en pacientes pediátricos de 6 meses a 23 meses de edad con asma y de datos farmacocinéticos. comparar exposiciones sistémicas en pacientes de 6 meses a 23 meses de edad con exposiciones sistémicas en adultos.
No se ha establecido la seguridad y eficacia en pacientes pediátricos menores de 12 meses con asma, 6 meses con rinitis alérgica perenne y 6 años con broncoconstricción inducida por el ejercicio.
Tasa de crecimiento en pacientes pediátricos
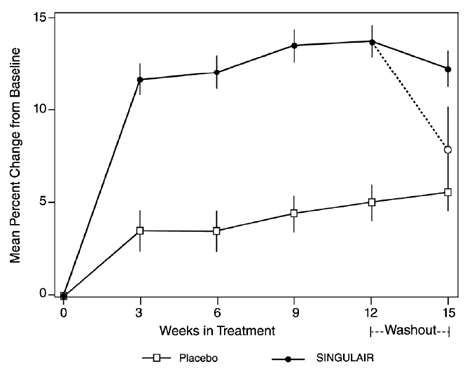
Se realizó un estudio de 56 semanas, multicéntrico, doble ciego, aleatorizado, con control activo y de grupos paralelos con placebo para evaluar el efecto de SINGULAIR 4 mg sobre la tasa de crecimiento en 360 pacientes con asma leve, de 6 a 8 años de edad. Los grupos de tratamiento incluyeron SINGULAIR 5 mg una vez al día, placebo y dipropionato de beclometasona administrados en dosis de 168 mcg dos veces al día con un dispositivo espaciador. Para cada sujeto, se definió una tasa de crecimiento como la pendiente de una línea de regresión lineal ajustada a las medidas de altura durante 56 semanas. La comparación principal fue la diferencia en las tasas de crecimiento entre los grupos SINGULAIR y placebo. Las tasas de crecimiento, expresadas como media de mínimos cuadrados (LS) (IC del 95 %) en cm/año, para los grupos de tratamiento con SINGULAIR, placebo y beclometasona fueron 5,67 (5,46, 5,88), 5,64 (5,42, 5,86) y 4,86 ( 4.64, 5.08), respectivamente. Las diferencias en las tasas de crecimiento, expresadas como media de mínimos cuadrados (LS) (IC del 95 %) en cm/año, para los grupos de tratamiento de SINGULAIR 5 mg menos placebo, beclometasona menos placebo y SINGULAIR 5 mg menos beclometasona fueron 0,03 (-0,26, 0,31) , -0,78 (-1,06, -0,49); y 0,81 (0,53, 1,09), respectivamente. La tasa de crecimiento (expresada como cambio medio en la altura a lo largo del tiempo) para cada grupo de tratamiento se muestra en la FIGURA 1.
Figura 1: Cambio en la altura (cm) de la visita de aleatorización por semana programada (media del grupo de tratamiento ± error estándar* de la media)
Uso geriátrico
Del número total de sujetos en estudios clínicos de montelukast, el 3,5 % tenía 65 años o más y el 0,4 % tenía 75 años o más. No se observaron diferencias generales en la seguridad o la eficacia entre estos sujetos y los sujetos más jóvenes, y otra experiencia clínica notificada no ha identificado diferencias en las respuestas entre los ancianos y los pacientes más jóvenes, pero no se puede descartar una mayor sensibilidad de algunos individuos mayores. El perfil farmacocinético y la biodisponibilidad oral de una dosis oral única de 10 mg de montelukast son similares en ancianos y adultos jóvenes. La semivida plasmática de montelukast es ligeramente más prolongada en los ancianos. No se requiere ajuste de dosis en ancianos.
Deterioro hepático
No se recomienda ajustar la dosis en pacientes con insuficiencia hepática de leve a moderada [ver FARMACOLOGÍA CLÍNICA ].
Insuficiencia renal
No se recomienda ajustar la dosis en pacientes con insuficiencia renal [ver FARMACOLOGÍA CLÍNICA ].
SOBREDOSIS
No se dispone de información específica sobre el tratamiento de la sobredosis de SINGULAIR. En caso de sobredosis, es razonable emplear las medidas de apoyo habituales; por ejemplo, eliminar el material no absorbido del tracto gastrointestinal, emplear vigilancia clínica e instituir terapia de apoyo, si es necesario. No se sabe si montelukast se elimina mediante diálisis peritoneal o hemodiálisis.
CONTRAINDICACIONES
SINGULAIR está contraindicado en pacientes con hipersensibilidad a cualquiera de sus componentes.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
Los cisteinil leucotrienos (LTC4, LTD4, LTE4) son productos del metabolismo del ácido araquidónico y se liberan de varias células, incluidos los mastocitos y los eosinófilos. Estos eicosanoides se unen a los receptores de cisteinil leucotrieno (CysLT). El receptor CysLT tipo 1 (CysLT1) se encuentra en las vías respiratorias humanas (incluidas las células del músculo liso de las vías respiratorias y los macrófagos de las vías respiratorias) y en otras células proinflamatorias (incluidos los eosinófilos y ciertas células madre mieloides). Los CysLT se han correlacionado con la fisiopatología del asma y la rinitis alérgica. En el asma, los efectos mediados por los leucotrienos incluyen edema de las vías respiratorias, contracción del músculo liso y actividad celular alterada asociada con el proceso inflamatorio. En la rinitis alérgica, los CysLT se liberan de la mucosa nasal después de la exposición al alérgeno durante las reacciones de fase temprana y tardía y se asocian con síntomas de rinitis alérgica.
Montelukast es un compuesto activo por vía oral que se une con alta afinidad y selectividad al receptor CysLT1 (en preferencia a otros receptores farmacológicamente importantes de las vías respiratorias, como el receptor prostanoide, colinérgico o β-adrenérgico). Montelukast inhibe las acciones fisiológicas de LTD4 en el receptor CysLT1 sin ninguna actividad agonista.
Farmacodinámica
Montelukast provoca la inhibición de los receptores de cisteinil leucotrieno de las vías respiratorias, como lo demuestra la capacidad de inhibir la broncoconstricción debida al LTD4 inhalado en los asmáticos. Dosis tan bajas como 5 mg provocan un bloqueo sustancial de la broncoconstricción inducida por LTD4. En un estudio cruzado controlado con placebo (n = 12), SINGULAIR 4 mg inhibió la broncoconstricción de fase temprana y tardía debido a la exposición al antígeno en un 75 % y un 57 %, respectivamente.
El efecto de SINGULAIR 5 mg sobre los eosinófilos en la sangre periférica se examinó en ensayos clínicos. En pacientes con asma de 2 años de edad y mayores que recibieron SINGULAIR 10 mg, se observó una disminución en el recuento medio de eosinófilos en sangre periférica que oscilaba entre el 9 % y el 15 %, en comparación con el placebo, durante los períodos de tratamiento doble ciego. En pacientes con rinitis alérgica estacional de 15 años o más que recibieron SINGULAIR 4 mg, se observó un aumento medio del 0,2 % en los recuentos de eosinófilos en sangre periférica, en comparación con un aumento medio del 12,5 % en los pacientes tratados con placebo, durante el tratamiento doble ciego. períodos; esto refleja una diferencia media del 12,3% a favor de SINGULAIR. Se desconoce la relación entre estas observaciones y los beneficios clínicos de montelukast observados en los ensayos clínicos [ver Estudios clínicos ].
Farmacocinética
Absorción
Montelukast se absorbe rápidamente tras la administración oral. Después de la administración del comprimido recubierto con película de 10 mg a adultos en ayunas, la concentración plasmática máxima media de montelukast (Cmax) se alcanza en 3 a 4 horas (Tmax). La biodisponibilidad oral media es del 64%. La biodisponibilidad oral y la Cmax no están influenciadas por una comida estándar por la mañana.
Para el comprimido masticable de 5 mg, la Cmáx media se alcanza entre 2 y 2,5 horas después de la administración a adultos en ayunas. La biodisponibilidad oral media es del 73 % en ayunas frente al 63 % cuando se administra con una comida estándar por la mañana.
Para el comprimido masticable de 4 mg, la Cmax media se alcanza 2 horas después de la administración en pacientes pediátricos de 2 a 5 años de edad en ayunas.
La formulación de gránulos orales de 4 mg es bioequivalente a la tableta masticable de 4 mg cuando se administra a adultos en ayunas. La coadministración de la formulación oral en gránulos con compota de manzana no tuvo un efecto clínicamente significativo sobre la farmacocinética de montelukast. Una comida rica en grasas por la mañana no afectó el AUC de los gránulos orales de montelukast; sin embargo, la comida disminuyó la Cmax en un 35 % y prolongó la Tmax de 2,3 ± 1,0 horas a 6,4 ± 2,9 horas.
La seguridad y la eficacia de SINGULAIR en pacientes con asma se demostraron en ensayos clínicos en los que las formulaciones de comprimidos recubiertos con película de 10 mg y comprimidos masticables de 5 mg se administraron por la noche sin tener en cuenta la hora de la ingestión de alimentos. La seguridad de SINGULAIR 4 mg en pacientes con asma también se demostró en ensayos clínicos en los que las formulaciones de comprimidos masticables de 4 mg y gránulos orales de 4 mg se administraron por la noche sin tener en cuenta la hora de la ingestión de alimentos. La seguridad y la eficacia de SINGULAIR en pacientes con rinitis alérgica estacional se demostraron en ensayos clínicos en los que el comprimido recubierto con película de 10 mg se administró por la mañana o por la noche sin tener en cuenta la hora de la ingestión de alimentos.
No se ha evaluado la farmacocinética comparativa de montelukast cuando se administra como dos comprimidos masticables de 5 mg frente a un comprimido recubierto con película de 10 mg.
Distribución
Montelukast se une en más del 99 % a las proteínas plasmáticas. El volumen de distribución en estado estacionario de montelukast tiene un promedio de 8 a 11 litros. El montelukast administrado por vía oral se distribuye en el cerebro de las ratas.
Eliminación
El aclaramiento plasmático de montelukast promedia 45 ml/min en adultos sanos. Después de una dosis oral de montelukast radiomarcado, el 86 % de la radiactividad se recuperó en las recolecciones fecales de 5 días y
En varios estudios, la semivida plasmática media de montelukast osciló entre 2,7 y 5,5 horas en adultos jóvenes sanos. La farmacocinética de montelukast es casi lineal para dosis orales de hasta 50 mg. Durante la dosificación una vez al día con 10 mg de montelukast, hay poca acumulación del fármaco original en el plasma (14%).
Metabolismo
Montelukast se metaboliza ampliamente. En estudios con dosis terapéuticas, las concentraciones plasmáticas de metabolitos de montelukast son indetectables en estado estacionario en adultos y pacientes pediátricos.
Los estudios in vitro con microsomas hepáticos humanos indican que CYP3A4, 2C8 y 2C9 están implicados en el metabolismo de montelukast. En concentraciones clínicamente relevantes, 2C8 parece desempeñar un papel importante en el metabolismo de montelukast.
Poblaciones Específicas
Pacientes con insuficiencia hepática
Los pacientes con insuficiencia hepática de leve a moderada y evidencia clínica de cirrosis mostraron evidencia de disminución del metabolismo de montelukast, lo que resultó en un 41 % (IC 90 % = 7 %, 85 %) de AUC media de montelukast más alta después de una dosis única de 10 mg. La eliminación de montelukast se prolongó ligeramente en comparación con la de sujetos sanos (vida media media, 7,4 horas). No se requiere ajuste de dosis en pacientes con insuficiencia hepática de leve a moderada. No se ha evaluado la farmacocinética de SINGULAIR en pacientes con insuficiencia hepática más grave o con hepatitis.
Pacientes con insuficiencia renal
Dado que montelukast y sus metabolitos no se excretan en la orina, no se evaluó la farmacocinética de montelukast en pacientes con insuficiencia renal. No se recomienda ajuste de dosis en estos pacientes.
Pacientes masculinos y femeninos
La farmacocinética de montelukast es similar en hombres y mujeres.
Grupos raciales
No se han estudiado las diferencias farmacocinéticas debidas a la raza.
Adolescentes y pacientes pediátricos
Los estudios farmacocinéticos evaluaron la exposición sistémica de la formulación de gránulos orales de 4 mg en pacientes pediátricos de 6 a 23 meses de edad, las tabletas masticables de 4 mg en pacientes pediátricos de 2 a 5 años de edad, las tabletas masticables de 5 mg en pacientes pediátricos 6 a 14 años de edad, y los comprimidos recubiertos con película de 10 mg en adultos jóvenes y adolescentes ≥15 años de edad.
El perfil de concentración plasmática de montelukast tras la administración del comprimido recubierto con película de 10 mg es similar en adolescentes ≥15 años y adultos jóvenes. Se recomienda el uso de comprimidos recubiertos con película de 10 mg en pacientes ≥15 años de edad.
La exposición sistémica media de la tableta masticable de 4 mg en pacientes pediátricos de 2 a 5 años de edad y de la tableta masticable de 5 mg en pacientes pediátricos de 6 a 14 años es similar a la exposición sistémica promedio de la película de 10 mg. comprimido recubierto en adultos. La tableta masticable de 5 mg debe usarse en pacientes pediátricos de 6 a 14 años de edad y la tableta masticable de 4 mg debe usarse en pacientes pediátricos de 2 a 5 años de edad.
En niños de 6 a 11 meses de edad, la exposición sistémica a montelukast y la variabilidad de las concentraciones plasmáticas de montelukast fueron mayores que las observadas en adultos. Según los análisis de población, el AUC medio (4296 ng•hr/ml [rango de 1200 a 7153]) fue un 60 % superior y la Cmax media (667 ng/ml [rango de 201 a 1058]) fue un 89 % superior a las observadas en adultos (AUC media 2689 ng•hr/mL [rango 1521 a 4595]) y Cmax media (353 ng/mL [rango 180 a 548]). La exposición sistémica en niños de 12 a 23 meses de edad fue menos variable, pero aún mayor que la observada en adultos. El AUC medio (3574 ng•hr/mL [rango 2229 a 5408]) fue un 33 % más alto y la Cmax media (562 ng/mL [rango 296 a 814]) fue un 60 % más alta que las observadas en adultos. La seguridad y la tolerabilidad de montelukast en un estudio farmacocinético de dosis única en 26 niños de 6 a 23 meses de edad fueron similares a las de los pacientes de dos años o más [ver REACCIONES ADVERSAS ]. La formulación de gránulos orales de 4 mg debe usarse para pacientes pediátricos de 12 a 23 meses de edad para el tratamiento del asma, o para pacientes pediátricos de 6 a 23 meses de edad para el tratamiento de la rinitis alérgica perenne. Dado que la formulación de gránulos orales de 4 mg es bioequivalente a la tableta masticable de 4 mg, también se puede usar como una formulación alternativa a la tableta masticable de 4 mg en pacientes pediátricos de 2 a 5 años de edad.
Estudios de interacción farmacológica
Teofilina, prednisona y prednisolona
SINGULAIR se ha administrado con otras terapias utilizadas habitualmente en la profilaxis y el tratamiento crónico del asma sin un aumento aparente de las reacciones adversas. En los estudios de interacción farmacológica, la dosis clínica recomendada de montelukast no tuvo efectos clínicamente importantes sobre la farmacocinética de los siguientes fármacos: teofilina, prednisona y prednisolona.
Montelukast a una dosis de 10 mg una vez al día administrado hasta el estado de equilibrio farmacocinético, no provocó cambios clínicamente significativos en la cinética de una dosis intravenosa única de teofilina [predominantemente un sustrato 1A2 del citocromo P450 (CYP)]. Montelukast en dosis de ≥100 mg diarios dosificados hasta el estado de equilibrio farmacocinético, no causó ningún cambio clínicamente significativo en los perfiles plasmáticos de prednisona o prednisolona luego de la administración de prednisona oral o prednisolona intravenosa.
Anticonceptivos orales, fexofenadina, digoxina y warfarina
En estudios de interacción de medicamentos, la dosis clínica recomendada de montelukast no tuvo efectos clínicamente importantes sobre la farmacocinética de los siguientes medicamentos: anticonceptivos orales (noretindrona 1 mg/etinilestradiol 35 mcg), digoxina y warfarina. Montelukast en dosis de ≥100 mg diarios dosificados hasta el estado de equilibrio farmacocinético no alteró significativamente las concentraciones plasmáticas de ninguno de los componentes de un anticonceptivo oral que contiene noretindrona 1 mg/etinilestradiol 35 mcg. Montelukast a una dosis de 10 mg una vez al día dosificado al estado de equilibrio farmacocinético no cambió el perfil de concentración plasmática de fexofenadina, no cambió el perfil farmacocinético ni la excreción urinaria de digoxina inmunorreactiva; no cambió el perfil farmacocinético de la warfarina (principalmente un sustrato de CYP2C9, 3A4 y 1A2) ni influyó en el efecto de una dosis oral única de 30 mg de warfarina sobre el tiempo de protrombina o el índice internacional normalizado (INR).
Hormonas tiroideas, hipnóticos sedantes, agentes antiinflamatorios no esteroideos, benzodiazepinas y descongestionantes
Aunque no se realizaron estudios adicionales de interacciones específicas, SINGULAIR se utilizó de forma concomitante con una amplia variedad de medicamentos comúnmente prescritos en estudios clínicos sin evidencia de interacciones clínicas adversas. Estos medicamentos incluían hormonas tiroideas, hipnóticos sedantes, agentes antiinflamatorios no esteroideos, benzodiazepinas y descongestionantes.
Inductores enzimáticos del citocromo P450 (CYP)
El fenobarbital, que induce el metabolismo hepático, redujo el área bajo la curva de concentración plasmática (AUC) de montelukast en aproximadamente un 40 % después de una dosis única de 10 mg de montelukast. No se recomienda ajustar la dosis de SINGULAIR. Es razonable emplear un control clínico adecuado cuando se coadministran inductores potentes de la enzima CYP, como fenobarbital o rifampicina, con SINGULAIR.
Efecto de montelukast sobre las enzimas del citocromo P450 (CYP)
Montelukast es un potente inhibidor de CYP2C8 in vitro. Sin embargo, los datos de un estudio clínico de interacción farmacológica con montelukast y rosiglitazona (un sustrato de prueba representativo de fármacos metabolizados principalmente por CYP2C8) en 12 individuos sanos demostraron que la farmacocinética de rosiglitazona no se altera cuando los fármacos se administran conjuntamente, lo que indica que montelukast no no inhibir CYP2C8 in vivo. Por lo tanto, no se prevé que montelukast altere el metabolismo de los fármacos metabolizados por esta enzima (p. ej., paclitaxel, rosiglitazona y repaglinida). Según resultados in vitro adicionales en microsomas hepáticos humanos, las concentraciones plasmáticas terapéuticas de montelukast no inhiben CYP 3A4, 2C9, 1A2, 2A6, 2C19 o 2D6.
Inhibidores de enzimas del citocromo P450 (CYP)
Los estudios in vitro han demostrado que montelukast es un sustrato de CYP 2C8, 2C9 y 3A4. La administración conjunta de montelukast con itraconazol, un inhibidor potente de CYP 3A4, no produjo un aumento significativo de la exposición sistémica a montelukast. Los datos de un estudio clínico de interacción farmacológica con montelukast y gemfibrozil (un inhibidor de CYP 2C8 y 2C9) demostraron que gemfibrozil, a una dosis terapéutica, aumentó la exposición sistémica de montelukast en 4,4 veces. La administración conjunta de itraconazol, gemfibrozil y montelukast no aumentó más la exposición sistémica de montelukast. Según la experiencia clínica disponible, no es necesario ajustar la dosis de montelukast tras la administración concomitante con gemfibrozil [ver SOBREDOSIS ].
Estudios clínicos
Asma
Adultos y adolescentes de 15 años de edad y mayores con asma
Los ensayos clínicos en adultos y adolescentes de 15 años de edad y mayores demostraron que montelukast no tiene un beneficio clínico adicional con dosis superiores a 10 mg una vez al día.
La eficacia de SINGULAIR para el tratamiento crónico del asma en adultos y adolescentes de 15 años de edad y mayores se demostró en dos ensayos (EE. UU. y multinacionales) de diseño similar, aleatorizados, de 12 semanas, doble ciego, controlados con placebo en 1576 pacientes ( 795 tratados con SINGULAIR, 530 tratados con placebo y 251 tratados con control activo). La mediana de edad fue de 33 años (rango 15 a 85); El 56,8% eran mujeres y el 43,2% eran hombres. La distribución étnica/racial en estos estudios fue 71,6% caucásicos, 17,7% hispanos, 7,2% de otros orígenes y 3,5% negros. Los pacientes tenían asma leve o moderada y no fumadores que requirieron aproximadamente 5 inhalaciones de agonista β inhalado por día según las necesidades. Los pacientes tenían un porcentaje inicial medio del volumen espiratorio forzado previsto en 1 segundo (FEV1) del 66 % (rango aproximado, 40 a 90 %). Los criterios de valoración coprimarios en estos ensayos fueron FEV1 y síntomas de asma durante el día. En ambos estudios, después de 12 semanas, un subconjunto aleatorio de pacientes que recibieron SINGULAIR 5 mg se cambió a placebo durante 3 semanas adicionales de tratamiento doble ciego para evaluar posibles efectos de rebote.
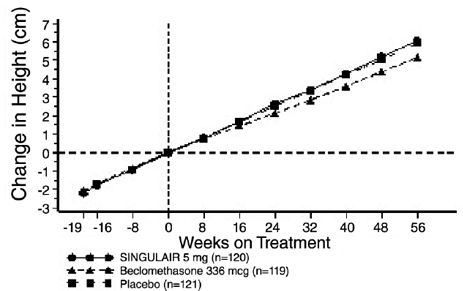
En la FIGURA 2 se muestran los resultados del ensayo de EE. UU. sobre el criterio principal de valoración, el FEV1 matutino, expresado como cambio porcentual medio desde el inicio promediado durante el período de tratamiento de 12 semanas. En comparación con el placebo, el tratamiento con una tableta de SINGULAIR de 10 mg al día en la tarde resultó en un aumento estadísticamente significativo en el cambio porcentual de FEV1 desde el inicio (13,0 % de cambio en el grupo tratado con SINGULAIR 4 mg frente a 4,2 % de cambio en el grupo de placebo, p
Figura 2: Cambio porcentual medio de FEV1 desde el inicio (ensayo de EE. UU.: SINGULAIR 5 mg N=406; placebo N=270) (modelo ANOVA)
El efecto de SINGULAIR 5 mg en otros criterios de valoración primarios y secundarios, representados por el estudio multinacional, se muestra en la TABLA 6. Los resultados en estos criterios de valoración fueron similares en el estudio de EE. UU.
Ambos estudios evaluaron el efecto de SINGULAIR 4 mg en los resultados secundarios, incluido el ataque de asma (utilización de recursos de atención médica, como una visita no programada al consultorio médico, a la sala de emergencias o al hospital; o el tratamiento con medicamentos orales, intravenosos o corticosteroide intramuscular) y el uso de corticosteroides orales para el rescate del asma. En el estudio multinacional, significativamente menos pacientes (15,6 % de los pacientes) con SINGULAIR experimentaron ataques de asma en comparación con los pacientes con placebo (27,3 %, p
Inicio de acción y mantenimiento de efectos
En cada ensayo controlado con placebo en adultos, el efecto del tratamiento de SINGULAIR 4 mg, medido por los parámetros de la tarjeta del diario, incluidas las puntuaciones de los síntomas, el uso de agonistas β "según necesidad" y las mediciones de PEFR, se logró después de la primera dosis y se mantuvo. durante todo el intervalo de dosificación (24 horas). No se observaron cambios significativos en el efecto del tratamiento durante la administración vespertina continua una vez al día en ensayos de extensión no controlados con placebo de hasta un año. La suspensión de SINGULAIR 4 mg en pacientes asmáticos después de 12 semanas de uso continuo no provocó un empeoramiento de rebote del asma.
Pacientes pediátricos de 6 a 14 años de edad con asma
La eficacia de SINGULAIR 5 mg en pacientes pediátricos de 6 a 14 años de edad se demostró en un ensayo doble ciego controlado con placebo de 8 semanas en 336 pacientes (201 tratados con SINGULAIR y 135 tratados con placebo) usando un agonista β inhalado. sobre una base "según sea necesario". Los pacientes tenían un FEV1 porcentual teórico promedio inicial del 72 % (rango aproximado, 45 a 90 %) y un requerimiento diario promedio de agonista β inhalado de 3,4 inhalaciones de albuterol. Aproximadamente el 36% de los pacientes tomaban corticosteroides inhalados. La mediana de edad fue de 11 años (rango 6 a 15); El 35,4% eran mujeres y el 64,6% eran hombres. La distribución étnica/racial en este estudio fue 80,1 % caucásica, 12,8 % negra, 4,5 % hispana y 2,7 % de otros orígenes.
En comparación con el placebo, el tratamiento con una tableta masticable de 4 mg de SINGULAIR de 5 mg al día dio como resultado una mejora significativa en el cambio porcentual medio matutino del VEF1 desde el inicio (8,7 % en el grupo tratado con SINGULAIR 4 mg frente a un cambio del 4,2 % desde el inicio en el grupo de placebo, p
Al igual que en los estudios en adultos, no se observó ningún cambio significativo en el efecto del tratamiento durante la administración continua una vez al día en un ensayo de extensión abierto sin un grupo de placebo simultáneo durante un máximo de 6 meses.
Pacientes pediátricos de 2 a 5 años de edad con asma
La eficacia de SINGULAIR para el tratamiento crónico del asma en pacientes pediátricos de 2 a 5 años de edad se exploró en un estudio de tolerabilidad y seguridad controlado con placebo de 12 semanas de duración en 689 pacientes, 461 de los cuales fueron tratados con SINGULAIR. La mediana de edad fue de 4 años (rango 2 a 6); El 41,5% eran mujeres y el 58,5% eran hombres. La distribución étnica/racial en este estudio fue 56,5% caucásica, 20,9% hispana, 14,4% de otros orígenes y 8,3% negra.
Si bien el objetivo principal fue determinar la seguridad y la tolerabilidad de SINGULAIR 10 mg en este grupo de edad, el estudio incluyó evaluaciones exploratorias de la eficacia, incluidas las puntuaciones de los síntomas del asma durante el día y la noche, el uso de agonistas β, el rescate con corticosteroides orales y la evaluación global del médico. Los hallazgos de estas evaluaciones exploratorias de eficacia, junto con la farmacocinética y la extrapolación de datos de eficacia de pacientes mayores, respaldan la conclusión general de que SINGULAIR es eficaz en el tratamiento de mantenimiento del asma en pacientes de 2 a 5 años de edad.
Efectos en pacientes con corticosteroides inhalados concomitantes
Ensayos separados en adultos evaluaron la capacidad de SINGULAIR 10 mg para aumentar el efecto clínico de los corticosteroides inhalados y permitir la reducción gradual de los corticosteroides inhalados cuando se usan de forma concomitante.
Un ensayo aleatorizado, controlado con placebo, de grupos paralelos (n = 226) inscribió a adultos con asma estable con un FEV1 medio de aproximadamente el 84 % del valor teórico que se mantuvieron previamente con varios corticosteroides inhalados (administrados mediante inhaladores de polvo seco o aerosol de dosis medida). ). La mediana de edad fue de 41,5 años (rango 16 a 70); El 52,2% eran mujeres y el 47,8% eran hombres. La distribución étnica/racial en este estudio fue 92,0% caucásica, 3,5% negra, 2,2% hispana y 2,2% asiática. Los tipos de corticosteroides inhalados y sus requisitos basales medios incluyeron dipropionato de beclometasona (dosis media, 1203 mcg/día), acetónido de triamcinolona (dosis media, 2004 mcg/día), flunisolida (dosis media, 1971 mcg/día), propionato de fluticasona (dosis media, 1971 mcg/día), dosis, 1083 mcg/día), o budesonida (dosis media, 1192 mcg/día). Algunos de estos corticosteroides inhalados eran formulaciones no aprobadas en los EE. UU. y las dosis expresadas pueden no ser exactas. Los requisitos de corticosteroides inhalados previos al estudio se redujeron en aproximadamente un 37 % durante un período de preinclusión con placebo de 5 a 7 semanas diseñado para ajustar a los pacientes la dosis efectiva más baja de corticosteroides inhalados. El tratamiento con SINGULAIR 4 mg resultó en una reducción adicional del 47 % en la dosis media de corticosteroides inhalados en comparación con una reducción media del 30 % en el grupo de placebo durante el período de tratamiento activo de 12 semanas (p≤0,05). No se sabe si los resultados de este estudio pueden generalizarse a pacientes con asma que requieren dosis más altas de corticosteroides inhalados o corticosteroides sistémicos.
En otro ensayo aleatorizado, controlado con placebo, de grupos paralelos (n=642) en una población similar de pacientes adultos tratados previamente, pero no controlados adecuadamente, con corticosteroides inhalados (336 mcg/día de beclometasona), la adición de SINGULAIR a la beclometasona resultó en mejoras estadísticamente significativas en el FEV1 en comparación con los pacientes que continuaron con beclometasona sola o aquellos pacientes a los que se les retiró la beclometasona y se les trató con montelukast o placebo solo durante las últimas 10 semanas del período de tratamiento ciego de 16 semanas. Los pacientes que fueron aleatorizados a los brazos de tratamiento que contenían beclometasona tuvieron un control del asma significativamente mejor desde el punto de vista estadístico que los pacientes aleatorizados a SINGULAIR solo o a placebo solo según lo indicado por FEV1, síntomas diurnos de asma, PEFR, despertares nocturnos debido al asma y β- Requerimientos de agonistas.
En pacientes adultos con asma con sensibilidad documentada a la aspirina, casi todos los cuales estaban recibiendo corticosteroides inhalados u orales concomitantes, un ensayo aleatorizado de grupos paralelos de 4 semanas (n = 80) demostró que SINGULAIR 10 mg, en comparación con el placebo, resultó en una mejora significativa de los parámetros de control del asma. La magnitud del efecto de SINGULAIR 4 mg en pacientes sensibles a la aspirina fue similar al efecto observado en la población general de pacientes asmáticos estudiados. No se ha evaluado el efecto de SINGULAIR sobre la respuesta broncoconstrictora a la aspirina u otros medicamentos antiinflamatorios no esteroideos en pacientes asmáticos sensibles a la aspirina [ver ADVERTENCIAS Y PRECAUCIONES ].
Broncoconstricción inducida por el ejercicio (EIB)
Broncoconstricción inducida por el ejercicio (adultos, adolescentes y pacientes pediátricos de 6 años de edad y mayores)
La eficacia de SINGULAIR 5 mg, 10 mg, cuando se administra como una dosis única 2 horas antes del ejercicio para la prevención de la EIB, se investigó en tres (EE. UU. y multinacional), estudios cruzados, aleatorizados, doble ciego, controlados con placebo que incluyeron un total de 160 pacientes adultos y adolescentes mayores de 15 años con BIE. La prueba de provocación con ejercicio se realizó a las 2 horas, 8,5 o 12 horas y 24 horas después de la administración de una dosis única del fármaco del estudio (SINGULAIR 10 mg o placebo). El criterio principal de valoración fue la caída porcentual máxima media del FEV1 después de la provocación con ejercicio 2 horas después de la dosis en los tres estudios (Estudio A, Estudio B y Estudio C). En el Estudio A, una dosis única de SINGULAIR 10 mg demostró un beneficio protector estadísticamente significativo contra la EIB cuando se tomó 2 horas antes del ejercicio. Algunos pacientes estaban protegidos de BIE a las 8,5 y 24 horas después de la administración; sin embargo, algunos pacientes no lo estaban. Los resultados de la caída porcentual máxima media en cada punto de tiempo en el Estudio A se muestran en la TABLA 7 y son representativos de los resultados de los otros dos estudios.
La eficacia de las tabletas masticables de SINGULAIR de 5 mg, cuando se administra como una dosis única 2 horas antes del ejercicio para la prevención de la EIB, se investigó en un estudio cruzado multinacional, aleatorizado, doble ciego, controlado con placebo que incluyó un total de 64 pacientes pediátricos. pacientes de 6 a 14 años con BIE. La prueba de provocación con ejercicio se realizó a las 2 horas y 24 horas después de la administración de una dosis única del fármaco del estudio (SINGULAIR 5 mg o placebo). El criterio principal de valoración fue la caída porcentual máxima media del FEV1 después de la prueba de ejercicio 2 horas después de la dosis. Una dosis única de SINGULAIR 5 mg demostró un beneficio protector estadísticamente significativo contra la BIE cuando se tomó 2 horas antes del ejercicio (TABLA 8). Se mostraron resultados similares 24 horas después de la dosis (un criterio de valoración secundario). Algunos pacientes estaban protegidos de BIE a las 24 horas de la administración; sin embargo, algunos pacientes no lo estaban. No se evaluaron puntos de tiempo entre 2 y 24 horas después de la dosis.
No se ha establecido la eficacia de SINGULAIR 5 mg para la prevención de la BIE en pacientes menores de 6 años.
No se ha establecido la administración diaria de SINGULAIR 4 mg para el tratamiento crónico del asma para prevenir episodios agudos de BIE.
En un estudio de grupos paralelos, aleatorizado, doble ciego, de 12 semanas de duración de 110 adultos y adolescentes asmáticos de 15 años de edad y mayores, con un porcentaje inicial medio de FEV1 del valor teórico del 83 % y con exacerbación documentada del asma inducida por el ejercicio, el tratamiento con SINGULAIR, 10 mg, una vez al día por la noche, dio como resultado una reducción estadísticamente significativa en el porcentaje medio máximo de caída del FEV1 y el tiempo medio de recuperación dentro del 5 % del FEV1 anterior al ejercicio. La provocación con ejercicio se realizó al final del intervalo de dosificación (es decir, 20 a 24 horas después de la dosis anterior). Este efecto se mantuvo a lo largo del período de tratamiento de 12 semanas, lo que indica que no se produjo tolerancia. Sin embargo, SINGULAIR 4 mg no evitó el deterioro clínicamente significativo en el porcentaje máximo de caída del FEV1 después del ejercicio (es decir, ≥20 % de disminución desde el valor inicial previo al ejercicio) en el 52 % de los pacientes estudiados. En un estudio cruzado separado en adultos, se observó un efecto similar después de dos dosis de SINGULAIR de 10 mg una vez al día.
En pacientes pediátricos de 6 a 14 años de edad, utilizando la tableta masticable de 5 mg, un estudio cruzado de 2 días demostró efectos similares a los observados en adultos cuando se realizó ejercicio de provocación al final del intervalo de dosificación (es decir, 20 a 24 horas después de la dosis anterior).
Rinitis alérgica (estacional y perenne)
Rinitis alérgica estacional
La eficacia de las tabletas de SINGULAIR para el tratamiento de la rinitis alérgica estacional se investigó en 5 ensayos de diseño similar, aleatorizados, doble ciego, de grupos paralelos, controlados con placebo y activo (loratadina) realizados en América del Norte. Los 5 ensayos reclutaron un total de 5029 pacientes, de los cuales 1799 fueron tratados con tabletas SINGULAIR. Los pacientes tenían entre 15 y 82 años de edad con antecedentes de rinitis alérgica estacional, una prueba cutánea positiva para al menos un alérgeno estacional relevante y síntomas activos de rinitis alérgica estacional al ingresar al estudio.
El período de tratamiento aleatorio fue de 2 semanas en 4 ensayos y de 4 semanas en un ensayo. La variable de resultado primaria fue el cambio medio desde el inicio en la puntuación de los síntomas nasales diurnos (el promedio de las puntuaciones individuales de congestión nasal, rinorrea, picazón nasal, estornudos) evaluada por los pacientes en una escala categórica de 0-3.
Cuatro de los cinco ensayos mostraron una reducción significativa en las puntuaciones de los síntomas nasales diurnos con tabletas de 10 mg de SINGULAIR en comparación con el placebo. Los resultados de un ensayo se muestran a continuación. La mediana de edad en este ensayo fue de 35,0 años (rango de 15 a 81); El 65,4% eran mujeres y el 34,6% eran hombres. La distribución étnica/racial en este estudio fue 83,1% caucásica, 6,4% de otros orígenes, 5,8% negra y 4,8% hispana. Los cambios medios desde el inicio en la puntuación de los síntomas nasales diurnos en los grupos de tratamiento que recibieron tabletas de SINGULAIR de 4 mg, loratadina y placebo se muestran en la TABLA 9. Los tres ensayos restantes que demostraron eficacia mostraron resultados similares. Se demostró eficacia para la rinitis alérgica estacional cuando se administró montelukast por la mañana o por la noche.
Rinitis alérgica perenne
La eficacia de las tabletas de 5 mg de SINGULAIR para el tratamiento de la rinitis alérgica perenne se investigó en 2 estudios aleatorizados, doble ciego, controlados con placebo, realizados en América del Norte y Europa. Los dos estudios reclutaron un total de 3357 pacientes, de los cuales 1632 recibieron tabletas de SINGULAIR de 10 mg. Pacientes de 15 a 82 años de edad con rinitis alérgica perenne confirmada por antecedentes y una prueba cutánea positiva a al menos un alérgeno perenne relevante (ácaros del polvo, caspa de animales y/o esporas de moho), que tenían síntomas activos en el momento del estudio entrada, se inscribieron.
En el estudio en el que se demostró la eficacia, la mediana de edad fue de 35 años (rango de 15 a 81); El 64,1% eran mujeres y el 35,9% eran hombres. La distribución étnica/racial en este estudio fue 83,2 % caucásica, 8,1 % negra, 5,4 % hispana, 2,3 % asiática y 1,0 % de otros orígenes. Se demostró que las tabletas de SINGULAIR de 10 mg una vez al día reducen significativamente los síntomas de la rinitis alérgica perenne durante un período de tratamiento de 6 semanas (TABLA 10); en este estudio, la variable de resultado principal fue el cambio medio desde el inicio en la puntuación de los síntomas nasales diurnos (el promedio de las puntuaciones individuales de congestión nasal, rinorrea y estornudos).
El otro estudio de 6 semanas evaluó SINGULAIR 10 mg (n=626), placebo (n=609) y un control activo (cetirizina 10 mg; n=120). El análisis principal comparó el cambio medio desde el inicio en la puntuación de los síntomas nasales diurnos para SINGULAIR frente a placebo durante las primeras 4 semanas de tratamiento; el estudio no fue diseñado para la comparación estadística entre SINGULAIR y el control activo. La variable de resultado primaria incluyó picazón nasal además de congestión nasal, rinorrea y estornudos. La diferencia estimada entre SINGULAIR y el placebo fue de -0,04 con un IC del 95 % de (-0,09; 0,01). La diferencia estimada entre el control activo y el placebo fue de -0,10 con un IC del 95 % de (-0,19, -0,01).
INFORMACIÓN DEL PACIENTE
SINGULAIR® (SING-u-lair)(montelukast sódico) tabletas masticables
¿Cuál es la información más importante que debo saber sobre SINGULAIR 4mg?Han ocurrido problemas graves de salud mental en personas que toman SINGULAIR o incluso después de que el tratamiento haya terminado.
Esto puede suceder en personas con o sin antecedentes de problemas de salud mental. Deje de tomar SINGULAIR e informe a su proveedor de atención médica de inmediato si usted o su hijo tienen cambios inusuales en el comportamiento o el pensamiento, incluido cualquiera de estos síntomas:
- agitación, incluido el comportamiento agresivo u hostilidad
- problemas de atencion
- sueños malos o vívidos
- depresión
- desorientación (confusión)
- sentirse ansioso
- irritabilidad
- alucinaciones (ver u oír cosas que en realidad no existen)
- problemas de memoria
- síntomas obsesivo-compulsivos
- inquietud
- caminar dormido
- tartamudeo
- pensamientos y acciones suicidas (incluido el suicidio)
- temblor
- problemas para dormir
- movimientos musculares descontrolados
¿Qué es SINGULAIR 10 mg?
SINGULAIR 4mg es un medicamento recetado que bloquea sustancias en el cuerpo llamadas leucotrienos. Esto puede ayudar a mejorar los síntomas del asma y la inflamación del revestimiento de la nariz (rinitis alérgica). SINGULAIR no contiene esteroides. SINGULAIR se utiliza para:
- alergias al aire libre que ocurren parte del año (rinitis alérgica estacional) en adultos y niños a partir de los 2 años de edad, y
- alergias en interiores que ocurren todo el año (rinitis alérgica perenne) en adultos y niños a partir de los 6 meses de edad.
No haga tome SINGULAIR si es alérgico a alguno de sus ingredientes. Consulte el final de esta Guía del medicamento para obtener una lista completa de los ingredientes de SINGULAIR.
Antes de tomar SINGULAIR 4 mg, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si:
- son alérgicos a la aspirina.
- tiene fenilcetonuria. Los comprimidos masticables de SINGULAIR contienen aspartamo, una fuente de fenilalanina.
- tiene o ha tenido problemas de salud mental.
- está embarazada o planea quedar embarazada. Hable con su proveedor de atención médica si está embarazada o planea quedar embarazada, es posible que SINGULAIR 4 mg no sea adecuado para usted.
- están amamantando o planean amamantar. No se sabe si SINGULAIR pasa a la leche materna. Hable con su proveedor de atención médica sobre la mejor manera de alimentar a su bebé mientras toma SINGULAIR.
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos recetados y de venta libre, las vitaminas y los suplementos a base de hierbas. Algunos medicamentos pueden afectar el funcionamiento de SINGULAIR, o SINGULAIR 4 mg puede afectar el funcionamiento de sus otros medicamentos.
¿Cómo debo tomar SINGULAIR 10 mg?
Para cualquiera Quién toma SINGULAIR:
- Lea el detallado Instrucciones de uso que viene con los gránulos orales de SINGULAIR.
- Tome SINGULAIR 4 mg exactamente como se lo recetó su proveedor de atención médica. Su proveedor de atención médica le dirá cuánto SINGULAIR debe tomar y cuando tomarlo
- Deje de tomar SINGULAIR 5 mg e informe a su proveedor de atención médica de inmediato si usted o su hijo tienen algún cambio inusual en el comportamiento o el pensamiento.
- Puede tomar SINGULAIR 5 mg con alimentos o sin alimentos. Ver la sección "¿Cómo puedo darle SINGULAIR gránulos orales a mi hijo?" en el Instrucciones de uso para obtener información sobre qué alimentos y líquidos se pueden tomar con SINGULAIR 10 mg gránulos orales.
- Si usted o su hijo olvidan una dosis de SINGULAIR, simplemente tome la siguiente dosis a la hora habitual. No tome 2 dosis al mismo tiempo.
- Si toma demasiado SINGULAIR, llame a su proveedor de atención médica de inmediato.
Para adultos y niños de 12 meses de edad y mayores con asma:
- Tome SINGULAIR 1 vez al día, por la noche. Continúe tomando SINGULAIR 5 mg todos los días durante el tiempo que se lo recete su proveedor de atención médica, incluso si no tiene síntomas de asma.
- Informe a su proveedor de atención médica de inmediato si sus síntomas de asma empeoran o si necesita usar su medicamento inhalador de rescate con más frecuencia para los ataques de asma.
- Siempre tenga a mano su medicamento inhalador de rescate para los ataques de asma.
- Continúe tomando sus otros medicamentos para el asma según lo recetado, a menos que su proveedor de atención médica le indique que cambie la forma en que toma estos medicamentos.
Para personas de 6 años de edad y mayores para la prevención del asma inducida por el ejercicio:
- Tome SINGULAIR al menos 2 horas antes del ejercicio.
- Siempre tenga a mano su medicamento inhalador de rescate para los ataques de asma.
- Si toma SINGULAIR 10 mg todos los días para el asma crónica o la rinitis alérgica, no haga tome otra dosis para prevenir el asma inducida por el ejercicio. Hable con su proveedor de atención médica sobre su tratamiento para el asma inducida por el ejercicio.
- No tome 2 dosis de SINGULAIR 5 mg dentro de las 24 horas (1 día).
Para cualquier persona de 2 años de edad en adelante con rinitis alérgica estacional, o para cualquier persona de 6 meses de edad en adelante con rinitis alérgica perenne:
- Tome SINGULAIR 1 vez al día, aproximadamente a la misma hora todos los días.
¿Qué debo evitar mientras tomo SINGULAIR 10mg?
Si tiene asma y la aspirina empeora sus síntomas de asma, siga evitando tomar aspirina u otros medicamentos llamados antiinflamatorios no esteroideos (AINE) mientras toma SINGULAIR.
¿Cuáles son los posibles efectos secundarios de SINGULAIR?
SINGULAIR puede causar efectos secundarios graves, que incluyen:
- Ver “¿Cuál es la información más importante que debo saber sobre SINGULAIR 4mg?”
- Aumento de ciertos glóbulos blancos (eosinófilos) y posibles vasos sanguíneos inflamados en todo el cuerpo (vasculitis sistémica). En raras ocasiones, esto puede suceder en personas con asma que toman SINGULAIR. Esto sucede a veces en personas que también toman un medicamento esteroide por vía oral que se está interrumpiendo o se está reduciendo la dosis.
Informe a su proveedor de atención médica de inmediato si tiene uno o más de estos síntomas:
- una sensación de alfileres y agujas o entumecimiento de brazos o piernas
- una enfermedad parecida a la gripe
- sarpullido
- inflamación grave (dolor e hinchazón) de los senos paranasales (sinusitis)
Los efectos secundarios más comunes de SINGULAIR incluyen:
- infeccion de las vias respiratorias altas
- fiebre
- dolor de cabeza
- dolor de garganta
- tos
- dolor de estómago
- Diarrea
- dolor de oído o infección de oído
- gripe
- nariz que moquea
- Infección sinusal
Estos no son todos los posibles efectos secundarios de SINGULAIR. Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo conservar SINGULAIR?
- Guarde SINGULAIR 10 mg a temperatura ambiente, entre 20 °C y 25 °C (68 °F y 77 °F).
- Mantenga SINGULAIR 4 mg en el paquete en el que viene.
- Conservar SINGULAIR 4mg en un lugar seco y protegido de la luz.
- Mantenga SINGULAIR y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de SINGULAIR.
A veces, los medicamentos se recetan para fines distintos a los enumerados en la Guía del medicamento. No use SINGULAIR para una condición para la cual no fue recetado. No le dé SINGULAIR a otras personas aunque tengan los mismos síntomas que usted. Puede que les haga daño.
Puede pedirle a su farmacéutico o proveedor de atención médica información sobre SINGULAIR 10 mg escrita para profesionales de la salud.
¿Cuáles son los ingredientes de SINGULAIR?
Ingrediente activo: montelukast sódico
Ingredientes inactivos:
- Gránulos orales de 4 mg: manitol, hidroxipropilcelulosa y estearato de magnesio.
- Comprimidos masticables de 4 mg y 5 mg: manitol, celulosa microcristalina, hidroxipropilcelulosa, óxido férrico rojo, croscarmelosa de sodio, sabor a cereza, aspartamo y estearato de magnesio.
- Personas con Fenilcetonuria: SINGULAIR 4 mg comprimidos masticables contienen 0,674 mg de fenilalanina y SINGULAIR 5 mg comprimidos masticables contienen 0,842 mg de fenilalanina.
- Tableta de 10 mg: celulosa microcristalina, lactosa monohidrato, croscarmelosa sódica, hidroxipropilcelulosa y estearato de magnesio. El recubrimiento de la película contiene: hidroxipropilmetilcelulosa, hidroxipropilcelulosa, dióxido de titanio, óxido férrico rojo, óxido férrico amarillo y cera de carnauba.
Instrucciones de uso
SINGULAIR® (SING-u-lair)(montelukast sódico) gránulos orales
Estas Instrucciones de uso contienen información sobre cómo usar SINGULAIR 10 mg granulado oral.
Información importante:
- Antes de administrar una dosis de SINGULAIR gránulos orales, lea estas Instrucciones de uso para asegurarse de preparar y administrar los gránulos orales correctamente.
- Administre los gránulos orales de SINGULAIR a su hijo exactamente como lo indique su proveedor de atención médica.
- Deje de administrar SINGULAIR 5 mg e informe a su proveedor de atención médica de inmediato si su hijo tiene algún cambio inusual en el comportamiento o el pensamiento.
- Continúe dándole a su hijo sus medicamentos para el asma según lo recetado, a menos que su proveedor de atención médica le indique que cambie la forma en que administra estos medicamentos.
- Puede administrar SINGULAIR 5 mg granulado oral con alimentos o sin alimentos.
¿Cómo puedo darle SINGULAIR 4 mg granulado oral a mi hijo?
- No haga abra el paquete hasta que esté listo para usar.
- Hay diferentes maneras de administrar SINGULAIR 4 mg granulado oral. Debe elegir el mejor método para su hijo:
- justo en la boca
- disuelto en 1 cucharadita (5 ml) de fórmula para bebés o leche materna fría o a temperatura ambiente
- mezclado con 1 cucharada de uno de los siguientes alimentos blandos a temperatura ambiente o fría: puré de manzana, puré de zanahoria, arroz o helado.
- Dele al niño toda la mezcla en 15 minutos.
- No almacene ninguna mezcla sobrante de SINGULAIR (gránulos orales mezclados con alimentos, fórmula para bebés o leche materna) para usarla más adelante. Deseche cualquier porción no utilizada.
- No mezcle los gránulos orales de SINGULAIR con ninguna bebida líquida que no sea fórmula para bebés o leche materna. Su hijo puede beber otros líquidos después de tragar la mezcla.
¿Cómo debo almacenar SINGULAIR 5 mg?
- Guarde SINGULAIR 4 mg a temperatura ambiente, entre 20 °C y 25 °C (68 °F y 77 °F).
- Mantenga SINGULAIR en el paquete en el que viene.
- Conservar SINGULAIR 5mg en un lugar seco y protegido de la luz.
- Mantenga SINGULAIR y todos los medicamentos fuera del alcance de los niños.
Estas instrucciones de uso han sido aprobadas por la Administración de Drogas y Alimentos de EE. UU.
