Anafranil 10mg, 25mg, 50mg Clomipramine Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Anafranil 10mg y cómo se usa?
Anafranil 50 mg es un medicamento recetado que se usa para tratar los síntomas del trastorno obsesivo-compulsivo. Anafranil 50 mg se puede usar solo o con otros medicamentos.
Anafranil pertenece a una clase de medicamentos llamados antidepresivos, TCA.
No se sabe si Anafranil 50 mg es seguro y eficaz en niños menores de 10 años.
¿Cuáles son los posibles efectos secundarios de Anafranil 25mg?
Anafranil 50 mg puede causar efectos secundarios graves, que incluyen:
- erupción cutanea,
- fiebre,
- glándulas inflamadas,
- síntomas similares a la gripe,
- dolores musculares,
- severa debilidad,
- hematomas inusuales,
- coloración amarillenta de la piel y los ojos (ictericia),
- cambios de comportamiento,
- ansiedad,
- ataques de pánico,
- problemas para dormir,
- comportamiento impulsivo,
- irritabilidad,
- agitación,
- hostilidad,
- agresividad,
- hiperactivo (mental o físicamente),
- depresión,
- pensamientos suicidas,
- visión borrosa,
- visión de túnel,
- dolor o hinchazón de los ojos,
- viendo halos alrededor de las luces,
- ritmo cárdiaco elevado,
- temblores o temblores,
- confusión,
- miedo extremo,
- dolor o dificultad para orinar,
- embargo,
- fiebre,
- alucinaciones,
- transpiración,
- temblando,
- frecuencia cardíaca rápida,
- rigidez muscular,
- retorciéndose,
- pérdida de coordinación,
- náuseas,
- vómitos y
- Diarrea
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Anafranil incluyen:
- boca seca,
- náuseas,
- dolor de barriga,
- pérdida de apetito,
- estreñimiento,
- sintiendo ansiedad,
- mareado,
- somnolencia,
- cansado,
- problemas para dormir,
- cambios en el apetito o el peso,
- problemas de memoria,
- problemas para concentrarse,
- aumento de la sudoración,
- entumecimiento u hormigueo,
- cambios de visión,
- disminución del deseo sexual,
- impotencia, y
- dificultad para tener un orgasmo
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Anafranil. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
ADVERTENCIA
Medicamentos suicidas y antidepresivos
Los antidepresivos aumentaron el riesgo de pensamientos y conductas suicidas (tendencia suicida) en comparación con placebo en niños, adolescentes y adultos jóvenes en estudios a corto plazo de trastorno depresivo mayor (TDM) y otros trastornos psiquiátricos. Cualquiera que esté considerando el uso de clorhidrato de clomipramina o cualquier otro antidepresivo en un niño, adolescente o adulto joven debe sopesar este riesgo con la necesidad clínica. Los estudios a corto plazo no mostraron un aumento en el riesgo de tendencias suicidas con antidepresivos en comparación con placebo en adultos mayores de 24 años; hubo una reducción del riesgo con los antidepresivos en comparación con el placebo en adultos de 65 años o más. La depresión y ciertos otros trastornos psiquiátricos están asociados con aumentos en el riesgo de suicidio. Los pacientes de todas las edades que comienzan con la terapia antidepresiva deben ser monitoreados apropiadamente y observados de cerca para detectar empeoramiento clínico, tendencias suicidas o cambios inusuales en el comportamiento. Se debe advertir a las familias y cuidadores de la necesidad de una estrecha observación y comunicación con el prescriptor. El clorhidrato de clomipramina no está aprobado para su uso en pacientes pediátricos, excepto en pacientes con trastorno obsesivo compulsivo (TOC) (ver ADVERTENCIAS , Empeoramiento clínico y riesgo de suicidio ; INFORMACIÓN DEL PACIENTE ; y PRECAUCIONES , Uso pediátrico ).
DESCRIPCIÓN
Anafranil™ (clomipramina clorhidrato) Cápsulas USP es un fármaco antiobsesivo que pertenece a la clase (dibenzazepina) de agentes farmacológicos conocidos como antidepresivos tricíclicos. Anafranil está disponible en cápsulas de 25, 50 y 75 mg para administración oral.
El clorhidrato de clomipramina USP es monoclorhidrato de 3-cloro-5-[3-(dimetilamino)propil]-10,11-dihidro5H-dibenz[b,f]azepina, y su fórmula estructural es:
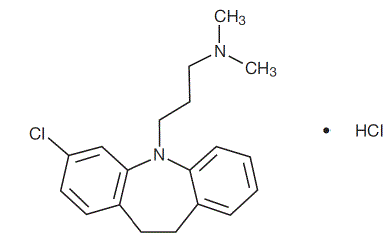
C19H23ClN2 • HCl PM = 351,31
El clorhidrato de clomipramina USP es un polvo cristalino de color blanco a blanquecino. Es libremente soluble en agua, en metanol y en cloruro de metileno, e insoluble en éter etílico y en hexano.
Ingredientes inactivos. D&C Red No. 33 (solo cápsulas de 25 mg), D&C Yellow No. 10, FD&C Blue No. 1 (solo cápsulas de 50 mg), FD&C Yellow No. 6, gelatina, estearato de magnesio, metilparabeno, propilparabeno, almidón (maíz), y dióxido de titanio.
INDICACIONES
Anafranil™ (clomipramina clorhidrato) Cápsulas USP está indicado para el tratamiento de obsesiones y compulsiones en pacientes con Trastorno Obsesivo Compulsivo (TOC). Las obsesiones o compulsiones deben causar una angustia marcada, consumir mucho tiempo o interferir significativamente con el funcionamiento social u ocupacional, para cumplir con el diagnóstico de TOC del DSM-III-R (alrededor de 1989).
Las obsesiones son ideas, pensamientos, imágenes o impulsos recurrentes y persistentes que son egodistónicos. Las compulsiones son comportamientos repetitivos, con propósito e intencionales que se realizan en respuesta a una obsesión o de manera estereotipada, y que la persona reconoce como excesivos o irrazonables.
La eficacia de Anafranil 25 mg para el tratamiento del TOC se demostró en estudios multicéntricos, controlados con placebo y de grupos paralelos, incluidos dos estudios de 10 semanas en adultos y un estudio de 8 semanas en niños y adolescentes de 10 a 17 años de edad. Los pacientes de todos los estudios tenían TOC de moderado a grave (DSM-III), con puntuaciones iniciales medias en la escala obsesiva compulsiva de Yale-Brown (YBOCS) que oscilaban entre 26 y 28 y una puntuación inicial media de 10 en la Escala obsesiva global clínica del NIMH. Escala Compulsiva (NIMH-OC). Los pacientes que tomaban CMI experimentaron una reducción media de aproximadamente 10 en la YBOCS, lo que representa una mejora media en esta escala del 35 % al 42 % entre adultos y del 37 % entre niños y adolescentes. Los pacientes tratados con CMI experimentaron una disminución de 3,5 unidades en el NIMH-OC. Los pacientes que recibieron placebo no mostraron una respuesta clínica importante en ninguna de las escalas. La dosis máxima fue de 250 mg/día para la mayoría de los adultos y de 3 mg/kg/día (hasta 200 mg) para todos los niños y adolescentes.
La eficacia de Anafranil 25 mg para uso a largo plazo (es decir, durante más de 10 semanas) no se ha evaluado sistemáticamente en ensayos controlados con placebo. El médico que decida usar Anafranil 10 mg durante períodos prolongados debe reevaluar periódicamente la utilidad a largo plazo del fármaco para el paciente individual (ver DOSIFICACIÓN Y ADMINISTRACIÓN ).
DOSIFICACIÓN Y ADMINISTRACIÓN
Los regímenes de tratamiento que se describen a continuación se basan en los utilizados en ensayos clínicos controlados de Anafranil 50 mg en 520 adultos y 91 niños y adolescentes con TOC. Durante la titulación inicial, Anafranil debe administrarse en dosis divididas con las comidas para reducir los efectos secundarios gastrointestinales. El objetivo de esta fase de titulación inicial es minimizar los efectos secundarios al permitir que se desarrolle la tolerancia a los efectos secundarios o permitir que el paciente tenga tiempo para adaptarse si no se desarrolla la tolerancia.
Debido a que tanto CMI como su metabolito activo, DMI, tienen semividas de eliminación prolongadas, el prescriptor debe tener en cuenta el hecho de que los niveles plasmáticos en estado estacionario pueden no alcanzarse hasta 2 o 3 semanas después del cambio de dosis (ver FARMACOLOGÍA CLÍNICA ). Por lo tanto, después de la titulación inicial, puede ser apropiado esperar de 2 a 3 semanas entre ajustes de dosis adicionales.
Tratamiento inicial/Ajuste de dosis (Adultos)
El tratamiento con Anafranil 25 mg debe iniciarse a una dosis de 25 mg diarios y aumentarse gradualmente, según se tolere, hasta aproximadamente 100 mg durante las primeras 2 semanas. Durante la titulación inicial, Anafranil 50 mg debe administrarse en dosis divididas con las comidas para reducir los efectos secundarios gastrointestinales. A partir de entonces, la dosis puede aumentarse gradualmente durante las próximas semanas, hasta un máximo de 250 mg al día. Después de la titulación, la dosis diaria total puede administrarse una vez al día a la hora de acostarse para minimizar la sedación diurna.
Tratamiento Inicial/Ajuste de Dosis (Niños y Adolescentes)
Al igual que con los adultos, la dosis inicial es de 25 mg diarios y debe aumentarse gradualmente (también se administra en dosis divididas con las comidas para reducir los efectos secundarios gastrointestinales) durante las primeras 2 semanas, según se tolere, hasta un máximo diario de 3 mg/kg o 100 mg, lo que sea menor. Posteriormente, la dosis puede aumentarse gradualmente durante las próximas semanas hasta un máximo diario de 3 mg/kg o 200 mg, lo que sea menor (ver PRECAUCIONES , Uso pediátrico ). Al igual que con los adultos, después de la titulación, la dosis diaria total puede administrarse una vez al día a la hora de acostarse para minimizar la sedación diurna.
Tratamiento de Mantenimiento/Continuación (Adultos, Niños y Adolescentes)
Si bien no hay estudios sistemáticos que respondan a la pregunta de cuánto tiempo continuar con Anafranil 10 mg, el TOC es una afección crónica y es razonable considerar la continuación para un paciente que responda. Aunque la eficacia de Anafranil 50 mg después de 10 semanas no se ha documentado en ensayos controlados, los pacientes han continuado la terapia en condiciones de doble ciego hasta por 1 año sin pérdida de beneficios. Sin embargo, se deben hacer ajustes de dosis para mantener al paciente con la dosis efectiva más baja, y los pacientes deben ser reevaluados periódicamente para determinar la necesidad de tratamiento. Durante el mantenimiento, la dosis diaria total puede administrarse una vez al día a la hora de acostarse.
Cambio de un paciente a o desde un inhibidor de la monoaminooxidasa (IMAO) destinado a tratar trastornos psiquiátricos
Deben transcurrir al menos 14 días entre la interrupción de un IMAO destinado a tratar trastornos psiquiátricos y el inicio de la terapia con Anafranil. Por el contrario, se deben permitir al menos 14 días después de suspender Anafranil antes de comenzar un IMAO destinado a tratar trastornos psiquiátricos (ver CONTRAINDICACIONES ).
Uso de Anafranil 25 mg con otros IMAO, como linezolid o azul de metileno
No comience Anafranil 50 mg en un paciente que está siendo tratado con linezolid o azul de metileno intravenoso porque existe un mayor riesgo de síndrome serotoninérgico. En un paciente que requiere un tratamiento más urgente de una condición psiquiátrica, se deben considerar otras intervenciones, incluida la hospitalización (ver CONTRAINDICACIONES ).
En algunos casos, un paciente que ya recibe terapia con Anafranil 25 mg puede requerir tratamiento urgente con linezolid o azul de metileno intravenoso. Si no se dispone de alternativas aceptables al tratamiento con linezolid o azul de metileno intravenoso y se considera que los beneficios potenciales del tratamiento con linezolid o azul de metileno intravenoso superan los riesgos del síndrome serotoninérgico en un paciente en particular, se debe suspender Anafranil de inmediato y linezolid o azul de metileno intravenoso. se puede administrar Se debe monitorear al paciente para detectar síntomas del síndrome serotoninérgico durante dos semanas o hasta 24 horas después de la última dosis de linezolid o azul de metileno intravenoso, lo que ocurra primero. La terapia con Anafranil puede reanudarse 24 horas después de la última dosis de linezolid o azul de metileno intravenoso (ver ADVERTENCIAS ).
No está claro el riesgo de administrar azul de metileno por vías no intravenosas (como comprimidos orales o inyección local) o en dosis intravenosas muy inferiores a 1 mg/kg con Anafranil 50 mg. No obstante, el médico debe ser consciente de la posibilidad de síntomas emergentes del síndrome serotoninérgico con dicho uso (ver ADVERTENCIAS ).
CÓMO SUMINISTRADO
Anafranil™ (clorhidrato de clomipramina) Cápsulas USP
Cápsulas de 25 mg: cuerpo marfil impreso en negro con una "M" y tapa de color amarillo melón impresa en negro con "ANAFRANIL 25 mg"
Botellas de 30………....……...…...…... … NDC 0406-9906-03
Cápsulas de 50 mg: cuerpo marfil impreso en negro con una "M" y tapa azul aguamarina impresa en negro con "ANAFRANIL 50 mg"
Botellas de 30………..………....…... ..…NDC 0406-9907-03
Cápsulas de 75 mg: cuerpo marfil impreso en negro con una "M" y tapa amarilla impresa en negro con "ANAFRANIL 75 mg"
Botellas de 30………..……...... ..…NDC 0406-9908-03
Almacenamiento
Almacenar a una temperatura de 20° a 25°C (68° a 77°F) [ver Temperatura ambiente controlada por USP ].
Dispensar en recipientes bien cerrados con cierre a prueba de niños. Proteger de la humedad.
Toxicología Animal
Se han observado con Anafranil fosfolipidosis y cambios testiculares, comúnmente asociados con compuestos tricíclicos. En estudios crónicos con ratas, los cambios relacionados con Anafranil 50 mg consistieron en fosfolipidosis sistémica, alteraciones en los testículos (atrofia, mineralización) y cambios secundarios en otros tejidos. Además, se observó trombosis cardíaca y dermatitis/queratitis en ratas tratadas durante 2 años con dosis que eran 24 y 10 veces la dosis diaria máxima recomendada en humanos (MRHD), respectivamente, en mg/kg, y 4 y 1,5 veces la MRHD. , respectivamente, sobre una base de mg/m².
Mallinckrodt, la marca "M", el logotipo de Mallinckrodt Pharmaceuticals, M Â y otras marcas son marcas comerciales de una empresa de Mallinckrodt.
Fabricado por: Patheon Inc., Whitby, Ontario, Canadá, L1N 5Z5 para SpecGx LLC, Webster Groves, MO 63119 EE. UU. Revisado: marzo de 2019
EFECTOS SECUNDARIOS
comúnmente observado
Los eventos adversos observados con mayor frecuencia asociados con el uso de Anafranil 10 mg y que no se observaron con una incidencia equivalente entre los pacientes tratados con placebo fueron molestias gastrointestinales, que incluyen sequedad de boca, estreñimiento, náuseas, dispepsia y anorexia; quejas del sistema nervioso, incluyendo somnolencia, temblores, mareos, nerviosismo y mioclonías; molestias genitourinarias, que incluyen cambios en la libido, insuficiencia eyaculatoria, impotencia y trastornos de la micción; y otras molestias misceláneas, como fatiga, sudoración, aumento del apetito, aumento de peso y cambios visuales.
Conduce a la interrupción del tratamiento
Aproximadamente el 20 % de los 3616 pacientes que recibieron Anafranil en los ensayos clínicos previos a la comercialización en los EE. UU. interrumpieron el tratamiento debido a un evento adverso. Aproximadamente la mitad de los pacientes que discontinuaron (9% del total) tenían múltiples quejas, ninguna de las cuales podía clasificarse como primaria. Cuando se pudo identificar un motivo principal para la suspensión, la mayoría de los pacientes interrumpieron debido a problemas del sistema nervioso (5,4 %), principalmente somnolencia. El segundo motivo más frecuente de interrupción fueron las molestias del sistema digestivo (1,3 %), principalmente vómitos y náuseas.
No hubo una relación aparente entre los eventos adversos y las concentraciones plasmáticas elevadas del fármaco.
Incidencia En Ensayos Clínicos Controlados
La siguiente tabla enumera los eventos adversos que ocurrieron con una incidencia del 1 % o mayor entre los pacientes con TOC que recibieron 10 mg de Anafranil en ensayos clínicos controlados con placebo en adultos o pediátricos. Las frecuencias se obtuvieron a partir de datos agrupados de ensayos clínicos en los que participaron adultos que recibieron Anafranil (N=322) o placebo (N=319) o niños tratados con Anafranil (N=46) o placebo (N=44). El prescriptor debe ser consciente de que estas cifras no pueden utilizarse para predecir la incidencia de efectos secundarios en el curso de la práctica médica habitual, en la que las características del paciente y otros factores difieren de los que prevalecieron en los ensayos clínicos. Del mismo modo, las frecuencias citadas no pueden compararse con cifras obtenidas de otras investigaciones clínicas que involucran diferentes tratamientos, usos e investigadores. Sin embargo, las cifras citadas proporcionan al médico una base para estimar la contribución relativa de los factores farmacológicos y no farmacológicos a la incidencia de efectos secundarios en las poblaciones estudiadas.
Incidencia de Experiencias Adversas Surgidas del Tratamiento en Ensayos Clínicos Controlados con Placebo (Porcentaje de Pacientes que Reportaron Evento)
Otros eventos observados durante la evaluación previa a la comercialización de Anafranil
Durante las pruebas clínicas en los EE. UU., se administraron dosis múltiples de 50 mg de Anafranil a aproximadamente 3600 sujetos. Los eventos adversos asociados con esta exposición fueron registrados por investigadores clínicos utilizando terminología de su propia elección. En consecuencia, no es posible proporcionar una estimación significativa de la proporción de personas que experimentan eventos adversos sin agrupar primero tipos similares de eventos adversos en un número menor de categorías de eventos estandarizados.
En las tabulaciones que siguen, se ha utilizado un diccionario de terminología modificado de la Organización Mundial de la Salud para clasificar los eventos adversos informados. Las frecuencias presentadas, por lo tanto, representan la proporción de las 3525 personas expuestas a Anafranil que experimentaron un evento del tipo mencionado en al menos una ocasión mientras recibían Anafranil. Se incluyen todos los eventos excepto los ya enumerados en la tabla anterior, los informados en términos tan generales que no son informativos y aquellos en los que la asociación con la droga fue remota. Es importante recalcar que si bien los eventos informados ocurrieron durante el tratamiento con Anafranil, no necesariamente fueron causados por éste.
Los eventos se clasifican además por sistema corporal y se enumeran en orden decreciente de frecuencia de acuerdo con las siguientes definiciones: los eventos adversos frecuentes son aquellos que ocurren en una o más ocasiones en al menos 1/100 pacientes; los eventos adversos poco frecuentes son los que ocurren en 1/100 a 1/1000 pacientes; Los eventos raros son aquellos que ocurren en menos de 1/1000 pacientes.
Cuerpo como un Todo - Infrecuente: edema general, mayor susceptibilidad a la infección, malestar general. Raro - edema dependiente, síndrome de abstinencia.
Sistema cardiovascular - Infrecuentes: ECG anormal, arritmia, bradicardia, paro cardíaco, extrasístoles, palidez. Raros: aneurisma, aleteo auricular, bloqueo de rama, insuficiencia cardíaca, hemorragia cerebral, bloqueo cardíaco, infarto de miocardio, isquemia miocárdica, isquemia periférica, tromboflebitis, vasoespasmo, taquicardia ventricular.
Sistema digestivo - Infrecuentes: función hepática anormal, sangre en las heces, colitis, duodenitis, úlcera gástrica, gastritis, reflujo gastroesofágico, gingivitis, glositis, hemorroides, hepatitis, aumento de la saliva, síndrome del intestino irritable, úlcera péptica, hemorragia rectal, ulceración de la lengua, caries dental. Raros: queilitis, enteritis crónica, heces descoloridas, dilatación gástrica, sangrado gingival, hipo, obstrucción intestinal, edema oral/faríngeo, íleo paralítico, agrandamiento de las glándulas salivales.
Sistema endocrino - Infrecuente - hipotiroidismo. Raros: bocio, ginecomastia, hipertiroidismo.
Sistema Hemático y Linfático - Infrecuente - linfadenopatía. Raros: reacción leucemoide, trastorno similar al linfoma, depresión de la médula.
Trastorno Metabólico y Nutricional - Infrecuentes: deshidratación, diabetes mellitus, gota, hipercolesterolemia, hiperglucemia, hiperuricemia, hipopotasemia. Raros: intolerancia a las grasas, glucosuria.
Sistema musculoesquelético - Infrecuente - artrosis. Raros: distonía, exostosis, erupción lúpica eritematosa, hematomas, miopatía, miositis, poliarteritis nodosa, tortícolis.
Sistema nervioso - Frecuente - pensamiento anormal, vértigo. Infrecuentes: coordinación anormal, EEG anormal, marcha anormal, apatía, ataxia, coma, convulsiones, delirio, discinesia, disfonía, encefalopatía, euforia, trastorno extrapiramidal, alucinaciones, hostilidad, hipercinesia, alucinaciones hipnagógicas, hipocinesia, calambres en las piernas, reacción maníaca , neuralgia, paranoia, trastorno fóbico, psicosis, alteración sensorial, sonambulismo, estimulación, ideación suicida, intento de suicidio, rechinamiento de dientes. Raros: síndrome anticolinérgico, afasia, apraxia, catalepsia, síndrome colinérgico, coreoatetosis, espasmo generalizado, hemiparesia, hiperestesia, hiperreflexia, hipoestesia, ilusión, alteración del control de los impulsos, indecisión, mutismo, neuropatía, nistagmo, crisis oculógira, parálisis del nervio oculomotor, reacción esquizofrénica , estupor, suicidio.
Sistema respiratorio - Infrecuente: bronquitis, hiperventilación, aumento de esputo, neumonía. Raros: cianosis, hemoptisis, hipoventilación, laringismo.
Piel y Anexos - Infrecuentes: alopecia, celulitis, quistes, eczema, erupción eritematosa, prurito genital, erupción maculopapular, reacción de fotosensibilidad, psoriasis, erupción pustulosa, decoloración de la piel. Raros: cloasma, foliculitis, hipertricosis, piloerección, seborrea, hipertrofia de la piel, ulceración de la piel.
Sentidos especiales - Infrecuentes: acomodación anormal, sordera, diplopía, dolor de oído, dolor ocular, sensación de cuerpo extraño, hiperacusia, parosmia, fotofobia, escleritis, pérdida del gusto. Raros: blefaritis, cromatopsia, hemorragia conjuntival, exoftalmos, glaucoma, queratitis, trastorno del laberinto, ceguera nocturna, trastorno de la retina, estrabismo, defecto del campo visual.
Sistema Urogenital - Poco frecuentes: endometriosis, epididimitis, hematuria, nocturia, oliguria, quiste ovárico, dolor perineal, poliuria, trastorno prostático, cálculo renal, dolor renal, trastorno uretral, incontinencia urinaria, hemorragia uterina, hemorragia vaginal. Raros: albuminuria, anorgasmia, ingurgitación mamaria, fibroadenosis mamaria, displasia cervical, hiperplasia endometrial, eyaculación precoz, pielonefritis, piuria, quiste renal, inflamación uterina, trastorno vulvar.
Experiencia posterior a la comercialización
Se ha informado la siguiente reacción adversa al medicamento durante el uso posterior a la aprobación de Anafranil. Debido a que esta reacción es informada voluntariamente por una población de tamaño incierto, no siempre es posible estimar la frecuencia de manera confiable.
Trastornos oculares - Glaucoma de ángulo cerrado.
Trastornos del sistema inmunológico - Erupción medicamentosa con eosinofilia y síntomas sistémicos (DRESS).
Trastornos del Metabolismo y la Nutrición - Hiponatremia.
Desordenes endocrinos - Síndrome de secreción inadecuada de hormona antidiurética (SIADH).
INTERACCIONES CON LA DROGAS
Los riesgos de usar Anafranil en combinación con otras drogas no han sido evaluados sistemáticamente. Dados los efectos primarios de Anafranil sobre el SNC, se recomienda precaución al usarlo concomitantemente con otros fármacos activos sobre el SNC (ver PACIENTE INFORMACIÓN ). Anafranil no debe utilizarse con inhibidores de la MAO (ver CONTRAINDICACIONES ).
Se requiere una estrecha supervisión y un ajuste cuidadoso de la dosis cuando Anafranil se administra con fármacos anticolinérgicos o simpaticomiméticos.
Se ha informado que varios antidepresivos tricíclicos bloquean los efectos farmacológicos de la guanetidina, la clonidina o agentes similares, y tal efecto puede anticiparse con CMI debido a su similitud estructural con otros antidepresivos tricíclicos.
Se ha informado que la concentración plasmática de CMI aumenta con la administración concomitante de haloperidol; Se ha informado que los niveles plasmáticos de varios antidepresivos tricíclicos estrechamente relacionados aumentan con la administración concomitante de metilfenidato o inhibidores de enzimas hepáticas (p. ej., cimetidina, fluoxetina) y disminuyen con la administración concomitante de inductores de enzimas hepáticas (p. ej., barbitúricos, fenitoína), y dicho efecto también se puede anticipar con CMI. Se ha informado que la administración de CMI aumenta los niveles plasmáticos de fenobarbital, si se administra de manera concomitante (ver FARMACOLOGÍA CLÍNICA , Interacciones ).
Fármacos metabolizados por P450 2D6
La actividad bioquímica del fármaco que metaboliza la isoenzima citocromo P450 2D6 (debrisoquina hidroxilasa) se reduce en un subconjunto de la población caucásica (alrededor del 7% al 10% de los caucásicos son los llamados "metabolizadores lentos"); Aún no se dispone de estimaciones fiables de la prevalencia de la actividad reducida de la isoenzima P450 2D6 entre las poblaciones asiáticas, africanas y otras. Los metabolizadores lentos tienen concentraciones plasmáticas de antidepresivos tricíclicos (TCA) más altas de lo esperado cuando se les administran las dosis habituales. Dependiendo de la fracción de fármaco metabolizado por P450 2D6, el aumento en la concentración plasmática puede ser pequeño o bastante grande (aumento de 8 veces en el AUC plasmático del TCA). Además, ciertos fármacos inhiben la actividad de esta isoenzima y hacen que los metabolizadores normales parezcan metabolizadores lentos. Un individuo que está estable con una dosis dada de TCA puede volverse tóxico repentinamente cuando se le administra uno de estos fármacos inhibidores como terapia concomitante. Los fármacos que inhiben el citocromo P450 2D6 incluyen algunos que no son metabolizados por la enzima (quinidina, cimetidina) y muchos que son sustratos del P450 2D6 (muchos otros antidepresivos, fenotiazinas y los antiarrítmicos tipo 1C propafenona y flecainida). Si bien todos los inhibidores selectivos de la recaptación de serotonina (ISRS), por ejemplo, fluoxetina, sertralina, paroxetina y fluvoxamina, inhiben P450 2D6, pueden variar en el grado de inhibición. También se ha demostrado que la fluvoxamina inhibe P450 1A2, una isoforma que también participa en el metabolismo del TCA. La medida en que las interacciones ISRS-TCA pueden plantear problemas clínicos dependerá del grado de inhibición y la farmacocinética del ISRS involucrado. No obstante, se recomienda precaución en la coadministración de TCA con cualquiera de los ISRS y también en el cambio de una clase a otra. De particular importancia, debe transcurrir suficiente tiempo antes de iniciar el tratamiento con ATC en un paciente al que se le retira la fluoxetina, dada la larga vida media del metabolito original y activo (pueden ser necesarias al menos 5 semanas). El uso concomitante de agentes de la clase de antidepresivos tricíclicos (que incluye Anafranil) con fármacos que pueden inhibir el citocromo P450 2D6 puede requerir dosis más bajas que las prescritas normalmente para el agente antidepresivo tricíclico o el otro fármaco. Además, cada vez que uno de estos fármacos se retira de la coterapia, puede ser necesario aumentar la dosis del agente antidepresivo tricíclico. Es deseable monitorear los niveles plasmáticos de TCA siempre que un agente de la clase de antidepresivos tricíclicos, incluido Anafranil, se coadministre con otro fármaco conocido por ser un inhibidor de P450 2D6 (y/o P450 1A2).
Debido a que Anafranil se une en gran medida a las proteínas séricas, la administración de Anafranil a pacientes que toman otros medicamentos que se unen en gran medida a las proteínas (p. ej., warfarina, digoxina) puede causar un aumento en las concentraciones plasmáticas de estos medicamentos, lo que podría provocar efectos adversos. Por el contrario, pueden producirse efectos adversos por el desplazamiento de Anafranil unido a proteínas por otros fármacos altamente unidos (ver FARMACOLOGÍA CLÍNICA , Distribución ).
Inhibidores de la monoaminooxidasa (IMAO)
(Ver CONTRAINDICACIONES , ADVERTENCIAS , y DOSIFICACIÓN Y ADMINISTRACIÓN .)
Fármacos serotoninérgicos
(Ver CONTRAINDICACIONES , ADVERTENCIAS , y DOSIFICACIÓN Y ADMINISTRACIÓN .)
Abuso y dependencia de drogas
Anafranil no ha sido estudiado sistemáticamente en animales o humanos por su potencial de abuso, tolerancia o dependencia física. Si bien se han descrito una variedad de síntomas de abstinencia asociados con la suspensión de Anafranil 50 mg (ver PRECAUCIONES , Síntomas de abstinencia ), no hay evidencia de conducta de búsqueda de drogas, excepto por un solo informe de abuso potencial de Anafranil por parte de un paciente con antecedentes de dependencia de codeína, benzodiazepinas y múltiples drogas psicoactivas. El paciente recibió Anafranil para la depresión y los ataques de pánico y pareció volverse dependiente después del alta hospitalaria.
A pesar de la falta de evidencia que sugiera una responsabilidad de abuso de Anafranil en la comercialización en el extranjero, no es posible predecir hasta qué punto Anafranil podría ser mal utilizado o abusado una vez comercializado en los EE. seguir de cerca a estos pacientes.
ADVERTENCIAS
Empeoramiento clínico y riesgo de suicidio
Los pacientes con trastorno depresivo mayor (MDD), tanto adultos como pediátricos, pueden experimentar un empeoramiento de su depresión y/o la aparición de ideación y comportamiento suicida (suicidalidad) o cambios inusuales en el comportamiento, estén o no tomando medicamentos antidepresivos, y esto el riesgo puede persistir hasta que ocurra una remisión significativa. El suicidio es un riesgo conocido de depresión y ciertos otros trastornos psiquiátricos, y estos trastornos en sí mismos son los predictores más fuertes de suicidio. Sin embargo, desde hace mucho tiempo existe la preocupación de que los antidepresivos puedan tener un papel en la inducción del empeoramiento de la depresión y la aparición de tendencias suicidas en ciertos pacientes durante las primeras fases del tratamiento. Los análisis combinados de ensayos controlados con placebo a corto plazo de medicamentos antidepresivos (ISRS y otros) mostraron que estos medicamentos aumentan el riesgo de pensamientos y conductas suicidas (tendencia suicida) en niños, adolescentes y adultos jóvenes (de 18 a 24 años) con depresión mayor. (TDM) y otros trastornos psiquiátricos. Los estudios a corto plazo no mostraron un aumento en el riesgo de tendencias suicidas con antidepresivos en comparación con placebo en adultos mayores de 24 años; hubo una reducción con los antidepresivos en comparación con el placebo en adultos de 65 años o más.
Los análisis agrupados de ensayos controlados con placebo en niños y adolescentes con TDM, trastorno obsesivo compulsivo (TOC) u otros trastornos psiquiátricos incluyeron un total de 24 ensayos a corto plazo de 9 fármacos antidepresivos en más de 4400 pacientes. Los análisis agrupados de ensayos controlados con placebo en adultos con MDD u otros trastornos psiquiátricos incluyeron un total de 295 ensayos a corto plazo (duración media de 2 meses) de 11 fármacos antidepresivos en más de 77 000 pacientes. Hubo una variación considerable en el riesgo de suicidio entre los fármacos, pero una tendencia hacia un aumento en los pacientes más jóvenes para casi todos los fármacos estudiados. Hubo diferencias en el riesgo absoluto de suicidio entre las diferentes indicaciones, con la mayor incidencia en MDD. Sin embargo, las diferencias de riesgo (fármaco frente a placebo) fueron relativamente estables dentro de los estratos de edad y entre las indicaciones. Estas diferencias de riesgo (diferencia de fármaco placebo en el número de casos de tendencias suicidas por cada 1000 pacientes tratados) se proporcionan en la Tabla 1.
No se produjeron suicidios en ninguno de los ensayos pediátricos. Hubo suicidios en los ensayos con adultos, pero el número no fue suficiente para llegar a ninguna conclusión sobre el efecto del fármaco sobre el suicidio.
Se desconoce si el riesgo de suicidio se extiende al uso a largo plazo, es decir, más allá de varios meses. Sin embargo, existe evidencia sustancial de ensayos de mantenimiento controlados con placebo en adultos con depresión de que el uso de antidepresivos puede retrasar la recurrencia de la depresión.
Todos los pacientes que reciben tratamiento con antidepresivos por cualquier indicación deben ser monitoreados adecuadamente y observados de cerca por si empeoran clínicamente, tienen tendencias suicidas y cambios inusuales en el comportamiento, especialmente durante los meses iniciales de un ciclo de terapia con medicamentos, o en momentos de cambios de dosis, ya sea aumentos o disminuye.
Los siguientes síntomas, ansiedad, agitación, ataques de pánico, insomnio, irritabilidad, hostilidad, agresividad, impulsividad, acatisia (inquietud psicomotora), hipomanía y manía, se han informado en pacientes adultos y pediátricos que también reciben tratamiento con antidepresivos para el trastorno depresivo mayor como para otras indicaciones, tanto psiquiátricas como no psiquiátricas. Aunque no se ha establecido un vínculo causal entre la aparición de tales síntomas y el empeoramiento de la depresión y/o la aparición de impulsos suicidas, existe la preocupación de que tales síntomas puedan representar precursores de tendencias suicidas emergentes.
Se debe considerar cambiar el régimen terapéutico, incluida la posibilidad de suspender el medicamento, en pacientes cuya depresión empeora persistentemente, o que están experimentando tendencias suicidas emergentes o síntomas que podrían ser precursores de un empeoramiento de la depresión o tendencias suicidas, especialmente si estos síntomas son severos, abruptos. en el inicio, o no formaban parte de los síntomas de presentación del paciente.
Se debe alertar a las familias y cuidadores de pacientes que reciben tratamiento con antidepresivos por trastorno depresivo mayor u otras indicaciones, tanto psiquiátricas como no psiquiátricas, sobre la necesidad de monitorear a los pacientes para detectar la aparición de agitación, irritabilidad, cambios inusuales en el comportamiento y los demás síntomas descritos anteriormente. , así como el surgimiento de tendencias suicidas, e informar dichos síntomas de inmediato a los proveedores de atención médica. Dicho seguimiento debe incluir la observación diaria por parte de las familias y los cuidadores. Las recetas de clorhidrato de clomipramina se deben escribir para la cantidad más pequeña de cápsulas compatible con un buen manejo del paciente, a fin de reducir el riesgo de sobredosis.
Detección de pacientes para el trastorno bipolar
Un episodio depresivo mayor puede ser la presentación inicial del trastorno bipolar. En general, se cree (aunque no se ha establecido en ensayos controlados) que tratar un episodio de este tipo con un antidepresivo solo puede aumentar la probabilidad de precipitación de un episodio mixto/maníaco en pacientes con riesgo de trastorno bipolar. Se desconoce si alguno de los síntomas descritos anteriormente representa tal conversión. Sin embargo, antes de iniciar el tratamiento con un antidepresivo, los pacientes con síntomas depresivos deben someterse a un cribado adecuado para determinar si tienen riesgo de trastorno bipolar; dicha evaluación debe incluir un historial psiquiátrico detallado, incluidos antecedentes familiares de suicidio, trastorno bipolar y depresión. Cabe señalar que el clorhidrato de clomipramina no está aprobado para su uso en el tratamiento de la depresión bipolar.
Síndrome de serotonina
Se ha informado el desarrollo de un síndrome serotoninérgico potencialmente mortal con IRSN e ISRS, incluido Anafranil 50 mg, solo, pero particularmente con el uso concomitante de otros medicamentos serotoninérgicos (incluidos triptanes, antidepresivos tricíclicos, fentanilo, litio, tramadol, triptófano, buspirona y hierba de San Juan) y con fármacos que alteran el metabolismo de la serotonina (en particular, los IMAO, tanto los destinados a tratar trastornos psiquiátricos como otros, como linezolid y azul de metileno intravenoso).
Los síntomas del síndrome serotoninérgico pueden incluir cambios en el estado mental (p. ej., agitación, alucinaciones, delirio y coma), inestabilidad autonómica (p. ej., taquicardia, presión arterial lábil, mareos, diaforesis, sofocos, hipertermia), cambios neuromusculares (p. ej., temblor, rigidez, mioclonías, hiperreflexia, falta de coordinación), convulsiones y/o síntomas gastrointestinales (p. ej., náuseas, vómitos, diarrea). Los pacientes deben ser monitoreados por la aparición del síndrome serotoninérgico.
Está contraindicado el uso concomitante de Anafranil 10 mg con IMAO destinados a tratar trastornos psiquiátricos. Anafranil 50 mg tampoco debe iniciarse en un paciente que está siendo tratado con IMAO como linezolid o azul de metileno intravenoso. Todos los informes con azul de metileno que proporcionaron información sobre la vía de administración involucraron la administración intravenosa en el rango de dosis de 1 mg/kg a 8 mg/kg. Ningún informe involucró la administración de azul de metileno por otras vías (como tabletas orales o inyección local en tejido) o en dosis más bajas. Puede haber circunstancias en las que sea necesario iniciar el tratamiento con un IMAO como linezolid o azul de metileno intravenoso en un paciente que toma Anafranil. Anafranil debe suspenderse antes de iniciar el tratamiento con el IMAO (ver CONTRAINDICACIONES y DOSIFICACIÓN Y ADMINISTRACIÓN ).
Si el uso concomitante de Anafranil 10 mg con otros fármacos serotoninérgicos, incluidos los triptanos, los antidepresivos tricíclicos, el fentanilo, el litio, el tramadol, la buspirona, el triptófano y la hierba de San Juan está clínicamente justificado, se debe advertir a los pacientes del posible aumento del riesgo de síndrome serotoninérgico, particularmente durante el inicio del tratamiento y los aumentos de dosis.
El tratamiento con Anafranil 10 mg y cualquier agente serotoninérgico concomitante debe suspenderse inmediatamente si se presentan los eventos anteriores y debe iniciarse un tratamiento sintomático de apoyo.
Glaucoma de ángulo cerrado
La dilatación pupilar que ocurre después del uso de muchos medicamentos antidepresivos, incluido Anafranil, puede desencadenar un ataque de ángulo cerrado en un paciente con ángulos anatómicamente estrechos que no tienen una iridectomía permeable.
convulsiones
Durante la evaluación previa a la comercialización, las convulsiones se identificaron como el riesgo más significativo del uso de Anafranil.
La incidencia acumulada observada de convulsiones entre los pacientes expuestos a Anafranil 25 mg en dosis de hasta 300 mg/día fue del 0,64 % a los 90 días, del 1,12 % a los 180 días y del 1,45 % a los 365 días. Las tasas acumuladas corrigen la tasa bruta del 0,7 % (25 de 3519 pacientes) para la duración variable de la exposición en los ensayos clínicos.
Aunque la dosis parece ser un predictor de convulsiones, existe una confusión entre la dosis y la duración de la exposición, lo que dificulta la evaluación independiente del efecto de cualquiera de los factores por sí solo. La capacidad de predecir la aparición de convulsiones en sujetos expuestos a dosis de CMI superiores a 250 mg es limitada, dado que la concentración plasmática de CMI puede depender de la dosis y puede variar entre sujetos que reciben la misma dosis. No obstante, se recomienda a los prescriptores limitar la dosis diaria a un máximo de 250 mg en adultos y 3 mg/kg (o 200 mg) en niños y adolescentes (ver DOSIFICACIÓN Y ADMINISTRACIÓN ).
Se debe tener precaución al administrar Anafranil 50 mg a pacientes con antecedentes de convulsiones u otros factores predisponentes, por ejemplo, daño cerebral de etiología variable, alcoholismo y uso concomitante con otros medicamentos que reducen el umbral convulsivo.
La vigilancia posterior a la comercialización en el extranjero ha informado informes raros de muertes asociadas con convulsiones, pero no en ensayos clínicos en los EE. UU. En algunos de estos casos, Anafranil se había administrado con otros agentes epileptógenos; en otros, los pacientes involucrados posiblemente tenían condiciones médicas predisponentes. Por lo tanto, no se ha establecido una asociación causal entre el tratamiento con Anafranil 25 mg y estas muertes.
Los médicos deben discutir con los pacientes el riesgo de tomar Anafranil mientras realizan actividades en las que la pérdida repentina del conocimiento podría provocar lesiones graves al paciente oa otras personas, por ejemplo, la operación de maquinaria compleja, conducir, nadar, escalar.
VESTIR
Se han informado casos raros de erupción cutánea con eosinofilia y síntomas sistémicos (DRESS) con el uso de clomipramina. En caso de reacciones agudas graves como DRESS, suspenda la terapia con clomipramina inmediatamente e instituya el tratamiento adecuado.
PRECAUCIONES
General
Suicidio
Dado que la depresión es una característica comúnmente asociada con el TOC, se debe considerar el riesgo de suicidio. Las recetas de Anafranil deben hacerse para la cantidad más pequeña de cápsulas compatible con un buen manejo del paciente, para reducir el riesgo de sobredosis.
Efectos cardiovasculares
Se observaron disminuciones ortostáticas moderadas en la presión arterial y taquicardia moderada en aproximadamente el 20 % de los pacientes que tomaron Anafranil 10 mg en ensayos clínicos; pero los pacientes eran frecuentemente asintomáticos. Entre aproximadamente 1400 pacientes tratados con CMI en la experiencia previa a la comercialización que se sometieron a ECG, el 1,5 % desarrolló anomalías durante el tratamiento, en comparación con el 3,1 % de los pacientes que recibieron fármacos de control activo y el 0,7 % de los pacientes que recibieron placebo. Los cambios en el ECG más comunes fueron PVC, cambios en la onda ST-T y anomalías en la conducción intraventricular. Estos cambios rara vez se asociaron con síntomas clínicos significativos. No obstante, es necesario tener precaución en el tratamiento de pacientes con enfermedad cardiovascular conocida y se recomienda una titulación gradual de la dosis.
Psicosis, confusión y otros fenómenos neuropsiquiátricos
Se ha informado que los pacientes tratados con Anafranil 10 mg muestran una variedad de signos y síntomas neuropsiquiátricos que incluyen delirios, alucinaciones, episodios psicóticos, confusión y paranoia. Debido a la naturaleza no controlada de muchos de los estudios, es imposible proporcionar una estimación precisa del grado de riesgo impuesto por el tratamiento con Anafranil. Al igual que con los antidepresivos tricíclicos con los que está estrechamente relacionado, Anafranil 25 mg puede precipitar un episodio psicótico agudo en pacientes con esquizofrenia no diagnosticada.
Manía/hipomanía
Durante las pruebas previas a la comercialización de Anafranil 10 mg en pacientes con trastorno afectivo, se precipitó hipomanía o manía en varios pacientes. También se ha informado activación de manía o hipomanía en una pequeña proporción de pacientes con trastorno afectivo tratados con antidepresivos tricíclicos comercializados, que están estrechamente relacionados con Anafranil.
Cambios hepáticos
Durante las pruebas previas a la comercialización, Anafranil se asoció ocasionalmente con elevaciones en SGOT y SGPT (incidencia combinada de aproximadamente 1 % y 3 %, respectivamente) de importancia clínica potencial (es decir, valores superiores a 3 veces el límite superior normal). En la gran mayoría de los casos, estos aumentos de enzimas no se asociaron con otros hallazgos clínicos sugestivos de daño hepático; además, ninguno tenía ictericia. Se han registrado informes raros de lesiones hepáticas más graves, algunas fatales, en la experiencia posterior a la comercialización en el extranjero. Se recomienda precaución en el tratamiento de pacientes con enfermedad hepática conocida, y se recomienda el control periódico de los niveles de enzimas hepáticas en dichos pacientes.
Cambios hematológicos
Aunque no se observaron casos de toxicidad hematológica grave en la experiencia previa a la comercialización con Anafranil 25 mg, ha habido informes posteriores a la comercialización de leucopenia, agranulocitosis, trombocitopenia, anemia y pancitopenia en asociación con el uso de Anafranil 50 mg. Como es el caso de los antidepresivos tricíclicos con los que Anafranil 25 mg está estrechamente relacionado, se deben obtener recuentos sanguíneos y de leucocitos en pacientes que desarrollan fiebre y dolor de garganta durante el tratamiento con Anafranil.
Sistema nervioso central
Se han registrado más de 30 casos de hipertermia mediante sistemas de vigilancia posteriores a la comercialización no domésticos. La mayoría de los casos ocurrieron cuando Anafranil se usó en combinación con otras drogas. Cuando Anafranil 25 mg y un neuroléptico se usaron concomitantemente, los casos a veces se consideraron ejemplos de un síndrome neuroléptico maligno.
Disfunción sexual
La tasa de disfunción sexual en pacientes masculinos con TOC que fueron tratados con Anafranil en la experiencia previa a la comercialización aumentó notablemente en comparación con los controles de placebo (es decir, el 42 % experimentó insuficiencia eyaculatoria y el 20 % experimentó impotencia, en comparación con el 2,0 % y el 2,6 %, respectivamente). en el grupo placebo). Aproximadamente el 85% de los hombres con disfunción sexual optaron por continuar con el tratamiento.
hiponatremia
Se ha producido hiponatremia como resultado del tratamiento con clomipramina. En muchos casos, la hiponatremia parece ser el resultado del síndrome de secreción inadecuada de hormona antidiurética (SIADH). Los pacientes de edad avanzada pueden tener un mayor riesgo de desarrollar hiponatremia con un antidepresivo serotoninérgico. Además, los pacientes que toman diuréticos o que tienen depleción de volumen pueden tener un mayor riesgo. Se debe instituir la suspensión de Anafranil en pacientes con hiponatremia sintomática y la intervención médica adecuada. Los signos y síntomas de la hiponatremia incluyen dolor de cabeza, dificultad para concentrarse, deterioro de la memoria, confusión, debilidad e inestabilidad, que pueden provocar caídas. Los casos más graves y/o agudos han incluido alucinaciones, síncope, convulsiones, coma, paro respiratorio y muerte.
Cambios de peso
En estudios controlados de TOC, se informó aumento de peso en el 18 % de los pacientes que recibieron Anafranil, en comparación con el 1 % de los pacientes que recibieron placebo. En estos estudios, el 28 % de los pacientes que recibieron Anafranil 25 mg tuvieron un aumento de peso de al menos el 7 % de su peso corporal inicial, en comparación con el 4 % de los pacientes que recibieron placebo. Varios pacientes tuvieron aumentos de peso superiores al 25% de su peso corporal inicial. Por el contrario, el 5 % de los pacientes que recibieron Anafranil y el 1 % que recibieron placebo tuvieron pérdidas de peso de al menos el 7 % de su peso corporal inicial.
Terapia electroconvulsiva
Al igual que con los antidepresivos tricíclicos estrechamente relacionados, la administración concomitante de Anafranil con terapia electroconvulsiva puede aumentar los riesgos; dicho tratamiento debe limitarse a aquellos pacientes para los que es imprescindible, ya que la experiencia clínica es limitada.
Cirugía
Antes de una cirugía electiva con anestésicos generales, se debe suspender la terapia con Anafranil 50 mg durante el tiempo que sea clínicamente factible y se debe informar al anestesista.
Uso en enfermedades concomitantes
Pacientes con insuficiencia renal significativa.
Síntomas de abstinencia
Se han informado una variedad de síntomas de abstinencia asociados con la interrupción abrupta de Anafranil 50 mg, que incluyen mareos, náuseas, vómitos, dolor de cabeza, malestar general, trastornos del sueño, hipertermia e irritabilidad. Además, estos pacientes pueden experimentar un empeoramiento del estado psiquiátrico. Si bien los efectos de abstinencia de Anafranil 10 mg no se han evaluado sistemáticamente en ensayos controlados, son bien conocidos con antidepresivos tricíclicos estrechamente relacionados, y se recomienda que la dosis se reduzca gradualmente y el paciente se vigile cuidadosamente durante la interrupción (ver Abuso y dependencia de drogas ).
Información para pacientes
Los prescriptores u otros profesionales de la salud deben informar a los pacientes, sus familias y sus cuidadores sobre los beneficios y riesgos asociados con el tratamiento con clorhidrato de clomipramina y deben asesorarlos sobre su uso apropiado. Se encuentra disponible una Guía de medicamentos para pacientes sobre “Medicamentos antidepresivos, depresión y otras enfermedades mentales graves y pensamientos o acciones suicidas” para el clorhidrato de clomipramina. El prescriptor o el profesional de la salud debe instruir a los pacientes, sus familias y sus cuidadores para que lean la Guía del medicamento y debe ayudarlos a comprender su contenido. Los pacientes deben tener la oportunidad de discutir el contenido de la Guía del medicamento y obtener respuestas a cualquier pregunta que puedan tener. El texto completo de la Guía del medicamento se reproduce al final de este documento.
Se debe informar a los pacientes sobre los siguientes problemas y pedirles que alerten a su prescriptor si ocurren mientras toman clorhidrato de clomipramina.
Empeoramiento clínico y riesgo de suicidio
Se debe alentar a los pacientes, sus familias y sus cuidadores a estar alerta ante la aparición de ansiedad, agitación, ataques de pánico, insomnio, irritabilidad, hostilidad, agresividad, impulsividad, acatisia (inquietud psicomotora), hipomanía, manía, otros cambios inusuales en el comportamiento. , empeoramiento de la depresión e ideación suicida, especialmente al principio del tratamiento con antidepresivos y cuando la dosis se ajusta hacia arriba o hacia abajo. Se debe recomendar a las familias y cuidadores de los pacientes que estén atentos a la aparición de dichos síntomas en el día a día, ya que los cambios pueden ser abruptos. Dichos síntomas deben informarse al médico o al profesional de la salud del paciente, especialmente si son graves, de inicio repentino o no formaban parte de los síntomas que presentaba el paciente. Síntomas como estos pueden estar asociados con un mayor riesgo de pensamientos y conductas suicidas e indican la necesidad de un control muy estricto y posiblemente cambios en la medicación.
Se aconseja a los médicos que hablen de los siguientes temas con los pacientes a los que prescriben Anafranil:
- El riesgo de convulsiones (ver ADVERTENCIAS );
- La incidencia relativamente alta de disfunción sexual entre los hombres (ver Disfunción sexual );
- Dado que Anafranil 50 mg puede afectar las capacidades mentales y/o físicas necesarias para la realización de tareas complejas, y dado que Anafranil 25 mg está asociado con un riesgo de convulsiones, se debe advertir a los pacientes acerca de la realización de tareas complejas y peligrosas (ver ADVERTENCIAS );
- Se debe advertir a los pacientes sobre el uso concomitante de alcohol, barbitúricos u otros depresores del SNC, ya que Anafranil 50 mg puede exagerar su respuesta a estos fármacos;
- Los pacientes deben informar a su médico si quedan embarazadas o tienen la intención de quedar embarazadas durante la terapia;
- Los pacientes deben informar a su médico si están amamantando.
Se debe advertir a los pacientes que tomar Anafranil puede causar una dilatación pupilar leve, que en individuos susceptibles puede conducir a un episodio de glaucoma de ángulo cerrado. El glaucoma preexistente casi siempre es glaucoma de ángulo abierto porque el glaucoma de ángulo cerrado, cuando se diagnostica, se puede tratar definitivamente con iridectomía. El glaucoma de ángulo abierto no es un factor de riesgo para el glaucoma de ángulo cerrado. Los pacientes pueden desear ser examinados para determinar si son susceptibles al cierre del ángulo y someterse a un procedimiento profiláctico (p. ej., iridectomía), si son susceptibles.
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
No se encontró evidencia de carcinogenicidad en dos bioensayos de 2 años en ratas a dosis de hasta 100 mg/kg, que es 24 y 4 veces la dosis diaria máxima recomendada en humanos (MRHD) en mg/kg y mg/m², respectivamente. , o en un bioensayo de 2 años en ratones a dosis de hasta 80 mg/kg, que es 20 y 1,5 veces la MRHD en mg/kg y mg/m², respectivamente.
En estudios de reproducción, no se encontraron efectos sobre la fertilidad en ratas que recibieron hasta 24 mg/kg, que es 6 veces y aproximadamente igual a la MRHD en mg/kg y mg/m², respectivamente.
Embarazo Categoría C
No se observaron efectos teratogénicos en estudios realizados en ratas y ratones a dosis de hasta 100 mg/kg, que es 24 veces la dosis diaria máxima recomendada en humanos (MRHD) en mg/kg y 4 veces (ratas) y 2 veces ( ratones) la MRHD sobre una base de mg/m². Se observaron ligeros efectos embriotóxicos/fetotóxicos no específicos en las crías de ratas tratadas que recibieron 50 y 100 mg/kg y de ratones tratados que recibieron 100 mg/kg.
No existen estudios adecuados o bien controlados en mujeres embarazadas. Se han informado síntomas de abstinencia, que incluyen nerviosismo, temblores y convulsiones, en recién nacidos cuyas madres habían tomado Anafranil 50 mg hasta el parto. Anafranil 10 mg debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto.
Madres lactantes
Anafranil se ha encontrado en la leche humana. Debido al potencial de reacciones adversas, se debe tomar la decisión de suspender la lactancia o suspender el fármaco, teniendo en cuenta la importancia del fármaco para la madre.
Uso pediátrico
No se ha establecido la seguridad y eficacia en la población pediátrica distinta de los pacientes pediátricos con TOC (ver CUADRO DE ADVERTENCIA y ADVERTENCIAS , Empeoramiento clínico y riesgo de suicidio ). Cualquiera que esté considerando el uso de Anafranil en un niño o adolescente debe sopesar los riesgos potenciales con la necesidad clínica.
En un ensayo clínico controlado en niños y adolescentes (10 a 17 años de edad), 46 pacientes ambulatorios recibieron Anafranil 50 mg durante un máximo de 8 semanas. Además, 150 pacientes adolescentes recibieron Anafranil 10 mg en protocolos abiertos durante períodos de varios meses a varios años. De los 196 adolescentes estudiados, 50 tenían 13 años o menos y 146 tenían entre 14 y 17 años. El perfil de reacciones adversas en este grupo de edad (ver REACCIONES ADVERSAS ) es similar a la observada en adultos.
No se han evaluado sistemáticamente los riesgos, si los hubiera, que pueden estar asociados con el uso prolongado de Anafranil en niños y adolescentes con TOC. La evidencia que respalda la conclusión de que Anafranil 50 mg es seguro para su uso en niños y adolescentes se deriva de estudios clínicos a corto plazo y de la extrapolación de la experiencia adquirida con pacientes adultos. En particular, no hay estudios que evalúen directamente los efectos del uso a largo plazo de Anafranil 25 mg en el crecimiento, desarrollo y maduración de niños y adolescentes. Aunque no hay evidencia que sugiera que Anafranil 10 mg afecte negativamente el crecimiento, el desarrollo o la maduración, la ausencia de tales hallazgos no es adecuada para descartar la posibilidad de tales efectos en el uso crónico.
No se ha establecido la seguridad y eficacia en pacientes pediátricos menores de 10 años. Por lo tanto, no se pueden hacer recomendaciones específicas para el uso de Anafranil en pacientes pediátricos menores de 10 años.
Uso geriátrico
Los estudios clínicos de Anafranil 50 mg no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes; 152 pacientes de al menos 60 años de edad que participaron en varios ensayos clínicos en los EE. UU. recibieron Anafranil durante períodos de varios meses a varios años. No se identificaron eventos adversos inusuales relacionados con la edad en esta población. Otra experiencia clínica informada no ha identificado diferencias en las respuestas entre los ancianos y los pacientes más jóvenes. En general, la selección de la dosis para un paciente de edad avanzada debe ser cautelosa, generalmente comenzando en el extremo inferior del rango de dosificación, lo que refleja la mayor frecuencia de disminución de la función hepática, renal o cardíaca y de enfermedad concomitante u otra terapia con medicamentos.
Anafranil se ha asociado con casos de hiponatremia clínicamente significativa. Los pacientes de edad avanzada pueden tener un mayor riesgo de sufrir esta reacción adversa (ver PRECAUCIONES , hiponatremia ).
SOBREDOSIS
Pueden ocurrir muertes por sobredosis con esta clase de medicamentos. La ingestión de múltiples drogas (incluido el alcohol) es común en la sobredosis deliberada de tricíclicos. Como el manejo es complejo y cambiante, se recomienda que el médico se comunique con un centro de control de intoxicaciones para obtener información actualizada sobre el tratamiento. Los signos y síntomas de toxicidad se desarrollan rápidamente después de una sobredosis de tricíclicos. Por lo tanto, se requiere seguimiento hospitalario lo antes posible.
Experiencia humana
En los ensayos clínicos de EE. UU., ocurrieron 2 muertes en 12 casos informados de sobredosis aguda con Anafranil, ya sea solo o en combinación con otras drogas. Una muerte involucró a un paciente sospechoso de ingerir una dosis de 7000 mg. La segunda muerte involucró a un paciente sospechoso de ingerir una dosis de 5750 mg. Los 10 casos no fatales involucraron dosis de hasta 5000 mg, acompañadas de niveles plasmáticos de hasta 1010 ng/mL. Los 10 pacientes se recuperaron por completo. Entre los informes de sobredosis de Anafranil de otros países, la dosis más baja asociada con una muerte fue de 750 mg. Según los informes posteriores a la comercialización en el Reino Unido, se considera que la letalidad de CMI en caso de sobredosis es similar a la notificada para compuestos tricíclicos estrechamente relacionados comercializados como antidepresivos.
Manifestaciones
Los signos y síntomas varían en gravedad según factores como la cantidad de fármaco absorbido, la edad del paciente y el tiempo transcurrido desde la ingestión del fármaco. Las manifestaciones críticas de la sobredosis incluyen arritmias cardíacas, hipotensión grave, convulsiones y depresión del SNC, incluido el coma. Los cambios en el electrocardiograma, particularmente en el eje QRS o el ancho, son indicadores clínicamente significativos de toxicidad tricíclica. Otras manifestaciones del SNC pueden incluir somnolencia, estupor, ataxia, inquietud, agitación, delirio, transpiración intensa, reflejos hiperactivos, rigidez muscular y movimientos atetoideos y coreiformes. Las anomalías cardíacas pueden incluir taquicardia, signos de insuficiencia cardíaca congestiva y, en casos muy raros, paro cardíaco. También pueden presentarse depresión respiratoria, cianosis, shock, vómitos, hiperpirexia, midriasis y oliguria o anuria.
administración
Obtenga un ECG e inicie inmediatamente la monitorización cardíaca. Proteja las vías respiratorias del paciente, establezca una vía intravenosa e inicie la descontaminación gástrica. Es necesario un mínimo de 6 horas de observación con monitorización cardíaca y observación de signos de depresión respiratoria o del SNC, hipotensión, arritmias cardíacas y/o bloqueos de conducción y convulsiones.
Si se presentan signos de toxicidad en cualquier momento durante este período, se requiere un seguimiento prolongado. Hay informes de casos de pacientes que sucumbieron a arritmias fatales después de una sobredosis; estos pacientes tenían evidencia clínica de envenenamiento significativo antes de la muerte y la mayoría recibió una descontaminación gastrointestinal inadecuada. La monitorización de los niveles plasmáticos del fármaco no debe guiar el tratamiento del paciente.
Descontaminación Gastrointestinal
Todos los pacientes con sospecha de sobredosis de tricíclicos deben recibir descontaminación gastrointestinal. Esto debe incluir un lavado gástrico de gran volumen seguido de carbón activado. Si la conciencia está alterada, se debe asegurar la vía aérea antes del lavado. La emesis está contraindicada.
Cardiovascular
Una duración máxima de QRS de derivación de extremidades de ≥ 0,10 segundos puede ser la mejor indicación de la gravedad de la sobredosis. Se debe usar bicarbonato de sodio intravenoso para mantener el pH sérico en el rango de 7,45 a 7,55. Si la respuesta del pH es inadecuada, también se puede utilizar la hiperventilación. El uso concomitante de hiperventilación y bicarbonato de sodio debe hacerse con extrema precaución, con monitoreo frecuente del pH. No es deseable un pH >7,60 o una pCO2
En casos raros, la hemoperfusión puede ser beneficiosa en la inestabilidad cardiovascular refractaria aguda en pacientes con toxicidad aguda. Sin embargo, la hemodiálisis, la diálisis peritoneal, las exanguinotransfusiones y la diuresis forzada por lo general han sido reportadas como ineficaces en el envenenamiento por tricíclicos.
SNC
En pacientes con depresión del SNC, se recomienda la intubación temprana debido al potencial de deterioro abrupto. Las convulsiones deben controlarse con benzodiazepinas o, si no son eficaces, con otros anticonvulsivos (p. ej., fenobarbital, fenitoína). No se recomienda la fisostigmina excepto para tratar síntomas potencialmente mortales que no han respondido a otras terapias, y solo en consulta con un centro de control de envenenamiento.
Seguimiento Psiquiátrico
Dado que la sobredosis suele ser deliberada, los pacientes pueden intentar suicidarse por otros medios durante la fase de recuperación. La derivación psiquiátrica puede ser apropiada.
Manejo pediátrico
Los principios de manejo de las sobredosis de niños y adultos son similares. Se recomienda enfáticamente que el médico se comunique con el centro local de control de envenenamiento para un tratamiento pediátrico específico.
CONTRAINDICACIONES
Anafranil está contraindicado en pacientes con antecedentes de hipersensibilidad a Anafranil 25 mg u otros antidepresivos tricíclicos.
Inhibidores de la monoaminooxidasa (IMAO)
El uso de IMAO destinados a tratar trastornos psiquiátricos con Anafranil o dentro de los 14 días posteriores a la interrupción del tratamiento con Anafranil está contraindicado debido a un mayor riesgo de síndrome serotoninérgico. También está contraindicado el uso de Anafranil 10 mg dentro de los 14 días posteriores a la interrupción de un IMAO destinado a tratar trastornos psiquiátricos (ver ADVERTENCIAS y DOSIFICACIÓN Y ADMINISTRACIÓN ).
También está contraindicado iniciar Anafranil en un paciente que está siendo tratado con linezolid o azul de metileno intravenoso debido a un mayor riesgo de síndrome serotoninérgico (ver ADVERTENCIAS y DOSIFICACIÓN Y ADMINISTRACIÓN ).
Infarto de miocardio
Anafranil está contraindicado durante el período de recuperación aguda después de un infarto de miocardio.
FARMACOLOGÍA CLÍNICA
Farmacodinámica
Se presume que la clomipramina (CMI) influye en los comportamientos obsesivos y compulsivos a través de sus efectos sobre la transmisión neuronal serotoninérgica. Se desconoce el mecanismo neuroquímico real, pero se cree que la capacidad de CMI para inhibir la recaptación de serotonina (5-HT) es importante.
Farmacocinética
Absorción/Biodisponibilidad
El CMI de las cápsulas de 25 mg de Anafranil es tan biodisponible como el CMI de una solución. La biodisponibilidad de CMI de las cápsulas no se ve significativamente afectada por los alimentos.
En un estudio de proporcionalidad de dosis que involucró múltiples dosis de CMI, las concentraciones plasmáticas en estado estacionario (Css) y las curvas de área bajo concentración plasmática-tiempo (AUC) de CMI y el principal metabolito activo de CMI, la desmetilclomipramina (DMI), no fueron proporcionales a la dosis. sobre los rangos evaluados, es decir, entre 25 a 100 mg/día y entre 25 a 150 mg/día, aunque la Css y el AUC están relacionadas de forma aproximadamente lineal con la dosis entre 100 a 150 mg/día. La relación entre la dosis y las concentraciones de CMI/DMI a dosis diarias más altas no se ha evaluado sistemáticamente, pero si existe una dependencia significativa de la dosis en dosis superiores a 150 mg/día, existe la posibilidad de que la Css y el AUC sean mucho más altos, incluso para los pacientes que reciben la dosis dentro de los límites establecidos. rango recomendado. Esto puede suponer un riesgo potencial para algunos pacientes (ver ADVERTENCIAS y INTERACCIONES CON LA DROGAS ).
Después de una dosis oral única de 50 mg, las concentraciones plasmáticas máximas de CMI ocurren dentro de las 2 a 6 horas (media, 4,7 horas) y oscilan entre 56 ng/ml y 154 ng/ml (media, 92 ng/ml). Después de múltiples dosis diarias de 150 mg de Anafranil 25 mg, las concentraciones plasmáticas máximas en estado estacionario oscilan entre 94 ng/mL y 339 ng/mL (media, 218 ng/mL) para CMI y entre 134 ng/mL y 532 ng/mL ( media, 274 ng/mL) para DMI. La información adicional de un estudio de dosis creciente de dosis de hasta 250 mg sugiere que la DMI puede exhibir una farmacocinética no lineal en el rango de dosificación habitual. Con una dosis de Anafranil de 200 mg, los sujetos a los que se les tomó una sola muestra de sangre aproximadamente de 9 a 22 horas (mediana de 16 horas) después de la dosis tenían concentraciones plasmáticas de hasta 605 ng/mL para CMI, 781 ng/mL para DMI , y 1386 ng/mL para ambos.
Distribución
CMI se distribuye en el líquido cefalorraquídeo (LCR) y el cerebro y en la leche materna. El DMI también se distribuye en el LCR, con una relación LCR/plasma media de 2,6. La unión a proteínas de CMI es de aproximadamente el 97%, principalmente a la albúmina, y es independiente de la concentración de CMI. La interacción entre CMI y otros fármacos altamente ligados a proteínas no ha sido completamente evaluada, pero puede ser importante (ver INTERACCIONES CON LA DROGAS ).
Metabolismo
El CMI se biotransforma ampliamente en DMI y otros metabolitos y sus conjugados de glucurónido. El DMI es farmacológicamente activo, pero se desconocen sus efectos sobre los comportamientos del TOC. Estos metabolitos se excretan en la orina y las heces, luego de la eliminación biliar. Después de una dosis radiomarcada de 25 mg de CMI en dos sujetos, el 60 % y el 51 %, respectivamente, de la dosis se recuperó en la orina y el 32 % y el 24 %, respectivamente, en las heces. En el mismo estudio, las recuperaciones urinarias combinadas de CMI y DMI fueron solo alrededor del 0,8% al 1,3% de la dosis administrada. CMI no induce enzimas metabolizadoras de fármacos, según lo medido por la vida media de la antipirina.
Eliminación
La evidencia de que la Css y el AUC para CMI y DMI pueden aumentar de manera desproporcionada con el aumento de las dosis orales sugiere que el metabolismo de CMI y DMI puede tener una capacidad limitada. Este hecho debe tenerse en cuenta al evaluar las estimaciones de los parámetros farmacocinéticos que se presentan a continuación, ya que se obtuvieron en individuos expuestos a dosis de 150 mg. Si la farmacocinética de CMI y DMI no es lineal en dosis superiores a 150 mg, sus vidas medias de eliminación pueden prolongarse considerablemente en dosis cercanas al extremo superior del rango de dosificación recomendado (es decir, 200 mg/día a 250 mg/día). En consecuencia, CMI y DMI pueden acumularse, y esta acumulación puede aumentar la incidencia de cualquier reacción adversa dependiente de la dosis o de la concentración plasmática, en particular convulsiones (ver ADVERTENCIAS ).
Después de una dosis de 150 mg, la vida media de CMI varía de 19 horas a 37 horas (media, 32 horas) y la de DMI varía de 54 horas a 77 horas (media, 69 horas). Los niveles de estado estacionario después de dosis múltiples generalmente se alcanzan dentro de los 7 a 14 días para CMI. Las concentraciones plasmáticas del metabolito exceden las del fármaco original en dosis múltiples. Después de dosis múltiples de 150 mg/día, el factor de acumulación para CMI es de aproximadamente 2,5 y para DMI es de 4,6. Es importante destacar que puede llevar dos semanas o más lograr este grado de acumulación con una dosis constante debido a las vidas medias de eliminación relativamente largas de CMI y DMI (ver DOSIFICACIÓN Y ADMINISTRACIÓN ). No se han determinado los efectos de la insuficiencia hepática y renal sobre la disposición de Anafranil.
Interacciones
La coadministración de haloperidol con CMI aumenta las concentraciones plasmáticas de CMI. La coadministración de CMI con fenobarbital aumenta las concentraciones plasmáticas de fenobarbital (ver INTERACCIONES CON LA DROGAS ). Los sujetos más jóvenes (de 18 a 40 años) toleraron mejor la CMI y tuvieron concentraciones plasmáticas en estado estacionario significativamente más bajas, en comparación con los sujetos mayores de 65 años. Los niños menores de 15 años tenían proporciones de dosis/concentración plasmática significativamente más bajas, en comparación con los adultos. Las concentraciones plasmáticas de CMI fueron significativamente más bajas en los fumadores que en los no fumadores.
INFORMACIÓN DEL PACIENTE
Anafranil™ (clorhidrato de clomipramina) Cápsulas USP
Medicamentos antidepresivos, depresión y otras enfermedades mentales graves, y pensamientos o acciones suicidas
Lea la Guía del medicamento que viene con su medicamento antidepresivo o el de su familiar. Esta Guía del medicamento solo trata sobre el riesgo de pensamientos y acciones suicidas con medicamentos antidepresivos. Hable con su proveedor de atención médica o el de su familiar sobre:
- todos los riesgos y beneficios del tratamiento con medicamentos antidepresivos
- todas las opciones de tratamiento para la depresión u otra enfermedad mental grave
¿Cuál es la información más importante que debo saber sobre los medicamentos antidepresivos, la depresión y otras enfermedades mentales graves y los pensamientos o acciones suicidas?
1. Los medicamentos antidepresivos pueden aumentar los pensamientos o acciones suicidas en algunos niños, adolescentes y adultos jóvenes durante los primeros meses de tratamiento.
2. La depresión y otras enfermedades mentales graves son las causas más importantes de pensamientos y acciones suicidas. Algunas personas pueden tener un riesgo particularmente alto de tener pensamientos o acciones suicidas. Estos incluyen personas que tienen (o tienen antecedentes familiares de) enfermedad bipolar (también llamada enfermedad maníaco-depresiva) o pensamientos o acciones suicidas.
3. ¿Cómo puedo vigilar y tratar de prevenir pensamientos y acciones suicidas en mí mismo o en un miembro de la familia?
- Preste mucha atención a cualquier cambio, especialmente a los repentinos, en el estado de ánimo, el comportamiento, los pensamientos o los sentimientos. Esto es muy importante cuando se inicia un medicamento antidepresivo o cuando se cambia la dosis.
- Llame al proveedor de atención médica de inmediato para informar cambios nuevos o repentinos en el estado de ánimo, el comportamiento, los pensamientos o los sentimientos.
- Mantenga todas las visitas de seguimiento con el proveedor de atención médica según lo programado. Llame al proveedor de atención médica entre visitas según sea necesario, especialmente si le preocupan los síntomas.
Llame a un proveedor de atención médica de inmediato si usted o un miembro de su familia tienen alguno de los siguientes síntomas, especialmente si son nuevos, empeoran o le preocupan:
- pensamientos sobre el suicidio o la muerte
- intentos de suicidio
- depresión nueva o peor
- ansiedad nueva o peor
- sentirse muy agitado o inquieto
- ataques de pánico
- dificultad para dormir (insomnio)
- irritabilidad nueva o peor
- Actuar agresivo, estar enojado o violento.
- actuando sobre impulsos peligrosos
- un aumento extremo en la actividad y el habla (manía)
- otros cambios inusuales en el comportamiento o el estado de ánimo
Niveles bajos de sal (sodio) en la sangre. Las personas mayores pueden estar en mayor riesgo de esto. Los síntomas pueden incluir:
- dolor de cabeza
- debilidad o sensación de inestabilidad
- confusión, problemas para concentrarse o pensar o problemas de memoria
Problemas visuales
- dolor de ojo
- cambios en la visión
- hinchazón o enrojecimiento en o alrededor del ojo
Solo algunas personas corren el riesgo de tener estos problemas. Es posible que desee someterse a un examen de la vista para ver si está en riesgo y recibir tratamiento preventivo si lo está.
¿Quién no debe tomar Anafranil?
No tome Anafranil si usted:
- tomar un inhibidor de la monoaminooxidasa (IMAO). Pregúntele a su proveedor de atención médica o farmacéutico si no está seguro si está tomando un IMAO, incluido el antibiótico linezolid.
- No tome un IMAO dentro de las 2 semanas posteriores a la suspensión de Anafranil 25 mg a menos que su médico se lo indique.
- No comience con Anafranil si dejó de tomar un IMAO en las últimas 2 semanas, a menos que su médico se lo indique.
¿Qué más necesito saber sobre los medicamentos antidepresivos?
- Nunca deje de tomar un medicamento antidepresivo sin hablar primero con un proveedor de atención médica. Detener un medicamento antidepresivo repentinamente puede causar otros síntomas.
- Los antidepresivos son medicamentos que se usan para tratar la depresión y otras enfermedades. Es importante discutir todos los riesgos de tratar la depresión y también los riesgos de no tratarla. Los pacientes y sus familias u otros cuidadores deben analizar todas las opciones de tratamiento con el proveedor de atención médica, no solo el uso de antidepresivos.
- Las medicinas antidepresivas tienen otros efectos secundarios. Hable con el proveedor de atención médica sobre los efectos secundarios del medicamento recetado para usted o su familiar.
- Los medicamentos antidepresivos pueden interactuar con otros medicamentos. Conozca todos los medicamentos que toma usted o su familiar. Mantenga una lista de todos los medicamentos para mostrársela al proveedor de atención médica. No empiece a tomar nuevos medicamentos sin antes consultar con su proveedor de atención médica.
- No todos los medicamentos antidepresivos recetados para niños están aprobados por la FDA para su uso en niños. Hable con el proveedor de atención médica de su hijo para obtener más información.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
Esta Guía del medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de EE. UU.
