Buspar 5mg, 10mg Buspirone Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Buspar y cómo se utiliza?
Buspar 5mg es un medicamento recetado que se usa para tratar los síntomas de los trastornos de ansiedad. Buspar 5 mg se puede usar solo o con otros medicamentos.
Buspar pertenece a una clase de medicamentos llamados agentes ansiolíticos, ansiolíticos, no benzodiazepínicos.
¿Cuáles son los posibles efectos secundarios de Buspar?
¿Cuáles son los posibles efectos secundarios de Buspar 5mg?
Buspar puede causar efectos secundarios graves que incluyen:
- Dolor de pecho,
- dificultad para respirar, y
- aturdimiento
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Buspar incluyen:
- dolor de cabeza,
- mareo,
- somnolencia,
- problema del sueño (insomnio),
- náuseas,
- malestar estomacal y
- sentirse nervioso o emocionado
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Buspar. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
Las tabletas de clorhidrato de buspirona, USP, son un agente ansiolítico que no está química ni farmacológicamente relacionado con las benzodiazepinas, los barbitúricos u otros medicamentos sedantes/ansiolíticos.
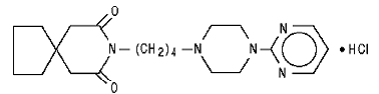
El clorhidrato de buspirona, USP es un polvo cristalino blanco. Es muy soluble en agua; libremente soluble en metanol y en cloruro de metileno; escasamente soluble en etanol y en acetonitrilo; muy poco soluble en acetato de etilo y prácticamente insoluble en hexanos. Su peso molecular es 422. Químicamente, el clorhidrato de buspirona es monoclorhidrato de 8-[4-[4-(2-pirimidinil)-1-piperazinil]butil]-8-azaspiro[4,5]decano-7,9-diona. La fórmula molecular C21H31N5O2•HCl está representada por la siguiente fórmula estructural:
Cada comprimido de clorhidrato de buspirona para administración oral contiene 5 mg o 10 mg o 15 mg o 30 mg de clorhidrato de buspirona (equivalentes a 4,6 mg, 9,1 mg, 13,7 mg y 27,4 mg de base libre de buspirona, respectivamente). Además, cada tableta contiene los siguientes ingredientes inactivos: dióxido de silicio coloidal, lactosa monohidrato, estearato de magnesio, celulosa microcristalina y glicolato de almidón de sodio. Los comprimidos de 5 mg y 10 mg están ranurados para que puedan dividirse en dos. Por lo tanto, la tableta de 5 mg también puede proporcionar una dosis de 2,5 mg y la tableta de 10 mg puede proporcionar una dosis de 5 mg. Los comprimidos de 15 mg y 30 mg están ranurados para que puedan dividirse en dos o en tres. Así, un solo comprimido de 15 mg puede proporcionar las siguientes dosis: 15 mg (comprimido entero), 10 mg (dos tercios de comprimido), 7,5 mg (medio comprimido) o 5 mg (un tercio de comprimido) . Una sola tableta de 30 mg puede proporcionar las siguientes dosis: 30 mg (tableta entera), 20 mg (dos tercios de una tableta), 15 mg (la mitad de una tableta) o 10 mg (un tercio de una tableta).
INDICACIONES
Los comprimidos de clorhidrato de buspirona están indicados para el tratamiento de los trastornos de ansiedad o el alivio a corto plazo de los síntomas de ansiedad. La ansiedad o tensión asociada al estrés de la vida cotidiana no suele requerir tratamiento con ansiolíticos.
La eficacia de las tabletas de clorhidrato de buspirona se ha demostrado en ensayos clínicos controlados de pacientes ambulatorios cuyo diagnóstico corresponde aproximadamente al trastorno de ansiedad generalizada (TAG). Muchos de los pacientes incluidos en estos estudios también tenían síntomas depresivos coexistentes y las tabletas de clorhidrato de buspirona aliviaron la ansiedad en presencia de estos síntomas depresivos coexistentes. Los pacientes evaluados en estos estudios habían experimentado síntomas durante períodos de 1 mes a más de 1 año antes del estudio, con una duración promedio de los síntomas de 6 meses. El trastorno de ansiedad generalizada (300.02) se describe en el Manual diagnóstico y estadístico de la Asociación Estadounidense de Psiquiatría, III1, de la siguiente manera:
Ansiedad persistente generalizada (de al menos 1 mes de duración continua), manifestada por síntomas de tres de las cuatro categorías siguientes:
tensión motora
Temblores, nerviosismo, nerviosismo, temblores, tensión, dolores musculares, fatigabilidad, incapacidad para relajarse, contracciones en los párpados, ceño fruncido, cara tensa, inquietud, inquietud, sobresalto fácil.
Hiperactividad autonómica
Sudoración, latidos fuertes o acelerados del corazón, manos frías y sudorosas, boca seca, mareos, aturdimiento, parestesias (hormigueo en las manos o los pies), malestar estomacal, períodos de frío o calor, micción frecuente, diarrea, malestar en la boca del estómago, bulto en la garganta, enrojecimiento, palidez, pulso elevado en reposo y frecuencia respiratoria.
Expectativa aprensiva
Ansiedad, preocupación, miedo, rumiación y anticipación de la desgracia para uno mismo o para los demás.
Vigilancia y escaneo
Hiperatención que resulta en distracción, dificultad para concentrarse, insomnio, sentirse "al límite", irritabilidad, impaciencia.
Los síntomas anteriores no se deberían a otro trastorno mental, como un trastorno depresivo o una esquizofrenia. Sin embargo, los síntomas depresivos leves son comunes en el TAG.
La eficacia de las tabletas de clorhidrato de buspirona en el uso a largo plazo, es decir, durante más de 3 a 4 semanas, no se ha demostrado en ensayos controlados. No existe un cuerpo de evidencia disponible que aborde sistemáticamente la duración apropiada del tratamiento para el TAG. Sin embargo, en un estudio de uso a largo plazo, 264 pacientes fueron tratados con tabletas de clorhidrato de buspirona durante 1 año sin efectos nocivos. Por lo tanto, el médico que opte por usar comprimidos de clorhidrato de buspirona durante períodos prolongados debe reevaluar periódicamente la utilidad del fármaco para el paciente individual.
DOSIFICACIÓN Y ADMINISTRACIÓN
La dosis inicial recomendada es de 15 mg al día (7,5 mg dos veces al día). Para lograr una respuesta terapéutica óptima, a intervalos de 2 a 3 días se puede aumentar la dosis 5 mg por día, según sea necesario. La dosis diaria máxima no debe exceder los 60 mg por día. En los ensayos clínicos que permitieron la titulación de la dosis, se emplearon comúnmente dosis divididas de 20 mg a 30 mg por día.
La biodisponibilidad de la buspirona aumenta cuando se administra con alimentos en comparación con el estado en ayunas (ver FARMACOLOGÍA CLÍNICA ). En consecuencia, los pacientes deben tomar buspirona de manera constante con respecto al momento de la dosificación; ya sea siempre con o siempre sin comida.
Cuando se va a administrar buspirona con un inhibidor potente de CYP3A4, las recomendaciones de dosificación descritas en la INTERACCIONES CON LA DROGAS se debe seguir la sección.
CÓMO SUMINISTRADO
Las tabletas de clorhidrato de buspirona USP, 5 mg son tabletas de color blanco a blanquecino, con forma de cápsula, de cara plana y borde biselado, grabadas con una bisección en un lado; un lado de la bisección tiene grabado 'ZE' y otro tiene grabado '36' y el otro lado es liso
Datos del fabricante: N/A. Revisado: mayo de 2016
EFECTOS SECUNDARIOS
No se proporcionó información.
INTERACCIONES CON LA DROGAS
Agentes psicotrópicos
Inhibidores de la MAO
Se recomienda que las tabletas de clorhidrato de buspirona no se usen concomitantemente con inhibidores de la MAO (ver ADVERTENCIAS ).
amitriptilina
Después de agregar buspirona al régimen de dosificación de amitriptilina, no se observaron diferencias estadísticamente significativas en los parámetros farmacocinéticos de estado estacionario (Cmax, AUC y Cmin) de amitriptilina o su metabolito nortriptilina.
diazepam
Después de agregar buspirona al régimen de dosis de diazepam, no se observaron diferencias estadísticamente significativas en los parámetros farmacocinéticos de estado estacionario (Cmax, AUC y Cmin) para diazepam, pero se observaron aumentos de alrededor del 15 % para nordiazepam y efectos clínicos adversos menores. (mareos, dolor de cabeza y náuseas).
haloperidol
En un estudio en voluntarios normales, la administración concomitante de buspirona y haloperidol resultó en un aumento de las concentraciones séricas de haloperidol. La importancia clínica de este hallazgo no está clara.
Nefazodona
[ver Inhibidores e Inductores del Citocromo P450 3A4 (CYP3A4) ].
trazodona
Hay un informe que sugiere que el uso concomitante de Desyrel®# (clorhidrato de trazodona) y buspirona puede haber causado elevaciones de 3 a 6 veces en SGPT (ALT) en algunos pacientes. En un estudio similar que intentó replicar este hallazgo, no se identificó ningún efecto interactivo sobre las transaminasas hepáticas.
triazolam/flurazepam
La coadministración de buspirona con triazolam o flurazepam no pareció prolongar ni intensificar los efectos sedantes de ninguna de las benzodiazepinas.
Otros psicotrópicos
Debido a que no se han estudiado los efectos de la administración concomitante de buspirona con la mayoría de los demás fármacos psicotrópicos, el uso concomitante de buspirona con otros fármacos activos sobre el SNC debe abordarse con precaución.
Inhibidores e inductores del citocromo P450 3A4 (CYP3A4)
Se ha demostrado in vitro que la buspirona es metabolizada por CYP3A4. Este hallazgo es consistente con las interacciones in vivo observadas entre la buspirona y lo siguiente:
diltiazem y verapamilo
En un estudio de nueve voluntarios sanos, la coadministración de buspirona (10 mg como dosis única) con verapamilo (80 mg tres veces al día) o diltiazem (60 mg tres veces al día) aumentó las concentraciones plasmáticas de buspirona (el verapamilo aumentó el AUC y la Cmax de la buspirona 3,4 veces mientras que el diltiazem aumentó el AUC y la Cmax 5,5 veces y 4 veces, respectivamente). Los eventos adversos atribuibles a la buspirona pueden ser más probables durante la administración concomitante con diltiazem o verapamilo. Puede ser necesario un ajuste de dosis posterior y debe basarse en la evaluación clínica.
Eritromicina
En un estudio en voluntarios sanos, la coadministración de buspirona (10 mg como dosis única) con eritromicina (1,5 g/día durante 4 días) aumentó las concentraciones plasmáticas de buspirona (aumento de 5 veces en Cmax y aumento de 6 veces en AUC). Estas interacciones farmacocinéticas estuvieron acompañadas por una mayor incidencia de efectos secundarios atribuibles a la buspirona. Si se van a utilizar los dos fármacos en combinación, se recomienda una dosis baja de buspirona (p. ej., 2,5 mg dos veces al día). El ajuste posterior de la dosis de cualquiera de los fármacos debe basarse en la evaluación clínica.
Jugo de uva
En un estudio en voluntarios sanos, la coadministración de buspirona (10 mg como dosis única) con jugo de toronja (200 ml de potencia doble tres veces al día durante 2 días) aumentó las concentraciones plasmáticas de buspirona (aumento de 4,3 veces en Cmax; aumento de 9,2 veces en AUC ). Se debe advertir a los pacientes que reciben buspirona que eviten beber cantidades tan grandes de jugo de toronja.
itraconazol
En un estudio en voluntarios sanos, la coadministración de buspirona (10 mg como dosis única) con itraconazol (200 mg/día durante 4 días) aumentó las concentraciones plasmáticas de buspirona (aumento de 13 veces en Cmax y aumento de 19 veces en AUC). Estas interacciones farmacocinéticas estuvieron acompañadas por una mayor incidencia de efectos secundarios atribuibles a la buspirona. Si se van a utilizar los dos fármacos en combinación, se recomienda una dosis baja de buspirona (p. ej., 2,5 mg una vez al día). El ajuste posterior de la dosis de cualquiera de los fármacos debe basarse en la evaluación clínica.
Nefazodona
En un estudio de farmacocinética en estado estacionario en voluntarios sanos, la coadministración de buspirona (2,5 o 5 mg dos veces al día) con nefazodona (250 mg dos veces al día) produjo aumentos marcados en las concentraciones plasmáticas de buspirona (aumentos de hasta 20 veces en la Cmax y hasta 50 veces más). -veces en AUC) y disminuciones estadísticamente significativas (alrededor del 50%) en las concentraciones plasmáticas del metabolito de buspirona 1-PP. Con dosis de 5 mg dos veces al día de buspirona, se observaron ligeros aumentos en el AUC de la nefazodona (23 %) y sus metabolitos hidroxinefazodona (HO-NEF) (17 %) y metaclorofenilpiperazina (9 %). Se observaron ligeros aumentos en la Cmax para nefazodona (8 %) y su metabolito HO-NEF (11 %).
Los sujetos que recibieron buspirona 5 mg dos veces al día y nefazodona 250 mg dos veces al día experimentaron aturdimiento, astenia, mareos y somnolencia, eventos adversos que también se observaron con cualquiera de los medicamentos solos. Si se van a utilizar los dos fármacos en combinación, se recomienda una dosis baja de buspirona (p. ej., 2,5 mg una vez al día). El ajuste posterior de la dosis de cualquiera de los fármacos debe basarse en la evaluación clínica.
rifampicina
En un estudio en voluntarios sanos, la coadministración de buspirona (30 mg en dosis única) con rifampicina (600 mg/día durante 5 días) disminuyó las concentraciones plasmáticas (disminución del 83,7 % en la Cmax; disminución del 89,6 % en el AUC) y los efectos farmacodinámicos de buspirona. Si los dos medicamentos se van a usar en combinación, es posible que sea necesario ajustar la dosis de buspirona para mantener el efecto ansiolítico.
Otros inhibidores e inductores de CYP3A4
Las sustancias que inhiben el CYP3A4, como el ketoconazol o el ritonavir, pueden inhibir el metabolismo de la buspirona y aumentar las concentraciones plasmáticas de buspirona, mientras que las sustancias que inducen el CYP3A4, como la dexametasona o ciertos anticonvulsivos (fenitoína, fenobarbital, carbamazepina), pueden aumentar la velocidad del metabolismo de la buspirona. Si un paciente ha sido ajustado a una dosis estable de buspirona, puede ser necesario un ajuste de la dosis de buspirona para evitar eventos adversos atribuibles a la buspirona o actividad ansiolítica disminuida. En consecuencia, cuando se administra con un inhibidor potente de CYP3A4, se recomienda usar con precaución una dosis baja de buspirona. Cuando se usa en combinación con un inductor potente de CYP3A4, puede ser necesario ajustar la dosis de buspirona para mantener el efecto ansiolítico.
Otras drogas
cimetidina
Se encontró que la coadministración de buspirona con cimetidina aumentó la Cmax (40 %) y la Tmax (2 veces), pero tuvo efectos mínimos en el AUC de la buspirona.
Enlace proteico
In vitro, la buspirona no desplaza de las proteínas séricas a fármacos fuertemente ligados como la fenitoína, el propranolol y la warfarina. Sin embargo, ha habido un informe de tiempo de protrombina prolongado cuando se añadió buspirona al régimen de un paciente tratado con warfarina. El paciente también recibía de forma crónica fenitoína, fenobarbital, digoxina y Synthroid®*. In vitro, la buspirona puede desplazar a fármacos que se unen con menos firmeza, como la digoxina. Se desconoce el significado clínico de esta propiedad.
Los niveles terapéuticos de aspirina, desipramina, diazepam, flurazepam, ibuprofeno, propranolol, tioridazina y tolbutamida solo tuvieron un efecto limitado sobre el grado de unión de la buspirona a las proteínas plasmáticas (ver FARMACOLOGÍA CLÍNICA ).
Interacciones entre medicamentos y pruebas de laboratorio
El clorhidrato de buspirona puede interferir con el ensayo de metanefrina/catecolaminas en orina. Se ha leído erróneamente como metanefrina durante las pruebas de ensayo de rutina para el feocromocitoma, lo que ha dado como resultado un resultado de laboratorio falso positivo. Por lo tanto, el clorhidrato de buspirona debe suspenderse durante al menos 48 horas antes de someterse a una recolección de orina para catecolaminas.
Abuso y dependencia de drogas
Clase de sustancia controlada
El clorhidrato de buspirona no es una sustancia controlada.
Dependencia Física Y Psicológica
En estudios con humanos y animales, la buspirona no ha mostrado potencial de abuso o desviación y no hay evidencia de que provoque tolerancia o dependencia física o psicológica. Se estudiaron voluntarios humanos con antecedentes de uso recreativo de drogas o alcohol en dos investigaciones clínicas doble ciego. Ninguno de los sujetos pudo distinguir entre las tabletas de clorhidrato de buspirona y el placebo. Por el contrario, los sujetos mostraron una preferencia estadísticamente significativa por la metacualona y el diazepam. Los estudios en monos, ratones y ratas han indicado que la buspirona carece de potencial de abuso. Luego de la administración crónica en ratas, la suspensión abrupta de buspirona no resultó en la pérdida de peso corporal comúnmente observada con sustancias que causan dependencia física.
Aunque no hay evidencia directa de que las tabletas de clorhidrato de buspirona provoquen dependencia física o comportamiento de búsqueda de drogas, es difícil predecir a partir de experimentos hasta qué punto una droga activa en el SNC será mal utilizada, desviada o abusada una vez comercializada. En consecuencia, los médicos deben evaluar cuidadosamente a los pacientes en busca de antecedentes de abuso de drogas y seguirlos de cerca, observándolos en busca de signos de uso indebido o abuso de las tabletas de clorhidrato de buspirona (p. ej., desarrollo de tolerancia, aumento de la dosis, comportamiento de búsqueda de drogas).
Clase de sustancia controlada
El clorhidrato de buspirona no es una sustancia controlada.
Dependencia Física Y Psicológica
En estudios con humanos y animales, la buspirona no ha mostrado potencial de abuso o desviación y no hay evidencia de que provoque tolerancia o dependencia física o psicológica. Se estudiaron voluntarios humanos con antecedentes de uso recreativo de drogas o alcohol en dos investigaciones clínicas doble ciego. Ninguno de los sujetos pudo distinguir entre las tabletas de clorhidrato de buspirona y el placebo. Por el contrario, los sujetos mostraron una preferencia estadísticamente significativa por la metacualona y el diazepam. Los estudios en monos, ratones y ratas han indicado que la buspirona carece de potencial de abuso. Luego de la administración crónica en ratas, la suspensión abrupta de buspirona no resultó en la pérdida de peso corporal comúnmente observada con sustancias que causan dependencia física.
Aunque no hay evidencia directa de que las tabletas de clorhidrato de buspirona provoquen dependencia física o comportamiento de búsqueda de drogas, es difícil predecir a partir de experimentos hasta qué punto una droga activa en el SNC será mal utilizada, desviada o abusada una vez comercializada. En consecuencia, los médicos deben evaluar cuidadosamente a los pacientes en busca de antecedentes de abuso de drogas y seguirlos de cerca, observándolos en busca de signos de uso indebido o abuso de las tabletas de clorhidrato de buspirona (p. ej., desarrollo de tolerancia, aumento de la dosis, comportamiento de búsqueda de drogas).
ADVERTENCIAS
La administración de tabletas de clorhidrato de buspirona a un paciente que toma un inhibidor de la monoaminooxidasa (IMAO) puede representar un peligro. Ha habido informes de la aparición de presión arterial elevada cuando se han agregado tabletas de clorhidrato de buspirona a un régimen que incluye un IMAO. Por lo tanto, se recomienda que las tabletas de hidrocloruro de buspirona no se usen concomitantemente con un IMAO.
Debido a que las tabletas de clorhidrato de buspirona no tienen actividad antipsicótica establecida, no debe emplearse en lugar de un tratamiento antipsicótico apropiado.
PRECAUCIONES
General
Interferencia con el rendimiento cognitivo y motor
Los estudios indican que las tabletas de clorhidrato de buspirona son menos sedantes que otros ansiolíticos y que no produce un deterioro funcional significativo. Sin embargo, sus efectos sobre el SNC en cualquier paciente individual pueden no ser predecibles. Por lo tanto, se debe advertir a los pacientes sobre la conducción de automóviles o el uso de maquinaria compleja hasta que estén razonablemente seguros de que el tratamiento con buspirona no les afecta negativamente.
Si bien los estudios formales de la interacción del clorhidrato de buspirona con el alcohol indican que la buspirona no aumenta el deterioro del rendimiento motor y mental inducido por el alcohol, es prudente evitar el uso concomitante de alcohol y buspirona.
Potencial de reacciones de abstinencia en pacientes dependientes de fármacos sedantes/hipnóticos/ansiolíticos
Debido a que las tabletas de clorhidrato de buspirona no exhiben tolerancia cruzada con las benzodiazepinas y otras drogas sedantes/hipnóticas comunes, no bloqueará el síndrome de abstinencia que a menudo se observa al suspender la terapia con estas drogas. Por lo tanto, antes de iniciar la terapia con tabletas de hidrocloruro de buspirona, se recomienda retirar gradualmente a los pacientes, especialmente a los pacientes que han estado usando crónicamente un fármaco depresor del SNC, de su tratamiento previo. Los síntomas de rebote o abstinencia pueden ocurrir durante períodos de tiempo variables, dependiendo en parte del tipo de fármaco y su vida media efectiva de eliminación.
El síndrome de abstinencia de fármacos sedantes/hipnóticos/ansiolíticos puede presentarse como cualquier combinación de irritabilidad, ansiedad, agitación, insomnio, temblor, calambres abdominales, calambres musculares, vómitos, sudoración, síntomas gripales sin fiebre y, en ocasiones, incluso como convulsiones. .
Posibles preocupaciones relacionadas con la unión de la buspirona a los receptores de dopamina
Debido a que la buspirona puede unirse a los receptores dopaminérgicos centrales, se ha planteado la cuestión de su potencial para causar cambios agudos y crónicos en la función neurológica mediada por la dopamina (p. ej., distonía, pseudoparkinsonismo, acatisia y discinesia tardía). La experiencia clínica en ensayos controlados no ha logrado identificar ninguna actividad similar a la de los neurolépticos significativa; sin embargo, se ha notificado un síndrome de inquietud, que aparece poco después del inicio del tratamiento, en una pequeña fracción de pacientes tratados con buspirona. El síndrome puede explicarse de varias maneras. Por ejemplo, la buspirona puede aumentar la actividad noradrenérgica central; alternativamente, el efecto puede atribuirse a efectos dopaminérgicos (es decir, representar acatisia). Ver REACCIONES ADVERSAS : Experiencia posterior a la comercialización .
Información para pacientes
Para garantizar el uso seguro y eficaz de las tabletas de clorhidrato de buspirona, se debe proporcionar a los pacientes la siguiente información e instrucciones:
Informe a su médico acerca de cualquier medicamento, recetado o sin receta, alcohol o drogas que esté tomando o planee tomar durante su tratamiento con tabletas de clorhidrato de buspirona.
Informe a su médico si está embarazada, si planea quedar embarazada o si queda embarazada mientras está tomando tabletas de clorhidrato de buspirona.
Informe a su médico si está amamantando a un bebé.
Hasta que experimente cómo le afecta este medicamento, no conduzca un automóvil ni opere maquinaria potencialmente peligrosa.
Debe tomar clorhidrato de buspirona de manera constante, ya sea siempre con o sin alimentos.
Durante su tratamiento con tabletas de clorhidrato de buspirona, evite beber grandes cantidades de jugo de toronja.
Pruebas de laboratorio
No se recomiendan pruebas de laboratorio específicas.
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
No se observó evidencia de potencial carcinogénico en ratas durante un estudio de 24 meses con aproximadamente 133 veces la dosis oral máxima recomendada en humanos; o en ratones, durante un estudio de 18 meses a aproximadamente 167 veces la dosis oral máxima recomendada en humanos.
Con o sin activación metabólica, la buspirona no indujo mutaciones puntuales en cinco cepas de Salmonella typhimurium (prueba de Ames) o cultivos de células de linfoma de ratón L5178YTK+, ni se observó daño en el ADN con buspirona en células humanas Wi-38. No se produjeron anomalías ni aberraciones cromosómicas en las células de la médula ósea de los ratones que recibieron una o cinco dosis diarias de buspirona.
El embarazo
Efectos teratogénicos
Embarazo Categoría B
No se observó alteración de la fertilidad ni daño fetal en estudios de reproducción realizados en ratas y conejos con dosis de buspirona de aproximadamente 30 veces la dosis máxima recomendada en humanos. En humanos, sin embargo, no se han realizado estudios adecuados y bien controlados durante el embarazo. Debido a que los estudios de reproducción en animales no siempre predicen la respuesta humana, este medicamento debe usarse durante el embarazo solo si es claramente necesario.
Trabajo y entrega
Se desconoce el efecto del clorhidrato de buspirona sobre el trabajo de parto y el parto en mujeres. No se observaron efectos adversos en estudios de reproducción en ratas.
Madres lactantes
Se desconoce el alcance de la excreción en la leche humana de buspirona o sus metabolitos. En ratas, sin embargo, la buspirona y sus metabolitos se excretan en la leche. Debe evitarse la administración de tabletas de clorhidrato de buspirona a mujeres lactantes si es clínicamente posible.
Uso pediátrico
La seguridad y la eficacia de la buspirona se evaluaron en dos ensayos controlados con placebo de 6 semanas de duración en los que participaron un total de 559 pacientes pediátricos (entre 6 y 17 años de edad) con TAG. Las dosis estudiadas fueron de 7,5 mg a 30 mg dos veces al día (15 a 60 mg/día). No hubo diferencias significativas entre buspirona y placebo con respecto a los síntomas del TAG después de las dosis recomendadas para el tratamiento del TAG en adultos. Los estudios farmacocinéticos han demostrado que, para dosis idénticas, la exposición plasmática a la buspirona y su metabolito activo, 1-PP, es igual o mayor en pacientes pediátricos que en adultos. No se asociaron resultados de seguridad inesperados con la buspirona en estos ensayos. No hay datos de seguridad o eficacia a largo plazo en esta población.
Uso geriátrico
En un estudio de 6632 pacientes que recibieron buspirona para el tratamiento de la ansiedad, 605 pacientes tenían ≥ 65 años y 41 tenían ≥ 75 años; los perfiles de seguridad y eficacia para estos 605 pacientes de edad avanzada (edad media = 70,8 años) fueron similares a los de la población más joven (edad media = 43,3 años). La revisión de eventos clínicos adversos notificados espontáneamente no ha identificado diferencias entre los pacientes de edad avanzada y los más jóvenes, pero no se puede descartar una mayor sensibilidad de algunos pacientes de mayor edad.
No hubo efectos de la edad sobre la farmacocinética de la buspirona (ver FARMACOLOGÍA CLÍNICA , Poblaciones Especiales ).
Uso en pacientes con función hepática o renal alterada
La buspirona se metaboliza en el hígado y se excreta por los riñones. Un estudio farmacocinético en pacientes con función hepática o renal alterada demostró un aumento de los niveles plasmáticos y una vida media prolongada de la buspirona. Por lo tanto, no se puede recomendar la administración de tabletas de clorhidrato de buspirona a pacientes con insuficiencia hepática o renal grave (ver FARMACOLOGÍA CLÍNICA ).
SOBREDOSIS
No se proporcionó información.
CONTRAINDICACIONES
Las tabletas de clorhidrato de buspirona están contraindicadas en pacientes hipersensibles al clorhidrato de buspirona.
FARMACOLOGÍA CLÍNICA
Se desconoce el mecanismo de acción de la buspirona. La buspirona se diferencia de los ansiolíticos típicos de las benzodiazepinas en que no ejerce efectos anticonvulsivos ni relajantes musculares. También carece del efecto sedante prominente que se asocia con los ansiolíticos más típicos. Los estudios preclínicos in vitro han demostrado que la buspirona tiene una alta afinidad por los receptores de serotonina (5-HT1A). La buspirona no tiene una afinidad significativa por los receptores de benzodiacepinas y no afecta la unión de GABA in vitro o in vivo cuando se prueba en modelos preclínicos.
La buspirona tiene una afinidad moderada por los receptores de dopamina D2 del cerebro. Algunos estudios sugieren que la buspirona puede tener efectos indirectos en otros sistemas de neurotransmisores.
El clorhidrato de buspirona se absorbe rápidamente en el hombre y sufre un extenso metabolismo de primer paso. En un estudio radiomarcado, la buspirona inalterada en el plasma representó solo alrededor del 1% de la radioactividad en el plasma. Después de la administración oral, las concentraciones plasmáticas de buspirona inalterada son muy bajas y variables entre sujetos. Se han observado niveles plasmáticos máximos de 1 ng/mL a 6 ng/mL 40 a 90 minutos después de dosis orales únicas de 20 mg. La biodisponibilidad de una dosis única de buspirona inalterada cuando se toma como tableta es en promedio alrededor del 90% de una dosis equivalente de solución, pero existe una gran variabilidad.
Los efectos de los alimentos sobre la biodisponibilidad de las tabletas de clorhidrato de buspirona se han estudiado en ocho sujetos. Se les administró una dosis de 20 mg con y sin alimentos; el área bajo la curva de concentración plasmática-tiempo (AUC) y la concentración plasmática máxima (Cmax) de buspirona inalterada aumentó un 84 % y un 116 %, respectivamente, pero la cantidad total de material inmunorreactivo de buspirona no cambió. Esto sugiere que los alimentos pueden disminuir el grado de eliminación presistémica de buspirona (ver DOSIFICACIÓN Y ADMINISTRACIÓN ).
Un estudio de dosis múltiples realizado en 15 sujetos sugiere que la buspirona tiene una farmacocinética no lineal. Por lo tanto, los aumentos de dosis y las dosis repetidas pueden conducir a niveles sanguíneos algo más altos de buspirona inalterada de lo que se podría predecir a partir de los resultados de los estudios de dosis única.
Un estudio de unión a proteínas in vitro indicó que aproximadamente el 86 % de la buspirona se une a las proteínas plasmáticas. También se observó que la aspirina aumentó los niveles plasmáticos de buspirona libre en un 23 %, mientras que el flurazepam disminuyó los niveles plasmáticos de buspirona libre en un 20 %. Sin embargo, no se sabe si estos medicamentos causan efectos similares en los niveles plasmáticos de buspirona libre in vivo o si tales cambios, si ocurren, causan diferencias clínicamente significativas en el resultado del tratamiento. Un estudio in vitro indicó que la buspirona no desplazó de las proteínas plasmáticas a fármacos altamente ligados a proteínas como la fenitoína, la warfarina y el propranolol, y que la buspirona puede desplazar a la digoxina.
La buspirona se metaboliza principalmente por oxidación, que se ha demostrado in vitro que está mediada por el citocromo P450 3A4 (CYP3A4) (ver INTERACCIONES CON LA DROGAS ). Se producen varios derivados hidroxilados y un metabolito farmacológicamente activo, 1-pirimidinilpiperazina (1-PP). En modelos animales que predicen el potencial ansiolítico, la 1-PP tiene aproximadamente una cuarta parte de la actividad de la buspirona, pero está presente en cantidades hasta 20 veces mayores. Sin embargo, esto probablemente no sea importante en humanos: las muestras de sangre de humanos expuestos crónicamente al clorhidrato de buspirona no muestran niveles altos de 1-PP; los valores medios son de aproximadamente 3 ng/mL y el nivel más alto en sangre humana registrado entre 108 pacientes que recibieron dosis crónicas fue de 17 ng/mL, menos de 1/200 de los niveles de 1-PP encontrados en animales que recibieron grandes dosis de buspirona sin signos de toxicidad.
En un estudio de dosis única que utilizó buspirona marcada con 14C, del 29 % al 63 % de la dosis se excretó en la orina dentro de las 24 horas, principalmente como metabolitos; la excreción fecal representó del 18% al 38% de la dosis. La vida media de eliminación promedio de la buspirona inalterada después de dosis únicas de 10 mg a 40 mg es de aproximadamente 2 a 3 horas.
Poblaciones Especiales
Efectos de edad y género
Después de dosis únicas o múltiples en adultos, no se observaron diferencias significativas en la farmacocinética de buspirona (AUC y Cmax) entre sujetos de edad avanzada y jóvenes o entre hombres y mujeres.
Deterioro hepático
Después de la administración de dosis múltiples de buspirona a pacientes con insuficiencia hepática, el AUC de buspirona en estado estacionario aumentó 13 veces en comparación con sujetos sanos (ver PRECAUCIONES ).
Insuficiencia renal
Después de la administración de dosis múltiples de buspirona a pacientes con insuficiencia renal (Clcr = 10 a 70 ml/min/1,73 m2), el AUC de buspirona en estado estacionario aumentó 4 veces en comparación con sujetos sanos (Clcr ≥ 80 ml/min/1,73 m2). (ver PRECAUCIONES ).
Efectos de carrera
No se han estudiado los efectos de la raza sobre la farmacocinética de la buspirona.
INFORMACIÓN DEL PACIENTE
Clorhidrato de buspirona Tabletas, USP Para tabletas de 15 mg y 30 mg
CÓMO UTILIZAR
La respuesta a la buspirona varía entre individuos. Su médico puede considerar necesario ajustar su dosis para obtener la respuesta adecuada.
Cada tableta está marcada y se puede romper con precisión.
Para romper una tableta con precisión y facilidad, sostenga la tableta entre los pulgares y los dedos índices cerca de la ranura (ranura) apropiada de la tableta. Luego, con la ranura de la tableta hacia usted, aplique presión y separe los segmentos de la tableta (no se deben usar segmentos que se rompan incorrectamente).
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA llamando al 1-800-FDA-1088.
